Журнал физической химии, 2022, T. 96, № 10, стр. 1448-1451
Проявления эффектов гидратации ионов в процессах замерзания смешанных водных растворов по данным ямр на протонах и ядрах 23Na
Н. А. Мельниченко a, В. Г. Савченко a, А. С. Абрамов a, *
a Дальневосточный федеральный университет
Владивосток, Россия
* E-mail: abramov.as@dvfu.ru
Поступила в редакцию 03.02.2022
После доработки 12.04.2022
Принята к публикации 15.04.2022
- EDN: IPAXGF
- DOI: 10.31857/S0044453722100223
Аннотация
Приведены результаты изучения температурных зависимостей интегральной интенсивности сигналов ЯМР и времени релаксации Т1 на протонах и ядрах натрия в смешанных водных растворах хлорида натрия с добавлением солей CaCl2, KCl, MgCl2 и MgSO4 различных концентраций. Показаны проявления гидратации ионов в процессах замерзания смешанных растворов: эвтектическая точка NaCl не смещается в присутствии других солей, время релаксации Т1 на протонах испытывает резкий скачок в области эвтектической точки NaCl, а на ядрах натрия происходит только незначительное изменение Т1.
В химических технологиях часто приходится иметь дело со сложными растворами строго определенного химического состава, содержащими несколько растворенных веществ. В справочной литературе обычно приводятся данные о свойствах растворов индивидуальных соединений. Многие природные объекты, например, морская вода, являются многокомпонентными водными растворами, которые содержат практически всю таблицу элементов Менделеева.
Процессы замерзания сложных растворов важны не только для химических технологий при получении различных охлаждающих смесей, но и для изучения различных факторов, связанных со взаимным влиянием отдельных компонентов охлаждаемых смесей. Температуру замерзания в смешанных водных растворах можно рассчитать по эмпирическим соотношениям, приведенным в справочной литературе [1], в том числе и в известных монографиях и учебных пособиях (например, [2]). Кривые ликвидуса позволяют приближенно оценить положение эвтектической точки в растворах солей. Однако до настоящего времени проявления эффектов гидратации ионов в процессах замерзания в смешанных водных растворах остаются недостаточно изученными. Результаты исследований структуры смешанных водных растворов и динамики молекулярных движений при положительных температурах приведены в [3, 4] и в недавних работах, например, [5].
Известно, что интегральная интенсивность линий поглощения в спектрах ЯМР на протонах и других ядрах пропорциональна количеству резонирующих ядер (протонов или ядер натрия) вещества, а время спин-решоточной релаксации T1 определяется молекулярной подвижностью [3, 4], в замороженных водных растворах оно пропорционально количеству жидкой фазы, т.е. воды, так как сигналы от твердой фазы в обычной методике ЯМР не регистрируются из большой разницы (на 5–6 порядков) в ширине спектральных линий.
Выбор хлорида натрия в качестве основной соли обусловлен тем, что ее водный раствор достаточно хорошо изучен методом ЯМР на протонах, на ядрах натрия и хлора, а также другими методами. Как известно, при диссоциации этой соли в структуре раствора появляются два иона разного знака гидратации: положительной – для ионов натрия и отрицательной – для ионов хлора (по терминологии О.Я. Самойлова) с частичной компенсацией их воздействия на структуру раствора.
Цель данной работы – установление закономерностей влияния гидратации ионов в процессах замерзания в смешанных водных растворах электролитов с ионами разной силы гидратации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Измерения интегральной интенсивности и времени релаксации Т1 на протонах и ядрах натрия проводили на ЯМР-спектрометре BRUKER-400 на резонансной частоте для протонов 400 МГц в температурных пределах от комнатной до –50°С с шагом 5 К. При записи спектров использовали импульсные последовательности 1D с 30° импульсами на ядрах 1H (zg30), и с 90° импульсами на ядрах 23Na (zg). Для определения времени релаксации Т1 использовали импульсную последовательность с восстановлением инверсии (t1ir).
Калибровку температурной шкалы (термопары) проводили на основе измерений разности значений химических сдвигов (Δ) сигналов OH и CH3-групп метанола (4% раствор в CD3OD) в диапазоне 210–300 K, с расчетом температуры по формуле T = (3.86 – Δ)/0.00782. Стабилизацию температуры обеспечивали в пределах 0.2 K.
Погрешность измерения интенсивности сигналов ЯМР и времени релаксации на протонах соответствовала паспортной и не превышала 2%. Температурную поправку на увеличение намагниченности ядер с понижением температуры учитывали с помощью заранее определенного коэффициента. Растворы готовили из солей марки “ос.ч.”.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На рис. 1 приведены температурные зависимости интегральных интенсивностей сигналов ЯМР на протонах и ядрах 23Na полумолярного водного раствора хлорида натрия с добавлением в него солей KCl, CaCl2, MgCl2 и MgSO4 в концентрациях 0.5 и 0.2 моль/л. На температурных зависимостях интегральной интенсивности сигналов на обоих ядрах наблюдались ярко выраженные изменения в виде “ступенек”, соответствующих резкому изменению количества жидкой фазы (воды) при замерзании раствора. Происхождение первой из них на протонах обусловлено замерзанием растворителя и соответствующим уменьшением количества жидкой фазы, а последующей ступеньки – образованием кристаллогидрата с выделением тепла кристаллизации и выпадением его в осадок. При охлаждении раствора сначала вымерзает пресная часть растворителя, т.е. чистая вода. Раствор становится более концентрированным. При достижении эвтектической температуры той или иной соли из концентрированного раствора частично выпадают ее кристаллогидраты. Это происходит на фоне понижения температуры и уменьшения объема жидкой фазы в ячейках льда и повышения ее концентрации. При дальнейшем понижении температуры процесс повторяется с образованием следующего кристаллогидрата из ионов высококонцентрированного раствора. Подобные процессы наблюдаются и в рассоле морского льда [6].
Рис. 1.
Температурные зависимости интегральной интенсивности сигналов ЯМР на протонах и ядрах 23Na в полумолярных водных растворах NaCl при добавлении 0.5 и 0.2 М растворов солей KCl, CaCl2, MgCl2 и MgSO4.
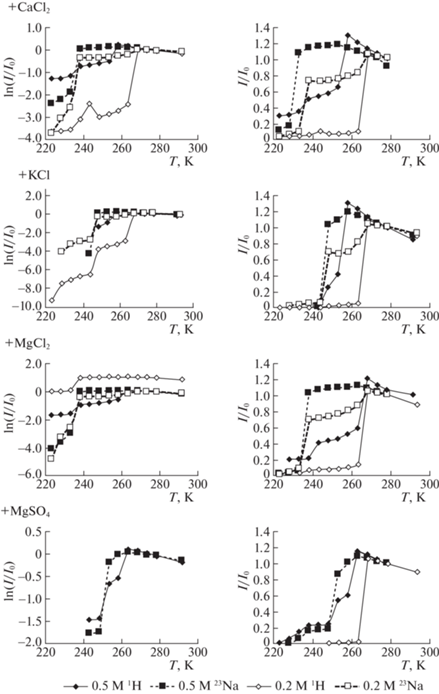
Температурные зависимости интенсивности сигналов представлены в линейных и логарифмических координатах для демонстрации изменений в случаях небольшой интенсивности сигналов поглощения.
Как видно из приведенных данных на протонах, температура замерзания в смешанных водных растворах, в соответствии с законом Рауля, понижается с повышением суммарной концентрации солей в растворе, что является вполне естественным. Об этом свидетельствует резкое уменьшение интегральной интенсивности сигналов как на протонах, так и на ядрах натрия, связанное с выпадением в осадок кристаллогидрата NаCl⋅2H2O при ~252 К. Однако положение второй ступеньки на кривой температурной зависимости на протонах практически совпадает с расположением ступенек на температурной шкале сигналов ЯМР на ядрах натрия при более низких температурах (~233 К). По-видимому, при таких температурах вблизи этой точки происходит усиленное падение концентрации ионов натрия в рассоле, содержащемся в ячейках льда.
На температурных зависимостях интегральной интенсивности сигналов 1Н ЯМР раствора NaCl с добавленными хлоридами кальция и магния можно наблюдать примерно одинаковые изменения относительной интенсивности (I/I0) вблизи эвтектической точки NaCl. Однако в случае добавления KCl в раствор NaCl первая ступенька понижалась на ~10 К. Влияние сульфата магния проявлялось в повышении ступеньки относительно оси абсцисс и в более пологой форме ниже 240 К. По-видимому, такой характер зависимости при добавлении MgSO4 обусловлен тем, что эта соль может выпадать в осадок в виде нескольких форм кристаллогидратов с количеством молекул воды от 7 до 12, в том числе с образованием кристаллогидратов с участием ионов натрия.
На рис. 2 приведены температурные зависимости времени спин-решеточной релаксации Т1 на протонах и ядрах 23Na в смешанных водных растворах хлорида натрия с солями кальция, калия и магния.
Рис. 2.
Температурные зависимости времени спин-решеточной релаксации Т1 в 0.5 М растворе NаCl при добавлении 0.5 М растворов солей KCl, CaCl2, MgCl2 и MgSO4 (слева – на 1Н, справа – на 23Na).

Важная особенность релаксационного поведения – скачкообразный рост времени релаксации Т1 на протонах вблизи эвтектической точки NaCl, при дальнейшем понижении температуры значение Т1 начинает падать. Увеличение времени релаксации обусловлено большей подвижностью молекул воды вследствие тепловых эффектов образования кристаллогидрата NаCl⋅2H2O и снижения концентрации рассола. Как известно, указанные два фактора (повышение температуры и снижение концентрации раствора) приводят к увеличению времени релаксации Т1 протонов в водных растворах электролитов [3, 4]. Понижение температуры ниже точки эвтектики сопровождается объемным концентрированием оставшейся части рассола и уменьшением Т1.
Гидратация ионов заметно влияет на температурные зависимости Т1. Ее влияние проявляется в ширине пиков. Наиболее узкий пик наблюдался при добавлении соли KCl c ее отрицательно гидратированными ионами. Широкий пик был отмечен при добавлении сульфата MgSO4, гидратные оболочки которого прочно связывали молекулы воды. Однако влияние добавления хлоридов кальция и магния в 0.5 М раствор NaCl оказалось сопоставимым, подобно их влиянию на подвижность молекул воды при положительных температурах. Время релаксации Т1 на ядрах натрия пропорционально вращательной подвижности релаксирующих ядер, которая изменялась в небольших пределах в отличие от трансляционной подвижности. Этим можно объяснить незначительное изменение Т1 на ядрах натрия вблизи эвтектической точки NаCl.
Список литературы
Химическая энциклопедия в пяти томах. М.: Большая российская энциклопедия, 1995. С. 184–191.
Крестов Г.А. Термодинамика процессов в растворах. Л.: Химия, 1984. 272 с.
Чижик В.И. Ядерная магнитная релаксация. СПб: Изд-во Санкт-Петербургского ун-та, 2004, 3-е изд. 85 с.
Мельниченко Н.А. // Журн. физ. химии. 2014. Т. 88. № 12. С. 1032.
Banauskaite V., Pestova O., Matveev V. et al. // Phys. Chem. Chem.Phys. 2019. V. 21. P. 22895.
Melnichenko N.A., Slobodyuk A.V. // J. Glaciol. 2013. V. 59. № 216. P. 711.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


