Журнал физической химии, 2022, T. 96, № 10, стр. 1506-1512
Особенности сорбции производных хинолина в условиях жидкостной хроматографии
С. А. Рыжкин a, С. В. Курбатова a, *, М. Н. Земцова b
a Самарский национальный исследовательский университет имени академика С.П. Королева
Самара, Россия
b Самарский государственный технический университет
Самара, Россия
* E-mail: curbatsv@gmail.com
Поступила в редакцию 25.02.2022
После доработки 01.03.2022
Принята к публикации 04.03.2022
- EDN: UEDKFQ
- DOI: 10.31857/S0044453722100284
Аннотация
Исследованы закономерности сорбции некоторых производных хинолина в условиях обращенно-фазовой высокоэффективной жидкостной хроматографии на сверхсшитом полистироле. Определены факторы удерживания сорбатов при различном содержании ацетонитрила в элюенте. Проанализированы зависимости изменения энтальпии сорбции и энтропийного члена температурной зависимости фактора удерживания от содержания органического компонента в элюенте для изученных соединений.
Интенсивное развитие теории и практики жидкостной хроматографии демонстрирует ее огромные возможности как аналитического метода, с одной стороны, а также как эффективного инструмента для определения различных физико-химических характеристик веществ и установления взаимосвязи между их удерживанием и структурой, с другой [1, 2]. Все больший интерес вызывает возможность применения хроматографии и для решения обратной задачи – определение особенностей строения сорбируемых молекул по их сорбционным характеристикам (так называемая хроматоскопия по определению А.В. Киселева [3]). Алгоритм решения этой задачи в основном разработан для условий газовой хроматографии, поскольку в жидкостной хроматографии при ее решении должны быть учтены многие факторы (природа и состав элюента, возможность протекания различных процессов в объемном растворе элюента и т.п.), существенно осложняющие подобные расчеты. Фундаментом для решения подобной задачи служит установление типов межмолекулярных взаимодействий различной природы, реализуемых в условиях жидкостной хроматографии, поскольку удерживание сорбатов и селективность их разделения в подобных системах определяется большим разнообразием видов специфических и неспецифических взаимодействий и их различными комбинациями [4].
Оптимальным в такого рода исследованиях следует, вероятно, считать сочетание теоретических и экспериментальных методов, при этом очевидно, что несоответствие полученных при этом данных может указывать либо на несовершенство выбранной теоретической модели и методологии теоретических расчетов, либо на неточность или недостаточность экспериментальных данных и имеющихся сведений о структуре молекулы. Очевидно, что базисом для решения как прямой, так и обратной задачи установления взаимосвязи между строением и хроматографическим удерживанием является накопление массива данных по структуре и удерживанию веществ различного строения для разных условий хроматографирования [5]. Значительное число публикаций в последнее время посвящено исследованию подобной взаимосвязи для гетероциклических соединений, многообразие строения которых и проявляемые этими веществами различные виды биологической активности делают их удобными объектами для решения данной проблемы [6–8].
Внимание к производным хинолина, как к представителям гетероциклов, обусловлено широким спектром проявляемых ими практически значимых свойств [9, 10]. Разнообразие строения хинолинов связано с наличием в их структуре восстановленного и/или ароматического гетероциклических фрагментов, функциональных групп и заместителей различной химической природы, что, в свою очередь, способствует реализации этими веществами широкого диапазона межмолекулярных взаимодействий с компонентами жидкостнохроматографической системы.
Цель настоящей работы – изучение закономерностей сорбции некоторых производных хинолина из водно-ацетонитрильных растворов на сверхсшитом полистироле в условиях обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ ВЭЖХ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Хроматографический анализ проводили на жидкостном хроматографе Милихром А02 с УФ-спектрометрическим детектором. Детектирование осуществляли при длине волны 254 нм. В качестве сорбента использовали монодисперсный сверхсшитый полистирол (ССПС) со степенью сшивки 150%; размер частиц 3.2 мкм; размеры колонки 150 × 3 мм. Эксперимент проводили в диапазоне температур 298–328 K.
Элюирование осуществляли в изократическом режиме. В качестве подвижной фазы использовали смеси ацетонитрил–вода с объемным содержанием ацетонитрила 50, 60 и 80%. Объемная скорость потока элюента составляла 500 мкл/мин. Для приготовления подвижных фаз использовали тридистиллированную воду и ацетонитрил марки HPLC-gradient grade (Panreac, Испания); дегазирование осуществляли воздействием на приготовленные водно-ацетонитрильные смеси ультразвука с помощью установки марки УЗДН-2Т.
Пробу сорбата готовили растворением кристаллического вещества в соответствующей подвижной фазе. Удерживание исследованных соединений характеризовали величиной фактора удерживания (k), рассчитанного по формуле
где tR – время удерживания исследуемого вещества, tM – время удерживания несорбирующегося вещества (нитрит натрия). Погрешность определения не превышала 2%.Формулы исследованных соединений, а также полученные экспериментально значения фактора удерживания, усредненные по 5–7 значениям, и рассчитанные с использованием программы HyperChem 8 Professional значения мольного объема (V), поляризуемости (α) и дипольного момента (µ) представлены в табл. 1.
Таблица 1.
Фактор удерживания (k) при разных концентрациях ацетонитрила в элюенте и физико-химические характеристики сорбатов
| № | Формула | k | V, Å3 | α, Å3 | µ, D | ||
|---|---|---|---|---|---|---|---|
| 50% | 60% | 80% | |||||
| 1 | 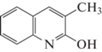 |
2.86 | 1.99 | 1.47 | 169.7 | 53.15 | 1.32 |
| 2 | 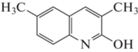 |
4.56 | 2.90 | 2.02 | 187.7 | 54.64 | 1.49 |
| 3 | 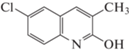 |
7.28 | 4.39 | 2.78 | 182.8 | 54.27 | 1.02 |
| 4 | 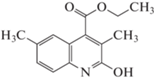 |
4.69 | 3.35 | 1.88 | 253.8 | 60.03 | 1.84 |
| 5 | 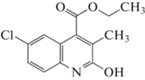 |
6.48 | 5.34 | 2.76 | 249.0 | 59.67 | 1.74 |
| 6 | 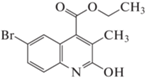 |
11.01 | 7.01 | 3.46 | 253.5 | 59.99 | 1.83 |
| 7 | 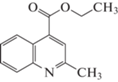 |
5.08 | 3.33 | 2.06 | 238.0 | 59.92 | 3.01 |
| 8 | 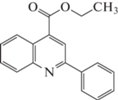 |
33.33 | 16.19 | 7.27 | 303.1 | 42.80 | 2.89 |
Расчет термодинамических характеристик сорбции исследованных производных хинолина осуществляли известным способом по уравнению:
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как известно, в обращенно-фазовом режиме ВЭЖХ удерживание веществ осуществляется в основном за счет дисперсионных и гидрофобных сил [12]. В то же время некоторые сорбенты (например, сверхсшитый полистирол, пористый графитированный углерод), используемые в этом варианте жидкостной хроматографии, способны к реализации и других типов взаимодействий, существенно влияющих на хроматографический процесс. Так, известно, что для пористого графитированного углерода характерен эффект полярного удерживания, проявляющийся в преимущественном удерживании полярных сорбатов [13]. При сорбции на сверхсшитом полистироле существенный вклад в удерживание вносят специфические π-взаимодействия, в которые могут вступать молекулы сорбатов, включающие ароматические фрагменты, ненасыщенные связи, заместители с вакантными d-орбиталями или неподеленными электронными парами [14].
Возможность реализации специфических взаимодействий, дополнительных к основным дисперсионным в таких хроматографических системах, приводит к тому, что удерживание многих гетероциклов, в том числе и производных хинолина, на этих сорбентах характеризуется рядом особенностей, определяемых как строением молекул гетероциклов, так и природой сорбента [7, 15, 16]. К особенностям строения производных хинолина, определяющим их возможность участия в различных видах межмолекулярных взаимодействий, реализуемых в хроматографическом процессе, можно отнести следующие. Прежде всего, это – ароматичность пиридинового фрагмента в молекуле хинолина, подтвержденная его значением энергии делокализации, сопоставимой с таковой в молекуле бензола (134 и 151 ккал/моль соответственно), причем атом азота в структуре данной молекулы проявляет отрицательные мезомерный и индуктивный эффекты и ведет себя как электроноакцепторный заместитель [17]. В целом молекулы производных хинолина имеют достаточно высокое сродство к протону, а строение возможных протонированных комплексов и распределение в них заряда определяются в основном природой и положением заместителей. В частности, положения 2 и 4 хинолинового цикла характеризуются пониженной электронной плотностью по сравнению с положениями 3, 5, 6 и 8, причем алкильные группы в этих положениях по свойствам аналогичны алкилам, связанным с типично ароматическими кольцами [18]. Различную активность проявляют атомы водорода метильных групп, расположенных в положениях 2 и 3 хинолина, атомы хлора в положениях 2 и 4, а активность функциональных групп в положении 4 во многом зависит от природы и положения других функциональных групп в молекуле, и т.п.
Таким образом, конденсированная ароматическая система хинолина с атомом азота и присутствие заместителей различной химической природы обусловливают неравномерное распределение электронной плотности в молекулах производных хинолина, которые сочетают свойства донора водорода и донора электронов, а также способны к проявлению сильных дисперсионных, π–π- и других специфических взаимодействий.
В выбранных нами для исследования производных хинолина присутствуют алкоксигруппы в положении 4, заместители различной химической природы в положениях 2 и 6 хинолинового ядра и метил в положении 3. Наличие этих заместителей, как уже было отмечено, способствует перераспределению электронной плотности в основном хинолиновом ядре, однако параметры исследованных веществ (объем, поляризуемость, дипольный момент) не претерпевают существенных изменений при переходе от одного вещества к другому, в среднем представляя собой величины одного порядка. Так, диапазон изменения мольного объема исследованных производных лежит в пределах 169.7–303.1 Å3, поляризуемость изменяется в пределах 42.8–60.03 Å3, дипольный момент – в диапазоне 1.02–3.01 D. С учетом того, что удерживание в ОФ ВЭЖХ определяется преимущественно дисперсионными взаимодействиями молекул сорбата с неподвижной фазой, следовало бы ожидать и близких значений удерживания исследованных соединений. Однако, диапазон значений фактора удерживания исследованных веществ оказывается более широким и ожидаемо зависит как от строения молекул сорбатов, так и от состава подвижной фазы.
Из представленных в табл. 1 данных видно, что минимальной оказывается величина фактора удерживания для вещества 1 с минимальным же значением молярного объема. Добавление метила в положение 6 (вещество 2) способствует возрастанию фактора удерживания в ⁓1.5 раза по сравнению с 1 при сопоставимых значениях объема и несмотря на его несколько большую полярность, которая должна была бы способствовать усилению взаимодействия с компонентами подвижной фазы. Переход от вещества 2 к 3, от 4 к 5 и затем к веществу 6 с соответствующей заменой метила на атом хлора и последующей заменой на атом брома существенно увеличивает значения фактора удерживания галогенсодержащих производных по сравнению с их аналогами, несмотря на близкие значения всех параметров этих пар веществ. В данном случае возрастание удерживания галогензамещенных хинолинов связано, вероятно, с дополнительным вкладом специфических взаимодействий атомов галогенов в общую энергию межмолекулярного взаимодействия сорбат – ССПС, что характерно для сорбции соответствующих производных и других гетероциклов [19].
Появление сложноэфирной группы в молекулах веществ 4 и 5 приводит к существенному увеличению объема молекул, их поляризуемости и дипольного момента, однако значения фактора удерживания этих веществ оказываются сопоставимыми с соответствующими значениями для их структурных аналогов 2 и 3. Вероятно, при удерживании сложноэфирных аналогов реализуются две тенденции, связанные с наличием этой группы. С одной стороны, присутствие гидрофобного углеводородного радикала в сложном эфире благоприятствует выталкиванию молекул сорбата из полярной подвижной фазы к поверхности сорбента, увеличивая удерживание. С другой стороны, бóльшая полярность этоксипроизводных и наличие карбонильного атома кислорода, склонного к взаимодействию с полярными компонентами подвижной фазы, ослабляют взаимодействие с сорбентом, уменьшая, таким образом, значения фактора удерживания.
С увеличением концентрации ацетонитрила в элюенте, как следует из табл. 1, величины фактора удерживания уменьшаются, что соответствует закономерностям удерживания в обращенно-фазовом варианте ВЭЖХ. Однако, конкретный вид зависимости, характеризующей влияние состава элюента на удерживание, может быть различным в зависимости от природы и строения элюируемых веществ, а также природы элюента и сорбента. Одной из наиболее простых и поэтому часто используемых моделей для описания влияния состава подвижной фазы на хроматографическое удерживание является модель Снайдера–Сочевинского, аппроксимирующая эти соотношения линейной зависимостью вида $\lg k$ = a – $n\lg {{x}_{m}}$ [12]. Известно, однако, что при хроматографировании соединений, способных к специфическим взаимодействиям с компонентами подвижной фазы, могут наблюдаться существенные отклонения от линейности [7, 20].
На рис. 1 приведены графики исследованной нами зависимости фактора удерживания производных хинолина от концентрации ацетонитрила в элюенте в координатах вытеснительной модели Снайдера–Сочевинского, а в табл. 2 – коэффициенты соответствующего уравнения.
Рис. 1.
Зависимости фактора удерживания производных хинолина (1–8) от концентрации ацетонитрила (Т = 298 K).
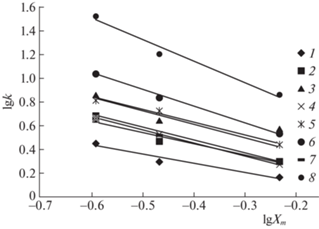
Таблица 2.
Параметры уравнения Снайдера–Сочевинского (Т = 298 K)
| Вещество | a | n | R2 |
|---|---|---|---|
| 1 | –0.033 | 0.789 | 0.952 |
| 2 | 0.061 | 0.965 | 0.956 |
| 3 | 0.157 | 1.141 | 0.960 |
| 4 | 0.070 | 1.119 | 0.999 |
| 5 | 0.198 | 1.070 | 0.983 |
| 6 | 0.201 | 1.408 | 0.998 |
| 7 | 0.047 | 1.081 | 0.982 |
| 8 | 0.412 | 1.822 | 0.980 |
Из представленных данных следует, что в выбранном концентрационном интервале эта зависимость линейна для всех соединений с коэффициентом корреляции от 0.952 до 0.999.
Коэффициент n, который, как известно, в модели Снайдера–Сочевинского трактуют как число молекул растворителя, вытесняемых с поверхности сорбента молекулами сорбата, при этом изменяется от минимального значения 0.789 у вещества 1 с минимальным значением объема, до максимального 1.822 у вещества 8 с максимальным объемом молекулы. В то же время для веществ 4 и 6 с практически одинаковыми значениями объема (253.8 и 253.5) число вытесняемых с поверхности сорбента молекул подвижной фазы оказывается несколько различным – 1.119 и 1.408 соответственно. И напротив, для пар веществ 3 и 4 или 3 и 5 при различающихся объемах молекул величины n оказываются достаточно близкими. Такое несоответствие в объемах сорбирующихся молекул аналита и величиной n (число вытесняемых молекул органического компонента подвижной фазы) можно, вероятно, объяснить различиями в площади контакта разных по природе сорбируемых молекул с поверхностью сорбента, определяемой, в свою очередь, энергетически более выгодной ориентацией молекулы относительно этой поверхности.
Вариативность такой ориентации при сорбции из водно-ацетонитрильного раствора связана, прежде всего со стереохимией соответствующих молекул – как правило, неплоские молекулы сорбатов контактируют с поверхностью сорбента лишь отдельными участками за счет стерических препятствий. Меньшими значениями коэффициента n характеризуются также более полярные сорбаты, испытывающие ориентирующее действие полярных компонентов элюента, способных “развернуть” молекулы относительно поверхности сорбента в соответствии с энергетически более выгодной ориентацией образующегося сорбционного комплекса, в результате чего они будут взаимодействовать с этой поверхностью лишь наиболее гидрофобной ее частью. Возможность подобного изменения ориентации сорбирующихся молекул относительно поверхности сорбента была продемонстрирована ранее для сложноэфирных и карбоксильных производных тетрагидрохинолина, для которых с помощью квантово-химических расчетов показано, что при сорбции из водно-ацетонитрильного элюента энергетически более выгодна ориентация молекул карбонильным кислородом в сторону раствора, существенно уменьшающая площадь контакта этих молекул с поверхностью сорбента и, таким образом, снижающая удерживание [21].
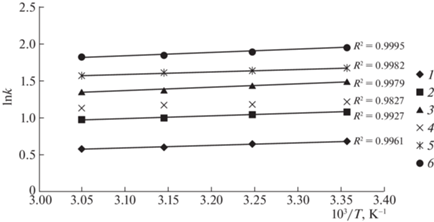
Увеличение температуры приводит к закономерному уменьшению значений фактора удерживания исследованных соединений, что иллюстрируют графики соответствующей зависимости, приведенные на рис. 2. Из представленных данных следует, что в выбранном интервале температурная зависимость фактора удерживания может быть аппроксимирована линейным уравнением с коэффициентами детерминации 0.982–0.999.
Рис. 2.
Температурные зависимости фактора удерживания производных хинолина 1–6 (содержание ацетонитрила в элюенте 60%).
Значения некоторых термодинамических характеристик сорбции исследованных веществ, полученные с использованием указанных температурных зависимостей, приведены в табл. 3. Как видно из приведенных данных, значения энтальпии сорбции отрицательны для всех веществ, что свидетельствует о смещении равновесия в хроматографической системе в сторону сорбции на поверхности ССПС из раствора вода–ацетонитрил в выбранном концентрационном диапазоне и об экзотермическом характере этого процесса. В то же время значения –ΔH° возрастают с увеличением содержания ацетонитрила в подвижной фазе. Такое в целом не характерное для сорбции в условиях жидкостной хроматографии изменение энтальпии мы наблюдали ранее при хроматографировании некоторых производных 1,3,4-оксадиазола и 1,2,4,5-тетразина [22]. Авторы [7, 23], получившие аналогичные изменения энтальпии при сорбции из водно-ацетонитрильных растворов гетероциклов иного строения, обосновали данный факт отклонением от конкурентного механизма сорбции: поскольку при высоком содержании ацетонитрила в подвижной фазе происходит модифицирование поверхности сорбента молекулами этого органического компонента, можно предположить, что в таком случае молекулы аналита не вытесняют молекулы модификатора в объемный раствор, а сорбируются на модифицированной молекулами ацетонитрила поверхности сорбента. В таком случае возрастание абсолютных значений ΔH° с ростом концентрации ацетонитрила в элюенте может быть результатом уменьшения дополнительных энергетических затрат на преодоление сорбируемыми молекулами взаимодействия между органическим компонентом и сорбентом. Этим же фактом можно, вероятно, объяснить отрицательные значения энтропийного члена A при максимальной концентрации ацетонитрила, свидетельствующие об уменьшении энтропии при сорбции из раствора такого состава. Следует заметить, что в работе [24] указано также, что подобный эффект может, по-видимому, проявиться за счет повышения набухания полимерного адсорбента при увеличении концентрации ацетонитрила либо в результате изменения вкладов гидрофобных и π–π-взаимодействий между молекулами сорбата и сорбентом в связи с ростом их сольватации.
Таблица 3.
Стандартные дифференциальные мольные изменения значений энтальпии (∆H°, кДж/моль) и энтропийного члена при разной мольной доле x ацетонитрила в элюенте
| Вещество | x = 0.257 | x = 0.341 | x = 0.580 | |||
|---|---|---|---|---|---|---|
| –∆H° | A | –∆H° | A | –∆H° | A | |
| 1 | 1.46 ± 0.03 | 0.46 ± 0.01 | 2.87 ± 0.01 | –0.47 ± 0.01 | 3.95 ± 0.04 | –1.21 ± 0.03 |
| 2 | 1.25 ± 0.04 | 1.01 ± 0.03 | 3.08 ± 0.02 | –0.17 ± 0.01 | 4.36 ± 0.06 | –1.05 ± 0.02 |
| 3 | 1.99 ± 0.07 | 1.18 ± 0.04 | 3.76 ± 0.01 | –0.04 ± 0.00 | 5.08 ± 0.02 | –1.03 ± 0.03 |
| 4 | 2.27 ± 0.03 | 0.63 ± 0.01 | 2.17 ± 0.04 | 0.33 ± 0.01 | 3.45 ± 0.03 | –0.76 ± 0.02 |
| 5 | 2.42 ± 0.05 | 0.89 ± 0.02 | 2.87 ± 0.01 | 0.52 ± 0.02 | 4.82 ± 0.05 | –0.93 ± 0.02 |
| 6 | 3.34 ± 0.03 | 1.05 ± 0.01 | 3.74 ± 0.01 | 0.43 ± 0.01 | 5.18 ± 0.03 | –0.85 ± 0.02 |
Вероятно, окончательный ответ о механизме сорбции производных хинолина в выбранных условиях хроматографирования можно будет дать на основании дополнительных экспериментальных данных для более широкого диапазона составов элюента и температуры.
Работа выполнена при поддержке Министерства образования и науки Российской Федерации в рамках государственного задания по гранту № FSSS-2020-0016.
Список литературы
Яшин Я.И., Яшин Е.Я., Яшин А.Я. Газовая хроматография. М.: Транслит, 2009. 528 с.
Снайдер Л.Р., Киркленд Д.Д., Долан Д.У. Введение в современную жидкостную хроматографию. М.: Техносфера, 2020. 960 с.
Киселев А.В. Межмолекулярные взаимодействия в адсорбции и хроматографии. М.: Высшая школа, 360 с.
Kaliszan R. // Chem. Rev. 2007. V. 107. P. 3212.
Wang C., Skibic M.J., Higgs R.E. et al. // J. Chromatogr. A. 2009. V. 1216. № 25. P. 5030.
Polyakova Yu., Long Mei Jin, Kyung Ho Row // Bull. Korean Chem. Soc. 2006. V. 27. № 2. P. 211.
Ланин С.Н., Рычкова С.А., Виноградов А.Е. и др. // Изв. АН. Сер. хим. 2016. № 1. С. 110.
Niknam M., Vatanparast M., Shekaari H. // J. Struct. Chem. 2017. V. 58. № 7. P. 1296.
Ekiert R.J., Krzek J., Talik P. // Talanta. 2010. V. 82. P. 1090.
D’Archivio A.A., Maggi M.A., Ruggieri F. // J. Sep. Sci. 2014. V. 37. P. 1930.
Сайфутдинов Б.Р., Пимерзин А.А. // Журн. физ. химии. 2013. Т. 87. № 4. С. 545.
Шатц В.Д., Сахартова О.В. Высокоэффективная жидкостная хроматография. Рига: Зинатне, 1988. 390 с.
Hanai T. // J. Chromatogr. A. 3003. V. 989. P. 183.
Davankov V.A., Sychov C.S., Ilyin M.M. et al. // J. Chromatogr. A. 2003. V. 987. P. 67.
Савченкова А.С., Курбатова С.В., Земцова М.Н. // Сорбц. и хроматогр. процессы. 2014. Т. 14. Вып. 3. С. 468.
Сайфутдинов Б.Р., Буряк А.К. // Журн. физ. химии. 2019. Т. 93. № 9. С. 1392.
Андреев В.П. // Химия гетероцикл. соед. 2010. № 2. С. 227.
Джоуль Д., Миллс К. Химия гетероциклических соединений. М.: Мир, 2004. 728 с.
Сайфутдинов Б.Р., Даванков В.А., Ильин М.М. // Журн. физ. химии. 2017. Т. 91. № 3. С. 539–543.
Lanin S.N., Rychkova S.A., Vinogradov A.E. et al. // Diamond & Relat. Mater. 2016. V. 64. P. 49.
Некрасова Н.А., Курбатова С.В. // Там же. 2019. Т. 93. № 1. С. 59.
Сайфутдинов Б.Р., Курбатова С.В., Емельянова Н.С. // Журн. физ. химии. 2010. Т. 84. № 4. С. 760.
Сайфутдинов Б.Р., Буряк А.К. // Коллоид. журн. 2019. Т. 81. № 6. С. 774.
Сайфутдинов Б.Р., Даванков В.А., Петухова Г.А. и др. // Докл. АН. 2015. Т. 462. № 6. С. 675.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


