Журнал физической химии, 2022, T. 96, № 11, стр. 1623-1629
Длины связей и радиусы атомов в соединениях рядов ЭХ3 (Э = N, P, As, Sb; X = F, Cl, Br, I)
К. Ф. Халитов a, Ф. Г. Халитов b, *
a Казанский (Приволжский) федеральный университет
420008 Казань, Россия
b Казанский государственный энергетический университет
420066 Казань, Россия
* E-mail: khalitovfar@mail.ru
Поступила в редакцию 04.03.2022
После доработки 30.03.2022
Принята к публикации 05.04.2022
- EDN: ILMMLR
- DOI: 10.31857/S0044453722110115
Аннотация
На основе экспериментальных данных установлены взаимосвязи между длинами связей d и первыми потенциалами ионизации атомов и молекул. Получены функциональные зависимости для рядов соединений ЭХ3 (Э = N, P, As, Sb; X = F, Cl, Br, I) при замещении Х или Э. Различные зависимости при варьировании Э или Х объяснены их неодинаковым влиянием на электронные пары ионов Э3–. Предложен метод оценки величин ионных радиусов RЭ элементов N, P, As, Sb. Обсуждены взаимозависимости между значениями ионных радиусов, их дипольными моментами и величинами рефракций. Показано влияние заместителей Х на величины радиусов RЭ. Оценены значения радиусов для сферически симметричных ионов RЭ(3–). Установлены линейные зависимости радиусов RЭ(3–), а также потенциалов ионизации соответствующих ионов Э3– и атомов инертных газов от их эффективных зарядов.
Разработка моделей, которые позволили бы с единых позиций интерпретировать экспериментальные данные, как спектральные, так и структурные, и получать дополнительную информацию, представляет интерес [1]. В частности, установление общих закономерностей изменения длин связей для определенных рядов соединений, зависимость их от радиусов атомов, образующих эти связи, электронного строения на основании различных моделей [2–5] необходимы при решении многих задач.
Ранее в работах [6–9] была предложена модель на основе параметров (ΔЕ,  ), связанных с потенциалами ионизации и дипольными моментами (ДМ) ионов Э3– соединений рядов ЭХ3 (Э = N, P, As, Sb; X = F, Cl, Br, I, СН3, С6Н5) и на базе экспериментальных данных были получены количественные соотношения между
величинами разности (ΔЕ) первых потенциалов ионизации (ПИ) атомов Э и молекул ЭХ3, валентными углами (α), дипольными моментами (μ) в основном и возбужденных состояниях,
константами квадрупольного взаимодействия.
), связанных с потенциалами ионизации и дипольными моментами (ДМ) ионов Э3– соединений рядов ЭХ3 (Э = N, P, As, Sb; X = F, Cl, Br, I, СН3, С6Н5) и на базе экспериментальных данных были получены количественные соотношения между
величинами разности (ΔЕ) первых потенциалов ионизации (ПИ) атомов Э и молекул ЭХ3, валентными углами (α), дипольными моментами (μ) в основном и возбужденных состояниях,
константами квадрупольного взаимодействия.
В данной работе на базе обсуждаемой модели с целью установления общих закономерностей и оценки молекулярных параметров для рядов соединений вида ЭХ3 (Э = N, P, As, Sb; X = F, Cl, Br, I), проведен анализ изменения величин длин связей d, полученных в газовой фазе, при варьировании элементов Э и заместителей Х. Ранее использованные в модели величины валентных углов, дипольных моментов, потенциалов ионизации, измерены в газовой фазе. Для сравнительного анализа использованы доступные в литературе величины рефракций Rn ионов Э3– в кристаллической фазе.
Один из параметров обсуждаемой модели – величина ΔЕ, характеризующая потенциалы ионизации при варьировании Э и Х в рядах соединений ЭХ3 (Э = N, P, As, Sb; Х = F, Cl, Br, I):
где $E_{{\text{Н}}}^{{\text{Э}}}$ – первый потенциал ионизации молекулы, $Е_{i}^{{\text{Э}}}$ – первый потенциал ионизации атома Э. Величина ΔЕ характеризует изменение энергии электронов неподеленных электронных пар (НЭП) иона Э3– в молекуле при варьировании заместителей Х [7]. Показано, что зависимости экспериментальных ДМ [7, 8] от величин ∆E для рядов ЭF3, ЭCl3, ЭBr3, ЭI3 (Э = N, P, As, Sb) описываются функциями типа(2)
${\text{ }}\mathop \mu \nolimits_{{\text{мол}}} = \mathop Y\nolimits_0 + A\exp [ - (B\Delta E)],$В рядах молекул ЭХ3, между дипольными моментами (${{\mu }_{{{{{\text{Э}}}^{{3 - }}}}}}$) ионов $\mathop {\text{Э}}\nolimits^{3 - } $ в молекулах и величинами ΔЕ, при варьировании Э и фиксированных Х, наблюдаются экспоненциальные, а при замещении атомов Х и одинаковых Э – линейные зависимости. Уравнения типа (1), (2) характеризуют относительную величину пространственного смещения электронов валентной оболочки иона $\mathop {\text{Э}}\nolimits^{3 - } $ относительно ядра при варьировании как центральных атомов Э, так и заместителей Х [7, 8].
АНАЛИЗ ДЛИН СВЯЗЕЙ Э–Х
Длины связей dЭ–Х в молекулах зависят от величин радиусов атомов RЭ и RХ, которые связаны с потенциалами ионизации валентных электронов [3, 5].
Поэтому можно ожидать определенных закономерностей в рядах ЭХ3 между длинами связей d и величинами ΔЕ при варьировании Э и Х [3, 5]. Экспериментальные значения длин связей для соединений ЭХ3 (Э = N, P, As, Sb; Х = F, Cl, Br, I) приведены в табл. 1 [10].
Таблица 1.
Величины ΔЕ, длин связей d и дипольных моментов ${{\mu }_{{{{{\text{Э}}}^{{3 - }}}}}}$ ионов Э3– соединений ЭХ3 [7, 8, 10]
| ЭХ3 | ΔЕ, эВ | d, Å | ${{\mu }_{{{{{\text{Э}}}^{{3 - }}}}}}$, D |
|---|---|---|---|
| NF3 | 1.56 | 1.365 | 0.12 |
| PF3 | –1.80 | 1.563 | 1.231 |
| AsF3 | –3.19 | 1.708 | 3.23 |
| SbF3 | –4.02 | 1.879 | 5.747 |
| NCl3 | 3.84 | 1.7535 | 0.14 |
| PCl3 | –0.04 | 2.0426 | 1.355 |
| AsCl3 | –1.04 | 2.1621 | 2.433 |
| SbCl3 | –2.09 | 2.333 | 4.497 |
| NBr3 | 4.44 | 1.856* | – |
| PBr3 | 0.52 | 2.22 | 0.989 |
| AsBr3 | –0.40 | 2.329 | 1.738 |
| SbBr3 | –1.40 | 2.49 | 3.857 |
| NI3 | 5.43 | 2.024* | – |
| PI3 | 1.33 | 2.43 | 0.730 |
| AsI3 | 0.70 | 2.557 | 1.242 |
| SbI3 | –0.42 | 2.719 | 3.105 |
* Рассчитаны по формуле (6).
Между величинами d и ΔЕ для рядов с постоянными Э и варьированием Х наблюдаются прямолинейные зависимости:
для ряда SbХ3 (Х = F, Cl, Br, I)
для ряда AsХ3 (Х = F, Cl, Br, I)
для ряда РХ3 (Х = F, Cl, Br, I)
для двух NХ3 (Х = F, Cl)
Из уравнения (6) можно оценить расстояния связей N–Br и N–I. Согласно данным [7], в рядах Э = N, P, As, Sb, Bi при одинаковых Х потенциалы ионизации $E_{{\text{Н}}}^{{\text{Э}}}$ остаются постоянными (табл. 2).
Таблица 2.
Экспериментальные значения первых потенциалов ионизации молекул ЭХ3($Е_{{\text{Н}}}^{{\text{Э}}}$, эВ)
| Х | N(14.53) | P(10.48) | As(9.81) | Sb(8.64) | Bi(7.29) | Среднее |
|---|---|---|---|---|---|---|
| F | 12.97 | 12.28 | 13.00 | 12.66 | 12.96 | 12.77 ± 0.47 |
| Cl | 10.69 | 10.52 | 10.85 | 10.73 | 10.98 | 10.75 ± 0.23 |
| Br | – | 9.96 | 10.21 | 10.04 | 10.15 | 10.09 ± 0.13 |
| J | – | 9.15 | 9.11 | 9.06 | 9.09 | 9.10 ± 0.05 |
| CH3 | 8.50 | 8.62 | 8.65 | 8.48 | 8.44 | 8.53 ± 0.12 |
Примечание. В скобках указан первый потенциал ионизации атомов Э [7] ($Е_{i}^{{\text{Э}}}$, эВ).
Используя величины $E_{{\text{Н}}}^{{\text{Э}}}$ = 10.09 и 9.10 эВ соответственно для NBr3 и NI3, из уравнения (6) получим для d(N–Br) = 1.856 Å и d(N–I) = 2.024 Å – значения, близкие к величинам d(N–Br) = 1.778 Å и d(N–I) = 1.965 Å для радикалов в газе [11, 12].
В рядах ЭХ3 с варьированием Э и с фиксированным Х наблюдаются экспоненциальные зависимости d = Y0 + Aexp[–ΔE/t]:
для ряда ЭF3 (Э = N, P, As, Sb)
В рассматриваемом интервале ошибки составляют ±0.050 – для Y0, ±0.049 – для А, ±0.550 – для t;
для ряда ЭCl3
(8)
$\begin{gathered} d = 1.555 + 0.481\exp (--\Delta E{\text{/}}4.357) \\ ( \pm 0.022,\; \pm {\kern 1pt} 0.024,\; \pm {\kern 1pt} 0.230); \\ \end{gathered} $для ряда ЭBr3
(9)
$\begin{gathered} d = 1.424 + 0.858\exp (--\Delta E{\text{/}}6.494) \\ ( \pm 0.102,\; \pm {\kern 1pt} 0.106,\; \pm {\kern 1pt} 0.977); \\ \end{gathered} $для ряда ЭI3
(10)
$\begin{gathered} d = 1.540 + 1.110\exp (--\Delta E{\text{/}}6.524) \\ ( \pm 0.305,\; \pm {\kern 1pt} 0.302,\; \pm {\kern 1pt} 2.659). \\ \end{gathered} $Таким образом, между длинами связей молекул d и разностью ПИ (ΔE) в рядах ЭХ3 с варьированием Х и фиксированным Э наблюдаются линейные зависимости ($E_{i}^{{\text{Э}}}$ = const; $E_{{\text{Н}}}^{{\text{Э}}}$ ≠ const, табл. 2). Для рядов с фиксированным Х при варьировании центрального атома Э наблюдаются экспоненциальные зависимости ($E_{i}^{{\text{Э}}}$ ≠ const; $E_{{\text{Н}}}^{{\text{Э}}}$ = const, табл. 2).
Различие функциональных зависимостей при замещении Э или Х в рядах ЭХ3 можно объяснить следующим образом. В рядах с фиксированным Э при варьировании заместителей Х (F, Cl, Br, I) значение первого ПИ атома Э $E_{i}^{{\text{Э}}}$ остается постоянным, а значение $E_{{\text{Н}}}^{{\text{Э}}}$ меняется (табл. 2, уравнения (3)–(6). В используемой модели (рис. 1) величина $E_{{\text{Н}}}^{{\text{Э}}}$ является ПИ неподеленной электронной пары, который определяется суммой энергии притяжения к ядру и энергии отталкивания между НЭП и тремя связывающими электронными парами (СЭП) на валентной оболочке иона Э3–. В [6, 7] показано, что величина $\Delta Е = E_{i}^{{\text{Э}}} - E_{{\text{Н}}}^{{\text{Э}}}$ пропорциональна энергии отталкивания электронных пар на валентной оболочке. В рассматриваемом случае при постоянном значении составляющей $E_{i}^{{\text{Э}}}$ величины $E_{{\text{Н}}}^{{\text{Э}}}$ определяются последовательным влиянием заместителей Х на три СЭП и соответственно на НЭП. Изменяется влияние положительного заряда Х на электронные пары иона Э3-. Из уравнений (3)–(6) следует, что изменения влияния заместителей Х на ион Э3– описываются прямой зависимостью.
Рис. 1.
Строение иона Э3– с тремя СЭП и одной НЭП (а) и радиусы RЭ атомов Э для состояний 5+, 3+, 3– (б).

В случае Э = N, P, As, Sb и постоянного Х в первом приближении влияние заместителей Х остается постоянным, а ПИ $E_{{\text{Н}}}^{{\text{Э}}}$ в пределах ряда не изменяется (табл. 2, уравнения (7)–(10)). Увеличение радиуса RЭ в ряду Э = N, P, As, Sb ослабляет влияние положительного заряда ядра на электронные пары иона Э3– и, соответственно, на потенциал ионизации атома Еi ∼ 1/RЭ.
Из формулы (1) следует $E_{{\text{Н}}}^{{\text{Э}}}$ = Еi – ΔE, т.е. при постоянных $E_{{\text{Н}}}^{{\text{Э}}}$ и Х в ряду Э = N, P, As, Sb изменения Еi и величины энергии ΔE, пропорциональной энергии отталкивания электронных пар на валентной оболочке, равны. Величина $E_{{\text{Н}}}^{{\text{Э}}}$ определяется энергиями притяжения к ядру и энергией отталкивания электронных пар на валентной оболочке. Величины Еi и углов α в этом ряду уменьшаются, а угол β (рис. 1а) увеличивается, т.е. расстояние между НЭП и СЭП увеличивается и, соответственно, уменьшается величина отталкивания НЭП и СЭП относительно СЭП и СЭП. В итоге при уменьшении Еi в ряду Э = N, P, As, Sb происходит ослабление притяжения НЭП к ядру и ослабление отталкивания НЭП от трех СЭП. В целом противоположные величины энергий этих вкладов в $E_{{\text{Н}}}^{{\text{Э}}}$ равны. Важность исследований зависимостей между энергиями притяжения к ядру и взаимного отталкивания электронов валентной орбитали обсуждается в работе [13].
ОПРЕДЕЛЕНИЕ ВЕЛИЧИН РАДИУСОВ ИОНОВ RЭ И RХ
Длины связей можно представить в виде суммы атомных радиусов d = RХ + RЭ. Ковалентные и ионные связи отличаются [3]. Во всех обсуждаемых соединениях полярные связи. Поэтому можно считать, что длина связи равна сумме радиусов ионов [3–5]. Анализ данных табл. 1 показывает, что для всех Э = N, P, As, Sb разности длин связей, например для четырех пар соединений ЭF3 и ЭCl3 остаются постоянными: dЭ–Cl – dЭ–F = ∆dCl–F = = 0.444 ± 0.056, ∆dBr–Cl = 0.152 ± 0.047, ∆dI–Br = = 0.212 ± 0.033; т.е. в первом приближении сохранение величин разностей свидетельствует о малом влиянии на RХ замены Э = N, P, As, Sb. Поэтому можно допустить, что в уравнениях (7)–(10) постоянные члены характеризуют RХ, а переменные экспоненциальные части определяют RЭ. Результаты расчетов приведены в табл. 3 (столбцы 2 и 3). Эти величины можно сравнить, например с приведенными в [5] радиусами для ионов RЭ и RХ (табл. 3, столбцы 4, 5).
Таблица 3.
Величины радиусов ионов RЭ и RХ, Å
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | ||
|---|---|---|---|---|---|---|---|---|
| ЭХ3 | RЭ, Å | RХ, Å | RЭ(5+) | RЭ(3+) | RЭ(3–) | RХ(1–) | RЭ, Å | RХ, Å |
| NF3 | 0.079 | 1.289 | 0.11 | 0.16 | 1.66 | 1.34 | 0.054 | 1.313 |
| NCl3 | 0.199 | 1.555 | 1.83 | 0.301 | 1.453 | |||
| NBr3 | 0.433 | 1.425 | 1.98 | 0.366 | 1.490 | |||
| NJ3 | 0.483 | 1.540 | 2.23 | 0.473 | 1.551 | |||
| PF3 | 0.264 | 1.289 | 0.34 | 0.44 | 2.11 | 1.34 | 0.231 | 1.318 |
| PCl3 | 0.486 | 1.555 | 1.83 | 0.603 | 1.449 | |||
| PBr3 | 0.792 | 1.424 | 1.98 | 0.721 | 1.490 | |||
| PJ3 | 0.905 | 1.540 | 2.23 | 0.892 | 1.550 | |||
| AsF3 | 0.434 | 1.289 | 0.46 | 0.64 | 2.29 | 1.34 | 0.405 | 1.318 |
| AsCl3 | 0.611 | 1.555 | 1.83 | 0.730 | 1.448 | |||
| AsBr3 | 0.912 | 1.424 | 1.98 | 0.827 | 1.487 | |||
| AsJ3 | 0.997 | 1.540 | 2.23 | 0.993 | 1.554 | |||
| SbF3 | 0.584 | 1.289 | 0.64 | 0.82 | 2.49 | 1.34 | 0.552 | 1.322 |
| SbCl3 | 0.777 | 1.555 | 1.83 | 0.884 | 1.445 | |||
| SbBr3 | 1.064 | 1.424 | 1.98 | 1.003 | 1.489 | |||
| SbJ3 | 1.184 | 1.540 | 2.23 | 1.172 | 1.551 | |||
Известно, что при увеличении положительного заряда иона радиус уменьшается [3, 5]. Для сравнения с вычисленными радиусами в табл. 3 (столбцы 4 и 5) приведены рассчитанные в [5] RЭ и RХ для зарядов (1–) ионов F–, Cl–, Br-, I– и (5+, 3+, 3–) для N, P, As, Sb. Действительно, сравнение литературных и полученных в настоящей работе значений RХ и RЭ показывает, что закономерности изменения во всех рядах и порядки величин при варьировании Э и Х качественно согласуются (табл. 3). При переходе от F к Cl, и далее к Br и I соответственно для всех Э (N, P, As, Sb) радиус RЭ увеличивается на ∼0.40–0.64 Å. Радиусы ионов RХ изменяются незначительно. Рассчитанные в [5] значения RЭ(+5) и RЭ(+3) близки соответственно к величинам для ЭF3 и ЭCl3 (табл. 3, столбец 2). Полученные из квантово-химических расчетов значения радиусов сфер при максимальной концентрации электронов валентной оболочки N(0.413 Å), P(0.804 Å), As(1.154 Å) [14] близки к величинам для ЭBr3 и ЭI3 (табл. 3, столбец 2).
В обсуждаемой модели (на базе ОЭПВО) рассматривается ион Э3– молекул ЭХ3 (рис. 1а), включающий пять электронов атома Э и три электрона атомов Х. На внешней оболочке иона находятся четыре электронные пары, между которыми действуют силы отталкивания. Увеличение электроотрицательности атомов Х в ряду I, Br, Cl, F сдвигает СЭП от ядра Э к Х, увеличивает ДМ иона Э3– (табл. 1), уменьшает угол α [7].
Согласно ионной модели [3, 15], сдвиг электронов валентной оболочки Э к Х уменьшает радиус RЭ. Например, RЭ для молекул ЭF3 будет меньше, чем для ЭI3. Для сопоставления с используемыми в литературе радиусами атомов Э условно на схеме (рис. 1б) показаны окружности при зарядах RЭ(+5) и RЭ(+3). Эти радиусы соответствуют крайним состояниям атома Э. Первый случай соответствует отрыву от Э3– всех четырех ЭП (НЭП и трех СЭП). Второй случай соответствует отрыву трех СЭП (рис. 1б). Окружность при заряде (3–), радиус которой RЭ(3–) соответствует сферически симметричной электронной оболочке с углами α = β = 109.5° и дипольным моментом $\mu _{{\text{Э}}}^{{3 - }}$ = 0 [7]. Для этой структуры иона энергии отталкивания всех электронных пар одинаковы [15, с. 39].
Полученные из уравнений (7)–(10) величины RХ и RЭ должны удовлетворять и уравнениям (3)–(6). В уравнениях (3)–(6) переменная часть определяется производными d(dЭ–X)/d(∆E), которые можно разложить на отдельные составляющие производные для Э и Х:
(11)
$\begin{gathered} {{R}_{{{\text{Sb}}}}} = 1.244 + 0.172\Delta E \\ (r = 0.963,\;{{S}_{0}} = \pm 0.090), \\ \end{gathered} $(13)
$\begin{gathered} {{R}_{{{\text{As}}}}} = 0.887 + 0.151\Delta E \\ (r = 0.944,\;{{S}_{0}} = \pm 0.106), \\ \end{gathered} $для ряда PX3 (F, Cl, Br, I)
(15)
$\begin{gathered} {{R}_{{\text{P}}}} = 0.611 + 0.211\Delta E \\ (r = 0.960,\;{{S}_{0}} = \pm 0.100), \\ \end{gathered} $для ряда NX3 (F, Cl, Br, I)
(17)
$\begin{gathered} {{R}_{{\text{N}}}} = --0.114 + 0.108\Delta E \\ (r = 0.927,\;{{S}_{0}} = \pm 0.088), \\ \end{gathered} $Для оптимизированных уравнений (11)–(18) всех рядов, согласно ожидаемому, производная d(RХ)/d(∆E) характеризующая изменение RX, мала в пределах 0.068 ± 0.007, а для d(RЭ)/d(∆E) от 0.108 до 0.211.
Рассчитанные по уравнениям (11)–(18) RЭ и RХ приведены в табл. 3 (столбцы 6 и 7). Разность величин составляет: ∆RN = 0.418, ∆RP = 0.661, ∆RAs = 0.588, ∆RSb = 0.620 Å. Примерно такой же порядок величин наблюдается для разности атомных (по Слейтеру) [3, стр. 140] и ионных с зарядами 3+ (табл. 3) радиусов для ∆RN = 0.49, ∆RP = 0.56, ∆RAs = 0.51, ∆RSb = 0.63 Å. Средние величины для RN = 0.299, RP = 0.612, RAs = 0.739, RSb = 0.902 Å близки к значениям рассчитанных радиусов для заряда 3+ (табл. 3). Для RX в рядах с варьированием Э наблюдаются незначительные изменения.
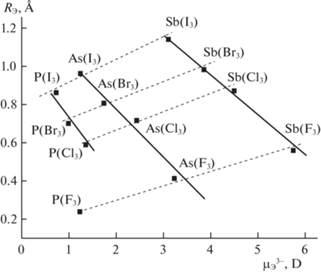
При замещении Х в ряду I, Br, Cl, F увеличивается перенос электронов от Э к Х. Это приводит к росту положительного заряда +Z на атоме Э и уменьшению RЭ (рис. 1). Происходит увеличение заряда положительного конца диполя на Э относительно отрицательного иона Х-. Значение ДМ иона Э3– (рис. 1) увеличивается за счет смещения трех СЭП иона Э3– к Х [6–9]. Действительно (рис. 2), зависимости величин RЭ от ДМ ионов Э3– (табл. 1) [7, 8] описываются уравнениями:
(19)
$\begin{gathered} {{R}_{{{\text{Sb}}}}} = 1.907--0.234\mu _{{\text{Э}}}^{{3 - }} \\ (r = 0.998,\;{{S}_{0}} \pm 0.023), \\ \end{gathered} $(20)
$\begin{gathered} {{R}_{{{\text{As}}}}} = 1.346--0.281\mu _{{\text{Э}}}^{{3 - }} \\ (r = 0.982,\;{{S}_{0}} \pm 0.058), \\ \end{gathered} $для хлор-, бром- и йодпроизводных фосфора
(21)
$\begin{gathered} {{R}_{{\text{Р}}}} = 1.203--0.454\mu _{{\text{Э}}}^{{3 - }} \\ (r = 0.979,\;{{S}_{0}} \pm 0.042). \\ \end{gathered} $Уравнения (11), (13), (15), (17) при экстраполяции позволяют оценить величины RЭ(3–) для сферически симметричных ионов Э3–(3–). Для них, согласно модели ОЭПВО, наблюдается полное равновесие энергий отталкивания электронных пар на валентной оболочке при валентных углах ХЭХ α = 109.5° [6–9, 15]. Величины ПИ и ∆Е для этого состояния приведены в [6–9]. Для всех Э3–(3–) при углах α = β = 109.5° значение ∆Е = 5.89 эВ, $\mu _{{\text{Э}}}^{{3 - }}$ = 0 (рис. 1), а $E_{{\text{Н}}}^{{\text{N}}}$(3–) = 8.64, $E_{{\text{Н}}}^{{\text{P}}}$(3–) = 4.59, $E_{{\text{Н}}}^{{{\text{As}}}}$(3–) = 3.92, ${\text{ }}E_{{\text{Н}}}^{{{\text{Sb}}}}$(3–) = 2.75 эВ. Из уравнений (11), (13), (15), (17) при ∆Е = 5.89 эВ получим RSb(3–) = 2.258 Å, RAs(3–) = 1.777 Å, RP(3–) = 1.855 Å, RN(3–) = 0.523 Å. Завышенная величина RP(3–) = 1.855 Å при экстраполяции до ∆Е = 5.89 эВ может быть связана со значительным понижением экспериментального значения $E_{{\text{H}}}^{P}$ для PF3 от среднего для фторпроизводных ЭF3 (табл. 2) и соответствующим увеличением d(RЭ)/d(∆E) в уравнении (15).
Для состояния (3–) величины RЭ(3–) всего ряда оценены в работах [16, 17]. Например, в работе [16, с. 240] для (3–) для всего ряда RN(3–) = 1.66 Å, RP(3–) = 2.11 Å, RAs(3–) = 2.29 Å, RSb(3–) = 2.49 Å. Эти данные можно сравнить с полученными из уравнений (11), (13), (15), (17) величинами RЭ(3–), за исключением RP(3–) = 1.855 Å. Между полученными нами и литературными величинами для трех соединений производных Sb, As, N наблюдается прямая зависимость:
(22)
$\begin{gathered} {{R}_{{\text{Э}}}}(3{\kern 1pt} - ) = --2.918 + 2.067{{R}_{{\text{Э}}}}{{(3{\kern 1pt} - )}_{{{\text{(лит)}}}}} \\ (r = 0.999,\;{{S}_{0}} \pm 0.049). \\ \end{gathered} $Уравнение (22) можно использовать для уточнения рассчитанного из уравнения (15) завышенного значения RP(3–) = 1.855 Å. Подставляя в уравнение (22) литературное значение RP(3–)(лит) = = 2.11 Å, получим для RP(3–) = 1.444 Å.
В работе [16, с. 81] приведены значения кристаллических рефракций Rn для ионов Э3–(3–) с зарядами (3–) (табл. 4). Между величинами рефракций Rn для N3–, As3–, Sb3– и радиусами RЭ(3–) (табл. 4) наблюдается корреляция:
(23)
$\begin{gathered} {{R}_{{\text{Э}}}}(3{\kern 1pt} --) = 0.114 + 0.080{{R}_{n}} \\ (r = 0.997,\;{{S}_{0}} \pm 0.106). \\ \end{gathered} $Таблица 4.
Величины радиусов, рефракций (Rn) и потенциалов ионизации ионов Э3– и инертных газов
| Величина | N3–(3–) | P3–(3–) | As3–(3–) | Sb3–(3–) | Ne | Ar | Kr | Xe |
|---|---|---|---|---|---|---|---|---|
| RЭ(3–), Å | 0.523 | 1.445 | 1.777 | 2.258 | – | – | – | – |
| R(орбит), Å | – | – | – | – | 0.354 | 0.66 | 0.79 | 0.99 |
| Rn, см3 | 5.5 | 16.7 | 19.8 | 27.6 | – | – | – | – |
| ЕН(3–), эВ | 8.64 | 4.59 | 3.92 | 2.75 | – | – | – | – |
| $Е_{{\text{Н}}}^{{{\text{VIII}}}}$, эВ | – | – | – | – | 21.56 | 15.79 | 14.00 | 12.13 |
Независимая оценка величин радиусов для ионов Э3–(3–) (при α = 109.5°) по уравнениям (19)–(21) также указывает на аналогичную общую закономерность повышения значений и порядок величин $R_{{\text{Э}}}^{{3--}}$(3–). При $\mu _{{\text{Э}}}^{{3 - }}$ = 0 получим RSb(3–) = = 1.907 Å, RAs(3–) = 1.346 Å, RP(3–) = 1.203 Å.
Таким образом, общая закономерность изменения значений RЭ(3–) для ряда ионов (табл. 4) хорошо коррелирует с величинами рефракций Rn и литературными значениями радиусов для этих ионов и с полученными из корреляций с ДМ.
ЗАКЛЮЧЕНИЕ
Согласно обсуждаемой модели [6–9], ионы Э3–(3–) имеют замкнутую оболочку с четыремя ЭП. Такую же завершенную оболочку имеют инертные газы [18, 19]. Поэтому можно ожидать, что между радиусами, а также первыми ПИ, для соответствующих периодов элементов 15 и атомами 18 групп Периодической системы (ПС), будут наблюдаться закономерные зависимости. Действительно, по соответствующим формулам [20] для радиусов атомов
Между первыми ПИ (табл. 4) ионов Э3–(3–) и инертных газов также наблюдается линейная зависимость с близким к рассчитанному значению коэффициентом
Таким образом, проведенный анализ длин связей dЭ–Х рядов ЭХ3 позволил провести разделение на составляющие радиусы RХ и RЭ. Для более электроотрицательных Х величины RХ при варьировании Э изменяются незначительно. Большие изменения величин RЭ при варьировании Х определяются меньшей электроотрицательностью и одновременным взаимодействием с тремя Х.
Дальнейшая экстраполяция величин RЭ позволила оценить их значения в равновесном состоянии RЭ(3–), известные в литературе как ионы с зарядом (3–). Эти ионы, в используемой модели, соответствуют равновесным, сферически симметричным ионам Э3–(3–) с радиусами RЭ(3–). Углы α и β между четыремя ЭП для них равны 109.5°, ДМ $\mu _{{\text{Э}}}^{{3 - }}$ = 0, а энергии отталкивания четырех электронных пар валентной оболочки одинаковы (рис. 1).
Рассматриваемая модель, позволившая ранее [6–9] для обсуждаемых соединений интерпретировать экспериментальные данные для валентных углов, дипольных моментов, потенциалов ионизации, констант квадрупольного взаимодействия, интенсивностей в ИК-спектрах, дополнительно может быть использована для анализа закономерностей между ПИ и длинами связей. Полученные значения RЭ могут быть использованы для оценки величин поляризуемостей и напряженностей [19] в ионах Э3–.
Список литературы
Теруков Е.И., Марченко А.В., Серегин П.П. и др. // Физика твердого тела. 2018. Т. 60. Вып. 10. С. 1866.
Холанд А. Молекулы и модели: Молекулярная структура соединений элементов главных групп. М.: УРСС: КРАСАНД, 2011. 384 с.
Бацанов С.С. Структурная химия. Факты и зависимости. М.: Диалог-МГУ, 2000. 292 с.
Кириллов А.С. // Вестн. Санкт-Петербургск. ун-та. 2007. Вып. 4. Сер. 7. С. 15.
Бугаенко Л.Т., Рябых С.М., Бугаенко А.Л. // Вестн. Московск. ун-та. Сер. 2. Химия. 2008. Т. 49. № 6. С. 363.
Халитов Ф.Г., Халитов К.Ф. // Политематический сетевой электронный научный журнал Кубанск. гос. аграрн. ун-та. 2014. № 99. С. 137. http://ej.kubagro.ru/2014/05/pdf/18.pdf
Халитов К.Ф., Новиков В.Ф., Халитов Ф.Г. // Журн. общ. химии. 2016. Т. 86. Вып. 10. С. 1640. https://doi.org/10.1134/S1070363216100078
Халитов К.Ф. // Изв. вузов. Проблемы энергетики. 2016. № 9–10. С. 138.
Халитов К.Ф., Новиков В.Ф. // Там же. 2018. Т. 20. № 1–2. С. 122.
Краснов К.С., Филиппенко Н.В., Бобкова В.А. и др. Молекулярные постоянные неорганических соединений. Л.: Химия, 1979. 447 с.
Sakamaki T., Okabayashi T., Tanimoto M. // J. Chem. Phys. 1998. V. 109. P. 7169.
Shestakov O., Gielen R., Setzer K.D., Fink E.H. // J. Mol. Spectr. 1998. V. 192. P. 139.
Новосадов Б.К., Грибов Л.А. // Журн. структур. химии. 2021. Т. 62. № 4. С. 555. https://doi.org/10.26902/JSC_id71034
Бейдер Р. Атомы в молекулах: Квантовая теория. М.: Мир, 2001. 533 с.
Киперт Д. Неорганическая стереохимия. М.: Мир, 1985. 280 с. [Inorganic Stereo-chemistry, Kepert David L., Springer-Verlag, Berlin-Heidelberg-New York, 1982, 279 pp.]
Бацанов С.С. Структурная рефрактометрия. М.: Высшая школа, 1976. 304 с.
Kordes E. // Z. Anorg. Allg. Chem., 1964, V. 327. P. 215.
Финкельштейн Д.Н. Инертные газы. Изд. 2-е. M.: Наука, 1979. 200 с.
Потапов А.А. // Электронный журнал “ИССЛЕДОВАНО В РОССИИ” http://zhurnal.ape.relarn.ru/articles/2005/049.pdf, 554-570, (alex_p@icc.ru)
Сивухин Д.В. Атомная и ядерная физика. М.: ФИ-ЗМАТЛИТ, 2006. 784 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии