Журнал физической химии, 2022, T. 96, № 12, стр. 1732-1738
Исследование комплексообразования в системе Fe(II)–Fe(III)–CH3COOH–H2O методом оксредметрии
М. Рахимова a, *, Дж. А. Давлатшоева a, Ш. С. Эмомадова a, Г. Б. Эшова a, Ф. Мираминзода a, М. Б. Жоробекова b
a Таджикский национальный университет
Душанбе, Таджикистан
b Ошский государственный университет
Ош, Киргизия
* E-mail: muboshira09@mail.ru
Поступила в редакцию 23.12.2021
После доработки 10.06.2022
Принята к публикации 14.06.2022
- EDN: TYFLDU
- DOI: 10.31857/S0044453722120202
Аннотация
Методом окислительного потенциала Кларка–Никольского при температуре 298.15 К, ионной силе раствора 0.1 моль/л (Na(H)CIO4) изучены процессы комплексообразования в окислительно-восстановительной системе Fe(II)–Fe(III)–CH3COOH–H2O. Получены экспериментальные зависимости ЭДС системы от концентраций ионов водорода, железа(III), железа(II) и уксусной кислоты (рН, рС0, рСr, pCL, соответственно). Установлено, что процессы комплексообразования в изученной системе протекают ступенчато в широком интервале рН от 0.6 до 9.8, при этом формируются моноядерные координационные соединения состава: [FeL(H2O)5]2+, [Fe(L)2(H2O)4]+, [FeLOH(H2O)4]+, [FeL(H2O)5]+, [Fe(L)2(H2O)4]0, [FeLOH(H2O)4]0, а также гетеровалентный комплекс [FeIIFeIII(L)2(OH)2(H2O)8]+. Составлены химические модели реакций образования комплексов и определены области их доминирования. Предложены возможные варианты реакций образования координационных соединений.
Переходные металлы – типичные металлы жизни – аккумулируются в основном во внеклеточном пространстве живых организмов. Они легко меняют степень окисления, особенно железо, и участвуют во многих окислительно-восстановительных, биохимических процессах [1, 2]. При взаимодействии ионов биогенных металлов с органическими лигандами протекают различные процессы комплексообразования, изучение которых, с дальнейшим их моделированием, позволяет выявить механизмы биологических и физиологических процессов. Кроме того, лиганды, содержащиеся в координационных соединениях, проявляют высокую биологическую активность, не свойственную им в свободном состоянии. Центральные атомы-комплексообразователи –обычно становятся менее токсичными и остаются эффективными “донорами” микроэлемента [3, 4]. На их основе получают лекарственные препараты [5, 6]. В связи с этим изучение процессов комплексообразования переходных металлов с органическими лигандами представляет теоретический и практический интересы.
Во второй половине прошлого столетия для исследования процессов комплексообразования переходных металлов в водных растворах с органическими лигандами широко использовался высокочувствительный, простой в выполнении эксперимента и недорогой метод окислительного потенциала Кларка–Никольского [7–9]. Этим методом были изучены процессы комплексообразования Fe(II) и Fe(III) с одноосновными карбоновыми кислотами [10, 11], аминокислотами [12–15] при различных ионных силах раствора.
Было установлено, что с ацетат-ионами при ионной силе раствора 1.0 моль/л [Na(H)ClO4] и концентрации уксусной кислоты 1 × 10–2 моль/л в интервале значений рН от 0.5 до 45 с ионами Fe(III) образуются комплексы состава: [FeОН(H2O)5]2+ , [FeL(H2O)5]2+, [FeLОН(H2O)4]+, [FeL2(H2O)4]+, [Fe3L6(ОН)2(H2O)10]+, а с ионами Fe(II) – [FeL(H2O)5]+. Комплекс состава [Fe3L6(ОН)2(H2O)10]+ – наиболее прочный, ($\lg {{\beta }_{{qpslk}}}$ = 21.16) и имеет максимальную степень накопления (100 мол. %). Другие координационные соединения имеют небольшие степени накопления 5.8, 7.0, 8.2, 16.0 и 10.0 мол. %. При повышении рН выше 4.5 при указанных условиях эксперимента начинается гидролиз Fe(III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Процессы формирования комплексов в системе Fe(II)–Fe(III)–CH3COOH–H2O изучали при ионной силе раствора 0.1 моль/л и температуре 298.15 К. Исследовали экспериментальные зависимости ЭДС системы от одного из концентрационных параметров: рН, pC0, pCr и pCL (показатели концентраций ионов водорода, окисленной, восстановленной форм металла и лиганда, соответственно).
Для проведения экспериментов использовали эквимолекулярную смесь растворов солей перхлоратов железа(II) и (III) в 1 М растворе хлорной кислоты. Исходные реактивы – перхлораты двух- и трехвалентного железа [16]. Концентрации железа(III) и железа(II) определяли по соответствующим методикам [17, 18]. Для предотвращения окисления Fe(II) эксперименты проводили в токе газообразного азота (аргона).
Перхлорат натрия (NaClO4) очищали фильтрацией, концентрацию определяли весовым методом [19]. ЭДС системы определяли методом потенциометрии. В электролитическую ячейку помещали платиновый, стеклянный, вспомогательный, хлорсеребряный электроды, трубки для инертного газа. Измерение ЭДС системы проводили с помощью двух гальванических элементов:
(I)
${\text{Pt}}\,|\,{\text{исследуемый}}\;{\text{р - р}}\,||\,{\text{KCI}}({\text{нас}}{\text{.}}),\;{\text{AgCI}}\,|\,{\text{Ag,}}$(II)
$\begin{gathered} {\text{Ag}}\,|\,{\text{AgCI}},({\text{НCl}}\;0.1\;{\text{н}}{\text{.}})\,|\,{\text{стекло}}\,|\,{\text{исследуемый}}\; \\ {\text{р - р}}\,||\,{\text{KCI}}({\text{нас}}{\text{.}}),{\text{AgCI}}\,|\,{\text{Ag}}{\text{.}} \\ \end{gathered} $Экспериментальные зависимости ЭДС системы от рН
Первый рабочий раствор (эквимолекулярная смесь перхлоратов Fe(II), Fe(III) и уксусной кислоты) готовили в мерной колбе на 50 мл. Концентрацию двух- и трехвалентного железа варьировали в пределах 1 × 10–4–1 × 10–2 моль/л, а кислоты – от 1 × 10–1 до 1 × 10–2 моль/л. Постоянную ионную силу рабочих растворов поддерживали хлорной кислотой. Второй рабочий раствор содержал те же компоненты, что и первый, в одинаковом количестве. Ионную силу раствора поддерживали перхлоратом и гидроксидом натрия. Так достигали более высокое значение рН второго рабочего раствора. Затем первый рабочий раствор помещали в электролитическую ячейку и в течение 15–20 мин через него пропускали инертный газ, проводили измерение ЭДС гальванических элементов (I) и (II). При титровании первого раствора вторым, значение рН системы постепенно смещается в щелочную область.
Экспериментальные зависимости ЭДС системы от рС0
Указанные зависимости необходимы для определения значения тангенсов угла наклона кривой и ядерности образующихся комплексов Fe(III). Два рабочих раствора готовили со значениями рН, соответствующими прямолинейным участкам зависимости ЭДС от рН. Первый раствор содержал эквимолекулярную смесь [Fe(III)] = = [Fe(II)] и уксусной кислоты, хлорной кислотой ионную силу поддерживали постоянной, значение рН полученного раствора минимально. Второй раствор содержал также эквимолекулярную смесь [Fe(III)] = [Fe(II)], определенную концентрацию лиганда, а ионную силу доводили до постоянного значения гидроксидом натрия, значение рН второго раствора максимально. Далее из них готовили растворы с заданными постоянными значениями рН. Отбирали 100 мл первого рабочего раствора в электролитическую ячейку и титровали вторым раствором до значения ЭДС системы, соответствующего требуемому значению рН. Из этого раствора получали два других с максимальной и минимальной концентрациями окисленной формы железа. Титрант вливали в микробюретку, в ячейку отбирали 50 мл первого рабочего раствора, пропускали в течение 20–30 мин инертный газ, помещали стеклянный и каломельный электроды, и измеряли первое значение ЭДС. Затем титровали небольшим количеством титранта и определяли значение ЭДС системы в каждой точке. Получали зависимость ЭДС системы от рС0.
Экспериментальные зависимости ЭДС системы от рСr
По описанной выше методике получали два раствора с различными значениями рН, а также максимальной и минимальной концентрацией Fe(II). В ячейку отбирали 50 мл первого рабочего раствора, через ячейку 20–30 мин пропускали инертный газ, помещали все необходимые электроды и измеряли первое значение ЭДС. Затем титровали титрантом, определяли значения ЭДС системы и строили зависимости ЭДС от рСr.
Экспериментальные зависимости ЭДС системы от рСL
Готовили два рабочих раствора, которые содержали эквимолекулярную смесь CFe(II) = CFe(III) и различные концентрации уксусной кислоты рСL. Рассматриваемый интервал значений рСL должен перекрывать использованные при получении зависимостей ЭДС от рН. Готовили раствор с минимальным количеством лиганда. В мерную колбу на 100 мл брали CFe(II) = CFe(III) = = 1 × 10–5 и 0.1 моль/л уксусной кислоты. Ионную силу раствора поддерживали постоянной хлорной кислотой и перхлоратом натрия. Второй раствор готовили так же, как первый, только ионную силу раствора поддерживали постоянной гидроксидом натрия. Первый раствор, электроды, помещали в электролитическую ячейку, куда постепенно приливали второй раствор до тех пор, пока ЭДС гальванического элемента (II) не стала соответствовать нужному значению рН.
В колбу на 50 мл брали исходное количество перхлората Fe(II) и Fe(III) и доводили до метки заранее приготовленным раствором с заданными значениями рН и концентрацией уксусной кислоты. Другой раствор готовили так же, с тем отличием, что применяемый для разбавления раствор должен был содержать максимальное количество лиганда (2 или 3 моль/л). Для получения зависимости ЭДС от рСL определенное количество первого раствора (V0) наливали в ячейку, продували инертным газом и замеряли ЭДС обоих гальванических элементов. В ячейку из микробюретки понемногу добавляли заданное количество второго раствора (Vi) и измеряли ЭДС.
Анализ всех экспериментальных кривых и их производных осуществляли на основании общего уравнения окислительного потенциала для системы Мz+ – ${{{\text{M}}}^{{(z - e) + }}}$ – слабая алифатическая кислота – вода:
(1)
$\begin{gathered} Е = {{Е}^{0}} + {v}\lg ({{C}_{0}}{\text{/}}{{C}_{{\text{r}}}}) + \\ + \;{v}\lg \mathop \sum \limits_1^g {\kern 1pt} {\kern 1pt} \mathop \sum \limits_0^x {\kern 1pt} {\kern 1pt} \mathop \sum \limits_0^y \,q\beta _{{qxy}}^{{1/q}}Q_{{qxy}}^{{(q - 1/q)}}K_{a}^{{x/g}}C_{a}^{{x/g}}{{h}^{{ - (x + y)/q}}} - \\ - \;{v}\lg \mathop \sum \limits_1^p {\kern 1pt} {\kern 1pt} \mathop \sum \limits_0^u {\kern 1pt} {\kern 1pt} \mathop \sum \limits_0^{v} \,p\beta _{{pu{v}}}^{{1/p}}P_{{pu{v}}}^{{(p - 1/p)}}K_{a}^{{u/p}}C_{a}^{{u/p}}{{h}^{{ - (u + {v})/p}}}, \\ \end{gathered} $ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В соответствии с методикой экспериментов [10–15], вначале получены зависимости ЭДС системы (Е) от рН (рис. 1).
Рис. 1.
Зависимости ЭДС системы Fe(II)–Fe(III)–CH3COOH–H2O от рН при температуре 298.15 К и ионной силе раствора 0.1 моль/л; 1 – СFe(II) = CFe(III) = = 1 × 10–4, CHL = 1 × 10–3; 2 – СFe(II) = CFe(III) = 1 × × 10–4, CHL = 1 × 10–2; 3 – СFe(II) = CFe(III) = 1 × 10–3, CHL = 1 × 10–2 моль/л.

Как видно из рис. 1, ЭДС системы с увеличением рН до значений 1.5–2.0 остается неизменной, наклон кривой равен нулю. Согласно методу, это связано с отсутствием в системе процесса комплексообразования. Далее ЭДС уменьшается, и тангенс угла наклона рассматриваемой кривой становится равным $ - {v}$ (–58 мВ). В соответствии с уравнением Нернста, это свидетельствует об образовании в растворе координационных соединений Fe(III). Указанный процесс длится до рН ⁓ ⁓ 4.6. Далее наклон кривой постепенно понижается до $ - 2{v}$ (116 мВ), что указывает на участие в комплексообразовании > катионов Fe(III). При рН > 7.5 наклон экспериментальных кривых повышается и становится равным $ + {v}$ (58 мВ), что связано с формированием комплексов Fe(II) или участием в процессах равновесия обеих форм железа и образованием гетеровалентного комплексного соединения (см. далее). Зависимость ЭДС системы от рН показала, что процесс комплексообразования протекает ступенчато в очень широком интервале рН от 0.5 до 9.8. В рабочих растворах при рН >10.0 начинается гидролиз Fe(III) и выпадает осадок бурого цвета.
Для определения точного количества атомов окисленной и восстановленной форм металла в составе формирующихся комплексных соединений получены экспериментальные зависимости ЭДС системы Е от pC0 (рис. 2) и Е от pCr (рис. 3).
Рис. 2.
Зависимости ЭДС системы Fe(II)–Fe(III)–CH3COOH–H2O от рС0 при температуре 298.15 К, ионной силе раствора 0.1 и различных значениях рН: 1 – 1.65, 2–3.00, 3 – 4.50, 4 – 7.00, 5 – 8.30; СFe(II) = = CFe(III) = 1 × 10–4, CHL = 1 × 10–3 моль/л.
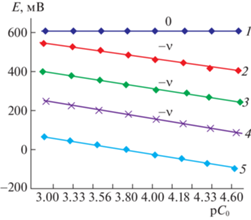
Рис. 3.
Зависимости ЭДС системы Fe(II)–Fe(III)–CH3COOH–H2O от рСr при температуре 298.15 К, ионной силе раствора 0.1 и различных значениях рН: 1 – 4.50, 2 – 5.25, 3 – 6.80, 4 – 8.20, 5 – 9.00; СFe(II) = = CFe(III) = 1 × 10–4; CHL = 1 × 10–3 моль/л.

Первая кривая рис. 2 относится к рН 1.65, наклон ее равен нулю. Согласно методу, это свидетельствует об отсутствии при указанном значении рН процесса комплексообразования, железо не формирует координационных соединений. При других значениях рН (3.00, 4.50, 7.00, 8.30) получены одинаковые наклоны, равные $ - {v}$ (‒58 мВ). Следовательно, в процессах комплексообразования участвует только один атом трехвалентного железа, т.е. образуются моноядерные комплексы.
Частное производное общего уравнения ЭДС (Е) системы от показателя концентрации окисленной формы металла имеет следующий вид:
(2)
${{\left( {\frac{{\partial E}}{{\partial p{{C}_{{{\text{ox}}}}}}}} \right)}_{{{\text{p}}{{C}_{{{\text{red}},}}}{\text{,pH}},{\text{p}}{{C}_{{\text{L}}}}}}} = - \frac{\vartheta }{{nq}}~.~$(3)
${{\left( {\frac{{\partial E}}{{\partial p{{C}_{{{\text{ox}}}}}}}} \right)}_{{{\text{p}}{{C}_{{{\text{red}}}}},{\text{pH}},{\text{p}}{{C}_{{\text{L}}}}}}} = - \frac{\vartheta }{{1 \times 1}} = - \vartheta ,~$Подобные эксперименты проведены при изменении концентрации двухвалентного железа, но при постоянных значениях всех остальных параметров (рис. 3). Известно, что двухвалентное железо образует координационные соединения при значениях рН > 4. Поэтому зависимости ЭДС от рСr получены при рН 4.5 и выше.
При рН 4.50 и 5.25 получены горизонтальные зависимости, так как при этих значениях рН Fe(II) не образует координационных соединений. Дальнейшее повышение рН приводит к изменению наклона экспериментальных кривых на ${v}$ (58 мВ), что, согласно методу, связано с образованием моноядерных комплексов Fe(II). Частное производное общего уравнения ЭДС (Е) системы от показателя концентрации восстановленной формы железа имеет вид:
(4)
$~{{\left( {\frac{{\partial E}}{{\partial p{{C}_{{{\text{red}}}}}}}} \right)}_{{{\text{p}}{{C}_{{{\text{ox}}}}},{\text{pH}},{\text{p}}{{C}_{{\text{L}}}}}}} = \frac{\vartheta }{{np}},$Далее получены экспериментальные зависимости ЭДС системы от показателя концентрации уксусной кислоты (рСL) (рис. 4).
Рис. 4.
Зависимости ЭДС системы Fe(II)–Fe(III)–CH3COOH–H2O от рСL при температуре 298.15 К, ионной силе раствора 0.1 и различных значениях рН: 1 – 1.5, 2 – 3.5, 3 – 5.5, 4 – 7.0, 5 – 8.0, 6 – 9.0; СFe(II) = = CFe(III) = 1 × 10-4; CHL = 1 × 10–3моль/л.

При рН 1.5 лиганд не координирует с центральным атомом-комплексообразователем, поэтому наклон экспериментальной кривой в указанных условиях равен нулю. При увеличении рН до 3.5 наклон становится равным ${v}$ (58 мВ), так как к атому-комплексообразователю присоединяется один лиганд. Далее с увеличением рН до 5.5 к металлу присоединяется второй лиганд, поэтому наклон кривых становится равным 2${v}$. Такой наклон кривых сохраняется вплоть до рН 8.0. С дальнейшим увеличением рН до 9.0–9.5 наклон уменьшается до ${v}$. Количество лигандов во внутренней координационной сфере снова становится равным 1.
Число ацетат-ионов, входящих во внутреннюю координационную сферу, устанавливалось на основании совместного рассмотрения экспериментальных зависимостей Е от рСL (рис. 4) и частной производной общего уравнения ЭДС системы от показателя концентрации лиганда:
(5)
${{\left( {\frac{{\partial E}}{{\partial p{{C}_{{\text{L}}}}}}} \right)}_{{{\text{pH}},~{\text{p}}{{C}_{{{\text{ox,}}}}},{\text{p}}{{C}_{{{\text{red}}}}}}}} = - \frac{\nu }{n}\left( {\frac{u}{p} - \frac{x}{q}} \right),$(6)
$\begin{gathered} x = 0,\quad u = 0,\quad {{\left( {\frac{{\partial E}}{{\partial p{{C}_{{\text{L}}}}}}} \right)}_{{{\text{pH}},~{\text{p}}{{C}_{{{\text{ox,}}}}},{\text{p}}{{C}_{{{\text{red}}}}}}}} = \\ = - \nu \left( {\frac{0}{0} - \frac{0}{1}} \right) = 0, \\ \end{gathered} $(7)
$\begin{gathered} x = 1,\quad u = 0,\quad {{\left( {\frac{{\partial E}}{{\partial p{{C}_{{\text{L}}}}}}} \right)}_{{{\text{pH}},~{\text{p}}{{C}_{{{\text{ox,}}}}},{\text{p}}{{C}_{{{\text{red}}}}}}}} = \\ = - \nu \left( {\frac{0}{1} - \frac{1}{1}} \right) = \nu , \\ \end{gathered} $(8)
$\begin{gathered} x = 2,\quad u = 0,\quad {{\left( {\frac{{\partial E}}{{\partial p{{C}_{{\text{L}}}}}}} \right)}_{{{\text{pH}},~{\text{p}}{{C}_{{{\text{ox,}}}}},{\text{p}}{{C}_{{{\text{red}}}}}}}} = \\ = - \nu \left( {\frac{0}{1} - \frac{2}{1}} \right) = 2\nu , \\ \end{gathered} $(9)
$\begin{gathered} x = 2,\quad u = 1,\quad {{\left( {\frac{{\partial E}}{{\partial p{{C}_{{\text{L}}}}}}} \right)}_{{{\text{pH}},~{\text{p}}{{C}_{{{\text{ox,}}}}},{\text{p}}{{C}_{{{\text{red}}}}}}}} = \\ = - \nu \left( {\frac{1}{1} - \frac{2}{1}} \right) = \nu . \\ \end{gathered} $Теперь, когда известны численные значения переменных общего уравнения (1), можно проверить наклоны зависимости Е от рН. Частная производная общего уравнения от рН при постоянстве всех остальных переменных имеет следующий вид:
(10)
${{\left( {\frac{{\partial E}}{{\partial {\text{pH}}}}} \right)}_{{{\text{p}}{{C}_{{{\text{ox}}}}},{\text{p}}{{C}_{{{\text{L,}}}}},{\text{p}}{{C}_{{{\text{red}}}}}}}} = \left( {\frac{{(u + \vartheta )}}{p} - \frac{{(x + u)}}{q}} \right),$(11)
$~{{\left( {\frac{{\partial E}}{{\partial {\text{pH}}}}} \right)}_{{{\text{p}}{{C}_{{{\text{ox}}}}},{\text{p}}{{C}_{{{\text{L,}}}}},{\text{p}}{{C}_{{{\text{red}}}}}}}} = \frac{\nu }{1}\left( {\frac{{(0 + 0)}}{1} - \frac{{(1 + 0)}}{1}} \right) = - \nu ,$(12)
${{\left( {\frac{{\partial E}}{{\partial {\text{pH}}}}} \right)}_{{{\text{p}}{{C}_{{{\text{ox}}}}},{\text{p}}{{C}_{{{\text{L,}}}}},{\text{p}}{{C}_{{{\text{red}}}}}}}} = \frac{\nu }{1}\left( {\frac{{(0 + 0)}}{1} - \frac{{(2 + 0)}}{1}} \right) = - 2\nu ,$Численные значения тангенсов угла наклона экспериментальных зависимостей ЭДС системы от концентрационных параметров составили основу стехиометрической матрицы (математической модели) имеющихся в растворе равновесий (табл. 1).
Таблица 1.
Стехиометрическая матрица равновесий системы Fe(II)–Fe(III)–CH3COOH–H2O при температуре 298.15 К и ионной силе раствора 0.1, СFe(II) = = CFe(III) = 1 × 10–4, CHL = 1 × 10–3 моль/л
| № п/п | Наклоны зависи-мостей ЭДС от | Состав комплексов | |||
|---|---|---|---|---|---|
| рН | рС0 | рСr | рСL | ||
| 1 | $ - {v}$ | $ - {v}$ | 0 | ${v}$ | [FeL(H2O)5]2+ |
| 2 | $ - 2{v}$ | $ - {v}$ | 0 | $2{v}$ | [Fe(L)2(H2O)4]+ |
| 3 | $ - {v}$ | $ - {v}$ | 0 | ${v}$ | [FeLOH(H2O)4]+ |
| 4 | $ - 2{v}$ | $ - {v}$ | ${v}$ | $2{v}$ | [FeIIIFeII(L)2(OH)2(H2O)8]+ |
| 5 | $ - {v}$ | 0 | ${v}$ | ${v}$ | [FeL(H2O)5]+ |
| 6 | $ - 2{v}$ | 0 | ${v}$ | $2{v}$ | [Fe(L)2(H2O)4]0 |
| 7 | $ - {v}$ | 0 | ${v}$ | ${v}$ | [FeLOH(H2O)4]0 |
| 8 | $ - 2{v}$ | $ - {v}$ | ${v}$ | $2{v}$ | [FeIIFeIII(L)2(OH)2(H2O)8]+ |
Полный анализ данных стехиометрической матрицы и установленных составов соединений показал формирование в изученной системе 3 моноядерных координационных соединений комплексов Fe(III) и такого же количества Fe(II). Кроме того, образуется гетеровалентный комплекс состава [FeIIFeIII(L)2(OH)2(H2O)8]+ или [FeIIIFeII(L)2(OH)2(H2O)8]+. Комплексы формируются в растворе ступенчато в широком интервале рН от 0.6 до 9.8. В кислой области рН образуются комплексные частицы Fe(III), присоединяется вначале один лиганд, затем – второй. С повышением рН гидроксочастицы конкурируют с ацетат-ионами, в результате образуются комплексы состава [FeLOH(H2O)4]+, а после рН 5.0 – гетеровалентный комплекс.
На основе данных стехиометрической матрицы составлена химическая модель реакций образования комплексных соединений (табл. 2).
Таблица 2.
Химическая модель реакций образования координационных соединений в системе Fe(II)–Fe(III)–CH3COOH–H2O при температуре 298.15 К и ионной силе раствора 0.1, СFe(II) = CFe(III) = 1 × 10–4, CHL = 1 × 10–3моль/л
| № п/п | Модельные параметры | Состав комплексов | |||
|---|---|---|---|---|---|
| g | p | l | k | ||
| Fe(III) | Fe(II) | L | OH | ||
| 1 | 1 | 0 | 1 | 0 | [FeL(H2O)5]2+ |
| 2 | 1 | 0 | 2 | 0 | [Fe(L)2(H2O)4]+ |
| 3 | 1 | 0 | 1 | 1 | [FeLOH(H2O)4]+ |
| 4 | 1 | 1 | 2 | 2 | [FeIIIFeII (L)2(OH)2(H2O)8]+ |
| 5 | 0 | 1 | 1 | 0 | [FeL(H2O)5]+ |
| 6 | 0 | 1 | 2 | 0 | [Fe(L)2(H2O)4]0 |
| 7 | 0 | 1 | 1 | 1 | [FeLOH(H2O)4]0 |
| 8 | 1 | 1 | 2 | 2 | [FeIIFeIII(L)2(OH)2(H2O)8]+ |
Химические модели могут быть использованы для составления компьютерных программ и расчета ионных равновесий. Возможные варианты реакций образования координационных соединений в изученной системе представлены в табл. 3.
Таблица 3.
Уравнения реакций образования координационных соединений в системе Fe(II)–Fe(III)–CH3COOH–H2O при температуре 298.15 К и ионной силе раствора 0.1, СFe(II) = CFe(III) = 1 × 10–4, CHL = 1 × × 10–3 моль/л
| № п/п | Уравнения реакций образования комплексов |
|---|---|
| 1 | [Fe(H2O)6]3+ + L– ↔ [FeL(H2O)5]2+ + H2O |
| 2 | [FeL(H2O)5]2+ + L– ↔ [Fe(L)2(H2O)4]+ + H2O или [Fe(H2O)6]3+ + 2L– ↔ [Fe(L)2(H2O)4]+ + 2H2O |
| 3 | [FeL(H2O)5]2+ + H2O ↔ [FeLОН(Н2О)4]+ + H3O+ |
| 4 | [Fe(H2O)6]3+ + [Fe(H2O)6]2+ + 2L– ↔ ↔ [FeIIIFeII(L)2(OH)2(H2O)8]+ + 2H3O+ или [FeIIIL(OH)2(H2O)3]0 + [FeIIL(H2O)5]2+ ↔ ↔ [FeIIIFeIIL)2(OH)2(H2O)8]+ |
| 5 | [Fe(H2O)6]2+ + L– ↔ [FeL(H2O)5]+ + H2O |
| 6 | [FeL(H2O)5]+ + L– ↔ [Fe(L)2(H2O)4]0 + H2O или [Fe(H2O)6]3+ + 2L– ↔ [Fe(L)2(H2O)4]0 + 2H2O |
| 7 | [FeL(H2O)5]+ + H2O ↔ [FeLОН(Н2О)4]0 + H3O+ |
| 8 | [Fe(H2O)6]2+ + [Fe(H2O)6]3+ + 2L– ↔ ↔ [FeIIFeIII(L)2 (OH)2(H2O)8]+ + 2H3O+ или [FeIIL(H2O)5]2+ + [FeIIIL(OH)2(H2O)3]0 ↔ ↔ [FeIIFeIII(L)2(OH)2(H2O)8]+ |
Сравнение ранее полученных [10] и данных настоящей работы показывает, что при ионной силе раствора 0.1 и 1.0 моль/л образуются четыре комплекса одинакового состава. При ионной силе 1 моль/л превалируют сольватационные взаимодействия и гидролизные процессы, поэтому кроме четырех комплексов еще образуются гидроксо- ([Fe(OH)2(H2O)5]2+) и трехъядерный ([Fe3А6(OH)2(H2O)10]+) комплексы. При рН 4.5 комплексообразование заканчивается и начинается гидролиз Fe(III).
При ионной силе раствора 0.1 моль/л после рН 4.5 начинается область комплексообразования Fe(II), образуются комплексы [FeL(H2O)5]+, [Fe(L)2(H2O)4]0, [FeLOH(H2O)4]0 и гетеровалентный [FeIIFeIII(L)2(OH)2(H2O)8]+, поэтому комплексообразование протекает до рН 9.8. При низких значениях ионной силы гидролиз в данной системе прекращается.
Таким образом, методом окислительного потенциала Кларка–Никольского изучены процессы образования координационных соединений Fe(II) и Fe(III) в системе Fe(II)–Fe(III)–CH3COOH–H2O при температуре 298.15 К и ионной силе раствора (Na(H)CIO4) 0.1 моль/л.
Показано, что процесс образования комплексных соединений происходит ступенчато в широком интервале рН от 0.6 до 9.8; в системе образуются комплексы состава: [FeL(H2O)5]2+; [Fe(L)2 (H2O)4]+; [FeLOH(H2O)4]+; [FeL(H2O)5]+; [Fe(L)2 (H2O)4]0; [FeLOH(H2O)4]0; а также гетеровалентного комплекса [FeIIFeIII(L)2(OH)2(H2O)8]+. Предложены модели ионных равновесий изученной системы и возможные уравнения реакций образования указанных комплексных соединений.
Список литературы
Ноздрюхина Л.Р. Биологическая роль микроэлементов в организме животных и человека. М.: Наука, 1977. 184 с.
Литвинова Т.Н. Биогенные элементы. Комплексные соединения: учеб.-метод. пособ. / Под ред. проф. Т.Н. Литвиновой. Ростов н/Д.: Феникс, 2009. 283 с.
Киселев Ю.М., Добрынина Н.А. Химия координационных соединений. М.: Академия, 2007. 352 с.
Скорик Н.А., Филиппова М.М., Бухольцева Е.И. и др. // Журн. неорган. химии. 2015. Т. 60. № 6. С. 729.
Машковский М.Д. Лекарства ХХ века. М.: Новая волна, 1998. 108 с.
Каравайко Г.И. Биотехнология металлов. М.: Центр международных проектов ГКНТ, 1989. 375 с.
Clark W.M. Oxidation–Reduktion Potentials of Organic Systems. Baltimore: The Williams and Wilkins Company, 1960. 584 p.
Никольский Б.П. Оксредметрия. Л.: Химия, 1975. 304 с.
3ахарьевский М.С. Оксредметрия. Л.: Химия, 1968. 118 с.
Рахимова М. // Журн. неорган. химии. 2013. Т. 58. № 6. С. 1.
Рахимова М. Комплексообразование ионов Fe, Co, Mn и Сu c одно- и многоосновными органическими кислотами, нейтральными лигандами в водных растворах: Автореф… докт. наук. Душанбе: Эр-граф, 2013. 34 с.
Davlatshoeva J.A., Eshova G.B., Rahimova M. et al. // J. Amer. Chem. Soc. 2017. V. 7 (2). P. 58.
Эшова Г.Б., Давлатшоева Дж.А., Рахимова М. и др. // Журн. неорган. химии. 2018. Т. 63. № 4. С. 525.
Эшова Г.Б., Давлатшоева Дж.А., Рахимова М. и др. // Там же. 2018. Т. 63. № 6. С. 736.
Рахимова М., Эшова Г.Б., Давлатшоева Дж.А. и др. // Журн. физ. химии. 2020. Т. 94. № 8. С. 1179.
Шумахер И. Перхлораты: свойства, производство и применение. М.: ГНТИХЛ, 1963. 276 с.
Пршибил Р. Комплексоны в химическом анализе / Пер. с чешского под ред. Ю.Ю. Лурье. М.: Изд-во иностр. лит., 1960. С. 383–386.
Заворотный В.Л., Калачева Н.А. Методическое руководство к лабораторным работам по аналитичекой химии. Титриметрический анализ. М.: РГУ нефти и газа им. И.М. Губкина, 2007. 44 с.
Сусленникова В.М., Киселева Е.К. Руководство по приготовлению титрованных растворов. Л.: Химия, 1968. С. 45–71.
Бейтис Р. Определение рН. Теория и практика. М.: Химия, 1972. 397 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


