Журнал физической химии, 2022, T. 96, № 4, стр. 575-581
Влияние структуры алкилимидазолиевых протонных ионных жидкостей на их физико-химические свойства
И. В. Федорова a, *, Л. Э. Шмуклер a, Ю. А. Фадеева a, М. А. Крестьянинов a, Л. П. Сафонова a
a Институт химии растворов им. Г.А. Крестова РАН
Иваново, Россия
* E-mail: fiv@isc-ras.ru
Поступила в редакцию 13.10.2021
После доработки 13.10.2021
Принята к публикации 14.10.2021
- EDN: SYGHLT
- DOI: 10.31857/S0044453722040070
Аннотация
Обсуждено влияние длины углеводородного радикала в катионе RIm (R = H, Me, Et, Pr, Bu) и природы аниона (СF3SO3, HSO4, СH3SO3) на структурные и физико-химические характеристики имидазольных и алкилимидазольных протонных ионных жидкостей. Особое внимание уделено ион-ионным взаимодействиям и водородной связи в ионных парах, представляющих собой структурные единицы изучаемых солей. На основании результатов компьютерных и экспериментальных исследований проведен анализ связи между структурой и свойствами изучаемых соединений.
Протонные ионные жидкости (ПИЖ) представляют собой соли, содержащие большой органический катион и органический или неорганический анион. Интерес к ним как к подклассу ионных жидкостей, наблюдаемый в последнее время, обусловлен тем, что они имеют в своем составе “активный” (подвижный) протон на катионе, позволяющий образовывать водородные связи с анионом. Сочетание таких свойств как низкое давление паров, высокая термическая стабильность, высокая ионная проводимость, большое электрохимическое окно определяет перспективу применения ионных жидкостей в электрохимии. Поскольку ПИЖ состоят практически из свободных носителей заряда, особенно интересно использование их в качестве электролитов для топливных элементов [1–3].
Несмотря на наличие в мировой научной литературе материала по синтезу и свойствам различных классов ионных жидкостей, в том числе протонных, дизайн новых ионных жидкостей “целевого назначения” и модификация свойств уже известных материалов с целью улучшения их физико-химических и транспортных характеристик продолжает оставаться актуальной задачей. В направленном дизайне новых солей с заранее заданными свойствами в последнее время активно используются квантово-химические расчеты [4, 5]. Они вносят ясность в понимание структуры и характера взаимодействия между катионом и анионом в ионной жидкости и позволяют находить определенные корреляции между структурой жидкости и ее физико-химическими свойствами. Наибольшей популярностью пользуются методы теории функционала плотности (density functional theory, DFT [6]) с функционалами B3LYP-GD3, M06, M06-2X и другими, учитывающими дисперсионные взаимодействия [7–10].
Проведенный анализ литературы показывает, что структурные характеристики и взаимодействие между ионами лучше всего изучены в этиламмониевых протонных ионных жидкостях с нитрат-анионом [11–14]. Способность катиона этиламмония и аниона кислоты быть донорами и акцепторами водородных связей приводит к образованию сетки межионных водородных связей, которые напоминают сетку воды. Характеристика водородных связей в протонных ионных жидкостях – совсем непростая задача. В отличие от классических водородных связей, водородные связи в ИЖ имеют свои особенности, связанные, главным образом, с зарядом на ионах, а критерии, разработанные и рекомендованные ИЮПАК [15], в большей степени подходят для описания водородных связей в молекулярной структуре жидкости. Имеются работы по квантово-химическим расчетам различного уровня ионных пар алкиламмониевых [16–19] и алкилимидазолиевых ПИЖ [19–22] с анионами различных протонных кислот и последующим топологическим анализом распределения электронной плотности в рамках квантовой теории атомов в молекулах (анализ QTAIM [23–25]), предназначенным для характеристики межатомных взаимодействий. В работах [19, 26] отмечено, что при изучении структуры ионных жидкостей квантово-химическими методами важно учитывать эффекты неспецифической сольватации, так как ошибки, связанные с их недоучетом, могут приводить к некорректным выводам о строении изучаемых соединений.
К настоящему времени нами квантово-химическими методами изучены структуры алкиламмониевых протонных ионных жидкостей общей формулой ${{{\text{R}}}_{n}}{{{\text{H}}}_{{4--n}}}$N/А (n = 1–3, R = метил (Me), этил (Et), пропил (Pr), бутил (Bu), А = анион кислоты) [27–30]. Проведен анализ влияния длины и степени разветвления алкильного радикала в катионе и природы аниона на структурные и физико-химические свойства ПИЖ. Выявлены некоторые корреляции между расчетными характеристиками и термическими свойствами, вязкостью и электропроводностью ионных жидкостей. В этой работе наш интерес будет сосредоточен на протонных ионных жидкостях с катионом имидазолия и алкилимидазолия общей формулой RIm (R = Н, Me, Et, Pr, Bu) и анионами серной (H2SO4), метансульфоновой (СH3HSO3) и трифторметансульфоновой (СF3HSO3) кислот.
МЕТОДИКА РАСЧЕТОВ
Оптимизированные геометрии ионных пар, представляющих собой структурные единицы изучаемых имидазольных и алкилимидазольных протонных ионных жидкостей, получены на основе метода DFT c применением гибридного обменно-корреляционного функционала B3LYP [31, 32] с учетом дисперсионной поправки GD3 [33] и базисным набором 6-31++G(d,p) [34], реализованным в пакете квантово-химических программ Gaussian 09 [35]. Все расчеты проведены с учетом неспецифической сольватации в рамках модели C-PCM [36, 37] в среде этанола (диэлектрическая проницаемость среды ε = 24.85 [35]). Выбор растворителя обусловлен в первую очередь тем, что величина ε для протонных ионных жидкостей обычно лежит в пределах 10–30 [19, 38]. Для всех оптимизированных структур проведен расчет частот нормальных колебаний. Отсутствие отрицательных значений указывает на достижение минимума энергии. Визуализация исследуемых структур выполнена в программном обеспечении GaussView 6.0 [39].
Протонное сродство (РА) алкилимидазола и аниона кислоты рассчитывалось как разность между значениями энтальпии образования катиона и соответствующего нейтрального амина, и молекулы кислоты и соответствующего аниона.
Энергия взаимодействия при образовании ионной пары рассчитывалась как разность ΔE = = ЕRIm/A – [ЕRIm + ЕA], где ЕRIm/A – полная энергия ионной пары, [ЕRIm + ЕA] – сумма энергий составляющих ее ионов.
Оценка энергии водородных связей проводилась с использованием корреляции Лекомта–Эспинозы [40] по формуле ЕBC = (1/2)V(r), где V(r) – плотность потенциальной энергии в критической точке водородно-связанных атомов, полученная на основе топологического анализа функции распределения электронной плотности с использованием программного пакета AIMAll (Version 10.05.04) [41].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты квантово-химического расчета исследованных в данной работе ионных пар RIm/СF3SO3 (R = H, Me, Et, Pr, Bu) и BuIm/HSO4 (СH3SO3) представлены на рис. 1 и в табл. 1. В табл. 1 приведены также данные по основным термическим (температуры плавления Tm, декомпозиции Tdec, стеклования Tg) и физико-химическим (удельная электропроводность κ, динамическая вязкость η) характеристикам солей, полученным нами ранее и найденным в литературных источниках. Следует отметить, что свойства ионных жидкостей очень чувствительны к наличию воды в образцах, поэтому для обсуждения выбирались данные, полученные при наименьшем содержании воды.
Рис. 1.
Оптимизированные методом B3LYP-GD3(CPCM)/6-31++G(d,p) структуры ионных пар с катионом имидазолия и алкилимидазолия и трифлат-анионом RIm/CF3SO3 (R = H, Me, Et, Pr, Bu) и ионных пар с катионом бутилимидазолия и гидросульфат-анионом BuIm/HSO4 и мезилат-анионом BuIm/CH3SO3.

Таблица 1.
Энергии водородных связей (ЕВС, кДж/моль) и ион-ионного взаимодействия (ΔЕ, кДж/моль) в ионных парах имидазолиевых и алкилимидазолиевых ПИЖ, их термические (Tm, Tdec, Tg) и физико-химические свойства (электропроводность κ и вязкость η), величины ∆pKa (разность значений pKa основания и кислоты в воде) и ∆PA (разность значений протонного сродства аниона кислоты и алкилимидазола, кДж/моль)
| ПИЖ | –ЕВС NH…O | –ЕВС C(2)H…O |
–ΔЕ | Tm,°С | Tdec,°С | Tg, °С | κ, мСм cм–1 (25°C) |
η, сПз (25°C) |
ΔpKa | ΔPA |
|---|---|---|---|---|---|---|---|---|---|---|
| HIm/CF3SO3 | 39.71 | 10.56 | 59.72 | 122.9 [42] | 375 [44] | nd [44] | 50 (190°C) [45] | – | 18.95 | 304.4 |
| MeIm/CF3SO3 | 38.65 | 10.66 | 58.42 | 104 [2] | 391.5 [46] | 45.8 [42] | 22.9 (100°C) [47] | – | 19.21 | 283.87 |
| EtIm/CF3SO3 | 38.32 | 10.68 | 58.39 | 18 [43] | 377 [44] | nd [44] | 4.56 [43] | 63.8 [43] | 19.26 | 276.99 |
| PrIm/CF3SO3 | 38.24 | 10.72 | 58.37 | 28.5 [44] | 411 [44] | nd [44] | 2.37 [44] | 72.4 (35°C) [44] | 19.22 | 273.84 |
| BuIm/CF3SO3 | 37.98 | 10.78 | 58.36 | 23 [47] | 359** [47] | – | 1.54 [43] | 134.8 [43] | 19.21 | 272.07 |
| BuIm/HSO4 | 41.94 | 10.98 | 62.37 | – | 365 [48] | –55 [49] | – | 2657.91 (20°C) [48] | 10.21 | 314.47 |
| BuIm/CH3SO3 | 52.37 | 11.75 | 72.35 | 67 [47] | 243* [43] | –54.1 [47] | 0.06 [43] | 567.6 [43] | 9.13 | 354.77 |
Влияние длины углеводородного радикала в катионе RIm (R = H, Me, Et, Pr, Bu) на структурные и физико-химические свойства солей с трифлат-анионом. Как видно из рис. 1, все ионные пары RIm/CF3SO3 имеют во многом аналогичные структуры; катион связывается с анионом посредством водородной связи NH…О. Межатомное расстояние H…О лежит в пределах 1.733–1.751 Å в зависимости от катиона, и оно значительно меньше суммы ван-дер-ваальсовых радиусов связывающих атомов (ΣvdW(Н–О) = 2.72 Å [50]. Угол N–Н…О варьируется от 170.6 до 171.3°, что свидетельствует о линейности водородно-связанного фрагмента и является типичным для классических водородных связей в молекулярных жидкостях [15].
При образовании ионных пар ковалентная связь N–H в катионе удлиняется на 0.025–0.023 Å. Наибольшее растяжение связи N–H в катионе и наиболее короткое расстояние Н…О наблюдается в ионной паре HIm/CF3SO3. По мере удлинения алкильного радикала в ряду катионов MeIm < < EtIm < PrIm < BuIm с трифлат-анионом длина водородной связи NН…О в ионных парах увеличивается. Данная последовательность аналогична изменениям энергии водородной связи EВС, величины которой приведены в табл. 1. Как общую закономерность следует отметить, что чем длиннее водородная связь NН…О, тем она слабее.
Кроме того, в рассматриваемых ионных парах возможно образование также водородной связи C(2)H…O. Однако расстояния Н...О в водородно-связанном фрагменте много больше, чем в фрагменте N–H…O и лежат в пределах 2.371–2.363 Å в зависимости от катиона, а углы С(2)–Н...О сильно искажены от линейной геометрии и находятся в интервале значений 124.3–124.8°. При образовании ионных пар ковалентная связь С(2)–H в катионе во всех случаях удлиняется не более, чем на 0.001 Å. Значения энергии водородной связи C(2)H…O во всех случаях гораздо меньше, чем для связи NН...O. Выводы о неравноценности связей NH...O и С(2)H...O были также сделаны авторами в работах [18, 20, 22] при изучении структур ионных пар протонных имидазольных и алкилимидазольных ПИЖ с анионами других кислот.
Как видно из табл. 1, изменение величин энергии ион-ионного взаимодействия ΔЕ в ионной паре RIm/CF3SO3 коррелирует с изменением силы водородной связи и уменьшается с удлинением углеводородного радикала в катионе в ряду HIm > MeIm > EtIm > PrIm > BuIm. Сопоставление полученных результатов с данными по термическим свойствам изучаемых солей (табл. 1) показало, что для них наблюдается тенденция к снижению температуры плавления с ослаблением взаимодействия ионов в ионной паре. Уменьшение температуры плавления с удлинением алкильного радикала в диапазоне С1–С3 также наблюдалось при изучении протонных алкиламмониевых ПИЖ с нитрат- и формиат-анионами [51]. Температуры плавления ПИЖ с катионом алкилимидазилия и трифлат-анионом ниже температуры плавления протонных ионных жидкостей на основе катиона алкиламмония общей формулой ${{{\text{R}}}_{n}}{{{\text{H}}}_{{4--n}}}$N (n = 1–3, R = Me, Et, Pr, Bu) и тем же самым анионом [27]. Уменьшение Tm при переходе от алкиламмониевых к алкилимидазольным ПИЖ вызвано, вероятно, ослаблением кулоновского взаимодействия и водородной связи при увеличении размера иона. Однако необходимо отметить, что температура плавления ионной жидкости определяется не только силой взаимодействия между ионами, но и зависит от структурных свойств катиона и аниона (размер, симметрия, конформационная гибкость), а также от плотности упаковки ионов в кристаллической решетке. Авторы различных работ [28, 52–54] показали, что наличие в ионной жидкости многоатомных катионов больших размеров, препятствующих эффективной упаковке ионов в кристаллической решетке за счет увеличения расстояния между ионами и ослабления электростатического взаимодействия, приводит к низким температурам плавления ПИЖ.
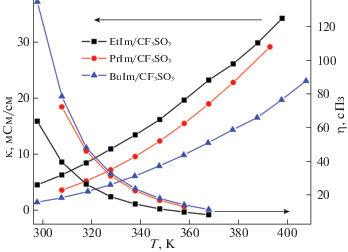
Проведенный анализ имеющихся данных по электропроводности и вязкости изученных солей показал, что удлинение углеводородного радикала в катионе приводит к увеличению вязкости ионной жидкости с трифлат-анионом в ряду катионов EtIm < PrIm < BuIm и сопровождается уменьшением ионной проводимости (табл. 1, рис. 2). Понижение проводимости в данном случае происходит, вероятнее всего, вследствие снижения подвижности большего по размеру катиона, а увеличение вязкости благодаря более высокой степени упорядоченности структуры ионной жидкости и усилению ван-дер-ваальсовых взаимодействий между катионами при удлинении алкильного радикала. Становится очевидным, что последние эффекты не могут быть учтены в квантово-химических расчетах на примере одной ионной пары. Здесь наиболее простым способом улучшения точности расчета и учета влияния ближайшего окружения и многочастичных взаимодействий является использование крупных систем, состоящих из нескольких ионных пар. Однако вопрос о том, насколько большим должен быть размер ионного кластера, чтобы он проявил объемные свойства реальной жидкости, остается пока нерешенным.
Влияние природы аниона (СF3SO3, HSO4, СH3SO3) на структурные и физико-химические свойства солей c катионом бутилимидазолия. Ионные пары BuIm/HSO4 и BuIm/СH3SO3 во многом подобны рассмотренной выше ионной паре BuIm/СF3SO3 (рис. 1) и имеют также две водородные связи, образованные протонами NH и C(2)H и различными атомами кислорода аниона кислоты. Протон NH катиона остается по-прежнему предпочтительным центром образования водородной связи с анионом кислоты, о чем свидетельствует более короткое расстояние H...О, линейность угла N‒H...O и более высокое значение энергии связи ЕВС. Как и в случае BuIm/СF3SO3, в данных структурах ионных пар большее растяжение ковалентной связи протонодонора в катионе наблюдается при образовании водородной связи NH...О (0.039 Å (СН3SO3) и 0.028 Å (HSO4)), чем при образовании связи C(2)H...О (∼0.0002). Сила водородных связей NH...O и C(2)H...O в ионных парах с катионом BuIm увеличивается в ряду анионов СF3SO3 < HSO4 < СH3SO3 (табл. 1). Энергия ион-ионного взаимодействия изменяется аналогично для указанной выше последовательности анионов. Заметим, что величины энергии взаимодействия для ионных пар с одним и тем же катионом, но с разными анионами изменяются в большей степени, чем для ионных пар с одним и тем же анионом, но с разными катионами. Вероятно, это связано с тем, что для рассматриваемых в данной работе солей значения ΔpKa в большей степени зависят от природы кислоты, нежели алкилимидазола. Сопоставление между собой величин ΔРА приводит к аналогичным заключениям.
Мы не смогли найти в литературе данные по температуре плавления и электропроводности ионной жидкости BuIm/HSO4, чтобы провести сравнительный анализ по данным характеристикам в ряду изучаемых анионов. Но все же отдельные выводы сделать можно. Как видно из табл. 1, температуры плавления ионной жидкости с катионом бутилимидазолия и анионом СF3SO3 ниже, чем в жидкости с анионом СH3SO3, что может быть связано с ослаблением ион-ионного взаимодействия из-за увеличения размера аниона (ван-дер-ваальсовый объем анионов, по данным наших расчетов, равен 49.5 и 40.6 см3/моль, соответственно). Вязкость солей с катионом BuIm снижается в ряду HSO4 > СH3SO3 > СF3SO3, что коррелирует с увеличением их проводимости (рис. 3). Самое высокое значение вязкости имеет жидкость с анионом HSO4, что, вероятней всего, связано с наличием анион-анионных ассоциатов, образованных за счет водородных связей. Данное предположение подтверждается результатами исследований авторов [55], показывающих, что анионы с гидроксильными группами способны димеризоваться или даже олигомеризоваться как в растворе, так и в кристаллических фазах, при этом водородные связи по своим характеристикам во многом аналогичны связям, образованным нейтральными молекулами.
ЗАКЛЮЧЕНИЕ
На основе квантово-химического метода расчета B3LYP-GD3/6–31++G(d,p) с учетом неспецифической сольватации в рамках модели С-РСМ определены структурные и энергетические характеристики ионных пар имидазольных и алкилимидазольных протонных ионных жидкостей общей формулой RIm/A (R = H, Me, Et, Pr, Bu, A = СF3SO3, HSO4, СH3SO3). Показано, что все установленные структуры ионных пар имеют две водородные связи, образованные протонами NH и С(2)Н катиона и различными атомами кислорода аниона кислоты. Наиболее сильными водородными связями являются связи NH...O, об этом свидетельствуют короткие расстояния и высокие значения энергий. Удлинение алкильного радикала в структуре катиона в ряду HIm < MeIm < EtIm < PrIm < BuIm приводит к ослаблению взаимодействия ионов в ионной паре. Замена аниона в ионной паре с одним и тем же катионом приводит к увеличению энергии взаимодействия в ряду анионов СF3SO3 < HSO4 < < СН3SO3. Выявлена связь между ионной структурой и физико-химическими свойствами ионной жидкости. Анализ проведенного исследования показывает, что изменение характера ион-ионного взаимодействия в изучаемом ряду ионных жидкостей – один из наиболее важных факторов, влияющих на изменение их температуры плавления. Исходя из этого, можно ожидать, что ионные жидкости, обладающие большей энергией ион-ионного взаимодействия, будут иметь более высокие температуры плавления.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 19-03-00505).
Список литературы
Vázquez-Fernández I., Raghibi M., Bouzina A. et al. // J. Energy Chem. 2021. V. 53. P. 197. https://doi.org/10.1016/j.jechem.2020.04.022
Fernicola A., Panero S., Scrosati B. et al. // ChemPhysChem 2007. V. 8. P. 1103. https://doi.org/10.1002/cphc.200600782
Sun X.-L., Deng W.-H., Chen H. et al. // Chem. Eur. J. 2017. V. 23. P. 1248. https://doi.org/10.1002/chem.201605215
Kirchner B. Ionic Liquids from Theoretical Investigations. In: Kirchner B. (eds) Ionic Liquids. Topic in Current Chemistry. Berlin, Heidelberg: Springer. V. 290. 2008. P. 213–262. https://doi.org/10.1007/128_2008_36
Hunt P.A. // Top. Curr. Chem. (Z) 2017. V. 375. P. 59. https://doi.org/10.1007/s41061-017-0142-7
Jensen F. Introduction to Computational Chemistry. 2nd ed. Chichester. England: John Wiley and Sons. Ltd. 2007, 620 p.
Snook I.K., Per M.C., Seyed-Razavi A., Russo S.P. // Chem. Phys. Lett. 2009. V. 480. P. 327. https://doi.org/10.1016/j.cplett.2009.09.022
Grimme S., Hujo W., Kirchner B. // Phys. Chem. Chem. Phys. 2012. V. 14. P. 4875. https://doi.org/10.1039/C2CP24096C
Izgorodina E.I., Bernard U.L., MacFarlane D.R. // J. Phys. Chem. A. 2009. V. 113. P. 7064. https://doi.org/10.1021/jp8107649
Zahn S., Kirchner B. // J. Phys. Chem. A. 2008. V. 112. P. 8430. https://doi.org/10.1021/jp805306u
Hayes R., Imberti S., Warr G.G., Atkin R. // Angew. Chem. Int. Ed. 2013. V. 52. P. 4623. https://doi.org/10.1002/anie.201209273
Zentel T., Kühn O. // J. Chem. Phys. 2016. V. 145. P. 234504. https://doi.org/10.1063/1.4972006
Huang Y., Zhou G., Li Y. et al. // Chem. Phys. 2016. V. 472. P. 105. https://doi.org/10.1016/j.chemphys.2016.03.020
Perlt E., Ray P., Hansen A. et al. // J. Chem. Phys. 2018. V. 148. P. 193835. https://doi.org/10.1063/1.5013122
Arunan E., Desiraju G.R., Klein R.A. et al. // Pure Appl. Chem. 2011. V. 83. P. 1637. https://doi.org/10.1351/PAC-REC-10-01-02
Han J., Wang L., Zhang H. et al. // J. Phys. Chem. A. 2020. V. 124. P. 10246. https://doi.org/10.1021/acs.jpca.0c07908
Bodo E., Bonomo M., Mariani A. // J. Phys. Chem. B 2021. V. 125. P. 2781. https://doi.org/10.1021/acs.jpca.1c00249
Hunt P.A., Ashworth C.R., Matthews R.P. // Chem. Soc. Rev. 2015. V. 44. P. 1257. https://doi.org/10.1039/C4CS00278D
Low K., Tan S.Y.S., Izgorodina E.I. // Front. Chem. 2019. V. 7. P. 1. https://doi.org/10.3389/fchem.2019.00208
Pant R., Kumar M., Venkatnathan A. // J. Phys. Chem. C 2017. V. 121. P. 7069. https://doi.org/10.1021/acs.jpcc.6b11997
Verma P.L., Gejji Sh.P. // J. Phys. Chem. A. 2018. V. 122. P. 6225. https://doi.org/10.1021/acs.jpca.8b04303
Watanabe H., Doi H., Saito S. et al. // J. Mol. Liq. 2016. V. 217. P. 35. https://doi.org/10.1016/j.molliq.2015.08.005
Bader R.F.W. // Acc. Chem. Res. 1985. V. 18. P. 9. https://doi.org/10.1021/ar00109a003
Bader P.F.W. // Chem. Rev. 1991. V. 91. P. 893. https://doi.org/10.1021/cr00005a013
Bader R.F.W. Atoms in Molecules. A Quantum Theory. Oxford: Oxford University Press, 1990. 458 p.
Fedorova I.V., Krestyaninov M.A., Safonova L.P. // J. Mol. Liq. 2021. V. 328. P. 115449. https://doi.org/10.1016/j.molliq.2021.115449
Shmukler L.E., Fedorova I.V., Fadeeva Yu.A., Safonova L.P. // J. Mol. Liq. 2021. V. 321. P. 114350. https://doi.org/10.1016/j.molliq.2020.114350
Fedorova I.V., Safonova L.P. // J. Phys. Chem. A 2020. V. 124. P. 3170. https://doi.org/10.1021/acs.jpca.0c01282
Fedorova I.V., Safonova L.P. // J. Phys. Chem. A. 2018. V. 122. P. 5878. https://doi.org/10.1021/acs.jpca.8b04003
Shmukler L.E., Fedorova I.V., Gruzdev M.S., Safonova L.P. // J. Phys. Chem. B. 2019. V. 123. P. 10794. https://doi.org/10.1021/acs.jpcb.9b08032
Becke A.D. // J. Chem. Phys. 1993. V. 98. P. 5648. https://doi.org/10.1063/1.464913
Lee C., Yang W., Parr R.G. // Phys. Rev. B. 1988. V. 37. P. 785. https://doi.org/10.1103/PhysRevB.37.785
Grimme S., Antony J., Ehrlich S., Krieg H. // J. Chem. Phys. 2010. V. 132. P. 154104. https://doi.org/10.1063/1.3382344
Ditchfield R., Hehre W.J., Pople J.A. // J. Chem. Phys. 1971. V. 54. P. 724. https://doi.org/10.1063/1.1674902
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Mennucci B., Petersson G.A., Nakatsuji H., Caricato M., Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G., Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Montgomery J.A., Peralta J.E., Jr, Ogliaro F., Bearpark M., Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N., Kobayashi R., Normand J., Raghavachari K., Rendell A., Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Rega N., Millam J.M., Klene M., Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramillo J., Gomperts R., Stratmann R.E., Yazyev O., Austin A.J., Cammi R., Pomelli C., Ochterski J.W., Martin R.L., Morokuma K., Zakrzewski V.G., Voth G.A., Salvador P., Dannenberg J.J., Dapprich S., Daniels A.D., Farkas O., Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J. Gaussian 09, Revision A.01, Gaussian, Inc., Wallingford CT, 2009.
Barone V., Cossi M. // J. Phys. Chem. A 1998. V. 102. P. 1995. https://doi.org/10.1021/jp9716997
Cossi M., Rega N., Scalmani G., Barone V. // J. Comput. Chem. 2003. V. 24. P. 669. https://doi.org/10.1002/jcc.10189
Izgorodina E.I., Forsyth M., MacFarlane D.R. // Phys. Chem. Chem. Phys. 2009. V. 11. P. 2452. https://doi.org/10.1039/B815835E
Dennington R., Keith T.A., Millam J.M. / GaussView, version 6. Semichem Inc., Shawnee Mission, KS, 2016.
Espinosa E., Molins E., Lecomte C. // J. Chem. Phys. Lett. 1998. V. 285. P. 170. https://doi.org/10.1016/S0009-2614(98)00036-0
Keith T.A. AIMAll, version 10.05.04 (aim.tkgristmill.com), 2010.
Belieres J.-P., Angell C.A. // J. Phys. Chem. B 2007. V. 111. P. 4926. https://doi.org/10.1021/jp067589
Lebga-Nebane J.L., Rock S.E., Franclemont J. et al. // Ind. Eng. Chem. Res. 2012. V. 51. P. 14084. https://doi.org/10.1021/ie301687c
Shmukler L.E., Fedorova I.V., Fadeeva Y.A. et al. // ChemPhysChem. 2021. https://doi.org/10.1002/cphc.202100772.
Tricoli V., Orsini G., Anselmi M. // Phys. Chem. Chem. Phys. 2012. V. 14. P. 10979. https://doi.org/10.1039/C2CP41027C
Chen B.-K., Wu T.-Y., Kuo Ch.-W. et al. // Int. J. Hydrogen Energy 2013. V. 38. P. 11321. https://doi.org/10.1016/j.ijhydene.2013.06.053
Fadeeva Yu.A., Gruzdev M.S., Kudryakova N.O. et al. // J. Mol. Liq. 2020. V. 297. P. 111305. https://doi.org/10.1016/j.molliq.2019.111305
Ullah Z., Bustam M.A., Muhammad N. et al. // J. Solution Chem. 2015. V. 44. P. 875. https://doi.org/10.1007/s10953-015-0329-x
Wojnarowska Z., Thoms E., Blanchard B. et al. // Phys. Chem. Chem. Phys. 2017. V. 19. P. 14141. https://doi.org/10.1039/C6CP08592J
Bondi A. // J. Phys. Chem. 1964. V. 68. P. 441. https://doi.org/10.1021/j100785a001
Hayes R., Warr G.G., Atkin R. // Chem. Rev. 2015. V. 115. P. 6357. https://doi.org/10.1021/cr500411q
Krossing I., Slattery J.M., Daguenet C. et al. // J. Am. Chem. Soc. 2006. V. 128. P. 13427. https://doi.org/10.1021/ja0619612
Greaves T.L., Weerawardena A., Fong C. et al. // J. Phys. Chem. B. 2006. V. 110. P. 22479. https://doi.org/10.1021/jp0634048
Turner E.A., Pye C.C., Singer R.D. // J. Phys. Chem. A. 2003. V. 107. P. 2277. https://doi.org/10.1021/jp021694w
Zhao W., Flood A.H., White N.G. // Chem. Soc. Rev. 2020. V. 49. P. 7893. https://doi.org/10.1039/D0CS00486C
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии