Журнал физической химии, 2022, T. 96, № 4, стр. 607-612
Атомистическое моделирование структурных и динамических свойств водных растворов NaCl и Na2SO4 в межслоевом пространстве эттрингита
Е. В. Тарарушкин a, b, *, В. В. Писарев a, c, **, А. Г. Калиничев a, d, ***
a Международная лаборатория суперкомпьютерного атомистического моделирования
и многомасштабного анализа НИУ ВШЭ
Москва, Россия
b Российский университет транспорта
Москва, Россия
c Объединенный институт высоких температур РАН
Москва, Россия
d Laboratoire SUBATECH (UMR 6457 – Institut Mines-Télécom Atlantique,
Université de Nantes, CNRS/IN2P3)
Nantes, France
* E-mail: evgeny.tararushkin@yandex.ru
** E-mail: vpisarev@hse.ru
*** E-mail: kalinich@subatech.in2p3.fr
Поступила в редакцию 14.09.2021
После доработки 16.10.2021
Принята к публикации 18.10.2021
- EDN: GJZSPP
- DOI: 10.31857/S004445372204032X
Аннотация
Применение новой модификации силового поля ClayFF для молекулярно-динамического моделирования кристаллов эттрингита и взаимодействия с их поверхностью водных растворов NaCl и Na2SO4, показывает, что возможность явного учета взаимодействий металл–O–H в системе приводит к формированию более прочных водородных связей в структуре кристалла и на поверхности, большей локализации атомов как кристаллической фазы, так и растворов в приповерхностной зоне. Изменяются также относительные доли внутри- и внешнесферной адсорбции ионов Na+, Cl–, (SO4)2– и подвижности молекул H2O обоих растворов. Рассчитанные параметры кристаллической решетки и плотность эттрингита остались практически неизменными между старой и новой версиями силового поля ClayFF, но точность воспроизведения механических характеристик кристалла заметно увеличилась.
Эттрингит, трехкальциевый гидросульфоалюминат (Ca6Al2(SO4)3(OH)12 ⋅ nH2O, n = 24–27), является одной из важных минеральных фаз, образующихся при гидратации портландцемента, а также встречается и в природе. Изучение его физических и химических свойств имеет важное значение для химии цемента, поскольку эттрингит выступает в качестве источника сульфатной коррозии цементных бетонов. Кристаллы эттрингита имеют тригональную сингонию с симметрией P31c [1] и обладают столбчатой структурой, ориентированной вдоль вектора c. В центре столбика располагаются октаэдры [Al(OH)6]3–, которые соединяются между собой тремя ионами Ca2+. Ионы Ca2+, в свою очередь, координированы четырьмя гидроксильными группами, принадлежащими [Al(OH)6]3– и молекулами воды, расположенными между столбиками [2]. Сцепление столбиков между собой обеспечивается главным образом водородными связями, образованными между гидроксильными группами структуры, тетраэдрами сульфат-анионов, расположенными в каналах эттрингита, и двумя структурными типами молекул H2O, как расположенными в тех же каналах, так и принадлежащими столбикам.
Эттрингит – наиболее важный представитель группы цементных AFt-фаз, который образуется при гидратации портландцемента в результате многостадийной химической реакции алюмината кальция, природного гипса и воды [3]:
Методы атомистического компьютерного моделирования в последнее время все более широко применяются для изучения свойств различных материалов на фундаментальном атомно-молекулярном уровне [4, 5]. В данной работе с помощью этих методов и новой версии силового поля ClayFF [5–7] мы заново исследуем структуру эттрингита. В том числе впервые для этой модели количественно оцениваем свойства и поведение водородных связей, а также взаимодействие водных растворов с поверхностью материала, способствуя, таким образом, более глубокому пониманию и предсказанию свойств этой важной цементной подсистемы.
МОДЕЛИ И МЕТОДЫ ИССЛЕДОВАНИЯ
Для атомистического моделирования глинистых и цементных материалов методом классической молекулярной динамики (МД) в последние 15–20 лет широко используется силовое поле ClayFF [6, 8], которое обладает простотой и гибкостью в применении, но позволяет в то же время моделировать различные свойства материалов в хорошем согласии с имеющимися экспериментальными данными [5]. Новая модификация силового поля ClayFF (ClayFF-MOH) [5, 7] позволяет теперь более точно моделировать наночастицы конечного размера и связанные с ними поверхностные эффекты за счет параметризации в явном виде углов между атомом металла и гидроксилом (M–O–H) в структуре и на поверхности таких частиц. В структуре эттрингита присутствует два типа таких углов: Al–O–H и Ca–O–H.
Моделирование системы эттрингит – водный раствор солей NaCl/Na2SO4 проводилось в два этапа. На первом этапе на основе кристаллографических данных [1] была построена сверхъячейка эттрингита, состоящая из 4 × 4 × 2 элементарных ячеек в направлениях осей a, b и c кристалла соответственно. В итоге размер сверхъячейки составил 44.92 × 44.92 × 42.88 Å3. Для этой модели рассчитывались структура и свойства собственно кристалла эттрингита: механические характеристики, количество и время жизни водородных связей, образованных всеми возможными парами донор-акцептор в кристалле. На втором этапе для моделирования систем эттрингит – водный раствор солей NaCl/Na2SO4 была построена аналогичная сверхъячейка размером 4 × 2 × 2, которую затем расщепили по кристаллографической плоскости (010) между столбиками эттрингита и привели в соприкосновение с отдельно приготовленным и уравновешенным слоем соответствующего водного раствора. Толщину этого слоя выбрали размером 30 Å, что позволило напрямую сравнивать полученные новые результаты с более ранними расчетами [8]. Таким образом, размеры симуляционных ячеек составляли 42.6 × 43.8 × × 55.6 Å3 для модели с водным раствором NaCl и 42.6 × 43.8 × 55.4 Å3 для модели с водным раствором Na2SO4. В первом случае в растворе содержалось 16 ионов Na+ и 16 ионов Cl–, во втором – 16 ионов Na+ и восемь ионов ${\text{SO}}_{4}^{{2 - }}$. Количество молекул H2O в заданном объеме раствора выбиралось исходя из плотности воды при нормальных условиях ~1 г/см3. В итоге моляльность водного растворов NaCl составила ~0.5 M, а водного раствора Na2SO4 – ~0.4 M. Такие концентрации примерно соответствуют экспериментально измеренным составам растворов в порах цементных бетонов [3, 8].
Все расчеты методом МД проводились с помощью пакета LAMMPS [9] с применением периодических граничных условий, а для описания всех межатомных взаимодействий в системах принимались параметры силового поля ClayFF согласно работам [5, 8]. Классические уравнения движения численно интегрировались по алгоритму Верле [10] с временным шагом 1 фс. Радиус обрезания короткодействующих взаимодействий составлял 12.5 Å, а для учета дальнодействующих электростатических взаимодействий применялся метод Эвальда [10]. Все построенные модели сначала приводились к термодинамическому равновесию при нормальных условиях (T = 298 K, P = = 1 бар) с применением термобаростата Нозе–Гувера для статистического NPT-ансамбля [10], затем равновесные расчеты проводились в NVT-ансамбле. Длина МД-траекторий составляла 500 пс для каждого типа ансамблей при моделировании свойств кристаллов эттрингита и 1 нс при моделировании поверхностей раздела с растворами солей. Выбор всех указанных параметров расчетов является вполне стандартным при моделировании такого рода систем [5, 10] и давно доказал свою надежность и эффективность.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ результатов вычисленных МД-параметров элементарной ячейки и плотности эттрингита с 26 молекулами H2O показал хорошее согласие как с экспериментальными данными, так и с более ранними расчетами. Так, экспериментальное значение плотности эттрингита находится в диапазоне от 1.77 до 1.78 г/см3 [11], а расчет методом теории функционала электронной плотности (DFT) показал значение плотности 1.747 г/см3 [11]. Плотность эттрингита в настоящей работе получилась равной 1.811 г/см3 и 1.814 г/см3 для оригинальной и модифицированной версий силового поля ClayFF соответственно. Величины векторов a и c в экспериментах составили значения от 11.229 до 11.240 Å для вектора a и от 21.468 до 21.478 Å для вектора c [11]. Расчетные значения (методом DFT) векторов a и c составили 11.289 и 21.617 Å [11] соответственно. Вычисленные в настоящей работе значения вектора a составили 11.163 и 11.144 Å для оригинальной и модифицированной версий силового поля ClayFF соответственно. Значения вектора c составили 21.623 и 21.673 Å для оригинальной и модифицированной версий ClayFF соответственно. Следует отметить, что результаты расчетов с обеими версиями силового поля ClayFF практически схожи, что указывает на отсутствие больших изменений в равновесной структуре эттрингита при явном учете углов Al–O–H и Ca–O–H модифицированной версией ClayFF.
Результаты вычисленных механических характеристик эттрингита (объемный модуль, K, модуль сдвига, G, модуль Юнга, E, и коэффициент Пуассона, ν) и их сравнение с экспериментальными данными и результатами расчетов методом DFT [12] приведены в табл. 1. Воспроизведение механических характеристик модифицированной версией поля ClayFF улучшилось по сравнению с оригинальной версией, что обусловлено более корректным описанием колебания углов связи между катионами металлов и структурными гидроксилами.
Такое улучшение воспроизведения механических характеристик хорошо согласуется с более корректным описанием структуры и динамики водородных связей в новой модели. В кристалле эттрингита существует устойчивая сетка водородных связей, которая и отвечает за стабильность кристалла в направлении вектора c элементарной ячейки [11]. В эттрингите представлено довольно широкое разнообразие донорно-акцепторных пар, которые создают водородные связи. В качестве доноров могут выступать как атомы водорода структурных гидроксильных групп, так и атомы водорода молекул воды, а в качестве акцепторов – атомы кислорода как сульфат-ионов, так и молекул обоих структурных типов H2O, а также атомы кислорода структурных гидроксильных групп. В итоге было проанализировано 11 возможных донорно-акцепторных пар, между которыми образуются H-связи. Для определения водородной связи между донором и акцептором использовался наиболее распространенный геометрический критерий [13, 14].
Время жизни водородных связей оценивалось как интеграл по времени автокорреляционных функций водородных связей [15]. В итоге по результатам вычислений наиболее прочные водородные связи для обеих версий ClayFF возникают между молекулами H2O и сульфат-ионами, что отлично согласуется с расчетами методом DFT [16]. Однако наши расчеты показывают, что водородные связи, возникающие между гидроксильными группами и молекулами H2O также играют существенную роль. Так, время жизни водородных связей между атомами водорода гидроксилов и кислорода молекул воды (пары Hh⋅⋅⋅Ow и Hh⋅⋅⋅Ow*, где * – молекула H2O в канале эттрингита) значительно увеличивается для модифицированной версии ClayFF по сравнению с оригинальной версией ClayFF (~10 пс вместо ~0.3 пс). На рис. 1 показаны временные автокорреляционные функции водородных связей для пары Hh⋅⋅⋅Ow. Кроме того, для пары Hh⋅⋅⋅Ow на 20% увеличивается и среднее число водородных связей, приходящихся на один атом H гидроксила. Такое повышение количества и прочности водородных связей между гидроксильными группами и молекулами H2O приводит к формированию более устойчивой сетки водородных связей в кристаллогидрате, что, в свою очередь, приводит к лучшему воспроизведению механических характеристик эттрингита модифицированной версией ClayFF (таблица 1).
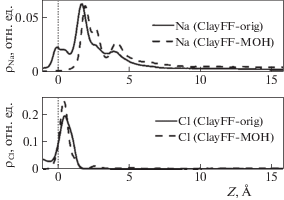
Для анализа взаимодействия водных растворов NaCl и Na2SO4 с поверхностью эттрингита были рассчитаны усредненные по времени профили плотности растворенных ионов и молекул H2O как функции расстояния соответствующих атомов раствора до поверхности кристалла. На рис. 2 представлены профили плотности для ионов Na+ и Cl– в направлении Z, перпендикулярном плоскости поверхности эттрингита. Для ионов Na+ наблюдается изменение положения пиков профиля плотности в первом гидратированном слое над поверхностью (не далее 3.5 Å от поверхности) для модифицированной версии ClayFF, что указывает на изменение внутрисферной адсорбции ионов. Такое изменение положения пиков ионов Na+ поверхностью кристалла можно объяснить более устойчивой структурой последнего по причине увеличения времени жизни водородных связей между гидроксильными группами и молекулами H2O. Кроме того, более реалистичный учет ограничений на изменения углов связи М–О–Н сильно уменьшает вероятность прямого доступа ионов Na+ непосредственно к отрицательно заряженным атомам кислорода поверхностных гидроксильных групп. В то же время, поскольку структурные молекулы H2O, находящиеся на поверхности кристалла и взаимодействующие с водным раствором, имеют меньшую подвижность в силу большей связанности с гидроксилами эттрингита за счет более прочных водородных связей, они также создают более плотную положительно заряженную поверхность эттрингита, в случае применения модифицированной версии ClayFF.
Во втором приповерхностном слое (от 3.5 до 7.0 Å от поверхности) положение пиков профилей плотности ионов Na+ для обеих версий ClayFF практически совпадает, но высота пика для модифицированной версии ClayFF несколько меньше и он расположен все-таки несколько дальше от поверхности, что указывает на изменение относительной доли внешнесферной адсорбции. Такое изменение, очевидно, связано с обсуждавшимися выше структурными изменениями в первом приповерхностном слое раствора за счет большего отталкивания ионов Na+ поверхностью эттрингита для модифицированной версии ClayFF. Вследствие создания такой более плотной положительно заряженной поверхности с применением новой версии ClayFF, наблюдается и более сильная адсорбция ионов Cl– на поверхности. Это заметно по увеличению высоты пика профиля плотности Cl– на рис. 2 и его расположению немного ближе к поверхности. При этом для обеих версий ClayFF наблюдается только внутрисферная адсорбция ионов Cl–.
Анализ профилей плотности для атомов водного раствора Na2SO4 показал, что поведение ионов Na+ ничем не отличается от поведения ионов Na+ в водном растворе NaCl, обсуждаемом выше. Для ионов (SO4)2–, как и для ионов Cl–, сохраняется положение пиков при некотором увеличении их высоты при использовании модифицированной версии ClayFF, что в свою очередь указывает на более сильную внутрисферную адсорбцию в этом случае. Анализ профилей плотности молекул H2O кристаллической фазы и водных растворов также показал, что для модифицированной версии ClayFF наблюдается более устойчивый и плотный молекулярный слой раствора на поверхности эттрингита, что в итоге приводит к большей гидрофильности поверхности и изменению внутрисферной адсорбции молекул H2O на поверхности.
Кроме одномерных профилей плотности атомов в межслоевых пространствах эттрингита, нами были проанализированы усредненные по времени двумерные распределения плотности каждого типа атомов на кристаллической поверхности (контурные карты). На рис. 3 показаны такие контурные карты атомов кислорода сульфат-ионов на поверхности эттрингита из расчета с водным раствором Na2SO4. Вертикальными пунктирными линиями указаны границы каналов эттрингита, у которых расстояния между пунктирными линиями наименьшие. В каналах эттрингита указаны кислороды ионов (SO4)2–, принадлежащие кристаллической фазе. Между каналами располагаются атомы кислорода ионов (SO4)2–, адсорбированных из водного раствора Na2SO4.
Рис. 3.
Плотность распределения атомов кислорода сульфат-ионов (сплошные жирные контуры) на поверхности эттрингита из расчета с водным раствором Na2SO4. Слева – для оригинальной версии ClayFF. Справа – для модифицированной версии ClayFF.

Из рисунков видно, что для модифицированной версии ClayFF наблюдается более стабильная структура кристаллической фазы, практически все кислороды ионов (SO4)2– располагаются в каналах эттрингита. Это одновременно указывает на большую устойчивость структуры эттрингита за счет формирования более прочной сетки водородных связей в самом кристалле. Как упоминалось выше, анализ одномерных профилей плотности ионов (SO4)2– водного раствора Na2SO4 показал, что наблюдается бóльшая адсорбция ионов (SO4)2– для модифицированной версии ClayFF. Контурные карты это также подтверждают: заметна бóльшая плотность атомов кислорода ионов (SO4)2– (рис. 3 справа). Стабильные положение и форма усредненных по времени контуров в то же время указывают, что ионы (SO4)2– водного раствора не диффундируют заметно по поверхности, а находятся в довольно локализованном состоянии на поверхности эттрингита. Анализ контурных карт поверхностной плотности других растворенных ионов и молекул H2O растворов NaCl и Na2SO4 тоже подтверждает выводы, сделанные выше на основе одномерных профилей плотности частиц: при применении модифицированной версии ClayFF наблюдается бóльшая локализация молекул H2O кристаллической фазы и изменяются доли внутрисферной и внешнесферной адсорбции ионов и молекул воды на поверхности.
Для исследования динамических свойств растворов рассчитывались двумерные коэффициенты диффузии молекул H2O на поверхности эттрингита. Коэффициенты диффузии вычислялись через среднеквадратическое смещение атомов по соотношению Эйнштейна−Смолуховского [10, 17]. При этом поверхностный слой раствора условно делился на три зоны в перпендикулярном поверхности кристалла направлении: ближайшая приповерхностная зона раствора толщиной 3.5 Å; зона, следующая за приповерхностной, также толщиной 3.5 Å; “объемная” зона – оставшаяся часть раствора в нанопоре дальше 7 Å от поверхности. В случае раствора NaCl во всех трех зонах наблюдается небольшое снижение диффузионной динамики молекул H2O для модифицированной версии ClayFF. Например, в приповерхностной зоне коэффициент двумерной диффузии для оригинальной версии ClayFF составил ${{D}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 1.15 × 10–5 см2/с, а для модифицированной версии ClayFF – ${{D}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 9.64 × 10–6 см2/с. Эти результаты качественно подтверждают сделанные выше выводы о бóльшей структурной стабильности поверхности эттрингита и усилении адсорбции ионов Cl– и молекул H2O этой поверхностью. В случае раствора Na2SO4 для первых двух зон, наоборот, наблюдается небольшое увеличение коэффициента диффузии молекул H2O для модифицированной версии ClayFF. В частности, в первой зоне коэффициент двумерной диффузии для оригинальной версии ClayFF составил ${{D}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 1.07 × 10–5 см2/с, а для модифицированной версии ClayFF – ${{D}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$ = 1.18 × 10–5 см2/с. Это небольшое увеличение диффузионной подвижности можно объяснить бóльшим ионным радиусом (SO4)2– по сравнению с Cl–. Как было сказано выше, ионы (SO4)2– сильнее адсорбируются поверхностью эттрингита в модифицированной версии ClayFF и при этом занимают несколько бóльший объем в приповерхностной зоне, что, в свою очередь, приводит к бóльшей подвижности молекул H2O, неадсорбированных поверхностью эттрингита.
Таким образом, более точный учет углового взаимодействия между катионами металлов и гидроксилами в структуре эттрингита позволяет предсказать более высокую степень адсорбции ионов растворов и молекул H2O на поверхности, а также влияет на количественное описание их подвижности. Увеличение адсорбции и изменение подвижности ионов и молекул растворов объясняется формированием более устойчивой и прочной сетки водородных связей как в кристаллической структуре эттрингита, так и на его поверхности. При этом явный учет углового взаимодействия M–O–H не влияет на качество описания термодинамически равновесной структуры кристалла, но позволяет лучше воспроизводить механические свойства последнего.
Работа выполнена в рамках Программы фундаментальных исследований НИУ ВШЭ в 2019–2021 годах. Исследование выполнено с использованием суперкомпьютерного комплекса НИУ ВШЭ [18].
Список литературы
Moore A.E., Taylor H.F.W. // Acta Crystall. Sec. B: Struct. Crystall. and Cryst. Chem. 1970. 26 (4). P. 386.
Moore A., Taylor H.F.W. // Nature. 1968. 218. P. 1048.
Taylor H.F.W., Famy C., Scrivener K.L. // Cem. Conc. Res. 2001. 31. P. 683.
Куксин А.Ю., Ланкин А.В., Морозов И.В. и др. // Програм. сист.: Теор. и прил. 2014. 1 (19). С. 191.
Cygan R.T., Greathouse J.A., Kalinichev A.G. // J. Phys. Chem. C. 2021. 125. P. 17573.
Cygan R.T., Liang J.-J., Kalinichev A.G. // J. Phys. Chem. B. 2004. 108. P. 1255.
Pouvreau M., Greathouse J.A., Cygan R.T., Kalinichev A.G. // J. Phys. Chem. C. 2017. 121. P. 14757.
Kalinichev A.G., Kirkpatrick R.J. // Chem. Mater. 2002. 14. P. 3539.
Plimpton S. // J. Comput. Phys. 1995. 117 (1). P. 1.
Allen M.P., Tildesley D.J. Computer Simulation of Liquids. 2nd Edition. Oxford University Press: New York, 2017. P. 626.
Manzano H., Ayuela A., Telesca A. et al. // J. Phys. Chem. C. 2012. 116 (30). P. 16138.
Honorio T., Guerra P., Bourdot A. // Cem. Concr. Res. 2020. 135. 106126.
Волошин В.П., Желиговская Е.А., Маленков Г.Г. и др. // Рос. хим. журн. (Журн. Рос. хим. об-ва им. Д.И. Менделеева). 2001. Т. XLV. № 3. С. 31.
Chowdhuri S., Chandra A. // Phys. Rev. E. 2002. 66 (4). 041203
Chanda J., Bandyopadhyay S. // J. Phys. Chem. B. 2006. 110. P. 23443.
Scholtzová E., Kucková L., Kožíšek J., Tunega D. // J. Molec. Struct. 2015. 1100. P. 215.
Кондратюк Н.Д., Норман Г.Э., Стегайлов В.В. // Высокомолекуляр. соединения. Сер. А. 2016. Т. 58. № 5. С. 519.
Kostenetskiy P.S., Chulkevich R.A., Kozyrev V.I. // J. Phys.: Confer. Ser. 2021. T. 1740. № 1.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии