Журнал физической химии, 2022, T. 96, № 9, стр. 1302-1310
Методы оценки теплоемкости кристаллических фаз
И. А. Успенская a, *, А. С. Иванов a, Н. М. Константинова a, И. Б. Куценок a
a Московский государственный университет имени М.В. Ломоносова,
Химический факультет
119991 Москва, Россия
* E-mail: ira@td.chem.msu.ru
Поступила в редакцию 08.01.2022
После доработки 12.03.2022
Принята к публикации 14.03.2022
- EDN: VGOFGN
- DOI: 10.31857/S0044453722090291
Аннотация
Проведен краткий обзор современных методов оценки теплоемкости; проанализированы их основные достоинства и недостатки. Более подробно рассмотрены инкрементные схемы, позволяющие прогнозировать температурные зависимости теплоемкости. Представлены результаты оценки теплоемкости твердых растворов (InAs)1 – x(GaAs)x с помощью специально подобранных правил смешения.
Теплоемкость – ключевая величина для определения температурных зависимостей термодинамических свойств различных веществ. При измерении изобарной теплоемкости используют разные методы – релаксационный (реализованный в измерительных системах PPMS), метод вакуумной адиабатической калориметрии, дифференциальной сканирующей калориметрии (ДСК), калориметрии сброса (drop) и др. Первые три метода позволяют непосредственно получать значения Cp(T), в последнем случае для оценки этой зависимости приходится проводить дифференцирование теплового эффекта по температуре. Все перечисленные методы различаются как температурным диапазоном измерений, так и точностью получаемых данных, а также трудоемкостью эксперимента. Наименьшую погрешность имеет метод адиабатической калориметрии (от 0.2 при 298 К до 10–15% вблизи 0 К), при этом верхний диапазон таких измерений, как правило, не превышает 300–350 К. Методы ДСК и drop-калориметрии характеризуются большими ошибками, но позволяют получать данные при достаточно высоких температурах. Есть еще одна проблема, связанная с измерениями теплоемкости: для некоторых веществ преимущества высокоточных экспериментальных методов не удается реализовать, так как погрешность измерения свойства определяется не столько точностью методики, сколько воспроизводимостью свойств исследуемого образца.
В этой связи встает вопрос о возможности априорного прогноза как низко-, так и высокотемпературных значений Сp(T) с погрешностью, сопоставимой с точностью эксперимента.
Цель настоящей работы – дать краткий обзор современных методов оценки теплоемкости кристаллических фаз. Основное внимание уделено наиболее востребованным способам оценки, даны ссылки на ранее опубликованные обзорные работы, в которых приведены альтернативные методы прогноза Cp(T), в том числе, многочисленные корреляционные соотношения.
Методы оценки теплоемкости неорганических веществ, предложенные до 90-х гг. XX века, достаточно подробно описаны в монографиях [1–3] и обзорной работе [4]. Из работ последующих десятилетий следует особо отметить публикации [5–10]. Основным отличием методов оценки, развиваемых в настоящее время, от предложенных в середине прошлого столетия, является попытка оценить именно температурные зависимости Cp(T), не ограничиваясь прогнозом значения Cp(298.15 K).
ПРАВИЛО НЕЙМАНА–КОППА И ЕГО МОДИФИКАЦИИ
Мольную теплоемкость интересующего соединения Cp(T) часто оценивают по правилу Неймана–Коппа (ПНК) суммированием при заданной температуре мольных теплоемкостей индивидуальных компонентов $C_{{p,i}}^{^\circ }$(T), умноженных на их количества в соединении ni:
тем самым пренебрегая изменением теплоемкости при образовании соединения из компонентов [11].Детальный анализ применимости указанного правила для описания теплоемкости различных веществ дан в публикациях Лейтнера с соавт. [6–8]. Как отмечалось в работе [8], правило Неймана–Коппа применимо для описания, в основном, тех веществ, у которых доминирует решеточный вклад в теплоемкость как самого вещества, так и образующих его компонентов. Несомненное достоинство этой работы – попытка проверить предсказательную способность ПНК в широком интервале температур и анализ факторов, обусловливающих отклонение экспериментальных данных от аддитивности.
На примере смешанных оксидов авторами [8] показано, что при низких температурах ненулевое значение ΔoxCp связано с различием в решеточном вкладе в теплоемкость смешанного оксида, обусловленном изменением колебательного спектра при образовании соединения. Так, анализ фононного спектра перовскита BaZrO3 выявил заметное различие именно между низкочастотными акустическими модами BaZrO3 и BaO, что, по мнению авторов, и привело к положительному отклонению от ПНК.
При высоких температурах отклонение от аддитивности связано с различием значений молярных объемов и термических коэффициентов, в связи с чем авторами [8] предложено вводить поправку ΔCdil в формулу расчета теплоемкости соединения, содержащего несколько компонентов:
(2)
$\begin{gathered} {{C}_{{p,m}}}({{{\text{A}}}_{{{{x}_{{\text{A}}}}}}}{{{\text{B}}}_{{{{x}_{{\text{B}}}}}}}{{{\text{O}}}_{z}}) = {{x}_{{\text{A}}}}{{C}_{{p,m}}}({\text{A}}{{{\text{O}}}_{{\text{a}}}}) + \\ + \;{{x}_{{\text{B}}}}{{C}_{{p,m}}}({\text{B}}{{{\text{O}}}_{{\text{b}}}}) + \Delta {{C}_{{{\text{dil}}}}}. \\ \end{gathered} $Учет объемного фактора при использовании правила Неймана–Коппа коррелирует с заключением Мейера [12], который в свое время показал, что ПНК удовлетворительно выполняется для тех твердых соединений, молярный объем которых приблизительно равен стехиометрической сумме атомных объемов элементов, образующих это соединение. Согласно его выводам, ${{C}_{{p,m}}}$(соединение) > ${{C}_{{p,{\text{at}}}}}$(элементы), если Vm(соединение) > Vat(элементы) и наоборот.
Предложение улучшить описание экспериментальных данных за счет введения дополнительного слагаемого в уравнение (1) не является абсолютно новым; ранее аналогичное решение предложено, например, в работе [13], автор которой рекомендовал для оценки теплоемкости использовать соотношение:
В работе [14] для улучшения качества оценок теплоемкости с помощью ПНК предлагалось вводить поправочный множитель. Например, для согласования результатов оценки теплоемкости Y2Cu2O5 с измеренными значениями Cp(T) в правой части (1) перед суммой слагаемых был введен поправочный множитель 0.982. Значение этого множителя находили по измеренным в той же работе приращениям энтальпии {H°(873 K) – ‒ H°(Tref)} купрата иттрия.
В работах [7] и [15] для повышения точности метода Неймана–Коппа было предложено проводить суммирование свойств более крупных “псевдокомпонентов”; так, для расчета теплоемкости соединения AaBbCc рекомендовано использовать Cp(T) бинарных соединений ${\text{A}}{{{\text{C}}}_{{{{c}_{1}}}}}$ и ${\text{B}}{{{\text{C}}}_{c}}_{{_{2}}}$, а не компонентов А, B и C:
Такой подход, по мнению авторов, не только повышает надежность прогноза, но и расширяет возможности получения адекватных оценок в случае, если простые вещества не могут существовать в твердом состоянии при интересующих условиях (один из компонентов является летучим веществом – O2, N2, Hal2 и т.п.).ИНКРЕМЕНТНЫЕ СХЕМЫ
В основу всех инкрементных схем оценки теплоемкости положено допущение, что функция Cp(T) интересующего вещества может быть представлена в виде суммы соответствующих вкладов отдельных структурных фрагментов (${{\hat {C}}_{{p,i}}}(T)$):
где ${{\hat {n}}_{i}}$ – количество i-го фрагмента в формуле соединения. Если при определении значений инкрементов используются данные только при комнатной температуре, то оцененное значение теплоемкости от температуры не зависит.Конкретный вид функций Сp(Т) и, как следствие, ${{\hat {C}}_{{p,i}}}(T)$, в работах разных авторов отличается. Так, в работе [16] использована зависимость вида:
и получающиеся из нее выражения при нулевых значениях некоторых параметров. Мостафа с соавт. [5] предложили описывать теплоемкость полиномом вида: В программном комплексе ASPEN PLUS [17] для кристаллических веществ использована более сложная зависимость:В зависимости от вида выбранной функции Cp(T), при построении инкрементной схемы различаются и выражения для оценки теплоемкости. Так, в схеме Мостафа для этого использовали соотношение:
(4)
$\begin{gathered} {{C}_{p}}(T) = \mathop \sum \limits_i \,{{n}_{i}}{{{\hat {C}}}_{{p,a,i}}} + \left( {\mathop \sum \limits_i \,{{n}_{i}}{{{\hat {C}}}_{{p,b,i}}}} \right){{10}^{{ - 3}}}T + \\ + \;\left( {\mathop \sum \limits_i \,{{n}_{i}}{{{\hat {C}}}_{{p,c,i}}}} \right){{10}^{6}}{{T}^{{ - 2}}} + \left( {\mathop \sum \limits_i \,{{n}_{i}}{{{\hat {C}}}_{{p,d,i}}}} \right){{10}^{{ - 6}}}{{T}^{2}}, \\ \end{gathered} $Наиболее популярной инкрементной схемой, используемой в настоящее время, можно считать схему Мостафа. В настоящей работе на ее примере рассмотрены как основные преимущества, так и недостатки такого подхода.
Основное достоинство любой инкрементной схемы – возможность априорной оценки теплоемкости интересующего соединения. Очевидно, что качество прогноза напрямую зависит от количества и точности данных, использованных при параметризации. Так, например, в работе [5] значения инкрементов О2– рассчитывали с учетом того, что данный фрагмент присутствует в 1155 соединениях, Na+ – в 91-м, а Cr2+ и Cr6+ – только в четырех. Очевидно, что достоверность оценок будет выше для тех фаз, которые содержат структурные фрагменты, присутствующие в большем количестве различных соединений. Расширение круга веществ, по свойствам которых оцениваются численные значения вкладов структурных единиц, приводит к увеличению числа веществ, теплоемкость которых можно предсказать, но при этом качество прогноза часто ухудшается по сравнению со схемами, в которых использован более узкий круг веществ с близкими структурными характеристиками [19].
К основным недостаткам инкрементных схем, по-видимому, следует отнести тот факт, что система инвариантов создается для коррелированных между собой параметров ${{\hat {C}}_{{p,i}}}$. Как отмечалось в работе [19], в этих условиях приходится решать численными методами плохо обусловленные системы уравнений и не удается эффективно разделить между собой зависимости свойств от температуры и от состава. Это отрицательно влияет на надежность получаемых оценок в целом. Прогнозируемая зависимость может оказаться даже физически противоречивой, например, с максимумом на кривой Cp(T), рассчитанной по ионным вкладам.
Один из показателей качества любой термодинамической модели – возможность воспроизвести значения свойств, которые не были использованы при параметризации модели. В работе [5] в качестве тестовых объектов были выбраны некоторые соли кальция, магния, цинка и марганца. Показано, что расхождение рассчитанных и измеренных значений варьируется в интервале от 0.63% для CaCO3 до 7.63% для CaSO4⋅2H2O. В настоящей работе была поставлена задача выборочно проверить возможность прогноза свойств смешанных оксидов, образующих стехиометрические фазы и твердые растворы, экспериментальные данные для которых не учитывались при оценке значений инкрементов в работе [5]: (U1 – xThx)O2 [21] и (U1 – xLax)O1.95 [22].
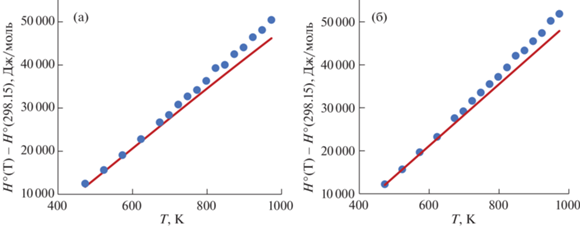
Для твердых растворов (U1 – xThx)O2 проверена воспроизводимость экспериментально измеренных значений приращения энтальпии ($H_{T}^{^\circ }$ – ‒ $H_{{298.15}}^{^\circ }$) с помощью значений инкрементов теплоемкости (см. табл. 1), рекомендуемых в работе [5]. Результаты сравнения эксперимента и расчета для двух составов (x = 0.5 и 0.1) представлены на рис. 1. Из рис. 1 видно, что наблюдается хорошее согласие значений ΔH°(T) ниже 700 К, расхождение увеличивается с ростом температуры. Среднее значение отклонений для трех твердых растворов (x = 0.1, 0.5 и 0.9) составляет ⁓5%, максимальное – 10%.
Таблица 1.
Значения инкрементов теплоемкости (Дж/(моль К)) для структурных единиц Uz+ (z = 4, 5, 6), La3+, Th4+ и O2– [5]
| Структурный фрагмент |
${{\hat {C}}_{{p,a,i}}}$ | ${{\hat {C}}_{{p,b,i}}}$ | ${{\hat {C}}_{{p,c,i}}}$ | ${{\hat {C}}_{{p,d,i}}}$ | N |
|---|---|---|---|---|---|
| U4+ | 26.669 | –29.923 | –0.066 | 2.171 | 7 |
| U5+ | 13.890 | –31.178 | 0.627 | –2.126 | 4 |
| U6+ | –14.769 | 50.875 | 1.654 | –14.399 | 11 |
| Th4+ | 20.291 | –28.458 | 0.351 | –1.633 | 11 |
| La3+ | 15.803 | –11.296 | 0.458 | 3.344 | 8 |
| O2– | 28.152 | 12.043 | –0.747 | –4.023 | 1155 |
Несколько иная картина наблюдается в твердых растворах (U1 – xLax)Oy. Отличие данного случая от предыдущего – разная степень окисления урана, которую необходимо учитывать при оценке свойств этих фаз. При расчете теплоемкости и приращения энтальпии использованы численные значения параметров для соответствующих структурных единиц (см. табл. 1). Результаты расчетов иллюстрируют графики на рис. 2. Для функции ΔH°(T) этих твердых растворов характерны те же закономерности, которые наблюдались в оксиде урана, допированном торием. Для фаз, представленных на рис. 2б, 2г, взятое по модулю среднее значение отклонений энтальпии (H°(T) – H°(298.15)) составляет 3.8 и 9.4% при мольной доле урана 0.8 и 0.6, соответственно.
Рис. 2.
Сравнение рассчитанных и измеренных значений теплоемкости и приращения энтальпии для фаз (U0.8La0.2)O1.95 (а, б) и (U0.6La0.4)O1.87 (в, г). Символы – экспериментальные данные [22], пунктирная линия – сглаженные значения Cp(T), сплошная линия – расчет с использованием значений инкрементов из табл. 1.

При этом обращает на себя внимание несколько нефизичное поведение рассчитанной теплоемкости фазы (U0.8La0.2)O1.95. На такой артефакт следует обратить внимание, так как это – не единичный случай, ранее аналогичное поведение при использовании инкрементов из работы [5] было обнаружено для стехиометрического соединения Y2Cu2O5 [19].
Дополнительно на примере ZrO2 была оценена возможность экстраполяции результатов оценки на температуры ниже 298.15 К. Следует отметить, что попытки экстраполировать предлагаемые модельные зависимости на более низкие температуры оказались неудачными; если при 298.15 К разница в рассчитанных и измеренных значениях составляла для оксида циркония 0.1%, то при понижении температуры до 278 К она достигала 1%, а далее расхождение увеличивалось все более существенно (так, при 238 К оно составило 5.6%). При введении в ZrO2 добавки 0.08 мол. % Y2O3 качество прогноза ухудшилось, разница в значениях Cp(298.15) составила ∼1%, но при 278 К отклонения были аналогичны наблюдаемым для чистого оксида циркония (т.е. увеличились на 1% по сравнению с 298.15 К). При расчетах использованы данные [23].
Помимо вида функциональной зависимости Cp(T) при построении инкрементной схемы важен выбор структурных фрагментов, в качестве которых могут быть использованы ионы, ионные или нейтральные формы, ассоциаты и т.п. Выбранные инкременты могут вообще не соответствовать реальным структурным элементам описываемых соединений или каким-либо существующим индивидуальным веществам. Обычно в качестве таких “псевдокомпонентов” выбирают ионы; причина этого – ограниченность набора экспериментальных данных и возможность при таком выборе проводить усреднение по большим выборкам экспериментальных данных. Однако, как отмечалось в работе [19], если при построении аддитивной схемы в качестве структурных единиц выбирать не группы атомов, а отдельные атомы или ионы, то при последовательном применении такого способа расчета свойств функции образования из индивидуальных оксидов (галогенидов, сульфидов и т.п.) более сложных фаз должны быть нулевыми.
МЕТОД ГЛАССЕРА И ДЖЕНКИНСА
Выше уже обсуждался вопрос о возможности улучшения предсказательной способности правила Неймана–Коппа за счет введения дополнительного слагаемого $\Delta {{C}_{{p{\text{,dil}}}}}$, при расчете которого используются сведения об объемных свойствах веществ.
На корреляции теплоемкости и мольного объема ионных соединений основан метод оценки теплоемкости, предложенный в работах Глассера и Дженкинса (Glasser&Jenkins) [9, 10]; следует обратить внимание, что предлагаемый подход позволяет прогнозировать значения Cp только при одной температуре (298.15 К). Для расчета теплоемкости Cp(298.15 K) авторы предлагают использовать следующие выражения:
ОЦЕНКА ТЕПЛОЕМКОСТИ ПРИ ИСПОЛЬЗОВАНИИ КОМБИНАЦИИ ФУНКЦИЙ ПЛАНКА–ЭЙНШТЕЙНА
В 2013 г. Ворониным и Куценком [25] для описания температурных зависимостей теплоемкости в интервале температур от 0 К до температуры плавления было предложено использовать комбинацию функций Планка–Эйнштейна:
(5)
$\begin{gathered} {{C}_{p}}(x,T) = \mathop \sum \limits_{i = 1}^m \,{{{{\alpha }}}_{i}}(x){{C}_{E}}\left( {\frac{{{{{{\theta }}}_{i}}(x)}}{T}} \right), \\ \frac{{{{C}_{E}}\left( {\frac{{{\theta }}}{T}} \right)}}{R} = \frac{{3{{{\left( {\frac{{{\theta }}}{T}} \right)}}^{2}}{{e}^{{\frac{{{\theta }}}{T}}}}}}{{{{{\left( {{{e}^{{\frac{{{\theta }}}{T}}}} - 1} \right)}}^{2}}}}, \\ \end{gathered} $В дальнейшем этот метод получил широкое развитие и сейчас активно используется при представлении Cp(T) веществ различной природы [26, 27]. В 2019 г. была предпринята первая успешная попытка разработать метод оценки термодинамических свойств с использованием данного подхода [28]; в качестве объектов исследования выбраны цеолиты. Для описания теплоемкости данного класса веществ предложено использовать выражение вида:
Следующий шаг в развитии методов оценки термодинамических функций (в частности, теплоемкости) с использованием комбинации функций Планка–Эйнштейна сделан авторами настоящей работы. На примере твердых растворов (InAs)1 – x(GaAs)x протестирована возможность применения различных “правил смешения” для оценки теплоемкости твердых растворов. Выбор именно этой системы обусловлен наличием достаточно точных измерений Cp(T) при различных составах фаз (в широком температурном интервале ниже 298 К), в том числе, для граничных составов – вплоть до температуры плавления [30, 31]. Немаловажным оказался также тот факт, что в настоящее время методы оценки термодинамических свойств сплавов представлены крайне скудно, в отличие от смешанных оксидов или солевых систем. Поэтому в случае успешного решения задачи можно было бы предложить новый способ оценки термодинамических свойств сплавов.
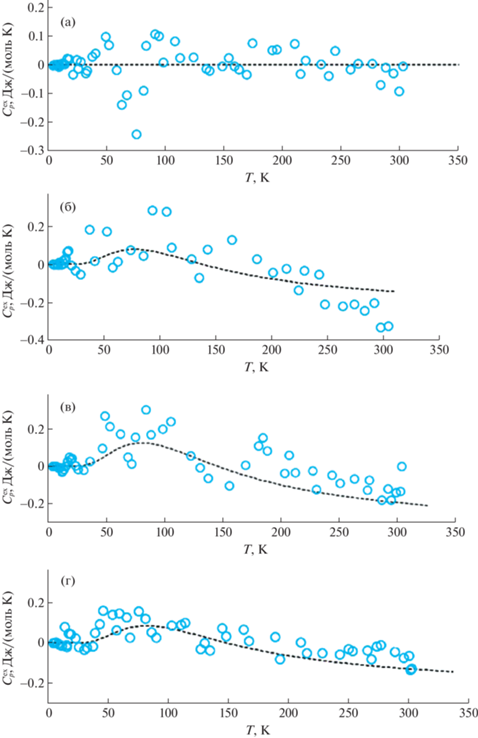
В ходе расчетов было опробовано несколько вариантов правил смешения для параметров α и θ. Оказалось, что удовлетворительное описание экспериментальных данных можно получить, если варьировать зависимость характеристических температур от состава только первых двух наибольших по значению параметров: θ1 и θ2, остальные же характеристические температуры θi (i ≥ 3) зафиксировать постоянными и не зависящими от состава (это несущественно повлияло на точность описания данных в пределах погрешностей их измерения). При этом все параметры αi (i ≠ 2) и характеристическую температуру θ1 можно принять линейно зависимыми от состава, а для характеристической температуры θ2 и параметра α2 необходимо учитывать, как минимум, параболическую зависимость от состава (без этого невозможно воспроизвести типичные аномалии на кривых избыточных теплоемкостей от температуры) (см. рис. 3).
Рис. 3.
Зависимости избыточной теплоемкости от температуры для различных составов твердых растворов (InAs)1 – x(GaAs)x, x = 0 (а), 0.4 (б), 0.6 (в) и 0.8 (г); символы – данные [30], пунктирная линия – наши результаты расчета.
С учетом этих ограничений, расчет теплоемкостей твердого раствора проводили с использованием формулы (5) с зависимостями параметров от состава, представленными в табл. 2. “Смешанные” параметры α2x и θ2x рассчитывали с помощью соотношений с единственным эмпирическим параметром z = 1/24 (это значение получено в ходе оптимизации по всем имеющимся экспериментальным данным):
(6)
$\begin{gathered} {{\alpha }_{{2x}}} = \frac{{{{\alpha }_{2}}(0) + {{\alpha }_{2}}(1)}}{2}(1 - z), \\ {{\theta }_{{2x}}} = \frac{{{{\theta }_{2}}(0) + {{\theta }_{2}}(1)}}{2}(1 - z). \\ \end{gathered} $Таблица 2.
Виды зависимости от состава параметров αi(x) и θi(x); для оценки “смешанных” параметров α2x и θ2x использованы формулы (6)
| i | αi(x) | θi(x) |
|---|---|---|
| 1 | α1(x) = (α1(1) – ‒ α1(0))x + α1(0) | θ1(x) = (θ1(1) – ‒ θ1(0))x + θ1(0) |
| 2 | α2(x) = α2(0)(1 – x)2 + + 2α2x(1 – x)x + α2(1)x2 | θ2(x) = θ2(0)(1 – x)2 + + 2θ2x(1 – x)x + θ2(1)x2 |
| ≥3 | αi(x) = (αi(1) – αi(0))x + + αi(0) | θi(x) = θi(0) = θi(1) |
Для адекватного описания температурных зависимостей теплоемкостей компонентов оказалось достаточно четырех пар функций Планка–Эйнштейна; при расширении интервала температур до точки плавления пришлось вести еще одну пару параметров α1 и θ1 (отсчет велся заново, начиная с пары параметров, имевшей наибольшее значение характеристической температуры θi). При оптимизации параметры θi с i ≥ 3 были принудительно уравнены, что позволило впоследствии упростить процедуру применения правил смешения. Численные значения параметров для компонентов приведены в табл. 3 (все цифры даны с избыточным числом значащих цифр для корректного воспроизведения представленных на рисунке зависимостей).
Таблица 3.
Параметры α и θ функций Планка–Эйнштейна для индивидуальных соединений InAs и GaAs
| i | InAs | GaAs | ||
|---|---|---|---|---|
| αi | θi | αi | θi | |
| 1 | 0.353146 | 3453.40 | 0.318291 | 4187.68 |
| 2 | 0.535623 | 331.677 | 0.633299 | 358.682 |
| 3 | 0.274842 | 130.221 | 0.339065 | 130.221 |
| 4 | 0.199201 | 67.2747 | 0.042965 | 67.2747 |
| 5 | 0.003273 | 21.1449 | 0.00092034 | 21.1449 |
При анализе графиков зависимости избыточной теплоемкости твердого раствора (ss) ($C_{p}^{{{\text{ex}}}}$ = = ${{C}_{{p,{\text{ss}}}}}$ – (1 – x)${{C}_{{p,{\text{InAs}}}}}$ – x${{C}_{{p{\text{,GaAs}}}}}$) от температуры на рис. 3 обращают на себя внимание два момента: (а) отсутствие значимых остаточных аномалий на зависимостях $C_{p}^{{{\text{ex}}}}$(T) для граничных компонентов и систематическое присутствие экстремумов на аналогичных зависимостях для твердых растворов, (б) довольно малые значения избыточной теплоемкости (что накладывает определенные требования к измерениям теплоемкости, их погрешности должны быть меньше $C_{p}^{{{\text{ex}}}}$). Видно, что использованные правила смешения (расчетная кривая с учетом правил смешения обозначена на рис. 3 пунктирной линией) позволяют удовлетворительно описать как вид кривых, так и численные значения избыточной теплоемкости твердых растворов в интервале температур 5–300 К.
ЗАКЛЮЧЕНИЕ
Проведенный анализ литературных данных и собственные расчеты позволяют сделать вывод, что, в целом, инкрементные схемы описывают экспериментальные данные лучше, чем классический вариант правила Неймана–Коппа. Однако, прежде чем использовать оценочные значения теплоемкости при расчетах фазовых и химических равновесий, следует проверять наличие нефизичных аномалий на кривых Cp(T).
При удачном подборе “правил смешения” могут быть разработаны схемы оценки термодинамических свойств фаз переменного состава, основанные на использовании комбинаций функций Планка–Эйнштейна. По-видимому, основным фактором, сдерживающим развитие такого рода работ, является ограниченность высокоточных данных, полученных методом адиабатической калориметрии для серий твердых растворов в системах различной природы.
Исследование выполнено при финансовой поддержке РФФИ (проект № 20-33-70269), а также частично в рамках темы “Химическая термодинамика и теоретическое материаловедение” (№ ЦИТИС – 121031300039-1).
Список литературы
Киреев В.А. Методы практических расчетов в термодинамике химических реакций. М.: Химия, 1970. 519 с
Карапетьянц М.Х. Методы сравнительного расчета физико-химических свойств. М.: Наука, 1965, 405 с.
Цагарейшвили Д.Ш. Методы расчета термических и упругих свойств. Тбилиси: Мецниереба, 1977. 264 с
Moiseev G.K., Sestak J. // Prog. Crystal Growth and Charact. 1995. V. 30. P. 23.
Mostafa G.A.T.M., Eakman J.M., Montoya M.M., Yarbro S.L. // Ind. Eng. Chem. Res. 1996. V. 35. P. 343.
Leitner J., Sedmidubsky D., Chuchvales P. // Ceramics – Silikaty. 2002. V. 46 (1). P. 29.
Leitner J., Chuchvales P., Sedmidubsky D. // Thermochimica Acta. 2003. V. 395. P. 27.
Leitner J., Vonka P., Sedmidubsky D. // Ibid. 2010. V. 497. P. 7. https://doi.org/10.1016/j.tca.2009.08.002
Glasser L., Jenkins H.D.B. // Inorg. Chem. 2011. V. 50. P. 8565.https://doi.org/10.1021/ic201093p
Glasser L., Jenkins H.D.B. // Ibid. 2012. V. 51. P. 6360.https://doi.org/10.1021/ic300591f
Кубашевский О.,Олкок С.Б. Металлургическая термохимия. М.: Металлургия, 1982. 392 с.
Meyer S. // Ann. Phys. 1900. V. 2. P. 135.
Hurst J.E., Harrison B.K. // Chem. Eng. Comm. 1992. V. 112. P. 21.
Zimmermann E., Hack K., Mohammad A. et al. // Z. Metallkd. 1995. V. 86. P. 2.
Qiu L., White M.A. // J. Chem. Educ. 2001. V. 78. P. 1076.
Robie R.A., Hemingway B.S., Fisher J.M. Thermodynamic Properties of Minerals and Related Substances at 298.15 K and 1 Bar (105 Pascal) Pressure and at higher Temperatures; United States Government Printing Office: Washington, DC, 1979.
ASPEN PLUS. User Guide Appendices, 2nd ed.; Aspen Technology, Inc.: Cambridge, MA, 1990.
Voronin G.F., Uspenskaya I.A. // Russ. J. Phys. Chem. A, 1996. V. 71 (10). P. 1572.
Voronin G.F., Uspenskaya I.A.// Ibid. 1997. V. 71 (11). P. 1927.
Berman R.G., Brown T.H. // Contrib. Mineral. Petrol. 1985. V. 89. P. 168.
Anthonysamy S., Joseph J., Vasudeva Rao P.R. // J. Alloys and Compounds. 2000. V. 299. P. 112. https://doi.org/10.1016/S0925-8388(99)00744-6
Krishnan R.V., Mittal V.K., Babu R., Senapati A., Bera S., Nagarajan K. // Journal of Alloys and Compounds. 2011. V. 509. P. 3229. https://doi.org/10.1016/j.jallcom.2010.12.090
Tojo T., Atake T., Mori T., Yamamura H. // J. Chem. Thermodynamics. 1999. V. 31. P. 831. https://doi.org/10.1006/jcht.1998.0481
Spencer P. J. // Thermochim. Acta. 1998. V. 314. P. 1.
Voronin G.F., Kutsenok I.B. // J. Chem. Eng. Data. 2013. V. 58 (7). P. 2083.https://doi.org/10.1021/je400316m
Benigni P. // CALPHAD. 2021. V. 72. P. 102238.https://doi.org/10.1016/j.calphad.2020.102238
Khvan A.V., Uspenskaya I.A., Aristova N.M. et al. // Ibid. 2020. V. 68. P. 101724
Voskov A.L., Voronin G.F., Kutsenok I.B. et al. // Ibid. 2019. V. 66. P. 101623
Voskov A.L., Kutsenok I.B., Voronin G.F. // Ibid. 2018. V. 61. P. 50.https://doi.org/10.1016/j.calphad.2018.02.001
Новиков В.В. Температурная зависимость теплоемкости твердых растворов системы арсенид галлия – фосфид индия – арсенид индия в области 5–300 К: Дисс. …. канд. физ.-мат. наук. М.: МГУ, 1984.
Pässler R. // AIP Advances 2013. V. 3.8. P. 082108.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии