Журнал физической химии, 2023, T. 97, № 3, стр. 363-369
Кислотный гидролиз гликозил-гликозных связей дисахаридов в водно-органических средах
М. А. Кушнер a, *, **, Т. С. Селиверстова a, Л. Г. Матусевич a
a Белорусский государственный технологический университет
Минск, Республика Беларусь
* E-mail: makushner@yandex.ru
** E-mail: makushner@yandex.by
Поступила в редакцию 17.06.2022
После доработки 17.09.2022
Принята к публикации 19.09.2022
- EDN: DXSSCY
- DOI: 10.31857/S0044453723030160
Аннотация
Определены кинетические параметры (константы скорости, энергии и энтропии активации) реакций кислотно-каталитического гидролиза восстанавливающих дисахаридов целлобиозы и лактозы в широком диапазоне составов смесей воды с органическими растворителями (диоксаном, ацетоном, ДМСО и уксусной кислотой). Показано, что увеличение содержания органического растворителя по-разному ускоряет реакции гидролиза гликозидной связи. Обcуждено влияние растворителей на скорость и механизм изученной реакции на основе сольватационных представлений.
Гликозидная связь – элемент структуры большинства низкомолекулярных природных соединений и практически всех биологических олигомеров и полимеров. Присутствие и расщепление именно гликозидных связей определяющим образом влияет как на существование и функционирование многообразных вариантов живой природы, так и на результат промышленных способов выделения и переработки природного растительного и животного сырья с целью получения целлюлозы, натуральных волокон, лекарственных и биологически активных соединений, продуктов питания, биотоплива и т.д. Изучение реакций гидролиза связей молекул углеводов с агликонами различной природы не теряет своей актуальности и ведется достаточно постоянно и активно [1–3]. При этом сложность проблем, связанных с расщеплением гликозидных связей, очевидно, не умещается в рамках химии углеводов, во-первых; и, во-вторых, в литературе практически отсутствуют результаты исследований влияния состава смешанных водно-органических растворителей на скорость и механизм гидролиза гликозидной связи, что и послужило целью данного исследования. Известно, что применение смешанных растворителей может открывать новые возможности для повышения избирательности целого ряда многочисленных путей и методов переработки натурального сырья и более эффективной и целенаправленной их реализации [4–7]. Между тем, как показано нами при исследовании влияния состава водно-органических растворителей на кислотный гидролиз бензилэфирных связей [8], изменение содержания органического растворителя не только вызывает изменение скорости гидролиза, но и приводит к изменению механизма таких реакций.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Нами исследовано влияние органических растворителей (диоксана, ДМСО, ацетона и уксусной кислоты) на скорость и механизм кислотного гидролиза β-D-глюкопиранозил(1 → 4)-D-глюкопиранозы (целлобиозы) (1) и β-D-галактопиранозил(1 → 4)-D-глюкопиранозы (лактозы) (2):
Кислотно-катализируемый гидролиз дисахаридов осуществляли в смесях органический растворитель–вода переменного состава в диапазоне температур 35–90°C, в качестве катализатора использовали HCl или H2SO4.
Для исследований кинетики гидролиза использовали целлобиозу и лактозу марки “ч.”, глюкозу марки “х.ч.”. Диоксан очищали согласно [9], ДМСО перегоняли под вакуумом, ацетон марки “ч.д.а.” и ледяную уксусную кислоту использовали без дополнительной очистки.
Кинетические исследования по определению констант скоростей реакций проводили ампульным методом. Из полученных зависимостей концентрации продуктов реакции от времени были построены кинетические кривые и их полулогарифмические анаморфозы в соответствии с уравнением реакции первого порядка, удовлетворительно описывающим кинетику данных реакций. Пробы с реакционной смесью выдерживали в запаянных ампулах в термостате. Через определенные промежутки времени ампулы охлаждали, вскрывали и определяли содержание моносахаридов (глюкозы и галактозы) по реакции с о-толуидиновым реагентом спектрофотометрически при длине волны 630 нм [10]. При этом для расчета текущей концентрации восстанавливающего дисахарида учитывали, что целлобиоза и лактоза также дают окрашенные соединения при взаимодействии с о-толуидиновым реагентом. Поэтому использовали уравнение: сдс = D – 2εмсс0дс/εдс – ‒ 2εмс, где D – оптическая плотность раствора при длине волны 630 нм; с0дс – исходная концентрация целлобиозы (лактозы); εмс и εдс – коэффициенты экстинкции моносахаридов и целлобиозы (лактозы), вычисленные по калибровочным графикам. Из полученных зависимостей концентрации продуктов реакции от времени были построены кинетические кривые и их полулогарифмические анаморфозы в соответствии с уравнением реакции первого порядка, удовлетворительно описывающим кинетику данных реакций.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
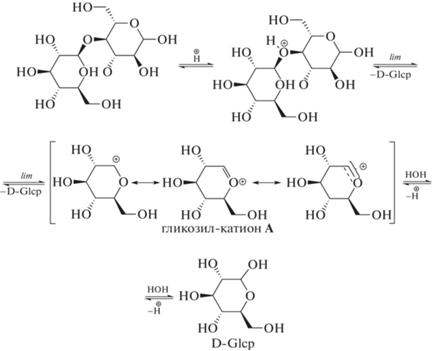
Кислотный гидролиз гликозидных связей может быть отнесен к одному из наиболее распространенных типов органических реакций – мономолекулярному нуклеофильному замещению у насыщенного атома углерода SN1. Особенность реакций разрыва гликозидных связей в том, что расщеплению предшествует протонирование кислорода гликозидной связи с последующим расщеплением гликозил-гликозной связи и освобождением одной молекулы моносахарида. При этом на скоростьлимитирующей стадии реакции образуется сопряженный гликозил-катион А, который быстро взаимодействует с водой, и образуется вторая молекула соответствующего моносахарида. Так, кислотный гидролиз лактозы приводит к получению галактозы и глюкозы, а гидролиз целлобиозы приводит к получению глюкозы:
Однако в отличие от других SN-реакций изучению влияния растворителей на механизм гидролиза гликозидов уделялось недостаточно внимания, как и на механизм гидролиза малоактивных в таких реакциях других простых эфиров. Для исследования гидролиза дисахаридов нами использованы апротонные растворители различной полярности (ДМСО, ацетон, диоксан) и протонодорный растворитель уксусная кислота, которые широко используются при изучении многих типов реакций, а также представляют интерес для химической промышленности при разработке технологических процессов с участием гликозидных связей.
На рис. 1 и 2 приведены зависимости константы скорости гидролиза дисахаридов 1 и 2 от состава смешанных растворителей. Как следует из приведенных данных, использованные растворители по-разному влияют на скорость гидролиза гликозил-гликозных связей. В то же время в растворителях с большим содержанием как апротонных растворителей, так и уксусной кислоты скорость расщепления гликозидной связи увеличивается. Причем в случае диоксана и ацетона скорость реакции возрастает существенно (в ≈20 раз) как для целлобиозы, так и для лактозы. Характер зависимости kэксп от концентрации растворителя (Xs, мол. доли) практически одинаков для обоих дисахаридов.
Рис. 1.
Зависимости константы скорости гидролиза дисахаридов от состава смешанного растворителя, 90°С: 1 – 1, вода–диоксан, 0.2 н. HCl; 2 – 1, вода–ДМСО, 0.2 н. HCl; 3 – 1, вода–уксусная кислота, 0.1 н. Н2SO4; 4 – 2, вода–диоксан, 0.2 н. HCl; Xs – концентрация апротонного растворителя, мол. доли.

Рис. 2.
Зависимость константы скорости кислотного гидролиза целлобиозы от состава смешанного растворителя вода–ацетон, 0.2 н HCl, 50°С.

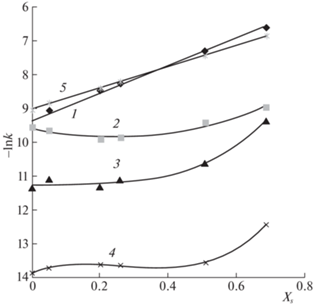
Полученные зависимости скорости гидролиза от состава водно-органического растворителя могут быть интерпретированы на основании сольватационных представлений. Характер зависимостей kэксп от концентрации растворителей с различной полярностью свидетельствует о значительном вкладе специфической (неэлектростатической) сольватации. Для оценки вклада таких эффектов среды как специфическая и неспецифическая сольватация реагирующих частиц, переходного состояния или уходящих групп нами построены зависимости $\ln k$ от полярности растворителя (1/ε) (рис. 3).
Рис. 3.
Зависимости $\ln k$ от 1/ε для гидролиза дисахаридов: 1 – целлобиоза, вода–диоксан; 2 – целлобиоза, вода–ДМСО; 3 – лактоза, вода–диоксан; 4 – целлобиоза, вода–уксусная кислота; 5 – целлобиоза, вода–ацетон.

Полученные зависимости характеризуются отклонениями от прямолинейности в области низких содержаний органического компонента растворителя. Наблюдаемые отклонения могут быть вызваны существенным вкладом специфической сольватации в рассматриваемых системах смешанных растворителей. Специфическая сольватация (образование водородных и (или) донорно-акцепторных связей) с реагирующими частицами в растворах воды с органическими растворителями тесно связана с изменением структурированности смешанного растворителя по сравнению с водой. В области небольших концентраций воды эти зависимости практически линейны и имеют положительный наклон, что указывает на преобладание влияния электростатических взаимодействий в растворе, без существенного вклада специфической сольватации.
Для учета электростатических взаимодействий в растворе используются эмпирические зависимости константы скорости и диэлектрической проницаемости среды [11]. Для ион-дипольного взаимодействия, к которому может быть отнесен гидролиз гликозидной связи, эта зависимость описывается уравнением $\lg {{k}_{\varepsilon }}$ = $\lg {{k}_{{\varepsilon = \infty }}}$ + + [Z]eμ/kTr≠ε, где ${{k}_{{\varepsilon = \infty }}}$ – константа скорости при бесконечно большом значении ε; Z – число единиц заряда иона; е – заряд электрона; μ – дипольный момент воды; k – постоянная Больцмана; Т – температура; r≠ – расстояние максимального сближения реагирующих частиц в лимитирующем акте реакции (радиус активированного комплекса). В соответствии с данным уравнением, положительный наклон зависимостей подтверждает участие в лимитирующей стадии гидролиза положительного иона во всем диапазоне составов смесей, что указывает на отсутствие влияния растворителя на механизм реакции.
Смешивание органических растворителей с водой, очевидно, приводит к изменению сил межмолекулярного взаимодействия в смеси. В отличие от индивидуальных компонентов таких смесей изменяется структурированность жидкостей, обусловленная преобразованием водородных связей между молекулами воды и органического компонента. Оценку сил межмолекулярных взаимодействий воды с органическими растворителями осуществляют на основе изучения энтальпий образования смешанного растворителя. Теплоты смешения для водно-органических систем определялись неоднократно [12, 13]. При этом во всем диапазоне составов смешанных растворителей имеются особые точки, в которых наблюдаются перегибы изотермы теплот смешения. Так, для водно-диоксановых смесей первая точка наблюдается при 0.12 мол. доли 1,4-диоксана, характеризующая экзотермический эффект смешения. Этот эффект объясняется упрочнением связей между молекулами воды за счет гидрофобного влияния молекул 1,4-диоксана. При 0.166 мол. доли 1,4-диоксана энтальпия смешения данных растворителей равна нулю. Максимальный эндотермический эффект смешения находится в области составов с 0.7–0.8 мол. доли 1,4-диоксана. Эндотермический эффект обусловлен наибольшим преобразованием структуры растворителя, вызванным полным разрывом водородных связей между молекулами воды и доминированием собственной структуры 1,4-диоксана, в которой отдельные молекулы воды заключены внутри кластеров, образованных органическим растворителем. Такой же вывод следует из анализа интегралов Кирквуда–Баффа для этой системы [14]. Необходимо отметить, что кластерная структура смеси диоксан–вода – одна из важных отличительных особенностей таких смесей. Эти особенности изменения структурированности смешанного растворителя находятся в полном соответствии с характером изменения скорости гидролиза дисахаридов в зависимости от содержания органического компонента в смеси. Подобные результаты получены авторами [15] при изучении влияния состава водно-ацетонового растворителя на сольволиз алкилгалогенидов (SN1-механизм).
Увеличение содержания ДМСО и уксусной кислоты не вызывает такого значительного ускорения расщепления гликозидной связи целлобиозы (в ⁓2 раза). Наблюдаемый результат, очевидно, показывает различие в структуре данных водно-органических растворителей, вызывающих специфические взаимодействия в реакционной среде.
ДМСО – протофильный растворитель, для которого характерно легкое разрушение собственной межмолекулярной структуры при смешении с протогенными веществами. Смешивание воды и ДМСО представляет собой сильно экзотермический процесс, протекающий с разрывом собственных ван-дер-ваальсовых связей данного растворителя и приводящий к созданию новых водородных связей, что влечет за собой образование новых структур с высокой степенью упорядоченности [14]. В области до 0.2 мол. доли ДМСО вода сохраняет собственную структуру, существующую за счет водородных связей. В системах с содержанием более 0.28 мол. доли ДМСО вода, главным образом, связана с двумя молекулами ДМСО с помощью новых водородных связей. Максимальные значения теплот смешения для данных смесей находятся в области 0.35 мол. доли органического компонента. Состав таких смесей примерно соответствует соотношению органический растворитель : вода 1 : 2. Молекулы ДМСО выступают акцепторами протона, образуя с водой локальные ассоциаты состава 1 : 2. В смесях вода–ДМСО выше данной области содержания ДМСО в бинарной смеси присутствуют разные структуры, с доминированием структур, характеризующихся большей долей свободных молекул воды [16]. Нами обнаружено повышение скорости гидролиза целлобиозы также при Xs(ДМСО) выше указанного значения.
Скорость кислотного гидролиза дисахарида в смесях воды с уксусной кислотой меньше, чем в случае водно-апротонных сред, что обусловлено использованием в качестве катализатора H2SO4, каталитическая активность которой ниже, чем активность HCl [17]. В водных растворах уксусной кислоты наблюдается, как и в случае протофильного растворителя ДМСО, аналогичное изменение скорости реакции с возрастанием концентрации уксусной кислоты (рис. 1). Скорость реакции гидролиза целлобиозы при добавке к воде уксусной кислоты первоначально незначительно снижается, достигая минимального значения в области Хs = 0.02 мол. доли, затем до содержания уксусной кислоты 0.22 мол. доли скорость реакции остается приблизительно постоянной, после чего реакция ускоряется, однако не так существенно, как в случае смесей с 1,4-диоксаном и ацетоном. Однако известно, что уксусная кислота влияет на структуру воды незначительно. C учетом общепринятого механизма гидролиза гликозидной связи можно предположить, что уксусная кислота, как ионизирующий растворитель, оказывает благоприятное влияние на скорость лимитирующей стадии – гетеролиз гликозидной связи и, тем самым, способствует ускорению реакции.
В кислотно-каталитических реакциях немаловажное значение имеет активность катализатора. Как растворитель вода способна влиять на кислотно-основные свойства и реакционную способность растворенных в них соединений. Варьирование состава растворителя приводит к изменению степени сольватации ионов катализирующей кислоты, что увеличивает либо уменьшает ее протонодонорную способность. Поскольку для рассматриваемого нами гидролиза гликозидной связи в лимитирующей стадии принимает участие протонированная форма субстрата, то скорость реакции будет зависеть от ее концентрации.
Как протонодонорный растворитель вода обладает большой способностью сольватировать катионы (ионы водорода) за счет образования водородных связей. Апротонные растворители, разрушая структурированность воды, снижают степень сольватации ионов водорода. Благодаря этому активность ионов водорода возрастает в смесях воды с апротонными растворителями, что и приводит к увеличению скорости реакции.
Тесная связь между сольватацией ионов водорода и их каталитической активностью подтверждается тем фактом, что изменение константы скорости гидролиза дисахаридов от содержания диоксана хорошо согласуется с данными работы [18], в которой показано, что первые порции диоксана резко уменьшают свободную энтальпию сольватации ионов водорода (HCl) вплоть до ХS = = 0.15 мол. доли. Далее это изменение происходит более плавно, и только после достижения 0.32 мол. доли энтальпия снова снижается. Характер зависимости k = f(ХS) для смеси ДМСО–вода также находится в соответствии с изменением коэффициента активности ионов водорода (HCl) в этой системе [19]. Коэффициент активности сначала увеличивается очень медленно при добавлении ДМСО и только после ХS = 0.3 мол. доли наблюдается увеличение коэффициента активности. Эти данные коррелируют с приведенными выше значениями концентраций диоксана и ДМСО, при которых происходят изменения структурированности смешанного растворителя.
Для оценки эффектов среды на гидролиз гликозидов нами также получены зависимости $\ln k$ от Xs (рис. 4). Анализ полученных зависимостей позволяет сделать вывод о том, что наиболее выраженный характер влияния специфической сольватации имеет место при использовании ДМСО, ацетона и уксусной кислоты, так как в этих случаях наблюдаются заметные отклонения от линейности. Напротив, линейность зависимостей $\ln k$ = f(Xs) для гидролиза целлобиозы и лактозы в смесях воды и 1,4-диоксана указывает на большее преобладание неспецифических (электростатических) взаимодействий при осуществлении гидролиза гликозидных связей дисахаридов.
Рис. 4.
Зависимость $\ln k$ от Xs для гидролиза дисахаридов: 1 – целлобиоза, вода–диоксан; 2 – целлобиоза, вода–ДМСО; 3 – целлобиоза, вода–уксусная кислота; 4 – целлобиоза, вода–ацетон, 5 – лактоза, вода–диоксан.
Кроме того, нами обнаружена линейная корреляция между логарифмом константы скорости кислотного гидролиза целлобиозы в смеси вода–диоксан и в смесях вода–ДМСО, вода–ацетон и вода–уксусная кислота при одинаковом содержании воды (рис. 5). Соблюдение такой зависимости указывает на единый механизм гидролиза гликозидной связи дисахарада в исследованном диапазоне состава смешанных растворителях – SN1-механизм.
Рис. 5.
Зависимости $\ln {{k}_{{{\text{(диоксан)}}}}}$ = = f($\lg {{k}_{{({\text{ДМСО, ацетон, уксусная кислота}})}}}$) для кислотного гидролиза целлобиозы в водно-органических средах переменного состава: 1 – ДМСО; 2 – уксусная кислота; 3 – ацетон.

На основании кинетических измерений для различных составов смешанных растворителей и различных температур рассчитаны термодинамические активационные параметры изученных реакций кислотно-катализируемого гидролиза дисахарида целлобиозы – энтальпии и энтропии активации в воде и в смесях воды с органическим компонентом в соотношении 1 : 9 (табл. 1).
Таблица 1.
Термодинамические активационные параметры реакций кислотно-каталитического гидролиза дисахаридов (XS – концентрация органического растворителя
| Дисахарид | Органический растворитель | XS, мол. доли | ΔЕ≠, кДж/моль | ΔS≠, кДж/(моль K) |
|---|---|---|---|---|
| 1 | Вода | 0 | 137 | 44 |
| Диоксан (0.2 н. HCl) | 0.64 | 133 | 36 | |
| ДМСО (0.2 н. HCl) | 0.7 | 133 | 37 | |
| Уксусная кислота (0.1 н. H2SO4) | 0.75 | 133 | 27 | |
| Ацетон (0.2 н. HCl) | 0.69 | 123 | 41 | |
| 2 | Диоксан (0.2 н. HCl) | 0.64 | 133 | 56 |
Полученные значения термодинамических параметров реакции кислотного гидролиза целлобиозы позволяют сделать вывод о механизме исследуемой реакции в смешанных растворителях. В смесях вода–апротонный растворитель и в смесях с уксусной кислотой получены сравнимые значения энтальпии и энтропии активации. Для данной реакции ΔS≠ > 0 как при гидролизе в воде, так и при гидролизе в водно-органических средах. Это свидетельствует о том, что добавка органического растворителя не вызывает изменения механизма реакции гидролиза гликозидной связи. Полученные значения энергии активации гидролиза гликозидной связи дисахаридов согласуются с результатами определения энергии активации кислотного гидролиза полисахарида целлюлозы с использованием в качестве катализатора серной кислоты [4].
Список литературы
Книрель Ю.А., Науменко О.И., Севченкова С.Н. и др. // Успехи химии. 2019. Т. 88. Вып. 4. С. 406. = label:RUSSIFNhttps://doi.org/10.1070/RCR4856?locant
Кучина Ю.А., Дубровин С.Ю., Коновалова И.Н. // Рыбное хоз-во. 2009. № 4. С. 115.
Бочков А.Ф., Афанасьев В.А., Заиков Г.Е. Образование и расщепление гликозидных связей. М.: Наука, 1978. 180 с.
Корольков И.И. Перколяционный гидролиз растительного сырья. М.: Изд-во “Лесн. пром-сть”. 1990. 272 с.
Барбаш В.А. // Энерготехнологии и ресурсосбережение. 2012. № 1. С. 27.
Гермер Э.И. // Лесной журнал. 2003. № 4. С. 99.
Синицын А.П., Синицына О.А. // Успехи биол. химии. 2021. Т. 61. С. 347.
Селиверстова Т.С., Кушнер М.А., Матусевич Л.Г. // Журн. физ. химии. 2020. Т. 94. № 2. С. 230. https://doi.org/10.31857/S0044453720020314
Денеш И. Титрование в неводных средах. М.: Мир, 1971. 413 с.
Усов А.И., Яроцкий С.В. // Изв. АН СССР. Сер. хим. 1974. № 4. С. 877.
Амис Э.А. Влияние растворителя на скорость и механизм химических реакций. М.: Мир, 1968. 328 с.
Богачев Н.А., Любичев Д.А., Никольский А.Б. и др. // Журн. общ. химии. 2018. Т. 88. № 1. С. 3.
Suzuki T., Fujisawa M., Takagi S. et al. // J. Thermal Analysis and Calorimetry. 2006. V. 85. № 3. P. 545.https://doi.org/10.1007/s10973-006-7658-3
Guang Y., Masaaki W., Toshiyuki T. // J. Mol. Liq. 2001. V. 94. P. 273. https. //doi: https://doi.org/10.1016/S0167-7322(01)00275-6
Bunton C.A., Mhalo M.M., Moffatt J.N. // J. Org. Chem. 1984. V. 49. P. 3639.
Верстаков Е.С., Коробкова С.А., Носаева Т.А. // Журн. физ. химии. 2020. T. 94. № 4. С. 564.
Wong D.B., Sokolowsky K.P., El-Barghouthi M.I. et al. // J. Phys. Chem. B. 2012. V. 116. P. 5479. https://doi.org/10.1021/jp301967e
Бакирова Г.А. // Изв. НАН КР. 2010. № 2. С. 108.
Гринева Н.Ф. Термодинамика хлористого водорода и его кислотность в смесях диоксана с водой: Автореф. дис. … канд. хим. наук. Харьков, 1974, 22 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии