Физиология растений, 2019, T. 66, № 1, стр. 73-80
Функциональная активность фотосинтетического аппарата табака и арабидопсиса при воздействии на растения низкой положительной температурой
В. Н. Попов a, О. В. Антипина a, А. А. Селиванов a, З. Ф. Рахманкулова a, А. Н. Дерябин a
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
Поступила в редакцию 26.09.2017
После доработки 24.10.2017
Принята к публикации 04.12.2017
Аннотация
Изучали активность фотосинтетического аппарата (ФА) теплолюбивого табака (Nicotiana tabacum L., сортотип Samsun) и холодостойкого арабидопсиса (Arabidopsis thaliana Heynh. (L.) экотип Columbia) при воздействии на молодые растения пониженной температурой. Определение функциональных показателей проводили после 1 и 6 суток экспозиции табака и арабидопсиса при 8 и 2°С, соответственно. У табака наблюдали снижение содержания хлорофиллов на 30%, максимального квантового выхода флуоресценции Хл а ФС II (Fv/Fm) на 5% и интенсивности видимого фотосинтеза (ИФ) почти в 2 раза к концу опыта. При этом концентрация растворимых сахаров в листьях табака увеличивалась на 30% и составила около 130 мг/г (сухой массы). В отличие от табака, содержание и соотношение фотосинтетических пигментов, величина Fv/Fm у арабидопсиса изменялись незначительно, а ИФ снижалась в меньшей степени (в 1.6 раза). Содержание сахаров в листьях арабидопсиса к концу низкотемпературного воздействия возрастало в 4 раза и достигало 90 мг/г. Таким образом, установлены различия в реакции ФА теплолюбивых и холодостойких растений на действие низких положительных температур. Полученные данные свидетельствуют о хорошей сохранности ФА арабидопсиса и его способности эффективно функционировать при закаливающей температуре. Процессы, протекающие в тилакоидах, и реакции фотосинтетического метаболизма углерода в листьях теплолюбивого табака более чувствительны к пониженной температуре и изменяются более или менее согласованно, что, по-видимому, может способствовать предотвращению избыточной генерации активных форм кислорода в хлоропластах.
ВВЕДЕНИЕ
В естественных условиях произрастания растения периодически подвергаются действию неблагоприятных факторов окружающей среды. Низкая температура относится к числу наиболее распространенных стресс-факторов, оказывающих повреждающее воздействие на растительный организм [1]. Выживаемость растений в таких условиях определяется их способностью к низкотемпературному закаливанию, в результате которого происходит повышение устойчивости к низким температурам [2]. Механизмы формирования низкотемпературной устойчивости существенно различаются у разных видов растений. Теплолюбивые растения могут повреждаться уже низкими положительными температурами и обладают ограниченной возможностью повышать свою холодоустойчивость [3]. Напротив, холодостойкие растения имеют более высокую конститутивную устойчивость к холоду, которую они способны значительно увеличивать в процессе низкотемпературного закаливания [4].
Сохранение фотосинтеза при низких положительных температурах является важным фактором холодового закаливания и последующего выживания растений при низких повреждающих температурах [5]. Считается, что у чувствительных к холоду растений именно фотосинтез подавляется в первую очередь [6]. У холодостойких растений интенсивность фотосинтеза при температурах близких к нулю значительно превышает интенсивность дыхания, что приводит к накоплению большого количества сахаров в их клетках. Сахара являются основным источником энергии и предшественниками при синтезе веществ с защитным эффектом, происходящим в период закаливания при низких положительных температурах. Обеспечение сахарами всех органов и тканей растения является важнейшим условием для успешного закаливания целого растения к гипотермии [7]. Поэтому целью нашей работы было сравнительное исследование особенностей функционирования фотосинтетического аппарата теплолюбивых (табак) и холодостойких (арабидопсис) растений в условиях низкотемпературного закаливания.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлись теплолюбивые растения табака (Nicotiana tabacum L., сортотип Samsun) и холодостойкие растения арабидопсиса (Arabidopsis thaliana Heynh. (L.) экотип Columbia). Растения выращивали в почвенной культуре в камерах фитотрона ИФР РАН при следующих условиях: табак – температура +22°С, 16-часовой фотопериод и освещенность 100 мкмоль/(м2 с), арабидопсис – температура +22°С, 8-часовой фотопериод и освещенность 100 мкмоль/(м2 с). Выбор 8-часового режима светового дня для арабидопсиса обусловлен тем, что он относится к длиннодневным растениям и при использовании короткого дня достигает необходимой для исследований биомассы розетки, не переходя в фазу цветения. Для опытов использовали растения в фазе вегетативного роста в возрасте шести недель. Растения табака имели 6–7 листьев, при высоте стебля 8–10 см, арабидопсиса – хорошо развитую прикорневую розетку листьев. Для исследований отбирали листья среднего яруса. Закаливание растений проводили в климатической камере KBW-240 (“Binder”, Германия) при следующих условиях: табак – температура +8°С, 16-часовой фотопериод и освещенность 100 мкмоль/(м2 с), арабидопсис – температура +2°С, 8-часовой фотопериод и освещенность 100 мкмоль/(м2 с). Данные режимы закаливания были подобраны в ходе предварительных опытов. Выбор температуры закаливания табака (+8°С) и арабидопсиса (+2°С) определялся, с одной стороны, необходимостью прекратить ростовые процессы у растений, что является важным условием эффективного закаливания, а с другой стороны, необходимостью сохранить функциональную активность фотосинтетического аппарата исследуемых растений. В качестве контроля использовали растения, не подвергнутые воздействию закаливающей температуры.
Фотосинтетические пигменты экстрагировали 80% ацетоном из навески 50–100 мг листьев растений. Содержание хлорофиллов а, b и каротиноидов определяли спектрофотометрически при помощи прибора Genesys 10 UV (“Termo Electron Corporation”, США) по методу Lichtenthaler [8] и выражали в мг/г сухой массы.
Изучение СО2-газообмена проводили на установке открытого типа с инфракрасным газоанализатором URAS 2T (Германия) при температурах +22°С (контроль) и +2°С (закаленные растения арабидопсиса) и +8°С (закаленные растения табака), то есть при температурах идентичных температурам вегетации и холодового закаливания. Измерение газообмена включало определение скорости видимой ассимиляции СО2, которую выражали в мг СО2/г сухой массы в час [9].
Регистрацию флуоресценции хлорофилла проводили с помощью РАМ флуориметра (РАМ 101, “Walz”, Германия). Измеряемым показателем был Fv/Fm – максимальный квантовый выход флуоресценции Хл а ФС II [10].
Для определения содержания сахаров в листьях арабидопсиса и табака навески последних (~500 мг) фиксировали 96% кипящим этанолом. Ткань растирали в фарфоровой ступке и сахара извлекали трехкратной экстракцией 80% этанолом. В полученных экстрактах определяли содержание глюкозы – глюкозооксидазным методом, сахарозы и фруктозы – по методу Рое [11].
Во всех экспериментах биологическая повторность измерений была 6-кратной, аналитическая – 3–4-кратной. Каждый эксперимент повторяли не менее 3–4 раз. Результаты экспериментов обработаны статистически. В таблицах и на гистограммах представлены средние значения, рассчитанные по результатам всех проведенных экспериментов и их стандартные ошибки. Надстрочные символы обозначают достоверность различий средних значений при р ≤ 0.05 с использованием t-критерия Стьюдента [12].
РЕЗУЛЬТАТЫ
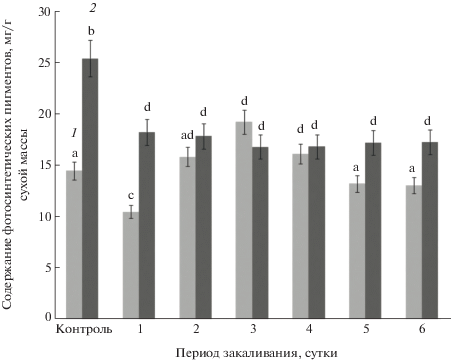
Результаты исследования динамики содержания хлорофиллов а, b и каротиноидов в листьях исследуемых растений при низкотемпературном закаливании представлены в табл. 1 и 2. До начала закаливания растения табака отличались от арабидопсиса почти в два раза большим содержанием пигментов (рис. 1), как за счет повышенного содержания хлорофиллов, так и каротиноидов. В процессе закаливания у растений табака, наблюдалось резкое снижение содержания фотосинтетических пигментов (почти на 30%) уже после первых суток холодовой экспозиции. В дальнейшем содержание пигментов у табака оставалось практически стабильным до конца периода закаливания. У арабидопсиса после резкого снижения в течение первых суток, наблюдался значительный рост содержания пигментов, который достигал максимума к третьим суткам закаливания. После этого к шестым суткам периода закаливания, содержание пигментов уменьшалось до уровня контрольных значений. Поскольку наиболее значительные изменения в содержании фотосинтетических пигментов были обнаружены в течение первых суток закаливания, то для исследования других физиологических параметров были использованы растения после первых суток и в конце периода закаливания.
Таблица 1.
Изменение содержания фотосинтетических пигментов в листьях растений табака в динамике низкотемпературного закаливания (мг/г сухой массы)
| Период закаливания, сут |
Хл а | Хл b | Кар | Отношение Хл а/Хл b |
Отношение Хл/Кар |
|---|---|---|---|---|---|
| Контроль | 16.87 ± 1.05a | 4.97 ± 0.55a | 3.51 ± 0.36a | 3.39 | 6.22 |
| 1 | 12.04 ± 1.12b | 3.60 ± 0.45b | 2.53 ± 0.25b | 3.34 | 6.18 |
| 2 | 11.83 ± 0.93b | 3.59 ± 0.46b | 2.39 ± 0.18b | 3.29 | 6.45 |
| 3 | 10.91 ± 0.96b | 3.38 ± 0.36b | 2.46 ± 0.20b | 3.22 | 5.80 |
| 4 | 10.93 ± 0.72b | 3.40 ± 0.29b | 2.45 ± 0.17b | 3.21 | 5.84 |
| 5 | 11.26 ± 0.81b | 3.45 ± 0.30b | 2.44 ± 0.15b | 3.26 | 6.02 |
| 6 | 11.33 ± 0.73b | 3.31 ± 0.34b | 2.60 ± 0.16b | 3.42 | 5.63 |
Таблица 2.
Изменение содержания фотосинтетических пигментов в листьях растений арабидопсиса в динамике низкотемпературного закаливания (мг/г сухой массы)
| Период закаливания, сут |
Хл а | Хл b | Кар | Отношение Хл а/Хл b |
Отношение Хл/Кар |
|---|---|---|---|---|---|
| Контроль | 9.32 ± 0.55a | 2.92 ± 0.25a | 2.20 ± 0.11a | 3.19 | 5.56 |
| 1 | 6.70 ± 0.44b | 2.23 ± 0.15b | 1.52 ± 0.15b | 3.0 | 5.87 |
| 2 | 10.13 ± 0.53a | 3.50 ± 0.36ac | 2.24 ± 0.17a | 2.89 | 6.08 |
| 3 | 12.25 ± 0.65c | 4.10 ± 0.28c | 2.84 ± 0.12c | 2.98 | 5.75 |
| 4 | 10.30 ± 0.42a | 3.43 ± 0.26a | 2.35 ± 0.14a | 3.0 | 5.84 |
| 5 | 8.51 ± 0.52a | 2.75 ± 0.30a | 1.91 ± 0.15a | 3.09 | 5.89 |
| 6 | 8.45 ± 0.63a | 2.64 ± 0.19a | 1.92 ± 0.13a | 3.20 | 5.77 |
Рис. 1.
Изменение суммарного содержания фотосинтетических пигментов (хлорофилл а, хлорофилл b, каротиноиды) в динамике низкотемпературного закаливания растений арабидопсиса (1) и табака (2). Достоверные различия средних значений при р ≤ 0.05 отмечены разными латинскими буквами над барами.
При закаливании растений арабидопсиса и табака наблюдались существенные изменения интенсивности фотосинтеза. Из данных, представленных на рис. 2, видно, что показатели интенсивности видимого фотосинтеза у исследованных растений за время закаливания снижались, но в разной степени. У табака интенсивность фотосинтеза снижалась в два раза уже к первым суткам холодовой экспозиции и сохранялась на этом уровне к шестым суткам закаливания. У арабидопсиса показатели видимого фотосинтеза в первые сутки охлаждения снижались почти в два раза и имели тенденцию к росту к концу периода закаливания.
Рис. 2.
Изменение интенсивности видимого фотосинтеза при низкотемпературном закаливании растений арабидопсиса (1) и табака (2). Достоверные различия средних значений при р ≤ 0.05 отмечены разными латинскими буквами над барами.

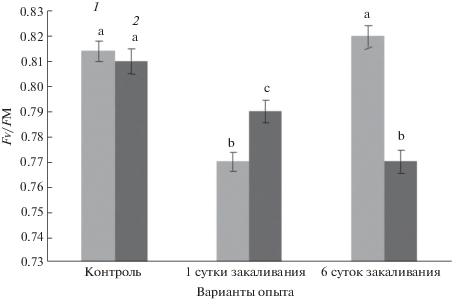
Результаты измерений флуоресценции хлорофилла представлены на рис. 3. Растения арабидопсиса и табака до закаливания практически не отличались по параметру Fv/Fm. У табака регистрировали существенное снижение значения максимального квантового выхода ФС II на первые и шестые сутки периода закаливания. У арабидопсиса отмечалось снижение показателя Fv/Fm после первых суток охлаждения и его восстановление до контрольного уровня в конце закаливания.
Рис. 3.
Изменение максимального квантового выхода ФС II при низкотемпературном закаливании растений арабидопсиса (1) и табака (2). Достоверные различия средних значений при р ≤ 0.05 отмечены разными латинскими буквами над барами.
На рис. 4 и 5 приведены результаты определения содержания сахаров в листьях растений табака и арабидопсиса в процессе закаливания. У табака имело место увеличение суммарного содержания растворимых сахаров на 30% только на шестые сутки закаливания, в основном за счет накопления сахарозы. У арабидопсиса заметный рост содержания сахарозы отмечался уже в первые сутки охлаждения, а на шестые сутки периода закаливания содержание сахаров более чем в 4 раза превышало уровень незакаленных растений за счет накопления всех форм сахаров.
ОБСУЖДЕНИЕ
Низкотемпературная устойчивость растений во многом зависит от возможности функционирования процесса фотосинтеза, который является поставщиком ассимилятов необходимых, как для жизнедеятельности растений при оптимальной температуре вегетации, так и для перестройки метаболизма клеток при адаптации к низким температурам [13]. Состав и содержание фотосинтетических пигментов является одним из информативных показателей, характеризующих состояние фотосинтетического аппарата растений [14].
Проведенные эксперименты позволили обнаружить значительные различия в динамике содержания фотосинтетических пигментов у растений табака и арабидопсиса при пониженных температурах. Табак демонстрировал стабильное снижение содержания всех пигментов (хлорофиллов а и b, каротиноидов). При этом отношения Хл а/Хл b и Хл/Кар оставались стабильными в течение всего периода закаливания. Известно, что снижение суммарного содержания хлорофилла, не сопровождаемое значительным изменением отношения Хл а/Хл b, можно рассматривать как защитный механизм, который обеспечивает уменьшение числа поглощаемых фотонов и снижает нагрузку на электронтранспортную цепь (ЭТЦ) хлоропласта [15]. Изменение содержания хлорофиллов и каротиноидов у арабидопсиса за время закаливания носило более сложный характер. После резких колебаний в начальный период закаливания, содержание фотосинтетических пигментов возвращалось на уровень контрольных значений. Отношения Хл а/Хл b и Хл/Кар у арабидопсиса, как и у табака, не претерпевали значительных изменений. Известно, что каротиноиды выполняют важную роль в защите фотосинтетического аппарата от деструктивного действия активных форм кислорода, продукция которых резко возрастает в условиях стресса [16]. Поэтому накопление каротиноидов является типичной реакцией растений на действие неблагоприятных факторов окружающей среды [17, 18]. Однако, в ходе наших экспериментов не было обнаружено ни увеличения доли каротиноидов в составе фотосинтетических пигментов, ни значительных изменений отношения Хл/Кар у обоих видов исследованных растений. Это дает возможность предположить отсутствие повреждения фотосинтетического аппарата растений во время закаливания. Выявленные нами различия в динамике содержания фотосинтетических пигментов в листьях табака и арабидопсиса должны были оказывать существенное влияние на функционирование процесса фотосинтеза в условиях длительного действия низких температур.
Для характеристики процесса фотосинтеза в целом мы использовали такой параметр, как скорость видимой ассимиляции СО2. Наши эксперименты показали, что растения табака и арабидопсиса при температурах холодового закаливания были способны сохранять фотосинтетическую активность, хотя интенсивность видимого фотосинтеза у них снижалась почти в 2 раза, по сравнению с контролем, уже в первые сутки закаливания. Столь резкое и сильное уменьшение интенсивности фотосинтеза может быть связано со снижением активности ключевых ферментов цикла Кальвина [19] и ингибированием флоэмного транспорта [20], поскольку эти процессы очень чувствительны к снижению температуры. Тем не менее, к концу периода закаливания интенсивность фотосинтеза у арабидопсиса несколько возрастала, в отличие от табака, что указывает на повышенный адаптационный потенциал фотосинтетического аппарата A. thaliana.
Об эффективности световых реакций фотосинтеза судили по флуоресценции хлорофилла, которая представляет собой индикатор скорости переноса электронов на световом этапе фотосинтеза [21]. В наших экспериментах значения максимального квантового выхода ФС II на первые и шестые сутки периода закаливания в целом повторяли динамику изменений интенсивности фотосинтеза, что подтверждает тесную связь между эффективностью световых реакций фотосинтеза и ферментативными реакциями фиксации СО2 [22]. Считается, что значения Fv/Fm на уровне 0.81–0.83 характерны для полноценно функционирующей ФС II в оптимальных для вегетации условиях, а при стрессе наблюдается снижение показателя Fv/Fm [23]. У табака при низкотемпературном закаливании показатели Fv/Fm были ниже оптимального уровня, что указывает на снижение эффективности ФС II. У арабидопсиса значения максимального квантового выхода ФС II к шестым суткам закаливания возвращались к уровню контроля, что свидетельствует о высоком адаптационном потенциале световых реакций фотосинтеза данного вида растений.
Известно, что образующиеся в процессе ассимиляции СО2 продукты фотосинтеза экспортируются из стромы хлоропластов в виде триозофосфатов в цитозоль, где и происходит синтез сахарозы [24]. Проведенные нами эксперименты показали, что к концу периода закаливания в листьях арабидопсиса количество растворимых сахаров увеличивалось более чем в 4 раза, а в листьях табака только на 30%. Следует отметить, что ранее нами были получены данные, свидетельствующие о высокой эффективности закаливания растений арабидопсиса, которые в закаленном состоянии были способны выживать при температуре до –6°С [25]. В то же время, была показана способность закаленных растений табака выдерживать низкие температуры вплоть до 0°С и неспособность переносить отрицательные температуры [26]. Можно предположить, что значительно более высокая эффективность закаливания арабидопсиса по сравнению с табаком может быть связана с различиями в накоплении сахаров, а следовательно, и с эффективностью фотосинтетического аппарата этих растений в условиях низких температур.
Таким образом, можно констатировать, что теплолюбивые растения табака и холодостойкие растения арабидопсиса демонстрировали разные стратегии адаптации к действию низких температур. Табак реагировал на закаливающие температуры значительным снижением содержания фотосинтетических пигментов, уменьшением эффективности ФС II и интенсивности видимого фотосинтеза. Известно, что в условиях гипотермии скорость переноса электронов может быть избыточной по сравнению со скоростью ферментативных реакций цикла Кальвина. Это может приводить к перевосстановлению электронтранспортной цепи хлоропластов и провоцировать значительный рост скорости генерации активных форм кислорода [27, 28]. Поскольку ранее нами было установлено, что закаливание растений табака сопровождалось почти двукратным уменьшением скорости генерации супероксидного анион-радикала и 30% снижением содержания перекиси водорода и малонового диальдегида [29], то можно предположить, что наблюдаемые нами реакции фотосинтетического аппарата растений табака, по-видимому, направлены на предотвращение перевосстановления ЭТЦ хлоропластов и, соответственно, на недопущение чрезмерной генерации активных форм кислорода и защиту растений от развития окислительного стресса.
Ранее было показано, что растения арабидопсиса способны эффективно противостоять повреждающему действию окислительного стресса в условиях низких положительных температур [30]. Поэтому, в отличие от теплолюбивого табака, стратегия низкотемпературной адаптации холодостойких растений арабидопсиса направлена, по-видимому, на поддержание функциональной активности фотосинтетического аппарата в условиях низких температур. Это служит предпосылкой для значительного накопления ассимилятов, обеспечивающих комплекс адаптивных перестроек метаболизма, благодаря которым растения арабидопсиса способны демонстрировать более высокую эффективность закаливания по сравнению с табаком.
Список литературы
Theocharis A., Clement C., Barka E.A. Physiological and molecular changes in plants grown at low temperatures // Planta. 2012. V. 235. P. 1091–1105.
Трунова Т.И. 64-е Тимирязевское чтение. Растение и низкотемпературный стресс. М.: Наука, 2007. 54 с.
Fortunato A.S., Lidon F.C., Batista-Santos P., Leitao A.E., Pais I.P., Ribeiro A.I., Ramalho J.C. Biochemical and molecular characterization of the antioxidative system of Coffea sp. under cold conditions in genotypes with contrasting tolerance // Journal of Plant Physiology. 2010. V. 160. P. 333–342.
Hasdai M., Weiss B., Levi A., Samach A., Porat R. Differential responses of Arabidopsis ecotypes to cold, chilling and freezing temperatures // Annals of Applied Biology. 2006. V. 148. P. 113–120.
Марковская Е.Ф., Сысоева М.И., Шерудило Е.Г. Феномен ежесуточного кратковременного влияния низких закаливающих температур на жизнедеятельность растений // Онтогенез. 2008. Т. 39. С. 323–332.
Климов С.В., Попов В.Н., Дубинина И.М., Бураханова Е.А., Трунова Т.И. Пониженная холодостойкость теплолюбивых растений связана с ингибированием ассимиляции СО2 в листьях и накопления сахаров в корнях // Физиология растений. 2002. Т. 49. С. 871–877.
Климов С.В., Дубинина И.М., Бураханова Е.А., Астахова Н.В., Попов В.Н., Алиева Г.П., Трунова Т.И. Связь СО2-газообмена с накоплением сахаров и активностью инвертаз при холодовом закаливании озимой пшеницы // Доклады Академии наук. 2004. Т. 398. С. 135–138.
Lichtenthaler H.K. Chlorophylls and carotenoids – pigments of photosynthetic biomembranes // Methods Enzymol. 1987. V. 148. P. 350–382.
Климов С.В. Холодовое закаливание растений – результат поддержания повышенного отношения фотосинтез/дыхание при низких температурах // Известия РАН. Серия биологическая. 2003. Т. 30. С. 57–62.
Рахманкулова З.Ф., Шуйская Е.В., Суюндуков Я.Т., Усманов И.Ю., Воронин П.Ю. Различия в устойчивости к осмотическому и ионному фактору солевого стресса двух экотипов С3–С4 ксерогалофита Bassia sedoides // Физиология растений. 2016. Т. 63. С. 372–381.
Туркина М.В., Соколова С.В. Методы определения моносахаридов и олигосахаридов // Биохимические методы в физиологии растений / Под ред. Павлиновой О.А. М.: Наука, 1971. С. 7–34.
Доспехов Б.А. Методика опытного дела. М.: Колос, 1977. 416 с.
Климов С.В., Трунова Т.И., Мокроносов А.Т. Механизм адаптации растений к неблагоприятным условиям окружающей среды через изменение донорно-акцепторных отношений // Физиология растений. 1990. Т. 37. С. 1024–1035.
Lichtenthaler H. K., Ac A., Marek M.V., Kalina J., Urban O. Differences in pigment composition, photosynthetic rates and chlorophyll fluorescence images of sun and shade leaves of four tree species // Plant Physiol. Biochem. 2007. V. 45. P. 577–588.
Лепедуш Х., Вильевач М., Цезар В., Любешич Н. Оценка функционального состояния фотосинтетического аппарата у хвои ели с признаками хлороза на слабом и сильном свету по изменениям флуоресценции хлорофилла in vivo // Физиология растений. 2005. Т. 52. С. 191–197.
Siefferman-Harms D. The Light-harvesting and protecting functions of carotenoids in photosynthetic membranes // Physiol. Plant. 1987. V. 69. P. 561–568.
Demming-Adams B., Adams W.W. Photoprotection and other responses of plants to high light stress // Annu. Rev. Plant Physiol. Plant Mol. Biol. 1992. V. 43. P. 599–626.
Сариева Г.Е., Кенжебаева С.С., Лихтенталер Х.К. Адаптационный потенциал фотосинтеза у сортов пшеницы с признаком “свернутый лист” при действии высокой температуры // Физиология растений. 2010. Т. 57. С. 32–41.
Du Y.C., Nose A., Wasano K. Effects of chilling temperature on photosynthetic rates, photosynthetic enzyme activities and metabolite levels in leaves of three sugarcane species // Plant, Cell and Environment. 1999. V. 22. P. 317–324.
Sowinski P., Rudzinska-Langwald A., Kobus P. Changes in plasmodesmata frequency in vascular bundles of maize seedling leaf induced by growth at sub-optimal temperatures in relation to photosynthesis and assimilate export // Environmental and experimental botany. 2003. V. 50. P. 183–196.
Климов С.В. Биоэнергетические аспекты адаптации и устойчивости зимующих злаков к морозу // Успехи современной биологии. 1987. Т. 104. С. 251–267.
Krall J.P., Edwards G.E. Relationship between photosystem II activity and CO2 fixation in leaves // Physiol. Plant. 1992. V. 86. P. 180–187.
Baker N.R. Chlorophyll fluorescence: A probe of photosynthesis in vivo // Annu. Rev. Plant Biol. 2008. V. 59. P. 89–113.
Winter H., Huber S.C. Regulation of sucrose metabolism in higher plants: localization and regulation of activity of key enzymes // Crit. Rev. Plant Sci. 2000. V. 19. P. 31–67.
Астахова Н.В., Попов В.Н., Селиванов А.А., Бураханова Е.А., Алиева Г.П., Мошков И.Е. Реорганизация ультраструктуры хлоропластов при низкотемпературном закаливании растений // Физиология растений. 2014. Т. 61. С. 790–797.
Попов В.Н., Антипина О.В., Трунова Т.И. Перекисное окисление липидов при низкотемпературной адаптации листьев и корней теплолюбивых растений табака // Физиология растений. 2010. Т. 57. С. 153–156.
Foyer C.H., Vanacker H., Gomez L.D., Harbinson J. Regulation of photosynthesis and antioxidant metabolism in maize leaves at optimal and chilling temperatures: review // Plant Physiol. Biochem. 2002. V. 40. P. 659–668.
Foyer C.H., Noctor G. Redox regulation in photosynthetic organisms: signaling, acclimation and practical implications // Antioxid. Redox Signal. 2009. V. 11. P. 861–905.
Попов В.Н., Антипина О.В., Астахова Н.В. Изменения ультраструктуры хлоропластов растений табака в процессе защиты от окислительного стресса при гипотермии // Физиология растений. 2016. Т. 63. С. 319–326.
Синькевич М.С., Селиванов А.А., Антипина О.В., Кропочева Е.В., Алиева Г.П., Суворова Т.А., Астахова Н.В., Мошков И.Е. Активность антиоксидантных ферментов у растений Arabidopsis thaliana при закаливании к гипотермии // Физиология растений. 2016. Т. 63. С. 777–782.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений




