Физиология растений, 2019, T. 66, № 2, стр. 137-145
Морфогенетические и физиолого-биохимические особенности Lavandula angustifolia при длительном микроразмножении in vitro
Н. А. Егорова a, b, И. В. Митрофанова a, В. А. Браилко a, О. А. Гребенникова a, А. Е. Палий a, И. В. Ставцева b
a едеральное государственное бюджетное учреждение науки “Ордена Трудового Красного Знамени
Никитский ботанический сад – Национальный научный центр РАН”
Ялта, Россия
b Федеральное государственное бюджетное учреждение науки “Научно-исследовательский институт
сельского хозяйства Крыма”
Симферополь, Россия
Поступила в редакцию 09.01.2018
После доработки 07.03.2018
Принята к публикации 05.04.2018
Аннотация
Представлены данные об особенностях морфогенеза и некоторых физиолого-биохимических параметрах эксплантов лаванды узколистной (Lavandula angustifolia Mill.) пяти сортов при длительном микроразмножении in vitro в течение 9 пассажей. При введении в культуру меристем сортов Степная, Синева, Вдала, Ранняя и Рекорд было выявлено множественное побегообразование, при этом максимальное число микропобегов было у Синевы (5.7), а минимальное – у Ранней (3.9). При микроразмножении лаванды в течение 9 субкультивирований было показано, что у всех сортов количество побегов увеличилось к 3 субкультивированию, а затем снизилось. Максимальный коэффициент размножения (12.2) в этом пассаже был отмечен у сорта Синева, при последующих субкультивированиях этот показатель снизился до 7.4–8.6. Наименьший коэффициент размножения в 5–9 пассажах был у Рекорда (3.8–4.5). Анализ водного режима полученных при размножении in vitro микропобегов показал, что общее содержание воды составило 83–89%, на фракцию связанной и коллоидно-поглощенной воды приходилось 40–57%. Максимальные значения водоудерживающей способности обнаружены у сортов Рекорд, Ранняя и Вдала. Полученные результаты указывают на активное функционирование хлоренхимы. Установлено, что сорта Вдала и Синева отличались максимальными значениями фотосинтетической активности листьев и побегов, и имели наибольший индекс жизнеспособности. Исследованные сорта при культивировании in vitro характеризовались высоким содержанием пролина, аскорбиновой кислоты и фенольных соединений, в частности флаванолов. Максимальная концентрация пролина была отмечена у сорта Вдала (372.87 мкг/г), аскорбиновой кислоты – у сорта Синева (31.28 мг/100 г), а фенольных соединений – у сорта Ранняя (1103 мг/100 г). У культивируемых in vitro побегов выявлена высокая активность каталазы и низкая – супероксиддисмутазы и полифенолоксидазы. Максимальная активность каталазы была у сортов Вдала и Синева. Сорт Синева также выделялся высокой активностью полифенолоксидазы. Полученные данные свидетельствуют о хорошей способности к длительному микроразмножению лаванды in vitro, эффективность которого зависела от сорта и числа субкультивирований.
ВВЕДЕНИЕ
Одной из наиболее широко распространенных эфиромасличных культур, которая выращивается во многих странах мира, является лаванда. Она используется также как лекарственное, пряноароматическое, медоносное, декоративное и противоэрозийное растение. В южных регионах России и Европы в промышленном производстве преимущественно возделывается Lavandula angustifolia Mill., реже – L. latifolia Vill., L. stoechas L. и лавандин (Lavandula x intermedia Emeric ex Loisel). Растительное сырье лаванды содержит эфирное масло (до 1.5–2.5% в свежем сырье) и комплекс фенольных соединений, таких как флавоны и антоцианины. Лавандовое эфирное масло используется в парфюмерно-косметической и пищевой промышленности, в керамическом и лакокрасочном производствах, а также в медицине – как антисептическое, обезболивающее, спазмолитическое и успокаивающее средство [1].
В производстве чаще всего применяют вегетативное размножение лаванды одревесневшими или зелеными черенками, однако этот традиционный метод не позволяет получать качественный оздоровленный посадочный материал и имеет невысокий коэффициент размножения (в течение года до 67–122 черенков с куста, в зависимости от возраста растения) [2]. Однако эти проблемы могут быть преодолены с привлечением биотехнологических приемов микроразмножения in vitro. Имеются сведения об исследовании некоторых вопросов клонального микроразмножения у L. angustifolia [3–5], L. vera [6], L. officinalis [7], L. dentata [8], L. viridis [9], L. pedunculata [10], лавандина [11, 12]. В качестве эксплантов авторы чаще всего использовали меристемы пазушных и апикальных почек [5, 7, 13] или узловые сегменты [6, 9, 10]. Большинство таких работ посвящено оптимизации состава питательных сред для различных этапов размножения в изолированной культуре. В частности, лучшее развитие микропобегов и множественное побегообразование из эксплантов у L. dentata было получено при добавлении в питательную среду БАП и ИМК [13], у L. officinalis – БАП и ИУК [7], у L. viridis – БАП [9]. В то же время для L. angustifolia в одних исследованиях была показана эффективность использования тидиазурона [3], а в других – кинетина и ГК3 [4]. В ряде публикаций освещалась роль генотипа и типа экспланта в процессах микроразмножения лаванды [3, 8, 14].
Важной проблемой является процесс адаптации растений к условиям культивирования in vitro. Для изучения адаптивных возможностей регенерантов необходимы данные об особенностях функционирования антиоксидантной системы, включающей как низкомолекулярные протекторные соединения (пролин, аскорбиновая кислота, флавоноиды и др.), так и специфические ферменты-антиоксиданты (супероксиддисмутаза, каталаза, различные оксидазы, в том числе полифенолоксидаза). Не менее важными физиологическими параметрами функционального состояния растений являются фотосинтетическая активность и индекс жизнеспособности [15]. Сведения о физиолого-биохимических исследованиях процессов микроразмножения in vitro у лаванды, также как и у других видов растений, немногочисленны. Так, у лаванды узколистной и лавандина были проанализированы анатомические особенности микропобегов и листьев в условиях in vitro [16], физиологические и биохимические изменения в вегетативных органах растений in situ и при микроразмножении in vitro в связи с вирусными заболеваниями. В частности, у регенерантов in vitro было показано увеличение содержания пролина и снижение содержания аскорбиновой кислоты и фенольных соединений, а также уменьшение активности окислительно-восстановительных ферментов по сравнению с растениями in situ [12]. При изучении физиолого-биохимических показателей лаванды и лавандина было отмечено, что с увеличением длительности культивирования происходило снижение концентрации пролина, и повышение у большинства сортов суммарного содержания фенольных соединений [17]. На энзиматическом уровне в 4 пассаже по сравнению с первым выявлено снижение активности каталазы на фоне увеличения или отсутствия изменений в активности супероксиддисмутазы и значительного увеличения активности полифенолоксидазы. Сравнение двух сортов лаванды узколистной (Белянка и Рекорд) выявило их различия по накоплению у регенерантов пролина, фенольных соединений и активности некоторых ферментов, хотя некоторые показатели, в частности индекс жизнеспособности, достоверно не отличались [12, 17]. Тем не менее, спектр изученных сортов лаванды весьма ограничен и многие вопросы клонального микроразмножения, в том числе касающиеся длительного культивирования эксплантов и выявления физиолого-биохимических изменений, происходящих у культивируемых в асептических условиях регенерантов, изучены пока недостаточно. Целью данной работы было исследование процесса морфогенеза и анализ физиолого-биохимических параметров развития эксплантов у различных сортов лаванды узколистной при длительном микроразмножении в условиях in vitro.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследований служила лаванда узколистная (Lavandula angustifolia Mill.) сортов Степная, Синева, Вдала, Ранняя, Рекорд. Исходные растения выращивали в полевых условиях Предгорной зоны Крыма в научном севообороте ФГБУН “НИИСХ Крыма”. В качестве инициальных эксплантов использовали меристемы с одной парой листовых примордиев, выделенные из пазушных почек растений. При введении in vitro эксплантов, субкультивировании, приготовлении питательных сред применяли традиционные методики для работ по культуре органов и тканей [18]. Меристемы вычленяли под стереоскопическим бинокулярным микроскопом Nikon SM2745T (Япония) и культивировали на модифицированной для лаванды МС среде [4] с 1.0 мг/л кинетина и 0.5 мг/л ГК3, а микрочеренки – с 0.5 мг/л кинетина и 0.1 мг/л ГК3 (Sigma, США). При дальнейшем размножении использовали сегменты стебля с узлом (5–7 мм), полученные при микрочеренковании микропобегов. Экспланты культивировали в фитокапсулах “БИОТРОН-2016” при 24–26°С, относительной влажности воздуха 70%, освещенности 2–3 клк с 16-часовым фотопериодом. Каждые 30–35 суток проводили микрочеренкование, перед которым определяли длину и число побегов, количество узлов (пар листьев) на побеге, частоту множественного побегообразования, частоту каллусогенеза и ризогенеза. Коэффициент размножения рассчитывали как количество микрочеренков, которое можно получить за одно субкультивирование, для этого количество образующихся на экспланте побегов умножали на число узлов на побеге.
Для физиолого-биохимических исследований использовали микропобеги лаванды, полученные после шестого пассажа in vitro. Пересчет всех изученных количественных показателей был произведен на сырую массу образцов. В качестве физиологических критериев, характеризующих водный режим, были проанализированы общая оводненность листьев (определялась методом термической сушки при 105°С) и фракционный состав воды по методу Маринчика-Гусева [19]. Параметры фотосинтетической активности измеряли при помощи портативного флуориметра LPT-1/CFU (Россия), предназначенного для оценки функционального состояния фотосинтетического аппарата различных тканей и органов растений in vitro, по параметрам индукции флуоресценции хлорофилла. Флуоресценция в приборе возбуждается в синей области спектра (470 нм), регистрируется кривая Каутского, и на ее базе определяются параметры фотосинтетического преобразования световой энергии в растительной клетке. Неселeктивный фотоприемник имел спектральный диапазон чувствительности 350–1100 нм, селективный – 680–750 нм. В ходе экспериментов регистрировали следующие компоненты кинетики индукции флуоресценции: начальный уровень флуоресценции (F0), максимальное (Fm) и стационарное (Fst) значения флуоресценции после световой адаптации. На основе полученных данных рассчитывали индекс жизнеспособности и фотосинтетическую активность [15]. Полученные показатели позволяют оценить функциональное состояние фотосинтезирующих тканей и всего организма в целом.
Биохимические показатели определяли по общепринятым методикам: содержание пролина – по модифицированной методике Чинарда с использованием нингидринового реактива, суммы фенольных веществ – спектрофотометрическим методом с использованием реактива Фолина-Чокальтеу, аскорбиновой кислоты – йодометрическим титрованием. Активность каталазы (КФ 1.11.1.6) определяли титриметрическим методом [20], полифенолоксидазы (КФ 1.14.18.1) – колориметрически в присутствии пирокатехина и п-фенилендиамина [21], супероксиддисмутазы (КФ 1.15.1.1) – по реакции окисления кверцетина [22]. При определениях использовали спектрофотометр Evolution 220 UV/VIS (“Thermo Scientific”, США).
Физиолого-биохимические эксперименты проводили в 3 кратной биологической и 3 кратной аналитической повторностях. Опыты по культуре тканей проводили в 3 кратной повторности, в каждом варианте анализировали не менее 20 эксплантов. Каждый эксперимент был повторен 2 раза. Для статистической обработки использовали программы Statistica 6.0, MS Excel 2007. Достоверность различий между вариантами рассчитывали по t-критерию Стьюдента при 5% уровне значимости. В таблицах и на графиках представлены средние значения определений и их стандартные ошибки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При введении в асептическую культуру изолированных меристем различных сортов лаванды на питательной среде МС с добавлением 1.0 мг/л кинетина и 0.5 мг/л ГК3 через неделю культивирования начиналось развитие основного побега. Через две недели появлялись адвентивные почки, из которых развивались побеги. Частота множественного побегообразования у всех сортов была довольно высокой – от 80.0 до 94.1%. Количество формирующихся побегов зависело от генотипа и варьировало от 3.9 (Ранняя) до 5.7 шт./эксплант (Синева) (табл. 1). На этапе введения меристем, помимо развития побегов, у сортов Вдала и Рекорд наблюдали формирование 1–2 небольших корней с частотой до 12.5%. Вместе с тем у сортов Ранняя и Вдала в базальной части микропобегов с частотой 6.5–17.8% развивался небольшой плотный каллус, который удаляли при дальнейшем пассировании из-за вероятности появления сомаклональных вариантов. Многие авторы при культивировании почек или узловых сегментов лаванды также отмечали формирование каллусной ткани [8–10].
Таблица 1.
Влияние сорта на развитие изолированных меристем лаванды in vitro
| Сорт | Число побегов, шт. | Длина побега, мм | Число узлов (пар листьев), шт. | Частота множественного побегообразования, % |
|---|---|---|---|---|
| Степная | 4.50 ± 0.46a | 12.5 ± 0.9a | 2.0 ± 0.2a | 83.3 ± 2.5a |
| Синева | 5.71 ± 0.66a | 9.4 ± 0.5b | 1.9 ± 0.1a | 94.1 ± 4.3a |
| Ранняя | 3.94 ± 0.49a | 11.5 ± 0.4a | 1.8 ± 0.1a | 80.0 ± 5.1a |
| Вдала | 5.33 ± 0.63a | 10.1 ± 0.7ab | 1.8 ± 0.1a | 88.9 ± 3.1a |
| Рекорд | 4.10 ± 0.50a | 12.2 ± 0.9a | 2.1 ± 0.2a | 89.0 ± 3.2a |
Для дальнейшего размножения полученные после введения in vitro побеги разделяли на микрочеренки (5–7 мм) с одним узлом и парой листьев и переносили на модифицированную ранее для лаванды среду МС. На этапе собственно микроразмножения отмечали развитие одного-двух основных побегов (из пазушных почек микрочеренка) длиной до 20–30 мм с 4–5 узлами и до 6–10 дополнительных побегов. В среднем из микрочеренка, в зависимости от сорта и числа субкультивирований, развивалось от 1.6 до 3.5 побега с 1.9–3.6 парой листьев (табл. 2).
Таблица 2.
Влияние количества субкультивирований и сорта на развитие меристемных культур лаванды узколистной на 2 этапе клонального микроразмножения
| Количество субкультивирований | Сорт | Число побегов, шт. | Длина побега, мм | Число узлов (пар листьев), шт. |
|---|---|---|---|---|
| 1 | Степная | 2.4 ± 0.2ab | 15.4 ± 1.1ab | 2.2 ± 0.2bc |
| Синева | 2.3 ± 0.3ab | 14.3 ± 0.8ab | 2.5 ± 0.2bc | |
| Ранняя | 2.3 ± 0.3ab | 14.2 ± 1.0ab | 2.1 ± 0.1c | |
| Вдала | 2.2 ± 0.2b | 12.5 ± 0.8b | 2.2 ± 0.2bc | |
| Рекорд | 2.7 ± 0.3ab | 11.6 ± 0.9b | 1.9 ± 0.2c | |
| 2 | Степная | 2.2 ± 0.2b | 15.7 ± 1.3ab | 2.2 ± 0.2bc |
| Синева | 3.5 ± 0.4a | 14.7 ± 1.0ab | 2.7 ± 0.2bc | |
| Ранняя | 2.5 ± 0.5ab | 13.9 ± 1.0ab | 1.9 ± 0.2c | |
| Вдала | 2.6 ± 0.5ab | 13.5 ± 0.9ab | 2.2 ± 0.2bc | |
| Рекорд | 3.0 ± 0.5ab | 12.6 ± 0.9b | 2.1 ± 0.1c | |
| 3 | Степная | 1.9 ± 0.3b | 14.8 ± 1.0ab | 2.9 ± 0.3ab |
| Синева | 3.4 ± 0.4a | 15.3 ± 0.7ab | 3.6 ± 0.2a | |
| Ранняя | 2.7 ± 0.5ab | 16.8 ± 1.0a | 3.6 ± 0.3ab | |
| Вдала | 2.6 ± 0.3ab | 13.7 ± 0.7ab | 3.0 ± 0.2ab | |
| Рекорд | 2.4 ± 0.3ab | 13.2 ± 0.9ab | 2.8 ± 0.2b | |
| 4 | Степная | 1.9 ± 0.2b | 16.3 ± 1.0ab | 3.5 ± 0.3ab |
| Синева | 3.2 ± 0.3a | 13.1 ± 0.9b | 3.6 ± 0.2a | |
| Ранняя | 2.3 ± 0.3ab | 15.8 ± 0.9ab | 3.4 ± 0.2ab | |
| Вдала | 2.5 ± 0.3ab | 14.1 ± 0.9ab | 3.2 ± 0.2ab | |
| Рекорд | 2.0 ± 0.2b | 13.2 ± 1.0ab | 2.8 ± 0.2b |
Полученные результаты свидетельствуют о возможности использования для размножения лаванды нескольких методов – микрочеренкования побегов, а также индукции пазушного и адвентивного побегообразования, что позволяет повысить коэффициент размножения. У изученных сортов на данном этапе почти не отмечали индукции формирования каллуса или ризогенеза, а также развития оводненных побегов. Исключение составлял сорт Синева, у которого формировалось наибольшее число побегов (до 10 штук на эксплант), некоторые из них проявляли признаки витрификации. В отдельных работах по микроразмножению лаванды также было выявлено развитие гипероводненных побегов, частота которых зависела от концентрации регуляторов роста [6] или агара [11] в питательной среде. При этом Hamza с соавт. [3] отмечали, что у L. angustifolia частота витрификации снижалась при использовании 1/4 МС питательной среды и увеличении содержания сахарозы.
Важным вопросом на 2 этапе микроразмножения является изучение влияния количества субкультивирований на развитие меристемных культур, т.к. во многих случаях необходимо размножать микрорастения длительный период для получения необходимого количества растительного материала, а также учитывать это при разработке приемов создания коллекций ценных генотипов in vitro. Изучение развития меристемных культур пяти сортов лаванды в течение девяти субкультивирований показало изменчивость ряда морфометрических параметров и коэффициента размножения (табл. 2, рис. 1) в зависимости от длительности культивирования.
Рис. 1.
Влияние сорта и длительности культивирования на коэффициент размножения лаванды узколистной
в условиях in vitro на 2 этапе клонального микроразмножения. Достоверные (P ≤ 0.05) различия обозначены разными буквами.  – сорт Степная;
– сорт Степная;  – сорт Синева;
– сорт Синева;  – сорт Ранняя;
– сорт Ранняя;  – сорт Вдала;
– сорт Вдала;  – сорт Рекорд.
– сорт Рекорд.

Как видно из представленных данных, в 3 и 4 пассажах по сравнению с первым число побегов на эксплант достоверно не возросло, однако увеличилось количество листьев (узлов) на побег, что и привело к повышению коэффициента размножения. Наибольшее увеличение коэффициента размножения к третьему пассажу отмечено у сортов Синева и Ранняя (соответственно в 2.1 и 2.0 раза). Следует отметить, что у Степной наибольшее значение этого показателя (6.7) было в 4 субкультивировании. После этого, в 5–9 пассажах наблюдали снижение коэффициента размножения (почти до уровня 1 пассажа) и некоторую стабилизацию этого показателя. Наиболее активное образование адвентивных побегов отмечено у сорта Синева, у которого коэффициент размножения достигал 12.2. В 3–4 пассажах сорта Вдала и Ранняя также проявили хорошую способность к микроразмножению. Следует отметить, что, в отличие от других изученных сортов, у Синевы коэффициент размножения в 5–9 пассажах был достоверно выше, чем в первом. Полученные данные свидетельствуют о возможности длительного субкультивирования сортов лаванды in vitro. При микроразмножении сортов розы эфиромасличной в течение 9 субкультивирований было выявлено аналогичное повышение коэффициента размножения к 3–4 пассажу [23]. Анализ влияния длительности культивирования на микроразмножение некоторых эфиромасличных растений показал, что у шалфея и фенхеля в течение первых трех пассажей коэффициент размножения не изменялся, а затем постепенно снижался, тогда как у сортов герани эфиромасличной коэффициент размножения был стабилен в течение двух лет [24]. У представителей семейства Caprifoliaceae максимальный коэффициент размножения отмечали в 3 пассаже, а у Ericaceae и Oleaceae – в 4–5 [25]. В работе индийских ученых у Lawsonia inermis количество побегов из пазушных меристем было стабильным до 5 пассажа (4.3), а затем снизилось до трех побегов на эксплант [26].
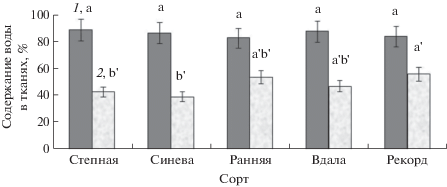
Для всех представленных в нашей работе физиолого-биохимических исследований были использованы микропобеги лаванды, полученные после шестого пассажа in vitro, так как в этот период при длительном культивировании наблюдали относительную стабилизацию морфометрических показателей процесса микроразмножения. Способность регулировать уровень оводненности в асептических условиях является одной из характеристик высокой адаптационной способности регенерантов на последующих этапах культивирования in vivo и ex situ. Учитывая распространение и культивирование растений Lavandula angustifolia в странах с аридным климатом, а также наличие ксероморфных черт организации вегетативных органов в условиях ex situ и in vitro [16], можно предположить наличие генетического потенциала к реализации механизмов защиты от водного стресса на всех этапах биотехнологического процесса. Физиологическое исследование микропобегов лаванды позволило выявить высокую степень оводненности, при этом общее содержание воды составило 83–89% (рис. 2). Достоверных различий у пяти изученных сортов по указанному параметру не установлено. Фракция связанной воды составила 40–57% от общего содержания. Максимум осмотической и коллоидно-связанной воды отмечали у сортов Рекорд (56.65%), Ранняя (54.51%) и Вдала (47.64%). Полученные данные согласуются с результатами ранее проведенных исследований некоторых сортов лаванды узколистной и лавандина в первом пассаже, при культивировании эксплантов на среде МС с 0.3 мг/л кинетина, 0.025 мг/л НУК и 0.25 мг/л ГК3 [12].
Рис. 2.
Cодержание воды в тканях микропобегов различных сортов лаванды узколистной в условиях in vitro. 1 – общее содержание воды; 2 – связанная вода. Достоверные (P ≤ 0.05) различия обозначены разными буквами.
Показано, что листья полученных при микроразмножении in vitro регенерантов имели характерную для лаванды темно-зеленую окраску, ланцетную форму, количество некротизированных тканей не превышало 5–7%. S. Waldenmaier и G. Schmidt [27] в своей работе пришли к выводу о слабом развитии васкулярной системы растений в условиях in vitro, отсутствии дифференциации тканей мезофилла листа, что также сопряжено с низкой интенсивностью фотосинтеза при условно гетеротрофном типе питания. Однако наши исследования [16] показали противоположный результат, касающийся структурных особенностей растений лаванды: листовые пластины микропобегов бифациальные, с ранних сроков культивирования in vitro имели дифференцированный мезофилл, покровные ткани составляли тонкостенные изодиаметрические, вытянутые, на абаксиальной стороне с извилистыми очертаниями клетки эпидермы и кутикулы; были развиты простые и железистые трихомы.
Исследования динамики структурных перестроек живых объектов – перспективная, но весьма сложная проблема экспериментальной биологии. Особенно актуально использование неинвазивных методов регистрации активности фотосинтетического процесса, позволяющих сохранять микропобеги витальными и далее проводить непрерывный мониторинг их функционального состояния. Были изучены некоторые показатели ассимиляционных способностей сортов лаванды in vitro (табл. 3). Выявленные особенности свето-индукционных процессов указывают на высокую фотосинтетическую активность листьев и побегов регенерантов. Так, относительная фотосинтетическая активность (Fm – Fst)/Fm варьировала от 0.51 до 0.68 отн. ед. При этом у сорта Вдала этот показатель был максимальным и достоверно выше, чем у Ранней. Сорт Синева характеризовался довольно высоким значением данного показателя. Индекс жизнеспособности (Fm/Fst) у сортов Вдала, Синева и Рекорд был достоверно выше, чем у Степной и Ранней. Наибольшие значения этого параметра были характерны для Вдалой (2.71) и Синевы (2.56). У Степной отмечены незначительные нарушения в работе светособирающих комплексов: значительная часть световой энергии была отражена, максимальная флуоресценция составила 117 отн. ед. фл. Определенные методом индукции флуоресценции хлорофилла показатели функционального состояния микропобегов лаванды свидетельствуют об отсутствии фотоингибирования, нормальном функционировании фотосистем как на уровне светособирающих комплексов (за исключением сорта Степная), так и в момент окисления доноров электронов в реакционном центре фотосистемы II. Выявленное на уровне фотосинтетической активности листьев лучшее функциональное состояние сортов Вдала и Синева вполне соответствует их лучшей регенерационной способности в течение длительного микрочеренкования и более высоким показателем коэффициента размножения. Особенно это относится к сорту Синева, который выделялся среди изученных генотипов, как в период введения меристем, так и в течение 9 субкультивирований in vitro.
Таблица 3.
Параметры фотосинтетической активности листьев микропобегов сортов лаванды при культивировании in vitro
| Сорт | Относительная фотосинтетическая активность, (Fm – Fst)/Fm | Индекс жизнеспособности, Fm/Fst | Максимальная флуоресценция, Fm |
|---|---|---|---|
| Степная | 0.58 ± 0.03ab | 1.47 ± 0.07b | 117.40 ± 6.77a |
| Синева | 0.59 ± 0.08ab | 2.56 ± 0.18a | 93.57 ± 19.93ab |
| Ранняя | 0.51 ± 0.04b | 1.38 ± 0.07b | 68.68 ± 0.41b |
| Вдала | 0.68 ± 0.04a | 2.71 ± 0.05a | 90.22 ± 9.15a |
| Рекорд | 0.56 ± 0.09ab | 2.36 ± 0.18a | 97.71 ± 7.47a |
Для изучения адаптивных возможностей регенерантов необходимо также учитывать особенности функционирования антиоксидантной системы, включающей как низкомолекулярные протекторные соединения, так и специфические ферменты-антиоксиданты. Одним из протекторных соединений является пролин – источник энергии, углерода и азота в условиях вызванного стрессом дефицита ресурсов и снижения активности ферментов синтеза. К основным протекторным соединениям растений также относятся фенольные вещества и аскорбиновая кислота – наиболее распространенные антиоксиданты в растениях, которые участвуют в основных процессах жизнедеятельности растительных клеток: фотосинтезе, дыхании, росте и защите от действия стрессовых факторов. Супероксиддисмутаза (СОД) и каталаза являются частью антиоксидантной системы, они связывают избыточные количества активных форм кислорода, останавливают свободнорадикальные цепные реакции и тем самым регулируют окислительные процессы, происходящие в растительном организме [28]. Полифенолоксидаза (ПФО) хоть и не является ферментом-антиоксидантом, однако, играет важную роль в регуляции окислительных процессов в растении [29].
Установлено, что при культивировании in vitro содержание протекторных соединений значительно варьировало в зависимости от сорта (табл. 4). Максимальной концентрацией пролина выделялся сорт Вдала (372.87 мкг/г). Высокое содержание этого соединения также выявлено у сортов Ранняя и Рекорд. В то же время у Степной количество пролина было в 1.8–3.7 раз ниже, чем у остальных сортов. Пролин обеспечивает накопление осмотической и коллоидно-связанной воды в вегетативных органах регенерантов и, вероятно, оказывает влияние на процессы роста и дифференцировки клеток лаванды. У изученных сортов лаванды выявлены высокие концентрации аскорбиновой кислоты и фенольных соединений, в частности флаванолов. Максимальное содержание аскорбиновой кислоты было обнаружено у сорта Синева (31.28 мг/100 г), а фенольных соединений – у сорта Ранняя (1103 мг/100 г). В культивируемых in vitro побегах сорта Степная данные соединения накапливались в минимальных концентрациях.
Таблица 4.
Содержание протекторных соединений в листьях сортов лаванды в условиях in vitro
| Сорт | Пролин, мкг/г | Аскорбиновая кислота, мг/100 г | Фенольные соединения, мг/100 г | Флавонолы, мг/100 г |
|---|---|---|---|---|
| Степная | 101.26 ± 3.02e | 19.01 ± 0.57c | 503 ± 15d | 65.0 ± 1.9c |
| Синева | 185.26 ± 5.54d | 31.28 ± 0.88a | 749 ± 22c | 49.4 ± 1.5d |
| Ранняя | 259.05 ± 7.77b | 24.55 ± 0.71b | 1103 ± 31a | 163.8 ± 4.6a |
| Вдала | 372.87 ± 11.16a | 22.97 ± 0.67b | 897 ± 26b | 132.6 ± 3.8b |
| Рекорд | 223.72 ± 6.60c | 28.81 ± 0.86a | 870 ± 25b | 137.8 ± 4.0b |
Исследование деятельности окислительно-восстановительных ферментов в вегетативных органах лаванды показало, что максимальная активность каталазы in vitro отмечена у сортов Вдала и Синева (табл. 5). Активность супероксиддисмутазы у этих сортов, напротив, была достоверно ниже, чем у сорта Степная и Ранняя. Сорт Синева также отличался от остальных очень высокой активностью полифенолоксидазы. Минимальные активности каталазы и полифенолоксидазы выявлены у сортов Степная и Ранняя. Эти сорта также отличались более высокой активностью супероксиддисмутазы. Сопоставление данных о ферментативной активности, морфометрических параметрах и содержании протекторных соединений позволяет предположить, что повышенная каталазная активность при низкой активности супероксиддисмутазы у Синевы и Вдалой могут свидетельствовать о более высокой адаптационной способности данных сортов к условиям культивирования in vitro по сравнению с остальными.
Таблица 5.
Активность окислительно-восстановительных ферментов в листьях сортов лаванды в условиях in vitro
| Сорт | Активность каталазы, г О2/(г мин) |
Активность СОД, усл. ед./ г |
Активность ПФО, усл. ед./(г с) |
|---|---|---|---|
| Степная | 21.05 ± 0.70c | 2.63 ± 0.11b | 0.067 ± 0.002c |
| Синева | 25.65 ± 0.75аb | 2.12 ± 0.10c | 0.233 ± 0.003a |
| Ранняя | 22.08 ± 0.71bc | 3.45 ± 0.12a | 0.012 ± 0.001d |
| Вдала | 26.86 ± 0.82а | 1.62 ± 0.08d | 0.077 ± 0.002b |
| Рекорд | 23.80 ± 0.60b | 2.25 ± 0.11bc | 0.083 ± 0.003b |
В проведенных ранее исследованиях по анализу адаптационных возможностей сортов лаванды и лавандина in vitro изменения индукции флуоресценции и активности окислительно-восстановительных ферментов были более отзывчивы, чем параметры оводненности и содержание низкомолекулярных антиоксидантов [12]. Также было показано, что культивируемые микропобеги отличались стабильностью в работе фотосинтетического аппарата и высокими показателями индекса жизнеспособности (от 1.39 до 2.36, в зависимости от сорта и пассажа) [17]. В норме индекс жизнеспособности обычно не превышает 4 ед. [15]. При изучении 4 редких эндемиков флоры Горного Крыма было показано, что этот показатель достигал максимума (3.18 и 3.59) у видов Lagoseris callicephala и Lagoseris purpurea [30]. В нашей работе у пяти сортов лаванды были выявлены сортоспецифические различия индекса жизнеспособности, который был наибольшим у Вдалой и Синевы (2.56 и 2.71), что может быть связано с достаточно высокой степенью реализации морфогенетического потенциала.
Таким образом, анализируя полученные данные, можно отметить, что по ряду морфометрических параметров при культивировании in vitro из всех изученных генотипов выделялся сорт Синева. У этого сорта более ярко проявилось увеличение коэффициента размножения к 3–4 пассажам, характерное и для остальных сортов. В целом, меристемы и микрочеренки Синевы имели больший потенциал к образованию дополнительных побегов, что и способствовало более высокому коэффициенту размножения во 2–9 пассажах по сравнению с другими сортами. Возможно, это обусловлено тем, что микропобеги сорта Синева отличались высоким содержанием аскорбиновой кислоты и низким – фенольных соединений на фоне высокой активности полифенолоксидазы. Можно предположить, что данный сорт характеризовался оптимальными физиологическими параметрами при клональном микроразмножении. Вместе с тем у сорта Вдала было выявлено максимальное содержание пролина и довольно высокая фотосинтетическая активность и индекс жизнеспособности. Однако при культивировании микропобегов коэффициент размножения у него был на уровне остальных сортов и ниже, чем у Синевы. Все это свидетельствует о достаточно сложной зависимости между регенерационной способностью эксплантов при микроразмножении в изолированных условиях и их физиолого-биохимическими показателями. Необходимы дальнейшие исследования в этом направлении, возможно, с расширением спектра изучаемых параметров и анализом динамики не только в течение пассажей, но и в пределах цикла культивирования.
Работа выполнена при поддержке Российского научного фонда, грант № 14-50-00079.
Список литературы
Паштецкий В.С., Невкрытая Н.В., Мишнев А.В., Назаренко Л.Г. Эфиромасличная отрасль Крыма. Вчера, сегодня, завтра. Симферополь: ИТ “АРИАЛ”, 2017. 244 с.
Скипор О.Б., Мишнев А.В. Продуктивность маточника Lavandula angustifolia Mill. сорта Степная в зависимости от возраста и нагрузки при заготовке черенков // Научные ведомости Белгородского Государственного университета. Серия Естественные науки. 2015. Т. 33. С. 52–57.
Hamza A.M., Abd El-Kafie Omaima M., Kasem M.M. Direct micropropagation of English lavender (Lavandula angustifolia Munstead) plant // J. Plant Production, Mansoura Univ. 2011. V. 2. P. 81–96.
Егорова Н.А. Получение растений-регенерантов в каллусной культуре лаванды и их микроразмножение in vitro (методические рекомендации). Симферополь: ИЭЛР УААН, 2008. 28 с.
Mitrofanova I.V., Chirkov S.N., Lesnikova-Sedoshenko N.P., Chelombit S.V., Zakubanskiy A.V., Rabotyagov V.D., M-itrofanova O.V. Micropropagation of Lavandula a-ngustifolia Mill. 'Record' and 'Belyanka' // Acta Hort. 2017. V. 1187. P. 37–42.
Andrade L.B, Echeverrigaray S., Fracaro F., Pauletti G.F., Rota L. The effect of growth regulators on shoot propagation and rooting of common lavander (Lavandula ver-a DC) // Plant Cell Tissue Org. Cult. 1999. V. 56. P. 79–83.
Chishti N., Kaloo Z.A., Shawl A.S., Sultan Ph. Rapid in vitro clonal propagation of Lavandula officinalis chaix a multipurpose plant of industrial importance // Pakistan J. Biol. Sciences. 2006. V. 9. P. 514–518.
Bona C.M., Reinhart V., Biasi L.A., Zanette F. Lavandula dentate and Lavandula angustifolia in vitro organogenesis // Plant Cell Cult. Micropropag., Lavras. 2011. V. 7. P. 66–70.
Dias M.C., Almeida R., Romano A. Rapid clonal multiplication of Lavandula viridis L’Her through in vitro axillary shoot proliferation // Plant Cell Tissue Org. Cult. 2002. V. 68. P. 99–102.
Zuzarte M.R., Dinis A.M., Cavaleiro C., Salgueiro L.R., Canhoto J.M. Trichomes, essential oils and in vitro propagation of Lavandula pedunculata (Lamiaceae) // Industrial Crops and Products. 2010. V. 32. P. 580–587.
Lucchesini M., Pacifici S., Tognoni F., Mensuali-Sodi A., Serra G. Optimisation of in vitro cultural conditions of some officinal species // Acta Hort. 2006. V. 723. P. 6–10.
Grebennikova O., Paliy A., Brailko V., Mitrofanova O., Rabotyagov V., Zhdanova I., Mitrofanova I. Adaptive capacity of some lavender and lavandin cultivars in vitro and in situ // AGROFOR International Journal. 2017. V. 2. P. 91–98.
Echeverrigaray S., Basso R., Andrade L.B. Micropropagation of Lavandula dentata from axillary buds of field-grown adult plants // Biol. Plantarum. 2005. V. 49. P. 439–442.
Егорова Н.А., Ставцева И.В. Разработка биотехнологических приемов микроразмножения in vitro для Lavandula angustifolia Mill. // Труды Кубанского государственного аграрного университета. 2015. Т. 54. С. 138–142.
Stirbet A., Govindjee J. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and Photosystem II: Basics and applications of the OJIP fluorescence transient // Journal of Photochemistry and Photobiology B: Biology. 2011. V. 104. P. 236−257.
Brailko V.A., Mitrofanova O.V. Lesnikova-Sedoshenko N.P., Chelombit S.V., Mitrofanova I.V. Anatomy features of Lavandula angustifolia Mill. and Lavandula hybrida Rev. plants in vitro // Agriculture and Forestry. 2017. V. 63. P. 111–117.
Mitrofanova O.V., Grebennikova O.A., Paliy A.E., Brailko V.A., Mitrofanova I.V. Biochemical and physiological features of regenerants in some lavender and lavandin cultivars in vitro // Plant Cell Biotechnology and Molecular Biology. 2016. V. 17. № 7–8. P. 335−341.
Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. Методы культуры тканей в физиологии и биохимии растений. Киев: Наук. думка, 1980. 488 с.
Лищук А.И. Методика определения водоудерживающей способности к обезвоживанию листьев плодовых культур. Физиологические и биофизические методы в селекции плодовых культур: методические рекомендации. М.: ГНБС, 1991. 58 с.
Воскресенская О.Л., Алябышева Е.А., Половникова М.Г. Большой практикум по биоэкологии. Йошкар-Ола: Мар. гос. ун-т, 2006. 108 с.
Ермаков А.И. Методы биохимического исследования растений. Ленинград: Колос, 1987. 456 с.
Костюк В.А., Потапович А.И., Ковалева Ж.В. Простой и чувствительный метод определения активности супероксиддисмутазы, основанный на реакции окисления кверцетина // Вопр. мед. химии. 1990. № 2. С. 88–91.
Егорова Н.А., Ставцева И.В., Митрофанова И.В. Влияние сорта и факторов культивирования in vitro на клональное микроразмножение розы эфиромасличной // Бюллетень ГНБС. 2016. Вып. 120. С. 36–43.
Егорова Н.А., Кривохатко А.Г., Ставцева И.В., Каменек Л.И. Микроразмножение эфиромасличных растений с использованием культуры изолированных тканей и органов in vitro // Таврический вестник аграрной науки. 2013. № 1. С. 9–14.
Молканова О.И. Особенности клонального микроразмножения у различных таксономических групп растений // III Международная научная конференция “Теоретические и прикладные аспекты биохимии и биотехнологии растений”. Минск: Изд. центр БГУ, 2008. С. 300–304.
Rout G.R., Das G., Samantaray S., Das P. In vitro micropropagation of Lawsonia inermis (Lythraceae) // Rev. biol. trop. 2001. V. 49. P. 957–963.
Waldenmaier S., Schmidt G. Histologische Unterschiede zwischen in-vitro und ex-vitro Blättern bei der Abhärtung von Rhododendron // Gartenbauwissenschaft. 1990. V. 55. P. 49–54.
Racchi M.L. Antioxidant Defenses in Plants with A-ttention to Prunus and Citrus spp. // Antioxidants. 2013. V. 2. P. 340–369.
Araji S., Grammer T.A., Gertzen R., Anderson S.D., M-ikulic-Petkovsek M., Veberic R., Phu M.L., Solar A., Leslie C.A., Dandekar A.M., Escobar M.A. Novel roles for the polyphenol oxidase enzyme in secondary metabolism and the regulation of cell death in walnut // Plant Physiol. 2014. V. 164. P. 1191–1203.
Митрофанова О.В., Митрофанова И.В., Лесникова-Седошенко Н.П., Браилко В.А., Никифоров А.Р., Челомбит С.В., Иванова Н.Н., Жданов И.В. Биотехнологические и физиологические аспекты размножения некоторых редких эндемиков флоры Горного Крыма // Экосистемы. 2017. Вып. 11. С. 44−52.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


