Физиология растений, 2019, T. 66, № 2, стр. 121-127
Роль метилирования CpG-островков промотора гена csy3 в световой регуляции активности АТФ-цитратлиазы в листьях кукурузы
А. Т. Епринцев a, Д. Н. Федорин a, М. А. Добычина a
a Федеральное государственное бюджетное образовательное учреждение высшего образования “Воронежский государственный университет”
Воронеж, Россия
Поступила в редакцию 22.05.2018
После доработки 27.06.2018
Принята к публикации 26.07.2018
Аннотация
Установлено, что функционирование АТФ-цитратлиазы в листьях кукурузы регулируется режимом освещения растений, в частности, на свету и при облучении растений кукурузы красным или синим светом наблюдается резкое увеличение активности фермента по сравнению с вариантами “темнота” и облучении дальним красным светом. Показано, что активные формы фитохрома и криптохрома принимают участие в увеличении активности АТФ-цитратлиазы посредством регуляции экспрессии гена csy3. Возможно, это достигается путем взаимодействия со специфическим G-участком промотора гена csy3. Анализ нуклеотидной последовательности промотора гена АТФ-цитратлиазы показал наличие в его составе CpG-островков, обеспечивающих потенциальную способность к метилированию. Исследование статуса метилирования отдельных CG-динуклеотидов промотора гена csy3 выявило изменение данного показателя в зависимости от условий светового режима растений. Высокая степень метилирования CG-динуклеотидов в составе промотора гена csy3 приводит к снижению уровня транскриптов данного гена, и, как следствие, торможению активности АТФ-цитратлиазы в темноте и при облучении дальним красным светом.
ВВЕДЕНИЕ
Цитоплазматическая АТФ-цитратсинтаза, также обозначаемая как АТФ-цитратлиаза (АТФ-ЦЛ, КФ 4.1.3.8), катализирует образование ацетил-СоА и оксалоацетата из цитрата и CoA. Известно, что ацетил-СоА является предшественником в биосинтезе широкого спектра соединений в растительном организме, поэтому растения должны иметь различные системы метаболизма ацетил-СоА в митохондриях (для цикла Кребса), в пластидах (для биосинтеза жирных кислот de novo), в пероксисомах (продукт окисления жирных кислот), и в цитозоле (для биосинтеза изопреноидов, флавоноидов) [1].
В клетках растений цитозольный пул ацетил-СоА, в накоплении которого принимает активное участие цитозольная АТФ-цитратлиаза, необходим для поддержки биосинтеза широкого диапазона биомолекул, которые важны для роста, развития и защиты растений. Эти биомолекулы включают масла, содержащие очень длинную цепь жирных кислот, воски [2, 3], флавоноиды, мевалоновую кислоту [4] и изопреноиды [5].
От регуляции активности фермента цитратлиазы зависят многие жизненно необходимые процессы в клетке. Особый интерес вызывает световая регуляция функционирования этого энзима. Участие фитохромной и криптохромной систем было показано в регуляции ферментов цикла трикарбоновых кислот и глиоксилатного пути [6, 7]. При этом была обнаружена четкая световая регуляция различных изоферментов цитратсинтазы (ЦС, КФ 2.3.3.1) в листьях кукурузы. Митохондриальная форма ЦС резко снижала активность при облучении красным и синим участками спектра, а цитоплазматическая цитратсинтаза, наоборот, активировалась в этих условиях освещения [8]. Механизм трансдукции светового сигнала связан с регуляцией на генном уровне. Как правило, гены, отвечающие за митохондриальный окислительный метаболизм, ингибируются красным светом, а за пероксисомальный и цитоплазматический – активируются [9]. Особая роль в регуляции экспрессии генов, кодирующих ферменты энергетического метаболизма, в том числе ЦТК, отводится метилированию ДНК [10]. Нами было показано, что экспрессия генов, кодирующих субъединицы А и В сукцинатдегидрогеназы у кукурузы, регулируется степенью метилирования их промоторов [11, 12].
В связи с этим целью данного исследования было выяснение механизма регуляции активности АТФ-цитратлиазы на уровне экспрессии гена в листьях кукурузы в условиях различного светового режима и роли метилирования СpG-островков промотора гена csy3.
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения экспериментов использовали 14-дневные растения кукурузы, выращенные гидропонным способом при температуре 22°С и интенсивности света 25 Вт/м2. Для этого растения помещали в темную камеру на 24 ч (вариант “темнота”), после чего облучали красным (вариант “КС”) и/или дальним красным (вариант “ДКС”) светом в течение 15 мин, синим светом (СС) с помощью светодиодов с областью испускания, 640–680 нм (КИПД40М40-К-П6, Россия), 710–750 нм (3Л127А-5, Россия) и 465–470 нм (ОАО “Протон“, Россия) соответственно. Интенсивность света составляла 0.044 Вт/м2. Пробы для дальнейшего анализа отбирали через 3 часа с момента облучения.
Активность АТФ-цитратлиазы измеряли с применением дополнительного фермента малатдегидрогеназы [13]. Среда спектрофотометрирования содержала следующие компоненты: 0.1 М Трис-НС1, рН 7.6, 10 мМ MgCl2, 10 мМ цитрата натрия, 100 мМ НАД ∙ Н, 3 Е малатдегидрогеназы, 5 мкМ CoASH, 3 мМ АТФ. Реакцию проводили при 340 нм.
Суммарную РНК из листьев кукурузы выделяли методом гуанидинтиоцианат-фенол-хлороформной экстракции [14].
Обратная транскрипция РНК осуществлялась с использованием набора “РЕВЕРТА-L” (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия) согласно инструкции производителя.
ПЦР в реальном времени проводили на приборе LightCycler96 (“Roche”, Швейцария), используя в качестве красителя SYBR Green I. В качестве праймеров, подобранных с помощью программного обеспечения Primer3 [15], использовали следующую нуклеотидную последовательность для гена csy3 (pco080711, NC_024461.2): прямой − GAGTGCTTTTGGATTGCGCT, обратный − TGGCGAGTCCAGTTTGGTAG.
Параметры амплификации: предварительная денатурация 95°С – 5 мин, затем цикл: 95°С – 30 с, 56°С – 30 с, 72°С – 30 с (детекция), финальная элонгация: 72°С – 10 мин. Количество матрицы контролировали с помощью параллельной амплификации фактора элонгации ef-1α с ген-специфичными праймерами [16]. В качестве отрицательного контроля использовали суммарную РНК без этапа обратной транскрипции.
Определение относительного уровня экспрессии исследуемых генов проводили с применением 2-ΔΔCt-метода [17] с использованием программного обеспечения Lightcycle 96 v1.1 (“Roche”).
ДНК выделяли из кукурузы с помощью набора “ПРОБА-ГС” (“ДНК-Технология”, Россия) согласно рекомендациям производителя. Пробу ДНК (50 мкг) денатурировали 0.3 М раствором NaOH и подвергали дезаминированию, используя 4.15 М раствор бисульфита и 0.2 М раствор гидрохинона при pH 5.0. Полученный образец обессоливали с помощью набора ПРОБА–ГС (“ДНК-Технология”). Десульфонирование проводили 0.3 М раствором NaOH с последующей нейтрализацией 10 М раствором ацетата аммония и 96% этанолом при pH 5.6 [18].
Для анализа нуклеотидного состава промотора гена csy3 на наличие G-участков использовали известные последовательности, аннотированные в международной базе данных GenBank.
Полимеразную цепную реакцию с метил-специфичными праймерами проводили с помощью набора реактивов DreamTaq PCR MasterMix (2x) (“Thermo Fisher Scientific”, США). Реакция ПЦР проводилась на приборе “Терцик” (ДНК-Технология) со следующими параметрами амплификации: предварительная денатурация при 95°С в течение 10 мин, затем 35 циклов [95°С – 20 с, 54–60°С – 20 с, 72°С – 30 с], финальная элонгация: 72°С – 4 мин.
Праймеры для метилспецифической ПЦР подбирали с помощью программы MethPrimer (http:// www.urogene.org/cgi-bin/methprimer2/MethPrimer.cgi).
Эксперименты осуществлялись в трех повторностях. Достоверность результатов устанавливалась с помощью методов вариационной статистики [19]. Обсуждаются статистически достоверные различия при Р < 0.05.
РЕЗУЛЬТАТЫ
Для выяснения световой регуляции активности АТФ-зависимой цитратлиазы в листьях кукурузы растения, выращенные на свету с интенсивностью 25 Вт/м2, облучали светом различной длины волны. В темноте наблюдали значительное снижение активности исследуемого фермента. При анализе прямой реакции скорость функционирования АТФ-цитратлиазы снижалась более чем в 5 раз по сравнению с растениями, находящимися на свету (рис. 1). Облучение листьев кукурузы красным светом увеличивает активность фермента до 240.1 Е/г сырой массы, что в 3.7 раза выше по сравнению с вариантом “темнота”. Действие дальнего красного и последовательное действие красного и дальнего красного света на активность АТФ-цитратлиазы аналогично варианту “темнота”, величина исследуемого показателя составила 85.3 и 91.25 Е/г сырой массы, соответственно.
Рис. 1.
Активность АТФ-цитратлиазы в листьях кукурузы в условиях различного освещения. 1 – прямая реакция, 2 – обратная реакция. КС – красный свет, ДКС – дальний красный свет, СС – синий свет.

Сходные данные были получены и при исследовании скорости обратной реакции, синтеза изоцитрата из оксалоацетата и ацетил-СоА. Активность АТФ-цитратлиазы по обратной реакции снижалась в 1.4 раза при инкубации растений в условиях темноты относительно контроля (свет). Облучение листьев кукурузы красным светом также приводило к активации обратной реакции АТФ-цитратлиазы: величина данного показателя составила 49.53 Е/г сырой массы. Действие дальнего красного и последовательное действие красного и дальнего красного света были аналогичны результатам по прямой реакции, что проявлялось в снижении данного показателя относительного варианта “свет”.
При облучении проростков кукурузы синим светом с длиной волны 465 нм было установлено, что каталитическая активность АТФ-цитратлиазы как по прямой, так и по обратной реакции сходна с вариантом “свет”, что указывает на активацию работы исследуемого фермента.
Проведенный анализ образцов кДНК из кукурузы с праймерами к гену csy3 в условиях разного освещения позволил установить, что в растениях на свету и после облучения красным светом с длиной волны 660 нм относительный уровень транскриптов исследуемого гена выше такового показателя растений в темноте в 4 и 2.6 раза соответственно (рис. 2). Облучение зеленых листьев кукурузы дальним красным светом и последовательное облучение красным и дальним красным светом приводило к снижению активности ЦС по сравнению со световым вариантом. При этом изучаемый показатель становился близким к таковому в варианте “темнота”. Относительное содержание мРНК гена csy3 в этих случаях составило 0.26 и 0.27 ед.
Рис. 2.
Относительный уровень транскриптов гена csy3 в листьях кукурузы при облучении красным, дальним красным и синим светом. КС – красный свет, ДКС – дальний красный свет, СС – синий свет.
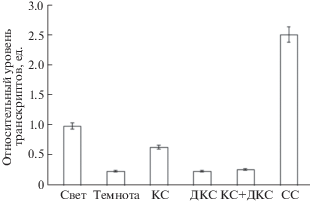
Относительное содержание транскриптов гена csy3 в листьях кукурузы при их облучении синим светом было значительно выше, чем при всех остальных вариантах светового режима растений. Содержание мРНК гена csy3 составило 2.52 ед., что в 10 раз больше этого показателя в темноте.
В качестве промотора использовали нуклеотидную последовательность, включающую 1000 нуклеотидов перед точкой начала транскрипции и первый экзон. Анализ промоторной последовательности гена csy3 кукурузы показал наличие трех CpG-островков: размером 176 п.н. в положении 49–224 нукл., 260 п.н. в положении 367–626 нукл. и 396 п.н. в положении 829–1224 нукл. (рис. 3). Координаты исследуемых CpG-островков определяли относительно последнего нуклеотида первого экзона исследуемого гена.
Рис. 3.
Нуклеотидная последовательность промотора гена cys3 с указанием точки начала транскрипции и CpG-островков.

Данные анализа нуклеотидной последовательности промотора гена csy3 АТФ-цитратлиазы позволили разработать праймеры для метилспецифичной ПЦР, обеспечивающие оценку статуса метилирования отдельных CG-динуклеотидов (табл. 1). Координаты трех исследуемых CpG-динуклеотидов определяли относительно точки начала транскрипции.
Таблица 1.
Праймеры к гену АТФ-цитратлиазы для метилспецифичной ПЦР
| Ген | Положение
исследуемого цитозина |
Название | Последовательность | |
|---|---|---|---|---|
| Csy3 | I | –806 нукл. | Прямой М | ATTATCACTCCAAAATCAAAAGCA |
| Обратный М | TGTACGATCTAACGATCGTGTTCAGAG | |||
| Прямой U | ATTGTCACTCCGAGATCGAGGGCG | |||
| Обратный U | TGTACGATCTAACGATCGTGTTCAGAG | |||
| II | –843 нукл. | Прямой М | AGTTTTACGTATATGCGGATTTTTC | |
| Обратный М | TGTACGATCTAACGATCGTGTTCAGAG | |||
| Прямой U | GTTTTATGTATATGTGGATTTTTTGG | |||
| Обратный U | TGTACGATCTAACGATCGTGTTCAGAG | |||
| III | –820 нукл. | Прямой М | TCCCCGCTCCAGGTCCACGGCA | |
| Обратный М | TGTACGATCTAACGATCGTGTTCAGAG | |||
| Прямой U | TCCCCGCTCCAAATCCACAGCA | |||
| Обратный U | TGTACGATCTAACGATCGTGTTCAGAG | |||
При анализе статуса метилирования отдельных CG-динуклеотидов промотора гена АТФ-цитратлиазы в зеленых листьях кукурузы в условиях различного светового режима был установлен дифференцированный характер изменения изучаемого показателя. Установлено, что на свету при облучении красным и синим светом наблюдается низкое значение степени метилирования исследуемых CG-динуклеотидов по сравнению с данными показателями в растениях в темноте и при облучении ДКС и КС + ДКС (табл. 2).
Таблица 2.
Степень метилирования CG-динуклеотидов промотора гена, кодирующего АТФ-цитратлиазу в листьях кукурузы в условиях различного освещения
| Ген | Свет | Темнота | КС | ДКС | КС + ДКС | СС | |
|---|---|---|---|---|---|---|---|
| Csy3 | I | ± | + | ± | + | + | ± |
| II | – | + | ± | + | + | - | |
| III | – | ± | + | + | + | ± | |
| % | 25 | 75 | 50 | 100 | 100 | 25 | |
На основе полученных данных была построена диаграмма зависимости относительного уровня транскриптов гена csy3 от степени метилирования его промотора. Показано, что в листьях кукурузы в условиях темноты при облучении дальним красным светом и при последовательном облучении красным и дальним красным светом наблюдается высокий уровень метилирования промотора, что проявляется в снижении концентрации мРНК данного гена. Обратную ситуацию наблюдали в растениях, находящихся на свету и при облучении красным и синим светом, в данных условиях степень метилирования CG-динуклеотидов промотора гена csy3 составила 25–50%, что обуславливает увеличение активности исследуемого фермента.
ОБСУЖДЕНИЕ
Изучение динамики работы АТФ-зависимой цитратлиазы в листьях кукурузы при последовательном экспонировании зеленых проростков кукурузы в условиях разного светового режима дало возможность выявить изменение ее активности в зависимости от условий освещения.
Обнаруженная высокая активность АТФ-цитратлиазы в цитозоле растений при освещении, по-видимому, необходима для образования ацетил-СоА, участвующего в различных биосинтетических процессах. Цитоплазматическая АТФ-цитратлиаза может синтезировать ацетил-СоА, используемый для метаболизма мевалоновой кислоты, приводящего к синтезу стеролов и других изопреноидных метаболитов [20]. Кроме того, было установлено повышение активности АТФ-цитратлиазы в сладком картофеле, наряду с накоплением сесквитерпеноидных фитоалексинов, что указывает на участие АТФ-цитратлиазы в обеспечении ацетил-СоА для биосинтеза изопреноидов [21]. В ряде исследований показано, что цитозольная АТФ-цитратлиаза может обеспечить синтез ацетил-СоА, который идет на удлинение цепи жирных кислот до C20–C30, при отсутствии классической ацетил-CoA-синтетазы в цитозоле [22]. Следовательно, можно предположить, что увеличение каталитической активности АТФ-цитратлиазы на свету необходимо для обеспечения нескольких метаболических путей.
В ходе работы было выявлено, что фитохромная и криптохромная системы принимают непосредственное участие в регуляции функционирования исследуемой АТФ-цитратлиазы. Активная форма фитохрома, а также активная форма криптохрома, приводят к возрастанию активности исследуемого фермента в 3−5 раз. Воздействие дальнего красного света на растения кукурузы имело противоположный характер, что проявлялось в снижении активности АТФ-цитратлиазы. Это указывает на фитохром-зависимый механизм регуляции исследуемого фермента. Аналогичный эффект был обнаружен ранее в наших работах и в работах других авторов. На большинство митохондриальных изоформ ферментов окислительного метаболизма красный и синий свет влияют негативно. В то же время, они резко активируют цитоплазматические изоформы цитратсинтазы, фумаразы и аконитазы [23, 7, 8 ]. Следует отметить, что на свету в листьях образуется большое количество первичных ассимилятов, в том числе ди- и трикарбоновых органических кислот, которые требуют дальнейшей метаболизации [24].
Изменение статуса метилирования ДНК – один из эпигенетических механизмов, контролирующих экспрессию генов и обеспечивающих регуляцию активности ферментов в адаптации клеточного метаболизма к свету [25].
Метилирование остатков цитозина в ДНК играет важную роль в регуляции экспрессии генов. При этом метилирование, как правило, происходит в CG-динуклеотидах кодирующей области [26, 27]. Также установлено, что в растениях Arabidopsis thaliana активная форма фитохрома А действует путем транскрипционного фактора PIL5, связывающегося с G-участком промотора в качестве регулятора гена, теряющего данную способность, по мнению авторов, при гиперметилировании CG-динуклеотидов [28]. Изменение статуса метилирования промоторов гена csy3 может служить механизмом регуляции работы АТФ-цитратлиазы. Регулирование активности фермента цитратлиазы красным светом в листьях кукурузы происходит через фитохромный механизм, который реализуется путем изменения степени метилирования CpG-островков промотора гена csy3. Было также показано участие криптохромов в регуляции синим светом активности цитратлиазы. При этом эффект действия синего света можно опосредовать также через изменение степени метилирования CpG-островков промотора гена csy3.
Распределение CG-динуклеотидов в геноме важно для нормального функционирования клетки и регуляторных участков генов. Большое значение для уровня транскрипции гена играет статус метилирования CpG-островков в его промоторе [29]. При этом неметилированный CpG-островок не всегда ассоциирован с активно транскрибируемым геном. Однако отсутствие метилирования CpG-островка в промоторе гена является условием, необходимым для транскрипции. Как правило, в такой ситуации CpG-динуклеотиды не метилированы в промоторах активно экспрессирующихся генов и метилированы в промоторах неэкспрессирующихся генов [30].
Анализ нуклеотидов промоторов гена АТФ‑цитратлиазы в листьях кукурузы позволил установить наличие в их составе CpG-островков, что может обуславливать их регуляцию за счет изменения степени метилирования. Вероятно, для него характерна ко-регуляция, обусловленная необходимостью синтеза группы пептидов, обеспечивающего функционирование определенных метаболических процессов в адаптации при изменении типа питания [11, 12].
Анализ данных по изменению экспрессии гена, кодирующего АТФ-цитратлиазу, и степени метилирования CG-динуклеотидов промотора в листьях кукурузы в условиях различного светового режима выявил определенные закономерности. Для гена csy3 была обнаружена четкая зависимость степени метилирования его промотора с экспрессией этого гена (табл. 2). Анализ влияния степени метилирования на уровень транскрипции гена АТФ-цитратлиазы при воздействии на растения света различной длины волны выявил, что данный показатель может являться важным фактором, регулирующим работу исследуемого фермента. Невысокая степень метилирования CG-динуклеотидов промотора гена csy3 в растениях, экспонируемых на свету и после облучения красным и синим светом, совпадала с высоким уровнем экспрессии исследуемого гена и, как следствие, высокой активностью АТФ-цитратлиазы. Обратная ситуация наблюдается в темноте и при облучении растений дальним красным светом и последовательным облучением красным и дальним красным светом. В данных вариантах опыта наблюдается увеличение степени метилирования CG-динуклеотидов исследуемого промотора, что приводит к снижению активности фермента.
Таким образом, в ходе исследования показано, что изменение статуса метилирования промотора гена csy3 АТФ-цитратлиазы является механизмом контроля его активности. При этом, активные формы фоторецепторов (фитохром и криптохром) принимают непосредственное участие в данном процессе, выступая в качестве регулятора активности исследуемого гена за счет опосредованного соответствующими факторами транскрипции взаимодействия со специфическим G-участком его промотора [28]. Увеличение степени метилирования CG-динуклеоидов в составе промотора гена csy3, по-видимому, препятствует данному взаимодействию, что обуславливает активацию работы АТФ-цитратлиазы на свету и при облучении растений красным и синим светом.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (№17-04-01039).
Список литературы
Pütter K.M., van Deenen N., Unland K., Prüfer D., Gronover C.S. Soprenoid biosynthesis in dandelion l-atex is enhanced by the overexpression of three key e-nzymes involved in the mevalonate pathway // BMC Plant Biol. 2017. V. 17. P. 88.
Pollard M., Stumpf P.K. Biosynthesis of C20 and C22 fatty acids by developing seeds of Limnanthes alba // Plant Physiol. 1980. V. 66. P. 649–655.
Bao X., Pollard M., Ohlrogge J. The biosynthesis of erucic acid in developing embryos of Brassica napus // Plant Physiol. 1998. V. 118. P. 183–190.
Stumpf D.K., Burris R.H. Organic acid contents of soybean: age and source of nitrogen // Plant Physiol. 1981. V. 68. P. 989–991.
Fatland B.L., Ke J., Anderson M.D., Mentzen W.I., Cui L.W., Allred C.C., Johnston J.L., Nikolau B.J., Wurtele E.S. Molecular characterization of a heteromeric ATP-citrate lyase that generates cytosolic acetyl-coenzyme A in Arabidopsis // Plant Physiol. 2002. V. 130. P. 740−756.
Eprintsev A.T., Fedorin D.N., Sazonova O.V., Igamberdiev A.U. Light inhibition of fumarase in Arabidopsis leaves is phytochrome A-dependent and mediated by calcium // Plant Physiol. Biochem. 2016. V. 102. P. 161−166.
Fedorin D.N., Eprintsev A.T. Regulation of aconitate hydratase activity in maize leaves with red and blue light // J. Stress Physiol. Biochem. V. 13. 2017. P. 121−129.
Eprintsev A.T., Fedorin D.N., Dobychina M.A., Igamberdiev A.U. Regulation of expression of the mitochondrial and peroxisomal forms of citrate synthase in maize during germination and in response to light // Plant Science. 2018. V. 272. P. 157–163.
Igamberdiev A.U., Eprintsev A.T., Fedorin D.N., Popov V.N. Phytochrome-mediated regulation of plant respiration and photorespiration // Plant Cell Environ. 2014. V. 37. P. 290−299.
Salminen A., Kauppinen A., Hiltunen M., Kaarniranta K. Krebs cycle intermediates regulate DNA and histone methylation: epigenetic impact on the aging process // Ageing Res. Rev. 2014. V. 16. P. 45−65.
Епринцев А.Т., Федорин Д.Н., Селиванова Н.В., Ву Т.Л., Махмуд А.С., Попов В.Н. Роль метилирования промоторов в регуляции генов сукцинатдегидрогеназы в проростках кукурузы // Физиология растений. 2012. Т. 59. С. 332–340.
Eprintsev A.T., Fedorin D.N., Karabutova L.A., Igamberdiev A.U. Expression of genes encoding subunits A and B of succinate dehydrogenase in germinating maize seeds is regulated by methylation of their promoters // J. Plant Physiol. 2016. V. 205. P. 33–40.
Enache L.S. ATP citrate lyase – Biology and implication in human pathology // Revista Romana de Medicina de Laborator. 2008. V. 12. P. 17−30.
Chomczynski P., Sacchi N. Singlestep-method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction // Anal. Biochem. 1987. V. 162. P. 156–159.
Rozen S., Skaletsky H. Primer3 on the WWW for general users and for biologist programmers // Methods Mol. Biol. 2000. V. 132. P. 365−386.
Nicot N., Hausman J.F., Hoffmann L., Evers D. Housekeeping gene selection for real-time RT-PCR normalization in potato during biotic and abiotic stress // J. Exp. Bot. 2005. V. 56. P. 2907–2914.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCt method // Methods. 2001. V. 25. P. 402–408.
Hsieh C.L. In vivo activity of murine de novo methyltransferases, Dnmt3a and Dnmt3b // Mol. Cell Biol. 1999. V. 19. P. 8211−8218.
Лакин Г.Ф. Биометрия. М.: Высшая школа, 1990. 351 с.
Rangasamy D., Ratledge C. Compartmentation of ATP: citrate lyase in plants // Plant Physiol. 2000. V. 122. P. 1225–1230.
Takeuchi A., Yamaguchi M., Uritani I. ATP:citrate lyase from opomea potatoes root tissue infected with Ceratocystis fimbriata // Phytochemistry. 1981. V. 20. P. 1235–1239.
Kuhn D.N., Knauf M.J., Stumpf P.K. Subcellular locations of acetyl-CoA synthetase in leaf protoplasts of Spinach oleracea // Arch. Biochem. Biophys. 1981. V. 209. P. 441–450.
Fedorin D.N., Eprintsev A.T. Regulation of fumarate hydratase gene expression in green maize leaves under hypoxic conditions // J. Stress Physiol. Biochem. 2017. V. 13. P. 114−120.
Igamberdiev A.U., Eprintsev A.T. Organic acids: the pools of fixed carbon involved in redox regulation and energy balance in higher plants // Front. Plant Sci. 2016. V. 7. doi 10.3389/fpls.2016.01042
Salmon A., Ainouche M.L. Polyploidy and DNA methylation: new tools available // Mol. Ecol. 2010. V. 19. P. 213–135.
Cokus S.J., Feng S., Zhang X., Chen Z., Merriman B., Haudenschild C.D., Pradhan S., Nelson S.F., Pellegrini M., Jacobsen S.E. Shotgun bisulphite sequencing of the Arabidopsis genome reveals DNA methylation patterning // Nature. 2008. V. 452. P. 215–219.
Niederhuth C.E., Schmitz R.J. Putting DNA methylation in context: from genomes to gene expression in plants // Biochim. Biophys. Acta. 2017. V. 1860. P. 149−156.
Oh E., Kang H., Yamaguchi S., Park J., Lee D., Kamiya Y., Choi G. Genome-wide analysis of genes targeted by PHYTOCHROME INTERACTING FACTOR 3-LIKE5 during seed germination in Arabidopsis // Plant Cell. 2009. V. 21. P. 403–419.
Antequera F., Bird A. Number of CpG islands and genes in human and mouse // Proc. Natl. Acad. Sci. USA. 1993. V. 90. P. 11995−11999.
Deaton A.M., Bird A. CpG islands and the regulation of transcription // Genes Dev. 2011. V. 25. P. 1010–1022.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


