Физиология растений, 2019, T. 66, № 3, стр. 163-177
Фитохромы и другие (фото)рецепторы информации у растений
О. В. Войцеховская
Федеральное государственное бюджетное учреждение науки Ботанический институт им. В.Л. Комарова
Российской академии наук
Санкт-Петербург, Россия
Поступила в редакцию 29.03.2018
После доработки 05.06.2018
Принята к публикации 13.06.2018
Аннотация
В настоящее время у растений выделяют пять групп фоторецепторов, воспринимающих информацию об условиях освещения, o длине светового дня, o температуре окружающей среды, o присутствии патогенов или соседей-конкурентов, o направлении вектора гравитации и других факторах. Эти фоторецепторы позволяют растению ориентироваться в окружающей обстановке и “принимать решения”, необходимые для выживания и успешного размножения: ускорять или останавливать рост, переходить к цветению или покою, выбирать направление роста, регулировать формирование боковых побегов, а также синтез летучих веществ, воздействующих на рост соседей или патогенов. К фоторецепторам относятся фитохромы, криптохромы, фототропины, а также белки семейства ZEITLUPE и рецептор ультрафиолетового излучения В-диапазона UVR8. Несмотря на разнообразие фоторецепторов растений, можно выделить некоторые общие “правила” их функционирования. В основе преобразования информации о количестве и спектральном составе света в ростовой, метаболический и морфогенетический ответ растений лежит принцип контролируемой деградации белков-регуляторов транскрипции генов через взаимодействие активной формы фоторецептора и Е3-убиквитин-лигазного комплекса СОР1-SPA1 в ядре клетки. Кроме СОР1, активные формы фоторецепторов в ядре клетки напрямую взаимодействуют с регуляторами транскрипции, опосредуя их деградацию. Фитохромы – одни из наиболее крупных (молекулярная масса мономера 125 кД) и сложно организованных рецепторов растений – кроме вышеуказанных механизмов, регулируют альтернативный сплайсинг транскриптов, а также осуществляют выбор альтернативных промоторов для тысяч генов растений. Особый интерес представляет взаимодействие фитохромов с жасмонатами: именно фитохромы, как оказалось, регулируют остановку роста растений в ответ на стресс-зависимую активацию жасмонатного сигналинга. В обзоре рассматриваются данные, выявляющие новые потенциальные приложения изучения фоторецепторной регуляции растений для получения сортов сельскохозяйственных культур, способных давать высокий урожай в условиях стресса.
ВВЕДЕНИЕ
Выявление механизмов, регулирующих фотосинтез и донорно-акцепторные взаимосвязи растений, имеет первостепенное значение для создания научной основы повышения продуктивности сельскохозяйственно ценных культур [1]. Выдающийся исследователь фотосинтеза и создатель концепции построения донорно-акцепторных систем целого растения в онтогенезе А.Т. Мокроносов отмечал определяющую роль фотопериодической регуляции как для фотосинтетической функции, так и для формирования архитектуры растений, влияющей на распределение фотоассимилятов между органами [1]. Согласно современным представлениям, у растений функционируют по меньшей мере пять групп фоторецепторов, воспринимающих информацию не только об условиях освещения и длине светового дня, но также о температуре окружающей среды, присутствии патогенов или соседей-конкурентов, направлении вектора гравитации и других факторах [2–4]. К таким рецепторам относятся рецепторы красного (КС) и дальнего красного света (ДКС) – фитохромы; рецепторы, воспринимающие ультрафиолетовое излучение А-диапазона, синий (СС) и зеленый (ЗС) свет – криптохромы, фототропины, белки семейства ZEITLUPE; а также рецептор ультрафиолетового излучения В-диапазона (УФ-В) – белок UVR8 [5–11]. Скорее всего, в растениях функционируют и другие, еще не известные, фоторецепторы, в том числе, специфичные к ЗС [12]. Совокупность фоторецепторов позволяет растению ориентироваться в окружающей обстановке и “принимать решения”, необходимые для выживания и успешного размножения: входить или выходить из состояния покоя, ускорять или останавливать рост, переходить к цветению или задерживать его, выбирать направление роста, образовывать либо подавлять формирование боковых побегов, а также регулировать синтез летучих веществ, воздействующих на рост соседей или патогенов, или включать реакцию “запрограммированной клеточной гибели” [13–18]. Столь широкий спектр физиологических ответов возможен благодаря взаимодействию систем фоторецепции с гормональными системами растений, а также с сигнальными системами, основанными на продукции АФК в фотосинтетическом аппарате [19–21]. Кроме того, как показали недавние исследования, механизмами переключения генетических программ под контролем фоторецепторов могут выступать альтернативный сплайсинг транскриптов, а также выбор альтернативных промоторов для тысяч генов растений [22, 23]. В настоящем обзоре кратко суммируются современные представления о фоторецепторах растений, а также сделан акцент на взаимодействие фитохромной системы растений с системой жасмонатного сигналинга с позиций возможности получения сортов сельскохозяйственных культур, способных давать высокий урожай в условиях стресса.
ГРУППЫ ФОТОРЕЦЕПТОРОВ РАСТЕНИЙ
У Arabidopsis thaliana в настоящее время насчитывают по меньшей мере 14 фоторецепторов: это пять фитохромов (PhyA-E), три криптохрома (СRY1-3), два фототропина (PHOT1, PHOT2), три белка семейства ZEITLUPE (ZTL, FKF1, LKP2) и рецептор УФ-В UVR8. Эти фоторецепторы встречаются у бактерий, грибов, водорослей и наземных растений, но не у всех групп этих организмов [24].
Рецепторы красного света – фитохромы
Ключевыми регуляторами развития и жизнедеятельности растений являются фитохромы. Это одни из наиболее крупных (молекулярная масса мономера 125 кД) и сложно организованных рецепторов у растений. N-концевая часть белка выполняет роль фотосенсора и состоит из трех консервативных доменов PAS, GAF и PHY; к домену GAF через тиоэфирную связь с цистеиновым аминокислотным остатком прикреплен хромофор фитохромобилин [25]. С-концевая часть белка представляет собой серин-треониновую киназу, которая выполняет автофосфорилирование белка, необходимое для образования его активной формы – димера. Фитохромы синтезируются в темноте в цитоплазме в виде неактивной формы. Поглощение фитохромобилином кванта света приводит к небольшим (порядка долей ангстрем) перемещениям молекулярных структур в хромофоре, которые, благодаря особенностям структурной организации белка, приводят к крупным конформационным изменениям в самом фитохроме, его активации и, в конечном итоге, к переключению генетических программ в клетке [25]. При поглощении кванта света двойная связь С15=С16 в составе фитохромобилина изомеризуется, что приводит к повороту плоскости кольца D на 180° [25]; альтернативным механизмом может быть поворот кольца А на 90º по двойной связи С4=С5 [26]. Белковая структура фитохрома образует уникальные трехмерные структуры: необходимый для прочной стабилизации гидрофобных взаимодействий внутри белковой цепи “узел” (полипептидная цепь образует петлю вокруг самой себя) и “шпильку”, образованную антипараллельными бета-слоями. При освещении КС высвобождение и ротация “шпильки” приводят к формированию в PHY-домене альфа-спирали на месте двух бета-слоев, а при освещении ДКС структура фитохрома возвращается в исходное состояние [25]. Такие конформационные изменения способствуют, в том числе, активации киназной функции фитохрома.
У неактивной формы фитохрома максимум поглощения хромофора приходится на красную область спектра (660 нм). После облучения КС фитохром переходит в активную форму, у которой появляется второй максимум поглощения хромофора в области ДКС (730 нм); эти формы условно обозначают Фкс и Фдкс. Освещение ДКС способствует переходу Фдкс обратно в Фкс. Реверсия Фдкс в Фкс также осуществляется и в темноте в результате постепенной терморелаксации фитохромобилина. Поглощение форм Фдкс и Фкс в области 450–550 нм незначительно, а в УФ-А-синей области спектра мало [9]. Однако, поглощение фитохромобилином в составе неактивной формы Фкс даже очень незначительных количеств света в других областях спектра, помимо красной, в том числе в области ДКС, становится физиологически значимым в ситуации, когда белка фитохрома в клетке очень много [27]. Это имеет место у этиолированных проростков Arabidopsis, где содержатся большие количества PhyA, при том, что соотношение различных фитохромов для PhyA, PhyB, PhyC, PhyD и PhyE составляет 85 : 10 : 2 : 1.5 : 1.5, соответственно [28]. В этом случае даже очень слабый ДКС или любой другой свет с большой вероятностью смогут перевести хотя бы несколько молекул PhyA в активную форму, и этих молекул будет достаточно для запуска программы фотоморфогенеза. Именно этим обусловлена особая роль PhyA в деэтиоляции, а также тот факт, что у этиолированных проростков уже активированный фотоморфогенез не “выключается” ДКС [27]. Программа фотоморфогенеза проростков, запускаемая PhyA, включает остановку роста гипокотиля двудольных (мезокотиля у однодольных), рост колеоптиля однодольных, разворачивание семядолей, позеленение проростков и завершение развития фотосинтетического аппарата пластид. Противоположная программа – скотоморфогенез – включает рост гипокотиля двудольных и мезокотиля злаков, торможение экспрессии ряда генов, кодирующих компоненты фотосинтетического аппарата, ферменты их биосинтеза и др. [27].
PhyA – фотолабильный фитохром; на высоком свету он подвергается фотодеструкции. Как уже было сказано, PhyA способен активироваться в ответ на менее 1 мкмоль/м2 квантов любого света в диапазоне 300–780 нм и опосредовать комплекс реакций, обозначаемых как very low fluence response (VLFR). Однако, PhyA может активироваться и на высоком свету (от 1000 мкмоль/м2 квантов и выше) в ответ на увеличение количества ДКС, а также при общем снижении освещенности [29]. Этот тип ответов называется High irradiance response (HIR). Благодаря HIR и PhyA, проростки даже под густым покровом листвы в тени могут полностью завершить деэтиоляцию [27, 30].
В темноте PhyA находится в цитозоле, так как в его структуре отсутствует сигнал ядерной локализации. Находясь в цитоплазме, PhyA может регулировать гравитропизм [31]; цитоплазматические формы фитохромов, возможно, взаимодействуют напрямую с белками плазматической мембраны [32]. Большое количество публикаций описывают реакции растений, регулируемые фитохромами, которые реализуются в течение менее чем 10 мин после воздействия КС или ДКС, т.е. слишком краткого промежутка времени для запуска изменений на уровне экспрессии генов (см. обзор [33]). Например, это перемещение хлоропласта в клетке водоросли Mougeotia в ответ на воздействие поляризованного красного света [34]. У сосудистых растений к таким реакциям относится быстрая (в течение нескольких секунд) деполяризация плазматической мембраны кончиков корней ячменя в ответ на действие КС, которая снимается ДКС (т.н. эффект Tanada; [35]), а также сворачивание листьев бобовых на ночь, быстрое набухание протопластов пшеницы и др. (см. обзор [33]). Интересно, что эти реакции могут быть опосредованы взаимодействием цитоплазматических фитохромов с другими фоторецепторами – прикрепленными к плазматической мембране фототропинами (см. ниже). Такое взаимодействие было продемонстрировано для клеток мха Physcomitrella [36], а для сосудистых растений пока не было показано, но представляется вероятным; не исключено, что в таком взаимодействии важную роль играют цитоплазматические белки PKS (phytochrome kinase substrate) [37]. Наконец, цитоплазматические фитохромы могут регулировать трансляцию мРНК, что было показано для транскриптов фермента протохлорофиллид оксидоредуктазы А [38].
Под влиянием любого света PhyA быстро перемещается в ядро с помощью белков FHY и FHL, которые содержат сигнал ядерной локализации [27]. С этими белками связывается фосфорилированная форма PhyA, которая в ядре дефосфорилируется и высвобождается. В ядре PhyA напрямую взаимодействует с Е3-убиквитинлигазным комплексом СОР1-SPA1 (Constitutive Photomorphogenic 1/Suppressor of PhyA 1) и с регуляторами транскрипции PIF1 и PIF3 (см. ниже).
В отличие от PhyA, PhyB и все другие фитохромы Arabidopsis фотостабильны. У проростков, выращенных на постоянном свету, доминирующим фитохромом становится PhyB: соотношение фитохромов по результатам иммуноблоттинга для PhyA, PhyB, PhyC, PhyD и PhyE составляет 5 : 40 : : 15 : 15 : 25, соответственно [28]. Однако, абсолютное содержание PhyB намного ниже, чем содержание PhyA в клетках этиолированных проростков; в связи с этим ни очень низкий КС, ни высокий ДКС или какой-либо другой свет не способны активировать физиологически значимое число молекул PhyB. Таким образом, только КС интенсивностью не менее 1–1000 мкмоль/м2 специфично активирует PhyB и комплекс регулируемых им реакций, называемых low fluence response (LFR). С этим связано и “деактивирующее” действие ДКС на программы фотоморфогенеза, запускаемые активной формой PhyB [27]. Поскольку PhyB содержит сигнал ядерной локализации, то он находится в ядре; там он взаимодействует с СОР1-SPA1 и с регуляторами транскрипции PIF4, PIF5, PIF7 и др. а также выполняет ряд других функций (см. ниже). На свету PhyB запускает фотоморфогенез, который выражается в завершении развития фотосинтетического аппарата хлоропластов, росте листовых пластинок в ширину, компактизации розеток и побегов, образовании боковых побегов (кущении) [13]. Противоположная программа – скотоморфогенез, или “синдром избегания тени” (shade avoidance syndrome, SAS), при инактивации PhyB за счет повышения в спектре падающего света доли ДКС и снижения доли КС приводит у взрослых растений к удлинению черешков, междоузлий, появлению гипонастических листьев и бледно-зеленой окраске, вызванной неполным формированием фотосинтетического аппарата [13]. На ярком свету именно дисфункция PhyB, но не PhyA, вызывает бледно-зеленую окраску листьев [30, 39]. Отсутствие у мутанта риса PhyB приводило к ингибированию экспрессии генов, кодирующих необходимые для формирования фотосинтетического аппарата субъединицу Mg-хелатазы ChlH и ее активатор GUN4, развитию бледно-зеленого фенотипа и запуску “синдрома избегания тени” [40].
PhyB является активатором формирования устьиц [41]. На примере формирования устьиц впервые было продемонстрировано, что PhyB действует системно, то есть что регулируемые им сигналы, опосредующие дифференциацию устьиц в эпидерме листа, распространяются из клетки в клетку, действуя неклеточноавтономно [42]. В листе ген PhyB экспрессируется в клетках-предшественницах устьиц, в устьицах и в эпидерме. У лишенного PhyB мутанта Arabidopsis со сниженным числом устьиц на единицу площади листа происходило восстановление формирования устьиц при комплементации кДНК нативного PhyB, причем под контролем не только промотора, специфично активного в устьицах, но и любого промотора, активного в других клетках и тканях, в том числе pAtSUC2, активного лишь в клетках флоэмы [42]. Кроме того, неклеточноавтономное действие PhyB было подтверждено комплементацией в мутанте phyb негативного гравитропизма гипокотиля с помощью экспрессии гена PhyB в клетках эпидермиса гипокотиля [43]. Поскольку гравитропическая реакция реализуется в эндодермисе, это также говорит о наличии регулируемого PhyB мобильного сигнала.
В целом PhyA является ключевым “переключателем” программ ското- и фото-морфогенеза у этиолированных проростков и взрослых растений в тени, а PhyB – у зеленых проростков и взрослых растений на ярком свету [27]. Это верно как для двудольных, так и для однодольных растений. Но в организации фитохромной системы однодольных и двудольных имеются и некоторые различия. В отличие от Arabidopsis, у риса, пшеницы и ячменя обнаружено всего три фитохрома PhyA-C. Однако, если PhyB у двудольных – репрессор цветения, то у исследованных злаков этот фитохром выступает позитивным регулятором цветения наряду с PhyC [44, 45]. В остальном функциональных различий фитохромов у обоих классов покрытосеменных пока не обнаружено.
В настоящее время описано большое число аллелей phya и phyb, где у мутантов благодаря мутациям в различных доменах апобелка специфично “отключены” некоторые функции фитохромов, например, у растений PhyA-302 отсутствует реакция на высокий свет (HIR), но сохраняется ответ на очень низкие уровни света (VLFR). Совсем недавно было подтверждено, что фитохромы у растений выполняют функцию терморецепторов [2]: конститутивно активная мутантная форма PhyB с заменой тирозина-276 на гистидин не подвергается в темноте реверсии в неактивную форму; ее использование в экспериментах помогло установить, что функция фитохромов как рецепторов температуры связана со скоростью реверсии Фдкс в Фкс в темноте [2]. Чем выше температура в ночной период, тем быстрее осуществляется реверсия в неактивную форму. Кроме того, чем выше температура, тем слабее связывание PhyB с промоторами регулируемых генов. Такой механизм терморецепции отличается от механизма, используемого двухкомпонентными сенсорными гистидиновыми киназами цианобактерий Hik33, которые так же, как и фитохромы растений, одновременно являются сенсорами света и температуры, но воспринимают индуцируемые температурой изменения в текучести мембран, в которые они встроены [46]. У Arabidopsis функциональные различия между пятью фитохромами проявляются в их роли в терморегуляции ряда функций растений: так, в тепле прорастание семян регулируется главным образом PhyB, а на холоду – PhyE; однако, после продолжительного холода семенам для прорастания необходим PhyA [47]. Подавление цветения на холоду регулируется PhyE, а в тепле – PhyB [47].
Фитохромы являются крупнейшими регуляторами транскрипционной активности генома растений. Последние данные показывают, что и PhyA, и PhyB могут напрямую связываться с промоторами регулируемых генов [2, 48]. У проростков при перемещении из темноты на свет фитохромы контролируют не только экспрессию нескольких тысяч генов, но и альтернативный сплайсинг транскриптов более тысячи генов [22]. Другой механизм, который регулируют фитохромы, представляет собой светозависимый выбор промоторов [23]. Наличие у гена альтернативных промоторов приводит к тому, что для одного и того же гена в зависимости от выбора старта транскрипции возможно получение мРНК, различающихся 5'-нетранслируемой областью, что может влиять на стабильность транскриптов, а также на N-концевую последовательность кодируемого белка. Как правило, сигнальные пептиды, обеспечивающие транспорт белков в митохондрии и хлоропласты, расположены на N-конце. Оказалось, что PhyB, вероятно, напрямую связываясь с ДНК регулируемых генов, контролирует выбор промотора для транскрипции предположительно более чем двух тысяч генов, что может приводить к синтезу белков с цитоплазменной либо органельной локализацией, в зависимости от световых условий [23]. В частности, в растениях Arabidopsis thaliana, растущих в тени, обнаруживаются как хлоропластная, так и ранее неизвестная цитоплазматическая изоформа фермента фотодыхания глицерат-киназы: обе изоформы являются продуктами одного и того же гена, но в зависимости от опосредованного PhyB выбора промотора N-сигнальный пептид, направляющий белок в хлоропласты, либо имеется, либо отсутствует. Наличие цитоплазматической изоформы обеспечивает функционирование дополнительного “шунта” фотодыхания, который играет важную роль в защите растений от фотоингибирования при переносе растений из тени на яркий свет [23].
В то время как механизмы синтеза и деградации белка фитохромов в клетке и связанная с этим регуляция сигнальной функции фитохромов интенсивно изучаются, намного меньше известно о том, как регулируется транскрипция генов, кодирующих фитохромы. Показано, что регуляция транскрипции PhyA осуществляется через (де)метилирование и (де)ацетилирование гистонов, и возможно в этом участвует PhyB [10]. По другим данным, на свету PhyB опосредует метилирование промотора гена PhyA и выключает его экспрессию [27]. В листьях Arabidopsis экспрессия гена PhyA ингибировалась светом, причем, вероятно, что опосредованно самим PhyA, а уровень экспрессии гена PhyB не изменялся в зависимости от световых условий; однако, в корнях экспрессия генов обоих фитохромов, но особенно PhyB, увеличивалась на свету [49]. В темноте экспрессия генов обоих фитохромов в листьях Arabidopsis увеличивалась; однако, эти данные были получены при изучении слияния промоторов генов фитохромов с маркерным геном GUS, то есть, не была учтена возможная регуляция стабильности транскриптов генов фитохромов in vivo в области 3'-UTR [49]. Позже аналогичным методом были изучены паттерны экспрессии PhyA у риса [50]. Оказалось, что у риса PhyA экспрессируется во всех тканях этиолированных проростков, а под действием КС (но не ДКС) экспрессия снижается и становится приуроченной только к сосудистым пучкам листьев; это снижение опосредовано PhyB [50].
Еще одним механизмом, регулирующим уровень транскрипции генов, кодирующих белки фитохромов, может быть содержание 5-аминолевулиновой кислоты – общего субстрата биосинтеза хлорофилла, гема и фитохромобилина. Поскольку синтез фитохромобилина происходит в пластидах, такой механизм мог бы служить “обратной связью” для координации биосинтеза апобелков фитохромов и хромофоров. В недавней работе получены доказательства в пользу совместной регуляции фитохромной системой и ретроградным сигналингом генов, индуцируемых светом [21]. В целом роль фитохромов в регуляции биосинтеза хлорофиллов в проростках велика и активно изучается [51].
Гены, кодирующие фитохромы, обнаружены у некоторых грибов, бактерий, у бурых водорослей (в том числе, в геномах вирусов, поражающих бурые водоросли), но отсутствуют в геномах гаптофитов, красных и зеленых водорослей [24]. Фитохромы харовых водорослей и наземных растений имеют общее происхождение. Фитохромы представлены единственной копией гена у печеночников, антоцеротовых мхов и разноспоровых плаунов, в то время как у настоящих мхов, равноспоровых плаунов, папоротников и семенных растений имела место их диверсификация. Особо следует отметить неохромы – фоторецепторы зигнемовых водорослей, антоцеротовых мхов и папоротников, где “фитохромный” фотосенсорный N-конец соединен с “фототропиновым” C-концом, и присутствуют оба хромофора [24, 52].
Рецепторы синего света – фототропины, белки семейства ZEITLUPE, криптохромы
Фототропины представляют собой протеинкиназы, активируемые светом. Они, как правило, локализуются у плазмалеммы, но не являются интегральными мембранными белками; они также могут ассоциироваться с внешней мембраной хлоропластов [6]. У Arabidopsis имеются два фототропина: фотостабильный PHOT1 и фотолабильный PHOT2. Активация светом и автофосфорилирование фототропинов вызывает их перемещение в цитозоль (PHOT1) или к мембранам Гольджи (PHOT2). Фототропины несут на N-конце два домена LOV1 и LOV2, каждый из которых связывает хромофор ФМН, а на С-конце располагается Ser/Thr-киназный домен, необходимый для автофосфорилирования под действием СС [5]. Множественное фосфорилирование по С-концу способствует образованию активной формы рецептора – димерной. В темноте киназная активность у фототропинов отсутствует, но поглощение кванта света хромофором в составе домена LOV2 способствует ее проявлению. Кроме фосфорилирования по остаткам серина и треонина, под действием СС в белке происходят структурные изменения, а именно частичное “раскручивание” альфа-спирали Jalpha [53]. Нековалентно связанный с белком окисленный ФМН в составе LOV-доменов после поглощения кванта света 450 нм образует ковалентную связь между атомом углерода ФМН и атомом серы расположенного рядом остатка цистеина. Образующийся в течение нескольких микросекунд аддукт неспособен к поглощению СС, а его появление способствует переходу фоторецептора в активное состояние. В темноте в течение нескольких десятков или сотен секунд происходит реверсия фоторецептора в неактивное состояние. Неполный список функций, регулируемых фототропинами у растений, включает фототропизм побега, корня и листьев, перемещение хлоропластов в ответ на световые и температурные сигналы, регуляцию движений устьиц [6, 54]. Механизм регуляции лучше всего прояснен для открывания устьиц на СС: фототропины активируют киназу BLUS1 (blue-light signaling 1), специфичную для замыкающих клеток устьиц, которая в свою очередь активирует Н+-АТФазу плазмалеммы, что вызывает гиперполяризацию мембраны и вход калия через внутрь-выпрямляющие каналы, набухание замыкающих клеток и открытие устьиц [55].
Поскольку биохимические “темновые” реакции фотосинтеза зависят от температуры, один и тот же уровень света при разной температуре может оказывать разное “давление возбуждения” (excitation pressure) на фотосинтетический аппарат хлоропластов; в связи с этим хлоропласты на одном и том же освещении, но при более низкой температуре, перемещаются к антиклинальным стенкам клеток мезофилла, а при более высокой – к периклинальным [54]. Это наблюдение дало основание предполагать, что фототропины у растений могут выступать термосенсорами. На примере Marchantia polymorpha, обладающей только одной копией гена MpPHOT, было показано, что перемещение хлоропластов, а также ядра и пероксисом, в ответ на снижение температуры требует наличия СС и обладающего киназной активностью MpPHOT [54]. Оказалось, что при низкой температуре на СС сильно возрастает уровень автофосфорилирования MpPHOT, а также значительно увеличивается время жизни его активированного состояния, что в совокупности способствует перемещению хлоропластов к антиклинальным клеточным стенкам и избеганию фотоокислительного стресса [54, 56]. Таким образом, фитохромы и фототропины представляют собой терморецепторы растений, которые функционируют в разных световых условиях и в разных временных диапазонах (время жизни активной формы фоторецептора для фитохромов составляет десятки минут, а для фототропинов – десятки секунд) [54].
Белки семейства ZEITLUPE – ZTL, FKF1 и LKP1 – представляют собой Е3-убиквитин-лигазы, активирующиеся под действием синего света и опосредующие убиквитинирование и протеасомную деградацию своих субстратов [6, 57]. Они содержат на N-конце единственный LOV-домен с хромофором ФМН, за которым располагаются F-box домен, обеспечивающий связь Е3-убиквитин-лигазы с субстратом, и KELCH-домен, ответственный за белок-белковые взаимодействия. Показано, что ZTL контролирует суточные циркадные ритмы, FKF1 контролирует переход к цветению, а LKP1 необходим для обоих процессов. Фотоактивация LOV-домена изменяет способность этих белков взаимодействовать с регуляторным белком GIGANTEA (GI), а также увеличивает их E3-убиквитин-лигазную активность. Комплекс GI-FKF1 необходим для запуска деградации репрессоров экспрессии генов CO (CONSTANS) – CDF (Cycling DOF Factors). CONSTANS, в свою очередь, активирует транскрипцию FT – “флоригена” и главного активатора цветения Arabidopsis. Комплекс GI-ZTL, напротив, ограничивает способность ZTL убиквитинировать его субстраты, которые представляют собой компоненты циркадного осциллятора. У белков семейства ZEITLUPE фотоактивация хромофора ФМН так же, как и у фототропинов, способствует образованию аддукта с цистеинилом, но его распад в случае FKF1 замедлен (время жизни может составлять несколько суток), а у ZTL идет так же быстро, как у фототропинов [6, 57]. В темноте ZTL опосредует деградацию репрессора коровых циркадных генов Timing of CAB expression 1 (TOC1), а СС ингибирует этот процесс: ингибирование ZTL путем связывания с GI способствует накоплению TOC1. Аналогично, GI связывает FKF1 (после активации последнего СС), но это, напротив, усиливает его убиквитин-лигазную активность: в результате на длинном дне запускается FKF1-зависимая деградация репрессоров транскрипции CO и FT – CDF [6, 57].
Еще один класс рецепторов синего света – криптохромы – изначально возникли в эволюции как ФАД-зависимые ДНК-фотолиазы, то есть ферменты, репарирующие вызванные синим светом разрывы в ДНК. Эта функция до сих пор сохранилась у некоторых криптохромов наземных растений, например, у криптохромов, относящихся к группе CRY-DASH (Drosophila, Arabidopsis, Synechocystis, Homo), которые могут связываться с ДНК и обладают ДНК-лиазной активностью [58]; примечательно, что для этой группы криптохромов фоторецепторная функция пока что не была показана. Домен PHR (photolyase homology region) в составе криптохромов связывает хромофор ФАД, который поглощает свет в диапазоне 320–500 нм, а также хромофор птерин (5,10-метенилтетрагидрофолат), который выполняет роль антенны, передавая на ФАД энергию света ближнего УФ-диапазона 370–390 нм [11]. Криптохром с окисленным ФАД представляет собой неактивную форму фоторецептора; после фотовосстановления и протонирования образуется нейтральный семихинон ФАД · H и фоторецептор переходит в активную форму [59]. Дальнейшее восстановление хромофора в ФАД · H2 (что имеет место при поглощении квантов зеленого света) соответствует переходу криптохрома в неактивное состояние [59]. Однако, для осуществления ДНК-фотолиазной активности необходим именно полностью восстановленный ФАД · H2. Криптохромы также могут связывать АМФ и АТФ, и, возможно, это способствует стабилизации активной семихинон-содержащей формы [6]. В составе криптохрома функционирует внутримолекулярная цепь переноса электронов через триптофаны к ФАД в ходе фотоактивации последнего, а его протонирование осуществляется от остатка аспартата в полипептидной цепи. На С-конце криптохромов (кроме группы CRY-DASH) имеется очень вариабельный сигнальный домен CCE (cryptochrome C-terminal extension) [11]. Киназных доменов в составе криптохромов нет, но для их активации также необходимо множественное фосфорилирование по С-концу и димеризация. При этом экспонируется так называемый NC-мотив на С-конце, содержащий 80 аминокислотных остатков. Экспрессия только лишь кДНК, кодирующей эти 80 аминокислотных остатков, комплементирует фенотип позднего цветения у мутантов Arabidopsis, дефектных по cry [11].
У Chlamydomonas единственный криптохром воспринимает и синий, и красный свет. В геноме Physcomitrella содержатся гены двух криптохромов, а у Adianthum capillus-veneris обнаружено пять криптохромов. У риса обнаружены два рецептора CRY1 и один CRY2, а у пшеницы два рецептора CRY1, один CRY2 и один CRY-DASH [11]. У Arabidopsis найдены три криптохрома: CRY1 – светостабильный, который активируется на сильном свету, СRY2 – светолабильный, который воспринимает только очень слабый свет, а на сильном свету подвергается деградации, вероятно, через СОР1-SPA1 Е3-убикивитин-лигазный комплекс [60], и CRY3, который у Arabidopsis относится к группе CRY-DASH. CRY1 и СRY2 локализуются в ядре, а CRY3 – в митохондриях и в хлоропластах. По понятным причинам лучше всего исследована криптохромная система регуляции Arabidopsis. Было показано, что криптохромы в условиях естественного затенения являются сенсорами соотношения СС/ЗС [61, 62]. Оказалось, что “синдром избегания тени” может вызываться не только снижением соотношения КС/ДКС, но и повышением доли ЗС в падающем спектре; запуск данной реакции ответ контролируется через криптохромы [12, 61, 62]. Кроме того, Zhang с соавт. [12] обнаружили и независимый от фито- и криптохромной систем ответ Arabidopsis на зеленый свет, который, по-видимому, осуществляется через еще не идентифицированный рецептор.
На СС активные формы криптохромов в ядре взаимодействуют с белками-регуляторами транскрипции PIFs, а также с факторами транскрипции CIB (cry-interacting bHLH), обеспечивая убиквитин-зависимую деградацию последних через СОР1-SPA1 убиквитин-лигазный комплекс. Кроме того, СRY связываются с СОР1-SPA1 и способствуют его удалению из клеточного ядра, запуская процессы фотоморфогенеза (см. ниже), а также регулируя (совместно с другими фоторецепторами) переход к цветению, поскольку именно СОР1 вызывает убиквитинирование и деградацию белка CONSTANS, необходимого для запуска цветения. Активная форма CRY2 связывает транскрипционный фактор CIB1, что приводит к активации экспрессии “флоригена” FT. В этом процессе также задействованы CIB2 и СIB5. Кроме того, у Arabidopsis на синем и белом свету CRY2 выступает негативным регулятором ингибитора цветения PhyВ. Таким образом CRY2 выполняет функцию основного активатора цветения у Arabidopsis. Запуск фотоморфогенеза на СС под контролем криптохромов идет с участием тех же принципиальных компонентов – активаторов транскрипции HY5, HFR1, HYH, что и при фитохромной регуляции (см. ниже). Криптохромы активируют экспрессию всех генов фотосинтетического аппарата, белки которых кодируются в ядре, таких, как САВ и RbcS. На СС CRY1 вызывает позеленение корней, т.е. фотоморфогенез пластид клеток корня [63]. При снижении освещенности в синей области спектра криптохромы могут вызывать реакцию “избегания тени” (SAS), но в данном случае не происходит подавления иммунитета растений, в отличие от SAS, контролируемого фитохромами (см. ниже) [62, 64], что может представлять интерес для использования в практике. Таким образом, криптохромы контролируют циркадные ритмы, индукцию цветения, СС-зависимый фотоморфогенез и другие функции растений [6].
Под действием СС у Arabidopsis CRY1 после перемещения в ядро активирует анионные (Cl-) каналы [11]. Это предположительно вызывает временную деполяризацию плазмалеммы, наблюдаемую в течение 30 с после воздействия СС, однако, точный механизм неизвестен. Кроме того, восстановленные формы хромофора криптохромов – семихинон ФАД·H и ФАД·H2- – могут способствовать восстановлению кислорода и появлению в клетке АФК, таких, как супероксид-радикал и пероксид водорода [11].
Рецептор ультрафиолетового света В-диапазона: UVR8
Лишь небольшая часть солнечного спектра (менее одного процента) представлена ультрафиолетом В-диапазона; тем не менее, у растений имеются рецепторы, способные специфично распознавать фотоны УФ-В. В настоящий момент у Arabidopsis обнаружен только один фоторецептор с такой функцией, UV RESISTANCE LOCUS 8 (UVR8) [65]. Однако, гены-гомологи UVR8 обнаруживаются во всех секвенированных геномах высших растений, мхов и водорослей [8]. UVR8 Arabidopsis представляет собой белок структуры “бета-пропеллер”, который в неактивном состоянии существует в форме димера, локализованного в цитоплазме, а при поглощении УФ-В переходит в активную мономерную форму, которая может перемещаться в ядро. Значительная часть активной формы рецептора остается в цитоплазме, но ее функции там пока не известны. Хромофором, поглощающим свет УФ-В, выступают остатки триптофана в полипептидной цепи UVR8. В димере UVR8 остатки триптофанов и аргининов, расположенные вблизи друг от друга, взаимодействуют, образуя “катион-пи” связи; поглощение триптофаном квантов УФ-В вызывает разрушение этих связей и мономеризацию белка [8]. В темноте в течение нескольких часов происходит ре-димеризация и инактивация рецептора; этому способствуют регуляторные WD40-белки RUP1 и RUP2 (Repressor of UV-B photomorphogenesis) [8].
В ядре UVR8 напрямую связывается с промоторами генов, кодирующих транскрипционные активаторы фотоморфогенеза, например, HY5. Кроме того, белок UVR8 в ядре взаимодействует с основным репрессором фотоморфогенеза Е3-убиквитин-лигазой СОР1. Однако, в отличие от других фоторецепторов – фитохромов и криптохромов, которые, связываясь с СОР1, приводят к “ингибированию ингибитора”, в сигналинге, опосредованном УФ-В, СОР1 играет роль активатора [8]. Оказалось, что UVR8 может напрямую взаимодействовать с СОР1 независимо от SPA1, и при этом не подвергаться деградации; при этом также не происходит выноса СОР1 из ядра, но запускается фототропизм и УФ-В-зависимый фотоморфогенез, который может включать деэтиоляцию, остановку роста гипокотиля проростков, активацию биосинтеза флавоноидов, и даже регуляцию циркадных ритмов и устойчивость растений к патогенам и грызущим насекомым [8]. Показано, что освещение УФ-В усиливает уровень иммунитета растений как зависимо, так и независимо от жасмонатного сигналинга, видимо, за счет биосинтеза фенилпропаноидов; более того, естественный уровень УФ-В необходим для иммунитета [14]. В связи с этим дальнейшее изучение механизмов фоторецепции и трансдукции УФ-В сигнала представляет большой интерес и с практической точки зрения, так как в данном случае активация иммунитета растений не связана с остановкой роста, как в случае жасмонатов (см. ниже). Активация PhyB у шпината и картофеля увеличивала устойчивость растений к УФ-В облучению [66, 67], что позволяет предположить наличие перекрестных путей трансдукции сигнала фитохромов и UVR8.
ОБЩИЕ МЕХАНИЗМЫ ФУНКЦИОНИРОВАНИЯ ФОТОРЕЦЕПТОРОВ РАСТЕНИЙ
Несмотря на разнообразие рецепторов света растений, можно выделить некоторые общие “правила” их функционирования. Так, для фитохромов, криптохромов и фототропинов активная форма рецептора, как правило, представляет собой димер, образование которого зависит от (авто)фосфорилирования; эта форма образуется при поглощении коротковолнового света (СС или КС, соответственно типу фоторецептора) и переходит в неактивную при поглощении длинноволнового света (ЗС или ДКС, соответственно типу фоторецептора). Для фитохромов, криптохромов и фототропинов в клетке имеются два типа рецептора, один из которых воспринимает крайне низкие уровни света и на высоком свету подвергается фотодеструкции (например, PHOT2, CRY2, PhyA у Arabidopsis), а другой воспринимает информацию о высоком уровне света и является фотостабильным (например, PHOT1, CRY1, PhyB у Arabidopsis).
В трансдукции воспринимаемого фоторецепторами светового сигнала могут участвовать вторичные мессенджеры Ca2+, cAMP, cGMP, G-белки и другие компоненты [32]. В основе преобразования информации о количестве и спектральном составе света в ростовой, метаболический и морфогенетический ответ растений лежит принцип регулируемой деградации белков-регуляторов транскрипции генов: активная форма фоторецептора (фитохрома, криптохрома или UVR8) входит в клеточное ядро и связывается с Е3-убиквитин-лигазой СОР1 – ферментом, вызывающим убиквитинирование регуляторов генетических программ, и их деградацию через 26S-протеасомы [60]. Находясь в ядре, СОР1 ингибирует фотоморфогенез, регулирует циркадные ритмы и цветение, иммунитет, взаимодействие между различными группами гормонов, работу устьиц и другие функции. Фоторецепторы способствуют выносу СОР1 из ядра, и таким образом переключению генетических программ [60]. Кроме СОР1-зависимого пути, активные формы фоторецепторов в ядре клетки напрямую взаимодействуют с репрессорами транскрипции, препятствуя их работе, и таким образом также активируют ряд программ [27]. Белки семейства ZEITLUPE не взаимодействуют напрямую с СОР1, но сами являются светозависимыми Е3-убиквитин-лигазами, которые подобно СОР1 поступают в ядро клетки и опосредуют протеасомную деградацию важнейших регуляторов. Для фототропинов пока не известно, могут ли они выступать регуляторами транскрипционной активности большого числа генов; недавнее исследование показало, что у томата наблюдается фототропин-зависимая регуляция экспрессии более сотни генов, в том числе кодирующих белки, необходимые для реорганизации хроматина, регуляции транскрипции и трансляции [68]. Однако, механизм данной регуляции пока остается неизвестен; можно предположить, что в нем задействованы пути фитохромного сигналинга [69].
Рис. 1.
Упрощенная схема интеграции сигналов, поступающих от фоторецепторов, активируемых светом различных областей спектра, у Arabidopsis thaliana. Стрелками показаны активирующие и ингибирующие взаимодействия. Двойной стрелкой показано прямое взаимодействие UVR8 с COP1 и вызванный ответ. Штриховой стрелкой обозначены взаимодействия фототропинового и фитохромного сигналинга. Aux – ауксины; GA – гиббереллины; Brs – брассиностероиды; JA – жасмонаты.
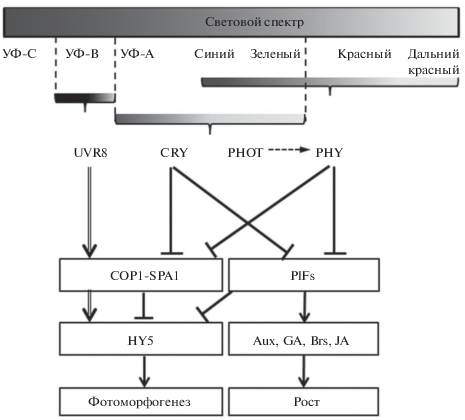
В результате подавления СОР1-активности на свету в клеточном ядре происходит накопление ряда транскрипционных факторов – активаторов фотоморфогенеза, из которых bZIP-факторы транскрипции HY5 и HYH, bHLH-фактор транскрипции HFR1 и MYB-белок LAF1 являются наиболее важными и находятся в центре регуляции транскрипционной активности генома растительной клетки светом и температурой [20]. В темноте данные белки подвергаются СОР1-зависимой протеасомной деградации. Кроме того, в темноте эти мастер-регуляторы взаимодействуют и с группой транскрипционных факторов PIFs (Phytochrome-interacting factors) – еще одной системой, регулирующей ответ растений на изменения световых условий.
PIFs представляют собой транскрипционные факторы bHLH. Белки PIF1, PIF3, PIF4, PIF5, PIF6, PIF7, PIF8 выступают активаторами скотоморфогенеза и ингибиторами фотоморфогенеза на протяжении всей жизни растения, опосредуя светозависимую регуляцию роста; однако, нужно отметить, что даже на ярком свету некоторый базальный уровень активности PIFs необходим для поддержания ростовых процессов [70]. PIFs обеспечивают рост путем многоуровневой регуляции нескольких классов ростовых гормонов. Так, они контролируют экспрессию генов ферментов биосинтеза ауксинов YUCCA [71]; кроме того, PIF3 и PIF4 связывают белки DELLA – негативные ингибиторы генов ответа на гиббереллины, а PIF5 активирует репрессоры биосинтеза гиббереллинов. Также DELLA и PIFs напрямую связываются с BZR1 – регулятором генов ответа на брассиностероиды [13]. Интересно отметить, что активация биосинтезов ауксина и гиббереллинов через PIFs регулируется снижением доли КС в спектре, а активация через PIFs брассиностероидного сигналинга – снижением доли СС [62]. Еще один тип взаимодействий между белками DELLA и PIFs регулирует остановку роста в ходе стрессового ответа растения на жасмонатный сигналинг [70]. В отсутствие жасмонатов белки-репрессоры JAZ связываются с факторами транскрипции MYC2/3/4 – активаторами генов жасмонатного ответа – и препятствуют их функционированию [72]. Белки JAZ взаимодействуют также и с белками DELLA; это взаимодействие частично снижает взаимодействие JAZ и MYC, а кроме того, высвобождает из комплексов DELLA-PIFs часть PIFs, которые, не будучи связанными, способствуют усилению роста. Синтез жасмонатов приводит к деградации JAZ и усилению связывания DELLA с PIFs, что снижает рост. Таким образом, баланс между MYС-зависимой активацией генов ответа на жасмонаты и программами роста на низком свету, регулируемыми PIF, в определенной мере зависит от биосинтеза гиббереллинов и опосредован белками DELLA: биосинтез гиббереллинов, вызывая деградацию DELLA, активирует PIFs-регулируемый рост и ингибирует экспрессию генов жасмонатного сигналинга [72].
В составе PIFs помимо ДНК-связывающего домена содержатся домены взаимодействия с фитохромами: APB (Active PhyB binding), а в составе PIF1 и PIF3 еще и домен APA (Active PhyA binding). Показано, что PhyA непосредственно взаимодействует с PIF1 и PIF3, а PhyB и c другими PIFs. Фитохромы, связываясь с PIFs, вызывают их фосфорилирование, убиквитинирование и протеасомную деградацию в течение нескольких минут, а кроме того, ингибируют связывание PIFs с промоторами их генов-мишеней [13]. Последние исследования показывают, что PIFs как крупнейшие системные интеграторы развития растений являются общим регуляторным звеном, куда поступают сигналы, воспринимаемые не только фитохромами, но и другими фоторецепторами: криптохромами и UVR8 [71, 73, 74]. Таким образом, самые различные сигналы от большинства фоторецепторов растений поступают на основные компоненты трех крупных регуляторных модулей: репрессор фотоморфогенеза COР1, активатор фотоморфогенеза HY5 и системные интеграторы PIFs (рис. 1).
“СИНДРОМ ИЗБЕГАНИЯ ТЕНИ” И ЕГО ЗНАЧЕНИЕ ДЛЯ ПРОДУКТИВНОСТИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР
“Синдром избегания тени” (shade-avoidance syndrome, SAS) представляет собой программу скотоморфогенеза, которая активируется в ответ как на снижение соотношения КС/ДКС в спектре, так и на общее снижение количества красного, синего, белого или УФ-В света, а по последним данным, и в ответ на снижение соотношения СС/ЗС [62]. Все эти изменения в спектре характерны для световых условий под плотным листовым пологом [4, 13]. Это позволяет предполагать, что в SAS так или иначе участвуют все фоторецепторы. Следует подчеркнуть, что само по себе снижение соотношения КС/ДКС может запускать SAS и на высоком свету: это позволяет растениям еще до затенения “заметить” соседей – будущих конкурентов за ресурс света – и заранее ускорить рост и запустить другие адаптивные реакции из программы SAS. Снижение соотношения КС/ДКС происходит за счет преимущественного поглощения зелеными частями растений КС и отражения ДКС; в результате сбоку на растения поступает отраженный от соседних стеблей обогащенный ДКС свет [4]. Снижение соотношения КС/ДКС переводит PhyB, который выступает главным ингибитором SAS на ярком свету, в неактивную форму. В тени главным ингибитором SAS является PhyA, а именно его дефосфорилированная, относительно фотостабильная форма, которая появляется в клетке при активации HIR. Запуск SAS опосредован СОР1-зависимой деградацией активаторов фотоморфогенеза HY5 и HFR1, а также активацией генов, регулируемых PIF4 и PIF5.
SAS обусловливает удлинение черешков листьев, их гипонастии, остановку роста листовой пластинки в ширину и ускорение ее роста в длину, удлинение междоузлий, замедление биосинтеза хлорофиллов и другие реакции – компоненты скотоморфогенеза. У злаков фактор транскрипции Grassy tillers в ходе SAS усиливает покой боковых почек и ингибирует кущение; он активируется за счет другого белка – teosinthe branched, который ингибируется PhyB [75]. Показано, что запуск SAS ингибирует эмиссию ряда летучих соединений, биосинтез которых активируется жасмонатами, возможно, в связи со снижением уровня фитохромов в клетке [76]. Кроме того, в развитии SAS задействованы механочувствительные каналы [4]. Механостимуляция по-разному влияет на выраженность симптомов SAS: усиливает их у проростков и снижает у взрослых растений. По-видимому, для проростков механостимуляция выступает дополнительным сигналом о “наличии соседей”, а для взрослых растений – сигналом о том, что растение выросло и поднялось над уровнем травостоя, где имеется естественная механостимуляция за счет движения воздуха и порывов ветра, отсутствующих в толще травостоя, и значит, избавилось от потенциальной конкуренции [4].
Жасмонаты (обеспечивающие защиту против некротрофных патогенов и грызущих насекомых) и салицилаты (защита от биотрофов) представляют собой становой хребет иммунитета растений [14]. Замечено, что у растений, растущих в тени, степень пораженности био- и некротрофами, как правило, больше, а кормящиеся на таких растениях личинки насекомых крупнее, чем у растений, растущих на ярком свету [14]. Действительно, SAS, обусловленный снижением КС/ДКС, часто связан со снижением иммунной защиты растений за счет ослабления жасмонатного сигналинга [14]. Инактивация PhyB в тени снижает и уровень биосинтеза салициловой кислоты [14, 77]. Ранее эти явления интерпретировались как способ перенаправить энергию и ресурсы растений от защиты к росту, с целью обогнать конкурентов за доступность света [14].
В целом запуск SAS приводит к снижению урожая: например, у злаков меняется перераспределение ресурсов от колосьев и листьев в рост “ненужных” стеблей. При этом в ходе тысячелетий доместикации, наряду с другими важными признаками, уже велся отбор сельскохозяйственных растений на способность давать высокий урожай при тесной посадке, то есть отбор растений с ослаблением SAS [78]. Важный вопрос для селекционеров и биотехнологов – как подавлять SAS и добиваться за счет этого дальнейшего уплотнения посадок сельскохозяйственно ценных культур, и одновременно изменять баланс биомассы растений “в пользу” сельскохозяйственно ценных органов [78], не снижая при этом иммунитет растений. Таким образом, возможность манипуляции ответом растений на свет, в частности “выключения” синдрома избегания тени, вызывает большой интерес, так как позволит более тесно сажать растения и получать с единицы площади больше биомассы [79]. С этой целью Wille с соавторами провели химический мутагенез шести сортов яровой пшеницы и многократный скрининг сначала с зеленым светофильтром, а затем в условиях сниженного соотношения КС/ДКС, для выявления мутантных линий пшеницы, где бы рост не ускорялся [80]. После анализа более чем 1000 линий были получены 5 мутантов с сильно редуцированным SAS: при более тесной посадке они демонстрировали хороший рост, раннее цветение, отращивали широкие листья и накапливали большую биомассу, чем исходные сорта в тех же условиях. В другой работе авторы для выявления компонентов сигнальных путей, регулирующих SAS, впервые применили фенотипирование [81], что позволило идентифицировать 18 новых генов, опосредующих SAS (среди них ген, кодирующий приуроченный к устьицам калиевый канал KAT1), и выделить группы генов, контролирующих три типа ответа на тень: удлинение гипокотиля, удлинение черешков и переход к цветению. Следует отметить, что в силу удобства использования для индукции SAS облучения растений светом со сниженным соотношением КС/ДКС, наиболее изучены характеристики именно SAS, вызванного инактивацией PhyB; исследования SAS, опосредованного криптохромами или UVR8, значительно отстают, хотя могут выявить ряд преимуществ с точки зрения селекции [64, 77].
ВЗАИМОДЕЙСТВИЕ ФИТОХРОМНОЙ И ЖАСМОНАТНОЙ СИСТЕМ РЕГУЛЯЦИИ
Как уже рассмотрено выше, запуск SAS может быть вызван снижением содержания активной формы либо основного ингибитора SAS – PhyB – за счет повышения доли ДКС в спектре, либо других фоторецепторов, CRY1 или UVR8, в ответ на снижение количества света в соответствующей области спектра. Снижение содержания в клетке активных форм фоторецепторов приводит к активации PIFs и регулируемых ими реакций, характерных для скотоморфогенеза, в том числе ускоренному росту растений в длину. Практически все группы гормонов участвуют в формировании SAS [82]. Известно, что в тени в растениях увеличивается содержание гиббереллинов [82], которые способствуют деградации DELLA – белков-репрессоров генов гиббереллинового ответа. На свету белки DELLA связываются с PIFs и препятствуют запуску SAS; однако, белки DELLA также взаимодействуют и с группой репрессоров факторов транскрипции JAZ [72]. JAZ – белки, которые ингибируют факторы транскрипции MYC2/3/4, активирующие гены жасмонатного сигналинга, в том числе гены, кодирующие ферменты биосинтеза летучих веществ и ответственные за остановку роста. В клетках Arabidopsis функционирует до 10 белков JAZ со сходными функциями [83].
Все больше работ выявляют тесное взаимодействие фитохромной и жасмонатной систем регуляции [83–91]. Биосинтез особой формы жасмоната – конъюгата с изолейцином – способствует деградации белков JAZ через Е3-убиквитинлигазный комплекс COI1 (CORONATINE-INSENSITIVE 1) [72]; однако, как показали недавние исследования, для этого требуется присутствие PhyA [84]. В свою очередь, белок JAZ10 оказался нужен растениям для восприятия соотношения КС/ДКС и ингибирования PhyB [83]. Активная форма белка JAZ10.4, подавляющая “жасмонатные” ответы, представляет собой продукт альтернативного сплайсинга [83]; было бы интересно выявить, не участвуют ли фитохромы в регуляции сплайсинга транскрипта JAZ10.4. Отсутствие фитохромов у мутанта Arabidopsis приводило к усилению биосинтеза жасмонатов [76], а ингибирование биосинтеза жасмоната у риса изменяло баланс спектральных форм PhyA [86, 87].
Для изучения регуляции роста растений особый интерес представляет выявление сигналов и механизмов, приводящих к остановке роста в стрессовых условиях [91–94]. Оказалось, что ведущую роль в этом феномене играют гены, регулируемые жасмоновой кислотой, синтез которой при стрессах резко возрастает [89, 91, 93]. В недавней работе убедительно показано, что остановка роста и запуск механизмов борьбы со стрессом представляют собой две отдельные генетические программы, которые функционируют в тесной связи, но тем не менее могут быть полностью разобщены у мутантов по соответствующим ключевым регуляторам этих программ [89]. Такие мутанты Arabidopsis thaliana в условиях стресса демонстрируют повышенную стрессоустойчивость и сильный рост, сравнимый с ростом растений дикого типа либо превосходящий его (видимо, за счет трансгрессивных эффектов). В цитируемой работе жасмоновая кислота выступает индуктором стрессового ответа, а PhyВ отвечает за остановку роста при активации жасмонатного сигналинга. Важно отметить, что манипуляции уровнем активности фитохромов оказывают влияние не только на рост побегов, но и на рост корней: роль фитохромов – причем как содержащихся в надземной части растений, так и в корнях – в росте корней показана недавними исследованиями [92]. Известно, что корневые фитохромы нужны для гравитропизма корней, а также изменения паттерна их роста, в том числе для перцепции сигналов жасмоната [95]. Попытки манипулировать уровнем экспрессии фитохромов в трансгенных растениях с целью сдвига баланса биомассы в сторону органов растений, представляющих практический интерес, начались давно и продолжаются до сих пор [96].
ЗАКЛЮЧЕНИЕ
Изучение системы фоторецепторного контроля роста и развития растений, а также ее функционирования в условиях стресса, в настоящее время переживает бурное развитие. Эти исследования в перспективе имеют значительный потенциал для практических приложений: получения сортов сельскохозяйственных культур, способных давать высокий урожай в условиях стресса.
Автор благодарна Prof. Katharina Pawlowski (Стокгольмский университет, Швеция) и анонимному рецензенту за критические замечания.
Исследования поддержаны Российским научным фондом (грант № 14-16-00120).
Список литературы
Мокроносов А.Т. Онтогенетический аспект фотосинтеза. М.: Наука, 1981. 195 с.
Jung J.H., Domijan M., Klose C., Biswas S., Ezer D., Gao M., Khattak A.K., Box M.S., Charoensawan V., Cortijo S., Kumar M., Grant A., Locke J.C., Schäfer E., Jaeger K.E., Wigge P.A. Phytochromes function as thermosensors in Arabidopsis // Science. 2016. V. 354. P. 886–889.
Lee H.J., Ha J.H., Kim S.G., Choi H.K., Kim Z.H., Han Y.J., Kim J.I., Oh Y., Fragoso V., Shin K., Hyeon T., Choi H.G., Oh K.H., Baldwin I.T., Park C.M. Stem-piped light activates phytochrome B to trigger light responses in Arabidopsis thaliana roots // Sci. Signal. 2016. V. 9: ra106.
Pierik R., de Wit M. Shade avoidance: phytochrome signalling and other aboveground neighbour detection cues // J. Exp. Bot. 2014. V. 65. P. 2815–2824.
Briggs W.R., Christie J.M. Phototropins 1 and 2: versatile plant blue-light receptors // Trends Plant Sci. 2002. V. 7. P. 204–210.
Christie J.M., Blackwood L., Petersen J., Sullivan S. Plant flavoprotein photoreceptors // Plant Cell Physiol. 2015. V. 56. P. 401–413.
Schultz T.F. The ZEITLUPE family of putative photoreceptors // Handbook of photosensory receptors / Ed. Briggs W.R., Spudich J.L. Weinheim. Germany: Wiley VCH. P. 337–347.
Tilbrook K., Arongaus A.B., Binkert M., Heijde M., Yin R., Ulm R. The UVR8 UV-B Photoreceptor: perception, signaling and response // Arabidopsis book. 2013. V. 11: e0164. doi https://doi.org/10.1199/tab.0164
Синещеков В.А. Фитохром A: полиморфизм и полифункциональность. М.: Научный мир, 2013. 161 с.
Wang H., Haiyang H. Phytochrome signaling: time to tighten up the loose ends // Molecular Plant. 2015. V. 8. P. 540–551.
Mishra S., Khurana J.P. Emerging roles and new paradigms in signaling mechanisms of plant cryptochromes // Crit. Rev. Plant Sci. 2017. V. 36. P. 89−115.
Zhang T., Maruhnich S.A., Folta K.M. Green light induces shade avoidance symptoms // Plant Physiol. 2011. V. 157. P. 1528–1536.
Casal J.J. Photoreceptor signaling networks in plant response to shade // Annu. Rev. Plant Biol. 2013. V. 64. P. 403–427.
Ballare C.L. Light regulation of plant defense // Annu. Rev. Plant Biol. 2014. V. 65. P. 335–363.
Кузнецов Е.Д., Сечняк Л.К., Киндрук Н.А., Слюсаренко О.К. Роль фитохрома в растениях. М.: Агропромиздат, 1986.
Song Y.H., Shim J.S., Kinmonth-Schultz H.A., Imaizumi T. Photoperiodic flowering: time measurement mechanisms in leaves // Annu. Rev. Plant Biol. 2015. V. 66. P. 441–464.
Chai T., Zhou J., Liu J., Xing D. LSD1 and HY5 antagonistically regulate red light induced-programmed cell death in Arabidopsis // Front. Plant Sci. 2015. V. 6: 292. doi https://doi.org/10.3389/fpls.2015.00292
Maurya J.P., Bhalerao R.P. Photoperiod- and temperature-mediated control of growth cessation and dormancy in trees: a molecular perspective // Ann. Bot. 2017. V. 120. P. 351−360.
Kreslavski V.D., Los D.A., Schmitt F.J., Zharmukhamedov S.K., Kuznetsov V.V., Allakhverdiev S.I. The impact of the phytochromes on photosynthetic processes // Biochim. Biophys. Acta. 2018. V. 1859. P. 400–408.
Chen D., Xu G., Tang W., Jing Y., Ji Q., Fei Z., Lina R. Antagonistic basic helix-loop-helix/bZIP transcription factors form transcriptional modules that integrate light and reactive oxygen species signaling in Arabidopsis // Plant Cell. 2013. V. 25. P. 1657–1673.
Martın G., Leivar P., Ludevid D., Tepperman J.M., Quail P.H., Monte E. Phytochrome and retrograde signalling pathways converge to antagonistically regulate a light-induced transcriptional network // Nat. Commun. 2016. V. 7. P. 11431.
Shikata H., Hanada K., Ushijima T., Nakashima M., Suzuki Y., Matsushita T. Phytochrome controls alternative splicing to mediate light responses in Arabidopsis // Proc. Natl. Acad. Sci. USA. 2014. V. 111. P. 18781–18786.
Ushijima T., Hanada K., Gotoh E., Yamori W., Kodama Y., Tanaka H., Kusano M., Fukushima A., Tokizawa M., Yamamoto Y.Y., Tada Y., Suzuki Y., Matsushita T. Light controls protein localization through phytochrome-mediated alternative promoter selection // Cell. 2017. V. 171. P. 1316–1325.
Li F.W., Melkonian M., Rothfels C.J., Villarreal J.C., Stevenson D.W., Graham S.W., Wong G.K., Pryer K.M., Mathews S. Phytochrome diversity in green plants and the origin of canonical plant phytochromes // Nat. Commun. 2015. V. 6. P. 7852. doi https://doi.org/10.1038/ncomms8852
Burgie E.S., Vierstra R.D. Phytochromes: an atomic perspective on photoactivation and signaling // Plant Cell. 2014. V. 26. P. 4568–4583.
Nagatani A. Phytochrome: structural basis for its functions // Curr. Opin. Plant Biol. 2010. V. 13. P. 565–570.
Casal J.J., Candia A.N., Sellaro R. Light perception and signalling by phytochrome A // J. Exp. Bot. 2014. V. 65. P. 2835–2845.
Sharrock R.A., Clack T. Patterns of expression and normalized levels of the five Arabidopsis phytochromes // Plant Physiol. 2002. V. 130. P. 442–456.
Ballar’e C.L., Scopel A.L., S’anchez R.A. Photocontrol of stem elongation in plant neighbourhoods: effects of photon fluence rate under natural conditions of radiation // Plant Cell Environ. 1991. V. 14. P. 57–65.
Brouwer B., Gardeström P., Keech O. In response to partial plant shading, the lack of phytochrome A does not directly induce leaf senescence but alters the fine-tuning of chlorophyll biosynthesis // J. Exp. Bot. 2014. V. 65. P. 4037–4049.
Rösler J., Klein I., Zeidler M. Arabidopsis fhl/fhy1 double mutant reveals a distinct cytoplasmic action of phytochrome A // Proc. Natl. Acad. Sci. USA. 2007. V. 104. P. 10737–10742.
Kreslavski V.D., Carpentier R., Klimov V.V., Allakhverdiev S.I. Transduction mechanisms of photoreceptor signals in plant cells. // J. Photochem. Photobiol. C: Photochem Rev. 2009. V. 10. P. 63–80.
Hughes J. Phytochrome cytoplasmic signaling // Annu. Rev. Plant Biol. 2013. V. 64. P. 377–402.
Haupt W. Regulation der Chloroplastenverteilung in der Zelle durch Lichtintensitaet und Lichtrichtung // Ber. Dtsch. Bot. Ges. 1973. V. 86. P. 403–406.
Tanada T. A rapid photoreversible response of barley root tips in the presence of 3-indoleacetic acid // Proc. Natl. Acad. Sci. USA. 1968. V. 59. P. 376–380.
Jaedicke K., Lichtenthaler A.L., Meyberg R., Zeidler M., Hughes J. A phytochromephototropin light signaling complex at the plasma membrane // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 12231–12236.
Fankhauser C., Yeh K.C., Lagarias J.C., Zhang H., Elich T.D., Chory J. PKS1, a substrate phosphorylated by phytochrome that modulates light signaling in Arabidopsis // Science. 1999. V. 284. P. 1539–1541.
Paik I., Yang S., Choi G. Phytochrome regulates translation of mRNA in the cytosol // Proc. Natl. Acad. Sci. USA. 2012. V. 109. P. 1335–1340.
Zhao J., Zhou J.-J., Wang Y.-Y., Gu J.-W., Xie X.-Z. Positive regulation of phytochrome B on chlorophyll biosynthesis and chloroplast development in rice // Rice Sci. 2013. V. 20. P. 243−248.
Inagaki N., Kinoshita K., Kagawa T., Tanaka A., O. Ueno, H. Shimada, M. Takano. Phytochrome B mediates the regulation of chlorophyll biosynthesis through transcriptional regulation of ChlH and GUN4 in rice seedlings // PLoS ONE. 2015. V. 10: e0135408.
Boccalandro H.E., Rugnone M.L., Moreno J.E., Ploschuk E.L., Serna L., Yanovsky M.J., Casal J.J. Phytochrome B enhances photosynthesis at the expense of water-use efficiency in Arabidopsis // Plant Physiol. 2009. V. 150. P. 1083–1092.
Casson S.A., Hetherington A.M. Phytochrome B is required for light-mediated systemic control of stomatal development // Curr. Biol. 2014. V. 24. P. 1216–1221.
Kim J., Song K., Park E., Kim K., Bae G., Choi G. Epidermal phytochrome B inhibits hypocotyl negative gravitropism non-cell-autonomously // Plant Cell. 2016. V. 28. P. 2770–2785.
Osugi A., Itoh H., Ikeda-Kawakatsu K., Takano M., Izawa T. Molecular dissection of the roles of phytochrome in photoperiodic flowering in rice // Plant Physiol. 2011. V. 157. P. 1128–1137.
Pearce S., Kippes N., Chen A., Debernardi J.M., Dubcovsky J. RNA-seq studies using wheat phytochrome B and phytochrome C mutants reveal shared and specific functions in the regulation of flowering and shade-avoidance pathways // BMC Plant Biol. 2016. V. 16. P. 141. doi https://doi.org/10.1186/s12870-016-0831-3
Sinetova M.A., Los D.A. New insights in cyanobacterial cold stress responses: Genes, sensors, and molecular triggers // Biochim. Biophys. Acta. 2016. V. 1860. P. 2391–2403.
Franklin K.A. Light and temperature signal crosstalk in plant development // Curr. Opin. Plant Biol. 2009. V. 12. P. 63–68.
Chen F., Li B., Li G., Charron J.B., Dai M., Shi X., Deng X.W. Arabidopsis phytochrome A directly targets numerous promoters for individualized modulation of genes in a wide range of pathways // Plant Cell. 2014. V. 26. P. 1949–1966.
Somers D.E., Quail P.H. Temporal and spatial expression patterns of PHYA and PHYB genes in Arabidopsis // Plant J. 1995. V. 7. P. 413–427.
Baba-Kasai A., Hara N., Takano M. Tissue-specific and light-dependent regulation of phytochrome gene expression in rice // Plant Cell Environ. 2014. V. 37. P. 2654–2666.
Беляева О.Б. Светозависимый биосинтез хлорофилла / ред.: Ф.Ф. Литвин, О.Б. Беляева / 3-е изд. (эл.). М.: Лаборатория знаний, 2015. 235 с.
Nozue K., Kanegae T., Imaizumi T., Fukuda S., Okamoto H., Yeh K.-C., Clark Lagarias J., Wada M. A phytochrome from the fern Adiantum with features of the putative photoreceptor NPH1 // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 15826–15830.
Harper S.M., Neil L.C, Gardner K.H. Structural basis of a phototropin light switch // Science. 2003. V. 301. P. 1541–1544.
Fujii Y., Tanaka H., Konno N., Ogasawara Y., Hamashima N., Tamura S., Hasegawa S., Hayasaki Y., Okajima K., Kodama Y. Phototropin perceives temperature based on the lifetime of its photoactivated state // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. 9206–9211.
Inoue S., Takemiya A., Shimazaki K. Phototropin signaling and stomatal opening as a model case // Curr. Opin. Plant Biol. 2010. V. 13. P. 587–593.
Casal J.J., Ouesta J.I. Light and temperature cues: multitasking receptors and transcriptional integrators // New Phytol. 2018. V. 217. P. 1029–1034.
Zoltowski B.D., Imaizumi T. Structure and Function of the ZTL/FKF1/LKP2 Group Proteins in Arabidopsis // Enzymes. 2014. V. 35. P. 213–239.
Huang Y., Baxter R., Smith B.S., Partch C.L., Colbert C.L., Deisenhofer J. Crystal structure of cryptochrome 3 from Arabidopsis thaliana and its implications for photolyase activity // Proc. Natl. Acad. Sci. USA. 2006. V. 103. P. 17701–11706.
Banerjee R., Schleicher E., Meier S., Viana R.M., Pokorny R., Ahmad M., Bittl R., Batschauer A. The signaling state of Arabidopsis cryptochrome 2 contains flavin semiquinone // J. Biol. Chem. 2007. V. 282. P. 14916–14922.
Lau O.S., Deng X.W. The photomorphogenic repressors COP1 and DET1: 20 years later // Trends Plant Sci. 2012. V. 17. P. 584–593.
Sellaro R., Crepy M., Trupkin S.A., Karayekov E., Buchovsky A.S., Rossi C., Casal J.J. Cryptochrome as a sensor of the blue/green ratio of natural radiation in Arabidopsis // Plant Physiol. 2010. V. 154. P. 401−409.
Keller M.M., Jaillais Y., Pedmale U.V., Moreno J.E., Chory J., Ballare C.L. Cryptochrome 1 and phytochrome B control shade-avoidance responses in Arabidopsis via partially independent hormonal cascades // Plant J. 2011. V. 67. P. 195–207.
Usami T., Mochizuki N., Kondo M., Nishimura M., Nagatani A. Cryptochromes and phytochromes synergistically regulate Arabidopsis root greening under blue light // Plant Cell Physiol. 2004. V. 45. P. 1798–1808.
Cerrudo I., Keller M.M., Cargnel M.D., Demkura P.V., Wit M., Patitucci M.S., Pierik R., Pieterse C.M.J., Ballare C.L. Low red/far-red ratios reduce arabidopsis resistance to Botrytis cinerea and jasmonate responses via a COI1-JAZ10-dependent, salicylic acid-independent mechanism // Plant Physiol. 2012. V. 158. P. 2042−2052.
Rizzini L., Favory J.J., Cloix C., Faggionato D., O’Hara A., Kaiserli E., Baumeister R., Schafer E., Nagy F., Jenkins G.I., Ulm R. Perception of UV-B by the Arabidopsis UVR8 protein // Science. 2011. V. 332. P.103–106.
Креславский В.Д., Кособрюхов А.А., Шмарев А.Н. Введение гена PHYB арабидопсиса повышает устойчивость фотосинтетического аппарата трансгенных растений Solanum tuberosum к УФ-B облучению // Физиология растений. 2015. Т. 62. С. 222−228.
Креславский В.Д., Христин М.С., Шабнова Н.И., Любимов В.Ю. Предоблучение отдельных листьев шпината красным светом повышает устойчивость фотосинтетического аппарата к УФ-радиации // Физиология растений. 2012. Т. 59. С. 723−729.
Hloušková P., Bergougnoux V. A subtracted cDNA library identifies genes up-regulated during PHOT1-mediated early step of de-etiolation in tomato (Solanum lycopersicum L.) // BMC Genomics. 2016. V. 17. P. 291.
Demarsy E., Schepens I., Okajima K., Hersch M., Bergmann S., Christie J., Shimazaki K., Tokutomi S., Fankhauser C. Phytochrome Kinase Substrate 4 is phosphorylated by the phototropin 1 photoreceptor // EMBO J. 2012. V. 31. P. 3457–3467.
Leivar P., Monte E. PIFs: Systems integrators in plant development // Plant Cell. 2014. V. 26. P. 56–78.
Goyal A., Karayekov E., Galvão V.C., Ren H., Casal J.J., Fankhauser C. Shade promotes phototropism through phytochrome B-controlled auxin production // Curr. Biol. 2016. V. 26. P. 3280–3287.
Kazan K., Manners J.M. The interplay between light and jasmonate signalling during defence and development // J. Exp. Bot. 2011. V. 62. P. 4087–4100.
Sun J., Qi L., Li Y., Zhai Q., Li C. PIF4 and PIF5 transcription factors link blue light and auxin to regulate the phototropic response in Arabidopsis // Plant Cell. 2013. V. 25. P. 2102–2114.
de Wit M., Keuskamp D.H., Bongers F.J., Hornitschek P., Gommers C.M.M., Reinen E., Martínez-Cerón C., Fank-hauser C., Pierik R. Integration of phytochrome and cryptochrome signals determines plant growth during competition for light // Curr. Biol. 2016. V. 26. P. 3320–3326.
Whipple C.J., Kebrom T.H., Weber A.L., Yang F., Hall D., Meeley R., Schmidt R., Doebley J., Brutnell T.P., Jackson D.P. Grassy tillers1 promotes apical dominance in maize and responds to shade signals in the grasses // PNAS. 2011. V. 108. P. E506–E512.
Zhai Q., Li C.B., Zheng W., Wu X., Zhao J., Zhou G., Jiang H., Sun J., Lou Y., Li C. Phytochrome chromophore deficiency leads to overproduction of jasmonic acid and elevated expression of jasmonate-responsive genes in Arabidopsis // Plant Cell Physiol. 2007. V. 48. P. 1061–1071.
de Wit M., Spoel S.H., Sanchez-Perez G.F., Gom-mers C.M.M., Pieterse C.M.J., Voesenek L.A.C.J., Pierik R. Perception of low red: far-red ratio compromises both salicylic acid- and jasmonic acid-dependent pathogen defences in Arabidopsis // The Plant Journal. 2013. V. 75. P. 90–103.
Carriedo L.G., Maloof J.N., Brady S.M. Molecular control of crop shade avoidance // Curr. Opin. Plant Biol. 2016. V. 30. P. 151–158.
Warnasooriya S.N., Brutnell T.P. Enhancing the productivity of grasses under high-density planting by engineering light responses: from model systems to feedstocks // J. Exp. Bot. 2014. V. 65. P. 2825–2834.
Wille W., Pipper C.B, Rosenqvist E., Andersen S.B., Weiner J. Reducing shade avoidance responses in a cereal crop //AoB PLANTS. 2017. V. 9: plx039.
Nozue K., Tat A.V., Devisetty U.K., Robinson M., Mumbach M.R., Ichihashi Y., Lekkala S., Maloof J.N. Shade avoidance components and pathways in adult plants revealed by phenotypic profiling // PLOS Genetics. 2015. V. 11: e1004953. doi https://doi.org/10.1371/journal.pgen.1004953
Yang C., Li L. Hormonal regulation in shade avoidance // Front. Plant Sci. 2017. V. 8. P. 1527.
Cerrudo I., Caliri-Ortiz M.E., Keller M.M., Degano M.E., Demkura P.V., Ballare C.L. Exploring growth-defence trade-offs in Arabidopsis: phytochrome B inactivation requires JAZ10 to suppress plant immunity but not to trigger shade-avoidance responses // Plant Cell Environ. 2017. V. 40. P. 635−644.
Robson F., Okamoto H., Patrick E., Harris S.R., Wasternack C., Brearley C., Turnera J.G. Jasmonate and phytochrome a signaling in Arabidopsis wound and shade responses are integrated through JAZ1 stability // Plant Cell. 2010. V. 22. P. 1143–1160.
Chen J., Sonobe K., Ogawa N., Masuda S., Nagatani A., Kobayashi Y., Ohta H. Inhibition of arabidopsis hypocotyl elongation by jasmonates is enhanced under red light in phytochrome B dependent manner // J. Plant Res. 2013. V. 126. P. 161–168.
Riemann M., Müller A., Korte A., Furuya M., Weiler E.W., Nick P. Impaired induction of the jasmonate pathway in the rice mutant hebiba // Plant Physiol. 2003. V. 133. P. 1820−1830.
Dhakarey R., Peethambaran P.K., Riemann M. Functional analysis of jasmonates in Rice through mutant approaches // Plants. 2016. V. 5: E15. doi https://doi.org/10.3390/ plants5010015
Hsieh H.L., Okamoto H. Molecular interaction of jasmonate and phytochrome A signaling // J. Exp. Bot. 2014. V. 65. P. 2847−2857.
Campos M.L., Yoshida Y., Major I.T., Ferreira D.O., Weraduwage S.M., Froehlich J.E., Johnson B.F., Kra-mer D.M., Jander G., Sharkey T.D., Howe G.A. Rewiring of jasmonate and phytochrome B signalling uncouples plant growth-defense tradeoffs // Nat. Commun. 2016. V. 7. P. 12570. doi https://doi.org/10.1038/ncomms12570
Moreno J.E., Tao Y., Chory J., Ballare C.L. Ecological modulation of plant defense via phytochrome control of jasmonate sensitivity // PNAS. 2009. V. 106. P. 4935–4940.
Wasternack C., Hause B. Jasmonates: biosynthesis, perception, signal transduction and action in plant stress response, growth and development // Ann. Bot. 2013. V. 111. P. 1021–1058.
Costigan S.E., Warnasooriya S.N., Humphries B.A., Montgomery B.L. Root-localized phytochrome chromophore synthesis is required for photoregulation of root elongation and impacts root sensitivity to jasmonic acid in Arabidopsis // Plant Physiol. 2011. V. 157. P. 1138–1150.
Ahmad P., Rasool S., Gul A., Sheikh S.A., Akram N.A., Ashraf M., Kazi A.M., Gucel S. Jasmonates: Multifunctional roles in stress tolerance // Front Plant Sci. 2016. V. 7: 813.
Ding H., Lai J., Wu Q., Zhang S., Chen L., Dai Y.S., Wang C., Du J., Xiao S., Yang C. Jasmonate complements the function of Arabidopsis lipoxygenase3 in salinity stress response // Plant Sci. 2016. V. 244. P. 1−7.
Warnasooriya S.N., Montgomery B.L. Spatial-specific regulation of root development by phytochromes in Arabidopsis thaliana // Plant Signal. Behav. 2011. V. 6. P. 2047–2050.
Robson P.R., McCormac A.C., Irvine A.S., Smith H. Genetic engineering of harvest index in tobacco through overexpression of a phytochrome gene // Nat. Biotechnol. 1996. V. 14. P. 995–998.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


