Физиология растений, 2019, T. 66, № 6, стр. 461-471
Фотосинтез и скорость поглощения кислорода в растениях озимого рапса, обработанных 5-аминолевулиновой кислотой
Н. Г. Аверина a, *, **, А. В. Емельянова a, Р. А. Щербаков a, Н. В. Козел a, Л. В. Обуховская b, А. В. Усатов c
a Институт биофизики и клеточной инженерии Национальной академии наук Беларуси
Минск, Беларусь
b Институт экспериментальной ботаники им. В.Ф. Купревича
Национальной академии наук Беларуси
Минск, Беларусь
c Южный федеральный университет
Ростов-на-Дону, Россия
* E-mail: averina_ng@tut.by
** E-mail: averina@ibp.org.by
Поступила в редакцию 28.09.2018
После доработки 29.01.2019
Принята к публикации 11.02.2019
Аннотация
Изучено влияние экзогенной 5-аминолевулиновой кислоты (АЛК) в концентрации 200 мг/л на фотосинтез и структурную организацию фотосинтетического аппарата, скорость поглощения кислорода тканью, содержание ключевых дыхательных ферментов – цитохром с-оксидазы (ЦО) и альтернативной оксидазы (АОX), а также активность ЦО в растениях озимого рапса (Brassica napus L.). Выявлено, что в 4–7-дневных растениях, выращенных на растворе АЛК, происходит накопление фенолов, а также их производных антоцианов, состав которых не отличается от состава антоцианов в контрольных растениях. В растениях варианта “АЛК” наблюдается ингибирование фотосинтеза путем снижения способности к формированию структурных компонентов фотосинтетического аппарата – пигмент-белковых комплексов (ПБК) фотосистем I и II. В таких растениях отмечено возрастание интенсивности поглощения кислорода тканью в условиях затемнения, а также увеличение активности терминальной ЦО цитохромной части дыхательного пути и содержания другого терминального дыхательного фермента – АОX, индукция которого, как правило, наблюдается в условиях стресса, в том числе окислительного.
ВВЕДЕНИЕ
Антоцианы относятся к наиболее распространенной и многочисленной группе фенольных соединений – флaвоноидам [1]. Это нефотосинтетические пигменты, которые накапливаются в вакуолях, а также встречаются в кристаллическом виде в некоторых видах растений. Антоциановые пигменты являются наиболее универсальными из всех пигментов и обладают огромным разнообразием функций, многие из которых в первую очередь связаны с ответами растений на стрессовые воздействия [2]. Показано, что антоцианы во многих видах растений уменьшают степень фотоингибирования, а также ускоряют восстановление фотосинтетического аппарата растений [3]. При высокой освещенности антоцианы действуют как оптический фильтр, защищая уже насыщенную электрон-транспортную цепь от избыточных квантов света с высокой энергией. Они снижают накопление супероксид анион-радикалов, тем самым ослабляя структурные повреждения клеточных мембран [4]. Показано, что очищенные растворы антоцианов удаляют практически все виды активных форм кислорода и азота с эффективностью в четыре раза большей, чем аскорбат и α‑токоферол [5]. Антоциановые пигменты в ходе ацилирования активно поглощают излучение в УФ-области, защищая растения (в частности, генетический аппарат) от губительного воздействия УФ лучей [6].
Антоцианы важны и для человека. Они активно используются в фармакологической, косметической и пищевой промышленностях в качестве натуральных красителей и биологически активных соединений, обладающих окислительно-восстановительными, антиоксидантными, противовоспалительными и нейропротекторными свойствами.
В настоящее время проводится множество исследований по поиску новых, дешевых и доступных источников антоцианов, а также соединений, стимулирующих их синтез. Существует ряд публикаций о стимуляции накопления антоцианов под действием 5-аминолевулиновой кислоты (АЛК) в кожуре яблок [7–9] и в листьях голосеменного реликтового растения Гинкго двулопастного (Ginkgo biloba) [10, 11]. АЛК – первичный предшественник в биосинтезе всех циклических (хлорофиллы, гемы, корриноиды) и линейных (билины, фикобилины) тетрапирролов – является уникальной природной молекулой, проявляющей в растениях различные функциональные свойства [12]. В низких и средних концентрациях (до 100 мг/л в зависимости от способа обработки) АЛК оказывает стимулирующее действие на рост и урожайность ряда овощных и зерновых культур, что явилось основанием для создания на ее основе ряда коммерческих препаратов, использование которых оказалось эффективным приемом повышения урожайности сельскохозяйственных культур [12]. В условиях стрессовых воздействий, таких как засоление почв, нарушение режима оводненности, низкие температуры и освещенность, повышенное содержание нитратов, сульфатов, использование гербицидов и др., обработка АЛК способствует повышению устойчивости растений к этим стрессорам, что делает ее использование перспективной стратегией при борьбе с различными типами стрессов [12, 13].
Нами было показано, что при выращивании растений озимого рапса (Brassica napus L.) на растворах АЛК в концентрациях 50–300 мг/л в семядольных листьях, а также в гипокотилях накапливались существенные количества антоцианов, что обеспечивалось практически двукратным возрастанием активности дигидрофлавонол-4-редуктазы – ключевого фермента биосинтеза этих пигментов [14]. В растениях озимого рапса, обработанных АЛК, нами также было отмечено ингибирование накопления фотосинтетических пигментов – хлорофиллов и каротиноидов, повышение содержания гема, пролина, возрастание антиоксидантной и антирадикальной активностей, а также активности супероксиддисмутазы [14]. До сих пор, однако, остается невыясненным вопрос о качественном составе антоцианов в растениях, выращенных на растворах АЛК, по сравнению с контрольными образцами. Использование растений озимого рапса в качестве перспективной модельной системы, обогащенной с помощью АЛК антоцианами, предполагает всестороннее изучение всего комплекса метаболических перестроек в этом объекте на биохимическом, биофизическом и генетическом уровнях.
В этой связи представляло значительный интерес оценить влияние АЛК на общее содержание вторичных соединений класса фенолов, а также качественный состав антоцианов, понять природу дефицита хлорофилла в условиях обработки растений озимого рапса его предшественником – АЛК, определить фотосинтетическую активность, способность растений поглощать кислород, а также сконцентрировать внимание на основных участниках этих двух процессов – компонентах пигмент-белковых комплексов двух фотосистем и активности терминальных дыхательных ферментов – цитохром с-оксидазы (ЦО) и альтернативной оксидазы (АОХ).
МАТЕРИАЛЫ И МЕТОДЫ
Выращивание растений. Семена озимого рапса (Brassica napus L., сорт Зорны) выращивали до 4–7-дневного возраста под белыми люминесцентными лампами Philips TD-36/765 (40.5 и 66.2 мкмоль фотонов/(м2 с)) при 26°С в режиме 14 ч света/10 ч темноты на воде (контроль), а также на растворе АЛК 200 мг/л. При отборе проб использовали семядольные листья.
Определение содержания фенолов. Количество фенольных соединений определяли с помощью метода Фолина и Чокальтеу в модификации Синглетона и Росси [15]. Навеску растительного материала (0.2 г) растирали в 1.5 мл дистиллированной воды и инкубировали в течение 10 мин при температуре 90°С с использованием термошейкера, после чего центрифугировали гомогенат при 17 000 g в течение 5 мин на центрифуге Heraeus Pico 17 (Thermo Fisher Scientific Inc., США). Супернатант переносили в мерные пробирки, осадок ресуспендировали в 0.5 мл горячей дистиллированной воды и вновь центрифугировали. Супернатанты объединяли, уравнивали объем во всех вариантах и к 125 мкл супернатанта приливали 750 мкл воды и 67.5 мкл реактива Фолина (A-ppliChem, Германия). Через 3 мин приливали 125 мкл насыщенного раствора Na2CO3 и 187.5 мкл воды и инкубировали в течение 1 ч, после чего измеряли оптическую плотность при 750 нм на спектрофотометре Solar PB 2201 (Беларусь). Содержание фенольных соединений рассчитывали в эквиваленте галловой кислоты по калибровочной кривой, построенной с использованием галловой кислоты производства AppliChem известной концентрации.
Определение антоцианов с помощью ВЭЖХ. В работе использовали жидкостной хроматограф высокого давления Shimadzu Prominence LC 20 (Япония) с хроматографической колонкой Nucleodur C-18 Prominence (250 мм × 3; 5 мкм, фирмы Macherey-Nagel, Германия). Процедуру осуществляли как описано в работе Le с соавт. [16]. Навеску 200 мг растительного материала экстрагировали 1 мл (1 : 1, v : v) смеси 50 мМ H3PO4 : 50% этанол. Экстракт центрифугировали при 12 000 g 10 мин на микроцентрифуге Scanspeed (Дания), отбирали супернатант, а осадок повторно обрабатывали, как описано выше, с последующим центрифугированием и объединением супернатантов для анализа антоцианов. Мобильная фаза представляла собой 1% уксусную кислоту (раствор А) и ацетонитрил (раствор Б) со следующим градиентом: 0–8% Б от 0 до 5 мин, 8–45% Б от 5 до 40 мин и 45–0% Б от 40 до 45 мин. Скорость потока 0.5 мл/мин, температура колонки 25°С, объем инъекции – 40 мкл. Визуализацию профиля хроматограммы осуществляли по спектрам поглощения при 520 нм с помощью спектрофотометрического детектора с диодной матрицей Shimadzu SPD-M20A (Япония).
Определение активности фотосинтеза и скорости поглощения кислорода с помощью компьютеризированной измерительной системы PlantVital® 5030. Половинку семядольного листа озимого рапса помещали в камеру прибора PlantVital® 5030 (Германия) на электрод – кислородный сенсор (Sensortechnik Meinsberg, Германия). Измерения проводили в течение 10–15 мин сначала в темноте, регистрируя скорость потребления кислорода, затем при освещении камеры, измеряя активность фотосинтеза по скорости выделения кислорода [17]. Регистрируемое прибором соотношение между скоростями выделения и поглощения кислорода показывает эффективность фотосинтеза по отношению к протекающим с участием кислорода реакциям окисления органического вещества. Для каждого варианта использовали 6 физиологических повторностей. Скорости потребления и выделения кислорода оценивали в мкмоль О2/(мг с), учитывая при этом сырую массу исходной навески.
Вестерн-блот-анализ содержания белковых компонентов пигмент-белковых комплексов фотосистем I и II. Экстракцию из растений озимого рапса белков и их электрофоретическое разделение в полиакриламидном геле и иммуноблоттинг выполняли, как описано в работе Jansson с соавт. 18]. Навеску 0.2 г растительной ткани растирали в 1 мл буфера, содержащего 56 мМ дитиотрейтол (ДТТ), 56 мМ Na2CO3, 12% сахарозу, 2 мМ этилендиаминтетраацилацетат, 2% SDS-Na. Гомогенат центрифугировали при 12 000 g в течение 5 мин. Надосадочную фракцию собирали и хранили при –20°С. После разделения белков с помощью денатурирующего гель-электрофореза, осуществляли электроперенос белков с геля на нитроцеллюлозную мембрану “Hybond-C pure” (Amersham, США) с порами 0.45 мкм. Иммунодетекцию белков на нитроцеллюлозной мембране проводили с помощью антител на белок D1 реакционного центра ФС II, а также на белки светособирающих комплексов (ССК) ФС I: Lhca1, Lhca2, Lhca3, Lhca4 и ССК ФС II: Lhcb1, Lhcb2, Lhcb4, Lhcb5 и Lhcb6.
Определение активности ЦО. Активность ЦО оценивали согласно методам, описанным в работах Edmands и Burton, а также Ермакова с соавт. [19, 20] с нашими модификациями. Навеску 0.3 г растительного материала экстрагировали на холоду в 1.5 мл 0.1 М K,Na-фосфатного буфера, содержащего 0.1% Тритон X-100. Гомогенат центрифугировали 10 мин при 12 000 g на центрифуге с охлаждением (+4°С) Sigma 1-15K (Германия). Полученный супернатант использовали для анализа. Активность фермента определяли спектрофотометрически по изменению оптической плотности раствора при 550 нм в ходе окисления восстановленного цитохрома с с помощью спектрофотометра Uvikon 931 (Германия). Активность ЦО рассчитывали, используя коэффициент молярной экстинкции 29.5 мМ–1 см–1.
Определение содержания субъединицы СОХIIb ЦО и AOХ. Выделение митохондрий из проростков осуществляли с помощью дифференциального центрифугирования согласно методике, описанной в работе Боровик с соавт. [21]. Навеску 0.5 г растительного материала растирали на холоду в 1.5 мл буфера для выделения (рН 7.4), содержащего 300 мМ сахарозу, 40 мM MOPS, 5 мМ ЭДТА, 10 мM KCl, 1 мM MgCl2, 0.05% цистеин и 0.1% БСА. Гомогенат фильтровали через капроновую ткань и центрифугировали 10 мин при 1100 g, после чего супернатант центрифугировали еще 10 мин при 15 000 g. Осадок, содержащий митохондрии, растворяли в буфере Лэммли, содержащем 10% SDS, 20% глицин, 1 M Трис-НCl (рН 6.8), 0.02% бромфенол синий и 0.1 М ДТТ и подвергали в течение 5 мин действию ультразвука на установке УЗДН-А (Россия), после чего нагревали 3 мин при 90°С. Электрофоретическое разделение в полиакриламидном геле и иммуноблоттинг выполняли, как описано в работе Jansson с соавт. [18]. Гомогенат центрифугировали при 12 000 g в течение 10 мин. Супернатант отбирали и хранили при –20°С. После разделения белков с помощью денатурирующего гель-электрофореза осуществляли электроперенос белков с геля на нитроцеллюлозную мембрану “Hybond-C pure” с порами 0.45 мкм. Иммунодетекцию белков на нитроцеллюлозной мембране проводили с помощью антител на белок альтернативной оксидазы АОХ1/2, а также на субъединицу ЦО COXIIb.
Определение содержания хлорофиллов и каротиноидов с помощью ВЭЖХ. Состав и содержание хлорофиллов a, b и каротиноидов в образцах определяли с помощью хроматографа высокого давления Shimadzu Prominence LC 20 (Япония) с хроматографической колонкой Nucleodur C18 Gravity (тип С18, размер частиц 3 мкм, длина 15 см) фирмы Macherey-Nagel (Германия). Выделение, разделение и идентификацию пигментов проводили согласно методике, описанной в работе Forni с соавт. [22]. Экстракцию пигментов из растений осуществляли с помощью щелочного ацетона (100% ацетон + 0.4% NH4OH в соотношении 9 : 1). Гомогенат центрифугировали 5 мин при 17 000 g на центрифуге Heraeus Pico 17, супернатант переносили в мерные пробирки, а осадок промывали щелочным ацетоном. Процедуру отмывки повторяли до полного извлечения пигментов. Разделение пигментов на колонке проводили с использованием растворов А (90% ацетонитрил, 9.9% Н2О, 0.1% триэтиламин) и Б (100% этилацетат) со скоростью потока 0.5 мл/мин. Пигменты регистрировали с помощью спектрофотометрического детектора с диодной матрицей Shimadzu SPD-M20A в диапазоне 200–800 нм. Визуализацию профиля хроматограммы осуществляли по спектрам поглощения при 440 нм. Для количественного определения пигментов использовали площади пиков хроматограммы.
Определение активности 5-аминолевулинатдегидратазы (АЛКД) и порфобилиногеназы (комплекса порфобилиногендеаминазы и уропорфириноген III-синтетазы). Активность АЛКД и порфобилиногеназы определяли, как описано в работе [23]. Навеску 0.5 г растительного материала растирали в охлажденных ступках в 1.5 мл 0.1 М Трис-HCl буфера (pH 8.2), содержащего 0.2 М MgCl2 · 6H2O, а также 0.05 М ДТТ. Гомогенат фильтровали через капроновую ткань. Из полученного ферментного препарата отбирали 0.5 мл и добавляли в инкубационную среду, содержащую 2 мл 0.1 М Трис-HCl буфера (pH 8.2), 0.2 мл 0.2 М MgCl2, 0.2 мл 0.05 М ДТТ, 0.5 мл 1% раствора АЛК, 0.6 мл H2O. Полученные пробы инкубировали 2 ч при 37°С. Контролем служили пробы, содержащие все вышеперечисленные компоненты, включая 0.5 мл H2O вместо АЛК. Реакцию останавливали, добавляя 0.8 мл смеси 3 М трихлоруксусной кислоты: 0.2 М MgCl2 (1 : 1, v/v). Затем пробы центрифугировали 10 мин при 6000 g. В осадке определяли содержание белков, а в супернатанте – порфобилиноген (ПБГ), являющийся продуктом деятельности АЛКД, и уропорфириноген III (УПГ III) – продукт деятельности порфобилиногендеаминазы и УПГ III-синтетазы. Для определения ПБГ к 2 мл супернатанта добавляли 2 мл модифицированного реагента Эрлиха и определяли оптическую плотность раствора при 553 нм. Использовали молярный коэффициент экстинкции 6.2 × 104 (М см)–1. Далее определяли количество ПБГ, превратившегося в УПГ III под действием порфобилиногеназы, учитывая, что на образование 1 молекулы УПГ III расходуется 4 молекулы ПБГ. Для определения количества УПГ III к 2 мл супернатанта добавляли 2 мл 5 н раствора HCl и через 10 мин регистрировали оптическую плотность при 406 нм на спектрофотометре Solar PB 2201 (Беларусь). Использовали молярный коэффициент экстинкции 53 × 104 (М см)–1.
В работе использовали реактивы фирмы Sigma-Aldrich (США) и AppliChem (Германия), а также в некоторых случаях реактивы аналитической чистоты других производителей. Все антитела, использованные в работе, были произведены фирмой Agrisera (Швеция).
Статистическая обработка данных. Приведены средние значения из 3–5 экспериментов и их стандартные ошибки. Различия по сравнению с контролем считали достоверными при уровне значимости P ≤ 0.05. Для статистической обработки экспериментальных данных использовали пакеты программ “Excel 2016”, “SigmaPlot 12.0” и статистические методы, принятые в области биологических исследований.
РЕЗУЛЬТАТЫ
Содержание фенолов и сравнительный анализ состава антоцианов
Было изучено общее содержание вторичных соединений класса фенолов в листовой ткани растений озимого рапса, как еще одной характеристики перспективной модельной системы с высоким содержанием антоцианов. В семядольных листьях 7-дневных растений озимого рапса, выращиваемых при освещенности 40.5 мкмоль фотонов/(м2 с) на растворах АЛК в концентрациях 50, 100, 150 и 200 мг/л, отмечена дозозависимая стимуляция накопления фенолов по сравнению с контрольными растениями, не обработанными АЛК. Так стимуляция составила 17, 10, 24 и 45% по отношению к контролю соответственно. Ранее мы отметили, что такие растения обогащены относящимися к классу полифенолов флавоноидами – антоцианами [14], что визуально проявлялось в розово-фиолетовой окраске листьев по сравнению с зеленой окраской контрольных растений, выращенных на воде. В работах, отметивших аналогичное стимулирующее действие экзогенной АЛК, не проводили качественного анализа антоцианов в контрольных и опытных образцах [7, 8, 10, 11, 24], что, несомненно, представляет научный интерес. С использованием ВЭЖХ был проведен сравнительный качественный анализ антоцианов, основанный на оценке количества пиков и параметров удерживания индивидуальных компонентов антоцианов на хроматограммах контрольных растений и растений, выращенных на экзогенной АЛК 200 мг/л при освещенности 66.2 мкмоль фотонов/(м2 с). На седьмой день развития содержание антоцианов в опытных вариантах превышало их содержание в контроле в среднем в 5.6 раза. В профилях элюции экстрактов контрольных и опытных растений было выявлено 7 полос, принадлежащих антоцианам (рис. 1, представлен вариант “АЛК”). Время удерживания веществ в опыте и контроле различалось лишь в сотом и тысячном знаках (таблица 1). Были отмечены лишь количественные различия – по высоте пиков и площади, занимаемой каждой полосой. Так, в одном из экспериментов полосы антоцианов варианта “АЛК” по занимаемой площади, пропорциональной концентрации вещества, превышали аналогичные в контроле в среднем в 6.4 раза.
Рис. 1.
Профиль элюции антоцианов, выделенных из семядольных листьев растений озимого рапса, выращенных на растворе АЛК 200 мг/л. Номера пиков соответствуют данным, представленным в таблице 1.

Таблица 1.
Хроматографические характеристики антоцианов, выделенных из 7-дневных растений озимого рапса
| № пика | Контроль | АЛК, 200 мг/л | ||||
|---|---|---|---|---|---|---|
| t*, мин | h** | S*** | t, мин | h | S | |
| 1 | 16.898 | 1675 | 78 065 | 16.868 | 5389 | 257 908 |
| 2 | 18.120 | 3112 | 69 184 | 18.128 | 8917 | 189 465 |
| 3 | 18.394 | 3770 | 145 893 | 18.386 | 11 280 | 433 921 |
| 4 | 19.376 | 2021 | 43 042 | 19.488 | 6374 | 121 031 |
| 5 | 19.958 | 6094 | 279 640 | 19.948 | 21 921 | 970 309 |
| 6 | 21.584 | 13 161 | 301 360 | 21.553 | 36 458 | 814 125 |
| 7 | 21.898 | 12 956 | 492 392 | 21.896 | 42 729 | 1 584 628 |
Активность АЛКД и комплекса порфобилиногендеаминазы и уропорфириноген III-синтетазы (порфобилиногеназы)
Ранее нами было отмечено, что в растениях озимого рапса, выращенных на растворе экзогенной АЛК 200 мг/л и накопивших существенные количества антоцианов, значительно подавлено накопление хлорофиллов а и b [14]. Поскольку АЛК является предшественником хлорофилла в биосинтезе, одной из причин дефицита последнего могла быть ограниченная способность экзогенного субстрата превращаться в хлорофилл из-за субстратного ингибирования АЛК-дегидратазы, фермента, участвующего в конденсации двух молекул АЛК с образованием пиррола ПБГ [12]. На рисунке 2 представлены результаты анализа активности АЛКД, рассчитанной по количеству зарегистрированного ПБГ и той его части, которая превратилась под действием порфобилиногеназы в УПГ III [23]. В экспериментах использовали 4–5-дневные растения, окрашенные в варианте АЛК в розово-фиолетовый цвет, с низким содержанием хлорофилла (в среднем 60% от контроля). В опытных растениях чрезвычайно низкой оказалась активность порфобилиногеназы – скорость образования УПГ III составила лишь 26.7% от таковой в контрольных растениях. Общее количество ПБГ, образованного АЛКД (с учетом УПГ III), также оказалось ниже в варианте “АЛК” – 58% от контроля.
Рис. 2.
Активность АЛКД (а) и порфобилиногеназы (б) в семядольных листьях 4–5-дневных растений озимого рапса, выращенных на воде (контроль) или на растворе экзогенной АЛК 200 мг/л. Достоверные различия при P ≤ 0.05 отмечены разными латинскими буквами (a–b).
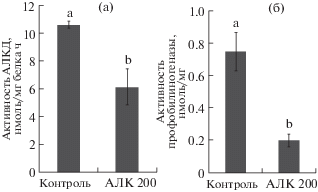
К 7-дневному возрасту по мере накопления хлорофилла и снижения разницы в его содержании между вариантами (в среднем разница составляла 20%) ингибирование активности порфобилиногеназы и АЛКД под действием экзогенной АЛК уменьшалось. Так активность порфобилиногеназы в опытных растениях составила 46%, АЛКД – 86% от контроля.
Состав и содержание каротиноидов
Наряду с торможением накопления хлорофилла в листьях растений озимого рапса, выросших на растворе экзогенной АЛК, в них было отмечено и значительное снижение скорости накопления каротиноидов [14]. Поскольку АЛК в высоких концентрациях обладает свойствами фотодинамического гербицида и, усиливая фотодеструкционные процессы, может влиять на качественный состав каротиноидов, в частности, на пигменты ксантофиллового цикла, был осуществлен сравнительный анализ состава и содержания каротиноидов в контрольных и обработанных АЛК розово-фиолетовых (4–5-дневные растения) листьях рапса с помощью метода ВЭЖХ. Качественный состав пигментов в экстрактах контрольных и опытных растений оказался идентичным – обнаружены кислород-содержащие ксантофиллы: неоксантин, виолаксантин, антераксантин, лютеин и бескислородный каротиноид β-каротин (рис. 3). Содержание вышеперечисленных пигментов в варианте “АЛК” составило 30, 37, 42, 35 и 33% от контроля соответственно (в среднем 35%). Оцененное методом ВЭЖХ содержание хлорофилла в этих же опытах дало следующие показатели: для хлорофилла а – 34% и для хлорофилла b – 33% от контроля, соотношение между хлорофиллами а и b составило 2.3 для контрольных растений и 2.4 для растений варианта “АЛК”.
Содержание апобелков пигмент-белковых комплексов (ПБК) фотосистем I и II
Поскольку хлорофилл является непосредственным участником фотосинтеза, далее был изучен белковый состав хлорофилл-белковых комплексов фотосинтетического аппарата, а также активность самого процесса. Опыты по определению содержания белков ПБК фотосинтетического аппарата в проростках озимого рапса показали, что обработка экзогенной АЛК снижала содержание белка D1 реакционного центра ФС II, что составляло 48% от контроля. Также отмечено снижение содержания белков светособирающих комплексов ФС I: Lhca1 – 73%, Lhca2 – 51%, Lhca3 – 56%, Lhca4 – 65% и ФС II: Lhcb1 – 27%, Lhcb2 – 33%, Lhcb4 – 47%, Lhcb5 – 70% и Lhcb6 – 59% по сравнению с их содержанием в растениях, выращенных на воде (рис. 4).
Рис. 4.
Вестерн-блот-анализ белков: D1, Lhca1, Lhca2, Lhca3, Lhca4, а также Lhcb1, Lhcb2, Lhcb4, Lhcb5 и Lhcb6, входящих в состав ПБК фотосинтетического аппарата растений озимого рапса, выращенных на воде или растворе АЛК 200 мг/л (а), а также их количественная оценка (б). Линия на рисунке (б) соответствует 100% содержания белков в контроле. Достоверные различия при P ≤ 0.05 отмечены разными латинскими буквами (a–i).

Активность фотосинтеза и поглощения кислорода
Отмеченные выше структурные изменения состава фотосинтетических мембран в растениях, обработанных экзогенной АЛК, сказались и на фотосинтетической активности. В розово-фиолетовых листьях 4–5-дневных растений с уровнем хлорофилла около 20% скорость фотосинтеза составляла 18% по сравнению с контролем (рис. 5а). В семядольных листьях 7-дневных растений варианта “АЛК” с содержанием хлорофилла в среднем 80% от контроля скорость выделения кислорода значительно возрастала по сравнению с 4–5-дневными растениями, достигая уровня 78% от контроля, и составляла 0.0064 ± 0.0007 мкмоль O2/(мг с) (рис. 5в).
Рис. 5.
Фотосинтетическая активность (а, в) и скорость поглощения кислорода листовой тканью (б, г) в 4–5-дневных (а, б) и в 7-дневных (в, г) семядольных листьях растений озимого рапса, выращенных на воде или на растворе АЛК 200 мг/л. Достоверные различия при P ≤ 0.05 отмечены разными латинскими буквами (a–b).

Вместе с тем обработка экзогенной АЛК оказала существенное стимулирующее влияние на потребление кислорода в затемненных семядольных листьях. На всех стадиях развития (4–7 дней) скорость потребления кислорода в темноте в опытных растениях возросла примерно в 2 раза по сравнению с таковой в контрольных растениях (рис. 5б, г).
Коэффициент фотосинтетической эффективности (скорость выделения кислорода/скорость поглощения кислорода) оказался в среднем на 44% ниже в 7-дневных растениях варианта “АЛК”.
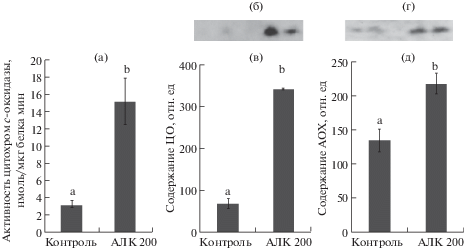
Активность и содержание субъединицы СОХIIb ЦО
Основными компонентами электронтранспортной дыхательной цепи, генерирующей АТФ в митохондриях, являются 8 гем-содержащих цитохромов, из которых наиболее значимым является терминальная ЦО, переносящая электрон от цитохрома с на кислород с образованием воды. На рисунке 6а представлена активность фермента, которая в растениях варианта “АЛК” составила 15.2 ± 3 нмоль/(мкг белка мин), что в 5 раз больше, чем в контрольных растениях, выращенных на воде. Такую же картину наблюдали при использовании вестерн-блот-анализа для оценки содержания субъединицы ЦО (СОХIIb), участвующей в образовании каталитического центра ферментного комплекса (рис. 6б, в). Как и в случае активности ЦО, содержание субъединицы СОХIIb фермента в опытных растениях в 5 раз превышало таковое в контроле.
Содержание АОХ
В условиях действия стрессовых биотических и абиотических факторов значительную роль в функционировании дыхательной электронтранспортной цепи митохондрий начинает играть терминальная АОХ, содержащая в активном центре 2 атома негеминового Fe и катализирующая четырехэлектронное окисление восстановленного убихинона (убихинола) кислородом без образования АТФ. На рисунках 6г и 6д представлено содержание белка АОХ в 7-дневных контрольных и опытных растениях. Обработка АЛК в 1.6 раза увеличила содержание фермента в семядольных листьях по сравнению с контрольными образцами.
ОБСУЖДЕНИЕ
АЛК относится к экологически чистым естественным метаболитам растений, обладающим в низких концентрациях свойствами регулятора роста растений и антистрессора [12]. Исследование механизмов росторегулирующей и антистрессовой активности низких концентраций АЛК показало значительное возрастание в обработанных растениях уровня эндогенных цитокининов, стабилизацию белкового метаболизма, усиление ассимиляции неорганического азота за счет активации экспрессии гена нитратредуктазы и возрастание активности фермента [13], увеличение содержания универсального стресс-протектора пролина, снижение уровня активных форм кислорода и возрастание активности защитных ферментов [12].
В высоких концентрациях (200–400 мг/л и выше) АЛК проявляет свойства фотодинамического гербицида (ФДГ), вызывая повышенное накопление порфиринов (уропорфирин(оген)а III, копропорфирин(оген)а III, протопорфирина IX, Mg-протопорфирина IX и протохлорофиллида) – предшественников хлорофилла и гема в биосинтезе, которые, являясь фотосенсибилизаторами, генерируют образование активных форм кислорода, которые запускают фотодинамические процессы, приводящие к разрушению растительных клеток. Теоретически АЛК является идеальным экологически чистым и безопасным для человека и животных ФДГ и должна действовать неселективно, поскольку система биосинтеза хлорофилла и гема присуща всем растениям. Однако однодольные и двудольные организмы показывают весьма широкий спектр различных ответных реакций на действие гербицидных концентраций АЛК [12]. Механизмы, используемые разными растениями для выживания в условиях фотодинамических процессов, генерируемых АЛК, мало изучены. В частности, показано, что уровень накопления порфиринов-фотосенсибилизаторов играет определяющую роль в чувствительности растений к АЛК и препаратам на ее основе. Например, низкая чувствительность однодольных организмов, в частности, злаков к АЛК, как фотогербициду, обеспечивается низкой способностью превращения АЛК (в среднем 20%) в порфирины-фотосенсибилизаторы [12]. У большинства чувствительных к этому ФДГ двудольных организмов, которые практически полностью погибают из-за развития фотоокислительных процессов (огурцы, мокрица, люпин), степень превращения АЛК в порфирины составляет в среднем 70%, а уровень накопления порфиринов на порядок превышает таковой у злаков [12].
Еще одним механизмом, функционирующим у ряда двудольных организмов, которые не демонстрируют фотодинамического обесцвечивания и повреждения тканей при использовании высоких концентраций экзогенной АЛК, является индуцированное действием АЛК накопление больших количеств вторичных метаболитов, таких как фенолы, флавоноиды и их производные антоцианы, которые, как известно, обладают ярко выраженными антиоксидантными свойствами [7, 8, 10, 11]. Функционирование этого механизма отмечается не только в листовой ткани [9–11], но и в кожуре плодов [7, 25], а также в каллусной ткани плодов яблок [9].
На примере листовой ткани двудольных растений озимого рапса показано возрастание под действием АЛК (200 мг/л) общего количества фенольных соединений, в том числе антоцианов, качественный состав которых остается при этом таким же, как и в контрольных растениях (рис. 1). Индукция накопления антоцианов под действием АЛК обеспечивается на молекулярном уровне повышением экспрессии генов структурных белков и транскрипционных факторов, а также активности ферментов, обеспечивающих синтез антоцианов [10, 14, 25]. Активизация защитной системы в таких растениях обеспечивается возрастанием содержания антистрессора пролина, а также антиоксидантной и антирадикальной активностей [14].
В условиях накопления антоцианов, особенно на ранних стадиях развития растений рапса (4–5-дневные проростки), отмечен низкий уровень накопления хлорофилловых пигментов (рис. 3) [14]. Дефицит хлорофиллов а и b на всех стадиях развития проростков варианта “АЛК” свидетельствует о том, что экзогенная аминокислота не использовалась в синтезе хлорофилла либо использовалась в очень ограниченных количествах. Отмеченное нами ингибирование скорости накопления хлорофилла в присутствии экзогенной АЛК могло быть вызвано подавлением в этих условиях синтеза эндогенной АЛК в результате избыточного накопления гема – ингибитора ключевого фермента синтеза АЛК – глу-тРНК-редуктазы [12, 14]. Мы предположили, что неспособность экзогенной АЛК восполнять уровень хлорофилла хотя бы до значений контрольных проростков может быть также связана с субстратным ингибированием АЛКД – фермента, осуществляющего конденсацию двух молекул АЛК с образованием ПБГ. Действительно, в 4–5-дневных растениях рапса активность АЛКД составила 58% от контроля (рис. 2). Однако оказалось, что основным фактором, лимитирующим превращение АЛК в порфирины, является активность порфобилиногеназы – комплекса порфобилиногендеаминазы и УПГ III-синтетазы, осуществляющего образование первичного порфирина в его восстановленной форме – УПГ III (рис. 2). В 4–5-дневных растениях активность этого комплекса составила лишь 26.7% от контроля. Интересно, что обработка кожуры яблок высокими концентрациями АЛК, вызывала их покраснение, обусловленное накоплением антоцианов [7, 8], но не усиление зеленой окраски, что также говорит о блокировании в этой ткани превращения экзогенной АЛК в продукты хлорофиллообразования. Функционирование описанных выше механизмов может рассматриваться в качестве защитных против избыточного накопления из эндогенной и экзогенной АЛК порфиринов-фотосенсибилизаторов.
Отмеченная нами ранее стимуляция накопления гема (на фоне подавления синтеза хлорофилла) в растениях рапса, обработанных АЛК [14], еще раз подтверждает концепцию о независимом функционировании, физическом разделении, участии разных изоэнзимов и разных механизмов контроля систем синтеза хлорофилла и гема в хлоропласте, начиная от образования АЛК [12]. Обсуждаемая в последние годы роль гема как сигнальной молекулы, участвующей в пластидно-ядерной сигнализации и контролирующей экспрессию ряда ядерных генов [26, 27], могла бы объяснить наблюдаемое угнетение активности закодированных в ядре ферментов синтеза хлорофилла в условиях высоких концентраций АЛК.
Интересно отметить одинаковое по эффективности действие экзогенной АЛК на две независимые в метаболическом и функциональном отношении системы синтеза хлорофилла (содержание в среднем 33% от контроля) и каротиноидов (содержание 35% от контроля). Это дает возможность предположить влияние АЛК на некий общий механизм контроля их содержания путем координированного подавления экспрессии закодированных в ядерном геноме генов обеих систем с помощью пластидно-ядерной сигнализации. При этом в растениях варианта “АЛК” не было отмечено изменения состава каротиноидов по сравнению с контрольными растениями (рис. 3).
Наряду с пигментами действие АЛК привело к значительному снижению содержания белков основных ПБК фотосистем I и II (рис. 4) – белка D1 РЦ ФС II, четырех белков внешней “минорной” антенны ФС II – Lhcb4-6, белков внешней мобильной антенны ССКII – Lhcb1-2 и четырех белков ССКI ФС I – Lhcа1-4. При этом наибольшее влияние АЛК оказала на мобильную внешнюю антенну ФС II (рис. 4), субъединицы Lhcb1-2, которые, входя в состав тримера, могут мигрировать от ФС II в область ФС I и ассоциироваться с ее внешней антенной. Значительное снижение содержания этих белков может отрицательно сказываться на перераспределении энергии между двумя фотосистемами.
Снижение содержания структурных компонентов ПБК фотосистем I и II в растениях варианта “АЛК” естественно сказалось и на эффективности фотосинтеза. В 4–5-дневных растениях с розово-фиолетовыми семядольными листьями и низким содержанием хлорофилла (<20% от контроля) скорость фотосинтеза составляла 18% по сравнению с растениями контрольного варианта (рис. 5а). В 7-дневных растениях, обработанных АЛК, с содержанием хлорофилла около 80% скорость фотосинтеза по сравнению с 4–5-дневными растениями значительно возрастала и в среднем составляла 78% от контроля (рис. 5в). В таких дефицитных по фотосинтезу растениях, несомненно, должна быть снижена и продукция энергетического субстрата – молекул АТФ. В этих условиях в растениях варианта “АЛК” отмечена интенсификации потребления кислорода листовой тканью. Отчетливая активация поглощения кислорода в затемненных растениях (рис. 5б, г) частично могла бы обеспечиваться за счет стимуляции митохондриального дыхания. Об этом свидетельствует повышение уровня компонента дыхательных цитохромов – гема [14] и 5-кратного возрастания активности гем-содержащего терминального фермента ЦО (рис. 6), чему в свою очередь соответствовало повышение содержания одной из трех кодируемых в митохондриях ключевых субъединиц фермента, формирующих его активный центр. Некоторый вклад в дыхательный процесс могла бы вносить и АОХ (рис. 6), индукция которой, как правило, является универсальным механизмом ответа на окислительный стресс путем его уменьшения или предотвращения [28, 29]. Использование ингибиторного анализа в дальнейшем позволит оценить вклад цитохромного и альтернативного дыхательных путей в индуцированную с помощью АЛК активацию поглощения кислорода. Следует также отметить, что в литературе описано расщепление экзогенной АЛК эндогенными оксидазами на два углеродных фрагмента, один из которых (С1–С4) поступает в цикл Кребса [30] и, таким образом, в условиях использования высоких концентраций АЛК расщепление последней могло бы также давать вклад в стимуляцию потребления кислорода листовой тканью растений варианта “АЛК”. Не исключается также активация под действием АЛК и других, не участвующих в митохондриальном дыхании, оксидаз.
Таким образом, установлено, что в растениях озимого рапса, выращенных на растворе экзогенной АЛК в концентрации 200 мг/л, происходит накопление вторичных метаболитов – фенолов и их производных антоцианов, состав которых не отличается от контрольных растений. В обогащенных антоцианами растениях наблюдается ингибирование фотосинтеза, путем снижения способности к формированию структурных компонентов фотосинтетического аппарата – ПБК фотосистем I и II. В этих условиях в растениях варианта “АЛК” отмечена интенсификация поглощения кислорода листовой тканью в условиях затемнения, а также возрастание активности терминальной ЦО и увеличение уровня другого терминального дыхательного фермента – АОХ, индукция которого, как правило, наблюдается в условиях стресса, в том числе окислительного.
Работа выполнена при поддержке Белорусского республиканского фонда фундаментальных исследований (грант № Б17МС-019).
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Чупахина Г.Н., Масленников П.В., Скрыпник Л.Н. Природные антиоксиданты (экологический аспект). Калининград: БФУ им. И. Канта, 2011. 111 с.
Gould K.S., Markham K.R., Smith R.H., Goris J.J. Functional role of anthocyanins in the leaves of Quintinia serrata A. Cunn. // J. Exp. Bot. 2000. V. 51. P. 1107.
Feild T.S., Lee D.W., Holbrook N.M. Why leaves turn red in autumn. The role of anthocyanins in senescing leaves of red-osier dogwood // Plant Physiol. 2001. V. 127. P. 566.
Neill S.O., Gould K.S. Anthocyanins in leaves: light attenuators or antioxidants? // Funct. Plant Biol. 2003. V. 30. P. 865.
Wang H., Cao G., Prior R.L. Oxygen radical absorbing capacity of anthocyanins // J. Agric. Food Chem. 1997. V. 45. P. 304.
Giusti M.M., Rodriguez-Saona L.E., Wrolstad R.E. Molar absorptivity and color characteristics of acylated and non-acylated pelargonidin-based anthocyanins // J. Agric. Food Chem. 1999. V. 47. P. 4631.
Xie L., Wang Z.H., Cheng X.H., Gao J.J., Zhang Z.P., Wang L.J. 5-Aminolevulinic acid promotes anthocyanin accumulation in Fuji apples // Plant Growth Regul. 2013. V. 69. P. 295.
Chen L., Guo Y., Bai G., Li Y. Effect of 5-aminolevulinic acid and genistein on accumulation of polyphenol and anthocyanin in qinyang apples // J. Anim. Plant Sci. 2015. V. 25. P. 68.
Feng X., An Y., Zheng J., Sun M., Wang L. Proteomic and SSH analyses of ALA-promoted fruit coloration and evidence for the involvement of a MADS-BOX gen, MdMADS1 // Front. Plant Sci. 2016. V. 7. 1615.
Feng X., Chang J., Cheng S.Y., Zhu J., Li L.L., Wang Y., Cheng H. Promotive effect of 5-aminolevulinic acid on the antioxidant system in Ginkgo biloba leaves // Afr. J. Biotechnol. 2009. V. 8. P. 3769.
Xu F., Cheng S., Zhu J., Zhang W., Wang Y. Effect of 5‑aminolevulinic acid on chlorophyll, photosynthesis, soluble sugar and flavonoids of Ginkgo biloba // Not. Bot. Horti Agrobot. Cluj-Napoca. 2011. V. 39. P. 41.
Аверина Н.Г., Яронская Е.Б. Биосинтез тетрапирролов в растениях. Минск: Беларуская навука, 2012. С. 413.
Beizai Z., Sherbakov R.A., Averina N.G. Response of nitrate reductase to exogenous application of 5-aminolevulinic acid in barley plants // J. Plant Growth Regul. 2014. V. 33. P. 745.
Аверина Н.Г., Емельянова А.В., Щербаков Р.А., Доманская И.Н., Усатов А.В. Индукция накопления антоцианов и состояние защитной системы растений озимого рапса, обработанных 5-аминолевулиновой кислотой // Физиология растений. 2017. Т. 64. С. 173.
Singleton V.L., Rossi J.A. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents // Am. J. Enol. Vitic. 1965. V. 16. P. 144.
Lee J., Rennaker C., Wrolstad R. Correlation of two anthocyanin methods: HPLC and spectrophotometric methods // Food chem. 2008. V. 110. P. 782.
Акиншина Н.Г., Азизов А.А., Карасева Т.А., Клозе Э. Новые возможности в оценке состояния растений // Сибирский экологический журнал. 2008. Т. 2. С. 249.
Jansson S., Stefansson H., Nystrom U., Gustafsson P., A-lbertsson P.-A. Antenna protein composition of PS I and PS II in thylakoid sub-domains // Biochim. Biophys. Acta. 1997. V. 1320. P. 297.
Edmands S., Burton R.S. Cytochrome c oxidase activity in interpopulation hybrids of a marine copepod: a test for nuclear-nuclear or nuclear-cytoplasmic coadaptation // Evol. 1999. V. 53. P. 1972.
Ермаков А.И., Арасимович В.В, Смирнова-Иконникова М.И., Ярош Н.П., Луковникова Г.А. Методы биохимического исследования растений. Изд. 2-е. Ленинград: Колос, 1972. С. 51.
Боровик О.А., Грабельных О.И., Королева Н.А., Побежимова Т.П. Связь между активностью альтернативного пути дыхания, содержанием сахаров и морозоустойчивостью озимой пшеницы // Журнал стресс-физиол. и биохимии. 2013. Т. 9, № 4. С. 241.
Forni E., Ghezzi M., Polesello A. HPLC separation and fluorimetric estimation of chlorophylls and pheophytins in fresh and frozen peas // Chromatography. 2012. V. 1. P. 120.
Shemin D. Delta-aminolevulinic acid degydrase from Rhodopseudomonas sphaeroides // Methods in Enzymol / Ed. by Colowick S.P., Koplan N.O. N.-Y.: Academic Press, 1962. V. 5. P. 883.
Chen L., Guo Y., Bai G., Li Y. Effect of 5-aminolevulinic acid and genistein on accumulation of polyphenol and anthocyanin in ‘qinyang’ apples // J. Anim. Plant Sci. 2015. V. 25. P. 68.
Guo L., Cai Z.X., Zhang B.B., Xu J.L., Song H.F., Ma R.J. The mechanism analysis of anthocyanin accumulation in peach accelerated by ALA // Acta Hortic. 2013. V. 40. P. 1043. https://doi.org/10.16420/j.issn.0513-353x.2013.06.004
Nagahatenna D.S.K., Langridge P., Whitford R. Tetrapyrrole-based drought stress signaling // Plant biotechnol. J. 2015. V. 13. P. 447.
Larkin R. Tetrapyrrole Signaling in Plants // Front. Plant Sci. 2016. V. 7. P. 1586. https://doi.org/10.3389/fpls.2016.01586
Рогов А.Г., Суханова Е.И., Уральская Л.А., Аливердиева Д.А., Звягильская Р.А. Альтернативная оксидаза: распространение, индукция, свойства, структура, регуляция, функции // Успехи биол. хим. 2014. Т. 54. С. 413.
Cvetkovska M., Vanlerberghe G.S. Alternative oxidase modulates leaf mitochondrial concentration of superoxide and nitric oxide // New Phytol. 2012. V. 195. P. 32.
Duggan J.X., Meller E., Gassman M.L. Catabolism of 5‑aminolevulinic acid to CO2 by etiolated barley leaves // Plant Physiol. 1982. V. 69. P. 19.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений