Физиология растений, 2020, T. 67, № 1, стр. 67-74
Устойчивое и чувствительное к салицилгидроксамовой кислоте дыхание теплолюбивых растений в условиях кратковременных ежесуточных понижений температуры
Е. Н. Икконен a, *, О. И. Грабельных b, Е. Г. Шерудило a, Т. Г. Шибаева a
a Институт биологии Карельского научного центра Российской академии наук,
Федеральный исследовательский центр “Карельский научный центр РАН”
Петрозаводск, Россия
b Федеральное государственное бюджетное учреждение науки Сибирский институт физиологии и биохимии растений Сибирского отделения Российской академии наук
Иркутск, Россия
* E-mail: likkonen@gmail.com
Поступила в редакцию 26.09.2018
После доработки 18.12.2018
Принята к публикации 25.12.2018
Аннотация
При изучении дыхательного метаболизма растений салицилгидроксамовая кислота (СГК) используется как специфический ингибитор альтернативной цианид-резистентной оксидазы, поэтому чувствительность дыхания интактных тканей растений к СГК может косвенно отражать активность альтернативного пути переноса электронов (АОП) в дыхательной цепи растений. Исследовали влияние кратковременных ежесуточных понижений температуры (ДРОП от англ. drop − понижение) в конце ночи до 12, 8, 4 или 1°С на СГК-устойчивое и СГК-чувствительное дыхание листьев теплолюбивых растений (огурец, томат и сладкий перец). При оптимальной температуре измерения (25°С) усиление дыхания листьев огурца и томата в результате ДРОП-воздействий было связано с активизацией СГК-чувствительного дыхания, отражающего с высокой долей вероятности активность АОП. В условиях низкой температуры измерения (15°С) стимуляция ДРОП-воздействиями общего дыхания листьев огурца сопровождалась усилением СГК-устойчивого дыхания, что, предположительно, отражает активизацию потока электронов по цитохромному пути (ЦОП), при этом степень увеличения активности ЦОП возрастала с понижением температуры ДРОП. При высокой температуре (35°С) чувствительность дыхания листьев огурца к СГК снижалась, а СГК-устойчивое дыхание возрастало с усилением интенсивности ДРОП. Вклад СГК-чувствительного дыхания в общее дыхание листьев огурца повышался с ростом температуры измерения. На примере растений огурца показано, что СГК-чувствительное дыхание, в большей степени, чем СГК-устойчивое, зависит от изменений температуры, что может отражать значимый вклад ЦОП в формирование устойчивости дыхания к действию низкой температуры. Результаты свидетельствуют, что у теплолюбивых видов растений АОП играет важную роль в дыхательном метаболизме клетки, однако ЦОП является основным механизмом поддержания дыхания при низкотемпературных воздействиях.
ВВЕДЕНИЕ
В электрон-транспортной цепи (ЭТЦ) растительных митохондрий существуют два пути транспорта электронов с пула убихинона – цитохромный (ЦОП), заканчивающийся на цитохром с-оксидазе (ЦО), и альтернативный (АОП), связанный с активностью альтернативной цианид-резистентной оксидазы (АО). В отличие от цитохромного пути, транспорт электронов по которому сопряжен с переносом протонов и синтезом АТФ, альтернативный путь не является протон-транслоцирующим и протекает без запасания энергии в форме АТФ. Конкурируя за электроны и регулируя их относительное распределение по потокам, ЦОП и АОП вместе поддерживают энергетический баланс клетки [1]. При ограничении транспорта электронов по ЦОП активизация их потока по АОП вносит вклад в снижение сверхвосстановленности пула переносчиков электронов на уровне ЭТЦ и усиленного окисления их кислородом, препятствуя, тем самым, накоплению избыточного количества активных форм кислорода (АФК) [2–4]. Предполагается, что АОП играет важную роль в фотосинтезирующей клетке: участвует в создании оптимальных условий для протекания фотосинтеза и защите клетки от фотоингибирования [4]. Смена соотношений путей дыхательного метаболизма может происходить в ходе онтогенеза [5, 6] или при изменении условий роста растений [3, 7, 8]. Считается, что вовлечение АОП расширяет адаптивные возможности клеточного метаболизма, способствует поддержанию роста и защите растений, поэтому в исследованиях отклика растений на стрессовые воздействия изучению путей дыхательного метаболизма уделяется должное внимание [9–12]. В таких исследованиях широко используется ингибиторный анализ, позволяющий косвенно судить о доле составляющих суммарного дыхания. В частности, альтернативный путь переноса электронов в ЭТЦ митохондрий растений чувствителен к салицилгидроксамовой кислоте (СГК), что позволяет использовать ее как ингибитор АОП. С определенной долей вероятности (ввиду влияния данного ингибитора не только на АО, но и в некоторой степени модулирования активности ЦОП) СГК-чувствительное дыхание может быть принято за вклад альтернативного пути в общее дыхание, а СГК-устойчивое – за сумму цитохромного пути дыхания и остаточного немитохондриального дыхания, которое, как правило, не превышает 10% от общего [6].
Одним из факторов, инициирующих переключение переноса электронов с цитохромного на альтернативный путь, является низкая температура [7–9]. Однако исследования влияния холода на активность путей дыхания растений проводились в основном при стабильных, постоянно низких температурах, а знания о реакции дыхательного метаболизма на нестабильность климата очень ограничены, несмотря на ее усиление, которое может выражаться в резких перепадах температуры в относительно короткие промежутки времени. Кратковременные ежесуточные понижения температуры (ДРОП-воздействия, от англ. drop – падение), как было установлено ранее, способны инициировать усиление дыхания теплолюбивых видов растений [13], однако не ясно, за счет активизации какого из путей дыхания происходит данное усиление. Целью исследования являлась оценка влияния ДРОП-воздействий на активность, соотношение и температурную зависимость СГК-чувствительного и СГК-устойчивого дыхания листьев на примере трех видов теплолюбивых растений (огурец, томат, сладкий перец).
МАТЕРИАЛЫ И МЕТОДЫ
Растения огурца (Cucumis sativus L., гибрид Кураж F1), томата (Solanum lycopersicum L., гибрид Верлиока F1) и сладкого перца (Capsicum annuum L., сорт Нежность) выращивали в камере искусственного климата (“Vötsch”, Германия) при поливе питательным раствором (рН 6.2–6.4), температуре воздуха 23/20°С день/ночь, 300 мкмоль/(м2 с) ФАР, фотопериоде 16 ч, влажности воздуха 70%. Растения огурца были разделены на группы в возрасте 7 суток, когда только начинал формироваться первый лист. Первую группу растений ежедневно в течение 13 суток переносили в конце темнового периода на 2 ч в камеру искусственного климата (“Snijders Microclima 1750”; “Snijders Scientific BV”, Нидерланды) с температурой 12°C (вариант ДРОП12), вторую − 8°C (ДРОП8), третью − 4°C (ДРОП4), четвертую − 1°C (ДРОП1), сохраняя прочие условия неизменными. Для сравнительной оценки влияния ежесуточных кратковременных и длительного низкотемпературного воздействия на дыхание, пятая группа растений в возрасте 14 дней была перенесена на 6 суток в камеру с температурой 12°C и ФАР, равной 100 мкмоль/(м2 с) (вариант НТ). Шестая группа растений, которую не подвергали низкотемпературным воздействиям и выращивали в первоначальных оптимальных условиях, служила контролем. Растения томата и перца в возрасте 3−4 настоящих листьев были разделены на четыре группы, три из которых в течение 13 суток подвергали ДРОП-воздействиям, снижая температуру на 2 ч, соответственно до 12, 8 и 4°C (варианты ДРОП12, ДРОП8, ДРОП4), а четвертая являлась контрольной.
Измерения темнового дыхания листьев растений производили не ранее, чем через сутки после окончания низкотемпературных воздействий. В течение данных суток все растения находились в оптимальных температурных и прочих условиях. У контрольных и опытных вариантов ДРОП измерения выполняли на полностью сформировавшихся 2−3-ем листьях растений огурца и на 5−6-ом листьях томата и перца. У растений огурца варианта НТ дыхание измеряли на первом листе. До начала измерений дыхания растения выдерживали в темноте не менее 15 мин. Интенсивность дыхания определяли полярографически с использованием электрода Кларка (“Oxygraph Plus”, “Hansatech Instruments”, Англия). Из листовых пластинок огурца, томата и перца острозаточенным стальным цилиндром вырезали диски площадью 2.6 см2, что составляло в среднем 6.9 мг сухой массы для огурца и перца и 5.5 мг сухой массы для томата. Отобранные образцы разрезали на полоски шириной не более 2 мм и помещали в измерительную кювету с 2 мл буферного раствора 100 мМ HEPES (pH 7.5) с добавлением или без добавления ингибитора альтернативной оксидазы − 30 мМ СГК, предварительно растворенного в спирте. Буферный раствор насыщали кислородом перед каждым измерением. Образцы растений выдерживали в буферном растворе в темноте не менее 15 мин и при условии стабилизации процесса скорость снижения содержания кислорода измеряли в течение 5 минут. Концентрацию ингибитора и длительность инкубации подбирали в предварительном эксперименте для каждого объекта. Скорость поглощения кислорода растительным материалом в буферном растворе, не содержащем СГК, была принята за общее дыхание (Vt), в буферном растворе, содержащем СГК, – за СГК-устойчивое дыхание (VСКГ-уст), а различия в скоростях поглощения кислорода в буфере, не содержащем и содержащем СГК, рассчитывали как СГК-чувствительное дыхание (VСКГ-чувств). Пренебрегая влиянием СГК на ЦОП, долю альтернативного пути в общем дыхании листьев растений определяли как VСГК-чувств/Vt. При этом авторы понимали условность данной величины и принимали, что системы потребления кислорода, чувствительные к СГК и способные имитировать СГК-ингибируемое дыхание растительной ткани, вносят незначительный вклад в общее поглощение кислорода и не имеют температурной зависимости.
С целью определения температурной зависимости общего, СГК-чувствительного и СГК-устойчивого дыхания листьев огурца измерения проводили при температурах буферного раствора 15, 25 и 35°C. Для создания требуемой температуры камеру с измерительной кюветой подсоединяли к жидкостному термостату MLW (“VEB MLW PRUFGERATE-WERK”, ГДР). Калибровку электрода проводили при каждой температуре измерения.
Температурную чувствительность дыхания выражали посредством величины Q10, показывающей во сколько раз изменяется скорость процесса при изменении температуры на 10°С. Для определения Q10 значения скоростей дыхания при разных температурах измерения аппроксимировали степенной функцией. Представлены средние значения и их стандартные ошибки по двум независимым экспериментам при 4 и более повторностях в каждом. Достоверность различий между средними значениями определяли при P < 0.05 на основе дисперсионного анализа (LSD-тест) с использованием программного обеспечения Statistica (v. 8.0.550.0, “StatSoft, Inc.”). В случае отсутствия статистически достоверного различия между величиной поглощения кислорода из буферного раствора, не содержащего и содержащего СКГ, значение VСКГ-чувств было принято за нулевое.
РЕЗУЛЬТАТЫ
При оптимальной температуре измерения (25°C) действие ДРОП не вызывало изменения интенсивности дыхания листьев в присутствии СГК (VСГК-уст) независимо от вида растений, но усиливало общее дыхание (Vt) листьев огурца варианта ДРОП4 и томата варианта ДРОП8 соответственно на 36 и 16% (рис. 1). Повышение скорости Vt происходило за счет усиления СГК-чувствительного дыхания, что отразилось на увеличении параметра VСГК-чувств/Vt (табл. 1). Следует отметить, что у растений сладкого перца в результате действия ДРОП величина VСГК-чувств/Vt возрастала независимо от интенсивности температуры ДРОП (рис. 1в, табл. 1), однако данное увеличение не подтверждено статистически. Влияние низкой температуры разной интенсивности и длительности действия на дыхание и соотношение путей дыхания в листьях огурца проявилось в большей степени при температурах, отличных от оптимальной. При температуре измерения 15°C величина Vt последовательно возрастала в ряду ДРОП12–ДРОП8–ДРОП4–ДРОП1–НТ, достигая в варианте НТ превышения контрольных значений на 90% (рис. 1г). При этом чувствительность дыхания растений данного ряда к СГК изменялась незначительно, и усиление общего дыхания осуществлялось за счет повышения VСГК-уст. При температуре измерения 15°C растения вариантов ДРОП12, ДРОП8 и ДРОП4 демонстрировали только тенденцию к увеличению VСГК-уст, но в листьях вариантов ДРОП1 и НТ данные значения превышали контрольные в 1.5 и 2 раза соответственно. С повышением температуры измерения до 35°C чувствительность дыхания листьев огурца к СГК существенно возрастала (рис. 1д), что сопровождалось повышением величины VСГК-чувств/Vt (табл. 1). Если при 15°C у контрольных растений СГК ингибировала только 33% дыхания, то при 35°C ингибирование достигало 63%. При 35°C величина VСГК-уст листьев огурца вариантов ДРОП12 и ДРОП8 была выше контроля на 16%, а вариантов ДРОП4, ДРОП1 и НТ соответственно на 52, 58 и 62% (рис. 1д), при этом скорость Vt снижалась в варианте ДРОП1 и особенно значимо в варианте НТ. Данное понижение Vt на фоне повышения VСГК-уст может с определенной долей вероятности отражать снижение активности АО. У растений, испытавших ранее действие низкой температуры, величина VСГК-чувств/Vt уменьшалась при 35°C, причем степень данного снижения была прямо пропорциональна напряженности низкотемпературного фактора (табл. 1). Влияние температуры на Vt, VСГК-уст и VСГК-чувств дыхания листьев огурца представлено на рисунке 2. В варианте НТ величина VСГК-чувств была стабильно низкой и не зависела от температуры измерения (табл. 2). Чувствительное к СГК дыхание листьев огурца в большей степени, чем СГК-устойчивое дыхание реагировало на изменения температуры (табл. 2). Значения Q10 СГК-чувствительного дыхания были выше таковых общего дыхания и особенно СГК-устойчивого. У растений варианта НТ величина Q10 как устойчивого, так и чувствительного к СГК дыхания существенно снижалась. ДРОП-воздействия мало повлияли на отклик Vt, VСГК-уст и VСГК-чувств дыхания на изменение температуры, за исключением варианта ДРОП1.
Рис. 1.
Темновое дыхание листьев огурца (а, г, д), томата (б) и сладкого перца (в) без ингибитора (1) и с ингибитором (2) альтернативного пути дыхания (СГК, салицилгидроксамовая кислота), не подвергавшихся (Контроль) и подвергавшихся кратковременному (2 ч) ежесуточному (13 суток) понижению температуры до 12°С (ДРОП12), 8°С (ДРОП8), 4°С (ДРОП4) и 1°С (ДРОП1) и продолжительному (6 суток) действию низкой (12°С) температуры (НТ). Измерения выполнены при температуре листа 15°С (г), 25°С (а, б, в) и 35°С (д). В пределах каждого параметра разные буквы указывают на достоверность различий средних значений при уровне значимости Р < 0.05. * означает достоверность различий средних значений дыхания без ингибирования и с ингибированием альтернативного пути дыхания для каждого варианта опыта отдельно.
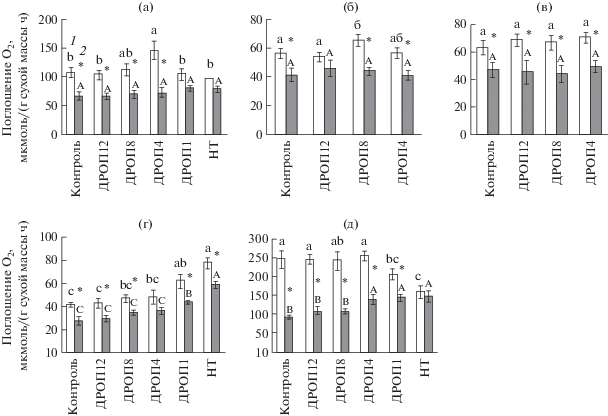
Таблица 1.
Величина VСГК-чувств/Vt у листьев огурца, томата и перца, не подвергавшихся (контроль) и подвергавшихся кратковременному ежесуточному понижению температуры до 12°С (ДРОП12), 8°С (ДРОП8), 4°С (ДРОП4), 1°С (ДРОП1) или продолжительному действию низкой температуры (НТ)
| Контроль | ДРОП12 | ДРОП8 | ДРОП4 | ДРОП1 | НТ | ||
|---|---|---|---|---|---|---|---|
| Огурец | 15°С | 0.33 | 0.31 | 0.26 | 0.25 | 0.30 | 0.24 |
| 25°С | 0.38 | 0.35 | 0.38 | 0.50 | 0.22 | 0.19 | |
| 35°С | 0.63 | 0.57 | 0.56 | 0.46 | 0.30 | ns | |
| Томат | 25°С | 0.28 | 0.15 | 0.32 | 0.27 | – | – |
| Перец | 25°С | 0.26 | 0.34 | 0.34 | 0.31 | – | – |
Рис. 2.
Температурная зависимость общего (1), СГК-устойчивого (2) и СГК-чувствительного (3) дыхания листьев огурца, не подвергавшихся (а, контроль) и подвергавшихся кратковременному (2 ч) ежесуточному (13 суток) понижению температуры до 12°С (б, ДРОП12), 8°С (в, ДРОП8), 4°С (г, ДРОП4), 1°С (д, ДРОП1) или продолжительному (6 суток) действию низкой (12°С) температуры (е, НТ).
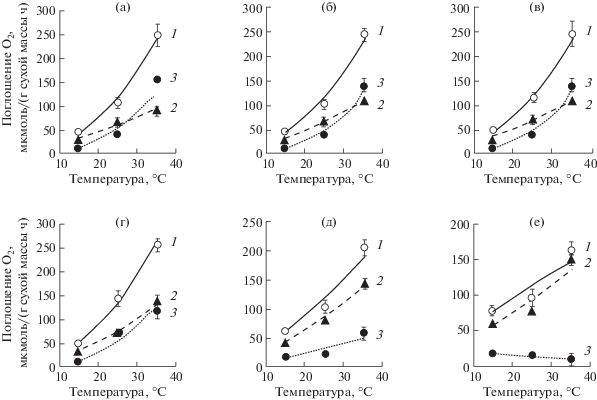
Таблица 2.
Величина Q10 общего, СГК-устойчивого и СГК-чувствительного дыхания листьев огурца, не подвергавшихся (контроль) и подвергавшихся кратковременному (2 ч) ежесуточному (13 суток) понижению температуры до 12°С (ДРОП12), 8°С (ДРОП8), 4°С (ДРОП4), 1°С (ДРОП1) или продолжительному (6 суток) действию низкой (12°С) температуры (НТ)
| Контроль | ДРОП12 | ДРОП8 | ДРОП4 | ДРОП1 | НТ | |
|---|---|---|---|---|---|---|
| Общее дыхание | 2.1 | 2.0 | 1.9 | 2.0 | 1.4 | 0.8 |
| СГК-устойчивое дыхание | 1.4 | 1.5 | 1.3 | 1.6 | 1.4 | 1.0 |
| СГК-чувствительное дыхание | 2.8 | 2.7 | 2.8 | 2.7 | 1.3 | ns |
ОБСУЖДЕНИЕ
На примере растений огурца, томата и сладкого перца показано, что у теплолюбивых видов даже при оптимальных условиях роста наряду с СГК-устойчивым дыханием функционирует СГК-чувствительное (рис. 1), отражающее, с высокой долей вероятности, активность альтернативного пути переноса электронов в ЭТЦ митохондрий (АОП). Ранее на митохондриях озимой пшеницы было показано, что ингибирование АО с помощью бензгидроксамовой кислоты (БГК) не приводило к изменению активности цитохром с оксидазы [8]. Так, способность АО к транспорту электронов (определяется, когда первым добавляли цианид) в митохондриях контрольных проростков и проростков, подвергнутых действию низкой температуры, совпадала с реальным вкладом АО в дыхание (когда первой добавляли БГК), на что указывает величина соотношения реального вклада АО и ее способности к транспорту электронов, равная 0.96 в митохондриях контрольных проростков, и 0.85 в митохондриях из проростков, прошедших первую фазу закаливания [8].
Кратковременные периодические понижения температуры повлияли на скорости как устойчивого, так и чувствительного к СГК дыхания, что предполагает влияние ДРОП на пути транспорта электронов в ЭТЦ и свидетельствует об изменениях в энергетическом метаболизме митохондрий исследованных видов растений. Незначительные понижения температуры могли стимулировать активизацию АО с повышением доли транспорта электронов по АОП, что согласуется с рядом работ, в которых показана возможность переключения потока электронов на АО в низкотемпературных условиях у теплолюбивых видов [11]. Являясь энергорассеивающей системой, АОП способствует стабилизации редокс-статуса митохондриального пула убихинона, участвует в оптимизации процесса фотосинтеза [14, 15], защите клетки от фотоингибирования и предотвращению накопления избытка АФК [6, 16]. Как известно, низкая температура является причиной окислительного стресса у теплолюбивых растений, образующиеся при этом АФК инициируют процесс перекисного окисления липидов, что вызывает холодовое повреждение растений [17]. Поскольку основным источником АФК в фотосинтезирующей клетке являются хлоропласты, то активация потока электронов через АО на начальных этапах действия низкой температуры может предотвращать сверхвосстановление не только ЭТЦ митохондрий, но и ЭТЦ хлоропластов, сохраняя, таким образом, фотосинтетическую активность растений. Возможный механизм взаимодействия митохондрий и хлоропластов видится в эффективном рассеивании в митохондриальной ЭТЦ избытка восстановительных эквивалентов, генерируемых в хлоропластах, которые поступают в митохондрии через цитозоль посредством малат/оксалоацетатного переносчика и окисляются в дыхательной цепи через альтернативные “внутренние” и “внешние” НАД(Ф) · Н-дегидрогеназы и АО. Такая роль АО в оптимизации фотосинтеза ранее была предложена в условиях избыточного освещения [18] и при ограничении транспорта электронов через цитохромный путь [16]. Также предполагается, что АО играет важную роль в защите растений от действия холода путем регулируемого термогенеза [9, 19]. Однако результаты данной работы также показали, что повышение напряженности или длительности низкотемпературного воздействия может ингибировать активность АО и снижать долю АОП в общем дыхании листьев теплолюбивых видов (табл. 1).
Стимуляция ДРОП-воздействиями дыхания листьев огурца в присутствии ингибитора АО – СГК проявлялась в основном при температурах, отличных от оптимальных (рис. 1г, д). В присутствии СГК дыхание осуществляется в большей степени за счет потока электронов по ЦОП, чем за счет процессов, обуславливающих остаточное дыхание. Остаточное митохондриальное дыхание, не ингибируемое СГК, составляет незначительную долю в общем дыхании [6] и не откликается на температурные изменения [20], поэтому можно предположить, что низкотемпературная стимуляция дыхания листьев в присутствии ингибитора, проявившаяся при температурах ниже и выше оптимальной, обусловлена в основном изменениями активности ЦОП, а не остаточного дыхания. Также можно предположить, что выявленное в данной работе усиление дыхания цитохромного типа в результате действия ДРОП вызвано необходимостью сохранения максимально возможной энергетической эффективности дыхания для реализации энергозависимых процессов адаптации к низкой температуре. Видимо, ДРОП-воздействия и длительное действие пониженной температуры на теплолюбивые растения могут вызывать изменения в энергетическом метаболизме митохондрий, которые, предположительно, затрагивают активность как АОП, так и ЦОП транспорта электронов в ЭТЦ.
Обеспеченность клеток растворимыми сахарами может принимать участие в контроле цитохромного пути дыхания в растениях [21]. На фоне увеличения содержания сахаров в листьях растений может происходить усиление потока электронов по ЦОП [10]. В низкотемпературных условиях содержание углеводов в растительных клетках, как правило, увеличивается [22], что было отмечено и для теплолюбивых растений, подвергавшихся действию ДРОП [23]. Кроме обеспеченности клеток сахарами, активность ЦОП регулируются доступностью АДФ, так как поток электронов по цитохромному пути в ЭТЦ митохондрий тормозится высоким соотношением АТФ/АДФ [19, 24]. Можно предположить, что повышение пропускной способности ЦОП в листьях огурца в результате ДРОП-воздействий связано с увеличением содержания в них сахаров и/или ростом энергетических потребностей, необходимых для процессов, способствующих повышению устойчивости растений к изменениям температуры. Следует отметить, что стимуляция СГК-устойчивого дыхания, проявившаяся в условиях высокой и низкой температуры, была характерна как для растений вариантов ДРОП, так и для растений варианта НТ (рис. 1г, д). При этом снижение температуры ДРОП-воздействий повышало степень активизации СКГ-устойчивого дыхания, максимум которого достигался у растений, подвергавшихся длительному действию холода. По-видимому, усиление цитохромного типа дыхания является общим механизмом реагирования теплолюбивых растений на кратковременные и длительное понижение температуры.
При росте растений в условиях низкой температуры поток электронов по АОП может повышаться у некоторых видов растений [7–9, 23], включая чувствительные к холоду [10], снижаться [25] или не осуществляться [3]. Данные различия, видимо, связаны с тем, что отклик АО на температуру может зависеть от вида и тканей растений, интенсивности и длительности низкотемпературного действия, стадии физиологического развития растений [14, 26]. Результаты данной работы показали, что в условиях вне оптимальных температур у растений, подвергавшихся ДРОП-воздействиям, доля АОП в общем дыхании снижалась, что, предположительно, связано с усилением активности ЦОП (табл. 1). При высокой температуре измерения чувствительность дыхания листьев к СКГ уменьшалась последовательно с повышением напряженности низкотемпературного фактора. Вероятно, в результате действия низких температур в метаболизме митохондрий осуществились адаптационные преобразования, которые не могли обеспечивать высокую функциональную активность АО при повышенной температуре.
Как устойчивое, так и чувствительное к СГК дыхание листьев огурца были зависимы от изменений температуры. Интенсивные ДРОП воздействия (вариант ДРОП1) снижали температурную чувствительность дыхания независимо от их устойчивости к СГК (табл. 2). При длительном действии низкой температуры СГК-чувствительное дыхание не реагировало на изменения температуры и поддерживалось на стабильно низком уровне, видимо, вследствие ингибирования синтеза АО (рис. 2е).
Способность растений к усилению потока электронов по АОП в холоде [7, 8, 11, 26] может быть обусловлена более слабой, чем у ЦОП, зависимостью от изменений температуры [10]. Результаты данной работы согласуются с результатами некоторых более ранних исследований, показавших, что чувствительность АОП к температуре может быть не ниже, чем у ЦОП [20], что, несмотря на важную роль АОП, отражает значимый вклад ЦОП в поддержание редокс-статуса фотосинтетических клеток и их защите от окислительного стресса в низкотемпературных условиях [25]. Различия в отклике цитохромного и альтернативного путей дыхания теплолюбивых растений на изменение температуры могут влиять на смещение их соотношения в общем дыхании и играть важную роль в формировании температурной чувствительности, а, следовательно, и устойчивости дыхания к действию низкой температуры. Таким образом, в условиях кратковременных ежесуточных понижений температуры АОП играет важную роль в дыхательном метаболизме теплолюбивых видов растений, но, видимо, основным механизмом повышения устойчивости их дыхания к изменениям температуры является цитохромный путь.
Работа выполнена в рамках государственного задания Карельского научного центра Российской академии наук (№ 0218-2019-0074) и при частичной поддержке Российского фонда фундаментальных исследований (проект № 14-04-00840а). Исследования выполнены на научном оборудовании Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Lambers H. Cyanide-resistant respiration: a non-phosphorylating electron transport pathway acting as an energy overflow // Physiol. Plant. 1982. V. 55. P. 478–485.
Климов С.В., Бураханова Е.А., Дубинина И.М., Алиева Г.П., Сальникова Е.Б., Олениченко Н.А., Загоскина Н.В., Трунова Т.И. Подавление донорной функции влияет на распределение углерода и морозостойкость вегетирующих растений озимой пшеницы // Физиология растений. 2008. Т. 55. С. 340–447.
Гармаш Е.В., Головко Т.К. Влияние скорости роста ячменя, выращиваемого при разных температуре и обеспеченности минеральным питанием, на активность альтернативного пути дыхания растений // Физиология и биохимия культурных растений. 2011. Т. 43. № 2. С. 113–121.
Гармаш Е.В. Митохондриальное дыхание фотосинтезирующей клетки // Физиология растений. 2016. Т. 63. С. 17–30.
Шугаев А.Г., Шугаева Н.А., Выскребенцева Э.И. Цианид- и ротенон-резистентное дыхание митохондрий корнеплода сахарной свеклы в ходе онтогенеза // Физиология растений. 2006. Т. 53. С. 503–510.
Garmash E.V., Grabelnych O.I., Velegzhaniniv I.O., Borovik O.A., Dalke I.V., Voinikov V.K., Golovko T.K. Light regulation of mitochondrial alternative oxidase pathway during greening of etiolated wheat seedlings // J. Plant Physiol. 2015. V. 174. P. 75–84.
Грабельных О.И., Побежимова Т.П., Корзун А.М., Возненко С.А., Королева Н.А., Павловская Н.С., Боровик О.А., Войников В.К. Участие цианид-резистентного дыхания в термогенерации и антиокислительной защите клетки в проростках озимой пшеницы при холодовом воздействии // J. Stress Physiol. Biochem. 2011а. V. 7. № 4. P. 447–456.
Грабельных О.И., Побежимова Т.П., Павловская Н.С., Королева Н.А., Боровик О.А., Любушкина И.В., Войников В.К. Антиоксидантная функция альтернативной оксидазы в митохондриях озимой пшеницы при холодовом закаливании // Биологические мембраны. 2011б. Т. 28. № 4. С. 274–283.
Грабельных О.И., Боровик О.А., Таусон Е.Л., Побежимова Т.П., Катышев А.И., Павловская Н.С., Королева Н.А., Любушкина И.В., Башмаков В.Ю., Попов В.Н., Боровский Г.Б., Войников В.К. Митохондриальные энергорассеивающие системы (альте-рнативная оксидаза, разобщающие белки и “внешняя” NADH-дегидрогеназа) вовлечены в развитие морозоустойчивости проростков озимой пшеницы // Биохимия. 2014. Т. 79. № 6. С. 645–660.
Kiener C.M., Bramlage W.J. Temperature effects on the activity of the alternative respiratory pathway in chill-sensitive Cucumis sativus // Plant Physiol. 1981. V. 68. P. 1474–1478.
Ribas-Carbo M., Aroca R., Gonzalez-Meler M.A., Irigoyen J.J., Sanchez-Diaz M. The electron partitioning between the cytochrome and alternative respiratory pathways during chilling recovery in two cultivars of maize differing in chilling sensitivity // Plant Physiol. 2000. V. 122. P. 199–204.
Рахманкулова З.Ф., Федяев В.В., Абдуллина О.А., Усманов И.Ю. Формирование адаптационных механизмов у пшеницы и кукурузы к повышенному содержанию цинка // Вестник башкирского университета. 2008. Т. 13. № 1. С. 43–46.
Икконен Е.Н., Шибаева Т.Г., Титов А.Ф. Влияние кратковременных ежесуточных понижений температуры на соотношение дыхания и фотосинтеза у теплолюбивых растений // Физиология растений. 2018. Т. 65. С. 45–51.
Del-Saz N.F., Ribas-Carbo M., McDonald A.E., Lambers H., Fernie A.R., Florez-Sarasa I. An in vivo perspective of the role(s) of the alternative oxidase pathway // Trends in Plant Science. 2018. V. 23. № 3. P. 206–219.
Гармаш Е.В., Малышев Р.В., Шелякин М.А., Головко Т.К. Активность дыхательных путей и фонд неструктурных углеводов в листе зеленеющих проростков яровой пшеницы // Физиология растений. 2014. Т. 61. С. 177–186.
Vishwakarma A., Tetali S.D., Selinski J., Scheibe R., Padmasree K. Importance of the alternative oxidase (AOX) pathway in regulating cellular redox and ROS homeostasis to optimize photosynthesis during restriction of the cytochrome oxidase pathway in Arabidopsis thaliana // Ann. Bot. 2015. V. 116. P. 555–569.
Лукаткин А.С. Холодовое поврждение теплолюбивых растений и окислительный стресс. Саранск: изд-во Мордов. ун-та, 2002. 208 с.
Yoshida K., Terashima I., Noguchi K. Up-regulation of mitochondrial alternative oxidase concomitant with chloroplast over-reduction by excess light // Plant Cell Physiol. 2007. V. 48. P. 606–614.
Grabelnych O.I., Kolesnichenko A.V., Pobezhimova T.P., Tourchaninova V.V., Korzun A.M., Koroleva N.A., Zykova V.V., Voinikov V.K. The role of different plant seedling shoots mitochondrial uncoupling systems in thermogenesis during low-temperature stress // J. Thermal B-iol. 2003. V. 28. P. 571–580.
Atkin O.K., Zhang Q., Wiskich J.T. Effect of temperature on rates of alternative and cytochrome pathway respiration and their relationship with the redox poise of the quinine pool // Plant Physiol. 2002. V. 128. P. 212–222.
Боровик О.А., Грабельных О.И., Королева Н.А., Побежимова Т.П., Войников В.К. Связь между активностью альтернативного пути дыхания, содержанием сахаров и морозоустойчивостью озимой пшеницы // J. Stress Physiol. Biochem. 2013. V. 9. № 4. P. 242–250.
Трунова Т.И. 64-е Тимирязевское чтение. Растение и низкотемпературный стресс. 2007. М.: Наука, 54 с.
Марковская Е.Ф., Шерудило Е.Г., Галибина Н.А., Сысоева М.И. Роль углеводов в реакции теплолюбивых растений на кратковременные и длительные низкотемпературные воздействия // Физиология растений. 2010. Т. 57. С. 687–694.
Millenaar F.F., Lambers H. The alternative oxidase: in vivo regulation and function // Plant Biol. 2003. V. 5. P. 2–15.
Armstrong A.F., Badger M.R., Day D.A., Barthet M.M., Smith P.M.C., Millar A.H., Whelan J., Atkin O.W. Dynamic changes in the mitochondrial electron transport chain underpinning cold acclimation of leaf respiration // Plant, Cell and Environment. 2008. V. 31. P. 1156–1169.
Vanlerberghe G.C. Alternative oxidase: A mitochondrial respiratory pathway to maintain metabolic and signaling homeostasis during abiotic and biotic stress in plants // Int. J. Mol. Sci. 2013. V. 14. P. 6805–6847.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


