Физиология растений, 2020, T. 67, № 1, стр. 105-112
Вегетационная климатическая установка для изучения воздействия на высшие растения увеличенной по сравнению с атмосферной концентрации СО2
А. В. Малиновский a, Э. Н. Аканов b, П. Ю. Воронин a, *
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Федеральное государственное бюджетное учреждение науки Всероссийский институт удобрений
и агропочвоведения им. Д.Н. Прянишникова Российской академии наук
Москва, Россия
* E-mail: pavel@ippras.ru
Поступила в редакцию 14.12.2018
После доработки 01.02.2019
Принята к публикации 04.03.2019
Аннотация
Разработана экспериментальная вегетационная климатическая установка (ВКУ), состоящая из двух идентичных климатических камер: опытной (КК-1) и контрольной (КК-2). ВКУ позволяет длительное выращивание высших растений в различных константных условиях микроклимата, влагообеспеченности и концентрации СО2. Рассмотрена принципиальная схема ВКУ, ее параметры и работа. В результате длительного (50 суточного) вегетационного опыта в ВКУ оценили воздействие удвоенной атмосферной концентрации СО2 на СО2/Н2О-газообмен, водный статус листьев и биологическую продуктивность растений гороха. Водный статус листа растений опытного и контрольного вариантов оценивали по величине водного потенциала на поверхности апопласта подустьичной полости. По сравнению с контрольными растениями в условиях удвоенной концентрации СО2 отмечали 1.5 кратное увеличение листовой, стеблевой и корневой массы. Сохранение пропорционального роста органов в условиях выращивания при удвоенной концентрации атмосферной СО2 у контрастных по биологической продуктивности сортов гороха: высокопродуктивного сорта Альфа и малопродуктивного сорта Медовик – свидетельствовало об отсутствии сортовой специфики ростовой реакции гороха на повышенную СО2. Максимальный выход флуоресценции хлорофилла ФСII, фотосинтетический СО2/Н2О-газообмен интактных листьев, измеренные при обычной концентрации СО2, а также водный статус листьев был одинаков у растений опытного и контрольного вариантов сорта Медовик. Сделали вывод, что при прочих равных условиях при удвоенной концентрации СО2 в не лимитирующих по водному режиму и минеральному питанию условиях выращивания растения гороха формировали лист не отличающийся от листа, сформированного при обычной концентрации СО2. Увеличение биологической продуктивности гороха в этих условиях обеспечивали как увеличенная при повышенной атмосферной концентрации СО2 активность фотосинтетического карбоксилирования, так и формирование большей стеблевой и листовой фитомассы. В результате заключили, что реакция фотосинтетической и ростовой функций растений гороха на длительное выращивание в условиях удвоенной атмосферной концентрации СО2 и нелимитирующих по минеральному питанию и водоснабжению условиях не вызывает диспропорций роста и развития, т.е. находится в пределах физиологической нормы реакции растения гороха на стресс.
ВВЕДЕНИЕ
Увеличение концентрации СО2 атмосферы является одним из ведущих факторов современного быстрого изменения климата. В естественных условиях растение обычно встречается с комплексом неблагоприятных факторов. Поэтому оценка воздействия на растения удвоенной концентрации СО2 как сама по себе, так и на фоне какого-либо традиционного в современных условиях стрессового фактора представляет научный и практический интерес. Хорошо известно, что выращивание растений при повышенной концентрации СО2 приводит к увеличению продуктивности и выходу хозяйственно ценной части урожая [1; 2, c. 162; 3–6]. В закрытом грунте многочисленные и разнообразные углекислотные подкормки растений показали возможное увеличение урожая овощных культур на 15–20%. Для более глубокого понимания того, как повышение концентрации СО2 влияет на продукционный процесс в естественных условиях необходимо выращивание целых растений при различных концентрациях СО2. В этой связи нужны экспериментальные технические системы для моделирования стрессовых воздействий на фоне удвоенной концентрации СО2. Такие исследования связаны с необходимостью использования дорогостоящих вегетационных климатических камер, обеспечивающих не только заданные режимы внешней среды (свет, температура, влажность и т.д.), но и повышенную концентрацию углекислого газа. Однако серийные вегетационные климатические камеры с регулируемым газовым составом в России не производятся. Поэтому в данной работе ставили две цели. Во-первых, описать оригинальную вегетационную климатическую установку (ВКУ) собственной конструкции, обеспечивающую выращивание высших растений с полноценным фотосинтезом в контролируемой среде с заданной концентрацией углекислого газа в длительном вегетационном опыте. Во-вторых, проиллюстрировать процедуру проведения длительного вегетационного опыта в ВКУ на примере растений гороха как традиционного объекта физиологических исследований. В этой части работы была поставлена цель соотнести изменения ростовой и фотосинтетической функций, состояние устьичного аппарата листа гороха, сформированного при удвоенной атмосферной концентрации СО2, с физиологической нормой реакции растения на стресс.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал и условия выращивания растений. Семена гороха (Pisum sativum) низкопродуктивный сорт Медовик (ССК “Биотехника”, Россия) и высокопродуктивный сорт Альфа (ССК “Поиск”, Россия) обрабатывали слабым раствором перекиси водорода и замачивали на фильтровальной бумаге, смоченной дистиллированной водой и проращивали в термостате в течение трех суток при температуре 25°С. Проросшие семена высаживали по одному в пластиковые сосуды объемом 0.8 л. В каждой камере: опытной (КК-1) и контрольной (КК-2), размещали по 15 сосудов с растениями. Глубина посева семян составляла 3 см. Питательным субстратом выращивания служил готовый почвенный грунт производства ООО “ТорфАгроПром” (Россия), представляющий собой смесь верхового, низинного торфа и песка в объемном соотношении 1 : 1 : 0.5. Кислотность почвенного грунта составляла рН KCl 6.0–6.5. Содержание питательных веществ (мг/л): азот (Nобщ) 150–200, фосфор (P2O5) 150–200, калий (K2O) 200–250. Начальная влажность грунта 70% ПВ. В начале опыта первые 14 дней растения поливали водопроводной водой через день по 50 мл на сосуд. Далее, до конца опыта – ежедневно с контролем полива по весу. Минеральную подкормку растений проводили стандартным раствором Кнопа раз в десять дней. До появления всходов в климатических камерах круглосуточно поддерживали температуру 25 ± 0.5°С. С появлением всходов дневную температуру не меняли, а ночную уменьшили до 18 ± 0.5°С. Относительную влажность воздуха в камерах поддерживали в пределах 65–70%. В качестве источника света использовали дуговые натриевые зеркальные лампы Дназ/Рефлакс-400 (OOO “Рефлакс”, Россия). Освещенность растений в камерах поддерживали на уровне 200 мкмоль/(м2 с) ФАР с длительностью фотопериода 18 ч. Освещенность ФАР контролировали с помощью квантометра LI-190SA (“Li-Cor”, США).
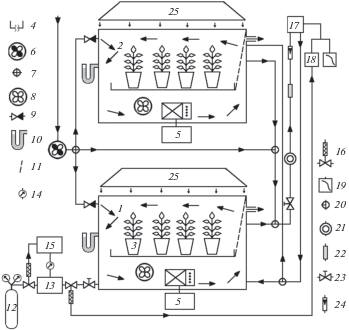
Вегетационная климатическая установка (ВКУ). Принципиальная схема ВКУ для выращивания растений при повышенной концентрации СО2 представлена на рис. 1. Как видно из рис. 1 опытные и контрольные растения гороха выращивали в конструкционно-идентичных климатических камерах с поддержанием в них одинаковых условий микроклимата, минерального питания, освещения и влагообеспеченности, кроме концентрации СО2 в воздухе. Так как в ВКУ использовали проточную схему регулирования газового режима, то через КК непрерывно продували атмосферный воздух. В качестве нагнетателя воздуха применяли канальный вентилятор ACF 100 (“ACFind”, Россия) с производительностью 300 м3/ч и поддержанием избыточного давления в трубопроводе 180 Па. Для уменьшения влияния колебаний концентрации СО2 в прокачиваемом воздухе его забор проводили на высоте 15 м. Объемную скорость протока воздуха через КК-1 и КК-2 круглосуточно в течение опыта поддерживали на постоянном уровне в 1.3 м3/ч. В климатических камерах создавали небольшое постоянное избыточное давление в 140 Па. Свободный внутренний объем каждой КК составлял 480 л. Воздух через каждую климатическую камеру продували с линейной скоростью потока 0.3 м/с. В течение всего опыта (50 суток) в опытной климатической камере КК-1 с помощью системы автоматического регулирования (САР) поддерживали удвоенную атмосферную концентрацию СО2. В контрольной камере КК-2 за счет непрерывного продува атмосферного воздуха поддерживали естественную концентрацию СО2.
Рис. 1.
Вегетационная климатическая установка для выращивания растений при повышенной концентрации СО2. 1 – опытная климатическая камера КК-1; 2 – контрольная климатическая камера КК-2; 3 – вегетационные сосуды; 4 – вегетационный поддон; 5 – блоки термовлагорегулирования; 6 – нагнетающий вентилятор; 7 – сочленение газовых линий; 8 – циркуляционные вентиляторы; 9 – шиберные краны регулировки протока воздуха; 10 – водяные манометры контроля давления в КК-1 и КК-2; 11 –рассеиватель воздушного потока; 12 – баллон СО2 c ручным редуктором давления; 13 – ресивер; 14 – электроконтактный манометр; 15 – блок реле; 16 – электромагнитные клапаны; 17 – ИК-газоанализатор; 18 – регулирующий двухпозиционный индукционный регулятор; 19 – самопишущий потенциометр; 20 – тройниковый кран для переключения газовых линий; 21 – компрессор; 22 – осушитель паров воды; 23 – вентиль тонкой регулировки СО2; 24 – контрольный ротаметр; 25 – источники освещения.
Определение листовой, стеблевой и корневой массы растений. Сухую массу каждой из фракций надземной и подземной массы каждого отдельного растения определяли на аналитических весах Scout Pro Balance (“Ohaus Corp.”, Китай) с точностью 0.1 мг после высушивания образцов до постоянного веса при 70°С в сушильном шкафу ED (“Binder GmbH”, Германия).
Стационарный фотосинтетический СО2/Н2О-газообмен интактных листьев гороха в листовой камере-прищепке определяли с помощью ИК газоанализатора (LI-820, “Li-Cor”, США) в открытой проточной системе при атмосферной концентрации СО2 и освещенности ФАР 200 мкмоль/(м2 с) [7]. Для этого неотделенный от растения лист помещали в листовую камеру-прищепку при комнатной температуре и освещали оптоволоконным световодом от осветителя (KL 1500 LCD, “Shott”, Германия) с галогеновой лампой (150 Вт, “Philips”, Нидерланды). Лист адаптировали к условиям листовой камеры-прищепки в течение 15–20 минут до достижения стационарного режима фотосинтетического СО2-газообмена. Транспирацию листа рассчитывали на основании разности влажности газа на входе и выходе из листовой камеры. В опорном газовом потоке на входе в листовую камеру поддерживали постоянную влажность при 25°С с помощью увлажнителя LI-610 (“Li-Cor”, США). Для определения влажности воздуха на выходе из листовой камеры использовали психрометрический датчик (HMP50, “Vaisala Intercap”, Финляндия). Питающим газом служил атмосферный воздух, предварительно собранный в 30 литровом полиэтиленовом газгольдере. Расход газа (100 мл/мин) обеспечивал непрерывную работу установки в течение 5 ч. Смесительный узел газового тракта позволял стабильно поддерживать концентрацию СО2 в 380 ppm в воздушном потоке на входе в листовую камеру.
Определение водного потенциала на границе водной и газовой фаз апопласта на поверхности клеток мезофилла, выстилающих подустьичную полость. Согласно теории общего термодинамического взаимодействия статистической физики [8, с. 246, 275], зависимость равновесного давления водяного пара над поверхностью водного раствора от водного химического потенциала описывается формулой [9, с. 15]:
(1)
$е = {{e}_{{\text{o}}}}\exp \left( {{{\psi V} \mathord{\left/ {\vphantom {{\psi V} {\left( {RT} \right)}}} \right. \kern-0em} {\left( {RT} \right)}}} \right),$(2)
$\psi = {{(RT\ln ({e \mathord{\left/ {\vphantom {e {{{e}_{{\text{o}}}}}}} \right. \kern-0em} {{{e}_{{\text{o}}}}}}))} \mathord{\left/ {\vphantom {{(RT\ln ({e \mathord{\left/ {\vphantom {e {{{e}_{{\text{o}}}}}}} \right. \kern-0em} {{{e}_{{\text{o}}}}}}))} V}} \right. \kern-0em} V}.$Физическая размерность водного потенциала видна из формулы (1) и выражается в Дж/м3 или Па.
По определению, относительная влажность (RH) представлена формулой:
(3)
${\text{RH}} = \left( {{e \mathord{\left/ {\vphantom {e {{{e}_{{\text{o}}}}}}} \right. \kern-0em} {{{e}_{{\text{o}}}}}}} \right) \times 100\% ,$Значение влажности воздуха, при которой транспирация прекращается, получали линейной аппроксимацией экспериментально полученной зависимости транспирации от относительной влажности воздуха [10]. Применение формул (2) и (3) позволяет рассчитать значение водного потенциала, исходя из экспериментально определенных значений относительной влажности (RH) в подустьичной полости при данной температуре листа.
Сигнал флуоресценции хлорофилла возбуждали в листе и отводили от листа к флуориметру (PAM 101, “Walz”, Германия) при помощи гибкого оптоволоконного световода (Fiberoptics 101F, “Walz”, Германия) [7]. Полезный сигнал передавали на персональный компьютер через последовательный порт RS-232, используя аналого-цифровой преобразователь PDA-100 (“Walz”, Германия). Измерения проводили после адаптации листа к темноте в течение 20 мин. Основным измеряемым показателем был темновой максимальный квантовый выход флуоресценции ФСII (Fv/Fm) [11]. Расчет показателей проводили на основании текущего значения минимальной (F0) и максимальной (Fm) флуоресценции адаптированного к темноте листа по формуле:
(4)
${{{{F}_{{\text{v}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{v}}}}} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}} = {{({{F}_{{\text{m}}}} - {{F}_{0}})} \mathord{\left/ {\vphantom {{({{F}_{{\text{m}}}} - {{F}_{0}})} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}}.$Представлены средние данные измерений на трех сформированных листьях третьего сверху яруса растения гороха и стандартные ошибки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Вегетационная климатическая установка (ВКУ) как автоматическая система управления микроклиматом и концентрацией СО2
Проанализировав существующие схемы и типы климатических камер [12–20] мы выбрали проточную схему регулирования концентрации СО2. Принцип ее работы заключается в обеспечении постоянного протока воздуха через климатическую камеру (КК), измерении в нем текущего значения концентрации СО2 (Ст), сравнении его с заданным зачением (Сз) и сведению этого рассогласования между Ст и Сз к наименьшему значению.
Таким образом, алгоритм управления концентрацией СО2 в климатической камере можно записать
где Сз – заданная концентрация СО2, Ст – текущая концентрация СО2.Основные микроклиматические параметры камеры допускают регулировку. Температуру можно задавать в диапазоне 10 до 35 ± 0.5°С, относительную влажность воздуха от 40 до 95 ± 10%, интенсивность освещения – от 150 до 300 мкмоль/(м2 с) ФАР, концентрацию СО2 – от 350 до 1000 ppm.
Как видно из рис. 1, где обозначения компонент отмечены числами в скобках, ВКУ состоит из двух идентичных климатических камер (КК): опытной КК-1 (1) и контрольной КК-2 (2). Каждая КК представляет собой два разъемных герметичных короба, изготовленных из 8 мм прозрачного органического стекла (верхний и нижний короба КК).
Верхний и нижний короба герметизируются между собой самоклеющейся резиновой уплотнительной лентой и стягиваются струбцинами. Верхняя часть КК соединена тросами с уравновешивающими ее вес грузами и легко поднимается над нижней частью на 1 м. Геометрические размеры верхней и нижней части одинаковы. Их линейные размеры (ширина × высота × длина) составляют: 68 × 42 × 93 см. Растения могут выращиваться в отдельных сосудах с почвой (3), или в общем поддоне с питательным раствором (4). Размер поддона для вегетационных сосудов 48 × 86 см. Общий свободный внутренний воздушный объем КК-1 и КК-2 за вычетом расположенных внутри блоков термо- и влаго-регулирования, вентиляторов и вегетационных сосудов с почвой составляет 480 л. В нижней части КК размещены сплит системы термо-влаго-регулирования: внутренний (SH09ZW), внешний (SH09ZW8X) блоки (“Samsung Electronics”, Китай) и ультразвуковой увлажнитель Liiot LH5311N (“Cuckoo Electronics”, Китай), (5). Через КК непрерывно продувается атмосферный воздух с помощью приточного канального вентилятора ACF-100 (“ACFind”, Россия) (6). Скорость протока воздуха через КК-1 и КК-2 регулируется шиберными кранами (9). Величина избыточного давления в КК контролируется водяными манометрами (10). Выравнивание температурно-влажностных параметров в объеме КК осуществляется с помощью вентиляторов (8) и рассеивателя воздушного потока (11). Повышенная концентрация СО2 поддерживается только в опытной климатической камере (1). В контрольной климатической камере (2) за счет непрерывного продува атмосферным воздухом поддерживается естественная концентрация СО2. Регулирование концентрации СО2 в опытной КК-1 осуществляется двух уровневой системой автоматического регулирования СО2. Система автоматического регулирования первого уровня (САР-1) осуществляет стабилизацию давления в системе подачи СО2 и состоит из баллона со сжатым СО2 c ручным редуктором давления УР 6-6 (Россия) (12), ресивера (13), электро-контактного манометра ЭКМ-1У (Россия) (14), блока реле МКУ-48 (Россия) (15), управляющего электромагнитным клапаном (16) подачи СО2 из баллона в ресивер (13). САР-1 поддерживает стабильное избыточное давление в системе в диапазоне 190–200 Па. Система автоматического регулирования второго уровня (САР-2) поддерживает в опытной КК-1 заданную повышенную (800 ± 50 ppm) концентрацию СО2. САР-2 включает в себя блок измерения и управления концентрацией СО2: ИК-газоанализатор Infralit-5 (VEB Juncalor Dessau, Германия) (17), регулирующий прибор RS 2300-8/02 (VEB EAW, Германия) (18), самопишущий потенциометр КСП-4 (Россия) (19). Работа системы регулирования концентрации СО2 происходит в следующей последовательности: анализируемый СО2 в составе воздуха опытной КК-1 направляется в САР-2 через трехходовый кран (20) с помощью компрессорного насоса (21) и прокачивается им через поглотитель паров воды (22) в ИК-газоанализатор (17). Скорость протока воздуха через газоанализатор регулируют краном (23) и контролируют поплавковым ротаметром РС-3 (Россия) (24). Измеренная ИК-газоанализатором концентрация СО2 преобразуется в электрический сигнал, поступающий одновременно на самописец (19) и регулирующий прибор (18). Регулирующий прибор (18) сравнивает заданный и измеренный газоанализатором уровень электрических сигналов и в зависимости от их рассогласования в соответствии с алгоритмом управления (выражение 5) открывает или закрывает электромагнитный клапан (16) подающий в опытную КК-1 углекислый газ. Для тонкой регулировки подаваемого сжатого СО2 предназначен игольчатый вентиль (23). САР-2 поддерживает стабильную концентрацию СО2 в опытной КК-1 в диапазоне 800 ± 50 ppm. Освещенность растений обеспечивают лампы Дназ/Рефлакс-400 (ООО “Рефлакс”, Россия) (25).
Продукционные характеристики растений гороха, выращенных при повышенной атмосферной концентрации СО2
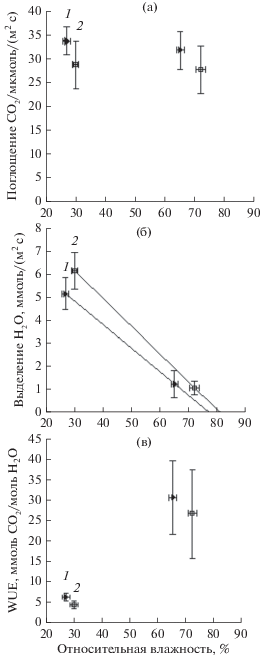
Биологическую продуктивность растений гороха оценивали по величине воздушно-сухой фитомассы надземной части и корневой системы. По массе органы опытных растений в 1.5 раза превосходили соответствующие органы растений контрольного варианта. Весовое соотношение между органами сохранялось в опытном варианте и не было сорто-специфичным (рис. 2). Поэтому в изучении влияния выращивания растений гороха при удвоенной концентрации СО2 в атмосфере на формирование фотосинтетического аппарата в данном опыте мы ограничились рассмотрением только одного низко-продуктивного сорта Медовик (рис. 3). При обычной концентрации СО2 в атмосфере значения максимального выхода флуоресценции хлорофилла ФСII листьев опытных растений не отличались от контрольного варианта (Fv/Fm = 0.78 ± 0.02), т.е. выращивание растений гороха при удвоенной концентрации СО2 не повлияло на эффективность фото-преобразующих процессов фотосинтеза листьев. Также, измерение при обычной концентрации СО2 фотосинтетического СО2/Н2О газообмена листьев опытных растений не выявило их отличий от контрольных растений (рис. 4а, б). Реакция устьичного аппарата листьев растений на выращивание при повышенной концентрации СО2 представляла особый интерес, поскольку именно через устьица происходит обмен газами и парами воды с окружающей средой. Здесь тесно связаны два процесса: обеспечение субстратом (СО2) процесса фотосинтеза и испарение воды листом в процессе транспирации. У разных видов растений влияние повышенной концентрации СО2 в атмосфере на формирование устьичного аппарата, его проводимость заметно различается. У некоторых видов С3 растений при хорошем водоснабжении реакция устьиц на увеличение концентрации СО2 слаба или отсутствует вовсе [21]. В зависимости от водообеспеченности растения на устьичную проводимость может влиять относительная влажность воздуха. Отношение поглощенного при фотосинтезе СО2 к потере воды при транспирации (WUE) является мерой эффективности использования растением воды при фотосинтезе. Увеличение WUE при увеличении относительной влажности воздуха представляет собой следствие снижения транспирации при поддержании фотосинтетической ассимиляции СО2 на прежнем уровне (рис. 4в). В этой связи следует осмотрительно подходить к сравнению значений WUE из разных источников. Влажность воздуха вокруг листа при измерении фотосинтетического СО2/Н2О газообмена может значительно различаться в разных экспериментальных моделях и тем самым вносить свой существенный вклад в эффект действия других факторов.
Рис. 2.
Продукционные характеристики растений гороха сортов Медовик (а) и Альфа (б), выращенных при обычной (1) и удвоенной (2) атмосферной концентрации СО2. Достоверные различия (Р < 0.05) между вариантами опыта отмечены разными латинскими буквами.
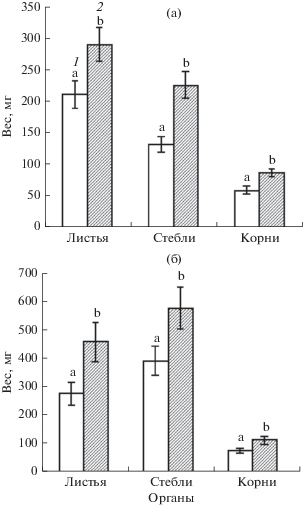
Рис. 3.
Внешний вид растений гороха сорта Медовик, выращенных в вегетационной климатической камере. Представлена линейка делением шкалы в 5 см.

Рис. 4.
Зависимость фотосинтетического СО2/Н2О газообмена листа гороха сорта Медовик от относительной влажности воздуха вокруг листа. Растения гороха, выращенные при обычной (1) и при удвоенной концентрации СO2 в атмосфере (2). (а) фотосинтетический СО2 газообмен листа, (б) транспирация листа на свету, (в) эффективность использования воды на транспирацию в процессе фотосинтеза листа (WUE). Измерения проводили при обычной концентрации атмосферного СО2.
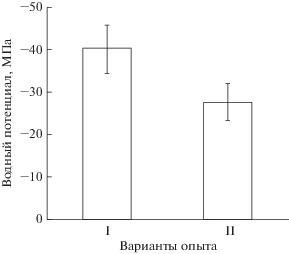
Выращивание растений при повышенной концентрации СО2 в условиях несбалансированного минерального питания и/или водоснабжения влияет не только на интенсивность фотосинтеза, но и на другие стороны функциональной активности фотосинтетического аппарата. Так известно, что у листьев растений березы, сформированных при удвоенной концентрации СО2 в атмосфере на фоне дефицита минерального азота формируется меньшая на единицу площади плотность устьиц [22], а значит снижаются потери воды листом на транспирацию. Тем не менее, в наших опытах при нормальном водоснабжении растений гороха в отношении водного потенциала апопласта на поверхности мезофилла подустьчной полости не было выявлено существенных различий между опытным и контрольным вариантами (рис. 5). Таким образом, увеличение биологической продуктивности гороха в опыте обеспечили как увеличенная за счет удвоения концентрации СО2 активность фотосинтетического карбоксилирования, так и сформированная большая стеблевая и листовая фитомасса у растений опытного варианта.
Рис. 5.
Водный потенциал на поверхности клеток мезофилла в подустьичной полости листа гороха. I – растения, выращенные при обычной концентрации СО2; II – растения выращенные при удвоенной концентрации СО2 в атмосфере.
В результате сделали вывод, что у растений гороха реакция фотосинтетической и ростовой функций на длительное выращивание в условиях удвоенной атмосферной концентрации СО2 не вызывает диспропорций роста и развития, в листе сформирован полноценный фотосинтетический аппарат. В этих условиях у гороха в ходе выращивания при удвоенной концентрации СО2 фотосинтез устанавливается на уровне адекватном запросу со стороны акцепторных элементов растения, т.е. в пределах физиологической нормы реакции растения на удвоенную концентрацию СО2.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Gifford R.M. Growth pattern, carbon dioxide exchange and dry weight distribution in wheat growing under differing photosynthetic environments // Austral. J. Plant Physiol. 1977. V. 4. P. 99.
Мокроносов А.Т. Онтогенетический аспект фотосинтеза. Москва: Наука, 1981. 194 с.
Kramer P.J. Carbon dioxide concentration, photosynthesis, and dry matter production // BioScience. 1981. V. 31. P. 29.
Oberbauer S.F., Sionit N., Hastings S.J., Oechel W.C. Effects of CO2 enrichments and nutrition on growth, photosynthesis and nutrient concentration of Alaskan tundra plant species // Can. J. Bot. 1986. V. 64. P. 2993.
Garbutt K., Williams W., Bazzaz F.A. Analysis of the differential response of five annuals to elevated CO2 during growth // Ecology. 1990. V. 71. P. 1185.
Drake B.G., Leadley P.W. Canopy photosynthesis of crops and native plant communities exposed to long-term elevated CO2 // Plant, Cell and Environ. 1991. V. 14. P. 853.
Воронин П.Ю. Установка для измерения флуоресценции хлорофилла, СО2-газообмена и транспирации отделенного листа // Физиология растений. 2014. Т. 61. С. 291.
Рейф Ф. Статистическая физика: Учебное руководство. 3-е изд. Москва: Наука, 1986. 336 с. (Reif F. Fundamentals of Statistical and Thermal Physics. New York: McGraw-Hill Book Co., 1965)
Лайск А.Х. Кинетика фотосинтеза и фотодыхания С3-растений. Москва: Наука, 1977. 194 с.
Воронин П.Ю., Рахманкулова З.Ф., Шуйская Е.В., Маевская С.Н., Николаева М.К., Максимов А.П., Максимов Т.Х., Мясоедов Н.А., Балнокин Ю.В., Рымарь В.П., Валдайских В.В., Кузнецов Вл.В. Новый метод количественного определения водного потенциала апопласта клеток мезофилла в подустьичной полости листа // Физиология растений. 2017. Т. 64. С. 235.
Shreiber U. Chlorophyll fluorescence and photosynthetic energy conversion: Simple introductory experiments with teacing-pam Chlorophyll Fluorimeter. Effeltrich: Heinz Walz GmbH, 1997. 73 p.
Лаптев В.В., Ниловская Н.Т. Герметическая установка для изучения газообмена // С.-х. биология. 1968. Т. 3. С. 892.
Ревут И.Б., Абросимова Л.И., Сергеев В.В., Кирьян Г.В. Климатическая фитокамера с регулируемым газовым составом // Исследование процессов обмена энергией и веществом в системе почва-растение-воздух. Ленинград: Наука, 1972. С. 130.
Барышнев Ю.П., Беспрозванный Р.Л., Захарин М.И., Привин М.Р. Отечественные климатические установки для селекционных целей // Доклады ВАСХНИЛ. 1975. № 1. С. 39.
Барышнев Ю.П., Беспрозванный Р.Л., Привин М.Р. Вегетационные климатические установки зарубежных фирм // Сборник трудов по агрономической физике. Агрофизический НИИ. 1976. Вып. 38. С. 144.
Каролин А.Ю., Молдау Х.А. Факторостатная камера с регистрацией транспирации и СО2 газообмена высших надземных растений // Физиология растений. 1976. Т. 23. С. 630.
Аканов Э.Н. Регулирование газового состава и измерение газообмена в камере с помощью автоматической системы // Физиология растений. 1981. Т. 28. С. 223.
Храпов В.Б., Бохан Н.И. Вегетационно-климатические камеры для оснащения селекционных комплексов и фитотронов // Сборник научных трудов Белорусской сельскохозяйственной академии. 1982. Вып. 88. С. 31.
Горшко В.В., Обринский Л.Е., Розенберг А.М. Установка для изучения фотосинтеза, дыхания и транспирации целых растений в регулируемых условиях среды // Физиология и биохимия культурных растений. 1983. Т. 15. С. 392.
Сапрыкин Л.Г., Гайдуков Е.Н., Сапрыкин Д.Л. Патент РФ 134744, 2013.
Farquhar G.D., Sharkey T.D. Stomatal conductance and photosynthesis // Ann. Rev. Plant Physiol. 1982. Vol. 33. P. 317.
Мао Ц.-Ж., Ванг Я.-Ж., Ванг С.-В., Воронин П.Ю. Морфотропный эффект удвоенной концентрации СО2 в воздухе: подавление образования устьиц у растущих листьев березы (Betula platyphylla Suk.) // Физиология растений. 2005. Т. 52. С. 198.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


