Физиология растений, 2020, T. 67, № 2, стр. 206-213
Молекулярно-биохимические аспекты световой регуляции 2-оксоглутаратдегидрогеназы в растениях
А. Т. Епринцев a, *, Д. Н. Федорин a, Г. Б. Анохина a, А. В. Седых a
a Федеральное государственное бюджетное образовательное учреждение высшего образования
“Воронежский государственный университет”
Воронеж, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 12.03.2019
После доработки 14.06.2019
Принята к публикации 17.06.2019
Аннотация
Исследовали молекулярные и эпигенетические механизмы регуляции ключевого фермента ЦТК 2‑оксоглутаратдегидрогеназы (2-ОГДГ) в реакции клеточного метаболизма растений на изменение светового режима. Показано, что в листьях кукурузы (Zea mays L.) активность 2-ОГДГ зависит от условий освещения. В темноте ускоряется функционирование исследуемого фермента, обуславливающее, по-видимому, активацию окислительных процессов в митохондриях. В растениях арабидопсиса (Arabidopsis thaliana L.), дефицитных по генам фоторецепторов, выявлено, что механизм светового ингибирования активности 2-ОГДГ, так же, как и в листьях кукурузы, опосредован через восприятие красного света фитохромом А и синего света криптохромом. Уровень транскриптов генов ogdh-1, ogdh-2, ogdh-3, кодирующих пептиды этого ферментного комплекса, снижался на свету и при облучении красным светом в растениях кукурузы, такое же снижение отмечено для генов ogdh-1, ogdh-2 арабидопсиса дикого типа. При этом исследование растений арабидопсиса, дефицитных по генам фоторецепторов, показало, что исследуемые гены подвержены фитохром- и криптохром-зависимой регуляции. Изменение степени метилирования СpG-островков промоторных областей генов ogdh-1, ogdh-2, ogdh-3 в различных условиях освещения позволяет заключить, что метильный статус существенно не влияет на транскрипцию исследуемых генов.
ВВЕДЕНИЕ
В митохондриях 2-оксоглутаратдегидрогеназный комплекс (2-ОГДК), представляющий собой сложную мультиферментную систему, является не только “поставщиком” сукцинил-СоА и НАДН для клеточного метаболизма, но и регулирует скорость дыхания у растений [1]. Помимо углеводного обмена, этот мультиферментный комплекс непосредственно обеспечивает процесс ассимиляции азота в растительных организмах [1, 2]. Недавние исследования показали, что 2-ОГДК локализован не только в митохондриях, как считалось ранее, а также и в ядре, где он участвует в процессе сукцинилирования ДНК [3].
Установлено, что 2-ОГДК подвергается временному стресс-опосредованному торможению [4]. Рядом исследований показано, что в растительных организмах свет подавляет работу цикла трикарбоновых кислот (ЦТК), хотя и не полностью, что подтверждается рядом исследований [5, 6]. Ранее были получены данные, посвященные роли света в функционировании 2-ОГДК, указывающие, что на свету он ингибируется [7]. Тем более, большой интерес вызывает изучение механизмов регуляции экспрессии генов 2-ОГДК в растениях при смене светового режима.
2-оксоглутаратдегидрогеназа (2-ОГДГ, КФ 1.2.4.2) – фермент класса оксидоредуктаз, первый компонент 2-ОГДК, который представляет собой гомодимер и катализирует самую медленную реакцию ЦТК, регулируя тем самым работу всего комплекса [8]. В геноме кукурузы этот фермент кодируют три гена: ogdh-1 (LOC100383579), ogdh-2 (LOC103639200) и ogdh-3 (LOC100383847), а в геноме арабидопсиса – два: ogdh-1 (AT3G55410) и ogdh-2 (AT5G65750). Регуляция этого фермента определяет интенсивность функционирования не только ЦТК, но и всего энергетического метаболизма растительной клетки в различных условиях светового режима. Ранее нами были установлены эпигенетические механизмы световой регуляции важнейших изоферментов цитратсинтазы, сукцинатдегидрогеназы и фумаратгидратазы в листьях растений. При этом было выявлено, что степень метилирования соответствующих генов определяет снижение активности ферментов и экспрессии этих генов [9–11].
Цель работы – исследование экспрессионных и эпигенетических аспектов регуляции 2-ОГДГ как ключевого фермента 2-ОГДК в адаптивной реакции растений при изменении светового режима.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использовали 14-дневные листья растений кукурузы (Zea mays L.) сорта Воронежская 76, выращенных гидропонным способом при 10-часовом световом дне с интенсивностью света 25 Вт/м2, а также 24-дневные проростки Arabidopsis thaliana L., выращенные при 12-часовом световом дне с интенсивностью света 25 Вт/м2 (климатическая камера “LabTech”, Корея). В работе использовали семена четырех линий A. thaliana: дикого типа (Col-0) и нокаутных по генам фоторецепторов: фитохрома А (phya-201), фитохрома В (phyb-1), криптохрома (cry-4) (Институт М. Планка, Гольм, Германия). Температура выращивания растений составляла 25°С.
Растения экспонировали 12 часов на белом свету (вариант “свет”). Для создания разных условий светового режима растения помещали в темную камеру на 24 часа (вариант “темнота”) после 12-часового светового дня, после чего облучали красным (вариант “КС”), и/или дальним красным (вариант “ДКС” и “КС + ДКС”), синим (вариант “СС”) светом в течение 15 минут, используя соответственно светодиоды 640–680 нм (КИПД40М40-К-П6, Россия) для облучения красным светом, 710–750 нм (3Л127А-5-5, Россия) для облучения дальнем красным светом и 465–470 нм (КИПД40М30-С1-7, Россия) для облучения синим светом. Интенсивность света составляла 0.044 Вт/м2. Пробы для анализа отбирали через каждые три часа инкубации в темноте с момента облучения.
Для выделения митохондриальной фракции навеску листьев кукурузы 5 г растирали в фарфоровой ступке со средой выделения: 0.15 М калий-фосфатный буфер (pH 7.4), 0.4 М сахароза, 2.5 мМ ЭДТА, 1 мМ хлорид калия, 4 мМ хлорид магния, 0.05% Тритон Х-100 в соотношении 1 : 10. Гомогенат фильтровали и центрифугировали 3 мин при 3000 g на центрифуге Еppendorf Centrifuge 5804 R (“Еppendorf”, Германия). Супернатант центрифугировали 10 минут при 18000 g. Полученный осадок растворяли в среде ресуспендирования: 0.15 М калий-фосфатный буфер (pH 7.4), 0.2 мМ тиаминдифосфат, 0.25 М сахароза. Выделенную фракцию митохондрий разрушали осмотическим шоком в среде, содержащей 0.15 М калий-фосфатный буфер (pH 7.4), 0.2 мМ тиаминдифосфат. Степень разрушения митохондрий была более 90%, что контролировали методом микроскопии на Olympus CX41RF (“Olympus”, Япония). Полученную фракцию митохондрий использовали для определения активности 2-ОГДГ. Все манипуляции проводили при температуре 4°С.
Активность 2-ОГДГ определяли спектрофометрически по скорости образования НАДН в реакционной смеси следующего состава: 0.1 М калий – фосфатный буфер (pH 7.5), 0.05% Тритон X-100, 0.5 мМ MgCl2, 2 мМ НАД+, 0.12 мМ литий-CoA, 0.2 мМ тиаминдифосфата, 2.5 мМ Cys-HCl, 1 мМ AMФ, 1 мМ 2-оксоглутарат калия, 5 Е липоамиддегидрогеназы (“Sigma”, США) [1, 12]. В контроле использовали среду без 2-оксоглутарата калия.
Общее количество белка определяли методом Lowry с соавт. [13].
Суммарный экстракт РНК из растений выделяли фенол-хлороформным методом [14]. Обратную транскрипцию мРНК проводили с использованием обратной транскриптазы M-MuLV (“Евроген”, Россия). Подбор праймеров осуществляли на основе нуклеотидных последовательностей из GeneBank с помощью программы Primer-BLAST (табл. 1). Полимеразную цепную реакцию проводили на приборе LightCycler96 (“Roche”, Швеция) с красителем SybrGreen I (“Евроген”, Россия). Количество матрицы контролировали с помощью параллельной амплификации фактора элонгации ef-1α [15]. В качестве отрицательного контроля использовали суммарную РНК без этапа обратной транскрипции. Относительный уровень экспрессии исследуемых генов определяли с применением 2–ΔΔCt-метода [16].
Таблица 1.
Праймеры для ПЦР-амплификации генов 2-оксоглутаратдегидрогеназы
| Ген | Праймер | Нуклеотидная последовательность | Температура отжига, °С |
|---|---|---|---|
| ogdh-1 | Прямой | 5'-ATTCCAATGACCGTGACAGG-3' | 59 |
| Обратный | 5'-AAAAATCGGCGCATCCAATG-3' | ||
| ogdh-2 | Прямой | 5'-CAAAGCCAAACTGCTACTGC-3' | 61 |
| Обратный | 5'-TTTTCACTCCGATGTGGTGG-3' | ||
| оgdh-3 | Прямой | 5'-GAAGCCATGACTACTCTGCC-3' | 61 |
| Обратный | 5'-GCTCCGCATCTTGGTTCATA-3' |
ДНК выделяли с помощью набора ПРОБА – ГС (“ДНК-Tехнология”, Россия) согласно рекомендациям производителя. Пробу ДНК (2 мкг) денатурировали 0.3 М раствором NaOH и подвергали дезаминированию, используя 4.15 М раствор бисульфита и 0.2 М раствор гидрохинона при pH 5.0. Полученный образец обессоливали с помощью набора ПРОБА – ГС (“ДНК-Tехнология”, Россия). ДНК десульфонировали 0.3 М раствором NaOH с последующей нейтрализацией 10 М раствором ацетата аммония и 96% этанолом при pH 5.6 [17].
Праймеры для метил-специфической ПЦР подбирали с помощью программы MethPrimer (табл. 2), реакцию проводили на приборе “Терцик” (“ДНК-Технология”, Россия).
Таблица 2.
Праймеры для метил-специфичной ПЦР-амплификации генов ogdh-1, ogdh-2 и ogdh-3
| Ген | Положение исследуемого цитозина, нуклеотид | Название | Последовательность | Температура отжига, °С | |
|---|---|---|---|---|---|
| ogdh-1 | I | –144 | Прямой М | GTTTTATATTGTAAAAATTGATCGA | 52 |
| Обратный М | AATTTTCCCATCTAATTATCTCCGT | ||||
| Прямой U | GTTTTATATTGTAAAAATTGATTGA | 52 | |||
| Обратный U | AATTTTCCCATCTAATTATCTCCAT | ||||
| II | –190 | Прямой М | GTTTAGATTGGTTATGCGT | 52 | |
| Обратный М | AATTTTCCCATCTAATTATCTCCGT | ||||
| Прямой U | GTTTAGATTGGTTATGTGT | 52 | |||
| Обратный U | AATTTTCCCATCTAATTATCTCCAT | ||||
| III | –316 | Прямой М | TTTTTTGGATGATAGTTTTGGCGT | 52 | |
| Обратный М | AATTTTCCCATCTAATTATCTCCGT | ||||
| Прямой U | TTTTTTGGATGATAGTTTTGGTGT | 52 | |||
| Обратный U | AATTTTCCCATCTAATTATCTCCAT | ||||
| ogdh-2 | I | –244 | Прямой М | AAAAAATTATTATTGTAACGT | 55 |
| Обратный М | AGATATTCAAAAAATTTA | ||||
| Прямой U | AAAAAATTATTATTGTAATGT | 55 | |||
| Обратный U | AGATATTCAGAAAATTTA | ||||
| II | –381 | Прямой М | GTATATTGTAGGGAGCGG | 55 | |
| Обратный М | AGATATTCAAAAAATTTA | ||||
| Прямой U | GTACATTGTAGGGAGTGG | 55 | |||
| Обратный U | AGATATTCAGAAAATTTA | ||||
| III | –464 | Прямой М | TGGTAGATTAGTTGGTCGG | 55 | |
| Обратный М | AGATATTCAAAAAATTTA | ||||
| Прямой U | TGGTAGATTAGTTGGTTGG | 55 | |||
| Обратный U | AGATATTCAGAAAATTTA | ||||
| ogdh-3 | I | –197 | Прямой М | TGTTATGGGAAGAAATCGC | 51 |
| Обратный М | CCCTACACAAAAACAAAAA | ||||
| Прямой U | TGTTATGGGAAGAAATTGC | 51 | |||
| Обратный U | CCCTGCACAAAAACAAAAA | ||||
| II | –275 | Прямой М | TTTTAGTGTTTTGTACGG | 51 | |
| Обратный М | CCCTACACAAAAACAAAAA | ||||
| Прямой U | TTTTAGTGTTTTGTATGG | 51 | |||
| Обратный U | CCCTGCACAAAAACAAAAA | ||||
| III | –297 | Прямой М | GTGCGTAATTGTTCGA | 49 | |
| Обратный М | CCCTACACAAAAACAAAAA | ||||
| Прямой U | GTGTGTAATTGTTTGA | 49 | |||
| Обратный U | CCCTGCACAAAAACAAAAA | ||||
Опыты проводили в 3–4-кратной повторности, аналитические определения для каждой пробы осуществляли в трех повторностях. Предварительная оценка характера распределения проводилась по асимметрии и эксцессу (Excel, Microsoft Office), а также с помощью критерия Колмогорова-Смирнова. Полученные значения позволили оценить характер распределения как нормальный. Критерий Стьюдента использовался с применением поправки на множественные сравнения (поправка Бонферрони) [18]. Дополнительно применялся однофакторный дисперсионный анализ ANOVA, который показал, что исследуемый в работе фактор действительно оказывал влияние (влияние фактора достоверно при P < 0.05).
РЕЗУЛЬТАТЫ
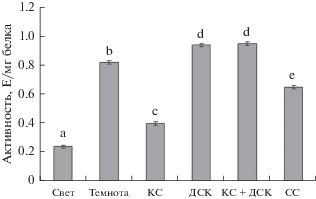
Исследования показали, что в листьях растений кукурузы, находившихся на свету, активность 2-ОГДГ составила 0.24 Е/мг белка, а в темноте была в 3.4 раза выше – 0.82 Е/мг белка (рис. 1). После облучения растений красным светом с длиной волны 660 нм эта активность снижалась в 2 раза относительно растений, находящихся в темноте. Однако облучение листьев кукурузы ДКС и КС + ДКС не изменяло работу ферментативной системы – активность 2-ОГДГ была близка к варианту “темнота”. Воздействие синего света на растения вызывало снижение активности 2-ОГДГ в 1.3 раза по сравнению с темновым вариантом.
Рис. 1.
Изменение общей ферментативной активности 2-ОГДК в листьях кукурузы при облучении светом с разными длинами волн. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; ДКС – растения, последовательно освещенные светом с длиной волны 730 нм; КС + ДКС – растения, последовательно освещенные светом с длиной волны 660 и 730 нм; С – растения, освещенные светом с длиной волны 465 нм. Продолжительность освещения – 15 мин. Разными буквами отмечены данные, достоверно различающиеся при P < 0.05.
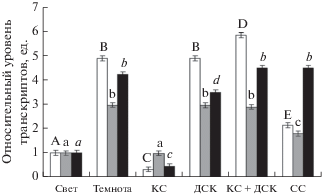
Относительный уровень транскриптов генов ogdh-1, ogdh-2 и ogdh-3 в растениях кукурузы при воздействии света различного спектрального состава в темноте был выше, чем на свету (рис. 2). Облучение растений кукурузы красным светом снижало уровень мРНК генов ogdh-1, ogdh-2 и ogdh-3 более чем в 4 раза, что свидетельствует об участии фитохромной системы в их регуляции. После воздействия ДКС и КС + ДКС наблюдали высокий уровень транскриптов исследуемых генов по сравнению с вариантом “свет” и КС. При исследовании влияния действия синего света на растения кукурузы установлено, что относительный уровень транскриптов генов ogdh-1 и ogdh-2 снижался по сравнению с этим показателем в растениях, находящихся в темноте. Уровень транскриптов гена ogdh-3 при облучении растений кукурузы синим светом не изменялся относительно варианта “темнота”.
Рис. 2.
Относительный уровень транскрипции генов ogdh-1 (белые столбцы), ogdh-2 (серые столбцы) и o-gdh-3 (черные столбцы) в листьях кукурузы в условиях разного светового режима. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; ДКС – растения, последовательно освещенные светом с длиной волны 730 нм; КС + ДКС – растения, последовательно освещенные светом с длиной волны 660 и 730 нм; СС – растения, освещенные светом с длиной волны 465 нм. Продолжительность освещения – 15 мин. Разными буквами отмечены данные, достоверно различающиеся при P < 0.05.
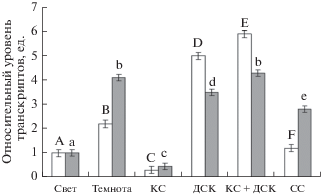
Для выяснения роли отдельных фоторецепторов в световой регуляции уровня транскриптов генов 2-ОГДГ были проведены исследования зависимости содержания их мРНК от светового режима в растениях арабидопсиса, нокаутных по генам соответствующих фоторецепторов. Было установлено, что оба гена ogdh-1 и ogdh-2, кодирующие 2-ОГДГ в геноме арабидопсиса, обнаруживают зависимость от условий светового режима, сходную с наблюдаемой у кукурузы. Относительный уровень транскриптов генов ogdh-1 и ogdh-2 в листьях арабидопсиса дикого типа был в 2–4 раза выше в темноте, чем при стандартном световом режиме (рис. 3). Облучение растений арабидопсиса КС приводило к снижению исследуемого показателя в 3.11 и 2 раза, соответственно, для генов ogdh-1 и ogdh-2. По сравнению с темнотой, воздействие ДКС и КС + ДКС увеличивало уровень транскриптов гена ogdh-1 в 2.3 и 2 раза, соответственно, в отличие от гена ogdh-2, уровень транскриптов которого изменялся незначительно. Следует отметить, что синий свет вызывал значительное снижение транскрипции генов o-gdh-1 и ogdh-2.
Рис. 3.
Относительный уровень транскриптов генов ogdh-1 (белые столбцы) и ogdh-2 (серые столбцы) 2‑ОГДГ в листьях арабидопсиса дикого типа в условиях различного светового режима. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; ДКС – растения, последовательно освещенные светом с длиной волны 730 нм; КС + ДКС – растения, последовательно освещенные светом с длиной волны 660 и 730 нм; СС – растения, освещенные светом с длиной волны 465 нм. Продолжительность освещения – 15 мин. Разными буквами отмечены данные, достоверно различающиеся при P < 0.05.
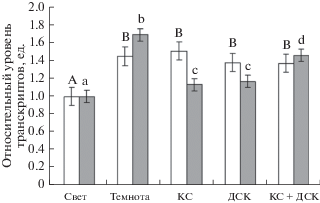
В темноте относительный уровень транскриптов генов ogdh-1 и ogdh-2 в растениях арабидопсиса, дефицитных по гену фитохрома А, увеличивался в 1.4 и 1.7 раз, соответственно, по сравнению со световым вариантом. При этом воздействие света различной длины волны вызывало снижение уровня транскриптов гена ogdh-2, однако этот уровень был выше, чем в варианте “свет” (рис. 4)
Рис. 4.
Относительный уровень транскриптов гена o-gdh-1 (белые столбцы) и ogdh-2 (серые столбцы) в листьях арабидопсиса, нокаутного по гену фитохрома А, в условиях различного освещения. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; ДКС – растения, последовательно освещенные светом с длиной волны 730 нм; КС + ДКС – растения, последовательно освещенные светом с длиной волны 660 и 730 нм. Разными буквами отмечены данные, достоверно различающиеся при P < 0.05.
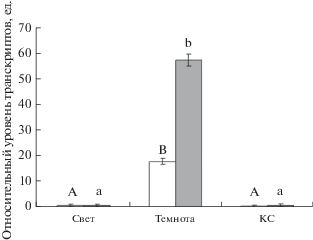
Анализ уровня транскриптов генов ogdh-1 и ogdh-2 арабидопсиса, дефицитного по гену фитохрома B, в условиях различного освещения показал, что экспозиция растений в темноте приводила к активации исследуемых генов (рис. 5). Относительный уровень транскриптов генов ogdh-1 и ogdh-2 в листьях арабидопсиса увеличился почти в 2 раза в сравнении со значениями этого показателя, установленными для растений, экспонирующихся на свету. Облучение мутантных по гену фитохрома В растений арабидопсиса КС приводило к снижению исследуемого показателя в 20 и 7.7 раз, соответственно, для генов ogdh-1 и ogdh-2. Исследование величины содержания мРНК генов 2-ОГДГ в растениях арабидопсиса, нокаутных по гену cry-4, показало, что оба гена ogdh-1 и ogdh-2 являются криптохром-зависимыми. При облучении растений СС наблюдалось снижение уровня транскриптов этих генов в 26 и 62 раза, соответственно (рис. 6). Проведенный анализ промоторов этих генов кукурузы позволил установить, что в промоторной области генов ogdh-2 и ogdh-3 обнаружены CpG-островки, тогда как у гена ogdh-1 их нет.
Рис. 5.
Относительный уровень транскриптов гена o-gdh-1 (белые столбцы) и ogdh-2 (серые столбцы) в листьях арабидопсиса, нокаутного по гену фитохрома B, в условиях различного освещения. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; ДКС – растения, последовательно освещенные светом с длиной волны 730 нм; КС + ДКС – растения, последовательно освещенные светом с длиной волны 660 и 730 нм; СС – растения, освещенные светом с длиной волны 465 нм. Продолжительность освещения – 15 мин. Разными буквами отмечены данные, достоверно различающиеся при Р < 0.05.
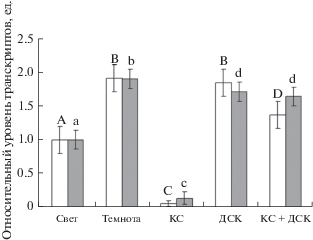
Рис. 6.
Относительный уровень транскриптов генов ogdh-1 (белые столбцы) и ogdh-2 (серые столбцы) 2‑ОГДГ в листьях арабидопсиса, нокаутных по гену cry-4, в условиях различного светового режима. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; СС – растения, освещенные светом с длиной волны 465 нм. Разными буквами отмечены данные, достоверно различающиеся при Р < 0.05.
Исследование метильного статуса отдельных CG-динуклеотидов промотора гена ogdh-1 в листьях кукурузы в различных световых режимах выявило, что уровень метилирования промотора менялся от 50 до 75% (табл. 3), однако, эти изменения не были связаны с уровнем транскриптов данного гена (рис. 3). Результаты анализа метильного статуса промотора гена ogdh-2 при смене светового режима указывают, что статус метилирования исследованных CpG-динуклеотидов составлял 50% и оставался практически неизменным во всех вариантах светового режима. Исследование влияния светового режима на степень метилирования CpG-динуклеотидов промоторной области гена ogdh-3 свидетельствует, что в исследуемых образцах степень метилирования не изменялась. Анализ полученных данных показал, что в исследуемых условиях степень метилирования составляет 25%.
Таблица 3.
Результаты метил-специфичной ПЦР CG-динуклеотидов промоторов генов 2-оксоглутаратдегидрогеназы в листьях кукурузы при разных условиях освещения
| Ген | Положение исследуемого цитозина, нуклеотид | Свет | Темнота | КС | ДКС | КС + ДКС | СС |
|---|---|---|---|---|---|---|---|
| ogdh-1 | –144 | + | ± | ± | + | + | + |
| –190 | ± | ± | ± | ± | ± | ± | |
| –316 | ± | ± | ± | ± | ± | ± | |
| % метилирования | 75 | 50 | 50 | 75 | 75 | 75 | |
| ogdh-2 | –244 | – | – | ± | – | – | – |
| –381 | ± | ± | ± | ± | ± | ± | |
| –464 | ± | ± | – | ± | ± | ± | |
| % метилирования | 25 | 25 | 25 | 25 | 25 | 25 | |
| оgdh-3 | –197 | ± | ± | ± | ± | ± | ± |
| –275 | ± | ± | ± | ± | ± | ± | |
| –297 | ± | ± | ± | ± | ± | ± | |
| % метилирования | 50 | 50 | 50 | 50 | 50 | 50 |
Примечание. Свет – растения, освещенные белым светом; Темнота – растения, выдержанные в темноте; КС – растения, освещенные светом с длиной волны 660 нм; ДКС – растения, последовательно освещенные светом с длиной волны 730 нм; КС + ДКС – растения, последовательно освещенные светом с длиной волны 660 нм и 730 нм; СС – растения, освещенные светом с длиной волны 465 нм. Продолжительность освещения – 15 мин.
ОБСУЖДЕНИЕ
Исследование влияния светового режима на активность 2-ОГДГ в листьях растений обнаружило, что на свету величина этого показателя резко снижалась. Аналогичные данные были получены ранее для ферментов ЦТК аконитатгидратазы, цитратсинтазы и сукцинатдегидроганазы, что свидетельствует о важной роли этого окислительного пути в энергообеспечении клеток в темноте [19, 20]. Известно, что АТФ в высоких концентрациях является ингибитором работы 2-ОГДГ и дыхательного метаболизма митохондрии в целом [21, 22].
Облучение листьев кукурузы красным светом снижало ферментативную активность 2-ОГДГ по сравнению с темновым контролем, что свидетельствует об участии фитохромной системы в регуляции этого фермента. Активная форма фитохрома снижала активность 2-ОГДГ более чем в 4 раза относительно варианта “темнота”. Снижение активности исследуемого фермента при облучении растений синим светом, вероятно, обусловлено опосредованным влиянием на 2-ОГДГ через систему криптохромов. Известно, что криптохромная система оказывает регулирующее действие на функционирование таких важнейших ферментов ЦТК, как фумаратгидратазы и сукцинатдегидрогеназы [23].
Результаты нашего исследования согласуются с полученными ранее данными об ингибировании 2-ОГДГ на свету, связанном с ремобилизацией 2‑оксоглутарата для синтеза глутамата в листьях на свету [8]. Кроме того, показано, что в этих условиях наблюдалось значительное увеличение содержания глутамата, аланина и γ-аминомасляной кислоты. Концентрации таких интермедиатов, как пируват, цитрат, изоцитрат и аконитат, как правило, возрастали, тогда как уровень фумарата и малата был снижен, что свидетельствовало о торможении 2-ОГДГ [8]. Вероятно, на свету ЦТК начинает работать нециклически [7, 24]. Сообщается об участии фитохрома в активации восстановительного ферментного комплекса цикла Кальвина [25]. Одним из опосредованных механизмов световой регуляции активности ферментов такими фоторецепторными системами растительной клетки, как фитохромы и криптохромы, является изменение экспрессии генетического аппарата клетки [26].
Исследование влияния света различных длин волн показало, что уровень транскриптов генов 2‑ОГДГ зависел от состояния фоторецепторных систем растительной клетки. Активная форма фитохрома снижала уровень транскриптов генов ogdh-1, ogdh-2 и ogdh-3 в листьях кукурузы относительно данного показателя в растениях, экспонируемых в темноте. Следует отметить, что последовательное облучение КС + ДКС снимало ингибирующее действие КС. Следовательно, фитохромная система является регулятором содержания транскриптов генов 2-ОГДГ в листьях кукурузы, причем активная форма фитохрома проявляет ингибирующий эффект. В растениях, облученных СС, также наблюдался более низкий уровень мРНК генов ogdh-1 и ogdh-2 по сравнению с темновым вариантом. Это может свидетельствовать о том, что криптохромная система также оказывает влияние на регуляцию работы данных генов.
Изучение растений арабидопсиса, нокаутных по генам фитохрома А, фитохрома В и криптохрома 4, позволило установить роль каждого из этих белков в световой регуляции функционирования 2-ОГДГ. Для арабидопсиса дикого типа показано, что характер уровня транскриптов всех исследуемых генов соотносился с таковым показателем в листьях кукурузы. Активная форма фитохрома и криптохрома вызывала ингибирование работы исследуемых генов. Также установлено, что КС не оказывал какого-либо существенного эффекта на работу генов ogdh-1 и ogdh-2 в листьях арабидопсиса, нокаутного по гену фитохрома А, что указывало на регуляцию экспрессии данных генов именно этим фоторецептором. Полученные данные позволяют предположить, что фитохром В не играет существенной роли в регуляции работы данного фермента.
Анализ относительного уровня транскриптов генов ogdh-1 и ogdh-2 2-ОГДГ в листьях арабидопсиса, дефицитных по гену cry-4, в условиях различного светового режима позволил установить, что регуляция работы генов 2-ОГДГ хотя и может осуществляться посредством криптохромной системы, однако не контролируется криптохромом 4. Свое действие фоторецепторные системы растений могут проявлять за счет специфических транскрипционных факторов [27], регулирующих работу промоторов генов [28]. Кроме того, была показана важная роль ионов кальция как вторичного мессенжера в регуляции генов [18]. Метилирование цитозина у растений наблюдается чаще всего в составе CpG-островков, которые обнаруживаются в 5'-регуляторных участках генов [29]. Исследование влияния светового режима на степень метилирования промоторных областей генов ogdh-1, ogdh-2 и ogdh-3 показало отсутствие изменения статуса метилирования промоторов генов ogdh-2 и ogdh-3. Вероятно, регуляция экспрессии генов обусловлена иными механизмами. Для гена ogdh-1 выявлено изменение метилирования анализируемых CG-динуклеотидов в составе его промотора, однако это изменение не соотносится с колебаниями содержания его мРНК в различных световых режимах.
Таким образом, установлено, что изменение относительного уровня транскриптов генов, кодирующих 2-ОГДГ в растениях в различных условиях светового режима, не связано с величиной статуса метилирования исследованных CG-динуклеотидов их промоторов. Полученные данные по анализу степени метилирования и уровня транскриптов генов 2-ОГДГ указывают на пассивную роль эпигенетического механизма в регуляции функционирования данного энзима.
Работа выполнена при финансовой поддержке гранта Российского научного фонда № 19-14-00150.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Araujo W.L., Nunes-Nesi A., Trenkamp S., Bunik V.I., Fernie A.R. Inhibition of 2-oxoglutarate dehydrogenase in potato tuber suggests the enzyme is limiting for respiration and confirms its importance in nitrogen assimilation // Plant Physiol. 2008. V. 148. P. 1782.
Vidal E.A., Gutierrez R.A. A system view of nitrogennutrient and metabolite responses in Arabidopsis // Curr. Opin. Plant Biol. 2008. V. 11. P. 521.
Wang Y., Guo Y.R., Liu K., Yin Z., Liu R., Xia Y., Tan L., Yang P., Lee J.H., Li X.J., Hawke D., Zheng Y., Qian X., Lyu J., He J., et al. KAT2A coupled with the alpha-KGDH complex acts as a histone H3 succinyltransferase // Nature. 2017. V. 552. P. 273.
Graf A., Trofimova L., Loshinskaja A., Mkrtchyan G., Strokina A., Lovat M., Tylicky A., Strumilo S., Bettendorff L., Bunik V.I. Up-regulation of 2-oxoglutarate dehydrogenase as a stress response // Int. J. Biochem. Cell Biol. 2013. V. 45. P. 175.
Попов В.Н., Епринцев А.Т., Федорин Д.Н. Световая регуляция экспрессии сукцинатдегидрогеназы в листьях Arabidopsis thaliana // Физиология растений. 2007. Т. 54. С. 409.
Igamberdiev A.U., Eprintsev A.T., Fedorin D.N., Popov V.N. Phytochrome-mediated regulation of plant respiration and photorespiration // Plant Cell Environ. 2014. V. 37. P. 290.
Araujo W.L., Tohge T., Nunes-Nesi A., Daloso D.M., Nimick M., Krahnert I., Bunik V.I., Moorhead G.B., Fernie A.R. Phosphonate analogs of 2 oxoglutarate perturb metabolism and gene expression in illuminated Arabidopsis leaves // Front. Plant Sci. 2012. V. 3. https://doi.org/10.3389/fpls.2012.00114
Frank R.A., Price A.J., Northrop F.D., Perham R.N., Luisi B.F. Crystal structure of the E1 component of the Escherichia coli 2-oxoglutarate dehydrogenase multienzyme complex // J. Mol. Biol. 2003. V. 68. P. 639.
Jonson M.K., Morningstar J.E., Bennet D.E. Magnetic circular clicloism studies of succinate dehydrogenase evidence for (2 Fe-2S), (3Fe-S) and (4 Fe-4S) in reconstitutively active enzyme // J. Biol. Chem. 1985. V. 260. P. 7368.
Eprintsev A.T., Fedorin D.N., Karabutova L.A., Igamberdiev A.U. Expression of genes encoding subunits A and B of succinate dehydrogenase in germinating maize seeds is regulated by methylation of their promoters // J. Plant Physiol. 2016. V. 205. P. 33.
Eprintsev A.T., Fedorin D.N., Dobychina M.A., Igamberdiev A.U. Regulation of expression of the mitochondrial and peroxisomal forms of citrate synthase in maize during germination and in response to light // Plant Sci. 2018. V. 272. P. 157.
Stanley C.J., Perham R.N. Purification of 2-oxo acid dehydrogenase multienzyme complexes from ox heart by a new method // Biochem. J. 1980. V. 191. P. 147.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the Folin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265.
Chomczynski P., Sacchi N. Single – step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction // Anal. Biochem. 1987. V. 162. P. 156.
Nicot N., Hausman J.F., Hoffmann L., Evers D. Housekeeping gene selection for real-time RT-PCR normalization in potato during biotic and abiotic stress // J. Exp. Bot. 2005. V. 56. P. 2907.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCt method // Methods. 2001. V. 25. P. 402.
Hsieh C.L. Evidence that protein binding specifies sites of DNA demethylation // Mol. Cell Biol. 1999. V. 19. P. 46.
Лакин Г.Ф. Биометрия. Москва: Высш. шк. 1990. 351 с.
Eprintsev A.T., Fedorin D.N., Igamberdiev A.U. Ca2+ is involved in phytochrome A-dependent regulation of the succinate dehydrogenase gene sdh1-2 in Arabidopsis // J. Plant Physiol. 2013. V. 170. P. 1349.
Fedorin D.N., Eprintsev A.T. Regulation of aconitate hydratase activity in Maize leaves with red and blue light // J. Stress Physiol. Biochem. 2017. V. 13. P. 121.
Strumilo S.A., Taranda N.I., Vinogradov V.V. Role of ATP in regulating the oxoglutarate dehydrogenase complex of the adrenal cortex // Vopr. Med. Khim. 1982. V. 28. P. 59.
Wedding R.T., Black M.K. Nucleotide activation of Cauliflower a-Ketoglutarate dehydrogenase // J. Biol. Chem. 1971. V. 246. P. 1638
Eprintsev A.T., Fedorin D.N., Cherkasskikh M.V., Igamberdiev A.U. Expression of succinate dehydrogenase and fumarase genes in maize leaves is mediated by cryptochrome // J. Plant Physiol. 2018. V. 221. P. 81.
Sweetlove L.J., Beard K.F., Nunes-Nesi A., Fernie A.R., Ratcliffe R.G. Not just a circle: flux modes in the plant TCA cycle // Trends Plant Sci. 2010. V. 15. P. 462.
Любимов В.Ю., Креславский В.Д. Фитохром-B-зависимая регуляция восстановительной фазы фотосинтетической ассимиляции углерода // Физиология растений. 2017. Т. 64. С. 383.
Kreslavski V.D., Fomina I.R., Los D.A., Carpentier R., Kuznetsov V.V., Allakhverdiev S.I. Red and near infra-red signaling: Hypothesis and perspectives // J. Photochem. Photobiol. C: Photochem. Rev. 2012. V. 13. P. 190.
Martínez-García J.F., Huq E., Quail P.H. Direct targeting of light signals to a promoter element-bound transcription factor // Science. 2000. V. 288. P. 859.
Kass S.U., Landsberger N., Wolffe A.P. DNA methylation directs a time-dependent repression of transcription initiation // Curr. Biol. 1997. V. 7. P. 157.
Antequera F., Bird A. Number of CpG islands and genes in human and mouse // PNAS USA. 1993. V. 90. P. 11995.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


