Физиология растений, 2021, T. 68, № 1, стр. 75-84
Оценка содержания витамина С и экспрессии гена ГДФ-L-галактозофосфорилазы (VTC2) у сортов лука-порея (Allium porrum L.)
О. К. Анисимова a, Т. М. Середин b, А. В. Щенникова a, Е. З. Кочиева a, М. А. Филюшин a, *
a Институт биоинженерии, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
b Федеральный научный центр овощеводства
143080 п. ВНИИССОК, Россия
* E-mail: michel7753@mail
Поступила в редакцию 24.04.2020
После доработки 14.05.2020
Принята к публикации 14.05.2020
Аннотация
У четырех сортов лука-порея (Allium porrum L.) определена последовательность кДНК гомологов гена VTC2, кодирующего ГДФ-L-галактозофосфорилазу – ключевой фермент L-галактозного пути биосинтеза аскорбиновой кислоты (АК). Определена вариабельность кДНК VTC2 и кодируемых ими ферментов у анализируемых сортов. Определены профили экспрессии гена VTC2 в корнях, донце, белой части и в листьях каждого сорта в период активного роста (август), сбора урожая (октябрь) и через два месяца хранения (декабрь). Обнаружено, что в корнях ген VTC2 экспрессируется сходным образом у всех исследуемых сортов, при этом максимальный уровень транскрипции приходится на октябрь. После двух месяцев хранения в анализируемых тканях лука-порея наблюдалось снижение уровней транскрипции VTC2. Было определено содержание АК в тканях сортов, которое положительно коррелировало с уровнем экспрессии VTC2 в зеленых листьях (r = 0.34), тогда как в белой части растений корреляция была отрицательной (r = −0.58). В ответ на холодовой стресс (+4°С) изменение уровня транскрипции VTC2 в зеленых листьях лука-порея наблюдалось только через 6 ч инкубации. В зеленых листьях лука-порея уровни экспрессии VTC2 и содержание АК через 24 ч были сопоставимы с исходными (0 ч) значениями и в нормальных условиях, и в ответ на холодовой стресс.
ВВЕДЕНИЕ
В процессе фотосинтеза, фотодыхания, а также при воздействии различных стрессовых факторов, таких как избыток ультрафиолетового излучения, засуха, экстремальные температуры, атаки патогенов и др., в клетках растений образуются активные формы кислорода (АФК), способные окислять компоненты мембран, приводить к деградации нуклеиновых кислот, белков и пигментов, что, в конечном итоге, вызывает гибель клеток [1]. Для предотвращения накопления АФК и минимизирования негативных последствий их перепроизводства, растительные клетки выработали сложную антиоксидантную систему. К ферментативной антиоксидантной системе относятся такие ферменты как супероксиддисмутаза (SOD; EC 1.15.1.1), каталаза (CAT; EC 1.11.1.6), глутатионредуктаза (GR; EC 1.6.4.2), аскорбатпероксидаза (APX; EC 1.11.1.11), монодегидроаскорбатредуктаза (MDHAR; EC 1.8.5.1) и дегидроаскорбатредуктаза (DHAR; EC 1.8.5.1) [1, 2]. К неферментативной антиоксидантной системе относятся каротиноиды, антоцианы, некоторые полифенолы, глутатион, а также витамины – α‑токоферол (витамин Е) и L-аскорбиновая кислота (АК, витамин С) [2]. Указанные антиоксиданты обнаружены почти во всех клеточных компартментах, что подчеркивает важность детоксикации АФК для выживания клеток [1].
L-аскорбиновая кислота – один из самых распространенных водорастворимых антиоксидантов растительных клеток. Помимо антиоксидантной функции, АК вовлечена в процессы клеточного роста и деления, а также является субстратом для синтеза других соединений и кофактором некоторых ферментов, вовлеченных, например, в пути биосинтеза каротиноидов и антоцианов [3, 4]. Несмотря на важность и разнообразие выполняемых функций, метаболические пути АК до недавнего времени оставались неизученными, а некоторые ферменты промежуточных этапов биосинтеза не определены до сих пор [4]. К настоящему времени описаны четыре основных пути биосинтеза АК – L-галактозный, L-гулозный, галактуроновый и мио-инозитоловый [4, 5]. L-галактозный путь (путь Смирнова-Уилера) считается доминирующим у растений [4]. Для этого пути определены все ферментативные стадии – в результате восьми последовательных реакций из D-фруктозы-6-Ф образуется L-аскорбиновая кислота [4, 6].
Ключевым ферментом L-галактозного пути является ГДФ-L-галактозофосфорилаза (EC 2.7.7.69), катализирующая превращения ГДФ-L-галактозы в L-галактоза-1-фосфат, который является первым соединением на пути биосинтеза АК [4, 7]. Для многих видов растений было показано, что увеличение экспрессии гена ГДФ-L-галактозофосфорилазы приводит к повышению АК в 1.4–6.0 раз, что сделало данный ген одной из мишеней в стратегиях по увеличению содержания АК в растениях [6]. Также, была выявлена положительная связь между увеличением экспрессии гена ГДФ-L-галактозофосфорилазы и толерантностью растения к абиотическим стрессам [8].
К настоящему времени последовательности генов, кодирующих ГДФ-L-галактозофосфорилазу, идентифицированы у многих видов растений. При этом геном некоторых растений, например, Arabidopsis thaliana, содержит два паралогичных гена VITAMIN C (VTC) 2 и VTC5, кодирующие изоформы данного фермента, которые совместно регулируют L-галактозный путь [9]. Было показано, что оба гена VTC2 и VTC5 экспрессируются в листьях, стеблях, корнях, цветках и стручках A. thaliana, однако уровень транскрипции VTC2 на 2–3 порядка выше, чем VTC5. Более того, содержание L-аскорбата в листьях растений с выключенной транскрипцией VTC5 не отличалось от такового у растений дикого типа [9]. Интересно также, что в ответ на окислительный стресс в клетках водоросли Chlamydomonas reinhardtii повышался уровень мРНК именно VTC2, что сопровождалось синтезом и накоплением L-аскорбата [10]. Очевидно, что из двух паралогов главная роль принадлежит VTC2, а VTC5, по-видимому, имеет вспомогательную функцию.
Среди овощных культур с высоким содержанием витамина С важное место занимают луковые культуры, в том числе, лук-порей (Allium porrum L.). Количество АК в зеленых листьях этого растения может достигать 8.5 мг/г сухой массы [11]. Отбеленная часть ложного стебля лука-порея (употребляемой в пищу) содержит значительно меньше витамина С, чем зеленые листья [11]. Несмотря на то, что лук-порей является перспективным объектом для селекции сортов с повышенным содержанием витамина С, ни у лука-порея, ни и у других видов Allium, гены биосинтеза аскорбиновой кислоты до сих пор не идентифицированы и не изучены.
Целью данной работы стала идентификация гена ГДФ-L-галактозофосфорилазы (VTC2) у лука-порея, определение профиля его экспрессии в различных частях растения в процессе вегетации и хранения, а также в ответ на холодовой стресс и дневное освещение, и оценка возможной корреляции уровня транскрипции VTC2 и содержания витамина С в зеленых листьях и отбеленной части ложного стебля лука-порея.
МАТЕРИАЛЫ И МЕТОДЫ
Для проведения работы были использованы четыре сорта лука-порея – Blauwgroene winter, Коламбус, Otina и Pandora. Растения были выращены в коллекционном питомнике Федерального научного центра овощеводства (ФНЦО). Для работы использовали растения, соответствующие трем временным точкам – август (активный рост), октябрь (уборка урожая) и декабрь (после двухмесячного периода хранения в овощехранилище при температуре 2°С и влажности 70%, без освещения). Собирали и замораживали (−80°С) образцы тканей корней, донца (видоизмененный стебель), листьев (фрагменты взрослых листьев в 10 см от белой части) и белой части (поперечный срез шириной 0.5 см отбеленного ложного стебля в 2 см от донца). Из данных образцов выделяли суммарную РНК, которую дополнительно очищали от примесей ДНК (наборы RNeasy Plant Mini Kit и RNase free DNasy set; “QIAGEN”, Германия) и использовали для синтеза кДНК (набор GoScriptтм Reverse Transcription System; “Promega”, США).
С целью разработки праймеров для амплификации гомологов гена VTC2 у лука-порея проводили поиск последовательностей, гомологичных VTC2, у видов Allium в базе транскриптомных данных NCBI_TSA (Transcriptome Shortgun Assembly) с помощью BLAST-N (https://blast.ncbi.nlm.nih.gov/). На основе выявленных транскриптов разрабатывали специфичные праймеры. Данные праймеры и препараты кДНК использовали для амплификации полноразмерных кодирующих последовательностей гомологов гена VTC2 у образцов A. porrum L. ПЦР-продукты ожидаемой длины очищали с помощью QIAEX® II Gel Extraction kit (“QIAGEN”, Германия) и секвенировали с использованием тех же праймеров на ABI Prism 3700 DNA Analyzer (“Applied Biosystems”, США). Анализ и выравнивание полученных нуклеотидных и аминокислотных последовательностей проводили с помощью программы MEGA 7.0 (https:// www.megasoftware.net/). Консервативные домены и мотивы в белках определяли с помощью программ NCBI-CDD (http://www.ncbi.nlm.nih.gov/ Structure/cdd/wrpsb.cgi). Влияние аминокислотных замен на структуру и функции белков предсказывали с помощью программы PROVEAN (http:// provean.jcvi.org/index.php).
Пространственно-временной профиль экспрессии гена VTC2 в корнях, донце, листьях и белой части исследуемых сортов лука-порея определяли методом ПЦР в реальном времени (РВ-ПЦР). На основе транскриптов, гомологичных VTC2, выявленных у видов Allium, разрабатывали специфичные праймеры для проведения РВ-ПЦР. Относительный уровень экспрессии VTC2 определяли по референсным генам GAPDH [12] и UBQ [13]. Для проведения РВ-ПЦР использовали набор “Реакционная смесь для проведения РВ-ПЦР в присутствии SYBR GreenI и ROX” (ООО “Синтол”, Россия) и амплификатор CFX96 Real-Time PCR Detection System (“Bio-Rad Laboratories”, США). В качестве матрицы использовали препарат кДНК каждого образца в количестве 3 нг. Реакции проводили в двух биологических и трех технических повторах в следующих условиях: 95°C – 5 мин; 40 циклов (95°C – 15 с, 62°C – 50 с).
Для определения содержания АК использовали набор “L-Ascorbic acid” (“R-Biopharm AG”, Германия). Статистическую обработку результатов РВ-ПЦР и биохимического анализа проводили с помощью программы GraphPad Prism v. 8 (https://www.graphpad.com).
Для симуляции холодового стресса, 60-дневные растения лука-порея сорта Коламбус помещали в климатическую камеру с регулируемыми условиями (день/ночь – 16/8 ч, 22/16°С, освещенность 190 ммоль/(м2 с)). Через 14 дней после такой инкубации собирали листовой материал (контрольная группа, в двух технических повторах) в четырех временных точках (0 – за 15 минут до включения света, затем через 2, 4, 6 и 24 часа). На следующий день за 15 минут до включения света в климатической камере меняли температуру (условия: день/ночь – 16/8 ч, температура 4°С, освещенность 190 ммоль/(м2 с). Ткани листьев (в двух технических повторах) подвергнутых стрессу растений отбирали через те же временные интервалы, что и образцы контрольной группы. При этом проба (0 ч) непосредственно отбиралась перед включением низкотемпературного режима. Собранный листовой материал использовали для выделения препаратов суммарной РНК (с последующим синтезом кДНК), исследования профиля экспрессии гена VTC2 (РВ-ПЦР) и биохимического анализа (определение содержания АК; протоколы см. выше).
РЕЗУЛЬТАТЫ
Для исследования были отобраны четыре сорта лука-порея – Blauwgroene winter, Коламбус, Otina и Pandora, которые по предварительным измерениям различались содержанием АК в белой части растений (44, 46, 31 и 59 мг/100 г сырой массы, соответственно), а также морфологией ложного стебля – тонкий у первых двух сортов (2–4 см), мощный и толстый (5–7 см) у двух последних.
Так как в базе данных NCBI отсутствуют какие-либо аннотированные у видов Allium последовательности, гомологичные VTC2, то с целью разработки праймеров для амплификации данного гена у лука-порея был проведен поиск гомологов VTC2 Asparagus officinalis (XM_020388507.1; ближайший родственный вид, геном которого полностью секвенирован и аннотирован) в базе транскриптомных данных (NCBI_TSA). Были выявлены гомологичные VTC2 транскрипты у видов Allium (A. ampeloprasum L. (GFAR01020967.1), A. cepa L. (GBGJ01076064.1) и A. sativum L. (GFAP01091649.1)). На основе их последовательностей были разработаны специфичные праймеры ApVTC2F (5'‑GTTCTCCTTCCGATTTGCT-3') и ApVTC2R (5'-ATTCCATARATACTGACTTCAG-3'). С их помощью были амплифицированы и секвенированы последовательности гомологов гена VTC2 анализируемых в работе сортов лука-порея. Для определения методом РВ-ПЦР уровней транскрипции гомолога гена VTC2 в различных органах лука-порея были разработаны специфичные праймеры rtVTC2F (5'-GGTGTCAAGCGTGTGTATCTG-3') и rtVTC2R (5'-TTCCCAAACAGCGGGATTGAC-3').
Длина полноразмерной кодирующей последовательности гомологов VTC2 у всех четырех анализируемых образцов лука-порея была инвариантна и составила 1275 п.н. Анализ вариабельности последовательностей гомологов VTC2 (в сравнении с VTC2 A. ampeloprasum) выявил 15 нуклеотидных замен (SNPs), наибольшее количество замен было идентифицировано у сорта Otina (10 SNPs).
Полученные нуклеотидные последовательности были транслированы. Сравнение полученных белков с последовательностями базы данных NCBI подтвердило их структурную гомологию с ферментом ГДФ-L-галактозофосфорилазой. Размер белка у всех исследуемых сортов лука-порея был инвариантен и составил 424 а.о. С помощью NCBI-CDD в последовательностях анализируемых белков VTC2 был выявлен консервативный домен ГДФ-L-галактозогексозо-1-фосфат-гуанилтрансферазы (PLN03103) в положении 1–393 а.о. Также, в анализируемых последовательностях белков был идентифицирован консервативный мотив HLHFQ (233–237 а.о.), являющийся каталитическим центром ГДФ-L-галактозофосфорилазы.
Обнаруженные в кДНК нуклеотидные замены приводили к пяти замещениям а.о. (P37A, S56C, A365P, R406S, A417S). Последовательности VTC2 у сортов Blauwgroene winter и Pandora были идентичны, тогда как VTC2 сортов Otina и Коламбус содержали одно (P37A) и четыре (S56C, A365P, R406S, A417S) замещения, соответственно. Анализ всех обнаруженных замещений в программе PROVEAN предсказал их нейтральный характер, что может свидетельствовать о консервативности каталитической функции идентифицированных ферментов VTC2 у сортов лука-порея.
Методом РВ-ПЦР был определен профиль экспрессии гена VTC2 в корнях, донце, белой части и листьях растений в фазе активного роста (август), сбора урожая (октябрь) и через два месяца хранения (декабрь) (рис. 1). Экспрессия гена VTC2 была выявлена во всех анализируемых органах сортов лука-порея. Для исследуемых сортов был характерен схожий профиль экспрессии VTC2 в корнях с максимумом в растениях, собранных в октябре (рис. 1). Уровни экспрессии VTC2 в корнях в августе (точка 1) и декабре (точка 3) были сопоставимы (сорта Коламбус и Otina) или значительно снижались в декабре (сорта Blauwgroene winter и Pandora).
Рис. 1.
Профиль экспрессии гена VTC2 в корнях, донце, белой части и зеленых листьях четырех сортов лука-порея (а – Blauwgroene winter, б – Коламбус, в – Otina, г – Pandora). 1 – август (активный рост), 2 – октябрь (сбор урожая), 3 – декабрь (через два месяца хранения).
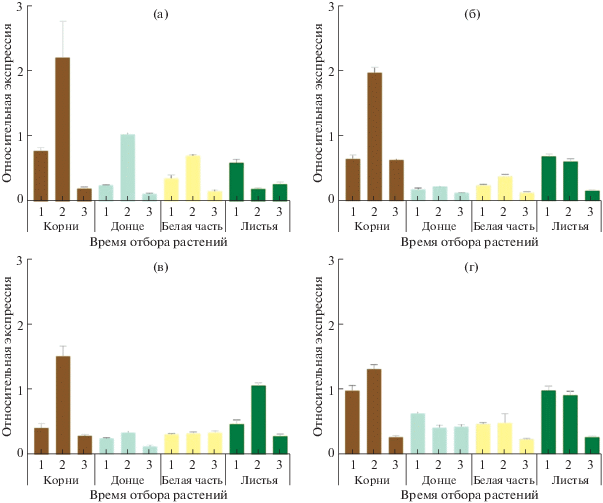
Во всех остальных исследуемых органах сортов лука-порея какого-либо заметного, системного сходства профиля экспрессии гена VTC2 не наблюдалось (рис. 1). Так, в донце VTC2 экспрессировался сходным образом у сортов Blauwgroene winter, Коламбус и Otina, при этом уровни транскрипции значительно варьировали (рис. 1). В белой части сходный профиль экспрессии был выявлен у сортов Blauwgroene winter и Коламбус, а у сорта Otina уровень транскрипции VTC2 был одинаков во всех трех временных точках (рис. 1). В зеленых листьях лука-порея схожий профиль (снижение от точки 1 к точке 3) экспрессии VTC2 наблюдался у сортов Коламбус и Pandora. Интересно отметить, что у растений лука-порея, собранных в августе, уровни экспрессии в корнях и зеленых листьях были примерно на одном уровне.
Для поиска возможных корреляций между уровнями транскрипции гена VTC2 и содержанием АК у анализируемых четырех сортов лука-порея, в белой части и зеленых листьях (в трех временных точках) было определено содержание витамина С (рис. 2а). В зеленых листьях всех четырех исследуемых сортов лука-порея содержание АК было выше, чем в белой части растений. Если сравнивать значения содержания АК в период сбора урожая (октябрь), то в зеленых листьях содержание АК было выше в 2.1–4.5 раза и достигало 52.8 мг/100 г сырой массы (сорт Pandora).
Рис. 2.
Содержание АК в белой части и зеленых листьях растений четырех сортов лука-порея (1 – август (активный рост), 2 – октябрь (сбор урожая), 3 – декабрь (через два месяца хранения)) (а); линейная регрессия уровней транскрипции гена VTC2 и содержания АК в белой части (б) и зеленых листьях (в) растений лука-порея четырех анализируемых сортов.
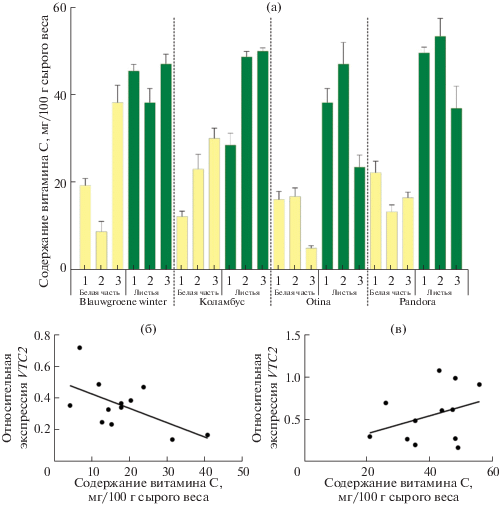
Динамика содержания АК в белой части и зеленых листьях у анализируемых сортов лука-порея значительно отличалась (рис. 2а). В белой части растений сорта Blauwgroene winter наблюдался рост содержания АК от августа к декабрю – в 2 (август vs. декабрь) и 4.5 (октябрь vs. декабрь) раза. При этом в зеленых листьях этого сорта содержание АК в трех анализируемых точках не имело достоверных различий. У сорта Коламбус и белая часть, и зеленые листья характеризовались ростом содержания АК в 2.5 и 1.7 раза (август vs. декабрь), соответственно. При этом в период с октября по декабрь содержание АК в зеленых листьях этих сортов, а также в белой части сорта Коламбус почти не менялось. В случае двух других сортов, Otina и Pandora, после двух месяцев хранения содержание АК снижалось в зеленых листьях (оба сорта) и в белой части (Otina) и оставалось постоянным в белой части образца сорта Pandora (рис. 2а).
Полученные значения содержания АК в белой части и зеленых листьях растений лука-порея были сопоставлены с уровнями транскрипции гена VTC2 (рис. 2б, в). В белой части растений была выявлена отрицательная корреляция (r = −0.58) между содержанием АК и уровнями транскрипции VTC2 (рис. 3б). В зеленых листьях уровни экспрессии VTC2 положительно коррелировали (r = 0.34) с содержанием АК (рис. 2в).
Рис. 3.
Уровни экспрессии гена VTC2 (а) и содержание АК (б) в зеленых листьях лука-порея сорта Коламбус при нормальных условиях выращивания (контроль) и при холодовом стрессе. Листовой материал отбирался через 0, 2, 4, 6 и 24 часа (ось абсцисс). 1 – контроль; 2 – холодовой стресс. Над графиками схематично указан световой режим в момент отбора листьев для анализа (черный круг – режим “ночь”; белый круг – режим “день”).
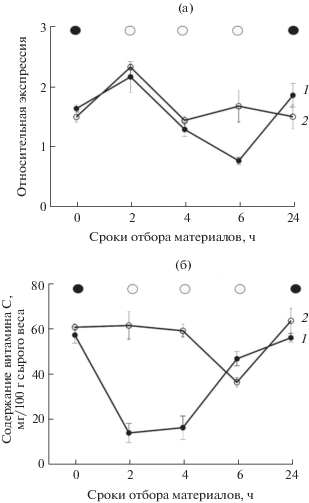
Для оценки влияния холодового стресса на уровни транскрипции гена VTC2 в зеленых листьях 60-дневных растений лука-порея (сорт Коламбус) были определены уровни экспрессии гена VTC2 (рис. 3а) и содержание АК (рис. 3б), при нормальных условиях выращивания (контроль) и при холодовом стрессе (+4ºС). При нормальных условиях выращивания через 2 ч после включения освещения в зеленых листьях лука-порея наблюдался максимальный уровень транскрипции VTC2, затем он снижался и через 6 ч достигал минимального значения (снижение в 2.1 раза по сравнению с начальным уровнем). В следующей временной точке (24 ч) уровень экспрессии VTC2 был сопоставим с исходным значением (0 ч).
В зеленых листьях, подвергнутых холодовому стрессу, уровни экспрессии VTC2 в первых трех временных точках (0, 2 и 4 ч) были сопоставимы с контролем (рис. 3а). В точке (2 ч) произошел резкий рост экспрессии VTC2, в том числе, в ответ на включение освещения. Через 6 ч (режим “день”) низкотемпературного воздействия уровень транскрипции VTC2 резко вырос в сравнении с контролем, а через 24 ч снова с ним сравнялся и оказался близок к исходному (0 ч) значению (рис. 3а).
Изменение содержания АК в зеленых листьях лука-порея при нормальных условиях выращивания и в ответ на холодовой стресс показано на рис. 3б. При нормальных условиях выращивания (контроль) максимальное содержание АК было выявлено в листьях при отсутствии освещения (режим “ночь”). Через 2 часа после включения света содержание АК в листьях значительно (в 3 раза) снижалось, однако затем начинало расти и через 24 ч достигало исходного уровня (рис. 3б).
Динамика содержания АК в зеленых листьях лука-порея при холодовом стрессе значительно отличалась от контроля (рис. 3б). В течение, как минимум, первых 4 ч стресса содержание АК оставалось неизменным, а через 6 ч – снижалось в 1.7 раза по сравнению с уровнем (0 ч). Однако через 24 ч низкотемпературного воздействия, аналогично контролю, содержание АК в зеленых листьях возвращалось к исходному (0 ч) уровню.
ОБСУЖДЕНИЕ
Чрезмерное образование АФК в растении приводит к окислительному стрессу, и АК является одним из наиболее важных низкомолекулярных неферментативных соединений, участвующих в антиоксидантной защите растения [2. Пути биосинтеза аскорбиновой кислоты достаточно хорошо охарактеризованы для некоторых видов растений [4, 7]. Однако список этих растений не включает виды Allium (в том числе Allium porrum, лук-порей), которые являются одним из источников витамина С в диете человека.
Основной для растений L-галактозный путь биосинтеза АК находится под контролем ГДФ-L-галактозофосфорилазы, кодируемой геном VTC2 [9]. В настоящей работе впервые были идентифицированы гомологи этого гена у четырех сортов лука-порея, различающихся по содержанию АК. Была определена вариабельность гомологов VTC2 и паттерн их экспрессии в динамике развития растений и в ответ на низкие температуры, а также проведена оценка возможных корреляций между уровнем экспрессии и содержанием АК.
Была показана высокая консервативность изучаемых гомологов и подтверждена их принадлежность к суперсемейству белков HINT (histidine triad nucleotide protein) [14]. Характерный домен PLN03103 присутствовал у всех идентифицированных ферментов, включая каталитический центр, инвариантный для VTC2 не только сортов лука-порея, но и A. thaliana, Solanum lycopersicum и других видов растений [14, 15].
В большинстве исследований при анализе генов биосинтеза витамина С акцент делается либо на плодах, либо на листьях [16–19]. Нами был проведен анализ профиля экспрессии VTC2 во всех частях растения лука-порея: корнях, донце, белой части и листьях в динамике их развития и хранения – на стадии активного роста (август), во время сбора урожая (октябрь) и спустя два месяца хранения (декабрь). За исключением корней, в исследуемых органах анализируемых сортов какого-либо заметного, системного сходства профиля экспрессии гена VTC2 не наблюдалось (рис. 1).
В корнях был выявлен довольно высокий уровень экспрессии VTC2 (особенно на стадии сбора урожая), сходный для всех анализируемых сортов лука-порея. При этом уровень экспрессии гена в 1.4–10.6 раз превосходил таковой в зеленых листьях (рис. 1). Особенно значимая разница наблюдалась у сортов Blauwgroene winter и Коламбус: в октябре уровень экспрессии VTC2 в корнях в 10.6 и 3.2 раза, соответственно, превысил уровень экспрессии в зеленых листьях. В целом, сравнивая уровни транскрипции VTC2 в растениях лука-порея после уборки (октябрь) и после двух месяцев в овощехранилище (декабрь), можно говорить о снижении экспрессии VTC2 во всех органах (за исключением белой части сорта Otina и донца сорта Pandora) анализируемых сортов в процессе хранения.
Динамика содержания АК в белой части и зеленых листьях у анализируемых сортов лука-порея значительно различалась (рис. 2а). В целом, полученные нами данные свидетельствуют о том, что в процессе послеуборочного хранения лука-порея значительного снижения содержания АК не происходит (за исключением сорта Otina), как это было показано для шпината и других листовых овощных культур [17]. Подобная динамика наблюдалась и в клубнях картофеля в процессе хранения [20].
Сопоставление уровня транскрипции VTC2 с содержанием АК в разных тканях лука-порея выявило положительную корреляцию в зеленых листьях и отрицательную в белой части растений. Полученные нами результаты находятся в соответствии с известными данными. Так, положительная корреляция между уровнями транскрипции гена VTC2 и содержанием АК наблюдается в фотосинтезирующих тканях проростков кукурузы [19]. В незрелых (фотосинтезирующих) плодах барбадосской вишни (Malpighia emarginata) высокое содержание АК сопровождается высокой экспрессией гена VTC2 и некоторых других структурных генов L-галактозного пути [18, 21]. Напротив, в нефотосинтезирующих тканях, таких как, например, сочные зрелые плоды шиповника (Rosa roxburghii), корреляция между содержанием АК и экспрессией VTC2 отрицательная [16]. Помимо статуса ткани (фотосинтезирующая/нефотосинтезирующая) и уровня экспрессии VTC2, на содержание АК может оказывать влияние экспрессия других структурных генов L-галактозного пути, альтернативные пути биосинтеза АК, активность ферментов деградации и рециклинга, а также особенности межклеточного транспорта АК [18, 22].
Температурные стрессы являются одними из наиболее важных факторов, влияющих на продуктивность и географическое распределение растений. Было показано, что уровень транскрипции гена VTC2 и содержание АК изменяются в ответ на температурный стресс, изменения освещенности и другие абиотические стрессы [23‒25]. Лук-порей является двухлетней культурой, наибольший вред для посевов в первый год вегетации представляют низкие температуры (заморозки).
В настоящем исследовании было проведено сравнение суточного (день/ночь, 16/8 ч) изменения экспрессии VTC2 в нормальных условиях и в ответ на холодовой стресс. Было показано, что в обоих случаях уровни транскрипции VTC2 были схожи, за исключением точки 6 ч после включения освещения (рис. 3а). По-видимому, активация транскрипции VTC2 в ответ на начало освещения может быть связана с наличием в промоторе светочувствительных cis-элементов [25], которые были идентифицированы также в промоторах некоторых других генов L-галактозного пути биосинтеза АК [26]. Однако рост экспрессии VTC2 в ответ на повышение освещенности наблюдается не у всех растений. Так, в проростках кукурузы уровень освещения не оказывал влияния на экспрессию VTC2, но значительное изменение уровня транскрипции в ответ на свет было выявлено для гена рециклинга АК – дегидроаскорбатредуктазы [27].
Сравнение динамики содержания АК в зеленых листьях лука-порея при нормальных и низкотемпературных условиях выявило значительные различия (рис. 3б). Наблюдаемое снижение содержания АК в листьях при нормальных условиях через 2 ч после включения света связано с тем, что АК расходуется в качестве специфического донора электронов ферментом аскорбатпероксидазой для детоксикации образующихся при фотосинтезе в хлоропластах АФК [28]. При холодовом стрессе отсутствие изменения содержания АК в листьях лука-порея в течение 4 ч после включения освещения (рис. 3б) может быть следствием снижения аскорбатпероксидазной активности в ответ на холод, однако данное предположение требует дополнительных исследований.
При сравнении данных по содержанию АК и уровню транскрипции VTC2 был выявлен ряд особенностей. В первую очередь это то, что в зеленых листьях лука-порея и при нормальных условиях, и при холодовом стрессе уровни экспрессии VTC2 и содержание АК через 24 ч были сопоставимы с исходными значениями (0 ч). Ранее подобная динамика экспрессии VTC2 была показана для видов киви (Actinidia eriantha и A. deliciosa), в листьях которых уровни транскрипции VTC2 значительно изменялись в ответ на различные абиотические стрессы через 12 и 24 ч воздействия, однако через 48 ч уровни транскрипции возвращались к исходным (0 ч) значениям [25]. С другой стороны, наблюдаемая нами возвратная динамика была характерна для точек 24 и 0 ч, которые соответствовали темному периоду (режим “ночь”), что может предполагать воздействие на экспрессию VTC2 освещения.
В тех же точках (0 и 24 ч) при отсутствии освещения в зеленых листьях лука-порея в нормальных условиях выращивания (контроль) было выявлено максимальное содержание АК. Это соответствует уровням транскрипции VTC2, близким к максимальным в сравнении с другими точками, и предполагает сниженную активность ферментов деградации витамина С. В нормальных условиях при наличии освещения наблюдалась обратная зависимость между уровнем экспрессии VTC2 и содержанием АК. При низких температурах в зеленых листьях такая корреляция либо отсутствовала (2 и 4 ч), либо также была отрицательной (6 ч) (рис. 3). Похожим образом, в проростках кукурузы в условиях холодового стресса при значительном росте уровня экспрессии VTC2 содержание АК сначала увеличивалось (через 15 ч), а потом резко падало (через 30 ч) [19]. Таким образом, можно говорить о воздействии холодового стресса на уровень экспрессии VTC2, при этом может подавляться экспрессия генов ферментов деградации АК и/или аскорбатпероксидазы, либо могут активироваться альтернативные пути биосинтеза АК.
Обычно лук-порей хранится в овощехранилище при низкой температуре и без освещения. Можно предположить, что, как и краткий холодовой стресс, продолжительное воздействие низких температур не должно влиять на содержание витамина С и транскрипцию VTC2. Однако во всех анализируемых тканях всех исследуемых сортов экспрессия VTC2 упала в декабре в сравнении с октябрем (рис. 1). При этом содержание АК у сортов варьировало без какой-либо единой зависимости (рис. 2). Возможно, ответ на воздействие низких температур имеет свою специфику для каждого сорта. Уровень экспрессии VTC2, по всей видимости, никак не отражает особенности ответа растений лука-порея на длительное низкотемпературное хранение. Сохранение или же падение содержания АК, скорее, может зависеть от активности ферментов деградации АК или аскорбатпероксидазы. Более того, наблюдаемое четырехкратное повышение в декабре содержания АК в белой части сорта Blauwgroene winter может свидетельствовать об активации, помимо L-галактозного, также и других альтернативных путей биосинтеза АК.
В процессе хранения лука-порея может произойти активация образования АФК. При этом может возникнуть, например, ферментативное потемнение тканей из-за работы полифенолоксидазы (PPO), окисляющей полифенолы, и АК является одним из эффективных ингибиторов активности PPO [29]. Также, от содержания АК зависит уровень устойчивости растения к фитопатогенам, так как ответ на заражение включает активацию образования АФК, имеющие конечной целью нарушение окислительно-восстановительной защиты патогенов [30]. Одновременно, растению необходима защита самого себя от возникающего окислительного стресса, для чего оно и использует АК в качестве “поглотителя” АФК [30].
Полученные нами данные, касающиеся корреляции содержания АК и уровня экспрессии VTC2, а также эффект воздействия на нее низких температур, могут быть использованы как для характеристики сортов лука-порея на устойчивость к стрессам и хранению, так и для селекции новых сортов c повышенной устойчивостью. Кроме того, полученные результаты станут основой для дальнейшего изучения генетических основ биосинтеза аскорбиновой кислоты у видов Allium.
Работа выполнена при финансовой поддержке гранта Российского фонда фундаментальных исследований (№ 19-016-00054) и, частично, гранта Президента РФ (МК-3350.2019.11; определение профиля экспрессии гена VTC2 в ответ на холодовой стресс), с использованием экспериментальной установки искусственного климата (ЭУИК) и Центра коллективного пользования “Биоинженерия” (Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Gill S.S., Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants // Plant Physiol. Biochem. 2010. V. 48. P. 909.
Bilska K., Wojciechowska N., Alipour S., Kalemba E.M. Ascorbic acid-the little-known antioxidant in woody plants // Antioxidants (Basel). 2019. V. 8. Article 645. https://doi.org/10.3390/antiox8120645
Conklin P.L., Barth C. Ascorbic acid, a familiar small molecule intertwined in the response of plants to ozone, pathogens, and the onset of senescence // Plant Cell Environ. 2004. V. 27. P. 959.
Smirnoff N. Ascorbic acid metabolism and functions: A comparison of plants and mammals // Free Radicals Biol. Med. 2018. V. 22. P. 116. https://doi.org/10.1016/j.freeradbiomed.2018.03.033
Yang X.Y., Xie J.X., Wang F.F., Zhong J., Liu Y.Z., Li G.H., Peng S.A. Comparison of ascorbate metabolism in fruits of two citrus species with obvious difference in ascorbate content in pulp // J. Plant Physiol. 2011. V. 168. P. 2196.
Broad R.C., Bonneau J.P., Hellens R.P., Johnson A.A.T. Manipulation of ascorbate biosynthetic, recycling, and regulatory pathways for improved abiotic stress tolerance in plants // Int. J. Mol. Sci. 2020. V. 21. Article 1790. https://doi.org/10.3390/ijms21051790
Giovannoni J.J. Completing a pathway to plant vitamin C synthesis // Proc. Natl. Acad. Sci. U.S.A. 2007. V. 104. P. 9109.
Ali B., Pantha S., Acharya R., Ueda Y., Wu L.-B., Ashrafuzzaman M., Ishizaki T., Wissuwa M., Bulley S., Frei M. Enhanced ascorbate level improves multi-stress tolerance in a widely grown indica rice variety without compromising its agronomic characteristics // J. Plant Physiol. 2019. V. 240. Article 152998. https://doi.org/10.1016/j.jplph.2019.152998
Dowdle J., Ishikawa T., Gatzek S., Rolinski S., Smirnoff N. Two genes in Arabidopsis thaliana encoding GDP-L-galactose phosphorylase are required for ascorbate biosynthesis and seedling // Plant J. 2007. V. 52. P. 673.
Urzica E.I., Adler L.N., Page M.D., Linster C.L., Arbing M.A., Casero D., Pellegrini M., Merchant S.S., Clarke S.G. Impact of oxidative stress on ascorbate biosynthesis in Chlamydomonas via regulation of the VTC2 gene encoding a GDP-L-galactose phosphorylase // J. Biol. Chem. 2012. V. 287. P. 14234. https://doi.org/10.1074/jbc.M112.341982
Bernaert N., De Paepe D., Bouten C., De Clercq H., Stewart D., Van Bockstaele E., De Loose M., Van Droogenbroeck B. Antioxidant capacity, total phenolic and ascorbate content as a function of the genetic diversity of leek (Allium ampeloprasum var. porrum) // Food Chem. 2012. V. 134. P. 669. https://doi.org/10.1016/j.foodchem.2012.02.159
Liu M., Wu Z., Jiang F. Selection and validation of garlic reference genes for quantitative real-time PCR normalization // Plant Cell Tiss. Organ Cult. 2015. V. 122. P. 435. https://doi.org/10.1007/s11240-015-0780-9
Schwinn K.E., Ngo H., Kenel F., Brummell D.A., Albert N.W., McCallum J.A., Pither-Joyce M., Crowhurst R.N., Eady C., Davies K.M. The onion (Allium cepa L.) R2R3-MYB gene MYB1 regulates anthocyanin biosynthesis // Front. Plant. Sci. 2016. V. 7. Article 1865. https://doi.org/10.3389/fpls.2016.01865
Brenner C. Hint, Fhit, and GalT: function, structure, evolution, and mechanism of three branches of the histidine triad superfamily of nucleotide hydrolases and transferases // Biochem. 2002. V. 41. № 29. P. 9003.
Тяпкина Д.Ю., Кочиева Е.З., Слугина М.А. Идентификация и анализ вариабельности генов-гомологов биосинтеза L-аскорбиновой кислоты VТC2 у видов томата (Solanum секция Lycopersicon) // Док-л. АН. 2018. Т. 483. С. 682. https://doi.org/10.31857/S086956520003457-5
Huang M., Xu Q., Deng X.-X. L-Ascorbic acid metabolism during fruit development in an ascorbate-rich fruit crop chestnut rose (Rosa roxburghii Tratt) // J. Plant Physiol. 2014. V. 171. P. 1205. https://doi.org/10.1016/j.jplph.2014.03.010
Dewhirst R.A., Clarkson G.J.J., Rothwell S.D., Fry S.C. Novel insights into ascorbate retention and degradation during the washing and post-harvest storage of spinach and other salad leaves // Food Chem. 2017. V. 233. P. 237. https://doi.org/10.1016/j.foodchem.2017.04.082
dos Santos C.P., Batista M.C., da Cruz Saraiva K.D., Roque A.L.M., de Souza Miranda R., Alexandre E Silva L.M., Moura C.F.H., Alves Filho E.G., Canuto K.M., Costa J.H. Transcriptome analysis of acerola fruit ripening: insights into ascorbate, ethylene, respiration, and softening metabolisms // Plant Mol. Biol. 2019. V. 101. P. 269. https://doi.org/10.1007/s11103-019-00903-0
Xiang N., Hu J., Wen T., Brennan M.A., Brennan C.S., Guo X. Effects of temperature stress on the accumulation of ascorbic acid and folates in sweet corn (Zea mays L.) seedlings // J. Sci. Food Agric. 2020. V. 100. P. 1694. https://doi.org/10.1002/jsfa.10184
Galani J.H.Y., Mankad P.M., Shah A.K., Patel N.J., Acharya R.R., Talati J.G. Effect of storage temperature on vitamin C, total phenolics, UPLC phenolic acid profile and antioxidant capacity of eleven potato (Solanum tuberosum) varieties // Hortic. Plant J. 2017. V. 3. P. 73. https://doi.org/10.1016/j.hpj.2017.07.004
Badejo A.A., Fujikawa Y., Esaka M. Gene expression of ascorbic acid biosynthesis related enzymes of the Smirnof-Wheeler pathway in acerola (Malpighia glabra) // J. Plant Physiol. 2009. V. 166. P. 652. https://doi.org/10.1016/j.jplph.2008.09.004
Franceschi V.R., Tarlyn N.M. L-ascorbic acid is accumulated in source leaf phloem and transported to sink tissues in plants // Plant Physiol. 2002. V. 130. P. 649.
Gao Q., Zhang L. Ultraviolet-B-induced oxidative stress and antioxidant defense system responses in ascorbate-deficient vtc1 mutants of Arabidopsis thaliana // J. Plant Physiol. 2008. V. 165. P. 138.
Ioannidi E., Kalamaki M.S., Engineer C., Pateraki I., Alexandrou D., Mellidou I., Giovannonni J., Kanellis A.K. Expression profiling of ascorbic acid-related genes during tomato fruit development and ripening and in response to stress conditions // J. Exp. Bot. 2009. V. 60. P. 663. https://doi.org/10.1093/jxb/ern322
Li J., Liang D., Li M., Ma F. Light and abiotic stresses regulate the expression of GDP-L-galactose phosphorylase and levels of ascorbic acid in two kiwifruit genotypes via light-responsive and stress-inducible cis-elements in their promoters // Planta. 2013. V. 238. P. 535. https://doi.org/10.1007/s00425-013-1915-z
Fukunaga K., Fujikawa Y., Esaka M. Light regulation of ascorbic acid biosynthesis in rice via light responsive cis-elements in genes encoding ascorbic acid biosynthetic enzymes // Biosci., Biotechnol., Biochem. 2010. V. 74. P. 888. https://doi.org/10.1271/bbb.90929
Liu F., Xiang N., Hu J.G., Shijuan Y., Xie L., Brennan C.S., Huang W., Guo X. The manipulation of gene expression and the biosynthesis of Vitamin C, E and folate in light-and dark-germination of sweet corn seeds // Sci. Rep. 2017. V. 7. Article 7484. https://doi.org/10.1038/s41598-017-07774-9
Caverzan A., Passaia G., Rosa S.B., Ribeiro C.W., Lazzarotto F., Margis-Pinheiro M. Plant responses to stresses: role of ascorbate peroxidase in the antioxidant protection // Genet. Mol. Biol. 2012. V. 35. P. 1011. https://doi.org/10.1590/s1415-47572012000600016
Ferelli A.M.C., Bolten S., Szczesny B., Micallef S.A. Salmonella enterica elicits and is restricted by nitric oxide and reactive oxygen species on tomato // Front. Microbiol. 2020. V. 11. P. 391. https://doi.org/10.3389/fmicb.2020.00391
Sikora M., Świeca M. Effect of ascorbic acid postharvest treatment on enzymatic browning, phenolics and antioxidant capacity of stored mung bean sprouts // Food Chem. 2018. V. 239. P. 1160. https://doi.org/10.1016/j.foodchem.2017.07.067
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


