Физиология растений, 2021, T. 68, № 1, стр. 36-52
Молекулярно-генетический анализ биосинтеза натурального каучукa
А. Ю. Америк a, *, Ю. Ц. Мартиросян a, b, Л. Ю. Мартиросян a, В. М. Гольдберг a, К. Р. Утеулин d, С. Д. Варфоломеев a, c
a Федеральное государственное бюджетное учреждение Институт биохимической физики
им. Н.М. Эмануэля Российской академии наук
Москва, Россия
b Федеральное государственное бюджетное учреждение Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии
Москва, Россия
c Федеральное государственное бюджетное учреждение Московский государственный университет
им. М.В. Ломоносова, Химический факультет
Москва, Россия
d Республиканское государственное предприятие Институт биологии и биотехнологии растений
Комитета науки Министерства образования и науки Республики Казахстан
Алматы, Казахстан
* E-mail: amerik.alexander@gmail.com
Поступила в редакцию 06.02.2020
После доработки 03.05.2020
Принята к публикации 18.06.2020
Аннотация
Натуральный каучук, цис-1,4-полиизопрен, − незаменимый исходный материал для тысяч продуктов, многие из которых абсолютно необходимы, в частности, для современной медицины. Каучук находится в латексе водной эмульсии, содержащейся в специализированных структурах каучук производящих растений – латициферах. Более 2500 видов растений способны синтезировать натуральный каучук, однако в настоящее время Hevea brasiliens (Бразильское каучуковое дерево, гевея) является единственным коммерчески значимым сырьем для получения каучука. Несколько белков играют ключевую роль в биосинтезе натурального каучука. Среди них цис-пренилтрансферазы, активатор цис-пренилтрансфераз и малыe белки, ассоциированныe с каучуковыми частицами. Эти белки непосредственно участвуют в синтезе полиизопреновой цепи. В этом обзоре мы анализируем молекулярно-генетические аспекты функционирования этих белков в процессе биосинтеза натурального каучука. В частности, мы описываем клонирование, экспрессию и функциональный анализ генов цис-пренилтрансфераз из Arabidopsis thaliana, Hevea brasiliensis и Taraxacum kok-saghyz и исследуем роль малых белков, ассоциированных с каучуковыми частицами, в биосинтезе натурального каучука. Особое внимание мы уделяем анализу влияния уровня экспрессии генов цис-пренилтрансфераз и гена-активатора цис-пренилтрансфераз на продукцию натурального каучука в клетках растений.
ВВЕДЕНИЕ
Натуральный каучук – один из важнейших биополимеров, которые востребованы в промышленности и медицине [1–4]. Несмотря на то, что каучук синтезируется более чем в 2500 видах растений, Hevea brasiliens (Бразильское каучуковое дерево, гевея) в настоящий момент является единственным коммерчески значимым источником каучука [5]. Ежегодно увеличивается спрос на натуральный каучук, но есть опасения, что современные плантации деревьев гевеи в дальнейшем не смогут удовлетворить все возрастающие потребности. Кроме того, гевея бразильская подвержена действию фитопатогенных грибов и бактерий, которые частично или полностью уже уничтожили огромные производственные плантации Бразилии. Следует также отметить, что многократный контакт с некоторыми белками латекса гевеи приводит к аллергической сверхчувствительности первого типа [6]. По этой причине идет активный поиск других семейств и видов каучуконосных растений, которые могут быть использованы в промышленном производстве натурального каучука. Исследуются растения, которые могут быть альтернативными продуцентами натурального каучука, из них выделяются растение рода одуванчик: кок-сагыз (Taraxacum kok-saghyz) [4, 5, 7–10]. Значительные количества каучука производят также растения гваюлы (Parthenium argentatum) [5, 11–13]. Таким образом, основной задачей становится изучение факторов, влияющих и на биосинтез натурального каучука, и на повышение продуктивности каучуконосных растений.
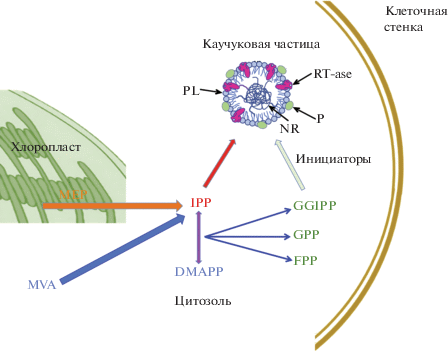
Целью настоящего обзора является анализ и обобщение данных по регуляции биосинтеза натурального каучука, понимание механизмов взаимодействия ключевых ферментов и белков-регуляторов. Внутриклеточными белками, необходимыми для биосинтеза натурального каучука (рис. 1), в частности, являются цис-пренилтрансферазы, малые белки, ассоциированные с каучуковыми частицами, и активаторы цис-пренилтрансфераз [14, 15]. В нашем недавнем обзоре мы подробно описали механизм биосинтеза натурального каучука и его регуляцию этими факторами [16]. В данном обзоре мы уделяем основное внимание молекулярно-генетическим аспектам этого процесса.
Рис. 1.
Биосинтез натурального каучука в растениях. Показаны метаболические пути биосинтеза субстрата и их внутриклеточная локализация. Изопентинилпирофосфат (IPP), мономерная единица для биосинтеза, синтезируется посредством двух метаболических путей – цитозольного пути мевалоновой кислоты (MVA) и пластидного метилэритритолфосфатного (MEP) пути. IPP и его стереоизомер диметилаллилпирофосфат (DMAPP) конденсируются с образованием нескольких аллильных пирофосфатов (APP): геранил пирофосфата (GPP), фарнезил пирофосфата (FPP) и геранил геранил пирофосфата (GGPP). Эти APP выполняют роль инициаторов биосинтеза. Биосинтез катализируется комплексом каучуковых трансфераз (RT-ase) связанным с протеолипидной мембраной (PL) цитозольных каучуковых частиц, стабилизируемых вспомогательными белками (P). Натуральный каучук (NR) накапливается внутри каучуковых частиц.
ЦИС-ПРЕНИЛТРАНСФЕРАЗЫ КАУЧУКОВЫХ ЧАСТИЦ, СИНТЕЗИРУЮЩИЕ ПОЛИИЗОПРЕН
Цис-пренилтрансферазы каучуковых частиц, синтезирующие полиизопрен (каучуковые трансферазы, RT) могут быть выделены в отдельное подсемейство цис-пренилтрансфераз (CPT) [17–19]. Они обладают низкой аффинностью к изопентeнил пирофосфату (IPP), что предотвращает синтез натурального каучука при низкой концентрации субстрата. Натуральный каучук эффективно синтезируется только в присутствии избытка IPP [20–23]. Различные классы CPT отличаются клеточной локализацией, способностью связывать молекулы субстрата и размером продуктов реакции. Примечательно, что только ферменты RT класса способны синтезировать высокомолекулярный полиизопрен [22–26].
Клонирование, экспрессия и функциональный анализ кДНК цис-пренилтрансферазы Arabidopsis thaliana
Цис-пренилтрансферазa Arabidopsis thaliana (ACPT) является первой охарактеризованной растительной CPT. Полимеразная цепная реакция (ПЦР) с использованием праймеров, соответствующих консервативным участкам аминокислотных последовательностей CPT микроорганизмов (M-icrococcus luteus, Escherichia coli, Saccharomyces cerevisiae), привела к амплификации фрагмента размером 500 п.о. Этот фрагмент был использован для скрининга кДНК библиотеки, который привел к изоляции полноразмерной кДНК ACPT размером 1062 п.о., содержащей открытую рамку считывания (ORF) размером 909 п.о. Эта рамка кодирует потенциальный белок с молекулярной массой 33 кДа. Анализ предсказанной аминокислотной последовательности показал, что на N-конце ACPT находится трансмембранный домен. Интересно, что CPT из M. luteus, E. coli и S. cerevisiae не имеют подобного домена [27].
ACPT экспрессируется во всех исследованных тканях, однако уровни экспрессии существенно разнятся. Так, экспрессия ACPT в корнях и листьях существенно выше, чем в стеблях и цветках. Следует также отметить, что независимо от исследуемой ткани, уровень экспрессии ACPT очень низок в растениях A. thaliana.
ACPT была оверэкспрессирована в клетках E. coli с использованием pET-22b(+) системы. После добавления индуктора (IPTG) интенсивная полоса ожидаемого размера (36 кДа) была видна в экстрактах белков A. thaliana. Фермент был очищен до практически гомогенного состояния с использованием метал-аффинной хроматографии.
Стандартный анализ CPT активности с использованием IPP и фарнезил пирофосфата (FPP) в качестве субстратов показал линейное включение [14C] IPP в синтезируемую полиизопреновую цепь в течение 3 ч. Для этого процесса также необходимы ионы Mg2+ кофактора CPT. Таким образом, ACPT действительно является цис-пренилтрансферазой.
Субстратная специфичность ACPT была исследована с использованием различных концентраций аллил пирофосфатов (APP). Включение [14C] IPP в случае FPP было значительно выше по сравнению с включением в случае геранил-геранил пирофосфата (GGPP) (Supplementary Fig. S1 ). Таким образом, FPP является более эффективным субстратом для ACPT по сравнению с GGPP.
Для того чтобы определить, способна ли ACPT катализировать образование высокомолекулярных полиизопренов, подобных натуральнoму каучуку, продукты реакции анализировали методом гель проникающей хроматографии (ГПХ). Было показано, что основным реакционным продуктом является полиизопрен с числом атомов углерода около 120. Таким образом, вполне вероятно, что для синтезa высокомолекулярных полиизопренов в клетках A. thaliana необходимы дополнительные белковые факторы.
Интересно, что 290 аминокислотных остатков последовательности ACPT идентичны остаткам предсказанного белка BAC F26B6, ген которого расположен на хромосоме II. Более того, ACPT высокогомологична предсказанному белку MJB20, ген которого также расположен на хромосоме II.
Характеризация кДНК, кодирующих цис-пренилтрансферазы Hevea brasiliensis
Как было отмечено выше, гевея (H. brasiliensis) является единственным коммерчески значимым источником натурального каучука благодаря высокому выходу и превосходным физическим качествам продукта [5]. Каучук из гевеи представляет собой высокомолекулярный полимер, состоящий и изопреновых мономеров, соединенных между собой в цис-конфигурации. Молекулы натурального каучука синтезируются и хранятся в так называемых каучуковых частицах в специфических клетках латекса – латициферах [28]. Таким образом, изучение белков, участвующих в биосинтезе натурального каучука из гевеи, в частности цис-пренилтрансфераз (HRT), безусловно, является актуальной задачей.
Для клонирования кДНК кодирующих HRT1 и HRT2 были использованы вырожденные праймеры, соответствующие консервативным регионам I и V охарактеризованных CPT (Supplementary Fig. S2 ) [29]. ПЦР с обратной транскрипцией (RT-PCR) с использованием этих праймеров привел к амплификации продуктов длиной приблизительно 600 п.о. Эти фрагменты были клонированы в вектор pT7BlueT, и один из них, содержащий консервативные мотивы II, III и IV, был назван LT600. Нуклеотидная последовательность этого фрагмента была использована для синтеза праймеров, необходимых для амплификации 5'- и 3'-концов кДНК HRT с использованием 5'- и 3'-RACE стратегий. Амплификация 3'-концевых продуктов привела к двум фрагментам кДНК размером 689 и 557 п.о. со степенью идентичности 85%. Интересно, что последовательности были идентичны в районе 3'-концов предполагаемых ORF. Амплификация 5'-концевых продуктов привела к единственному фрагменту размером 424 п.о. Для получения полноразмерных кДНК были использованы праймеры, синтезированные на основании данных RACE стратегии. Были идентифицированы две кДНК, названные HRT1 (1282 п.о., ORF 870 п.о.) и HRT2 (1051 п.о., ORF 852 п.о.). HRT1 и HRT2 кодируют белки, состоящие из 290 и 284 аминокислот (87.3% идентичности) с предсказанными молекулярными массами 33.2 и 32.8 кДа соответственно [30]. Анализ аминокислотных последовательностей показал, что HRT1 и HRT2 являются гидрофильными белками, содержащими на N-конце трансмембранные домены. Выведенные структуры демонстрируют высокий уровень идентичности (31.6, 32.0, 31.6, 29.9 и 30.1%) с цис-пренилтрансферазaми из M. luteus B-P 26 [31], S. cerevisiae (Rer2p [32], Srt1p [33]), E. coli [34, 35] и A. thaliana [27, 36], соответственно. Более того, все 5 консервативных мотивов CPT [29] присутствуют в структурах HRT1 и HRT2 (Supplementary Fig. S2 ).
Для анализа экспрессии генов HRT1 и HRT2 в различных тканях гевеи был использован Нозерн блот. Оба гена экспрессируются в основном в латексе, хотя низкий уровень экспрессии наблюдается также в листьях и проростках. Последовательности кДНК HRT1 и HRT2 высокогомологичны, и, следовательно, нельзя исключить кросс-гибридизацию. Для более детального анализа тканеспецифичности экспрессии использовали RT-PCR. Праймеры соответствовали низкогомологичным регионам HRT1 и HRT2 в кодирущих последовательностях и 3'-нетранслируемых регионах. Продукты амплификации наблюдались только в реакциях с использованием мРНК из латекса. Таким образом, HRT1 и HRT2, вероятно, функционируют в латексе, где также синтезируется натуральный каучук.
Для получения рекомбинантных HRT1 и HRT2 кДНК экспрессировали в E. coli, используя систему pET32b(+), позволяющую получать белки в форме гибрида с тиоредоксином. После индукции с IPTG, клетки E. coli продуцировали значительные количества нерастворимых рекомбинантных белков размером около 52 кДа. Однако некоторое количество HRT2 было также обнаружено в растворимой фракции клеточного экстракта. Растворимая и нерастворимая фракции HRT2 были подвергнуты металл-аффинной хроматографии для выделения гибридных белков, содержащих полигистидин на C-конце, при нативных и денатурирующих условиях соответственно. Aффинная хроматография приводила к получению высокоочищенного тиоредоксин-HRT гибрида. После расщепления гибрида энтерокиназой наблюдалось образование белка с молекулярной массой 33 кДа, соответствующей молекулярной массе HRT2.
CPT активность в экстрактах Е. coli, содержащих рекомбинантные HRT1 (BL21(DE3)/pETHRT1) и HRT2 (BL21(DE3)/pETHRT2) определяли, как описано в литературе [30]. Натуральный каучук экстрагировали смесью толуол/гексан (1 : 1) после удаления полиизопренов среднего размера 1-бутанолом. Если экстракт из клеток, оверэкспрессирующих HRT2, показывал небольшой уровень продукции натурального каучука, то в экстрактах клеток, оверэкспрессирующих HRT1, CPT активности обнаружено не было. Так как CPT активность в экстрактах Е. coli, содержащих рекомбинантную HRT2, была незначительна, былa проведена реакция полимеризации в присутствии промытых каучуковых частиц (WBP), которые являются местом инициации синтеза натурального каучука [30]. При коинкубации экстрактов, содержащих HRT1 и промытые каучуковые частицы (WBP), включение [14C]IPP в толуол/гексановую фракцию не отличалось от включения в контрольном эксперименте. Однако добавлениe WBP к гомогенату BL21(DE3)/ pETHRT2 приводило к значительному увеличению включения [14C]IPP во фракцию, содержавшую натуральный каучук. Таким образом, WBP содержат факторы, активирующие ферментативную активность HRT2. Интересно, что даже прогретые до 100°C течение 20 мин WBP способны частично активировать HRT2. Следовательно, некоторые активаторы HRT2 термостабильны.
CPT активность также была обнаружена при использовании очищенной HRT2. Активность увеличивалась с ростом концентрации фермента до достижения насыщения. Эффект WBP на CPT активность анализировали в присутствии 5 мкг HRT2. Активность увеличивалась пропорционально количеству добавленных WBP; насыщение наступало, когда количество WBP превышало 1 мг.
Для того чтобы определить молекулярную массу продуктов реакции HRT2 в присутствии WBP, был использован метод ГПХ. Основной продукт реакции имел молекулярную массу 2 × 105–1 × 106 Да, что соответствует полиизопрену размером 3000–15 000 изопреновых единиц. Наблюдались также небольшие количества продуктов с молекулярной массой 3 × 104, 2 × 103 и 1 × 103 Да (полимеры, содержащие 400, 30 и 15 единиц, соответственно). Когда реакция проводилась в отсутствии WBP, наблюдалось только небольшое количество полиизопренов с молекулярной массой от 2000 до 104 Да. Эти результаты показывают, что для синтезa натурального каучука HRT2 необходимы кофакторы, локализованные на поверхности WBP.
Для того чтобы определить, являются ли рекомбинантные HRT1 и HRT2 функционально активными CPT in vivo, кДНК были экспрессированы в дрожжевом мутанте SNH23-7D, в котором отсутствует дегидродолицил-дифосфат синтаза. Этот штамм чувствителен к высокой температуре и не может расти при 37°С. Интересно, что экспрессия HRT2 супрессирует мутантный фенотип, в то время как экспрессия HRT1 не влияет на фенотипические свойства мутанта.
HRT1, экспрессированная в E. coli, не обладает каучук-синтезирующей активностью. Вероятно, 35 аминокислотных замен между HRT1 и HRT2 являются критическими для ферментативных функций. Возможно, HRT1 принимaет участие в синтезе полиизопренов, таких как дегидродолицил-дифосфат, или выполняет до сих пор неизвестную функцию в H. brasiliensis [30].
Анализ кДНК цис-пренилтрансфераз, ответственных за биосинтез натурального каучука в Taraxacum kok-saghyz
Только некоторые из около 2500 видов растений, содержащих натуральный каучук в латексе, производят достаточно большие количества высокомолекулярного полиизопрена, представляющие коммерческий интерес [3, 5]. К ним относится “Русский одуванчик” (T. kok-saghyz). Основным преимуществом рода Taraxacum является относительная простота генетических манипуляций, которая позволяет детально исследовать механизм биосинтеза натурального каучука in planta [5].
Для клонирования ключевых ферментов биосинтеза натурального каучука, CPT T. kok-saghyz, были синтезированы вырожденные праймеры, соответствующие консервативным участкам последовательностей H. brasiliensis HRT1 and HRT2 [30], A. thaliana ACPT [27] и Saccharomyces cerevisiae Rer 2 [32]. RT-PCR, проведенный с использованием тотальной РНК из латекса в качестве матрицы, привел к идентификации трех неполных кДНК, кодирующих различные CPT. При помощи метода RACE были клонированы 5'- и 3'-концы; полноразмерные последовательности были обозначены как TkCPT1, TkCPT2 и TkCPT3. Анализ нуклеотидных последовательностей показал присутствие ORF размером 927 п.о. (TkCPT1 и TkCPT2) и 906 п.о. (TkCPT3), которые потенциально кодируют белки с молекулярной массой 35 кДа (TkCPT1 и TkCPT2) и 34.2 кДа (TkCPT3), соответственно. Аминокислотные последовательности TkCPT1, TkCPT2 и TkCPT3 обладают высоким уровнем идентичности (98%) [29]. Они также гомологичны, хотя и в меньшей степени, HRT1 (53%), HRT2 (52%), Rer2 (21%) и ACPT (21%) (Supplementary Fig. S2 ). Все 5 консервативных мотивов, которые отличают CPT от транс-пренилтрансфераз (ТPT), были идентифицированы в TkCPT1, TkCPT2 и TkCPT3 [24]. Некоторые из них выполняют критические функции. Так, мотив I необходим для узнавания и связывания FPP [37]. Мотив III контролирует геометрию связывания IPP и также необходим для каталитической активности [37]. Мотивы III и V участвуют в элонгации полиизопреновых цепей [25]. Интересно, что консервативные аминокислотные остатки в CPT, необходимые для синтеза коротких полиизопреновых цепей [25, 38], отсутствуют в TkCPT1, TkCPT2 и TkCPT3. Эти наблюдения, а также высокая степень консервативности аминокислотных последовательностей между тремя CPT из T. kok-saghyz и двумя из H. brasiliensis, позволяют предположить, что TkCPT1, TkCPT2 и TkCPT3 принимают участие в синтезе натурального каучука в клетках T. kok-saghyz.
Как было отмечено, натуральный каучук синтезируется в специализированных клетках латекса – латициферах. Исходя из этого, была исследована тканеспецифичность экспрессии TkCPT1-3, для того чтобы понять, соответствует ли она предполагаемой роли ферментов в биосинтезе натурального каучука. Тканеспецифичность экспрессии CPT1-3 в четырех тканях (корни, листья, стебли и цветки) исследовали методом RT-PCR. Было установлено, что среди трех CPT T. kok-saghyz только TkCPT1 преимущественно экспрессируется в латексе. TkCPT2 и TkCPT3 показывают примерно одинаковый уровень мРНК в латексе и корнях. Следует отметить, что низкий уровень мРНК наблюдается в корнях и стеблях в случае TkCPT1 и в стеблях в случае TkCPT2 и TkCPT3, соответственно (Supplementary Fig. S3 ). Анализ энзимологически активныx WBP, выделенныx из корней T. kok-saghyz, показал, что все три TkCPT экспрессируются преимущественно в латициферах и ассоциированы с WBP [39]. Интересно, что эти ферменты способны синтезировать высокомолекулярный полиизопрен в дрожжах [39].
Внутриклеточная концентрация цис-пренилтрансфераз регулирует биосинтез натурального каучука в Taraxacum brevicorniculatum
К настоящему времени идентифицировано относительно небольшое число CPT подсемейства RT, включая два фермента из гевеи (HRT1 и HRT2). Интересно, что HRT2 (но не HRT1) способна синтезировать высокомолекулярный натуральный каучук в присутствии WBP из латекса гевеи, APP и дивалентных катионов, таких как Mg2+ и Mn2+, играющих роль кофакторов [30]. Однако до недавнего времени, не было прямого подтверждения участия CPT в биосинтезе натурального каучука in planta.
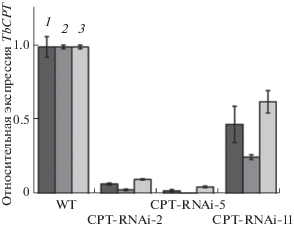
Для более полного понимания роли CPT1-3 в латексе были созданы трансгенные растения Taraxacum brevicorniculatum, близкого родственника Taraxacum kok-saghyz, в которых экспрессия всех трех генов CPT была подавлена с использованием метода РНК-интерференции (RNAi) [40]. Трансформация T. brevicorniculatum бактериями Agrobacterium tumefaciens, несущими соответствующие бинарные плазмиды, привела к изоляции 12 независимых трансгенных линий. Присутствие трансгенов было подтверждено ПЦР. Уровни экспрессии каждого гена TbCPT в латексе из корней анализировали методом RT-PCR, используя праймеры, специфические для TbCPT1-3. Так как эффективность супрессии синтеза мРНК варьировала от линии к линии, были выбраны три линии для дальнейшего анализа. Линии CPT-RNAi-2 и CPT-RNAi-5 демонстрировали практически полную супрессию, в случае линии CPT-RNAi-11 супрессия была лишь частичной (рис. 2). Трансгенные растения были морфологически неотличимы от растений дикого типа. Во всех трех линиях наивысший остаточный уровень экспрессии наблюдался в случае TbCPT3, далее следовали TbCPT1 и TbCPT2 [40].
Рис. 2.
Сайленсинг РНК TbCPT1-3 в трансгенных CPT-RNAi линиях T. brevicorniculatum. Количественный RT-PCR анализ экспрессии TbCPT1-3 в латексе из корней трансгенных CPT-RNAi линий и растения дикого типа (WT). Уровни экспрессии были нормализованы относительно уровня TbGAPDH и значение 1 было установлено для WT. 1 – TbCPT1; 2 – TbCPT2; 3 – TbCPT3. Рисунок взят из статьи Post с соавт. [40].
На белковом уровне эффективность нокаутов TbCPT1-3 определяли с помощью вестерн-блота латексных белков. Были использованы поликлональные антитела, узнающие все три TbCPT. В контрольном растении дикого типа анализ показал присутствие белков с молекулярными массами 34 кДа (TbCPT1 и 2) и 32 кДа (TbCPT3), соответственно. Если в линии CPT-RNAi-11 уровень TbCPT был только частично понижен по сравнению с растениями дикого типа, то в линиях CPT-RNAi-2 и CPT-RNAi-5 белки не детектировались вестерн-блотом (не показано).
Для понимания взаимосвязи между количеством TbCPT ферментов в латексе и суммарной пренилтрансферазной активностью, было исследовано включение [1-14C]IPP в экстракты латекса из каждой трансгенной линии и контрольного растения. Короткие и средние полиизопреновые цепи были экстрагированы бутанолом [30], затем длинноцепочечные продукты были экстрагированы смесью толуола и гексана. Активность CPT, приводящая к образованию длинноразмерных цепей, была обнаружена после добавления в реакцию экстрактов из клеток дикого типа (0.62 пмоль/(мин мг)) и CPT-RNAi-11 (0.5 пмоль (мин мг)). При использовании экстрактов из линий CPT-RNAi-2, CPT-RNAi-5 соответствующая активность отсутствовала [40].
Для определения молекулярной массы продуктов, синтезируемых в экстрактах из растений дикого типа и линии CPT-RNAi-11, была использована эксклюзионная хроматография (ЕХ). Эти исследования показали, что в растениях дикого типа синтезируется высокомолекулярный полиизопрен с молекулярной массой между 105 и 107 Да. В растениях линии CPT-RNAi-11 наблюдался более низкий уровень полиизопрена с молекулярной массой около 107 Да. Гексановыe экстракты из линий CPT-RNAi-2, CPT-RNAi-5 не содержали высокомолекулярный полиизопрен, что согласуется с отсутствием активности CPT в экстрактах из этих линий [40].
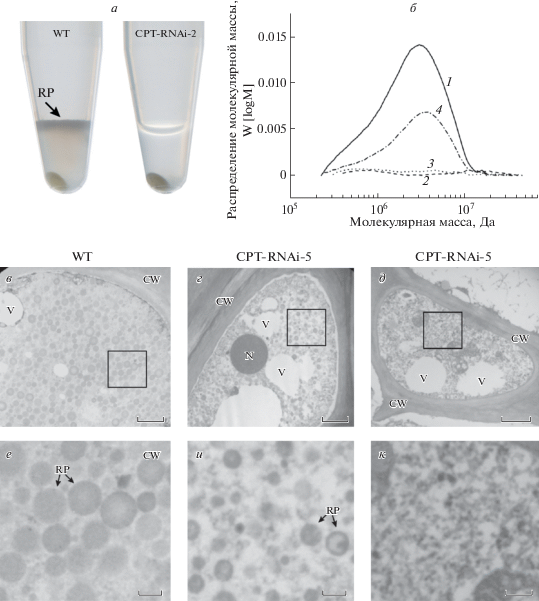
Интересные результаты были получены при анализе латекса из растений дикого типа и трансгенных линий. При центрифугировании экстракта латекса из растений дикого типа наблюдалось образование осадка, растворимой фракции цитоплазмы (C-serum) и верхней каучуковой фракции, содержащей каучуковые частицы. В латексе трансгенных растений CPT-RNAi-2 и CPT-RNAi-5 каучуковая фракция отсутствовала (рис. 3). Эти данные убедительно демонстрируют ключевую роль TbCPT1-3 в биосинтезе натурального каучука in planta.
Рис. 3.
Влияние сайленсингa CPT на содержание натурального каучука и его состав. Экстракты латекса после центрифугирования (а). Верхняя фаза, содержащая каучуковые частицы (RP), отсутствовала в латексе из трансгенных линий CPT-RNAi-2 и CPT-RNAi-5 (CPT-RNAi-2 показана в качестве примера). ЕХ хроматография (б) экстрактов латекса из клеток дикого типа (WT) и трансгенных CPT-RNAi линий. 1 – WT; 2 – CPT-RNAi-2; 3 – CPT-RNAi-5; 4 – CPT-RNAi-11. Экстракты латекса были обработаны гексаном для выделения гидрофобных веществ. Молекулярная масса была определена с использованием стандартов полиизопрена. Изображения латициферов, полученные с помощью TEM, из клеток растения дикого типа (WT, в) и трансгенной линии CPT- RNAi-5 (г, д). Изображения в нижнем ряду (е–к) показывают детали в квадратах при более высoком увеличении. CW – клеточная стенка; N – ядро; RP – каучуковые частицы; V – вакуоль. Шкала рисунка соответствует 1 мкм (в–д) и 0.2 мкм (е–к). Рисунок взят из статьи Post с соавт. [40].
Количество высокомолекулярного полиизопрена в экстрактах из корней растений дикого типа и трансгенных линий было также исследовано с использованием 1Н-ЯМР спектроскопии. Интенсивный сигнал, соответствующий цис-1,4-полиизопрену, наблюдался при анализе экстрактов из корней дикого типа. Экстракты из трансгенов CPT-RNAi-2 и CPT-RNAi-5 показывали гораздо более слабые сигналы. При сравнительном анализе интенсивности пика соответствующему протону при атоме углерода С5 было установлено, что количество цис-1,4- полиизопрена в экстрактах из корней линий CPT-RNAi-2, CPT-RNAi-5 и CPT-RNAi-11 составляло 25, 38 и 84% по сравнению с экстрактом из корней дикого типа [40].
Гравиметрический анализ показал, что корни линий CPT-RNAi-2 и CPT-RNAi-5 содержат незначительное количество высокомолекулярного полиизопрена. Лиофилизированные корни были обработаны толуолом для экстракции полиизопрена, который затем осаждали метанолом и центрифугировали. Масса осадков, полученных из линий CPT-RNAi-2 и CPT-RNAi-5, составляла 7 и 4% по сравнению с осадком из растений дикого типа, соответственно. Таким образом, результаты ЯМР-спектроскопии и гравиметрического анализа однозначно показывают, что уровень синтеза натурального каучука значительно снижен в трансгенныx линиях CPT-RNAi-2 и CPT-RNAi-5.
Размер поли-цис-1,4-изопренoвых цепей, синтезируемых in planta, был исследован методом ЕХ латексных экстрактов. Экстракты из растений дикого типа содержали большое количество полиизопрена с молекулярной массой 106-107 Да. В полном соответствии с результатами ЯМР спектроскопии и гравиметрического анализа, количество полиизопрена было понижено в экстрактах из линии CPT-RNAi-11, однако молекулярная масса полимера не отличалась от молекулярной массы полиизопрена из растений дикого типа. Таким образом, уровень активности CPT не влияет на размер полиизопреновых цепей. Как и ожидалось, высокомолекулярные полиизопреновые цепи отсутствовали в экстрактах из линий CPT-RNAi-2 и CPT-RNAi-5 (рис. 3).
Примечательно, что отсутствие высокомолекулярного полиизопрена в трансгенных линиях CPT-RNAi-2 и CPT-RNAi-5 совпадает с дефектной морфологией каучуковых частиц в латексе, что объясняет отсутствие каучуковой фракции в центрифугатах этих линий. Морфологию каучуковых частиц внутри латициферов из корней каждой линии изучали методом электронной трансмиссионной микроскопии (TEM). Латициферы растений дикого типа были плотно заполнены каучуковыми частицами. В отличие от растений дикого типа, клетки трансгенных линий CPT-RNAi-2 и CPT-RNAi-5 содержали всего несколько меньших по размеру каучуковых частиц. В некоторых латициферах каучуковые частицы полностью отсутствовали (рис. 3). Вероятно, каучуковые частицы из трансгенных растений обладают свойствами, отличными от свойств частиц из растений дикого типа, так как они не способны формировать каучуковую фазу в процессе центрифугирования [40].
Как указывалось выше, несмотря на множество исследований in vitro, ключевая роль CPT в биосинтезе природного каучука не была показана непосредственно in planta. Таким образом, ингибирование экспрессии TbCPT1-3 методом RNAi и его влияние на биосинтез природного каучука убедительно продемонстрировали роль TbCPT1-3 в этом процессе в клетках растений. T. brevicorniculatum представляет собой идеальную модель для подобных исследований, потому что это растение производит высококачественный натуральный каучук, имеет короткий жизненный цикл и может быть генетически модифицировано с использованием относительно простых и надежных подходов.
РОЛЬ МАЛЫХ БЕЛКОВ, АССОЦИИРОВАННЫХ С КАУЧУКОВЫМИ ЧАСТИЦАМИ, В БИОСИНТЕЗЕ НАТУРАЛЬНОГО КАУЧУКА
Таким образом, анализ данных, имеющихся в нашем распоряжении к настоящему времени, не вызывает сомнений в том, что CPT играют ключевую роль в биосинтезе натурального каучука in planta. К сожалению, мембранная ассоциация CPT затрудняет изучение этих ферментов и функционально связанных с ними белков при использовании классических биохимических подходов. Однако несколько белков-кандидатов были идентифицированы либо на основе их ассоциации с каучуковыми частицами [41], либо исходя из пространственного и временного паттерна их экспрессии [42–44]. Один из таких белков, малый белок, ассоциированный с каучуковыми частицами (SRPP), обнаруженный в латексе H. brasiliensis, является кислым белком (pI 4.8) с молекулярной массой 23 кДа [45]. Были также идентифицированы гомологи SRPP в P. argentatum [46] и T. kok-saghyz [29]. Несколько наблюдений указывают на важную роль SRPP в биосинтезе натурального каучука. Во-первых, в гевее SRPP экспрессируется во фракции латекса, синтезирующей натуральный каучук [29, 45]. Во-вторых, SRPP локализован на поверхности каучуковых частиц [28, 47]. В-третьих, in vitro исследования показали, что добавление рекомбинантного SRPP к каучуковым частицам из гевеи или гваюлы приводит к значительному увеличению полимеразной активности CPT [45, 46]. В-четвертых, инкубация каучуковых частиц с антителами против SRPP приводит к значительному снижению активности CPT [45].
В то же время, несмотря на убедительные результаты исследований in vitro, указывающие на участие SRPP в биосинтезе натурального каучука, in planta данные полностью отсутствовали. Для тестирования гипотезы, предполагающей, что уровень экспрессии SRPP коррелирует с качеством и количеством природного каучука, производимого в растениях, были использованы подходы обратной генетики. Для этих исследований растения Т. kok-saghyz, легко трансформируемые агробактериями, послужили модельной системой для анализа генов, потенциально важных для биосинтеза натурального каучука. Основным преимуществом Т. kok-saghyz перед гевеей и гваюлой, которые также могут быть трансформированы агробактериями, является то, что изменение уровня продукции каучука в трансформантах можно анализировать в течение первых 9 месяцев жизни растения, тогда как гевея и гваюлa требуют 5 и 2 года, соответственно (время, необходимое для достижения приемлемого уровня продукции натурального каучука).
Сравнительный анализ EST-последовательностей Т. kok-saghyz, используя известную последовательность SRPP из гевеи, привел к идентификации пяти кДНК, кодирующих потенциальные SRPP [29]. Исследования протеома Т. kok-saghyz показали, что три из них, а именно TkSRPP3, TkSRPP4 и TkSRPP5, ассоциированы с каучуковыми частицами [48]. Эти белки мигрируют в виде кластера на 2D-гель электрофорезе. Идентичность каждого SRPP с высокой степенью вероятности была подтверждена масс-спектрометрическим анализом. Для TkSRPP3 было подтверждено около 80% последовательности и 40% − для TkSRPP4 и TkSRPP5. TkSRPP3, являющийся основной изоформой, связанной с каучуковыми частицами, был изучен более детально.
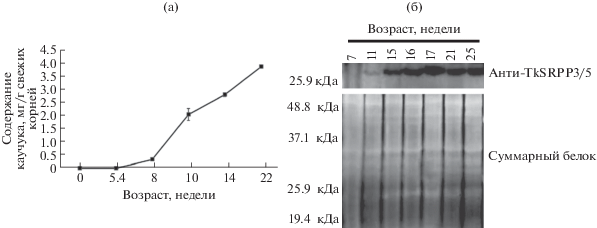
Вначале было исследовано, наблюдается ли корреляция между уровнями TkSRPP3/5 белков (поликлональные антитела одинаково эффективно узнают TkSRPP3 и TkSRPP5, но очень слабо реагируют с TkSRPP4) и TkSRPP3 транскрипта и накоплением натурального каучука в корневых тканях растения. Каучук не детектируется в 4-недельных растениях. Его накопление начинается в 5.4 недели, причем наибольшая скорость наблюдается между 8 и 10 неделями. После этой стадии развития корней уровень каучука продолжает расти, но более медленно. Вестерн-блот-анализ показал, что паттерн накопления TkSRPP3/5 коррелирует с паттерном накопления каучука в процессе развития корней. Белки отсутствуют в очень молодых корнях и впервые детектируются в растениях возрастом около 11 недель, что совпадает с периодом наиболее быстрого накопления натурального каучука. Значительный рост уровня TkSRPP3/5 белков наблюдается между 11 и 15 неделями, после чего уровень остается неизменным (рис. 4). Уровень TkSRPP3 транскриптa достигает максимального значения к 7 неделе и затем постепенно падает. Таким образом, экспрессия TkSRPP3 коррелирует с накоплением природного каучука в корнях [48]. Как показали недавние исследования, в латексе H. brasiliensis содержится множество изоформ SRPP, однако экспрессия только нескольких из них коррелирует с продукцией натурального каучука при стимуляции биосинтеза этиленом [24].
Рис. 4.
Содержание натурального каучука и TkSRPP белков в развивающихся корнях T. kok-saghyz. Накопление натурального каучука (а). Каучук был экстрагирован из растений в возрасте от 5 до 22 недель. Стандартная девиация была рассчитана на основании как минимум трех независимых экспериментов. Накопление TkSRPP3/5 (б) в течение развития T. kok-saghyz. На верхней панели показаны результаты вестерн-блота с использованием очищенных анти-TkSRPP3 антител. Нижняя панель демонстрирует количество нанесенного белка, окрашенного Сипро рубиновым. Рисунок взят из статьи Collins-Silva с соавт. [48].
Для того чтобы функционально охарактеризовать роль SRPP в биосинтезе натурального каучука, TkSRPP3 был оверэкспрессирован в трансгенном Т. kok-saghyz. С помощью агробактерии A. tumefaciens в геном растения была введена конструкция, содержащая TkSRPP3 кДНК под контролем промотора CaMV 35S. Анализ RT-PCR в реальном времени показал, что две из пяти трансгенных линий, названных ОЕ1 и ОЕ2, имеют повышенный уровень (> 2 раз) транскриптa TkSRPP3. Вестерн-блот-анализ также показал повышенный уровень TkSRPP3/5 белков в оверэкспрессирующих трансгенных линиях. Измерение содержания природного каучука в этих линиях продемонстрировало, что концентрация полимера в линии ОЕ2 повышена по сравнению с векторным контролем (1.88 и 1.43 мг/г, соответственно). В случае линии ОЕ1 эффект был меньше, но все же значительным (1.67 и 1.43 мг/г). Молекулярная масса природного каучука в оверэкспрессирующих линиях практически не отличалась от массы каучука в контрольной линии и варьировала в пределах 1–1.2 × 106 Да [48]. Фенотипически трансгенные растения не отличались от растений дикого типа.
Для более детального изучения роли SRPP в биосинтезе природного каучука экспрессия гена TkSRPP3 в Т. kok-saghyz была подавлена с помошью RNAi-подхода. Было получено 8 трансгенных линий, в двух из которых, получивших название RNAi1 и RNAi2, уровень TkSRPP3 мРНК был значительно ниже, чем в контрольной векторной линии. Вестерн-блот-анализ показал, что в этих линиях уровень белков TkSRPP3/5 также понижен. Обе линии продуцировали существенно меньше натурального каучука по сравнению с контрольной линией. Если корни RNAi1 и RNAi2 содержали 1.08 и 0.79 мг/г каучука, соответственно, то содержание каучука в контрольной линии достигало 1.48 мг/г [48]. Более того, молекулярная масса каучука в трансгенных линиях была значительно ниже, чем в контрольной линии. Когда экспрессия гена TkSRPP3 была подавлена RNAi, молекулярная масса понижалась до ~0.3 × 106 Да (RNAi1) и до 0.5 × 106 Да (RNAi2). В контрольной линии средняя молекулярная масса природного каучука составляла ~0.9 × 106 Да [48]. Как и в случае оверэкспрессии, фенотипически трансгенные линии не отличались от контрольной. Таким образом, подавление экспрессии TkSRPP3 в Т. kok-saghyz оказывает существенное влияние на количество синтезируемого природного каучука и его молекулярную массу.
АКТИВАТОР ЦИС-ПРЕНИЛТРАНСФЕРАЗЫ КАК КЛЮЧЕВОЙ РЕГУЛЯТОРНЫЙ БЕЛОК В БИОСИНТЕЗЕ НАТУРАЛЬНОГО КАУЧУКА
Семейство CPT включает в себя не только ферменты, ответственные за биосинтез натурального каучука, но и другие CPT, способные синтезировать полиизопреновые цепи с максимальной длиной до 50 изопреновых единиц [24, 25]. В эукариотах эти ферменты синтезируют долихол, необходимый для гликозилирования белков, и другие полиизопреноиды, выполняющие различные функции, включая адаптацию к стрессу [49, 50]. CPT человека, ответственная за биосинтез долихола, содержащего 22 изопреновых единицы, взаимодействует с Nogo-B рецепторным белком (NgBR). Этот белок стабилизирует фермент посредством прямых белок-белковых взаимодействий и также необходим для ферментативной активности CPT [51, 52]. C-конец NgBR гомологичен CPT, но другие домены, характерные для этих ферментов (мотивы I–V) отсутствуют, вследствие чего рецептор не обладает каталитической активностью [51, 53].
Было исследовано, могут ли белки, родственные NgBR, также стабилизировать CPT, ответственные за биосинтез натурального каучука, в качестве компонентов трансферазного комплекса на поверхности каучуковых частиц. Следует отметить, что NgBR – интегральный белок эндоплазматического ретикулума (ЭПР), и, следовательно, обнаружение его растительного аналога подтвердило бы гипотезу, согласно которой каучуковые частицы являются производными ЭПР [51, 52, 54].
Как было упомянуто выше, в клетках Т. kok-saghyz были обнаружены три CPT (TkCPT1-3), ассоциированные с каучуковыми частицами и необходимыми для биосинтеза натурального каучука [29, 39]. Однако эти ферменты не имеют трансмембранных доменов, и поэтому механизм их локализации на мембране каучуковых частиц оставался неясным.
Для дальнейшего анализа белков, ассоциированных с каучуковыми частицами, очищенные частицы из T. brevicorniculatum были обработаны трипсином и полученные пептиды были анализированы масс-спектрометрией. Определенные последовательности использовали для скрининга базы данных NCBI. Было установлено, что четыре пептида соответствуют EST DR00807 кДНК из корней Т. kok-saghyz. Более того, BLAST-анализ показал, что эта EST гомологична NgBR-рецептору. Исходя из того, что NgBR физически взаимодействует с CPT, было предположено, что гомолог NgBR из каучуковых частиц T. brevicorniculatum взаимодействует с ферментами, синтезирующими каучук и, тем самым, является до сих пор неидентифицированным компонентом трансферазного комплекса на поверхности этих органелл [55].
Полноразмерная кДНК, соответствующая Т. kok-saghyz EST, была амплифицирована на основе мРНК из латекса T. brevicorniculatum. ORF кодирует белок, состоящий из 244 аминокислотных остатков и имеющий молекулярную массу 28.6 кДа. Он на 24–25% идентичен человеческому и мышиному NgBR и на 42–48% – растительным NgBR из Medicago truncatula (Mt NgBR), Oryza sativa (Os NgBR) и A. thaliana (AtLEW1). Белок содержит три консервативных региона (мотивы I, II и III), характерные для NgBR растений и млекопитающих. Исходя из предполагаемой функциональной аналогии с NgBR, этот белок получил название активатор цис-пренилтрансферазы (TbRTA) [55]. Недавние исследования привели к идентификации гомологов RTA, известного также как белок-связывающий цис-пренилтрансферазы (CPT-binding protein, CPB) в нескольких растениях [56], включая салат (Lactuca sativa) [57], томаты (Lycopersicon esculentum) [58] и гваюлу (Parthenium argentatum) [59].
RT-PCR aнализ показал, что концентрация мРНК, кодирующей TbRTA, в латексе гораздо выше, чем в других тканях. Это коррелирует с экспрессией CPT1-3 и предполагает, что TbRTA принимает участие в биосинтезе каучука. Было сконструировано трансгенное растение T. brevicorniculatum, экспрессирующее TbRTA, содержащий эпитоп c-Myc. Латекс из этого растения был разделен на три фазы: осадок, интерфаза и фаза, содержащая каучуковые частицы. Последующий иммуноблот показал, что белок массой 33 кДа, c-Myc-TbRTA, локализован исключительно во фракции, содержащей каучуковые частицы и, скорее всего, ассоциирован с ними.
Интересные результаты были получены при исследовании локализации TbRTA в клетках Nicotiana benthamiana. Ген C-концевого гибридного белка, состоящего из ТbRTA и голубого флуоресцентного белка Cerulean (TbRTA-Cerulean), был транзиентно экспрессирован в клетках табака и его локализация была исследована методом конфокальной лазерной сканирующей микрокопии (CLSM). Мономерный красный флуоресцентный белок mRFP был использован в качестве цитозольного контроля, а гибридный белок, состоящий из N-концевой последовательности стерол-14-деметилазы (NtermCYP51G1) и мRFP – в качестве контроля эндоплазматического ретикулума (ЭПР) (NtermCYP51G1 локализован на цитоплазматической стороне ЭПР мембраны). CLSM анализ показал, что гибридный белок TbRTA-Cerulean колокализован с NtermCYP51G1-mRFP, a не с цитозольным контролем mRFP (Supplementary Fig. S4 ). Таким образом, было продемонстрировано, что TbRTA локализован на ЭПР мембране в клетках N. benthamiana. Это соответствует свойствам NgBR и подтверждает модель, согласно которой биогенез каучуковых частиц происходит на ЭПР мембране [53, 55].
В клетках млекопитающих NgBR физически взаимодействует с CPT, ответственной за синтез долихола [53]. Для того чтобы определить, взаимодействует ли растительный гомолог NgBR (TbRTA) c CPT1-3 в клетках T. brevicorniculatum, были использованы несколько подходов.
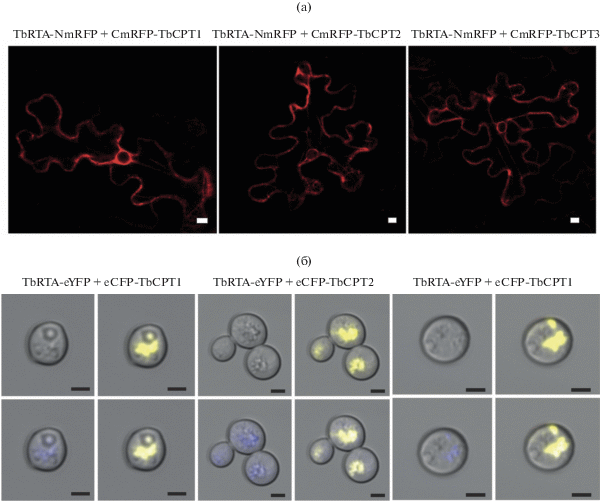
В бимолекулярном флуоресцентном комплементационном анализе (BiFC) использовались части mRFP. Kомбинации TbRTA и CPT1-3 в виде C- и N-концевых гибридных белков с фрагментами RFP были экспрессированы в клетках N. benthamiana. Физическое взаимодействие между TbRTA и TbCPT1-3 предполагало воссоздание полноразмерного RFP и, следовательно, флуоресценцию. Действительно, интенсивная флуоресценция наблюдалась, когда TbRTA, слитый с N-концевым фрагментом mRFP (TbRTA-NmRFP) был коэкспрессирован с каждой CPT, слитой с C-концевым фрагментом mRFP (CmRFP-TbCPT1-3) (рис. 5). Инвертированная комбинация приводила к тем же результатам. Для подтверждения специфичности BiFC системы TbRTA-NmRFP был коэкспрессирован с NtermCYP51G1-CmRFP. Как и ожидалось, в этом случае флюоресценции не наблюдалось. Клетки, коэкспрессирующие свободные компоненты mRFP или их комбинацию с TbRTA или TbCPT1-3, слитыми с соответствующими частями mRFP, служили дополнительным отрицательным контролем [55].
Рис. 5.
TbRTA взаимодействует с TbCPT1-3. BiFC анализ клеток N. benthamiana, коэкспрессирующих TbRTA-NmRFP и CmRFP-CPT1-3 (а). Шкала рисунка соответствует 10 мкм. FRET анализ дрожжевых клеток, коэкспрессирующих TbRTA-eYFP и eCFP-TbCPT1-3 (б). CLSM изображения соответствующих клеток. Показаны изображения, полученные по методу Номарского, eYFP и eCFP флуоресценция и оверлеи. Шкала рисунка соответствует 2 мкм. Рисунок взят из статьи Epping с соавт. [55].
Эти результаты были подтверждены коиммунопреципитацией. HA (хемоаглютинин)-TbRTA и c-Myc-TbCPT1-3 были транзиентно коэкспрессированы в клетках N. benthamiana. Взаимодействие было подтверждено коэлюцией и детекцией с использованием анти-HA и анти-c-Myc антител. В контрольном растении, экспрессирующем только TbRTA, сигнала в элюируемой фракции не наблюдалось. Таким образом, BiFC и коиммунопреципитация подтверждают взаимодействие TbRTA и TbCPT1-3 in planta [55].
Был также проведен анализ флуоресцентнoго резонанснoго переноса энергии (FRET). Были созданы несколько гибридных белков, в которых C-конец TbRTA был слит с желтым флуоресцентным белком еYFP (TbRTA-eYFP), и C-конец голубого флуоресцентного белка был слит с TbCPT1-3 (eCFP-TbCPT1-3). При коэкспрессии этих конструкций в дрожжах взаимодействие между TbRTA и TbCPT1-3 должно вызывать FRET между eCFP и eYFP, т.е. возбуждение eCFP должно приводить к эмиссии еYFP. Действительно, дрожжевые клетки, коэкспрессирующие TbRTA-еYFP и любой из еCFP-TbCPT, показывали интенсивную желтую флуоресценцию [55] (рис. 5). В контрольных клетках, экспрессирующих TbRTA-еYFP и еCFP или еYFP и еCFP FRET, эффект не наблюдался.
Комплементационный анализ в дрожжах показал, что TbRTA необходим для ферментативной активности TbCPT1-3. TbRTA и TbCPT1-3 поодиночке или в комбинации были экспрессированы в тройном мутанте nus1Δ rer2Δ srt1Δ. Эти клетки могут расти на богатой среде YPD, только если они содержат плазмиду, экспрессирующую Giardia lamblia cis-PTase [60], ген которой локализован на URA3 плазмиде. На среде, содержащей 5-фтороротовую кислоту (5-FOA), экспрессия Ura3 превращает 5-FOA в токсическое производное 5-фтороурацил. Таким образом, только клетки, потерявшие URA3 плазмиду, и в которых nus1Δ rer2Δ srt1Δ мутации комплементированы комбинацией TbRTA/TbCPT1-3, могут расти на средах, содержащих 5-FOA. Действительно, анализ показал, что только TbRTA вместе с TbCPT1-3 могут комплементировать тройной мутант. TbRTA и TbCPT1-3 по отдельности не способны поддерживать рост дрожжевых клеток на средах, содержащих 5-FOA [55] (рис. 6).
Рис. 6.
Функциональная комплементация CPT активности в дрожжах Sacharomyces cerevisiae. Мутантные штаммы nus1Δ rer2Δ srt1Δ (nΔ rΔ sΔ) и nus1Δ были трансформированы комбинацией TbRTA и TbCPT1-1 плазмид или TbRTA и TbCPT1-1 плазмидами и контрольным вектором. Клетки выращивали на богатой YPD среде или на полной минеральной среде, содержащей 1 г/л 5-фтороротовой кислоты (SD + 5-FOA). Рисунок взят из статьи Epping с соавт. [55].

Для изучения роли TbRTA в биосинтезе натурального каучука экспрессия гена TbRTA в клетках T. brevicorniculatum была подавлена с использованием RTA-RNAi подхода. Среди полученных восьми трансгенных линий семь показывали выраженный ингибиторный эффект, четыре из которых (1, 2, 5 и 8) были выбраны для дальнейшего анализа. Примечательно, что подавление экспрессии TbRTA не влияло на рост и развитие трансгенов. Они были неотличимы от контрольных растений дикого типа.
В первую очередь, было исследовано влияние подавления экспрессии TbRTA на синтез натурального каучука. Латекс, собранный из растений дикого типа, после центрифугирования образовывал пенообразный верхний слой, содержащий каучуковые частицы. В латексе трансгенных растений верхний слой отсутствовал. Более того, они не содержали нормальных каучуковых частиц, вместо этого в латициферах трансгенов было обнаружено некоторое количество пустых структур, по форме напоминающих нормальные частицы. Отсутствие каучука в трансгенных линиях было подтверждено 1Н-ЯМР анализом, который показал, что TbRTA-RNAi линии 1, 2, 5 и 8 содержат только 1.7–2.7 мг/г полиизопрена в латексе и 0.09–0.19 мг/г полиизопрена в корнях. Для сравнения, растения дикого типа содержали 108 мг/г и 2.19 мг/г полиизопрена в латексе и корнях, соответственно [55].
Были также проведены RT-PCR, в реальном времени, и вестерн-блот-анализы для того, чтобы выяснить, является ли ингибирование TbCPT1-3 экспрессии причиной отсутствия натурального каучука в трансгенах, или это посттрансляционная потеря соответствующих белков. Было показано, что уровни TbCPT1-3 мРНК примерно одинаковы в трансгенных RNAi линиях и контрольном растении дикого типа. Интересно, что вестерн-блот-анализ показал отсутствие TbCPT1-3 белков во всех четырех трансгенных линиях (рис. 7). Эти результаты предполагают, что TbRTA необходим для поддержания активной конформации TbCPT1-3 в составе трансферазного комплекса на мембране каучуковых частиц и объясняют отсутствие полиизопрена в TbRTA-RNAi трансгенных линиях. Таким образом, TbRTA не только активирует TbCPT1-3, но и предохраняет трансферазы от деградации. Более того, принимая во внимание тот факт, что TbCPT1-3 не имеют трансмембранного домена, TbRTA может играть важную роль в локализации трансфераз на поверхности каучуковых частиц [55].
Рис. 7.
Влияние нокаута TbRTA на экспрессию TbCP-T. Анализ экспрессии TbCPT1-3 в латексе с помощью RT-PCR (а). 1 – TbCPT1; 2 – TbCPT2; 3 – TbCPT3. Стандартная девиация была рассчитана на основании трех независимых экспериментов. Анализ экспрессии TbCPT1-3 белков вестерн-блоттингом (б). Верхняя панель показывает белки, окрашенные понсо S после переноса на нитроцеллюлозную мембрану. Рисунок взят из статьи Epping с соавт. [55].
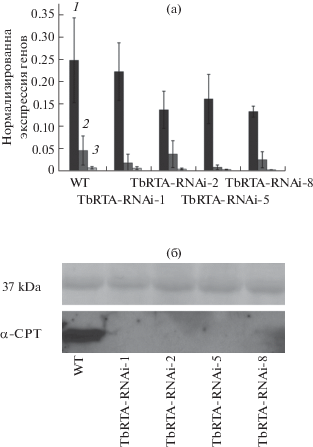
Для того чтобы исключить возможность того, что подавление экспрессии TbRTA влияет на экспрессию генов других белков трансферазного комплекса, был измерен уровень TbSRPP в трансгенных линиях. Он существенно не отличался от уровня этих белков в растениях дикого типа [55].
Таким образом, TbRTA является ключевым компонентом трансферазного комплекса. К сожалению, в настоящее время не представляется возможным синтезировать натуральный каучук на основе гетерологичной микробной или растительной платформ. Однако идентификация новых компонентов трансферазного комплекса может привести к решению этой проблемы в будущем.
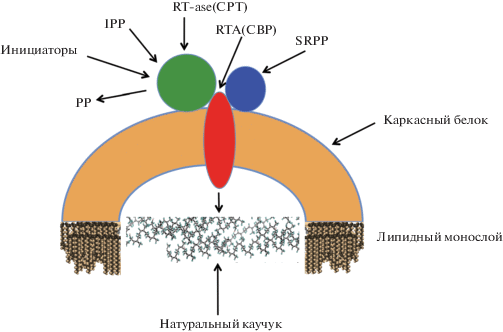
Следует также отметить, что на основании данных, описанных выше, была предложена модель функционирования трансферазного комплекса на мембране каучуковых частиц, представленная на рис. 8.
Рис. 8.
Схематическая модель цис-пренилтрансферазного комплекса, встроенного в монослойную биомембрану каучуковой частицы. Комплекс состоит из каркасного белка и белков, ответственных за биосинтез натурального каучука – RT-ase (CPT), RTA (CBP) и SRPP. Данная модель предложена на основании анализа последних литературных данных.
ЗАКЛЮЧЕНИЕ
Как было отмечено выше, более чем 2500 видов растений способны синтезировать натуральный каучук. К сожалению, большинство из них обладает нежелательными характеристиками, такими как очень низкий выход и недостаточная молекулярная масса полимера. В настоящее время H. brasiliensis является единственным растением, производящим коммерчески значимый природный каучук [5], однако из-за специфических условий роста, высокой чувствительности к патогенам и трудоемкости сбора продукта поиск других потенциальных продуцентов вызывает большой интерес. P. argentatum и Т. kok-saghyz являются потенциальными альтернативными источниками натурального каучука. Они не столь требовательны к природным условиям (растут в более холодных и менее плодородных географических регионах), имеют короткое время созревания и могут быть посеяны и собраны с использованием индустриальных подходов. Каучук из их экстрактов имеет примерно одинаковую молекулярную массу с каучуком из H. brasiliensis, однако содержит гораздо меньше аллергенных белков [5, 6, 20]. В 2015 году первая автомобильная шина из каучука P. argentatum была произведена Bridgestone Corporation. Это направление, безусловно, имеет высокий потенциал для развития.
Несмотря на существенный прогресс в поиске и разработке альтернативных источников натурального каучука, эффективность потенциальных продуцентов остается серьезным препятствием. Прогресс, достигнутый в агробактериальной генетической трансформации каучуконосов, должен привести к увеличению выхода натурального каучука. Также относительно простой геном и короткий жизненный цикл Т. kok-saghyz делает его идеальной модельной системой для изучения биосинтеза натурального каучука.
В течение последних 20 лет были охарактеризованы множество аспектов биосинтеза натурального каучука, таких как oбнаружение и характеристика CPT, механизм полимеризации изопрена и измерение молекулярной массы полимера [4, 56]. В этом обзоре мы кратко описываем прогресс в изучении молекулярно-генетических аспектов биосинтеза натурального каучука, достигнутый в последнее время.
Авторы благодарны к.б.н. В.В. Мартиросян за критические замечания и помощь в написании данного обзора.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Eng A.H., Ong E.L. Hevea natural rubber // Plastics engineering: handbook of elastomers / Eds. Bhowmick A.K, Stephens H. New York: Marcel Dekker, 2000, P. 29.
McIntyre D., Stephens H.L., Schloman Jr. W.W., Bhowmick A.K. Guayule rubber // Plastics engineering: handbook of elastomers / Eds. Bhowmick A.K, Stephens H. New York: Marcel Dekker, 2000, P. 1.
Puskas J.E. Producers and world market of synthetic rubbers // Biopolymers, polyisoprenoids / Eds. Koyama E., Steinbuchel A. Weinheim: Wiley, 2001, P. 287.
Cornish K. Rubber production // Encyclopedia of Applied Plant Sciences, Second edition / Eds. Thomas B., Murphy D.J., Murray B.G. Cambridge: Academic Press, 2016, P. 410. https://doi.org/10.1016/B978-0-12-394807-6.00088-5
Cornish K. Alternative natural rubber crops: why should we care? // Technol. Innov. 2017. V. 18. P. 245. https://doi.org/10.21300/18.4.2017.245
Cornish K., Xie W., Kostyal D., Shintani D., Hamilton R.G. Immunological analysis of the alternate natural rubber crop Taraxacum kok-saghyz indicates multiple proteins cross-reactive with Hevea brasiliensis latex allergens // J. Biotechn. Biomat. 2015. V. 5. P. 201. https://doi.org/10.4172/2155-952X.1000207
Arias M., Herrero J., Ricobaraza M., Hernández M., Ritter E. Evaluation of root biomass, rubber and inulin contents in nine Taraxacum koksaghyz Rodin populations // Ind. Crops Prod. 2016. V. 83. P. 316. https://doi.org/10.1016/j.indcrop.2016.01.023
Kreuzberger M., Hahn T., Zibek S., Schiemann J., Thiele K. Seasonal pattern of biomass and rubber and inulin of wild Russian dandelion (Taraxacum koksaghyz L. Rodin) under experimental field conditions // Eur. J. Agro. 2016. V. 80. P. 66. https://doi.org/10.1016/j.eja.2016.06.011
Luo Z., Iafaldano B.J., Zhuang X., Fresnedo-Ramírez J., Cornish K. Analysis of the first Taraxacum kok-saghyz transcriptome reveals potential rubber yield related SNPs // Sci. Rep. 2017. V. 7. P. 9939. https://doi.org/10.1038/s41598-017-09034-2
Ramirez-Cadavid D.A., Cornish K., Michel F.C. Jr. Taraxacum kok-saghyz (TK): compositional analysis of a feedstock for natural rubber and other bioproducts // Ind. Crops Prod. 2017. V. 107. P. 624. https://doi.org/10.1016/j.indcrop.2017.05.043
Eranki P.L., El-Shikha D., Hunsaker D.J., Bronson K.F., Landis A.E. A comparative life cycle assessment of flood and drip irrigation for guayule rubber production using experimental field data // Ind. Crops Prod. 2017. V. 99. P. 97. https://doi.org/10.1016/j.indcrop.2017.01.020
Soratana K., Rasutis D., Azarabadi H., Eranki P.L., Landis A.E. Guayule as an alternative source of natural rubber: A comparative life cycle assessment with Hevea and synthetic rubber // J. Cleaner Prod. 2017. V. 159. P. 271. https://doi.org/10.1016/j.jclepro.2017.05.070
Cornish K. Hypoallergenic natural rubber products from Parthenium argentatum (gray) and other non-Hevea brasiliens species. US Patent 5,580,942, 1996; 5,717,050. 1998.
Men X., Wang F., Chen G.-Q., Zhang H.B., Xian M. Biosynthesis of natural rubber: current state and perspectives // Int. J. Mol. Sci. 2019. V. 20. 50. https://doi.org/10.3390/ijms20010050
Cherian S., Beungtae Ryu S.-B., Cornish K. Natural rubber biosynthesis in plants, the rubber transferase complex, and metabolic engineering progress and prospects // Plant Biotech. J. 2019. V. 17. P. 204. https://doi.org/10.1111/pbi.13181
Amerik A.Yu., Martirosyan Yu.Tc., Gachok I.V. Regulation of natural rubber biosynthesis by proteins associated with rubber particles // Rus. J. Bioorg. Chem. 2018. V. 44. P. 140. https://doi.org/10.1134/S106816201801003X
Akhtar T.A., Matsuba Y., Schauvinhold I., Yu G., Lees H.A., Klein S.E., Pichersky E. The tomato cis prenyltransferase gene family // Plant J. 2013. V. 73. P. 640. https://doi.org/10.1111/tpj.12063
Yamashita S., Yamaguchi H., Waki T., Aoki Y., Mizuno M., Yanbe F., Ishii T., Funaki A., Tozawa Y., Miyagi-Inoue Y., Fushihara K., Nakayama T., Takahashi S. Identification and reconstitution of the rubber biosynthetic machinery on rubber particles from Hevea brasiliensis // eLife, 2016. V. 5. e19022. https://doi.org/10.7554/eLife.19022
Grabińska K.A., Park E.J., Sessa W.C. cis-Prenyltransferase: New Insights into Protein Glycosylation, Rubber Synthesis, and Human Diseases // J. Biol. Chem. 2016. V. 291. P. 18582. https://doi.org/10.1074/jbc.R116.739490
Cornish K. Similarities and differences in rubber biochemistry among plant species // Phytochemistry. 2001. V. 57. P. 1123. https://doi.org/10.1016/s0031-9422(01)00097-8
Cornish K. Biochemistry of natural rubber, a vital raw material, emphasizing biosynthetic rate, molecular weight and compartmentalization, in evolutionarily divergent plant species // Nat. Prod. Rep. 2001. V. 18. P. 182. https://doi.org/1039/a902191d
da Costa B.M.T., Keasling J.D., Cornish K. Regulation of rubber biosynthetic rate and molecular weight in Hevea brasiliensis by metal cofactor // Biomacromolecules. 2005. V. 6. P. 279. https://doi.org/10.1021/bm049606w
da Costa B.M.T., Keasling J.D., McMahan C.M., Cornish K. Magnesium ion regulation of in vitro rubber biosynthesis by Parthenium argentatum Gray // Phytochemistry. 2006. V. 67. P. 1621. https://doi.org/10.1016/j.phytochem.2006.04.010
Kharel Y., Koyama T. Molecular analysis of cis-prenyl chain elongating enzymes // Nat. Prod. Rep. 2003. V. 20. P. 111. https://doi.org/10.1039/b108934j
Kharel Y., Takahashi S., Yamashita S., Koyama T. Manipulation of prenyl chain length determination mechanism of cis-prenyltransferases // FEBS J. 2006. V. 273. P. 647. https://doi.org/10.1111/j.1742-4658.2005.05097.x
Surmacz L., Plochocka D., Kania M., Danikiewicz W., Swiezewska E. cis-Prenyltransferase atCPT6 produces a family of very short-chain polyisoprenoids in planta // Biochim. Biophys. Acta. 2014. V. 1841. P. 240. https://doi.org/10.1016/j.bbalip.2013.11.011
Oh S.K., Hwan Han K., Ryu S.B., Kang H. Molecular cloning, expression, and functional analysis of a cis-prenyltransferase from Arabidopsis thaliana. Implications in rubber biosynthesis // J. Biol. Chem. 2000. V. 275. P. 18482. https://doi.org/10.1074/jbc.M002000200
d’Auzac J., Jacob J.L., Chrestin H. The composition of latex from Hevea brusiliensis as a laticiferous cytoplasm // Physiology of Rubber Tree Latex / Eds. d’Auzac J., Jacob J.L., Chrestin H. Boca Raton: CRC Press. 1989. P. 59. https://doi.org/10.1201/9781351075695
Schmidt T., Hillebrand A., Wurbs D., Wahler D., Lenders M., Gronover C.H., Prufer D. Molecular cloning and characterization of rubber biosynthetic genes from Taraxacum koksaghyz // Plant Mol. Biol. Rep. 2010. V. 28. P. 277. https://doi.org/10.1007/s11105-009-0145-9
Asawatreratanakul K., Zhang Y.-W., Wititsuwannakul D., Wititsuwannakul R., Takahashi S., Rattanapittayaporn A., Koyama T. Molecular cloning, expression and characterization of cDNA encoding cis-prenyltransferases from Hevea brasiliensis. A key factor participating in natural rubber biosynthesis // Eur. J. Biochem. 2003. V. 270. P. 4671. https://doi.org/10.1046/j.1432-1033.2003.03863.x
Shimizu N., Koyama T., Ogura K. Molecular cloning, expression, and purification of undecaprenyl diphosphate synthase. No sequence similarity between E- and Z-prenyl diphosphate synthases // J. Biol. Chem. 1998. V. 273. P. 19476. https://doi.org/10.1074/jbc.273.31.19476
Sato M., Sato K., Nishimura S., Hirata A., Kato J., Nakano A. The yeast RER2 gene, identified by endoplasmic reticulum protein localization mutations, encodes cis-prenyltransferase, a key enzyme in dolichol synthesis // Mol. Cell. Biol. 1999. V. 19. P. 471. https://doi.org/10.1128/mcb.19.1.471
Sato M., Fujisaki S., Sato K., Nishimura Y., Nakano A. Yeast Saccharomyces cerevisiae has two cis-prenyltransferases with different properties and localizations. Implication for their distinct physiological roles in dolichol synthesis // Genes Cells. 2001. V. 6. P. 495. https://doi.org/10.1046/j.1365-2443.2001.00438.x
Apfel C.M., Takacs B., Fountoulakis M., Stieger M., Keck W. Use of genomics to identify bacterial undecaprenyl pyrophosphate synthetase: cloning, expression, and characterization of the essential uppS gene // J. Bacteriol. 1999. V. 181. P. 483.
Kato J., Fujisaki S., Nakajima K., Nishimura Y., Sato M., Nakano A. The Escherichia coli homologue of yeast RER2, a key enzyme of dolichol synthesis, is essential for carrier lipid formation in bacterial cell wall synthesis // J. Bacterol. 1999. V. 181. P. 2733.
Cunillera N., Arro M., Fores O., Manzano D., Ferrer A. Characterization of dehydrodolichyl diphosphate synthase of Arabidopsis thaliana, a key enzyme in dolichol biosynthesis // FEBS Lett. 2000. V. 477. P. 170. https://doi.org/10.1016/s0014-5793(00)01798-1
Fujihashi M., Zhang Y.-W., Higushi Y., Li X.-Y., Koyama T., Miki K. Crystal structure of cis-prenyl chain elongating enzyme, undecaprenyl diphosphate synthase // PNAS. 2001. V. 98. P. 4337. https://doi.org/10.1073/pnas.071514398
Ambo T., Noike M., Kurokawa H., Koyama T. Cloning and functional analysis of novel short-chain cis-prenyltransferases // Biochem. Biophys. Res. Commun. 2008. V. 375. P. 536. https://doi.org/10.1016/j.bbrc.2008.08.057
Schmidt T., Lenders M., Hillebrand A., van Deenen N., Munt O., Reichelt R., Eisenreich W., Fischer R., Prüfer D., Gronover C.S. Characterization of rubber particles and rubber chain elongation in Taraxacum koksaghyz // BMC Biochem. 2010. V. 11. https://doi.org/10.1186/1471-2091-11-11
Post J., van Deenen N., Fricke J., Kowalski N., Wurbs D., Schaller H., Eisenreich W., Huber C., Twyman R.M., Prüfer D., Gronover C.S. Laticifer-specific cis-prenyltransferase silencing affects the rubber, triterpene, and inulin content of Taraxacum brevicorniculatum // Plant Physiology. 2012. V. 15. P. 1406. https://doi.org/10.1104/pp.111.187880
Dennis M.S., Light D.R. Rubber elongation factor from Hevea brasiliensis. Identification, characterization, and role in rubber biosynthesis // J. Biol. Chem. 1989. V. 264. P. 18608.
Kush A., Goyvaerts E., Chye M.L., Chua N.H. Laticifer-specific gene expression in Hevea brasiliensis (rubber tree) // Proc. Natl. Acad. Sci. U.S.A. 1990. V. 87. P. 1787. https://doi.org/10.1073/pnas.87.5.1787
Han K.H., Shin D.H., Yang J., Kim I.J., Oh S.K., Chow K.S. Genes expressed in the latex of Hevea brasiliensis // Tree Physiol. 2000. V. 20. P. 503. https://doi.org/10.1093/treephys/20.8.503
Chow K.S., Wan K.L., Isa M.N., Bahari A.A., Tan S.-H., Harikrishna K., Yeang H.-Y. Insights into rubber biosynthesis from transcriptome analysis of Hevea brasiliensis latex // J. Exp. Bot. 2007. V. 58. P. 2429. https://doi.org/10.1093/jxb/erm093
Oh S.K., Kang H., Shin D.H., Yang J., Chow K.S., Yeang H.Y., Wagner B., Breiteneder H., Han K.H. Isolation, characterization, and functional analysis of a novel cDNA clone encoding a small rubber particle protein from Hevea brasiliensis // J. Biol. Chem. 1999. V. 274. P. 17132. https://doi.org/10.1074/jbc.274.24.17132
Kim I.J., Ryu S.B., Kwak Y.S., Kang H. A novel cDNA from Parthenium argentatum Gray enhances the rubber biosynthetic activity in vitro // J. Exp. Bot. 2004. V. 55. P. 377. https://doi.org/10.1093/jxb/erh039
Yeang H.Y., Ward M.A., Zamri A.S., Dennis M.S., Light D.R. Amino acid sequence similarity of Hev b 3 to two previously reported 27- and 23-kDa latex proteins allergenic to spina bifida patients //Allergy. 1998. V. 53. P. 513. https://doi.org/10.1111/j.1398-9995.1998.tb04089.x
Collins-Silva J., Nural A.T., Skaggs A., Scott D., Hathwaik U., Woolsey R., Schegg K., McMahan C., Whalen M., Cornish K., Shintani D. Altered levels of the Taraxacum kok-saghyz (Russian dandelion) small rubber particle protein, TkSRPP3, result in qualitative and quantitative changes in rubber metabolism // Phytochemistry. 2012. V. 79. P. 46. https://doi.org/10.1016/j.phytochem.2012.04.015
Kera K., Takahashi S., Sutoh T., Koyama T., Nakayama T. Identification and characterization of a cis,trans-mixed heptaprenyl diphosphate synthase from Arabidopsis thaliana // FEBS J. 2012. V. 279. P. 3813. https://doi.org/10.1111/j.1742-4658.2012.08742.x
Surmacz L., Plochocka D., Kania M., Danikiewicz W., Swiezewska E. cis-Prenyltransferase atCPT6 produces a family of very short-chain polyisoprenoids in planta // Biochim. Biophys. Acta. 2014. V. 1841. P. 240. https://doi.org/10.1016/j.bbalip.2013.11.011
Harrison K.D., Park E.J., Gao N., Kuo A., Rush J.S., Waechter C.J., Lehrman M.A., Sessa W.C. Nogo-B receptor is necessary for cellular dolichol biosynthesis and protein N-glycosylation // EMBO J. 2011. V. 30. P. 2490. https://doi.org/10.1038/emboj.2011.147
Park E.J., Grabińska K.A., Guan Z., Stránecký V., Hartmannová H., Hodaňová K., Barešová V., Sovová J., Jozsef L., Ondrušková N., Hansíková H., Honzík T., Zeman J., Hůlková H., Wen R. et al. Mutation of Nogo-B receptor, a subunit of cis-prenyltransferase, causes a congenital disorder of glycosylation // Cell Metab. 2014. V. 20. P. 448. https://doi.org/10.1016/j.cmet.2014.06.016
Miao R.Q., Gao Y., Harrison K.D., Prendergast J., Acevedo L.M., Yu J., Hu F., Strittmatter S.M., Sessa W.C. Identification of a receptor necessary for Nogo-B stimulated chemotaxis and morphogenesis of endothelial cells // Proc. Natl Acad. Sci. U.S.A. 2006. V. 103 P. 10997. https://doi.org/10.1073/pnas.0602427103
Martin S., Parton R.G. Lipid droplets: a unified view of a dynamic organelle // Nature Rev. Mol. Cell Biol. 2006. V. 7. P. 373. https://doi.org/10.1038/nrm1912
Epping J., van Deenen N., Niephaus E., Stolze A., Fricke J., Huber C., Eisenreich W., Twyman R.M., Prüfer D., Gronover C.S. A rubber transferase activator is necessary for natural rubber biosynthesis in dandelion // Nature Plants. 2015. V. 1. Article 15048. P. 1.
Kwon M., Kwon J.G., Ro D.K. cis-Prenyltransferase and polymer analysis from a natural rubber perspective // Methods Enzymol. 2016. V. 576. P. 121. https://doi.org/10.1016/bs.mie.2016.02.026
Qu Y., Chakrabarty R., Tran H.T., Kwon E.J., Kwon M., Nguyen T.D., Ro D.K. A lettuce (Lactuca sativa) homolog of human Nogo-B receptor interacts with cis-prenyltransferase and is necessary for natural rubber biosynthesis // J. Biol. Chem. 2015. V. 290. P. 1898. https://doi.org/10.1074/jbc.M114.616920
Brasher M.I., Surmacz L., Leong B., Pitcher J., Swiezewska E., Pichersky E., Akhtar T.A. A two-component enzyme complex is required for dolichol biosynthesis in tomato // Plant J. 2015. V. 82. P. 903. https://doi.org/10.1111/tpj.12859
Lakusta A.M., Kwon M., Kwon E.G., Stonebloom S., Scheller H.V., Ro D.K. Molecular studies of the protein complexes involving cis-prenyl transferase in guayule (Parthenium argentatum), an alternative rubber-producing plant // Front. Plant Sci. 2019. V. 10. P. 165. https://doi.org/10.3389/fpls.2019.00165
Grabińska K.A., Cui J., Chatterjee A., Guan Z., Raetz C.R., Robbins P.W., Samuelson J. Molecular characterization of the cis-prenyltransferase of Giardia lamblia // Glycobiology. 2010. V. 20. P. 824. https://doi.org/10.1093/glycob/cwq036
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


