Физиология растений, 2021, T. 68, № 1, стр. 3-19
Эндосимбиотическое происхождение хлоропластов в эволюции растительной клетки
И. Н. Стадничук a, *, В. В. Кузнецов a
a Федеральное государственное бюджетное учреждение науки
Институт физиологии растений им. К.А. Тимирязева РАН
Москва, Россия
* E-mail: stadnichuk@mail.ru
Поступила в редакцию 16.06.2020
После доработки 16.06.2020
Принята к публикации 18.06.2020
Аннотация
Теория эндосимбиотического происхождения хлоропластов стала базовой для современной биологии. Установлено возникновение эукариотного фотосинтеза в результате фагоцитарного приобретения цианобактерий предковой эукариотной клеткой. Феномен эндосимбиоза неотделим от теории клеточной эволюции. Среди решающих факторов биологического прогресса, приведших к разнообразию и огромной сложности эукариотных организмов, лежит процесс эндосимбиогенеза. Современная эволюционная теория строится на объединении феномена эндосимбиоза, параллельного переноса генов, теории естественного отбора и данных филогеномики. Эукариогенез объединил в клетках разные надмолекулярные комплексы, создал разнообразие органелл, привел к оксигенации биосферы и современному многообразию форм жизни.
ВВЕДЕНИЕ
Теория симбиогенеза хлоропластов [1] стала крупнейшим достижением отечественной и мировой биологии ХХ века и легла в основу современных представлений об эволюции клетки. Древность происхождения цианобактерий, установленная палеомикробиологией и палеогеологией (≥ 2.5 млрд. лет), сходство в строении фотосинтетического аппарата и молекулярном механизме осуществления фотосинтеза с хлоропластами, безоговорочно подтвердили теорию. Данные молекулярной биологии и геносистематики пластид раскрыли последовательность эволюционных событий. Установлено происхождение двух-, трех- и четырех-мембранных хлоропластов как следствие первичного и вторичного эндосимбиозов. Обнаружены третичный и сериальный первичный эндосимбиозы микроводорослей и транзиторные симбиозы водорослей с протистами и беспозвоночными животными. Установлена передача большинства пластидных генов в ядерный геном клеток-хозяев и зафиксирован латеральный перенос генов от хлоропластов к митохондриям. Найдено объяснение присутствия в растительном мире нескольких пигментных линий пластид. Создание раздельной геносистематики ядерных и пластидных геномов, синхронизация биосинтеза белков на рибосомах цитоплазмы и хлоропластов, молекулярные механизмы транспорта белковых продуктов из цитоплазмы в хлоропласт с помощью транзиторных и сигнальных пептидов являются предметом современных исследований. Возникла новая биологическая дисциплина – симбиогенетика.
ВОЗНИКНОВЕНИЕ ТЕОРИИ
Аккумуляция биологических знаний, предшествовавших теории эндосимбиоза
Активное становление естественных наук, включая биологию, началось со второй половины XVIII века. Многие из биологических открытий и обобщений оказались впоследствии связаны с теорией эндосимбиоза. В 1771 г. Д. Пристли открыл фотосинтез. а в 1779 г. Я. Ингенхгаузом было показано, что для протекания фотосинтеза необходим свет. В 1817 г. Ж. Пельте и Ж. Каванту обнаружили хлорофилл а – основной пигмент фотосинтеза. В 1824–1825 г.г. сине-зеленые водоросли (прежнее название цианобактерий) были включены как самостоятельная группа в ботаническую номенклатуру. В 1881–1884 г.г. Т.В. Энгельману удалось доказать, что сине-зеленые водоросли, подобно растениям, осуществляют фотосинтез. В 1883 г. А. Шимпер и А. Мейер описали “зеленые гранулы” – хлоропласты, где локализуется хлорофилл. В 1885 г. А. Шимпер показал, что хлоропласты обладают в клетке бинарным делением, передаваясь из поколения в поколение, и предположив возможность происхождения хлоропластов от цианобактерий. В 1879 г. Г.А. де Бари ввел в биологию термин “симбиоз”. Важным результатом в 1895 г. стало сообщение Р. Лаутерборна об обнаружении зеленой амебы Paulinella. В конце ХХ века изучение этого одноклеточного сыграло заметную роль как одно из доказательств теории эндосимбиоза.
Положения теории эндосимбиоза К.С. Мережковского
От эволюционных предположений и эволюционных идей теория отличается тем, что предлагает конкретные движущие силы и факторы эволюции, предоставляя для этого примеры и доказательства. Корректность приводимых положений может быть подвергнута проверке и при их ошибочности отвергнута, а при справедливости – подхвачена и развита. Эволюционные высказывания появились уже у древнегреческих философов. Они не были ложными, но теория эволюции возникла лишь с обоснованием ее ведущего фактора – естественного отбора. К.С. Мережковскому удалось создать теорию эндосимбиоза, опираясь на собственные микроскопические наблюдения над хлоропластами диатомовых водорослей и на обобщение накопленных ранее сведений. Были представлены доказательства происхождения хлоропластов от цианобактерий на основе сходства размеров, внутреннего строения и бинарного деления, идущего разновременно с делением клеточных ядер. Было введено понятие “симбиогенезис”, равнозначное термину “эндосимбиоз”. В качестве основы симбиогенезиса предложена теория двух клеточных плазм, микоплазмы и амебоплазмы, предвосхитившая разделение живой материи на два царства, про- и эукариотов [1, 2].
Период непризнания
В 1858 г. “Теория происхождения видов…” Ч. Дарвина сразу после публикации, не обходясь без критики и возражений, вызвала огромный интерес и внимание биологов. Положение о естественном отборе, подкрепляемое новыми данными, завоевало множество сторонников. Иначе сложилась судьба опытов Г. Менделя, результаты которых после опубликования в 1865 г. не привлекли внимания, а датой рождения генетики считается 1900 г. – год повторного открытия менделеевских законов. Теория эндосимбиоза К.С. Мережковского, опубликованная в 1905 г., прошла путь к всеобщему признанию через длительный период критицизма. Хотя симбиоз в качестве биологического феномена был известен, положение о цианобактериях как прародительницах хлоропластов противоречило утвердившимся представлениям о прямой дарвиновской филиации и последовательном накоплении видовых различий на пути усложнения и дивергенции организмов. Происхождение водорослей-эукариотов от сине-зеленых водорослей (цианобактерий), согласно филогенетическим схемам, требовало промежуточного звена в виде праводоросли (Uralga), позже названной ботаническим мифом, и поиск которой в дальнейшем не дал результатов. В биологии не признавалось положение о том, что одноклеточный организм может быть проглочен, но лишь частично переварен организмом-хозяином с созданием принципиально новой ветви развития жизни. Теория эндосимбиоза получала критические замечания со стороны крупнейших российских биологов, таких как А.С. Фаминцын, Б.М. Козо-Полянский и А.И. Опарин, которые занимались сопредельными вопросами. Критика была строго научной и апеллировала к неясным частям теории, которые не находили отклика в устоявшихся представлениях, так как эндосимбиоз стал качественно новым уровнем понимания эволюции клетки. В международной литературе публикации К.С. Мережковского предпочитали не замечать (известный популяризатор Л. Маргелис), либо критика оставалась бездоказательной. Дискуссии, сопровождавшие отрицание теории, продолжались более полувека (см. [3, 4] и ссылки).
Возрождение теории
Отношение к теории эндосимбиоза с появлением данных электронной микроскопии и молекулярной биологии в начале 60-х годов ХХ века стало быстро меняться на противоположное. Была выявлена двойная мембрана хлоропластов, в них обнаружена кольцевая ДНК, собственные рибосомы и биосинтез белка. Несколько позже появились данные о наличии у микроводорослей трех- и четырехмембранных хлоропластов, что уже было легко интерпретировать как следствие вторичных эволюционных эндосимбиозов (см. обзор работ тeх лет [5] и ссылки). В перипластидном пространстве хлоропластов между третьей и четвертой мембранами у криптофитовых водорослей и у зеленой амебы Chlororachnion было найдено редуцированное ядро промежуточного хозяина, названное нуклеоморфом [5]. С начала 80-х годов феномен симбиогенеза, или доместикации цианобактерий, стал общепризнанным. Молекулярно-биологические данные не оставили ни малейших сомнений в осуществившемся эндосимбиозе [6]. 100-летие создания теории было отмечено переводом основополагающей статьи К.С. Мережковского [1], изданной в 1905 г. на немецком языке, на английский [7]. В отечественной литературе юбилей теории был отмечен одним эссе [8] и двумя статьями [9, 10] к одной из которых [10] также прилагался полный русский перевод.
Происхождение эукариотной клетки
Эндосимбиоз хлоропластов неотделим от вопроса происхождения клетки. При возрасте Земли в 4.6 млрд. лет клеточная жизнь, согласно изотопному составу углерода в осадочных породах и данным палеобиологии и филогеномики, возникла 3.9–3.6 млрд. лет тому назад [11, 12]. К середине ХХ века возникло прочное представление о наличии двух клеточных царств, прокариот (бактерии) и эукариот (все остальные организмы). Монофилетическое древо с общим клеточным предком, обозначенным как “ЛУКА” (LUСА, Last Universal common Ancestor) было воссоздано в итоге сравнения гомологии 16S-рРНК современных микроорганизмов [13]. Царство прокариот распалось на подцарства бактерий и архей, а клеточная система организмов разделилась после появления “ЛУКИ” на три ветви, получившие названия бактерий, архей и эукариотов (Bacteria, Archea, Eucaria). Происхождение эукариотов, кардинально отличающихся от двух других фил сложностью строения, осталось наиболее трудным вопросом.
За последние годы метагеномика и геномный анализ единичных клеток вывели филогеномику на новый этап исследований клеточной эволюции. Выяснились широкое распространение архей в природных экосистемах и их способность к кооперативной синтрофии с бактериями вплоть до слияния клеток. Было найдена группа асгардархей, оказавшихся в процессах репликации, транскрипции и трансляции ближе к эукариотам, чем к другим археям и бактериям [14]. Концепция LUCA сменилась представлением о LECA (Last Eukaryotic Common Ancestor), последнем общем предке эукариотов. LECA возник благодаря слиянию предковой архебактериальной клетки, ставшей основой ядерного генома, и α-бактериальной клетки, ставшей промитохондрией [15, 16]. Поэтому митохондрия является столь же древней компонентой эукариотной клетки, как и ее ядро, а немногие известные в природе безмитохондриальные эукариоты-протисты утратили митохондрии вследствие редукционной эволюции [17]. Трехдоменная схема “древа жизни” сменилась схемой двух доменов, в которой эукариоты стали вторичным царством [16]. Двухдоменный сценарий пояснял наличие геномного (ядро) и энергетического (митохондрии) компартментов у эукариотной клетки, но оставался малопригодным для описания ее сложной внутримембраннной организации и автономизации органелл. Противоречия могут быть сняты первичным синтрофным слиянием с третьим партнером – δ-эубактериальной клеткой, привносящей свои метаболические возможности и ставшей основой эукариотной цитоплазмы [18]. Хотя в первичном архейно-бактериальном сообществе были все условия и для синтрофии, и для параллельного переноса генов, реализация подобных событий была крайне маловероятной, и от времени возникновения жизни до появления первых эукариотов прошло не менее 1.5 млрд. лет.
Энергетические возможности микроорганизмов
Источниками энергии для всех клеточных форм являются процессы хемоавто-, фотоавто- и органотрофии. Хемоавтотрофия основана на наиболее простых окислительных процессах и, по общему мнению, появилась ранее фотоавтотрофии, а органотрофы возникли с получением возможности окислять накопленную органику [19, 20]. Фотосинтез возник только в филе Bacteria. Поскольку первичная атмосфера Земли была бескислородной или малокислородной, первые фотосинтезирующие организмы были анаэробами [21]. Пять из шести известных групп фотобактерий (зеленые нитчатые, зеленые одноклеточные и зеленые серные бактерии, а также пурпурные и гелиобактерии) являются аноксигенами, и лишь одна группа, цианобактерии, стала оксигенными фотосинтетиками [19]. Время их появления, согласно возрасту диметилгопанов – древнейших сланцевых биомаркеров цианобактерий – и возрасту цианобактериальных строматолитов, оценивается в 2.5–2.7 млрд. лет; более древние пласты микрофоссилий относят к зеленым бактериям-анаэробам [20, 21].
Эндосимбиоз хлоропластов мог произойти только после формирования митохондрий. Выигрыш от эндосимбиоза для обоих партнеров является очевидным. Проглоченная цианобактерия cмогла улавливать из цитоплазмы клетки-хозяина часть углекислоты, продуцируемой митохондриями, а митохондрии получали выделяемый при фотосинтезе кислород. Митохондрии, используя О2, способствовали выживанию проэукариотов, что стало актуальным после случившейся в биосфере 2.45 млрд. лет назад “Кислородной катастрофы” (Great oxidation event), созданной цианобактериями [22]. Избыточный в малоаэробной клеточной цитоплазме О2 мог приводить к появлению активных форм кислорода (АФК) и окислительным повреждениям. Хлоропластами были выработаны различные формы нейтрализации АФК, благодаря чему тройная система хлоропласты–цитозоль–митохондрии оказалась устойчивой формой существования.
Формирование фотосинтеза и строение пигментного аппарата
Все фотосинтетики имеют общие принципы строения пигментного аппарата, в состав которого входят реакционный центр (РЦ), где происходит первичное разделение заряда, пигментная антенна, снабжающая РЦ энергией поглощенных световых квантов, и цепь переноса электрона к конечным акцепторам. Первоначальный РЦ возник у аноксигенных фотобактерий и затем разделился на два типа: в РЦ типа I возбужденный электрон стабилизируется с участием Fe/S-центров, а в РЦ типа II – с участием феофитин/хинонного кластера. Каждая группа аноксигенных фотосинтетиков располагает только одним из вариантов РЦ. Фундаментальным отличием цианобактерий служит объединение в клетке двух РЦ, переименованных в РЦ фотосистемы I (ФС I) и фотосистемы II (ФС II) (рис. 1 ). Существует несколько возможных сценариев этого ароморфоза, которые ждут дальнейшего рассмотрения [23]. Биологический прогресс оксигенных фотосинтетиков связан с появившейся способностью фоторазложения воды, ставшей донором электронов в Mn-содержащем белковом кластере ФС II. Цепь переноса электрона была унаследована всеми фотосинтетиками от ранее появившихся хемоавтотрофов [19, 20]. Основным пигментом фотосинтеза у цианобактерий и всех эукариотных пластид стал хлорофилл а. Пигментами антенны, увеличивающей светопоглощение, в цианобактериях служат фикобилипротеины, собранные в фикобилисомы [24] и замененные у большинства фотосинтезирующих эукариотов на хлорофилл а/b или хлорофилл а/с-содержащие комплексы [25].
Фикобилины и О2 в качестве маркеров эволюции оксигенного фотосинтеза
Хлорофиллы и в меньшей степени фикобилины могли бы стать прекрасными пигментными маркерами хронологии фотосинтеза, но продукты их катаболизма не сохраняются в осадочных породах более 10 млн. лет [26]. Вместе с тем, существует известное положение о том, что “последовательность реакций биосинтеза пигментов может являться рекапитуляцией эволюционных событий” [27], что в случае биогенеза фикобилинов предоставляет возможность важных умозаключений. У фикобилинов как хромофоров пигментной антенны цианобактерий цепь биосинтеза вплоть до образования протогема, образующегося из протопорфирина IX благодаря вставке в тетрапиррольное кольцо атома железа, совпадает с путем биосинтеза гемов. Ключевой реакцией синтеза билинов является обратная реакция удаления ставшего ненужным Fe2+, происходящая одновременно с размыканием созданной перед тем кольцевой молекулярной структуры и требующая участия трех молекул О2 [28]. Приобретенное железо теряется вновь (рис. 2 ), что служит указанием на то, что гемы как атрибут цитохромов в электрон-транспортных цепях у хемосинтетиков и в дыхательной цепи митохондрий появились ранее антенных пигментов фотосинтеза. Участие кислорода в появившейся реакции биосинтеза также свидетельствует, что к этому моменту уже существовала оксигенация атмосферы за счет деятельности протоцианобактерий, еще не приобретших фикобилипротеиновую антенну. Аналогично, в реакции гидроксилирования хлорофиллида а в хлорофиллид b используется кислород, указывая на более позднее возникновение последнего [29].
ПЕРВИЧНЫЙ, ВТОРИЧНЫЙ И ТРЕТИЧНЫЙ ЭНДОСИМБИОЗЫ
Особенности филогении и систематики протист и микроводорослей
Одноклеточные эукариоты носят общее название протист. Возникает вопрос о числе и последовательности эндосимбиозов, в результате которых среди одноклеточных организмов сформировались микроводоросли [30, 31]. Филогения и систематика протист как находящиеся у корней эукариотного древа жизни активно развиваются. На смену информационным ограничениям сиквенса 16S рРНК приходят сведения о первичной структуре полноядерных геномов, о сиквенсе ДНК индивидуальных клеток и о метагеномных исследованиях, которые позволяют выделить новые таксоны и систематические категории организмов, не укладывающиеся в рамки прежних классификаций (13 типов протист – [32]). В молекулярно-биологической систематике формируются супергруппы, как например сверхтаксон SAR, объединяющий облигатных паразитов, свободных гетеротрофов и фотоавтотрофные виды [33]. Другие еще недавно существовавшие супергруппы, такие, как например, Chromalveolata, подразделяются на отдельные филы [34]. Современная протистология и альгология, где учитываются такие виды, как малярийный плазмодий, утративший хлоропласты и ставший инфекционным возбудителем, оказываются взаимосвязанными науками. Важную роль в классификации водорослевых таксонов играет понимание, что эволюция хлоропластов и эволюция клеток-хозяев обладают значительной самостоятельностью [35]. Возникают новые и по-прежнему используются старые наименования систематических групп и их синонимы. Характерен небольшой (22 вида) отдел глаукофитовых водорослей, в чьем названии используются синонимы: глаукофиты, глауцистокофиты, греко-латинский термин Glaucophyta, или Glaucophyceae, и совместное с красными водорослями название подцарства Biliphyta. Критерии построения эволюционных древ, в систематике про- и эукариотов, в классической ботанике, в альгологии и протистологии, в зависимости от классификационных подходов зачастую не совпадают. В международной литературе применяются как латинские, так и английские названия таксонов, которые начинаются как с прописных, так и с заглавных букв (например, гаптофитовые водоросли: Haptophyta, или haptophytes). Наиболее корректным представляется применение международного кода номенклатуры: “International Code of Nomenclature for Algae, Fungi and Plants”, 2018.
Мембранная система хлоропластов у архепластид (Archaeplastida)
Бесспорные совпадения в мембранном строении цианобактериальной клетки с хлоропластами зеленых водорослей и высших растений выявлены благодаря электронной микроскопии. Грамотрицательная клетка цианобактерии, обладающая двумя наружными мембранами и межмембранным слоем пептидогликана, превращается в двумембранный хлоропласт (рис. 3 ). За счет пищеварительной вакуоли хозяина число мембран при фагоцитозе должно стать равным трем, и, следовательно, одна из мембран оказывается утраченной. Редукция мембраны, очевидно, уменьшает число препятствий для трансмембранного транспорта метаболитов. Благодаря различию липидного состав мембран у про- и эукариотов было выяснено, что исчезает мембрана вакуоли [36].
Кроме зеленых водорослей и происшедших от них высших растений, хлоропласты с двойной мембраной найдены у красных и глаукофитовых водорослей, объединенных в группу архепластид (Archаeplastida). У глаукофит на стромальной поверхности тилакоидов, как и у цианобактерий, находятся фикобилисомы, хлоропласты сохраняют межмембранный пептидогликан. У красных водорослей фикобилисомы и строение тилакоидов сохраняется, но исчезает пептидогликановый слой между мембранами. У зеленых водорослей в хлоропластах исчезают фикобилисомы, увеличивается число тилакоидов и уменьшается межтилакоидное пространство. Вместо фикобилисом тилакоиды содержат Хл а/b-протеин и разделяются на стопки гран и удлиненные тилакоидные мембраны стромы (рис. 3 ).
Рис. 1.
Схема формирования пигментного аппарата оксигенного фотосинтеза у цианобактерий, отражающая объединение в клетке ФС I и ФС II и наличие промежуточной клеточной формы в виде не имеющих антенны протоцианобактерий. Появление фикобилисом (ФБС) у цианобактерий, давших начало архепластидным хлоропластам. Боковые ветви современных цианобактерий, содержащие Хл b, Хл d или Хл f и частично или полностью утратившие фикобилисомы.
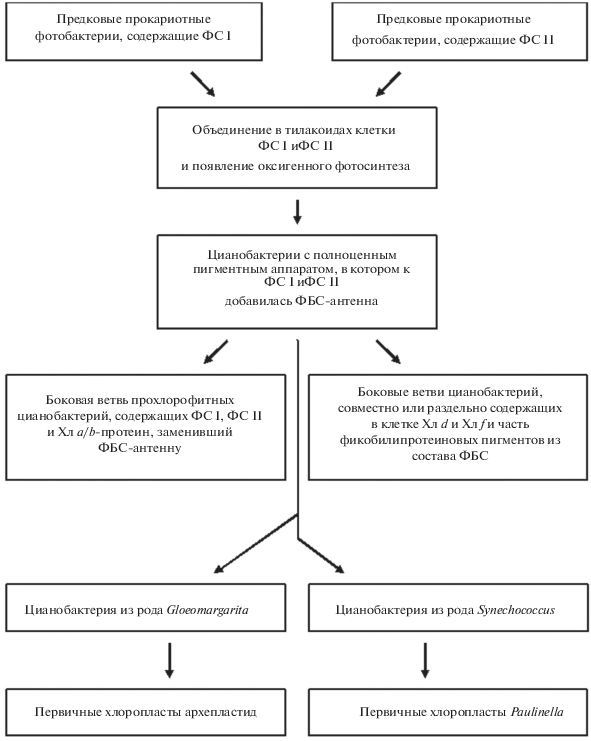
Рис. 2.
Ключевая реакция метаболического пути синтеза фикобилинов, указывающая на наличие в биосфере молекулярного кислорода и гемов как участников цепи переноса электронов ко времени ее эволюционного формирования. Показаны размыкание сформированной ранее кольцевой тетрапиррольной структуры, удаление гемового железа и двухэтапная дезоксигенация с удалением трех молекул О2 (М – метил, Р – пропионил и V – винил; см. текст).
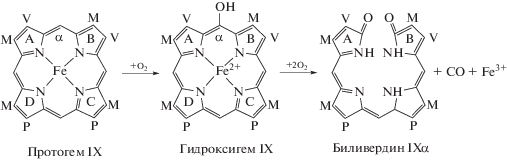
Рис. 3.
Три типа архепластидных двумембранных хлоропластов. У глаукофитовых водорослей в хлоропластах сохранились фикобилисомы и пептидогликановый слой, находившийся между двумя мембранами цианобактериальной клетки, которые стали двойной мембраной хлоропласта. Багрянки (красные водоросли): сохранили в хлоропластах фикобилисомы, но слой пептидогликана оказался элиминированным. У хлорофитных водорослей в хлоропластах утрачены фикобилисомы, утерян петидогликановый слой, среди тилакоидов сформировались граны и уменьшилось межтилакоидное пространство.
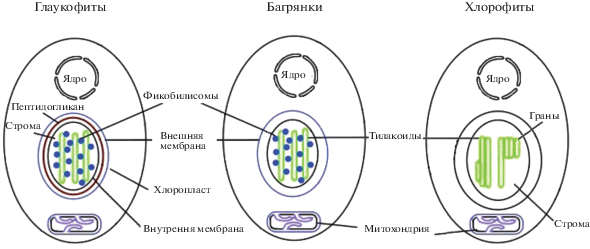
Рис. 4.
Схема первичного, вторичного и третичного эндосимбиозов хлоропластов в основных таксонах микроводорослей. Обозначены антенные пигмент-белковые комплексы зеленой, синей и красной линий археплатид.
Молекулярно-филогенетические исследования показали, что все три разновидности хлоропластов имеют монофилетическое происхождение: их родоначальником оказался предковый вид из цианобактериальной клады, возникшей 2.1 млрд. лет назад, и родственный ныне живущим примитивным цианобактериям Gloeomargarita [36]. Около 1.9 млрд. лет назад благодаря эндосимбиозу, вероятнее всего, со жгутиковым эукариотом возник общий автотрофный предок, который пока не получил своего названия. Этот первый эукариотный ствол архепластидного древа подвергся разновременной дивергенции на три ветви, получившие название синей (глаукофиты), красной (багрянки) и зеленой (зеленые водоросли) линий (рис. 4 ). Примерно (разброс сроков составляет 200 млн. лет) 1.7 млрд. лет назад возникли глаукофиты, спустя еще 400–100 млн. лет – примитивные одноклеточные багрянки, и, наконец, 1.1. млрд. лет назад – зеленые водоросли [36]. Еще через 600 млн. лет от сцеплянковых водорослей, сохранив свойства хлоропластов зеленой линии, возникли высшие растения [37]. Три перечисленные группы водорослей были названы архепластидами. Несмотря на значительный эволюционный возраст все три таксона вместе с цианобактериями сохранились до настоящего времени. Лишь значительно позже, 140–100 млн. лет назад, первичный эндосимбиоз с цианобактерией из рода Synechoccus, произошел вновь, дав фотосинтезирующих амеб рода Paulinella [38].
Вторичный эндосимбиоз
Двумембранные хлоропласты архепластидных водорослей получили название первичных. Для их эволюционного происхождения справедливо правило: один цианобактериальный предшественник и три разные группы эукариот, ставших хозяевами хлоропластов. Присутствие хлоропластов с четырьмя мембранами у других микроводорослей объясняется эндосимбиозом с архепластидами и сохранением после фагоцитоза плазмалеммы автотрофного эукариота вместе с фагосомальной мембраной вторичного хозяина [39]. Эукариотная клетка подобна матрешке, у которой внутри находится архепластидный симбионт, а в нем – его хлоропласт. Подобные пластиды названы комплексными, а эндосимбиоз называется вторичным. В эволюции возникла возможность выбора между тремя архепластидными линиями. Глаукофиты, несущие жгутики, не дали эволюционного усложнения хлоропластов. Вторичный эндосимбиоз имел место в двух линиях, идущих от предковых зеленых и красных микроводорослей. В зеленой линии возникли две новые филы: эвгленовые (Euglenophyta) и хлорорахниофитовые (Chlorarachniopyta) водоросли. В красной линии багрянки послужили хлоропластами разнообразным группам протистов (см. [35, 40] и ссылки). На рис. 4 представлены наиболее известные филы вторичной красной линии, к которым относятся криптофиты, гаптофиты, динофлагелляты и обширная супергруппа гетероконт, объединившая в себе диатомовые, бурые, желто-зеленые, золотистые водоросли и некоторые другие филы.
У части комплексных пластид существуют любопытные особенности, непосредственно вытекающие из феномена эндосимбиоза. Хлоропласты эвгленовых водорослей и динофлагеллят стали трехмембранными благодаря редукции наружной, четвертой мембраны [6], что рассматривается как прогрессивный признак, облегчающий трансмембранный транспорт ассимилятов. У хлорорахниофитовых и криптофитовых водорослей в перипластидном пространстве пластид между второй и третьей мембранами находится нуклеоморф – остаточное ядро с редуцированными хромосомами, оставшимися от промежуточного эукариотного хозяина. В обоих случаях в нуклеоморфе осталось по три палочковидные хромосомы. Так как нуклеоморфы двух групп ведут начало от разных линий, красной и зеленой, они являются интересным примером эволюционного параллелизма. Цитологическое выявление нуклеоморфов и ДНК-сиквенсы принадлежащих им хромосом предоставляют убедительные доказательства вторичного эндосимбиоза [5, 41].
Почему в продолжение эволюции протисты приобретали комплексные хлоропласты вместо новых вариантов первичного симбиоза с цианобактериями? Водоросли с комплексными хлоропластами появились значительно позже архепластид, успевших пройти длительный путь эволюции, за время которого сформировался редуцированный и приспособленный к взаимодействию с эукариотным ядром хлоропласт. Несмотря на усложненную мембранную систему, как ни странно это выглядит внешне, вторичный эндосимбиоз мог осуществляться быстрее и проще, чем первичный. Большое число возникших водорослевых таксонов (рис. 4 ) и дивергентное распространение фотосинтеза являются, как известно, признаком биологического прогресса в эволюции.
Третичный и сериальный вторичный эндосимбиозы
Третичный эндосимбиоз обнаружен только у динофлагеллят, среди которых были найдены виды с комплексными хлоропластами, принадлежащими иным водорослям красной линии: криптофитовым, гаптофитовым и гетероконтным. Таким образом, были выявлены не совсем понятные гибриды. Можно сравнить с той же матрешкой, в которой утерянная фигурка была заменена на сходную по размеру из других комплектов. Этому феномену находится общепринятое объяснение. При увеличении гетеротрофной составляющей питания в прежних границах обитания или при расширении ареала микроводоросль может перейти к миксотрофному метаболизму, а при устойчивом обилии органики вообще отказаться от автотрофии с редукцией хлоропластов. Облигатная гетеротрофия выгоднее энергетически, но более уязвима. При любом повторном обеднении среды органическим веществом и достаточном времени потребность в фотоавтотрофии может вернуться. Поэтому хлоропласты могут быть ассимилированы вновь благодаря фагоцитарному поглощению других вторичных фотоавтотрофов. Усложненность эволюционного сценария коррелирует с малым числом подобных видов. Число мембран в третичных хлоропластах индивидуально и может равняться двум, трем или четырем в зависимости от вариантов фагоцитирования, например, всасывания хлоропластов с отбрасыванием остальных клеточных компонентов [42]. У динофлагеллят рода Lepidodinium описаны случаи третичного эндосимбиоза, когда заново приобретается пластида не вторичного симбионта красной линии, а архепластидный зеленый симбионт с первичными хлоропластами. В этом случае эффект носит название сериального вторичного эндосимбиоза [6, 35].
Апикомплексы и апикопласты
Апикомплексы – тип простейших, состоящих из облигатных паразитов животных и человека. Входят вместе с динофлагеллятами-фотосинтетиками и инфузориями в монофилетическую надгруппу авльвеолят. Большинство апикомплексных протист, включая токсоплазм и плазмодиев, в том числе возбудителей малярии, содержат редуцированные, утратившие фотосинтез пластиды-апикопласты. Эти маленькие, не более 1.5 мкм органеллы, имеют четыре мембраны. Секвенированный геном апикопласта из Plasmodium уменьшен до 35 кб и 68 генов; в протеоме найдено лишь 550 белков (vs 3000 в хлоропластах растений). На примере апикопластов прекрасно видны нефотосинтетические функции пластид. Они участвуют в биосинтезе жирных кислот, изопреноидных кофакторов ряда энзимов, задействованы в путях биосинтеза гемов, железо-серных белковых кластеров и некоторых других соединений. Это облигатная органелла, без которой прерывается клеточный цикл апикомплексов [43, 44]]. Интересно, что у микроводоросли Polytomella, утратившей фотосинтез, но не ставшей паразитом, пластом полностью утрачен, но в редуцированном хлоропласте происходит накопление некоторого количества крахмала [45].
Замена фикобилисомной антенны с эукариотизацией фотосинтеза
Насыщение атмосферы кислородом в ходе эволюции не повлияло на селективный отбор хлорофилла а в качестве оптимального пигмента фотосинтеза, поскольку О2 не поглощает свет в видимой области спектра. Присутствие различных антенных пигментов отражается на названиях водорослей, среди которых известны бурые, зеленые, красные (багрянки), золотистые, желто-зеленые, и сине-зеленые (цианобактерии). У обособленной группы цианопрохлорофит к главному пигменту добавляются хлорофилл b и у ряда экзотических видов цианобактерий – хлорофиллы d, f и, возможно, хлорофилл с (рис. 1 ). Зеленые водоросли и высшие растения содержат хлорофилл b, обширная группа хромофит – до 10 разновидностей хлорофилла с [46–48]. Фикобилисомная антенна цианобактерий сохранилась у глаукофитовых и красных водорослей; “остатки” фикобилисом в виде отдельных фикобилипротеинов имеются у криптофит (рис. 4 ). Во всех остальных таксонах вплоть до цветковых растений фикобилисомы замещены либо на Хл а/b-, либо на Хл а/с-содержащие антенные комплексы. Возникает вопрос о причинах замены фикобилипротеиновой антенны. Сравнение спектральных свойств фикобилисом и Хл а/b- или Хл а/с-протеинов показывает, что фикобилисомы обладают преимуществом светопоглощения как на земной поверхности, так и во всей фотической зоне океана, от глубин до мелководья [6, 49]. Благодаря филогенетической световой адаптации существует стратификация водорослей в морских биотопах, но наземные биогеоценозы образованы растениями только с Хл а/b-содержащей антенной [6, 24].
Решающим недостатком фикобилисом как антенны является в 4–9 раз меньшее содержание хромофорных групп на единицу полипептидной массы в сравнении с Хл а/b- и Хл а/с-протеинами из-за ковалентной связи фикобилиновых тетрапирролов с апопротеинами [25, 50]. Фикобилисомы составляют до 60% водорастворимого белка или до 20% суммарного белка у цианобактерий [50]. На содержание пигментного аппарата клетка, согласно расчетам [51], может тратить не более 1/3 получаемой световой энергии. Подвижность растений в ходе эволюции была утрачена, начиная с макрофитных водорослей, что привело к появлению защитной клеточной стенки. На суше целлюлозная стенка приобрела опорную функцию, разделившись на первичную и вторичную и достигнув сложной архитектоники у покрытосеменных [52, 53]. Ее созданием и функционированием управляют до 2500 генов, что значительно больше, чем число генов фотосинтетического аппарата [54] и сравнимо с геномом всей цианобактериальной клетки [55].
Причиной утраты фикобилисом является увеличение потребности растительных клеток в усвоении CO2, вызванной появлением клеточной стенки [25]. Из усваиваемого высшими растениями углекислого газа примерно треть приходится на целлюлозу [52, 53], что вступает в противоречие с затратами на поддержание пигментного аппарата. Сохранение фикобилисом у глаукофит соответствует наличию жгутиков и подвижности, что указывает на недоразвитость клеточной оболочки. У макрофитных красных водорослей потребность в укреплении таллома покрывается за счет его кальцификации. Вторым фактором, вызвавшим преобразование антенны, является изменение соотношения ФС I и ФС II в эукариотных хлоропластах. Эукариоты для построения стенки требуют большего усвоения СО2, чем цианобактерии, и хлоропласты экспортируют в цитоплазму больше синтезируемых сахаров. Стандартное отношение ФС I к ФС II у цианобактерий и красных водорослей равняется 3:1 [24]. В ФС I за счет увеличенной доли циклического транспорта электронов может идти активное фотофосфорилирование без фиксации углекислого газа. При взаимодействии двух фотосистем усвоение СО2 происходит благодаря линейному электронному транспорту, и соотношение двух фотосистем в хлоропластах растений составляет 1:1, и эта стехиометрия адекватна возрастанию потребности в углекислоте. Увеличенная доля ФС II в хлоропластах находит отражение в появлении тилакоидных гран, причем Хл а/b-протеин способствует их формированию и уплотненной компоновке в хлоропласте.
МЕТАБОЛИЧЕСКИЙ КОНТРОЛЬ ФУНКЦИЙ ПЛАСТИД
Передача пластидных генов в ядро клетки
В хлоропластах выявлено 3000–4000 белков, из которых не более 3–5% кодируются пластидным геномом [55–57]. Не сохранив 95% цианобактериальных генов, хлоропласты утратили способность к самостоятельному внеклеточному существованию. Даже хлоропласты Paulinella, возникшие позже, чем у других архепластид (см. выше) и сохранившие 35–40% генома цианобактерий, не способны к выживанию in vitro [58]. Часть пластома была элиминирована как дублирующая геном ядра, некоторая часть перенесена в митохондрии и основная доля благодаря внутриклеточному переносу оказалась в клеточном ядре. Гены, попадавшие в ядро, встраивались в разных пропорциях во все хромосомы [59]. Эти ставшие ядерными гены кодируют большинство белков пластидной транскрипции, почти все белки процессинга хлоропластной РНК, до двух третей белков пластидных рибосом и большинство регуляторных факторов транскрипции и трансляции. В пластоме сохранились гены фотосинтетических белков, генетической системы и некоторые другие. Сохранение части генетического материала объясняется требованиями быстрого реагирования на смену световых условий фотосинтеза, сложностью обратного внесения в хлоропласт из цитоплазмы ряда гидрофобных мембранных белков и повышенным риском мутирования ДНК под действием АФК в хлоропластах [60, 61].
Хлоропластные геномы микроводорослей несут до 200 генов, у цветковых растений они содержат 100–120 генов. Большая часть сведений о пластоме и протеоме хлоропластов получена на модельных видах, таких как Chlamydomonas reinhardtii и Arabidopsis thaliana. Кольцевые ДНК хлоропласта существуют в виде 200 и более копий, что объясняется особенностями транскрипции генов у прокариот, и это в несколько раз превышает число копий ДНК у цианобактерий [62]. Так как в клетках мезофилла цветковых растений находятся десятки пластид, то на одну клетку может приходиться ≥10 000 копий пластидной ДНК, что составляет ~20% ее содержания в составе ядра [62].
Контраст между небольшим размером генома и разнообразием протеинов, выявляемых в составе хлоропластов, и их высокой метаболической активностью означает, что бóльшая часть белков поступает в хлоропласт из цитозоля, что подразумевает существование механизмов регуляции и доставки. Двойная мембрана ядра с ядерными порами и развитая система цитозольных мембран позволяют регулировать поток протеинов, поступающих в хлоропласт. Громоздкие пигмент-белковые комплексы тилакоидных мембран и многие сложные ферменты состоят из полипептидов, кодируемых как пластомом, так и ядерным геномом. Кодируемые в ядре и транспортируемые в хлоропласт белки содержат N-концевой транзиторный пептид, который обеспечивает транслокацию сквозь два мультибелковых мембранных канала, называемых ТОС механизмом (translocon at the outer envelope membrane) и TIC механизмом (translocon at the inner envelope membrane). В комплексных пластидах для обеспечения транспорта белка сквозь четыре пластидные мембраны требуется присоединение к N-концу еще одного короткого петида, называемого сигнальным. Протеолиз и обновление белков наружной мембраны осуществляется убиквитин-протеосомальной системой, утилизацию белков внутри хлоропласта осуществляют протеазы бактериального происхождения [63, 64].
Пластиды кроме фотосинтеза задействованы, как указано выше, в азотном обмене, синтезе аминокислот, нуклеотидов, изопреноидов, фенольных соединений, жирных кислот, крахмала, участвуют в метаболизме фитогормонов и вторичных метаболитов [55, 65].
Наряду с энзимами и структурными белками существуют сотни ядерно-кодируемых протеинов, которые участвуют в контроле экспрессии пластидного генома. Это регуляторное воздействие ядра на хлоропласт получило название антероградного сигнала. Под ядерным контролем находятся практически все этапы биогенеза и функционирования хлоропластов. Пластом объединил в себе про- и эукариотные признаки: наличие оперонов, интронов и редактирование транскриптов. Основные этапы экспрессии протекают по прокариотическому сценарию, в котором важнейшую роль играет посттранскрипционное созревания РНК: сплайсинг, редактирование и созревание 5'- и 3'- концов РНК.
В зависимости от внешних и внутренних воздействий от хлоропластов в цитозоль, в свою очередь, поступают разнообразные метаболиты, которые, достигая ядра, позволяют клетке оптимизировать фотосинтез. Метаболитный информационный поток от хлоропласта к ядру назван ретроградной сигнализацией. Эти сигналы, направляемые к ядру на стадии биогенеза хлоропластов, называются биогенными, на стадии активного фотосинтеза хлоропластов – операционными, а сигнал от стареющего или поврежденного хлоропласта называется деградационным сигналом. Сигнальные молекулы биохимически различны и могут быть подразделены на пять групп [66]. 1. Сигналы, связанные с экспрессией хлоропластного генома. 2. Сигналы, идущие от промежуточных продуктов биосинтеза тетрапирролов. 3. Воздействия, вызванные редокс состоянием пластохинона в ЭТЦ хлоропластов и образованием АФК. 4. Поток разнообразных низкомолекулярных соединений, появляющихся в результате метаболических нарушений в хлоропласте. 5. Регуляция, связанная с белками двойной локализации (ядерной и хлоропластной) [67]. Ретроградный сигнал хлоропластов является важной составляющей сети внутриклеточной сигнализации и служит предметом исследований метаболомики и других наук. Многие регуляторные сети и функции сформировались еще на основе цианобактериального генома [68], после чего вместе со структурными и регуляторными генами были переданы в ядерный геном эукариот.
Митохондрии в сравнении с хлоропластами
Митохондрии, чье формирование в составе эукариотной клетки произошло раньше, чем эндосимбиоз хлоропластов [16–18], имеют с ними многие черты сходства, начиная с двойной наружной мембраны [5, 6]. Протеомы в обоих случаях насчитывают до 2000–3000 белков, размеры геномов, состоящих из 150–200 генов, также сравнимы. Величина митохондриального протеома находится в сильной зависимости от водорослевого таксона, а у наземных растений еще и от вида ткани и разнящихся филогенетических и онтогенетических условий. При этом у растительной клетки митохондриом (300–800 т.п.н.) выглядит значительно большим, чем у грибов и животных, где он равен 16–100 т.п.н. Большинство генов протомитохондрий оказались перенесенными в ядерный геном, как впоследствии произошло и в ходе эволюции хлоропластов. К примеру, белковые комплексы электрон-транспортных цепей в обоих типах энергодающих компартментов клетки состоят из полипептидов, кодируемых в ядерном геноме и в геноме органелл. Ретроградный и антероградный сигналинг с ядром также сближает две энергодающие органеллы. Сопоставление пластома и ядерного генома демонстрирует лишь односторонний перенос генов в ядро. В отличие от хлоропластов, перенос генов между ядром и митохондриями является двусторонним процессом, и это различие еще не нашло убедительного объяснения [69]. Существует также однонаправленный цитозольный перенос генов от хлоропластов к митохондриям, который, вероятно, реализуется напрямую, минуя посредничество ядра. Таким образом, растительная клетка представляет собой генетическую систему, состоящую из трех взаимодействующих геномов. В случае таких водорослей, как криптомонады, к ним присоединяется четвертый геном, находящийся в нуклеоморфе.
СИМБИОЗЫ С УЧАСТИЕМ ЦИАНОБАКТЕРИЙ И МИКРОВОДОРОСЛЕЙ
В синэкологии описаны многочисленные разновидности факультативных и облигатных симбиозов с участием цианобактерий и микроводорослей, которые сопровождаются ингибированием протеаз и других ферментов переваривания “пищи”, но не завершаются образованием хлоропластов. Симбиозы микроорганизмов с многоклеточными растениями и животными являются одним из разделов общей теории симбиотических взаимоотношений, предметом исследований хологеномики [70].
Синцианозы
Симбиозы с участием цианобактерий, фото- и диазотрофов получили название синцианозов. Эпифитные цианоабактерии используют другие организмы в качестве субстратов, в том числе поселяясь в морях на талломах бурых и красных водорослей, а также образуя бактериальные маты совместно с гетеротрофными микробами. В эпибиозах нельзя исключать метаболитный обмен цианобактерий с опорными организмами [71]. Диазотрофные цианобактерии-микросимбионты селятся внутри клеток морских диатомей, играющих роль макросимбионтов. Внутри клеток диатомей, став эндосимбионтами, цианобактерии могут утрачивать фотосинтетическую функцию [72]. В синцианозы с наземными растениями чаще всего вступают гетероцистные нитчатые цианобактерии-азотфиксаторы рода Nostoc. Партнерами могут быть антоцеротовые, печеночные и листостебельные мхи, в том числе сфагнум, среди цветковых – травянистое растение Gunnera. Цианобактерии находятся в спецполостях коралловидных корней у голосеменных саговниковых пальм и в листьях водного папоротника азолла, где служат внеклеточными эндосимбионтами [73]. В симбиозах с протистами, беспозвоночными и низшими хордовыми цианобактерии выполняют роль фотоавтотрофов. Synechococcus sp. и Prochloron являются внутриклеточными цианобактериями-симбионтами цилиат и радиолярий. Кроме протист, Synechococcus и Prochloron обитают в симбиозе с асцидиями семейства Didemnidae (дидемниевые) [73, 74]. Среди губок описано более 100 видов, вступающих в симбиоз как с одноклеточными, так и с нитчатыми цианобактериями.
Лишайники
Благодаря изучению лишайников сформировалось само понятие симбиоза (А. де Бари). В лихенологии описано 26.000–27.000 видов этих организмов, которые являются симбионтами гриба и водоросли или цианобактерии. Зеленые водоросли входят в состав 80–85% видов, в остальных находятся цианобактерии. Гриб носит название микобионта, водоросль или цианобактерия – фико- или фотобионта. В талломах лишайника реализуются непрямой или приповерхностный контакт между симбионтами, или же гаустории гриба проникают в клетку водоросли. В двухкомпонентных лишайниках присутствует один вид фотобионта, но известны трехкомпонентные виды, формируемые грибом, зеленой водорослью и цианобактерией в качестве азотфиксатора. На поверхности таллома может находиться второй вид гриба из класса базидиомицетов [75]. Поэтому лишайники являются сложносоставными организмами, которые правильнее было бы называть симбиотической ассоциацией. Обнаружены актинолишайники, в которых прокариотный и эукариотный участники меняются ролями. Функции гриба выполняют прокариоты, за черты сходства с грибами названные актиномицетами, а роль фотобионта – зеленая водоросль, как в истинных лишайниках. Между фико- и микобионтом происходит обмен метаболитами, но отсутствует эндосимбионтное формирование пластид. Просматривается, однако, некая аналогия: цианобактерию-фитобионт можно сравнить с первичным эндосимбионтом, симбиоз с зеленой водорослью формально сравним со вторичным эндосимбиозом [76].
Приобретаемая автотрофия и клептопластия
Приобретенной автотрофией называется способность водных гетеротрофов заглатывать микроводоросли, длительно поддерживая их жизнеспособность. Там, где в экологических нишах есть недостаток хотя бы одного из органических метаболитов, появляются стимулы для сожительства с автотрофами. Их приобретение повышает выживаемость за счет циркуляции продуктов фотосинтеза в метаболических сетях клеток и тканей. Хозяин получает от врéменного “раба” дополнительный доступ к кислороду и низкомолекулярные, в том числе азотные, фотосинтаты, в ответ предоставляя СО2 от своей дыхательной деятельности. Происходит даже стимуляция фотосинтетической активности симбионтов, которыми служат диатомовые, хлорофитные и красные водоросли, динофлагелляты и гаптофиты [77]. Наряду с фотосинтетической деятельностью, водоросли сохраняются в вакуолях клеток хозяев как консервируемая пища. Благодаря огромной разнице в размерах микро- и макросимбионтов число заглотанных микроводорослей может доходить до 7.000–20.000 на клетку, хотя в среднем оно значительно меньше. Среди одноклеточных хозяев феномен приобретенной автотрофии охватывает прежде всего инфузорий (Rhizaria) и донных фораманифер (Foraminifera). Возможность замедлять переваривание жертвы за счет подавления протеаз, вероятно, дублирует начальные стадии феномена эндосимбиоза. Наиболее частый пример – симбиоз между ресничной инфузорией Paramecium bursaria и Chlorella sp. Если от проглоченной автотрофной клетки остаются только хлоропласты, они носят название клептопластов, а эффект их присвоения в целом называется клептопластией. Разные протисты могут сохранять приобретенные хлоропласты от 1–3 суток до 2 недель. Инфузория Myrionecta накапливает клептопласты, питаясь клетками криптомонад, и, в свою очередь, становится жертвой динофлагелляты Dinophysis, которая затем сохраняет их еще до двух месяцев. Тем самым, между приобретенной автотрофией, клептопластией и третичным эндосимбиозом границы размываются, но приобретенная автотрофия и клептопластия не сопровождаются массовым переносом генов от хлоропластов к ядру [78].
Многоклеточные хозяева микроводорослей встречаются среди различных видов Porifera (губки), Cnidaria (кораллы, анемоны, гидры), Mollusca (тридакны и голожаберники), Acoelomorpha (плоские черви) и даже у эмбрионов Chordata (асцидии). Наиболее известен ползающий моллюск Elysia chlorotica, эксплуатирующий клептопластиды поедаемых водорослей до 9 месяцев в своих покровных тканях [79].
Метаболическое разнообразие динофлагеллят
Динофлагелляты, или панцирные жгутиконосцы, отличаются фантастическими трофическими возможностями, заслуживая отдельного рассмотрения. К ним относится около 2500 современных видов (иные названия: динофи́ты, перидине́и, или Dinoflagellata, Dinophyta, Peridinea), входящих в надтип альвеолят (Alveolata). В этом таксоне протистов возможны все варианты перехода от хемогетеротрофии к истинному эндосимбиозу. 1) Около половины всех видов являются фотоавтотрофами, среди которых описаны симбионты двустворчатых моллюсков и кораллов, где они носят название зооксантелл. 2) Имеются утратившие пластиды бесцветные виды-гетеротрофы, в том числе паразитические формы. 3) Найдено несколько вторичногетеротрофных видов, утративших хлоропласты и приобретших их вновь от микроводорослей других групп (третичный эндосимбиоз, см. выше). 4) У многих видов хищных динофлагеллят практикуется клептопластия, временное сохранение пластид от поедаемых ими микроводорослей. Миксотрофия, то есть сочетание фототрофного и гетеротрофного метаболизма, является нередкой не только среди динофлагеллят, но и других представителей морского фитопланктона [78].
ЭВОЛЮЦИЯ ПЛАСТИД У ЦВЕТКОВЫХ РАСТЕНИЙ
Цветковые, или покрытосеменные, являются самой высокоорганизованной ботанической филой с телом растения, разделенным на вегетативные и генеративные органы, где пластиды претерпели ряд частных и общих изменений [37]. Современные базы генетических данных позволяют раздельно исследовать ядерную и пластомную филогению как крупных, так и мелких таксонов.
Два типа хлоропластов для С3 и С4 фотосинтеза
Фотосинтетики с выходом на сушу оказались в условиях возросшей инсоляции и нехватки воды. Для фотосинтетического усвоения СО2 в строме хлоропласта служит цикл Кальвина, сформированный еще у цианобактерий. Большинством цветковых растений используется С3-путь фиксации углерода, когда углекислый газ улавливается напрямую из воздуха, а растение из-за транспирации вынуждено терять до 97% воды, поступающей от корней. Закрытие устьиц уменьшает испарение, но стимулирует фотодыхание, ведя к потерям углерода и снижению эффективности фотосинтеза. У С4 растений в клетках мезофилла вместо CO2 фиксируется гидрокарбонат-ион, ${\text{HCO}}_{3}^{ - }$, и первым продуктом фотосинтеза служит вместо 3-фосфоглицерата С4-щавелевоуксусная кислота. В этом ферментном пути уменьшена потребность в Н2О, устьица на свету остаются открытыми и фотодыхание отсутствует. Проводящие пучки, доставляющие воду, окружены в листе двумя слоями морфологически различных зеленых клеток паренхимы, что названо кранц-анатомией (немецкое Kranz – корона, венец). Внешний слой образуют клетки мезофилла, а внутренний — меньшие по численности клетки обкладки сосудистого пучка. Перевод СО2 в растворимую форму происходит в наружных хлорофиллл-содержащих клетках, а повторная фиксация СО2 в цикле Кальвина – во внутреннем слое обкладки. В результате диморфизма во внешнем слое клеток находятся “обычные” хлоропласты с тилакоидами, разделенными на граны и строму, а хлоропласты обкладки имеют меньшее число гран и меньшее содержание ФС II.
Эволюционный возраст С4-фотосинтеза составляет не более 30.000 лет, но в аридных зонах этот путь метаболизма неоднократно возникал в различных семействах цветковых, являясь ярким примером конвергентной эволюции [80]. С4-путь требует несколько большего расхода энергии, но подобные растения, в основном травы, обеспечивают до 30% наземного фотосинтеза. Известен также САМ-фотосинтез (метаболизм по типу толстянковых), который включает в себя некоторые ферменты С4-пути, но усвоение СО2 разделено не между клетками, а во времени. У САМ-растений в концентрирующем СО2 механизме используются ферменты фотодыхания [81].
Вегетативная гибридизация и видообразование
В дикой природе и в селекционном процессе межвидовая и межродовая гибридизация могут происходить за счет совместной передачи хлоропластов и цитоплазмы от одного вида к близкородственному, сочетаясь в гибридной клетке с его ядрами. (По всей видимости, эмпирически использовано в селекционной работе И.В. Мичуриным). В частности, для рода Heuchera показано, что природное видообразование благодаря появлению новых пластидно-ядерных комбинаций происходило неоднократно [82, 83].
Пластиды генеративных и вегетативных тканей и органов
У цветковых растений в мезофилле листьев хлоропласты имеют размеры 3–10 мкм. Пластиды других органов и тканей, выполняя иные функции, характеризуются разнообразием формы, размеров и окраски. В ботанической литературе подробно описаны их разновидности: 1) родоначальные органеллы-пропластиды в меристемах, семенах и яйцеклетках; 2) содержащие протохлорофиллид этиопласты выросших в темноте проростков; 3) окрашенные накопленными каротиноидами хромопласты цветков и плодов; 4) бесцветные лейкопласты запасающих органов, в зависимости от типа накапливаемых веществ называемые олеопластами, протеинопластами и амилопластами; 5) гравипласты тканей кончика корня и боковых ветвей; 6) геронтопласты с продуктами фотодеструкции хлорофилла в листопадных листьях; 7) таннопласты с накоплениями таннина [84].
ДНК всех типов пластид остается идентичной, то есть при формировании тех или иных органов растения увеличения или уменьшения размеров генома в пластидах не происходит. Дифференцированно меняется активность большинства генов, находящихся под контролем клеточного ядра. Многие пластиды способны к взаимопревращениям, что сопровождается изменениями мембран, состава пигментов, формы и размеров органелл. Этиопласты являются наиболее изученной разновидностью пластид благодаря прекрасной доступности для экспериментальных исследований. Были исследованы биосинтез протохлорофиллида, действие фотофермента протохлорофиллидоксидоредуктазы, накопление проламеллярных тел и их световое превращение в тилакоиды, развитие фотосинтетической активности и световая и гормональная регуляция зеленения [85, 86]. Сведения о других пластидах отстают от изучения этиопластов из-за нехватки молекулярно-генетических данных [87]. Изменения хлоропластов в зависимости от дифференциации тканей обнаруживаются, начиная с меристемных клеток макрофитных водорослей. Молекулярные механизмы развития хлоропластов, взаимопревращений разных типов пластид, как и природа сигналов от хлоропласта в ядро, еще остаются во многом открытыми вопросами.
Паразитические, насекомоядные и миксотрофные виды
До 1% всех цветковых растений составляют виды-паразиты и полупаразиты, утратившие или частично сохранившие хлорофилл и питающиеся c помощью гаусторий от других растений. Например, сем. Orobanchaceae (заразиховые) – облигатные паразиты с редуцированными листьями и корнями. Знаменитая раффлезия с самым большим цветком в мире относится к полным паразитам. В хвойных лесах северного полушария встречается бесхлорофилльный подъельник (Monotropa, сем вересковые), живущий за счет тесного симбиоза с грибами. В хищничество (насекомоядные растения) вовлечено меньшее число число видов, чем в паразитизм. Все они в меньшей степени, чем автотрофы, зависят от фотосинтеза. Пластиды всех подобных растений подвержены уменьшению размеров генома (до 70 т.п.н.) с утратой фотосинтетического аппарата [88].
ЗАКЛЮЧЕНИЕ
Исследователи всегда находили яркие образы для описания симбиогенеза хлоропластов, которых называли “маленькими зелеными рабами клетки” (К.С. Мережковский), “проглоченными и не переваренными” (P.J. Keeling) и “продуктом шопинга для эукариотов” (A.W.D. Larkum). К настоящему времени сложилось понимание, что роль симбиогенеза в происхождении и развитии клеточной жизни выходит за рамки появления отдельных органелл. Симбиотические отношения, начиная с синтрофии ранних микроорганизмов, пронизывают все процессы взаимодействий в экосистемах. Возникла симбиогенетика как новая биологическая дисциплина; симбиогенез, параллельный перенос генов и сигнальные внутриклеточные и межклеточные взаимодействия лежат в основе развития жизни.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-14-50366.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Mereschkowsky C. Über Natur und Ursprung der Chromatophoren im Pflanzenreiche // Biol. Centralbl. 1905. B. 25. S. 593.
Мережковский К.С. Теория двух плазм, как основа симбиогенезиса, нового учения о происхождении организмов // Казань: Типо-лит. Имп. ун-та., 1909. 94 с.
Хахина Л.Н. Проблема симбиогенеза. Л.: Наука, 1979. 156 с.
Колчинский Э.И. Единство эволюционной теории в разделенном мире ХХ века. СПб.: Нестор-История, 2015. 822 с.
Gibbs S.P. The evolution of algal chloroplasts // Origins of plastids: Symbiogenesis, prochlorophytes and the origins of chloroplasts / Ed. by R.A. Lewin. Springer-Science+Business Media, 1993. P. 107.
Archibald J.M. Endosymbiosis and eukaryotic cell evolution // Curr. Biol. 2015. V. 25. P. 911.
Martin W., Kowallik K.W. Annotated english translation of Mereschkowsky’s 1905 paper “Über Natur und Ursprung der Chromatophoren im Pflanzenreiche” // Eur. J. Phycol. 1999. V. 34. P. 287.
Стрельникова Н.И. Мережковский К.С. и его работы по диатомовым водорослям (к 150-летию со дня рождения) http://www.ksu.ru/conf/botan200/s183.rtf
Захаров И.А. 100 лет теории симбиогенеза // Вестник ВОГиС. 2009. Т. 13. С. 355.
Проворов Н.А. К.С. Мережковский и происхождение эукариотической клетки: 111 лет теории симбиогенеза // Сельхозяйственная биология. 2016. Т. 51. С. 746.
Федонкин М.А. Сужение геохимического базиса жизни и эвкариотизация биосферы: причиннная связь // Палеонтологический журнал. 2003. № 6. С. 33.
Розанов А.Ю. Бактериальная палеонтология, седиментогенез и ранние стадии эволюции биосферы // Труды ГИН РАН. М. 2004. Вып. 565. С. 448.
Woese C.R., Kandler O., Wheelis M.L. Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya // Proc. Natl Acad. Sci. USA. 1990. V. 87. P. 4576.
MacLeod F., Gareth S. Kindler G.S., Wong H.L., Chen R., Burns B.P. Asgard archaea: diversity, function, and evolutionary implications in a range of microbiomes // AIMS Microbiology. 2019. V. 5. P. 48. https://doi.org/10.3934/microbiol.2019.1.48
Yutin N., Wolf M.Y., Wolf Y.I., Koonin E.V. The origins of phagocytosis and eukaryogenesis // Biology Direct. 2009. V. 4. P. 9. https://doi.org/10.1186/1745-6150-4-9
Шестаков С.В. Роль архей в происхождении эукариот // Экологическая генетика. 2017. Т. 15. С. 52. https://doi.org/10.17816/ecogen15452-59
Martijn J., Vosseberg J., Guy L., Offre P., Ettema T.J.G. Deep mitochondrial origin outside the sampled alphaproteobacteria // Nature. 2018. V. 557. P. 101.
Lypez-Garcìa P., Móreira D. The syntrophy hypothesis for the origin of eukaryotes revisited // Nature Microbiol. 2020. V. 5. P. 655.
Горленко В.М. Аноксигенные фототрофные бактерии // Труды института микробиологии им. С.Н. Виноградского. М. 2010. Bып. XV. С. 133.
Wachterschauser G. From volcanic origins of chemoautotrophic life to Bacteria, Archaea and Eukarya // Philosophical Transactions Roy. Soc. B: Biol. Sci. 2006. V. 361. P. 1787.
Schopf J.W., Kudrjavtsev A.B., Agresti D.G., Wdowiak T., Czaja F.D. Laser-raman imagery of Earth’s earliest fossils // Nature. 2003. V. 416. P. 73.
Schirrmeister B.E., Gugger M., Donoghue P.C.J. Cyanobacteria and the great oxidation event: evidence from genes and fossils // Palaeontology. 2015. V. 58. P. 769.
Nelson N., Junge W. Structure and energy transfer in photosystems of oxygenic photosynthesis // Annu. Rev. Biochem. 2015. V. 84. P. 659.
Стадничук И.Н., Красильников П.М., Зленко Д.В. Фикобилисомы и фикобилипротеины цианобактерий // Микробиология. 2015. Т. 84. С. 131.
Стадничук И.Н., Тропин И.В. Замена антенны в эволюционной истории хлоропластов // Микробиология. 2014. Т. 83. С. 385.
Keely B.G. Geochemistry of chlorophylls // Chlorophylls and Bacteriochlorophylls / Eds. Grimm B., Porra R.J., Rüdiger W., Scheer H. Springer, Dordrecht, 2006. P. 535.
Granick S. Speculations on the origins and evolution of photosynthesis // Ann. N.Y. Acad. Sci. 1957. V. 69. P. 292.
Beale S.I. Enzymes of Chlorophyll Biosynthesis // Photosynth. Res. 1999. V. 60. P. 43.
Oster U., Tanaka R., Tanaka A., Rüdiger W. Cloning and functional expression of the gene encoding the key enzyme for chlorophyll b biosynthesis (CAO) from Arabidopsis thaliana // Plant J. 2000. V. 21. P. 305.
Саут Р., Уиттик А. Основы альгологии. Москва: Мир, 1990. 595 с.
Кусакин О.Г., Дроздов А.Л. Филема органического мира. Ч. 2. Prokaryota, Eukaryota. СПб.: Наука, 1987. 381 с.
Хаусман К., Хюльсман Н., Радек К. Протистология. Москва: Товарищество научн. изданий КМК, 2010. 495 с.
Cavalier-Smith T. Kingdom Chromista and its eight phyla: a new synthesis emphasising periplastid protein targeting, cytoskeletal and periplastid evolution, and ancient divergences // Protoplasma. 2017. V. 255. P. 297. https://doi.org/10.1007/s00709-017-1147-3
Burki F., Okamoto N., Pombert J.F. Keeling P.J. The evolutionary history of haptophytes and cryptophytes: phylogenomic evidence for separate origins // Proc. Biol. Sci. 2012. V. 279. P. 2246. https://doi.org/10.1098/rspb.2011.2301
Keeling P.J. The endosymbiotic origin diversification and fate of plastids // Philos. Trans. R. Soc. 2010. V. 365. P. 792.
Sánchez-Baracaldo P., Raven J.A., Pisani D., Knoll A.H. Early photosynthetic eukaryotes inhabited low-salinity habitats // Proc. Natl. Acad. Sci. USA. 2017. V. 114: e7737.
Donoghue P., Paps J. Plant evolution: assembling land plants // Current Biology. 2020. V. 30. P. R81. https://doi.org/10.1016/j.cub.2019.11.084
Lhee D., Ha J.-S. Kim S., Park M.G., Bhattacharya D., Yoon H.S. Evolutionary dynamics of the chromatophore genome in three photosynthetic Paulinella species // Sci. Reports. 2019. V. 9. 1https://doi.org/10.1038/s41598-019-38621-8
Gibbs S.P. The chloroplast of some algal groups may evolved from endosymbiotic eukaryotic algae // Ann. N.Y. Acad. Sci. 1981. V. 361. P. 193.
Archibald J.M. The puzzle of plastid evolution // Current Biol. 2009. V. 19. P. R81.
Ludwig M., Gibbs S.P. Evidence that the nucleomorphs of Chlororachnion reptans (Chlororachniophyceae) are vestigal nuclei: morphologi, division and DNA-DAPI fluorescence // J. Phycol. 1989. V. 25. P. 385.
Luo Z., Hu Z., Tang Y., Mertens K.N., Leaw C.P., Lim P.T., Teng S.T., Wang L., Gu H. Morphology, ultrastructure, and molecular phylogeny of Wangodinium sinense Gen. Et Sp. Nov. (Gymnodiniales, Dinophyceae) and revisiting of Gymnodinium dorsalisulcum and Gymnodinium impudicum // J. Phycol. 2018. V. 54. P. 744. https://doi.org/10.1111/jpy.12780
Sheiner L., Vaidya A.B., McFadden G.I. The metabolic roles of the endosymbiotic organelles of Toxoplasma and Plasmodium spp. // Curr. Opin. Microbiol. 2013. V. 16. P. 452.
Striepen B. The apicoplast: a red alga in human parasites // Essays Biochem. 2011. V. 51. P. 111. https://doi.org/10.1042/BSE0510111
Smith D. R., Lee R.W. A Plastid without a genome: evidence from the nonphotosynthetic green algal genus Polytomella // Plant Physiol. 2014. V. 164. P. 1812.
Larkum A.W.D. Light-harvesting systems in algae // Photosynthesis of Algae / Eds. A.W.D. Larkum, S.E. Douglas, J.A. Raven. Dordrecht: Kluwer Acad. Publ., 2003. P. 277.
Tomo T., Allakhverdiev S.I. The divergence of chlorophyll and photosynthetic reactions in chlorophyll d‑containing algae // Современные проблемы фотосинтеза / Под ред. С.И. Аллахвердиева, А.Б. Рубина, В.А. Шувалова. Москва-Ижевск, 2014. Т. II. С. 115.
Averina S.G., Velichko N.V., Pinevich A.A., Senatskaya E.V., Pinevich A.V. Non-a chlorophylls in cyanobacteria // Photosynthetica. 2019. V. 57. P. 1109.
Raven J.A. Photosynthesis in watercolours // Nature. 2007. V. 448. P. 418.
Glazer A.N. Light guides. Directional energy transfer in a photosynthetic antenna // J. Biol. Chem. 1989. V. 264. P. 1.
Raven J.A. A cost-benefit analysis of photon absorption by photosynthetic unicells // New Phytol. 1984. V. 98. P. 274.
Горшкова Т.А. Растительная клеточная стенка как динамичная система. Москва: Наука, 2007. 428 с.
Sarkar P., Bosneaga E., Auer M. Plant cell walls throughout evolution: towards a molecular understanding of their design principles // J. Exp. Bot. 2009. V. 60. P. 3615.
Yong W., O’Malley R., Link B. Plant cell wall genomics // Planta. 2005. V. 221. P. 745.
Кузнецов В.В. Структура и экспрессия хлоропластного генома // Физиология растений. 2018. Т. 65. С. 243.
Martin W., Rujan T., Richly E., Hansen A., Cornelsen S., Lins T., Leister D., Stoebe B., Hasegawa M., Penny D. Evolutionary analysis of Arabidopsis, cyanobacterial, and chloroplast genomes reveals plastid phylogeny and thousands of cyanobacterial genes in the nucleus // Proc. Natl. Acad. Sci. USA. 2002. V. 99. P. 12246.
Nakayama T., Archibald J.M. Evolving a photosynthetic organelle // BMC Biol. 2012. https://doi.org/10.1186/1741-7007-10-35
Ponce-Toledo R.I., López-Garcıa P., Moreira D. Horizontal and endosymbiotic gene transfer in early plastid evolution // New Phytologist. 2019. V. 224. P. 618. https://doi.org/10.1111/nph.15965
Matsuo M., Ito Y., Yamauchi R., Obokata J. The rice nuclear genome continuously integrates, shuffles, and eliminates the chloroplast genome to cause chloroplast–nuclear DNA flux // The Plant Cell. 2005. V. 17. P. 665.
Allen J.F. The CoRR hypothesis for genes in organelles // J. Theor. Biol. 2017. V. 434. P. 50. https://doi.org/10.1016/j.jtbi.2017.04.008
Tripathi D., Oldenburg D.J., Nam A., Bendich A.J. Reactive oxygen species, antioxidant agents, and DNA damage in developing maize mitochondria and plastids // Frontiers in Plant Science. 2020. https://doi.org/10.3389/fpls.2020.00596
Bendich A.J. Why do chloroplasts and mitochondria contain so many copies of their genome? // Bioessays. 1987. V. 6. P. 279. https://doi.org/10.1002/bies.950060608
Даниленко Н.Г., Давыденко О.Г. Миры геномов органелл. Минск: Тэхналогiя, 2003. 494 с.
Ling Q., Jarvis P. Regulation of chloroplast protein import by the ubiquitin E3 ligase SP1 is important for stress tolerance in plants // Current Biology. 2015. V. 25. P. 1.
Юрина Н.П., Одинцова М.С. Ретроградная сигнальная система хлоропластов // Физиология растений. 2019. Т. 66. С. 243.
Pfannschmidt T., Terry M.J., Van Aken O., Quiros P.M. Retrograde signals from endosymbiotic organelles: a common control principle in eukaryotic cells // Phil. Trans. R. Soc. B. 2020. V. 375. 20190396. https://doi.org/10.1098/rstb.2019.0396
Krupinska K., Blanco N.E., Oetke S., Zottini M. Genome communication in plants mediated by organelle–nucleus-located proteins // Phil. Trans. R. Soc. B. 2020. V. 375: e 20190397. https://doi.org/10.1098/rstb. 2019.0397
Синетова М.А., Лось Д.А. Уроки транскриптомики цианобактерий: универсальные гены // Мол. биология. 2016. Т. 50. С. 685.
Константинов Ю.М., Дитриш А., Вебер-Лотфи Ф., Ибрагим Н., Клименко Е.С., Тарасенко В.И., Болотова Т.А., Кулинченко М.В. Импорт ДНК в митохондрии // Биохимия. 2016. Т. 81. С. 1307.
Zilberg-Rosenberg J., Rosenberg E. Role of microorganisms in the evolution of animals and plants: the hologenome theory of evolution // FEMS Microbiol. Rev. 2008. V. 32. P. 723.
Murakami A., Miyashita H., Iseki M., Adachi K., Mimuro M. Chlorophyll d in an epiphytic cyanobacterium of red algae // Science. 2004. V. 303. P. 1633.
Nakayama T., Kamikawa R., Tanifuji G., Kashiyama Y., Ohkouchi N., Archibald J.M., Inagaki Y. Complete genome of a nonphotosynthetic cyanobacterium in a diatom reveals recent adaptations to an intracellular lifestyle // Proc. Natl. Acad. Sci. 2014. V. 111. P. 11407.
Adams D.G., Bergman B., Nierzwicki-Bauer S.A., Duggan P.S., Rai A.N., Schüßler A. Cyanobacterial-Plant Symbioses // The Prokaryotes / Eds. Rosenberg E., DeLong E.F., Lory S., Stackebrandt E., Thompson F. Springer, 2002. P. 359.
Пиневич А.В., Аверина С.Г., Величко Н.В. Очерки биологии прохлорофитов. С.-Петербург: Изд-во СПб ун-та, 2010. 197 с.
Tuovinen V., Ekman S., Thor G., Vanderpool D., Spribille T., Johannesson H. Two basidiomycete fungi in the cortex of wolf lichens // Current Biol. 2019. V. 29. P. 476.
Spribille T. Lichen symbionts outside of symbiosis: how do they find their match? A commentary on: ‘A case study on the re-establishment of the cyanolichen symbiosis: where do the compatible photobionts come from?’ // Annals Botany. 2019. V. 124. P. 379.
Johnson M.D. The acquisition of phototrophy: adaptive strategies of hosting endosymbionts and organelles // Photosynth. Res. 2011. V. 107. P. 117. https://doi.org/10.1007/s11120-010-9546-8
Stoecker D.K., Hansen P.J., Caron D.A., Mitra A. Mixotrophy in the Marine Plankton // Ann. Rev. Mar. Sci. 2017. V. 9. P. 311.
Клочкова Т.А. Обзор явления клептопластии у морских заднежаберных моллюсков // Вестник КамчатГТУ. 2016. № 37. С. 57. https://doi.org/10.17217/2079-0333-2016-37-57-69
Sage R.F., Stata M. Photosynthetic diversity meets biodiversity: The C4 plant example // Plant Physiol. 2015. V. 172. P. 104.
Иванищев В.В. Эволюционные аспекты С4-фотосинтеза // Известия ТулГУ. Естественные науки. 2017. Вып. 3. С. 64.
Folk R.A., Soltis P.S., Soltis D.E., Guralnick R. New prospects in the detection and comparative analysis of hybridization in the tree of life // Am. J. Bot. 2018. V. 105. P. 364.
Kiu L.-X., Du Y.-X., Folk R.A., Wang S.-Y., Soltis D.E., Shang F.-D., Li P. Plastome evolution in Saxifragaceae and multiple plastid capture events involving Heuchera and Tiarella // Front. Plant Sci. 2020. https://doi.org/10.3389/fpls.2020.0036183
Brillouet J.M., Romieu C., Schoefs B., Solymosi K., Cheynier V., Fulcrand H., Verdeil J.L., Conéjéro G. The tannosome is an organelle forming condensed tannins in the chlorophyllous organs of Tracheophyta // Annals Botany. 2013. V. 112. P. 1003.
Беляева О.Б., Синещеков В.А. Регуляция биосинтеза хлорофилла а фитохромом // Биохимия. 2019. Т. 84. С. 648.
Кузнецов В.В., Дорошенко А.С., Кудрякова Н.В., Данилова М.Н. Роль фитогормонов и света в процессе деэтиоляции // Физиология растений. 2020. Т. 67. С. 563.
Jarvis P., López-Juez E. Biogenesis and homeostasis of chloroplasts and other plastids // Nat. Rev. Mol. Cell Biol. 2014. V. 27. P. 787.
Westwood J.H., Yoder J.I., Timko M.P., de Pamphilis C.W // Evolution of parasitism in plants // Trends Plant Sci. 2010. V. 15. P. 227.
Филюшин М.А., Кочиева Е.З., Щенникова А.В., Белецкий А.В., Марданов А.В., Равин Н.В., Скрябин Н.Г. Профиль экспрессии генов унипортеров семейства SWEET в процессе развития ловчих аппаратов плотоядного растения Nepenthes sp. // Генетика. 2019. Т. 55. С. 655.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


