Физиология растений, 2021, T. 68, № 3, стр. 227-244
Перспективные биотехнологии: коллекции культур клеток высших растений как основа разработки и производства лекарственных препаратов
Е. В. Попова a, *, А. В. Носов a, М. В. Титова a, Д. В. Кочкин a, b, А. А. Фоменков a, И. Е. Куличенко a, А. М. Носов a, b
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
b Федеральное государственное бюджетное образовательное учреждение высшего образования
Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: elena_aygol@hotmail.com
Поступила в редакцию 31.08.2020
После доработки 10.10.2020
Принята к публикации 10.10.2020
Аннотация
В обзоре рассматриваются принципы становления и формирования коллекций культур клеток и тканей высших растений in vitro как варианта генетических коллекций, анализируются современное состояние и перспективные возможности использования коллекций в исследованиях особенностей и закономерностей синтеза биологически активных веществ высших растений, рассматривается важная роль коллекций в биотехнологических производствах субстанций для лекарственных препаратов, обсуждаются методы поддержания и сохранения стабильности культур клеток в процессе длительного культивирования. Особое внимание уделяется ретроспективному и современному состоянию Всероссийской коллекции культур клеток высших растений, основателем которой была член-корреспондент РАН Р.Г. Бутенко.
ГЕНЕТИЧЕСКИЕ КОЛЛЕКЦИИ И ИХ РОЛЬ В СОХРАНЕНИИ БИОРАЗНООБРАЗИЯ
В современном мире остро стоит проблема сохранения генетических ресурсов. Подходы к ее решению разрабатываются как на уровне отдельных отраслей (сельское хозяйство, биотехнология, экология, лесное хозяйство), так и в национальном и в мировом масштабах. Сохранение генетического разнообразия семян и культивируемых растений, в том числе “посредством содержания разнообразных (их) банков на национальном, региональном и международном уровнях, и расширение доступа к ним”, является одной из основных задач Цели 2 “Ликвидация голода” – одной из 17 целей устойчивого развития ООН. Во всем мире активно развиваются коллекции ex situ: генетические банки и ботанические сады, где в созданных человеком условиях сохраняются ценные генотипы культурных растений, их дикорастущих сородичей, а также редких и исчезающих природных видов. В 2010 г. по данным ФАО в мире насчитывалось 1750 генетических банков, в которых сохранялось 7.4 млн образцов только сельскохозяйственных культур [1]. Более 90% таких коллекций составляют ортодоксальные семена, чья долговечность (longevity) предсказуемо увеличивается с понижением температуры и влажности [2]. Международные стандарты сохранения семян (7% влажности, –18°С) легко достижимы практически в любой точке мира. Классическим примером является международное хранилище в Свальбарде (Норвегия), где в условиях вечной мерзлоты хранится более миллиона дубликатов образцов семян сельскохозяйственных культур [3]. Однако для целого ряда культурных и дикорастущих видов использование семенных банков для сохранения генетических ресурсов невозможно или нецелесообразно. К ним относятся растения, которые в ходе одомашнивания потеряли способность производить семена, а также культурные сорта, чьи уникальные характеристики передаются только путем вегетативного размножения [4]. Для семян многих редких и исчезающих видов характерна низкая всхожесть даже при оптимальных условиях [5]. К “проблемным” также можно отнести виды, семена которых быстро теряют всхожесть при температурах, рекомендованных ФАО для длительного хранения или не выносят дегидратацию. Это большинство тропических и субтропических видов, многие древесные виды и виды, производящие семена с высоким содержанием липидов [6]. Такие виды обычно поддерживаются в виде растений на полях или в ботанических садах, а также в коллекциях in vitro (в стерильных контролируемых условиях на искусственных питательных средах) и в криобанках в жидком азоте (–196°С) или его парах [2, 4, 5, 7]. Однако, несмотря на значительные успехи в разработке и оптимизации технологий in vitro и криосохранения, масштабное применение этих методов для сохранения генофонда вегетативно размножаемых растений до сих пор ограничено. Согласно анализу 2017 г. [8], 66% вегетативно размножаемых сельскохозяйственных культур все еще сохраняется в полевых коллекциях, 46% in vitro и только 16% в криобанках. При этом только для восьми культур число образцов в криобанках превышает 100. Из зарегистрированных в онлайн системе BGCI 3679 ботанических садов и институтов, 466 содержат банки семян, и только 172 имеют функционирующие лаборатории для размножения и сохранения растений in vitro, а криосохранением занимаются лишь единичные группы [9]. Особую озабоченность вызывает отсутствие надежного длительного хранения для дубликатов образцов вегетативно размножаемых культур, аналогичного хранилищу в Свальбарде [8]. Таким образом, в настоящий момент многие вегетативно размножаемые культурные сорта, а также редкие и исчезающие виды с неортодоксальными семенами находятся в группе повышенного риска, учитывая высокую стоимость поддержания полевых коллекций (до $200 за образец в год) с одной стороны, а также риски безвозвратной потери уникального генетического материала, не продублированного в условиях in vitro или криосохранения, из-за природных катаклизмов, болезней и вредителей, да и просто человеческой ошибки – с другой [8, 10].
Особую группу генетических банков составляют коллекции культур изолированных клеток и органов растений, такие как коллекции эмбриогенных культур, адвентивных и трансформированных (“бородатых”, или “hairy roots”) корней и культур недифференцированных клеток. Эти коллекции исторически создавались не только для сохранения растительного биоразнообразия, но прежде всего – как депозитарии потенциально ценных линий для биотехнологических производств и фармакологии, о чем будет сказано ниже. Очевидно, что такие культуры были созданы и существуют только в условиях in vitro, и для их поддержания целесообразно использовать только коллекции in vitro и криосохранение, то есть те же методы, которые применяются и для вегетативно размножаемых растений [4, 6, 8, 11, 12]. В данном обзоре, посвященном прежде всего коллекциям культур клеток высших растений, рассматривается связь между двумя самостоятельными концепциями – (1) концепцией биобанкирования и генетических коллекций, с одной стороны, и (2) концепцией Hi-Tech биотехнологий на основе культуры клеток, с другой. На основе российского и мирового опыта рассматриваются принципы формирования коллекций культур клеток, их история и современное состояние, а также использование культур клеток в биотехнологических производствах. Особое внимание уделяется роли Р.Г. Бутенко как основателя данного направления в России и созданной ею Всероссийской коллекции культур клеток высших растений (ВККК ВР).
КУЛЬТУРА РАСТИТЕЛЬНЫХ КЛЕТОК И ТКАНЕЙ – РАЗВИТИЕ КОНЦЕПЦИИ И ФОРМИРОВАНИЕ КОЛЛЕКЦИЙ
Ключевое понятие предлагаемого обзора – культура клеток высших растений, которая представляет собой пул соматических клеток, выращиваемых in vitro на искусственной питательной среде в стерильных контролируемых условиях. Традиционно единицей формирования коллекции считается клеточный штамм (линия), то есть популяция клеток, обладающая уникальными только для нее ростовыми, биосинтетическими, цитогенетическими и молекулярно-генетическими характеристиками. История зарождения и развития культуры клеток растений и тесно связанная с ней история биотехнологии растений детально изложены в ряде публикаций [13–15] и не являются предметом рассмотрения данного обзора. Однако для понимания принципов формирования коллекций культур клеток растений необходима рекапитуляция важнейших моментов становления метода.
В основе культуры клеток лежит идея тотипотентности – возможности хранения в клетках “памяти” о функциональном потенциале всего организма – сформировавшаяся как результат коллективных наблюдений, исследований и прогнозов микроскопистов, ботаников и анатомов конца XVIII – начала XIX века. Отправной точкой для экспериментов по культивированию клеток животных и растений in vitro стали эксперименты Vöchting, показавшие, что мельчайшие фрагменты стеблевых черенков или таллома некоторых видов способны к регенерации [16, 17]. Придя к выводу о тотипотентности клеток, Vöchting предложил исследовать это свойство: выращивать клетки изолированно на искусственной питательной среде, чтобы оградить их от влияния соседних клеток. Однако основателем культуры клеток растений in vitro как отдельного научного направления справедливо считается немецкий ботаник Haberlandt, который первым попытался получить экспериментальные доказательства тотипотентности путем культивирования растительных клеток в питательных растворах в надежде на регенерацию целых растений [18]. Дифференцированные палисадные клетки яснотки, клетки железистых волосков медуницы и крапивы, клетки волосков тычиночных нитей традесканции и другие виды клеток растений увеличивались в размерах, но не делились и, в конце концов, культуры были потеряны из-за инфекции.
Начало системных работ по культурам клеток и тканей во многом было связано с открытием фитогормонов. Gautheret [19] (рис. 1в) и Nobecourt [20] во Франции и White [21] в США независимо получили первые культуры растительных тканей на полностью синтетических средах на основе раствора Кнопа с добавлением глюкозы или сахарозы, тиамина, глицина и недавно открытого фитогормона – индолилуксусной кислоты. Получение Miller и Skoog кинетина [22], важнейшего синтетического цитокинина и компонента большинства современных питательных сред, позволило значительно расширить видовой и тканевой спектры эксплантов растений для культивирования in vitro. В конце 50-х годов XX века, согласно классической монографии Готре [23], список культур клеток и тканей растений включал уже 142 вида. В 1957 г. директор Института физиологии растений АН СССР (ныне ИФР РАН) академик А.Л. Курсанов после посещения лаборатории, руководимой Готре, предложил Р.Г. Бутенко развивать это направление в ИФР РАН. В конце 50-х – середине 60-х годов Р.Г. Бутенко с немногочисленными сотрудниками получила каллусные культуры из разных тканей более десятка видов растений. Интересуясь лекарственными растениями и, возможно, наблюдая за относительно быстрым ростом культивируемых клеток и его независимостью от внешних природных условий, Р.Г. Бутенко приступила к получению культуры клеток медленно растущих ценных лекарственных растений, таких как женьшень настоящий, а также растений, не встречающихся во флоре СССР. Впервые в мире были получены культуры клеток Panax ginseng (рис. 1г), других представителей рода Panax spp., Rauwolfia serpentina, Dichroa febrifuga, Catharanthus roseus и др. [24–28]. В 1965 году при Группе культуры тканей и морфогенеза ИФР РАН была создана Коллекция культур клеток и тканей растений. В 1978 году [29], значительно расширив свои фонды, Всероссийская коллекция культур клеток высших растений (ВККК ВР) вошла в состав Российской коллекции клеточных культур человека, животных и растений (РККК).
Рис. 1.
Каллусные и суспензионные культуры клеток высших растений: (а) каллусная культура Cladocheta candidissima*; (б) световая каллусная культура Sutherlandia frutescens*; (в) каллусная культура, полученная из корнеплода Daucus carota R. Gautheret в 1937 г. и более 63 лет поддерживаемая в пересадочной культуре; источник – Le Conservatoire botanique national du Bassin parisien (http://cbnbp.mnhn.fr/cbnbp/actualites/evenement.jsp), фотография Bernard Faye; (г) культура ткани корня Panax ginseng, клон получен Р.Г. Бутенко в 1959 г., фотография из работы [28]; (д) каллусная культура Mandragora turcomanica*; (е) каллусная культура Pancratium maritimum*; (ж) суспензионная миксотрофная культура Arabidopsis thaliana** (задний план) и суспензионная световая культура Euonymus maximowiczianus* (передний план); (з) клетки суспензионной культуры Taxus baccata**; (и) клетки суспензионной культуры Dioscorea deltoidea**; (к) суспензионная гетеротрофная культура Arabidopsis thaliana**; (л) клетки суспензионной световой культуры Euonymus maximowiczianus*; (м) клетки суспензионной культуры Panax japonicus**; (н) клетки гетеротрофной суспензионной культуры Arabidopsis thaliana**; (о) клетки суспензионной культуры Ajuga turkestanica*. Масштабная линейка (50 мкм) приведена на (о) и одинакова для всех фотографий клеток. * – штаммы Отдела биологии клетки и биотехнологии ИФР РАН, не депонированные в ВККК ВР; ** – штаммы Всероссийской коллекции культур клеток высших растений (ВККК ВР).

В период перехода от этапа проверки концепции культуры клеток и тканей растений к ее становлению как важного и полезного инструмента для исследований и манипуляций с растениями и их клетками у исследователей всего мира формировались локальные рабочие коллекции линий и штаммов клеток. С одной стороны, видовой состав этих коллекций определялся конкретными задачами фитопатологии и физиологии растений [23, 24, 26, 30], с другой стороны, был осознанный выбор растений, связанный с их химическим составом, представляющих интерес для фармацевтики и других отраслей промышленности [25, 31]. С 60-х и вплоть до начала 80-х годов XX века число публикаций с упоминанием культур клеток растений постоянно росло и, безусловно, в пополнении списка тон задавали школы Р. Готре, Ф. Уайта, А. Хильдебрандта, Ф. Скуга, Х. Стрита, О. Гамборга, и, конечно, Р. Бутенко. Так формировались коллекции культур клеток и тканей растений in vitro, ставшие важным инструментом как для фундаментальных исследований, так и для практического использования.
КОЛЛЕКЦИИ КУЛЬТУР КЛЕТОК ВЫСШИХ РАСТЕНИЙ – СОВРЕМЕННОЕ СОСТОЯНИЕ
До середины 60-х годов XX века коллекции формировались в научных лабораториях в университетах и научных институтах, и исследователи, работавшие с культурами клеток, могли свободно получить тот или иной штамм культивируемых клеток для научных целей. К сожалению, важной современной особенностью состояния коллекций штаммов культур клеток высших растений является практически полное отсутствие информации о них в открытых источниках. В частности, в списке членов Европейской Ассоциации коллекций культур (ЕССО) (https://www.eccosite.org/ members/) на данный момент значатся всего две национальные коллекции культур клеток растений – немецкая (http://www.dsmz.de) и финская (http://culturecollection.vtt.fi/). Функционирует японская коллекция культур клеток растений (https://epd.brc.riken.jp/en/pcellc). Более детальная информация о коллекциях культур клеток высших растений представлена в табл. 1.
Таблица 1.
Информация о некоторых мировых коллекциях культивируемых клеток растений
| Страна, название, принадлежность коллекции | Число таксонов, число линий/штаммов культур клеток растений | Комментарии | Ссылка |
|---|---|---|---|
| Германия, Leibniz Institute DSMZ-German Collection of Microorganisms and Cell Cultures, частная с правительственным наблюдательным советом | более 80 семейств; более 700 линий культур клеток растений на 2019 г. | в апреле 2019 г. в каталоге значилась 41 линия клеток растений [36] | https://www.dsmz.de/ |
| Финляндия, VTT Culture Collection, полугосударственная | 23 вида растений; 25 каллусных культур, 22 суспензионные культуры, 12 линий бородатых корней | для каждого штамма приведена основная информация | http://culturecollection.vtt.fi/ |
| США, Массачусетс, Plant Cell Culture Library UMass Amherst, университет | более 1000 видов растений; все образцы заявлены как каллусные культуры клеток | для каждого штамма приведена основная информация | https://www.umass.edu/ials/pccl-database |
| Япония, RIKEN BRC Plant Cultured Cell Resources, полугосударственная | 32 вида растений; 38 каллусных культур, 22 суспензионные культуры | на каждый штамм имеется очень подробный паспорт и дополнительная документация | https://epd.brc.riken.jp/en/pcellc |
| Украина, Банк клеточных культур in vitro Института клеточной биологии и генетической инженерии НАН Украины, полугосударственная | более 2000 линий культур клеток растений | – | http://germplasm.icbge.org.ua/en/ |
| Венгрия, Tissue culture collection Department of Botany University of Debrecen, университет | 26 видов растений; 28 каллусных культур | информация из публикации | http://abs.bibl.u-szeged.hu/index.php/abs/ article/view/2784 [37] |
| Чехия, Сollection of in vitro plant cell cultures, Institute of Experimental Botany of CAS, институт | более 20 видов растений; 500 отобранных штаммов или клонов | – | http://lpb.ueb.cas.cz/About.html |
Сложившаяся ситуация объясняется, по-видимому, несколькими причинами. Поддержание пересадочных коллекций культур клеток растений – процесс трудоемкий и дорогой. Вероятно, это стало одной из причин существенного сокращения числа активно поддерживаемых коллекций культур клеток высших растений в настоящее время по сравнению с 70–80 гг. прошлого века, а среди оставшихся превалируют коллекции, имеющие государственную финансовую поддержку. Обширные коллекции культур клеток поддерживаются также некоторыми биотехнологическими и биофармацевтическими компаниями, о чем говорят их рекламные материалы, однако подробной информации о составе таких коллекций в открытом доступе найти не удалось.
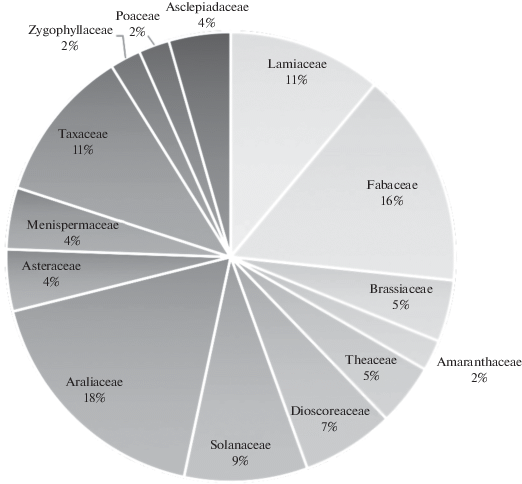
Среди мировых коллекций ВККК ВР (далее Коллекция) выделяется как по разнообразию, так и по возрасту сохраняемых образцов. В настоящий момент в Коллекции поддерживаются в активном состоянии 47 линий культур клеток 29 видов высших растений, из них 19 линий поддерживаются в виде каллусных культур и 32 линии в виде суспензионных культур (некоторые культуры дублированы в каллусах и суспензиях). Поддерживаемые культуры клеток включают как модельные штаммы, которые служат объектами для фундаментальных исследований по физиологии растений, так и штаммы-продуценты биологически активных соединений (гинзенозидов и других тритерпеновых гликозидов, стероидных гликозидов фуростанолового ряда, фенольных соединений и некоторых других), а также штаммы редких и эндемичных видов растений. Среди них штаммы-сверхпродуценты диоскореи дельтовидной (содержание фуростаноловых гликозидов до 12% к сухой биомассе клеток), различных видов аралиевых (продуцентов тритерпеновых гликозидов), нескольких видов тиса (продуцентов противоопухолевых таксоидов) и других (табл. 2). Некоторые штаммы, например Beta vulgaris, Dioscorea deltoidea, Mandragora turcomanica, Medicago sativa поддерживаются методом пересадок в активной коллекции с 70-80-х гг. XX века. Наиболее представленными семействами на данный момент являются Araliaceae (8 линий), Fabaceae (7 линий), Lamiaceae (5 линий) и Taxaceae (5 линий) (рис. 2). Наличие в Коллекции различных видов растений одного и того же семейства, а также линий одного вида, полученных из одного экспланта, но культивируемых долгое время на средах с различным минеральным и фитогормональным составом позволяет проводить уникальные исследования по влиянию условий культивирования на рост культур, качественный и количественный состав вторичных соединений в них, а также исследовать внутри- и межвидовые закономерности биосинтеза в культуре изолированных клеток по сравнению с целым растением [32–35]. Ведется работа по пополнению Коллекции новыми культурами. Только в 2019 г. были получены 16 новых линий культур клеток 9 видов высших растений, являющихся эндемиками, редкими или лекарственными, в том числе, это культуры видов Dioscorea bulbifera, Polyscias filicifolia, Rubus arcticus, Rubus chamaemorus, Sutherlandia frutescens, Cladochaeta candidissima, Thuja occidentalis, Olea europaea, Alhagi persarum, Alcea kusjariensis. Совместно с научными группами других институтов проводится скрининг коллекционных культур на биологическую активность, для ряда штаммов-продуцентов биологически активных веществ (БАВ) ведутся исследования по токсикологии, что является следующим шагом к их применению в биотехнологии.
Таблица 2.
Некоторые штаммы, поддерживаемые в состоянии активного роста методом пересадок во Всероссийской Коллекции Культур Клеток Высших Растений ИФР РАН
| Видовое название | Традиционное название | Число линий | Происхождение | Год получения | Тип культуры | Назначение |
|---|---|---|---|---|---|---|
| Модельные культуры | ||||||
| Arabidopsis thaliana (L.) Heynh. | Резуховидка Таля | 2 | Листья | 2006, 2009 | Суспензия | Модельный объект |
| Beta vulgaris L. | Свекла обыкновенная | 1 | Корень | 1972 | Суспензия | Модельный объект |
| Nicotiana tabacum L. | Табак обыкновенный | 2 | Стеблевая паренхима | Суспензия | Модельный объект | |
| Triticum timopheevii Zhuk. | Пшеница Тимофеева | 1 | Зародыш | 1986 | Суспензия | Модельный объект |
| Культуры-продуценты | ||||||
| Dioscorea deltoidea Wall. | Диоскорея дельтовидная | 3 | Культура клеток | 1972 | Суспензия, каллус | Продуцент стероидных гликозидов фуростанолового ряда |
| Medicago sativa L. | Люцерна посевная | 1 | Лист | 1985 | Суспензия | Продуцент пероксидазы |
| Panax ginseng С.A. Mey. | Женьшень настоящий | 3 | Корень | 1977–2001 | Суспензия, каллус | Продуцент гинзенозидов |
| Panax japonicus С.A. Mey. var. repens | Женьшень ползучий | 2 | Корень | 1995–1997 | Суспензия | Продуцент гинзенозидов |
| Panax vietnamensis Ha et Grushv. | Женьшень вьетнамский | 1 | Корень | 2014 | Суспензия | Продуцент гинзенозидов |
| Polyscias filicifolia Bailey | Полисциас папортниколистный | 2 | Лист | 1991 | Суспензия, каллус | Пищевая добавка с выраженным тонизирующим и антитерратогенным действием |
| Polyscias fruticosa (L.) Harms. | Полисциас кустарниковый | 1 | Лист | 2005 | Суспензия, каллус | Продуцент тритерпеновых гликозидов |
| Stephania glabra (Roxb.) Miers | Стефания гладкая | 2 | Культура клеток | 2004 | Суспензия, каллус | Продуцент стефарина |
| Taxus baccata L. | Тис ягодный | 3 | Стебель, лист | Каллус | Продуцент таксоидов | |
| Taxus x media | Тис средний | 1 | Стебель, лист | Каллус | Продуцент таксоидов | |
| Taxus wallichiana Zucc. | Тис гималайский | 1 | Культура клеток | 2016 | Суспензия | Продуцент таксоидов |
| Tribulus terrestris L. | Якорцы стелющиеся | 1 | Семена | 2014 | Суспензия | Продуцент стероидных гликозидов |
Примечание: полный каталог культур представлен на странице Коллекции на сайте ИФР РАН (https://ippras.ru/institut/nauchnye_podrazdeleniya/vserossiyskaya-kollektsiya-rastitelnykh-kletok-i-organov-vysshikh-rasteniy/)
Работы ВККК ВР и опыт других коллекций [36, 37], позволяют говорить о том, что коллекции культур клеток, несмотря на свою немногочисленность, – это не “музеи”, а живые, активно функционирующие системы, где не только сохраняются ценные генетические образцы, но и ведутся научные исследования по их изучению, активный обмен и сбор нового материала. Эти особенности, наряду с используемыми методами сохранения, такими как in vitro и криосохранение, позволяют рассматривать коллекции культур клеток как равноправную часть большой международной сети по сохранению, изучению и обмену генетическими ресурсами растений. Однако у коллекций культур клеток есть и уникальная особенность – наряду с важной функцией сохранения генетического материала, они являются первым звеном в многостадийной цепочке получения возобновляемого сырья лекарственных растений и продуктов на его основе, в том числе различных препаратов, содержащих БАВ.
КУЛЬТУРА КЛЕТОК ВЫСШИХ РАСТЕНИЙ КАК ОСНОВА ДЛЯ БИОТЕХНОЛОГИЧЕСКОГО ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
Культуры in vitro представляют собой “удобную” систему для изучения различных процессов в клетках растений. В рамках данной методологии имеется потенциальная возможность строго контролировать условия выращивания клеток, что позволяет ограничивать число факторов, влияющих на изучаемый процесс. Классическим примером может служить культура клеток табака BY-2 – одна из самых популярных моделей в биологии клетки растений, благодаря ее быстрой пролиферации, гомогенному клеточному фенотипу и наличию эффективных протоколов синхронизации [38]. Эта культура популярна в исследованиях регуляции клеточного цикла, запрограммированной гибели клеток, в изучении стресс-реакций и т. п. [39]. Не меньшую роль в экспериментальной биологии клетки играют разные линии культивируемых клеток Arabidopsis thaliana, чей геном полностью секвенирован [40, 41].
Однако традиционно наиболее важной “функциональной” частью коллекций культур клеток высших растений являются штаммы продуцентов БАВ [25]. Как правило, БАВ растительного происхождения являются продуктами вторичного метаболизма и играют важнейшую роль в современной медицине [42]. В большинстве обзоров, посвященных данной теме, повторяются сходные утверждения, характеризующие преимущества культуры клеток в качестве альтернативного способа получения БАВ [43–46]. Мы не будем нарушать традицию и приведем наиболее значимые преимущества:
1. Потенциальная возможность широкого выбора исходных растений независимо от наличия и доступности ареалов их обитания в конкретной стране, охранного статуса или угрозы исчезновения данных видов;
2. Экологическая чистота производства биомассы в строго контролируемых условиях, гарантирующих безопасность препаратов;
3. При условии оптимизации условий поддержания/выращивания и ростовых/биосинтетических характеристик конкретных линий/штаммов культур клеток возможно гарантированное получение биомассы с заданными характеристиками, независимо от сезона, климатических и погодных условий;
4. Высокая производительность и более сжатые сроки получения биомассы и/или целевых БАВ по сравнению с интактными растениями; при этом в ряде случаев, например для женьшеня настоящего, речь может идти о сокращении срока культивирования с нескольких лет до нескольких месяцев;
5. Использование штаммов-сверхпродуцентов, позволяющее в некоторых случаях решить проблему низкого содержания БАВ в природном растительном сырье;
6. Потенциальная возможность масштабирования производства биомассы клеток растений с определенными свойствами.
Столь очевидные преимущества должны были бы привести к повсеместному использованию культур клеток высших растений для промышленного производства БАВ, однако этого не произошло. В публикациях начала 1980-х – конца 1990-х годов упоминается целый ряд пилотных производств на основе культур клеток высших растений, запущенных в Японии, США, Германии и других странах. Это, например, производство розмариновой кислоты из культуры клеток Coleus blumei [47], антоцианов на основе клеток Aralia cordata [48], биомассы клеток Catharanthus roseus [49], паклитаксела из Taxus spp. [50], берберина из клеток Coptis japonica [51], производных шиконина из Lithospermum erythrorhizon var. erythrorhizon [52] и некоторые другие [53]. Среди наиболее масштабных проектов можно выделить выращивание Nicotiana tabacum в биореакторах объемом 20 000 л для производства биомассы и никотина [54], Rauwolfia serpentina (75000 л) для получения индольных алкалоидов [55] и биомассы клеток Panax ginseng в биореакторах объемом 20 000–25 000 л [56]. Однако анализ современного состояния отрасли показал, что большинство этих проектов были закрыты по разным причинам, среди которых упоминается нерентабельность, а компании либо перестали существовать, либо переключились на другие продукты [57]. К настоящему времени известны лишь единичные примеры действующих производств БАВ на основе культур клеток высших растений. Это, например, компания Phyton Catalytic с производственными мощностями в Германии и Канаде, производящая паклитаксел (растительный дитерпеноид, обладающий выраженной противоопухолевой активностью) на основе клеток Taxus spp. (https://phytonbiotech.com). Южнокорейская компания Samyang Biopharmaceuticals Corp. также является производителем паклитаксела из культуры клеток тиса [58], препарат уже прошел клинические испытания [59]. Культура клеток лекарственного растения Polyscias filicifolia является основным компонентом ряда российских препаратов с подтвержденным общеукрепляющим и антитератогенным действием (https:// www.vitagmal.ru/).
Более широкое применение клеточные биотехнологии получили в современной косметологии и для производства пищевых добавок: согласно анализу [60], за последние 10 лет более 12 европейских и американских компаний представили на этих рынках продукцию, полученную из культур клеток высших растений. Это согласуется с современными тенденциями к здоровому питанию, с одной стороны, и, с другой стороны, – с возросшим интересом к новым источникам питания, произведенным высокотехнологичным способом с использованием экологичных технологий, отвечающих критериям устойчивого развития [61, 62]. В косметологии, как и следовало ожидать, наибольшей популярностью пользуются лекарственные растения, такие как Rhodiola rosea, Aloe barbadensis, Ajuga reptans, Echinacea spp., Calendula spp. и другие [60]. Однако все чаще используются культуры клеток сельскохозяйственных и декоративных растений и видов, ранее считавшихся исключительно модельными объектами: Nicotiana sylvestris, Malus domestica, Rubus idaeus, Vitis vinifera, Daucus carota, Oryza sativa, Coffea bengalensis, Syringa vulgaris, Rhododendron hirsutum, Camellia sinensis. Показано, что экстракты культур клеток и/или различные препараты на основе их биомассы ряда видов влияют на экспрессию генов, отвечающих за синтез коллагена, обладают противовоспалительной, антиоксидантной и УФ-протекторной активностью, активируют процессы регенерации кожных покровов [63]. Отмечается, что высокий потенциал для промышленного использования имеют культуры с высоким содержанием полифенольных соединений [64]; некоторые авторы [65] связывают возросший интерес к культурам клеток именно с косметической индустрией.
Причиной сложившейся ситуации является, по-видимому, целый ряд факторов. Во-первых, это высокая стоимость биотехнологических производств. Во-вторых, для вывода любого нового лекарственного препарата на фармацевтический рынок необходимы многолетние и дорогие клинические испытания [62], осуществить которые под силу далеко не каждой биотехнологической компании. Однако самым существенным фактором можно назвать низкую продуктивность культур клеток по целевым вторичным соединениям по сравнению с исходным растением. Используя традиционные методы – селекцию продуктивных штаммов, оптимизацию сред, элиситацию, добавление химических предшественников синтеза [45, 66], можно повысить продуктивность культур клеток растений на один-два порядка. Безусловно, свою лепту в решение проблемы внесут подходы метаболической инженерии [67], поскольку генно-инженерная настройка экспрессии генов, определяющих синтез целевого продукта, может существенно изменить биосинтетические способности клеток in vitro. Однако зачастую именно низкое содержание, либо отсутствие целевых соединений является сдерживающим фактором при переходе от получения и первичного скрининга культур клеток к пилотным производствам на их основе и затем к полномасштабной промышленной технологии. Это обусловлено спецификой культуры клеток как биологической системы.
ОСОБЕННОСТИ СИНТЕЗА БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ В КУЛЬТУРАХ КЛЕТОК ВЫСШИХ РАСТЕНИЙ
Растения синтезируют сотни тысяч сложных органических соединений – продуктов вторичного метаболизма, среди которых выделяют несколько основных групп: алкалоиды, изопреноиды и фенольные производные [68]. При этом в конкретном растении каждая группа вторичных метаболитов, как правило, представлена в виде сложных смесей соединений, близких по химической структуре, но отличающихся в тонких структурных “нюансах”. К последним можно отнести различные типы изомерии, характер и взаимное расположение заместителей (гидроксилирование, метилирование, метоксилирование, пренилирование и т. д.), образование конъюгатов и их модификация (ацилирование и т. д.) [69]. Так, например, в растениях Tribulus terrestris L. (Zygophyllaceae) к настоящему времени обнаружено более 100 индивидуальных стероидных гликозидов фуростанолового и спиростанолового ряда [70], а для растений рода Panax L. известно более полутысячи индивидуальных гинзенозидов (тритерпеновых гликозидов) [71].
Считается, что в культурах клеток высших растений in vitro процессы вторичного метаболизма и его регуляции отличаются от таковых в интактных растениях [30]. Это связанно с особенностями культуры клеток как уникальной системы, где отсутствуют механизмы организменного контроля, характерные для целого растения, и на первый план выходит процесс “автоселекции” – постоянного отбора клеток по интенсивности роста, скорости пролиферации и адаптивности [68, 69]. Более чем полувековой опыт изучения вторичного метаболизма в культурах растительных клеток позволил предположить, что в таких системах сохраняется и поддерживается прежде всего синтез соединений, способствующих пролиферации клеток. Например, некоторые изопреноиды могут стимулировать рост клеток, а также проявляют антиоксидантную и осмопротекторную активности [72]. Также возможно, что многие вторичные соединения, кроме участия в системе защиты растений, обладают гораздо более широким спектром функций, чем это было принято считать. Например, стероидные гликозиды диоскореи могут играть роль резерва углеводов, а алкалоиды – принимать участие в азотном обмене [69]. В табл. 3 приведены некоторые факторы, влияющие на синтез вторичных метаболитов в культуре клеток in vitro по сравнению с интактным растением. Логично, что качественный и количественный состав вторичных соединений в интактном растении и в полученной из него культуре клеток может существенно отличаться. Например, в растениях, продуцирующих стероидные гликозиды, как правило, присутствуют фуростаноловые и спиростаноловые формы этих соединений, тогда как в культурах клеток in vitro стероидные гликозиды накапливаются в основном в фуростаноловой форме [69].
Таблица 3.
Основные факторы, влияющие на синтез и накопление вторичных метаболитов в культивируемых in vitro растительных клетках по сравнению с целым растением (по [69] с изменениями)
| Факторы, влияющие на синтез и накопление вторичных метаболитов | Культура недифференцированных клеток in vitro | Интактные растения |
|---|---|---|
| Дифференциация и пролиферация клеток | Вторичные метаболиты синтезируются в непрерывно растущей культуре недифференцированных клеток | Вторичные метаболиты синтезируются в дифференцированных непролиферирующих клетках |
| Клеточная ультраструктура | Пластиды редки или рудиментированы, популяция состоит из меристемоподобных и/или паренхимоподобных гетеротрофных клеток | Высокая степень внутриклеточной компартментации, многочисленные пластиды участвуют в процессах пластид-ассоциированного биосинтеза и хранения вторичных метаболитов |
| Специализация по типу ткани | Биосинтез и накопление вторичных соединений ограничены либо одиночной клеткой, либо агрегатами из 10–30 клеток, или вторичные соединения выделяются в питательную среду | Биосинтез вторичных метаболитов тканеспецифичен, соединения могут транспортироваться, синтезироваться и храниться в разных органах |
В настоящее время большинство исследований по получению БАВ в культуре клеток высших растений строится по сходному принципу: получение стабильно растущих культур клеток, их скрининг на наличие целевых соединений, направленное увеличение содержания целевого метаболита (или группы метаболитов) с помощью изменения условий культивирования, методов элиситации, стрессовых воздействий, генно-инженерных подходов или мутагенеза [73]. Такая стратегия оказывается успешной, благодаря уникальным свойствам культур клеток: быстрому росту, пластичности (адаптивности) и чувствительности ко внешним воздействиям [30]. Это дает возможность воздействовать на качественный и количественный состав синтезируемых соединений целым арсеналом методов. Показано, например, что изменение состава гормонов в среде выращивания приводит к изменению состава и количественного содержания тритерпеновых гликозидов в культуре клеток женьшеня настоящего [74, 75] и стероидных гликозидов в культуре клеток T. terrestris [76]. В Отделе биологии клетки и биотехнологии ИФР РАН методом индуцированного мутагенеза из культуры клеток диоскореи дельтовидной было получено несколько мутантных линий, отличающихся как по ростовым характеристикам, так и по содержанию целевых метаболитов – стероидных гликозидов [77] (табл. 4). Причем одна из полученных линий оказалась суперпродуцентом с содержанием фуростаноловых гликозидов до 10% от сухого веса, что превышает их содержание в интактном растении [77].
Таблица 4.
Ростовые характеристики и содержание гликозидов в различных линиях культивируемых клеток Dioscorea deltoidea, полученных в результате мутагенеза по сравнению с исходным штаммом D-1, данные по [69, 77].
| Линия | Удельная скорость роста, сут–1 | Максимальное накопление биомассы, г/л | Индекс роста | Содержание гликозидов (% сухого веса) | |
|---|---|---|---|---|---|
| фуростаноловые | спиростаноловые | ||||
| D-1 (исходный) | 0.18 | 11.2 | 8.4 | 2.0 | 0.04 |
| DM-0.5 | 0.20 | 11.9 | 8.4 | 9.3 | 0.07 |
| DM-1 | 0.17 | 11.7 | 7.2 | 3.2 | 0.06 |
| DM-8 | 0.16 | 10.9 | 6.8 | 2.1 | <0.06 |
Приведенные выше работы можно считать удачными примерами применения “классической” стратегии, где культура клеток рассматривается с целью получения “мажорных” (основных в количественном отношении) и/или наиболее характерных для конкретного вида растений специализированных метаболитов [73]. Приходится признать, что такие методы получения БАВ не всегда приводят к желаемому результату, то есть высокому содержанию целевых БАВ в биомассе клеток in vitro. Это не только сдерживает применение культуры клеток в биотехнологии, как было показано выше, но и приводит к распространению представления об ограниченности специализированного метаболизма в культивируемых in vitro клетках по сравнению с интактными растениями [69]. Однако развитие структурной и аналитической фитохимии, в частности использование различных видов хромато-масс-спектрометрии для качественного и количественного анализа вторичных метаболитов в интактных растениях, позволяет надеяться на возможность другого подхода. В наиболее универсальном варианте этот экспериментальный подход основан на совместном применении жидкостной хроматографии (высокоэффективная жидкостная хроматография (HPLC) или ультраэффективная жидкостная хроматография (UPLC)) и квадрупольной-времяпролетной масс-спектрометрии при ионизации электрораспылением (ESI-Q-TOF-MS) [78]. В качестве примера в одной из пионерских работ этого направления показано, что LC-ESI-Q-TOF-MS позволяет обнаружить и структурно описать в различных образцах видов женьшеня (Panax spp.) более 600 тритерпеновых гликозидов (гинзенозидов) разной структуры [79].
Применение такого подхода для изучения структурного разнообразия вторичных соединений в культурах клеток растений имеет большой потенциал, поскольку позволяет получить более полное представление об их химическом составе, в том числе – о присутствии нехарактерных и/или “минорных” (редко встречающиеся или присутствующие в исчезающе малых количествах) для интактных растений метаболитов, которые также могут обладать биологической активностью. В этом смысле, уже имеющиеся коллекции культур клеток растений представляют прекрасное поле для фитохимических исследований и, по аналогии с коллекциями ценных сельскохозяйственных культур, обладают качеством “потенциальной ценности” (option value), полный потенциал которой может быть проявлен в недалеком будущем. На примере некоторых линий, которые поддерживаются в активно растущем состоянии в ВККК ВР показана эффективность комбинированного использования “классических” (выделение индивидуальных соединений и описание их структуры с помощью спектроскопии ядерного магнитного резонанса и масс-спектрометрии высокого разрешения) и “новых” (в основном основаны на хромато-масс-спектрометрии) фитохимических приемов при биохимическом описании культур клеток высших растений. Так, впервые было показано, что в клетках Panax japonicus in vitro кроме семи так называемых “мажорных” гликозидов женьшеня (гинзенозиды Rg1, Re, Rf, Rb1, Rb2, Rb3, Rd) также образуются малонилированные производные гинзенозидов (например, малонил-Rg1, ‑Rb1, -Rb2 и др.) [80, 81] и неполярные (так называемые “редкие” (“rare”)) гинзенозиды (например, гипенозид XVII и гинзенозид F2) [82, 83]. Подробный фитохимический скрининг биомассы культур клеток разных видов тиса позволил выявить некоторые закономерности изменения (по сравнению с интактными растениями) в них вторичного метаболизма. А именно, было показано, что для клеток Taxus spp. характерно преимущественное образование 14-гидроксилированных таксоидов [34]. Эта закономерность, вероятно, имеет фундаментальное значение, поскольку полиацилированные 14-гидроксилированные таксоиды были выявлены даже в клетках Taxus canadensis in vitro (в интактных растениях этого вида тиса неполярные полиацилированные 14-гидроксилированные таксоиды ранее не были обнаружены) [84]. Таким образом, химический анализ с применением новейших методов исследований открывает новые перспективы для использования культур клеток не только как источника целевых БАВ, но и как продуцентов уникального набора биологически активных компонентов, не характерных для интактных растений.
МЕТОДЫ ПОДДЕРЖАНИЯ КОЛЛЕКЦИОННЫХ ШТАММОВ И СТАБИЛЬНОСТЬ КУЛЬТУР КЛЕТОК В ПРОЦЕССЕ ДЛИТЕЛЬНОГО КУЛЬТИВИРОВАНИЯ
Для биологических объектов в коллекциях, будь то растения или культуры клеток, ключевым понятием является понятие стабильности. В идеальном варианте, любой запрошенный из коллекции образец должен обладать всеми ключевыми свойствами первичного образца, заложенного на хранение. Однако в случае живых систем, для которых характерны постоянные изменения и адаптация к внешним условиям, стабильность является скорее нежелательным качеством. Неудивительно, что одним из “столпов” биобанкирования всегда являлся поиск и разработка методов хранения, которые позволяли бы достичь баланса между наиболее эффективным и стабильным поддержанием основных свойств образцов, с одной стороны, и сохранением их высокой жизнеспособности, с другой, в течение наиболее длительного периода времени и с минимальными затратами [8]. Этот принцип хорошо согласуется с требованиями биотехнологических производств, где должно быть обеспечено стабильно высокое качество конечного продукта при заданных технологических параметрах [73]. При масштабах многотонных биореакторов, потеря или непредвиденная мутация штамма продуцента, влияющая на его ростовые и биосинтетические свойства, грозит полной или частичной остановкой производства, а значит и серьезными экономическими потерями.
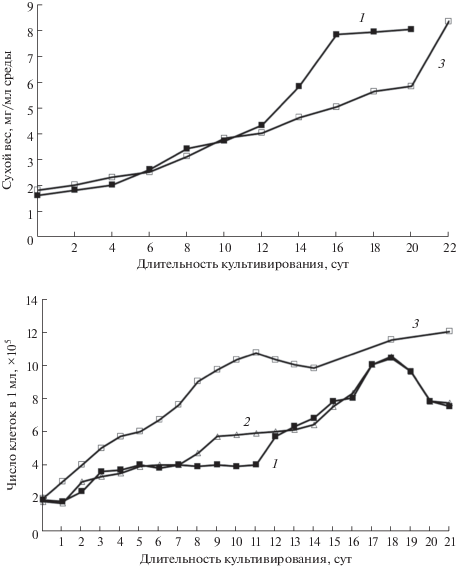
В литературе имеются данные об исследовании влияния процесса культивирования in vitro и криосохранения на морфологические, цитологические и генетические характеристики высших растений [8]. Однако для изолированных культур клеток такие сведения достаточно скудны. Считается, что культуры изолированных клеток являются нестабильными и гетерогенными по своей природе. Например, было показано, что культура клеток BY-2, полученная из проростков Nicotiana tabacum L. “BrightYellow 2” в 1970-х гг. в Японии и являющаяся широко используемым модельным объектом для целого ряда фундаментальных исследований в биологии растений, значительно отличается от клеток исходного растения по числу хромосом и имеет существенные модификации в геноме [85]. Изменения в геномном аппарате и эпигенетические вариации были зафиксированы и для клеточных линий многих других видов [86]. В этом смысле ВККК ВР представляет уникальную платформу для исследований, так как содержит штаммы культур, полученные более 45 лет назад. К сожалению, паспортные данные штаммов, полученных до 1990-х гг. содержат очень лимитированный набор сведений, таких как данные о плоидности и об индексе роста. В данный момент в ВККК ВР ведется работа по актуализации основных параметров поддерживаемых культур как в ходе экспериментальной работы, так и путем сравнения литературных данных. Например, показано, что культура клеток Panax japonicus, поддерживаемая методом пересева с циклом субкультивирования 21 сут в течение 15 лет осталась стабильной по основным ростовым параметрам: числу клеток, накоплению сухой биомассы (рис. 3). При этом в культуре сохраняется способность к накоплению достаточно широкого спектра гинзенозидов разных структурных групп [80, 81, 87, 88].
По сравнению с культивированием in vitro, криосохранение растительного материала в жидком азоте (–196ºС) считается более надежным методом, позволяющим поддерживать образцы в состоянии анабиоза без значительных изменений в течение длительного времени. В ряде исследований криосохранение приводится в качестве единственного надежного способа длительного хранения вегетативно размножаемых культур [6, 8, 12]. Методология криосохранения для культур изолированных клеток приведена в более ранних обзорах [11, 89], поэтому в данной статье будут рассмотрены только примеры криосохранения клеточных культур, используемых для промышленных или полупромышленных производств БАВ. В большинстве исследований для криосохранения культур клеток использовали программное (или медленное) замораживание с предварительным выдерживанием концентрированных суспензий клеток в растворах криопротекторов, представляющих собой комбинации ДМСО, сахарозы, этиленгликоля и глицерина в низких концентрациях (до 20%). Например, Kim с соавт. [90] добились 40% выживаемости и сохранения биосинтеза паклитаксела для культуры клеток Taxus chinensis после замораживания в смеси 0.5 М ДМСО и 0.5 М глицерина.
Успешную криоконсервацию культур клеток Panax ginseng и P. quinquefolius проводили методом как программного, так и прямого замораживания [91–94]. При этом для культур после криосохранения продуктивность по сырой и сухой биомассе увеличивалась по сравнению с контрольной культурой [92], а содержание основных гинзенозидов после криосохранения оставалось неизменным [93, 94]. Содержание диосгенина, ситостерина и стигмастерина в клетках Dioscorea deltoidea после предварительного культивирования на среде с аспарагином и аланином и криоконсервации методом программного замораживания также сохранялось на уровне контроля [95].
В более поздних исследованиях была продемонстрирована высокая эффективность современных методов: двухэтапного замораживания, витрификации и инкапсуляции – для криоконсервации культур клеток Gentiana tibetica [96], Catharanthus roseus [97] и некоторых других [89]. Важные данные были получены в исследованиях Отдела биологии клетки и биотехнологии ИФР РАН на культуре Polyscias filicifolia, восстановленной после замораживания в соломинах [98] и хранения в криобанке в течение пяти лет. Было показано, что при культивировании в колбах и в биореакторах с использованием различных режимов ростовые характеристики (удельная скорость роста, продуктивность) и жизнеспособность восстановленной культуры не отличались от характеристик исходной культуры и той же культуры, поддерживаемой в активной коллекции методом пересадок в течение 5 лет [99]. Что касается длительности хранения, уникальным экспериментом можно считать восстановление культуры Medicago sativa после 27 лет хранения в криобанке [100]. Восстановленная культура полностью сохранила свои цитогенетические характеристики и высокую пероксидазную активность. Данная работа считается одним из немногих примеров длительного (более 20 лет) хранения растительного материала в криобанке, известным в настоящий момент [8]. Полный список коллекционных культур, сохраняющихся в криобанке ИФР РАН, представлен в табл. 5.
Таблица 5.
Культуры клеток из ВККК ВР, находящиеся на хранении в криобанке ИФР РАН.
| Вид | Число штаммов | Год замораживания |
|---|---|---|
| Daucus carota | 1 | 1977 |
| Dioscorea balcanica | 1 | 1995 |
| Dioscorea caucasica | 1 | 1995 |
| Dioscorea deltoidea | 4 | 1984–1998 |
| Medicago sativa | 1 | 1985–1989 |
| Nicotiana sylvestris | 1 | 1984 |
| Panax ginseng | 5 | 1983–1992 |
| Panax japonicus | 1 | 1999 |
| Panax quinquefolius | 1 | 1985–1987 |
| Polyscias filicifolia | 1 | 1998 |
| Rhaponticum carthamoides | 3 | 1992–1999 |
| Solanum tuberosum, cv. Tawa | 1 | 1991 |
| Thalictrum minus | 1 | 1998–1999 |
| Triticum aestivum | 1 | 1994 |
| Triticum timopheevii | 1 | 1994 |
Приведенные выше исследования демонстрируют высокую эффективность криосохранения как надежного метода длительного хранения культур клеток, обеспечивающего полное восстановление их ростовых и биосинтетических характеристик, а также полное восстановление способности к масштабированию в биореакторах разного объема для получения БАВ. Показано также, что по крайней мере некоторые культуры демонстрируют стабильные ростовые характеристики в процессе культивирования in vitro. Таким образом, метод пересева может использоваться для поддержания коллекций средней длительности хранения. Для наиболее перспективных и часто используемых штаммов целесообразно поддержание их в активно растущей коллекции с сохранением дубликатов в криобанке.
ЗАКЛЮЧЕНИЕ
Коллекции культур клеток растений представляют собой уникальный тип генетического банка, материалы которого служат нескольким целям. Наличие штаммов одного вида, выращиваемых в различных условиях на разных средах, позволяет изучать механизмы клеточного роста, а также синтеза и накопления вторичных метаболитов в клеточных культурах по сравнению с интактным растением. Очевидно, что коллекции культур клеток растений in vitro будут в такой же степени востребованы в фундаментальных исследованиях вторичного метаболизма, в какой они сейчас незаменимы в исследованиях биологии клетки растений. Получение новых культур и изучение содержания в них БАВ, а также получение штаммов-суперпродуцентов и усовершенствование методов химического анализа позволяет надеяться на скорый период “ренессанса” для культур клеток как возобновляемого сырья лекарственных растений и продуктов на его основе, что отвечает современным тенденциям – развитию фитомедицины и здорового образа жизни. Комбинированное использование “классического” анализа индивидуальных соединений и описания их структуры с помощью спектроскопии ядерного магнитного резонанса и масс-спектрометрии высокого разрешения и биохимического скрининга с помощью хромато-масс-спектрометрии позволит составлять биохимические паспорта культур и, вероятно, откроет новые перспективы для использования коллекционных штаммов культур клеток не только как источника целевых БАВ, но и как продуцентов уникального набора биологически активных компонентов, не характерных для интактных растений. Данные о стабильности ростовых и биосинтетических характеристик культур клеток, поддерживаемых методом пересева в течение длительного времени, а также разработка методов криосохранения позволят выбирать наиболее эффективные методы сохранения культур в коллекциях, что еще больше укрепит их позиции как неотъемлемой части международной сети по сохранению, изучению и обмену генетическими ресурсами растений.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта “Экспансия” № 19-116-50163.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
FAO. The second report on the state of the world’s plant genetic resources for food and agriculture. Rome: FAO, 2010. 399 p.
Pritchard H.W. Cryopreservation of desiccation-tolerant seeds // Cryopreservation and freeze-drying protocols / Eds. Day J.G., Stacey G.N. Totowa: Humana Press Inc., 2007. P. 185.
Asdal A., Guarino L. The Svalbard Global Seed Vault: 10 Years – 1 Million Samples // Biopreserv. Biobanking. 2018. P. 391. https://doi.org/10.1089/bio.2018.0025
Benson E.E., Harding K., Debouck D., Dumet D., Escobar R., Mafla G., Panis B., Panta A., Tay D., Van den Houwe I., Roux N. Refinement and standardization of storage procedures for clonal crops-Global Public Goods Phase 2: Part I. Project landscape and general status of clonal crop in vitro conservation technologies. System-wide Genetic Resources Programme, Rome, 2011. 86 p.
Pence V.C. Cryopreservation of seeds of Ohio native plants and related species // Seed Sci. Technol. 1991. V. 19. P. 235.
Reed B.M. Plant cryopreservation: a continuing requirement for food and ecosystem security // In Vitro Cell. Dev. Biol.: Plant. 2017. V. 53. P. 285.
Pritchard H.W., Nadarajan J., Ballesteros D., Thammasiri K., Prasongsom S., Malik S.K., Chaudhury R., Kim H.-H., Lin L., Li W.-Q., Yang X.-Y., Popova E. Cryobiotechnology of tropical seeds – scale, scope and hope // Acta Hortic. 2017. V. 1167. P. 37. https://doi.org/10.17660/ActaHortic.2017.1167.6
Acker J.P., Adkins S., Alves A., Horna D., Toll J. Feasibility study for a safety back-up cropreservation facility. Independent expert report: July 2017. Rome: Bioversity International, 2017. 100 p.
BGCI (2020) https://www.bgci.org/resources/bgci-databases/gardensearch/ Cited 20 Aug 2020.
Fu Y.B. The vulnerability of plant genetic resources conserved ex situ // Crop Sci. 2017. V. 57. P. 2314.
Popov A.S., Popova E.V., Nikishina T.V., Vysotskaya O.N. Cryobank of plant genetic resources in Russian Academy of Sciences // Int. J. Refrig. 2006. V. 29. P. 403. https://doi.org/10.1016/j.ijrefrig.2005.07.011
Popova E.V., Shukla M., Kim H.H., Saxena P.K. Plant cryopreservation for biotechnology and breeding // Advances in plant breeding strategies: Breeding, biotechnology and molecular tools / Eds. Al-Khairy J.M., Jain M., Johnson D.V. Springer, 2015. P. 63.
Thorpe T.A. History of Plant Tissue Culture // Methods in Molecular Biology. Plant Cell Culture Protocols, Second Edition / Eds. Loyola-Vargas V.M., Vázquez-Flota F., Totowa N.J. USA: Humana Press Inc., 2006. P. 9.
Vasil I.K. A history of plant biotechnology: from the cell theory of Schleiden and Schwann to biotech crops // Plant Cell Rep. 2008. V. 27. P. 1423.
Sussex I.M. The scientific roots of modern plant biotechnology // Plant Cell. 2008. V. 20. P. 1189.
Vöchting H. Über organbildung im pflanzenreich. Physiologische untersuchungen über wachsthumsursachen und lebenseinheiten. Bd. 1. Bonn: Verlag von Max Cohen und sohn, 1878. 258 p.
Vöchting H. Über die Regeneration der Marchantieen // Jahrb. Wiss. Bot. 1885. V. 16. P. 367.
Haberlandt G. Experiments on the culture of isolated plant cells // Bot. Rev. 1969. V. 35. P. 68.
Gautheret R.J. Sur la possibilité de réaliser la culture indéfinie des tissus de tubercules de carrote // C.R. Hebd. Séances Acad. Sci. 1939. V. 208. P. 118.
Nobécourt P. Sur la pérennité et l’augmentation de volume des cultures de tissus végétaux // C. R. Séances Soc. Biol. Fil. 1939. V. 130. P. 1270.
White P.R. Potentially unlimited growth of excised plant callus in an artificial nutrient // Am. J. Bot. 1939. V. 26. P. 59.
Miller C.O., Skoog F., Von Saltza M.H., Strong F.M. Kinetin, a cell division factor from deoxyribonucleic acid // J. Am. Chem. Soc. 1955. V. 77. P. 1392.
Gautheret R.J. La Culture des Tissus Végétaux. Techniques et réalisations. Paris: Masson et Cie, 1959. 868 p.
Бутенко Р.Г. Культура изолированных тканей и физиология морфогенеза растений. Москва: Наука, 1964. 272 с.
Бутенко Р.Г. Культура тканей лекарственных растений и перспективы ее использования в фармации // Труды ЛХФИ. Вопросы фармакогнозии. 1967. Т. 21. С. 184.
Butenko R.G. Plant Tissue Culture and Plant Morphogenesis. Jerusalem: Israel Program for Scientific Translations, 1968. 291 p.
Слепян Л.И., Грушвицкий И.В., Бутенко Р.Г. Женьшень как объект для введения в культуру тканей in vitro // Труды Ленинградского химико-фармацевтического института. Вопросы фармакогнозии. 1967. Т. 21. С. 198.
Бутенко Р.Г., Грушвицкий И.В., Слепян Л.И. Органогенез и соматический эмбриогенез в культуре тканей женьшеня и других представителей рода Panax L. // Ботанический журнал. 1968. Т. 53. С. 906.
Пинаев Г.П., Полянская Г.Г. Создание и развитие Российской коллекции клеточных культур человека, животных и растений // Клеточные культуры. Информационный бюллетень. Вып. 26. / Под ред. М.С. Богдановой. СПб.: Изд-во Политехн. ун-та, 2010. Т. 61 С. 3.
Носов А.М. Культура клеток высших растений – уникальная система, модель, инструмент // Физиология растений. 1999. Т. 46. С. 837.
Zenk M.H. The impact of plant cell culture on industry // Frontiers of Plant Tissue Culture / Ed. Thorpe T.A. Calgary, Canada: Intl. Assoc. Plant Tissue Culture, Univ. of Calgary Printing Services, 1978. P. 1.
Titova M.V., Khandy M.T., Konstantinova S.V., Kulichenko I.E., Sukhanova E.S., Kochkin D.V., Nosov A.M. Effect of inhibitors of two isoprenoid biosynthetic pathways on physiological and biosynthetic characteristics of Dioscorea deltoidea cell suspension culture // Russ. J. Plant Physiol. 2016. V. 63. P. 894.
Кочкин Д.В., Ханды М.Т., Зайцев Г.П., Толкачева Н.В., Шашков А.С., Титова М.В., Чирва В.Я., Носов А.М. Протодиосцин в суспензионной культуре клеток Dioscorea deltoidea // Химия природных соединений. 2016. Т. 4. С. 572.
Kochkin D.V., Globa E.B., Demidova E.V., Gaisinsky V.V., Galishev B.A., Kolotyrkina N.G., Kuznetsov Vl.V., Nosov A.M. Occurrence of 14-hydroxylated taxoids in the plant in vitro cell cultures of different yew species (Taxus spp.) // Dokl. Biochem. Biophys. 2017. V. 476. P. 337.
Khandy M.T., Kochkin D.V., Tomilova S.V., Galishev B.A., Sukhanova E.S., Klyushin A.G., Ivanov I.M., Nosov A.M. Obtaining and Study of Callus and Suspension Plant Cell Cultures of Tribulus terrestris L., a Producer of Steroidal Glycosides // Appl. Biochem. Microbiol. 2017. V. 53. P. 800.
Kreis W. Exploiting plant cell culture for natural product formation // J. Appl. Bot. Food Qual. 2019.V. 92. P. 216.
Máthé C., Demeter Z., Resetár A., Gonda S., Balázs A., Szôke É., Kiss Z., Simon Á., Székely V., Riba M., Garda T., Gere B., Noszály Z., Molnár A.V., Vasas G. The plant tissue culture collection at the department of botany, University of Debrecen // Acta Biol. (Szeged). 2012. V. 56. P. 179.
Nagata T., Nemoto Y., Hasezawa S. Tobacco BY–2 cell line as the “HeLa” cell in the cell biology of higher plants // Int. Rev. Cytol. 1992. V. 132. P. 1.
Takahashi S., Kojo K.H., Kutsuna N., Endo M., Toki S., Isoda H., Hasezawa S. Differential responses to high- and low-dose ultraviolet-B stress in tobacco Bright Yellow-2 cells // Front. Plant Sci. 2015. V. 6: 254. https://doi.org/10.3389/fpls.2015.00254
Novikova G.V., Mur L.A.J., Nosov A.V., Fomenkov A.A., Mironov K.S., Mamaeva A.S., Shilov E.S., Rakitin. V.Y., Hall M.A. Nitric oxide has a concentration-dependent effect on the cell cycle acting via EIN2 in Arabidopsis thaliana cultured cells // Front. Phys. 2017. V. 8: 142.
Zlobin I.E., Pashkovskiy P.P., Kartashov A.V., Nosov A.V., Fomenkov A.A., Kuznetsov Vl.V. The relationship between cellular Zn status and regulation of Zn homeostasis genes in plant cells // Environ. Exp. Bot. 2020. V. 176. 104104.https://doi.org/10.1016/j.envexpbot.2020.104104
Xu J., Zhang N. On the way to commercializing plant cell culture platform for biopharmaceuticals: present status and prospect // Pharm. Bioprocess. 2014. V. 2. P. 499.
Davoodi A., Khoshvishkaie E., Azadbakht M. Plant cells technology as an effective biotechnological approach for high scale production of pharmaceutical natural compounds; A meta-analysis study // Pharm. Biomed. Res. 2019. V. 5. P. 1.
Ochoa-Villarreal M., Howat S., Hong S., Jang M.O., Jin Y.-W., Lee E.-K., Loake G.J. Plant cell culture strategies for the production of natural products // BMB Rep. 2016. V. 49. P. 149.
Nosov A.M. Application of cell technologies for production of plant-derived bioactive substances of plant origin // Appl. Biochem. Microbiol. 2012. V. 48. P. 609.
Chandran H., Meena M., Barupal T., Sharma K. Plant tissue culture as a perpetual source for production of industrially important bioactive compounds // Biotech. Rep. 2020. V. 26: e00450. https://doi.org/10.1016/j.btre.2020.e00450
Ulbrich B., Wiesner W., Arens H. Large-Scale Production of Rosmarinic Acid from Plant Cell Cultures of Coleus blume Benth // Primary and Secondary Metabolism of Plant Cell Cultures / Eds. Neumann K.-H., Barz W., Reinhard E. Heidelberg: Springer-Verlag Berlin Heidelberg Publisher, 1985. P. 293.
Kobayashi Y., Akita M., Sakamoto K., Liu H., Shigeoka T., Koyano T., Kawamura M., Furuya T. Large-scale production of anthocyanin by Aralia cordata cell suspension cultures // Appl Microbiol Biotechnol. 1993. V. 40. P. 215. https://doi.org/10.1007/BF00170369
Smart N. J., Fowler M. W. An airlift column bioreactor suitable for large-scale cultivation of plant cell suspensions // J. Exp. Bot. 1984. V. 35. P. 531. https://doi.org/10.1093/jxb/35.4.531
Goodman J., Walsh V. The story of taxol: nature and politics in the pursuit of an anti-cancer drug. Cambridge: Cambridge University Press, 2001. 286 p.
Sato F., Yamada Y. High berberine-producing cultures of Coptis japonica cells // Phytochem. 1984. V. 23. P. 281. https://doi.org/10.1016/S0031-9422(00)80318-0
Tabata M., Fujita Y. Production of shikonin by plant cell cultures // Biotechnology in Plant Science / Eds. Zaitlin M., Day P., Hollaender A. Orlando, 1985. P. 207.
Sasson A. Production of useful biochemicals by higher-plant cell cultures: biotechnological and economic aspects // Biotechnology: economic and social aspects. Issues for developing countries / Cambridge: Cambridge University Press., 1992. P. 81.
Azechi S., Hashimoto T., Yuyama T., Nagatuska S., Nakashizuka M., Nishiyama T., Murata A. Continuous cultivation of tobacco plant cells in an industrial scale plant // Hakko Kogaku Kaishi. 1983. V. 61. P. 117.
Rittershaus E., Ulrich J., Weiss A., Westphal K. Large scale industrial fermentation of plant cells: experiences in cultivation of plant cells in a fermentation cascade up to a volume of 75 000 L // BioEngineering. 1989. V. 5. P. 28.
Hibino K., Ushiyama K. Commercial Production of Ginseng by Plant Tissue Culture Technology // Plant Cell and Tissue Culture for the Production of Food Ingredients / Eds. Fu T.J., Singh G., Curtis W.R. Boston: Springer, 1999. P. 215.
Yazaki K. Lithospermum erythrorhizon cell cultures: Present and future aspects // Plant Biotechnol. (Tokyo, Jpn.). 2017. V. 34. P. 131. https://doi.org/10.5511/plantbiotechnology.17.0823a
Choi H.-K., Son J.-S., Na G.-H., Hong S.-S., Park Y.-S., Song J.-Y. Mass production of paclitaxel by plant cell culture // J. Plant Biotechnol. 2002. V. 29. P. 59.
Park I.H., Sohn J.H., Kim S.B., Lee K. S., Chung J.S., Lee S.H., Kim T.Y., Jung K.H., Cho E.K., Kim Y.S., Song H.S., Seo J.H., Ryoo H.M., Lee S.A., Yoon S.Y. et al. An Open-label, randomized, parallel, phase III trial evaluating the efficacy and safety of polymeric micelle-formulated paclitaxel compared to conventional cremophor EL-based paclitaxel for recurrent or metastatic HER2-negative breast cancer // Cancer Res. Treat. 2017. V. 49. P. 569.
Eibl R., Meier P., Stutz I., Schildberger D., Hühn T., Eibl D. Plant cell culture technology in the cosmetics and food industries: current state and future trends // App-l. Microbiol. Biotechnol. 2018. V. 102. P. 8661.
Nordlund E., Lille M., Silventoinen P., Nygren H., Seppänen-Laakso T., Mikkelson A., Aura A.M., Heiniö R.L., Nohynek L., Puupponen-Pimiä R., Rischer H. Plant cells as food – a concept taking shape // Food Res. Int. 2018. V. 107. P. 297.
Schäfer C., Bosshart D., Frick K., Muller C. European Food Trends Report 2019. Hacking Food: Redefining What We Eat // GDI-Study No. 47. Zurich: GDI Gottlieb Duttweiler Institute, 2019.
Barbulova A., Apone F., Colucci G. Plant cell cultures as source of cosmetic active ingredients // Cosmetics. 2014. V. 1. P. 94.
Suvanto J., Nohynek L., Seppänen-Laakso T., Rischer H., Salminen J.-P., Puupponen-Pimiä R. Variability in the production of tannins and other polyphenols in cell cultures of 12 Nordic plant species // Planta. 2017. V. 246. P. 227.
Trehan S., Michniak-Kohn B., Beri K. Plant stem cells in cosmetics: current trends and future directions // Future Sci OA. 2017. V. 3: FSO226.
Yue W., Ming Q.L., Lin B., Rahman K., Zheng C.J., Han T., Qin L.P. Medicinal plant cell suspension cultures: pharmaceutical applications and high-yielding strategies for the desired secondary metabolites // Crit. Rev. Biotechnol. 2016. V. 36. P. 215.
Nielsen E., Temporiti M.E.E., Cella R. Improvement of phytochemical production by plant cells and organ culture and by genetic engineering // Plant Cell. Rep. 2019. V. 38. P. 1199.
Носов А.М. Функции вторичных метаболитов in vivo и in vitro // Физиология растений. 1994. Т. 41. С. 873.
Nosov A.M., Popova E.V., Kochkin D.V. Isoprenoid Production via Plant Cell Cultures: Biosynthesis, Accumulation and Scaling-Up to Bioreactors // Production of Biomass and Bioactive Compounds Using Bioreactor Technology / Eds. Paek K.-Y. Murthy H.N., Zhong J.-J. Netherlands: Springer, 2014. P. 563.
Kostova I., Dinchev D. Saponins in Tribulus terrestris – chemistry and bioactivity // Phytochem. Rev. 2005. V. 4. P. 111.
Christensen L.P. Ginsenosides chemistry, biosynthesis, analysis, and potential health effects // Adv. Food Nutr. Res. 2008. V. 55. P. 1.
Tetali S.D. Terpenes and isoprenoids: a wealth of compounds for global use // Planta. 2019. V. 249. P. 1.
Murthy H.N., Dandin V.S., Zhong J.-J., Paek K.-Y. Strategies for Enhanced Production of Plant Secondary Metabolites from Cell and Organ Cultures // Production of Biomass and Bioactive Compounds Using Bioreactor Technology / Eds. Paek K.-Y. Murthy H.N., Zhong J.-J. Netherlands: Springer, 2014. P. 471.
Smolenskaya I.N., Reshetnyak O.V., Smirnova Y.N., Chernyak N.D., Globa E.B., Nosov A.M., Nosov A.V. Opposite effects of synthetic auxins, 2,4-dichlorophenoxyacetic acid and 1-naphthalene acetic acid on growth of true ginseng cell culture and synthesis of ginsenosides // Russ. J. Plant Physiol. 2013. V. 54. P. 215.
Smirnova Y.N., Reshetnyak O.V., Smolenskaya I.N., Voevudskaya S.Y., Nosov A.M. Effect of growth regulators on ginsenoside production in the cell culture of two ginseng species // Russ. J. Plant Physiol. 2010. V. 57. P. 430.
Томилова С.В., Ханды М.Т., Кочкин Д.В., Галишев Б.А., Клюшин А.Г., Носов А.М. Влияние синтетических аналогов ауксинов – 2,4-Д и α-НУК – на ростовые и биосинтетические характеристики суспензионной культуры клеток Tribulus terrestris L. // Физиология растений. 2020. Т. 67. С. 389.
Бутенко Р.Г., Воробьев А.С., Носов А. М. Синтез, накопление и локализация стероидных гликозидов в клетках разных штаммов Dioscorea deltoidea Wall // Физиология растений. 1992. Т. 39 С. 1146.
Dettmer K., Aronov P.A., Hammock B.D. Mass spectrometry-based metabolomics // Mass Spectrom. Rev. 2007. V. 26. P. 51.
Yang W.Z., Ye M., Qiao X., Liu C.F., Miao W.J., Bo T., Tao H.Y., Guo D.A. A strategy for efficient discovery of new natural compounds by integrating orthogonal column chromatography and liquid chromatography/mass spectrometry analysis: Its application in Panax ginseng, Panax quinquefolium and Panax notoginseng to characterize 437 potential new ginsenosides // Anal. Chim. Acta. 2012. V. 739. P. 56.
Kochkin D.V., Kachala V.V., Shashkov A.S., Chizhov A.O., Chirva V.Y., Nosov A.M. Malonyl-ginsenoside content of a cell-suspension culture of Panax japonicus var. repens // Phytochemistry. 2013. V. 93. P. 18.
Kochkin D.V., Galishev B.A., Glagoleva E.S., Titova M.V., Nosov A.M. Rare triterpene glycoside of ginseng (ginsenoside malonyl-Rg1) detected in plant cell suspension culture of Panax japonicus var. repens // Russ. J. Plant Physiol. 2017. V. 64. P. 649.
Kochkin D.V., Zaitsev G.P., Kachala V.V., Chizhov A.O., Demidova E.V., Titova M.V., Chirva V.Y., Nosov A.M., Kuznetsov V.V. The occurrence of gypenoside XVII in suspension cell culture of ginseng Panax japonicus var. repens // Dokl. Biochem. Biophys. 2012. V. 442. P. 42.
Глаголева Е.С., Кочкин Д.В. Изменение состава тритерпеновых гликозидов на стадии деградации культуры клеток женьшеня // Acta Naturae. Т. 2 из Спецвыпуск. / Москва: Издательство Перо, 2019. С. 267.
Kochkin D.V., Globa E.B., Demidova E.V., Gaisinsky V.V., Kuznetsov V.V., Nosov A.M. Detection of taxuyunnanin C in suspension cell culture of Taxus canadensis // Dokl. Biochem. Biophys. 2019. V. 485. P. 129.
Kovařik A., Lim K.Y., Soucková-Skalická K., Matyasek R., Leitch A.R. A plant culture (BY-2) widely used in molecular and cell studies is genetically unstable and highly heterogeneous // Bot. J. Linn. Soc. 2012. V. 170. P. 459.
Betekhtin A., Rojek M., Jaskowiak J., Milewska-Hendel A., Kwasniewska J., Kostyukova Y., Kurczynska E., Rumyantseva N., Hasterok R. Nuclear genome stability in long-term cultivated callus lines of Fagopyrum tataricum (L.) Gaertn. // PloS One. 2017. V. 12: e0173537.
Смоленская И.Н., Зоринянц С.Э., Смирнова Ю.Н., Носов А.В., Чайко А.Л., Носов А.М. Суспензионная культура клеток Panax japonicus var. repens 1. Параметры роста и цитогенетические характеристики // Биотехнология. 2005. Т. 5. С. 20.
Решетняк О.В., Смоленская И.Н., Смирнова Ю.Н., Чайко А.Л., Носов А.В., Носов А.М. Суспензионная культура клеток Panax japonicus var. repens 2. Качественный и количественный состав гинзенозидов в клетках при культивировании in vitro // Биотехнология. 2005. Т. 6. С. 20.
Heine-Dobbernack E., Kiesecker H., Schumacher H.M. Cryopreservation of dedifferentiated cell cultures // Plant cryopreservation: a practical guide / Ed. Reed B.M. New York: Springer, 2008. P. 141.
Kim S.I., Choi H.K., Son J.S., Yun J.H., Jang M.S., Kim H.R., Song J.Y., Kim J.H., Choi H.J., Hong S.S. Cryopreservation of Taxus chinensis suspension cell cultures // CryoLetters. 2001. V. 22. P. 43.
Fedorovskii D.N., Chernyak N.D., Popov A.S. The disturbing effects of cryopreservation on the plasma membranes of ginseng cells // Sov. Plant Physiol. 1993. V. 40. P. 94.
Joshi A., Teng W.L. Cryopreservation of Panax ginseng cells // Plant Cell Rep. 2000. V. 19. P. 971.
Mannonen L., Toivonen L., Kauppinen V. Effects of long-term preservation on growth and productivity of Panax ginseng and Catharanthus roseus cell cultures // Plant Cell Rep. 1990. V. 9. P. 173.
Seitz U., Reinhard E. Growth and ginsenoside patterns of cryopreserved Panax ginseng cell cultures // J. Plant Physiol. 1987. V. 131. P. 215.
Butenko R.G., Popov A.S., Volkova L.A., Chernyak N.D., Nosov A.M. Recovery of cell cultures and their biosynthetic capacity after storage of Dioscorea deltoidea and Panax ginseng cells in liquid nitrogen // Plant Sci. Lett. 1984. V. 33. P. 285.
Mikula A. Comparison of three techniques for cryopreservation and reestablishment of long-term Gentiana tibetica suspension culture // CryoLetters. 2006. V. 27. P. 269.
Samar F., Mujib A., Nasim S.A., Siddiqui Z.H. Cryopreservation of embryogenic cell suspension of Catharanthus roseus L. (G) Don. // Plant Cell, Tissue Organ Cult. 2009. V. 98. P. 1.
Krivokharchenko A.S., Chernyak N.D., Nosov A.M. Cryopreservation of suspension cultures of plant cells by the freezing technique elaborated for mammalian embryos. Rus. J. Plant Physiol. 1999. V. 46. P. 831.
Титова М.В., Шумило H.A., Черняк Н.Д., Кривохарченко A.C., Орешников A.B., Носов A.M. Использование криосохранения для поддержания стабильности штамма при аппаратном культивировании суспензии клеток Polyscias filicifolia Bailey: 1. Оценка ростовых характеристик возобновленной культуры // Биотехнология. 2007. V. 5. С. 60.
Volkova L.A., Urmantseva V.V., Popova E.V., Nosov A.M. Physiological, cytological and biochemical stability of Medicago sativa L. cell culture after 27 years of cryogenic storage // CryoLetters. 2015. V. 36. P. 252.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений