Физиология растений, 2021, T. 68, № 4, стр. 339-355
Генная инженерия биосинтеза лигнина в деревьях: компромисс между свойствами древесины и жизнеспособностью растений
В. Г. Лебедев a, *, К. А. Шестибратов a
a Федеральное государственное бюджетное учреждение науки Филиал Института биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук
Пущино, Россия
* E-mail: vglebedev@mail.ru
Поступила в редакцию 03.09.2020
После доработки 27.09.2020
Принята к публикации 02.10.2020
Аннотация
Лигнин является вторым по распространенности наземным биополимером. Он обеспечивает механическую прочность растений и водонепроницаемость проводящей системы, а также играет важную роль в защите от биотических и абиотических стрессов. Химическая стойкость лигнина препятствует переработке растительной биомассы в целлюлозу и биотопливо, что привело к интенсификации исследований его биосинтеза. Длительное время считалось, что лигнин состоит почти исключительно из трех монолигнолов, но к настоящему времени обнаружено еще около тридцати минорных мономеров различной химической природы. С помощью методов генной инженерии получено большое количество трансгенных деревьев с измененной экспрессией как генов ферментов биосинтеза лигнина, так и генов факторов транскрипции, регулирующих этот процесс. Изменения в содержании и/или составе лигнина позволили значительно повысить эффективность делигнификации и ферментативного гидролиза древесной биомассы, но это часто приводило к замедлению роста и отклонениям в развитии растений. В поисках баланса между потребностями промышленности и жизнеспособностью растений был предложен ряд новых стратегий, основанных на включении в состав лигнина новых монолигнолов, а также использовании природных форм с дефицитом лигнина. Новые физико-химические свойства лигнина должны повысить его экстрагируемость, но вместе с тем необходимо изучение роста, развития и стрессоустойчивости таких растений в полевых условиях. В обзоре представлено современное состояние исследований по изучению и модификации лигнина в древесных растениях. Кроме того, обсуждается взаимосвязь этих изменений с жизнеспособностью растений и перспективы их коммерческого использования.
ВВЕДЕНИЕ
Лигнин является вторым по распространенности биополимером в природе после целлюлозы и представляет собой сложное разветвленное соединение из фенилпропаноидных мономеров. Лигнин откладывается в основном в клеточной стенке трахеальных элементов и волокон, а у некоторых видов растений – также в эндодерме, перидерме и эпидермисе [1]. Физико-химические свойства лигнина (твердость, стойкость, гидрофобность) обуславливают его основные функции в растениях: обеспечение механической прочности и водонепроницаемости сосудов ксилемы. Кроме этого, лигнин как вещество фенольной природы принимает участие в защите растений от различных стрессов [2]. Эти биотические и абиотические стрессы включают засуху, УФ-радиацию, атаки патогенов и вредителей, механические повреждения и др. [3]. Ценные для растений свойства лигнина становятся недостатком при использовании растительной биомассы в качестве сырья. Его удаление в процессе получения бумаги высокозатратно и вредно для окружающей среды [4]. Лигнин снижает эффективность ферментативной переработки биомассы в сбраживаемые сахара для получения биотоплива [5]. Наконец, лигнин ухудшает перевариваемость кормов у жвачных животных, так как отрицательно влияет на их микробное расщепление [6]. Синтез лигнина усиливается в ответ на различные стрессы, и не исключено повышение его содержания в растениях в связи с глобальным изменением климата, которое увеличивает вероятность их появления и интенсивность стрессов. В целом, снижение содержания или изменение состава лигнина обеспечивает значительный экономический и экологический выигрыш для различных отраслей промышленности. Очевидно, что достичь этого можно только путем глубокого изучения биосинтеза лигнина на биохимическом и молекулярном уровнях. Хотя подобные исследования интенсивно ведутся и на травянистых растениях – с фундаментальной целью на модельных объектах (арабидопсис, табак) и для практического применения на сельскохозяйственных культурах (люцерна, кукуруза), в данном обзоре рассматриваются лесные древесные породы, главным образом, лиственные, так как лигнин в основном определяет характеристики древесины.
БИОСИНТЕЗ ЛИГНИНА
Фенилпропаноидный путь метаболизма
Биосинтез лигнина является частью фенилпропаноидного пути метаболизма и включает три этапа: синтез монолигнолов в цитозоле, их транспорт через плазматическую мембрану и окислительную полимеризацию монолигнолов с образованием макромолекул в клеточной стенке [7]. Синтез монолигнолов изучен достаточно хорошо, и долгое время считалось, что в нем участвует 10 ферментов: фенилаланин аммонийлиаза (PAL), циннамат 4-гидроксилаза (C4H), 4-кумарат КоА-лигаза (4CL), шикимат гидроксициннамоил трансфераза (HCT), п-кумароил шикимат 3-гидроксилаза (C3’H), кофеоил-КоА-О-метилтранфераза (CCoAOMT), ферулат 5-гидроксилаза (F5H), метилтрансфераза кофейной кислоты (COMT), циннамоил КоА-редуктаза (CCR) и дегидрогеназа коричного спирта (CAD) [8]. Биосинтез начинается с дезаминирования фенилаланина и является общим для всех монолигнолов до образования п-кумароил-КоА c участием ферментов PAL, C4H и 4CL (рис. 1). После этого происходит разветвление: к образованию предшественника п-гидроксифенильного (H) лигнина ведет самый короткий путь из двух ферментов – CCR и CAD, а к синтезу предшественников гваяцильного (G) и сирингильного (S) лигнинов – фермент HCT. Этот фермент катализирует образование сложного эфира п-кумароил шикимата, который служит субстратом для фермента C3'H [7]. Затем ферменты CCoAOMT и CCR катализируют образование кониферилового альдегида, который CAD превращает в конифериловый спирт (G-лигнин). Еще одним ключевым ферментом регуляции лигнификации является F5H, который отклоняет поток фенилпропаноидов от синтеза G-лигнина в направлении синтеза S-лигнина [9]. Используя в качестве субстратов конифериловые альдегид и спирт, F5H (CAld5H) вместе с COMT образует синаповые альдегид и спирт. Таким образом, для синтеза п-кумарового спирта (H-лигнина) требуется только пять ферментов (PAL, C4H, 4CL, CCR и CAD), тогда как для синтеза кониферилового спирта (G-лигнина) – восемь (пять вышеперечисленных плюс НСТ, C3'H и CCoAOMT), а для синтеза синапового спирта (S-лигнина) – все десять, включая F5H и COMT [8].
Рис. 1.
Современные представления о биосинтезе лигнина в древесных растениях. Названия классических монолигнолов помещены в рамку. PAL – фенилаланин аммонийлиаза, C4H – циннамат 4-гидроксилаза, 4CL – 4-кумарат КоА-лигаза, HCT – шикимат гидроксициннамоил трансфераза, C3'H – п-кумароил шикимат 3-гидроксилаза, CSE – кофеоил шикимат эстераза, CCoAOMT – кофеоил-КоА-О-метилтранфераза, F5H – ферулат 5-гидроксилаза, COMT – метилтрансфераза кофейной кислоты, CCR – циннамоил КоА- редуктаза, CAD – дегидрогеназа коричного спирта.
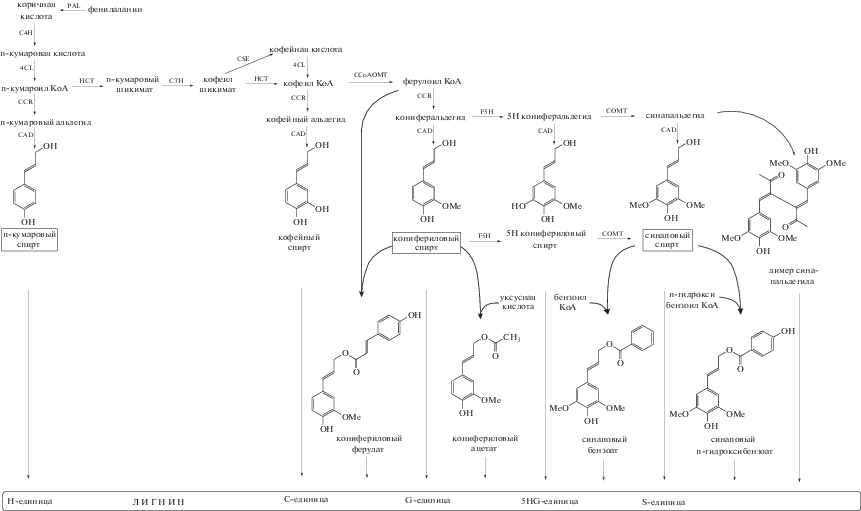
Несколько лет назад общепринятая модель биосинтеза лигнина была пересмотрена и к ней добавили еще один фермент. Исследования показали, что обнаруженный в 2010 г. фермент кофеоил шикимат эстераза (CSE) играет важную роль в биосинтезе лигнина в арабидопсисе [10]. Этот фермент катализировал образование кофеата из кофеоил шикимата, что вместе с активностью 4CL обеспечивало обходной путь (помимо реакции с HCT) получения кофеоил-КоА и в итоге направляло биосинтез от H-лигнина к G- и S-лигнину (рис. 1). Позже было показано участие этого фермента в лигнификации лиственных (Populus tremula × P. alba) [5] и хвойных (Larix kaempferi) [11] деревьев. При этом отсутствие генов CSE в некоторых травянистых видах говорит о том, что этот фермент является единственным в пути монолигнолов, чье присутствие необязательно для биосинтеза лигнина [12].
После синтеза монолигнолы транспортируются в апопласт, но этот механизм все еще не полностью понятен – он может осуществляться путем пассивной диффузии или с помощью мембранных транспортеров [12]. Ранее предполагалось, что монолигнолы транспортируются в форме гликозидов, которые перед полимеризацией гидролизуются гликозидазой [8]. Однако эта гипотеза еще не получила убедительных доказательств и гликозиды, вероятно, в большей степени используются как запасающие формы в вакуолях [12]. В апопласте происходит дегидрирование монолигнолов с помощью пероксидаз и лакказ до образования монолигноловых радикалов, которые затем соединяются между собой. Среди связей между монолигнолами в полимере лигнина преобладает алкил-арильная эфирная связь (β-O-4; 50–80%), но также встречаются фенилкумарановая (β-5), резинольная (β-β), дибензодиоксоциновая (5-5), бифенилэфирная (5-O-4) и спиродиеноновая (β-1) связи [13]. Эти связи гораздо сильнее лабильных связей между гликозидами и пептидами в других природных полимерах – целлюлозе и белках. В полимеризации не участвуют ферменты или белки, она является чисто химической реакцией, зависящей от таких физических факторов, как pH, ионная сила раствора и запас субстрата [14]. В результате такого механизма биосинтеза образуется сложный разветвленный биополимер нерегулярного строения, что обуславливает его различные физико-химические свойства и затрудняет деполимеризацию.
Несмотря на сложное строение, лигнин состоит в основном из H-, G- и S-единиц, образующихся из п-кумарового, кониферилового и синапового спиртов, соответственно, различающихся только степенью метоксилирования ароматического кольца (рис. 1). Содержание различных мономеров лигнина значительно варьирует в зависимости от таксона, вида, стадии развития, типа ткани и клеток и даже слоя клеточной стенки, также на них влияют факторы развития и стрессы окружающей среды [15]. Известно, что лигнин голосеменных состоит в основном из G-единиц с небольшим количеством Н-единиц, тогда как у покрытосеменных преобладают G- и S-единицы, причем у однодольных доля Н-единиц выше, чем у двудольных [16]. Состав лигнина оказывает большое влияние на его химическую стойкость и эффективность делигнификации или сахарификации древесной биомассы. Лигнин хвойных древесных пород более устойчив к расщеплению, так как у G-единиц преобладают углерод-углеродные связи β–5, 5–5 и β–β [17]. Лигнин лиственных пород содержит единицы S и G в соотношении около 2:1, и обилие эфирных связей β-O-4 повышает его реакционную способность [18].
Неканонические монолигнолы
Длительное время считалось, что лигнин состоит только из Н-, S- и G-единиц, но исследования последних 20 лет показали наличие в его составе и других мономеров, что приводит к еще большему разнообразию физико-химических свойств лигнина. Сейчас известно уже более 30 минорных мономеров [13, 19], но большинство из них у деревьев отсутствует. Из группы гидроксикоричных спиртов, куда входят и классические монолигнолы, в деревьях обнаружен 5-гидроксиконифериловый спирт – в лигнине тополя (P. tremula × P. alba) [20] и кофейный спирт – в культуре трахеальных элементов Pinus radiata [21] (рис. 1). Эти мономеры заместили классические гидроксикоричные спирты, синтез которых снизился из-за подавления экспрессии генов метилтрансфераз: COMT – в тополе и CCoAOMT – в сосне.
Большую группу новых монолигнолов составляют их конъюгаты с ацетатом, ферулатом, п-гидроксибензоатом или п-кумаратом. Последние обычны в травянистых растениях, но другие были обнаружены и в деревьях, например, остатки п‑гидроксибензоата – в P. tremula × P. alba с геном F5H [22] (рис. 1). От 7 до 23% ферулатных конъюгатов входило в состав лигнина P. alba × grandidentata с геном ферулоил-КоА монолигнол трансферазы (FMT) из Angelica sinensis. Конифериловые ферулаты, в отличие от синаповых, были обнаружены в древесине некоторых видов (Populus, Salix, Eucalyptus и Acer) – от 0.1 до 3.9% от массы лигнина, но у голосеменных они вообще отсутствовали [23]. У хвойных также отсутствовали и ацетатные конъюгаты, содержание которых в лиственных породах сильно варьировало: доля ацетилированных S-единиц колебалась от 1.1% у эвкалипта до 44.6% у граба, а G-единиц – от 0.8% у осины до 4.9% у эвкалипта [24]. Последними в составе лигнина растений были обнаружены еще два конъюгата монолигнолов: бензоаты и ванилаты в листовых тканях Phoenix canariensis [25] и синаповый бензоат в P. trichocarpa с подавленной экспрессией генов C4H и C3'H [26].
Кроме этого, в состав лигнина могут входить некоторые соединения, образующиеся в результате блокирования этапов его биосинтеза. Например, фермент CAD катализирует образование спиртов из альдегидов, и снижение его активности повышает содержание последних в лигнине. Подавление экспрессии гена CAD с помощью РНК-интерференции (РНКи) в P. tremula × P. alba привело к значительному (до 20 раз) увеличению встраивания синапового альдегида в лигнин, но конифериловый альдегид заметно не изменился [27] (рис. 1). В мутантной сосне ладанной (Pinus taeda) с активностью CAD около 1% от контроля в составе лигнина преобладали единицы дигидрокониферилового спирта (рост с 3 до 30%), но также присутствовали единицы коричных альдегидов (смесь единиц п-гидроксикоричного и кониферилового) и единицы бензойных альдегидов (смесь единиц п-гидроксибензальдегида и ванилина) [28].
Определение неканонических мономеров лигнина часто требует дополнительных методов анализа. Например, стандартные протоколы для определения состава лигнина, такие как тиоацидолиз и ЯМР, могут не отличать спиртовые мономеры от их ацилированных аналогов, и поэтому конифериловые и синаповые спирты в лигнине обычно просто указывают как единицы G и S, соответственно, независимо от того, ацилированы они или нет [19]. Доля минорных монолигнолов в лигнине обычно низка, но выживание в ходе эволюции растений с такими мономерами позволяет предположить, что они обеспечивают растениям определенные преимущества.
Регуляция биосинтеза лигнина
Лигнин растений в основном является компонентом вторичной клеточной стенки, которая образуется только после прекращения роста клетки. Во время ее формирования биосинтез лигнина координируется с биосинтезом целлюлозы и гемицеллюлоз с помощью сложной сети тканеспецифичных транскрипционных факторов (ТФ) [8]. До настоящего времени механизмы регуляции биосинтеза лигнина изучены недостаточно [29]. Регуляторы процесса в основном принадлежат к семействам генов NAC и MYB с преобладанием последних [1]. Регуляция биосинтеза лигнина, в первую очередь, изучалась на арабидопсисе, но у деревьев подавляющую долю биомассы составляет древесина, формирование которой представляет длительный процесс, подверженный сезонным изменениям и различным стрессам окружающей среды. Очевидно, что деревья обладают уникальными регуляторными механизмами лигнификации, отсутствующими у травянистых растений.
Одну из главных ролей в регуляции биосинтеза лигнина играют ТФ из семейства NAC, которые содержат консервативный N-концевой ДНК-связывающий домен с С-концом, имеющим домен активации [30]. ТФ NAC из P. trichocarpa (гены PtrWND) выполняли роль ключевых регуляторов и путем связывания с промоторами активировали ряд ТФ следующего уровня (семейства NAC, MYB, “цинковых пальцев”) [31]. В этом исследовании была показана более сложная транскрипционная сеть регулирования биосинтеза вторичной клеточной стенки у деревьев по сравнению с арабидопсисом. Сверхэкспрессия гена NAC PdWND3A в P. deltoides увеличила число сосудистых клеток и повысила экспрессию гена F5H1, что привело к увеличению содержания лигнина на 12–13% и соотношения S:G с 1.3 до 1.5 и 2.1 [32].
Гены MYB составляют одно из самых больших семейств ТФ в растениях и регулируют различные биологические процессы. Помимо биосинтеза лигнина, эти ТФ активно участвуют в регуляции биосинтеза флавоноидов – другой части фенилпропаноидного пути, входя в состав транскрипционного комплекса MBW [33]. Большинство активаторов MYB, участвующих в регуляции биосинтеза лигнина, относятся к подсемейству R2R3-MYB, которое характеризуется высококонсервативным N-концевым ДНК-связывающим доменом (домен R2R3-MYB) и сильно вариабельным С-концевым доменом активации или репрессии [34]. Например, сверхэкспрессия генов ТФ тополей PtoMYB216 и PtrMYB152 усиливала экспрессию различных генов биосинтеза лигнина в P. tomentosa и P. trichocarpa, соответственно [1, 35].
Кроме ТФ – активаторов транскрипции генов биосинтеза лигнина, были обнаружены и ТФ-репрессоры. Белок ТФ EgMYB1 из Eucalyptus gunnii содержал активный репрессорный мотив в регуляторном домене, и перенос его гена в P. tremula × P. alba привел к снижению транскрипции генов биосинтеза лигнина и уменьшению его содержания [36]. Трансформация тополя геном PtoMYB156 вызвала значительное падение экспрессии генов биосинтеза целлюлозы, ксилана и лигнина, что снизило их содержание, а также содержание фенолов и флавоноидов [37].
В целом, сеть транскрипционной регуляции биосинтеза вторичной клеточной стенки у сосудистых растений консервативна и в ней ТФ NAC и MYB (ключевые регуляторы первого и второго уровней, соответственно) активируют нижележащие ТФ и гены биосинтеза [38]. Среди регуляторов третьего уровня преобладают ТФ из семейства MYB, из которых некоторые выступают в качестве репрессоров биосинтеза вторичной клеточной стенки [39]. Построение сложной сети транскрипционной регуляции биосинтеза лигнина в деревьях еще далеко не закончено и постоянно уточняется. Недавно выяснилось, что изоформа 5-енолпируват шикимат 3-фосфат синтазы (EPSPS) из P. trichocarpa, имеющая на N-конце мотив спираль-поворот-спираль, кроме канонической функции в биосинтезе шикимата, также активирует экспрессию ТФ MYB021 и фенилпропаноидный путь [40]. В одной из последних работ предлагается четырехуровневая схема, включающая 57 взаимодействий между 17 ТФ и 27 генами-мишенями [41]. Авторы предположили, что регуляция формирования древесины осуществляется не только иерархическими взаимодействиями белок – ДНК, но и взаимодействиями белок – белок в пределах одного уровня. Понимание механизмов регулирования биосинтеза лигнина важно не только для фундаментальной науки, но для разработки стратегий целенаправленного улучшения характеристик древесной биомассы.
Особенности “стрессовых” лигнинов
Хорошо известно, что биосинтез лигнина регулируется не только внутренними сигналами развития растения, но и различными внешними факторами, такими как патогены, механические повреждения, ветер, гравитация и др. [9, 29]. Так называемые “стрессовые” лигнины по своей структуре отличаются от лигнинов развития, что предполагает различие и физических свойств, но их изучению уделяется мало внимания [42]. Известно, что в ответ на изменение положения ствола и ветвей в пространстве под действием гравитации деревья изменяют биосинтез лигнина, чтобы заставить их вернуться в нормальное положение, и это приводит к развитию реактивной древесины (reaction wood). У лиственных пород ее называют тяговой древесиной (tension wood), она развивается над наклонной областью ствола и ветвей (в зоне растяжения), характеризуется дифференциацией сосудов в волокна и содержит меньше лигнина с измененным составом [3]. У хвойных такую древесину, расположенную под наклонной областью (в зоне сжатия), называют кренью, или древесиной сжатия (compression wood). Она содержит меньше целлюлозы и больше лигнина с повышенным уровнем Н-единиц и изменениями в химических связях между мономерами [3]. Кроме этого, реактивная древесина содержит значительно больше β-1,4-галактана как у хвойных, где он является хорошим биохимическим маркером древесины сжатия [43], так и в лиственных породах [44].
Недостаток воды во время засухи вызывает осмотический стресс, и многие исследования показали усиление биосинтеза лигнина в этот период. Имитация засухи на видах эвкалипта увеличила содержание лигнина в базальной зоне ствола Eucalyptus urograndis и апикальной зоне ствола E. globulus, но в обоих случаях возросло соотношение S:G [45]. Обработка проростков Leucaena leucocephala маннитолом и NaCl значительно увеличила содержание лигнина и синтез белка CCR в стеблях, что может играть важную роль в устойчивости к засухе [46]. Наконец, ТФ PtoMYB170 из P. tomentosa не только активировал биосинтез лигнина, но и усиливал устойчивость к засухе через индуцированное темнотой закрытие устьиц [47].
Значительно меньше изучалось влияние на лигнификацию холодового стресса и, главным образом, на травянистых растениях. Холодовая обработка растений нута усилила транскрипцию генов PAL, CAD и лакказ, повысила активность пероксидаз и содержание лигнина [48]. Перенос в растения табака гена фермента SAMS, синтезирующего донора метильных групп для различных молекул, включая лигнины, привел к утолщению клеточной стенки в 3–4 раза и выживанию после 48 ч при 2°С [49]. Таким образом, лигнин, вероятно, участвует в защите растений от холода, но на деревьях подобные работы почти неизвестны.
Растения часто отвечают на атаки патогенных микроорганизмов усилением лигнификации, создавая механический барьер. Например, виды Eucalyptus и Ulmus с повышенной устойчивостью к грибным заболеваниям отличались от менее устойчивых увеличенным отложением лигнина [3]. Кроме этого, изменение биосинтеза лигнина при инфекции может приводить к увеличению синтеза промежуточных соединений или запускать активацию других защитных механизмов [50]. Таким образом, лигнин играет важную роль в адаптации растений к окружающей среде.
Несмотря на всю важность “стрессовых” лигнинов, молекулярные механизмы, лежащие в основе их биосинтеза, остаются в основном неизвестными [42]. Их структура в значительной степени зависела от типа и интенсивности стресса, а также от вида растения, но все же наблюдались некоторые общие свойства: такие лигнины содержали больше Н-единиц, у которых самый короткий путь биосинтеза, что позволяло растению быстрее реагировать на стресс [42]. Возможно, различные неканонические мономеры, открытые в лигнинах в последние годы, также принимают участие в защите растений от стрессов. Понимание механизмов биосинтеза “стрессовых” лигнинов позволит изменять содержание и состав лигнинов без ослабления защитных свойств растений.
ГЕННАЯ ИНЖЕНЕРИЯ ЛИГНИНА В ДЕРЕВЬЯХ
Модификация биосинтеза лигнина
В биосинтезе монолигнолов участвует 11 ферментов, и к настоящему времени получено большое количество трансгенных деревьев с подавлением или усилением экспрессии соответствующих генов. Наблюдаемые эффекты в значительной степени зависели от расположения фермента в пути биосинтеза. Общий путь фенилпропаноидов включает три стадии, катализируемые ферментами PAL, C4H или 4CL, в ходе которых происходит конверсия фенилаланина в п-кумароил-коА – предшественника флавоноидов, монолигнолов и фенольных кислот [32]. На деревьях почти не проводились эксперименты с генами первых ферментов – PAL и С4Н. Причина, вероятно, в том, что нарушение их работы вызовет слишком большие изменения в лигнификации, а также в содержании разнообразных низкомолекулярных вторичных соединений, обладающих физиологическими эффектами, что критично для выживания растений. Только в 2010 г. антисмысловая конструкция гена С4Н была перенесена в P. tremula × tremuloides, что снизило содержание лигнина с 22 до 15% без изменения S:G, уменьшило плотность древесины на 10% и несколько ослабило рост [51]. Значительные изменения были отмечены и при подавлении экспрессии гена C4H у гибридного эвкалипта: ослабление роста, снижение содержания лигнина с 29.6 до 18.9% и уменьшение соотношения S:G с 2.0 до 1.5 [52].
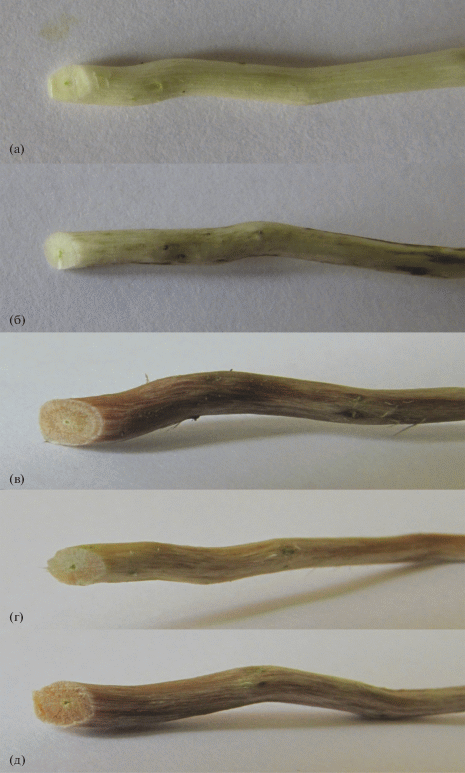
Значительно больше работ известно с генами фермента 4CL. Антисмысловая конструкция с геном 4CL не изменила содержание лигнина в березе повислой (Betula pendula), но у одной линии из трех высота уменьшилась в 2 раза и у всех в 1.5–3 раза снизилась масса корней [53]. У всех линий P. tremula × P. alba с антисмысловым геном 4CL в полевых экспериментах лигнин снизился умеренно (до 10%), но падение экспрессии 4CL ниже 50% привело к уменьшению биомассы в 3–5 раз и развитию красно-коричневой древесины с измененным химическим составом [54]. Схожие эффекты наблюдались и у голосеменных растений. Сильная супрессия гена 4CL с помощью РНКи у Pinus radiata привела к карликовости по типу “бонсай”, увеличению доли Н-единиц с 3.4 до 13.5% и потемнению древесины, что говорит о значительных изменениях в анатомии и химии [55]. Красно-коричневая окраска древесины также отмечалась у большинства линий осины (P. tremula), трансформированных РНКи конструкций на ген 4CL (рис. 2), и максимальное снижение лигнина достигало 23% [56]. Степень развития окраски древесины у этих растений коррелировала со снижением лигнина, и у линий со значительным подавлением экспрессии гена 4CL наблюдалось ослабление роста [57]. Таким образом, подавление активности 4CL часто приводит к значительному ослаблению роста и серьезным физиологическим и морфологическим нарушениям.
Рис. 2.
Окраска древесины у растений осины в возрасте 4 месяцев, трансформированных РНКи вектором на ген 4CL: а – Pt (нетрансформированный контроль), б – Pt 4CL 1c, в – Pt 4CL 2c, г – Pt 4CL 3a, д – Pt 4CL 4a.
От п-кумароил-КоА путь монолигнолов разветвляется на биосинтез Н-единиц и общую ветвь для S- и G-единиц (ферменты НСТ, C3'H и ССоАОМТ). У растений P. grandidentata × alba с РНКи конструкцией на ген С3Н содержание лигнина варьировало в широких пределах – от схожих с контролем (22%) до очень низкого (9%), причем снижение лигнина до 17% не влияло на соотношение S : G (64 : 36), но при низком уровне лигнина резко возростало содержание Н-единиц (Н : S : G = 21 : 19 : 60), причем только за счет G‑единиц [58]. У растений линии с минимальным лигнином объем биомассы был ниже в 3 с лишним раза, а сухая масса корней – ниже в 9 раз [59]. Интересно, что подавление активности C3'H привело к значительному накоплению нескольких глюкозидов п‑кумаровой кислоты, обладающих активностью в отношении грибных патогенов и насекомых-вредителей, что может повысить защитные свойства растений [58]. О резком росте Н-единиц (с 0.5 до 23.8%) сообщалось и для P. trichocarpa с РНКи вектором на ген С3Н3 [26]. Подавление экспрессии гена С3Н у эвкалипта снизило содержание лигнина на 25% и высоту растений с 6 до 2 м [52]. Сравнение РНКи подавления у P. alba × × P. glandulosa экспрессии генов C3H или HCT показало снижение уровня лигнина на 30 и 20%, соответственно [60]. Авторы сделали вывод, что подавление HCT было эффективнее, чем C3H, за счет значительного повышения механических свойств клеточной стенки. Растения P. tomentosa с антисмысловым геном CCoAOMT после 5 лет в поле демонстрировали снижение лигнина на 10% без каких-либо отклонений в росте [61]. В работе этой же ветви биосинтеза лигнина участвует и недавно открытый фермент CSE. Подавление гена CSE с помощью РНКи у P. tremula × P. alba снизило содержание лигнина (на 19–25%) и соотношение S : G (c 2.1 до 1.9), а также повысило уровень Н‑единиц (с 0.6 до 1.2%) [5]. Трансгенные деревья не отличались по морфологии и скорости роста от контроля, что открывает перспективы использования этого гена в качестве мишени для модификации содержания и/или состава лигнина в растениях.
Фермент CCR катализирует предпоследнюю стадию биосинтеза монолигнолов. Около 5% трансформантов P. tremula × P. alba с геном CCR имели карликовый фенотип и погибли еще на стадии in vitro, но у остальных не было отклонений в росте, несмотря на снижение уровня лигнина до 50% и то, что у некоторых растений была оранжево-красная окраска древесины [62]. У березы Betula platyphylla с подавлением экспрессии гена CCR содержание лигнина существенно не изменилось, но у двулетних растений неожиданно увеличилась высота до 35%, а масса стеблей возросла в 2.5 раза [63].
Подавление экспрессии генов начала пути биосинтеза обычно изменяет содержание лигнина, а подавление экспрессии генов поздних этапов – его состав. Ферменты F5H и СОМТ регулируют соотношение S- и G-единиц, и сверхэкспрессия гена F5H в P. tremula × P. alba не изменила содержание лигнина, но повысила долю S-единиц до 97.5% (в контроле 68%) и увеличила соотношение S : G до 38 [22]. Это привело к заметным изменениям структуры лигнина (увеличению линейности и снижению полимеризации), но не повлияло на фенотип растений. Трансформация P. tremula × P. alba геном COMT также почти не изменила содержание лигнина, за исключением одной линии, у которой уровень лигнина снизился на 17% [64]. У этой линии также сильно изменилась структура лигнина: упало содержание S-единиц (с 64–67% до 5–6%) и возросло содержание 5-гидроксигваяцильных единиц (с 1 до 11–12%), но это не привело к изменениям в росте растений.
Фермент CAD катализирует последний этап биосинтеза монолигнолов – восстановление п-кумарового, кониферилового и синапового альдегидов до соответствующих спиртов и является хорошей мишенью. Подавление активности CAD c помощью антисмыслового гена в P. deltoides × P. nigra незначительно снизило содержание лигнина (с 19.6 до 17.5–18%), но у линий с уровнем активности CAD 30% и ниже древесина приобрела светло-красную окраску [65]. У таких растений до половины лигнина могло растворяться в щелочи при комнатной температуре, что говорит об аномально высоком содержании свободных фенольных концевых групп. Подавление экспрессии гена CAD1 с помощью РНКи в P. tremula × P. alba не уменьшило биомассу, несмотря на 10% снижение содержания лигнина и серьезные изменения в его составе: значительное увеличение (до 20 раз) встраивания синапового альдегида в лигнин, в том числе и в виде нового соединения – гомодимера [27].
Модификация регуляции биосинтеза лигнина
Модификация биосинтеза лигнина проводилась и с помощью генов ТФ. В ряде случаев сверхэкспрессия ТФ MYB в растениях тополя повышало содержание лигнина, сопровождаемое небольшим ослаблением роста. Так, перенос гена PtrMYB152 активировал экспрессию всех генов биосинтеза лигнина, кроме гена F5H2, и повысил содержание лигнина на 10–29% [35], а перенос гена PtoMYB216 увеличил содержание лигнина на 25–43% и вызвал его отложение в обычно нелигнифицированных клетках [1]. Кроме генов ТФ, для регуляции биосинтеза лигнина недавно стали использоваить и микроРНК. В P. tomentosa ослабление экспрессии микроРНК miR6443, регулирующей экспрессию гена F5H2, увеличило в лигнине долю S-единиц без изменения его содержания, но растения имели полегающий фенотип со сниженной механической прочностью стеблей [66].
В ряде случаев ТФ биосинтеза лигнина участвовали в реакциях растений на внешние воздействия. Трансформация тополя геном EgMYB88 из эвкалипта, представителя отсутствующей у арабидопсиса подгруппы WPS-I из семейства MYB, привела к увеличению соотношения S : G вместе со значительным повышением содержания флавоноидов и фенольных гликозидов, известных своими защитными функциями [34]. Авторы предполагают, этот ген может регулировать в камбии и первых слоях дифференцирующейся ксилемы биосинтез фенилпропаноидных метаболитов, способствуя адаптации формирования древесины к условиям окружающей среды. У тополя обнаружили осмотин-подобный белок PdOLP1, представители семейства которого участвуют в защите от абиотических и биотических стрессов, включая и грибные патогены [67]. Исследования с трансгенными растениями P. alba × P. glandulosa показали, что PdOLP1 может функционировать как негативный регулятор биосинтеза вторичной стенки и играет важную роль в развитии растений при нормальных и стрессовых условиях.
Недавно был обнаружен механизм управления биосинтезом лигнина, основанный на регуляции активности белка ТФ путем его посттрансляционной модификации – фосфорилирования. ТФ тополя LTF1 связывался с промотором гена 4CL и в нефосфорилированном состоянии подавлял лигнификацию, но под действием внешних факторов, например, поранения, происходило фосфорилирование белка с его последующим разрушением протеасомами, что активировало биосинтез лигнина [29]. Таким образом, этот ТФ регулирует биосинтез лигнина в ответ на факторы окружающей среды. Этот механизм было предложено использовать для предотвращения ослабления роста, часто наблюдаемого при модификации биосинтеза лигнина. Экспрессия гена LTF1 под сосудоспецифичным промотором привела к карликовости и развитию тонкостенных сосудов, а под волокноспецифичным – к снижению содержания лигнина с 22.2 до 12.5% без изменений в росте и развитии растений [16]. Таким образом, была разработана эффективная стратегия точного регулирования биосинтеза лигнина без нежелательных последствий.
Модификация биосинтеза лигнина с помощью редактирования генома
Технология редактирования генома с помощью системы CRISPR/Cas9, которая обеспечивает стабильные мутации потери функций в генах-мишенях, успешно применялась и для модификации биосинтеза лигнина у деревьев. Впервые об этом сообщалось в 2015 г., когда 100% эффективность была достигнута на P. tremula × P. alba при использовании в качестве мишени генов 4CL1 и 4CL2: у всех линий наблюдалась красно-коричневая окраска древесины [68]. Содержание лигнина в растениях снизилось на 23%, а соотношение S:G – с 1.81 до 1.26. Эффективность этого метода значительно превосходила предыдущие исследования с использованием косупрессии, антисмысловой стратегии или РНКи, где значительные изменения наблюдались только у небольшого числа трансформантов [68]. После 4 лет выращивания в теплице снижение уровня лигнина почти не изменилось и составило 19% [69].
В качестве мишеней для этой технологии использовали и гены ТФ. Мутация в гене ТФ PtoMYB170 из P. tomentosa, вызванная с помощью CRISPR/Cas9, снизила содержание лигнина на 8–12% и придала растениям полегающий фенотип, что указывает на активацию этим геном биосинтеза лигнина [47]. С помощью CRISPR/Cas9 в P. tremula × P. tremuloides нокаутировали четыре гена NST/SND из семейства ТФ NAC и показали, что они являются ключевыми регуляторами образования вторичной клеточной стенки в волокнах древесины и флоэмы [70].
ПЛЮСЫ И МИНУСЫ МОДИФИКАЦИИ ЛИГНИНА В ДЕРЕВЬЯХ
Путем генетической модификации биосинтеза лигнина в трансгенных деревьях удалось существенно улучшить эффективность сахарификации – важный показатель пригодности лигноцеллюлозной биомассы для получения биотоплива. У растений P. trichocarpa с пониженным лигнином выход сахара был выше вне зависимости от вида предварительной обработки, что указывает на лигнин как основную причину низкой эффективности осахаривания биомассы [71]. Эффективность ферментативного гидролиза целлюлозы после щелочной обработки биомассы 5-летних растений P. tomentosa с антисмысловым геном CCoAOMT составила 67–77% по сравнению с 53–69% у обычных деревьев [61]. Существенное увеличение выхода глюкозы было показано для растений P. tremula × P. alba с подавленной активностью ферментов CAD [27] или CSE [5].
Работы последних лет показали, что улучшить сахарификацию возможно и с помощью генов ТФ, например, путем подавления экспрессии микроРНК miR6443 в P. tomentosa [66]. На эффективность осахаривания влияла и тканеспецифичность экспрессии встроенных генов: выход глюкозы из биомассы тополя с волокноспецифичным подавлением биосинтеза лигнина был увеличен на 67%, а с сосудистоспецифичным – наоборот, снижен на 65% [16]. Известно, что высокое содержание лигнина отрицательно влияет на сахарификацию, тогда как высокое соотношение S : G – положительно [72]. Для оценки эффекта каждого из этих факторов использовали растения тополя с экспрессией гена ТФ NAC и выяснили, что высокое содержание лигнина доминирует над высоким соотношением S:G [32]. Кроме них, на процесс сахарификации могут влиять и другие факторы: наличие в лигнине неканонических монолигнолов и свободных фенольных групп, количество и структурные особенности ксилана, поражаемость вредителями и патогенами (т.е. присутствие “стрессового” лигнина другого состава) [72].
Положительные результаты были получены и в направлении повышения экстрагируемости лигнина. Щелочная делигнификация (крафт-процесс) древесины выращенных в поле 5-летних растений P. tremula × P. alba с геном SSR проходила легче, что снизило расход химикатов на 12% [62]. Значительно превосходила обычную древесину по эффективности делигнификации (ниже число Каппа, выше выход и вязкость пульпы) древесина P. alba × P. grandidentata с геном FMT, содержащая zip-лигнин, названный так по наличию химически лабильных эфирных связей (zips – застежек-молний) [73].
К сожалению, кроме своих достоинств, трансгенные деревья с модифицированным биосинтезом лигнина часто демонстрировали отклонения в росте и развитии, вызванные нарушением его основных функций – обеспечения механической поддержки и водного транспорта. Исследования биомеханики растений P. tremuloides с генами 4CL и/или CAld5H показали, что снижение лигнина вызывало уменьшение как модуля упругости, так и прочности на сжатие параллельно волокнам [18]. Значительное снижение содержания лигнина (на 30%) без изменения соотношения S:G в древесине P. tremula × tremuloides с антисмысловым геном С4Н существенно снизило модуль упругости, вероятно, из-за уменьшения плотности древесины, но не повлияло на прочность на растяжение [51]. Исследования на P. tremula × P. alba с супрессированным геном CSE показали, что модуль упругости был снижен на 36–53%, а предел прочности – примерно на 15% [74]. Модуль упругости при этом хорошо коррелировал со снижением плотности и содержания лигнина.
Некоторое снижение продуктивности деревьев с уменьшенным содержанием лигнина может быть компенсировано повышением эффективности делигнификации и осахаривания, но так происходит не всегда. Как правило, значительное отставание в росте вызывает изменение активности ферментов C4H, 4CL, C3'H, HCT и CCR, но не F5H, COMT и CAD. Ослабление роста обычно связывают с тем, что дефицит лигнина в ксилеме приводит к разрушению клеток и это вызывает коллапс сосудов и нарушение водного транспорта [8, 75]. Кроме того, нарушение биосинтеза лигнина приводит к накоплению промежуточных фенольных соединений, которые могут оказывать токсический эффект сами по себе или в сочетании с другими веществами, а также ингибировать ферменты биосинтеза лигнина или влиять на уровень гормонов [19]. По-видимому, существует определенный предел содержания лигнина, ниже которого рост растений значительно ухудшается: например, полевые испытания трансгенных тополей показали, что снижение лигнина менее чем на 10% не влияет на рост, а на 20% – существенно его замедляет [54].
В ряде исследований была показана прямая связь между снижением содержания лигнина и нарушением водного транспорта. Сильное ингибирование лигнификации клеточной стенки у растений тополя с подавлением активности C3'H привело к коллапсу ксилемы и ухудшению гидравлической проводимости [59]. В работе Kitin с соавт. [4] снижение лигнина до 40% в растениях P. tremula × P. alba с антисмысловым геном 4CL вызвало ослабление гидравлической проводимости и гибель ветвей в конце сезона, но причиной был не коллапс сосудов, а их блокировка тиллами и отложением фенольных соединений. Выращивание этих же растений с поддержкой показало, что механические нагрузки при сниженном лигнине ухудшают водный транспорт ксилемы [75].
Влияние внешних условий на водный транспорт оценивали в работе Marchin с соавт. [76]: трансгенные деревья P. trichocarpa, у которых гидравлическая проводимость составляла 15–25% от контроля, выращивали в горном и более жарком и сухом районах. В сухом районе у деревьев длина побегов и площадь листьев снизилась в 2–4 раза, но в горном рост не изменился и был отмечен неожиданный эффект – снижение потребления воды без ущерба для продуктивности. Таким образом, снижение гидравлической проводимости может использоваться для повышения эффективности использования воды растениями [76].
Исследования показывают необходимость адекватной лигнификации деревьев для механической поддержки ствола и водного транспорта, и через них – для роста и выживания. В условиях глобального изменения климата, приводящего к увеличению продолжительности и интенсивности засушливых периодов, особое значение приобретает гидравлическая проводимость. Возможно, снижение этого параметра из-за изменений лигнификации в текущих условиях не является критическим, но деревья растут долго, и в будущем усиление водного стресса может ухудшить его до некоего порогового уровня, после которого последует ослабление роста и даже гибель растений от высыхания.
НОВЫЕ СТРАТЕГИИ МОДИФИКАЦИИ ЛИГНИНА
Генно-инженерное изменение состава лигнина
В целом выяснилось, что несложно получить трансгенные деревья со значительно сниженным содержанием лигнина, но такие растения часто обладают различными дефектами роста и развития, и более перспективным представляется изменение его состава. Новые физико-химические свойства, обусловленные составом лигнина, могут повысить его экстрагируемость и/или уменьшить ингибирующее воздействие на осахаривание лигноцеллюлозной биомассы.
На основе исследований особенностей биосинтеза и биохимии лигнина в различных растениях, включая трансгенные, было предложено несколько стратегий. Одна из них предусматривает изменение соотношения классических мономеров лигнина, а другие – включение в состав новых мономеров, обеспечивающих: а) увеличение химически лабильных связей, б) снижение степени полимеризации, в) снижение гидрофобности, г) ослабление связей с полисахаридами [17, 77]. Первая стратегия основана на том, что увеличение S-единиц в лигнине увеличивает частоту наиболее лабильных β-эфирных связей и одновременно уменьшает частоту связей 5–5 и β–5, что улучшает экстрагируемость [77]. В работе Studer с соавт. [72] на деревьях P. trichocarpa с широким диапазоном содержания лигнина (15.7–27.9%) и соотношения S:G (1.0–3.0) было показано, что отрицательное влияние содержания лигнина ослаблялось только при соотношениях S : G > 2.0. Кроме того, лигнин трансгенного тополя с геном F5H, состоящий почти исключительно из S-единиц (97.5%), имел пониженную полимеризацию, так как разветвлению цепи препятствовало замещение мономеров как в 3′-, так и в 5′-положениях ароматического кольца [22].
Неканонические мономеры, предполагаемые для включения в состав лигнина, должны отвечать нескольким условиям. В обязательном порядке они должны эффективно связываться с другими мономерами и кроме этого: а) синтезироваться в достаточных количествах, б) производиться в лигнифицирующихся клетках или транспортироваться в них, в) эффективно встраиваться в клеточную стенку [19]. Примерами таких мономеров являются, например, конъюгаты монолигнолов, включение которых в состав лигнина увеличивает количество легко расщепляемых эфирных связей, что облегчает его деполимеризацию при щелочной обработке. Экспрессия гена FMT в P. alba × P. grandidentata привела к образованию так называемого “zip-лигнина” с большим количеством (7–23%) ферулатных конъюгатов монолигнолов, что значительно повысило эффективность осахаривания при слабощелочной обработке [78] и выхода крафт-пульпы [73].
Другим способом является снижение степени полимеризации (укорачивание цепей лигнина). Мономеры с алифатическими или фенольными концевыми группами способны только инициировать или завершать полимеризацию, и повышение их доступности может привести к образованию лигнина с увеличенным числом коротких молекул, то есть лигнина с пониженной степенью полимеризации [79]. Схожим образом остановка полимеризации была достигнута встраиванием в P. tremula × P. alba гена монолигнол-4-O-метилтрансферазы (MOMT4) [80]. Это привело к образованию 4-O-метилированных конифериловых и синаповых спиртов, которые не могут включаться в растущий полимер лигнина, что снизило его содержание без изменения фенотипа и повысило эффективность осахаривания на 50–62%.
Наконец, включение в состав гидрофобного по своей природе лигнина гидрофильных мономеров (например, гваяцилглицерина) или мономеров, которые минимизируют количество связей лигнин-полисахарид (например, кофейного спирта), может повысить его растворимость в процессе делигнификации и улучшить доступ ферментов во время гидролиза биомассы [79]. Так как реакции растений на включение в состав лигнина новых мономеров изучены еще недостаточно, применение таких стратегий требует проведения испытаний в полевых условиях для изучения их роста, развития и устойчивости к биотическим и абиотическим стрессам.
Природные мутации и вариации генотипа деревьев
Другим направлением преодоления отклонений в росте и развитии растений с модифицированным лигнином является использование природных форм, мутантных по биосинтезу лигнина, которые смогли выжить в ходе естественного отбора, что демонстрирует их жизнеспособность. Таких мутантных деревьев известно очень мало. У кукурузы и родственных видов мутации в генах биосинтеза лигнина (bm или bmr), придающие красно-коричневую окраску центральной жилке листа, известны давно, но только в середине 1990-х гг. сообщили о первом древесном растении с подобной мутацией – сосне ладанной (Pinus taeda) [28]. Как и у кукурузы, у сосны мутация была в гене фермента последнего этапа биосинтеза лигнина CAD, что снизило активность фермента до 1% от нормы и ниже. У сосны, гомозиготной по мутантной аллели cad-n1, была коричнево-красная древесина, сниженное содержание лигнина и значительно измененный состав, но доля Н-единиц не изменилась, что указывает на независимый механизм образования п-кумарового спирта [28]. Несмотря на значительные изменения состава лигнина, его функции не были нарушены, и мутантные сосны росли нормально.
С помощью секвенирования 768 деревьев из природной популяции P. nigra был выявлен мутант, гомозиготный по гену с преждевременным стоп-кодоном, кодирующим фермент НСТ, который необходим для синтеза мономеров G- и S-лигнина [81]. У генотипа с дефектным геном содержание лигнина не изменилось, но резко выросло содержание Н-единиц (с 0.4 до 7%) в основном за счет G-единиц, что также повысило соотношение S : G с 1.8 до 2.4, но не вызвало различий по росту и фенотипу [81].
Наконец, недавно было охарактеризовано мутантное дерево шелковицы (Morus alba) с поникающими ветвями и необычной красной древесиной, обнаруженное около 1912 г. в Японии [82]. У этого дерева по сравнению с другими сортами шелковицы были снижены содержание лигнина (14.9% и 20.1–22.3%) и соотношение S : G (0.78 и 0.99–1.19). Секвенирование показало в гене CAD вставку гуанина вблизи старт-кодона, что приводило к преждевременному образованию стоп-кодона в аминокислотной цепи фермента [82]. Авторы публикации считают, что одной из причин редкого выявления мутантных по лигнину деревьев является то, что один из признаков мутации – изменение окраски древесины под корой – чрезвычайно сложно идентифицировать.
Из-за уникальности мутантных деревьев более перспективным представляется использование природного генетического разнообразия. Известно, что существует большая разница в количестве и составе лигнина между особями одного и того же вида. Например, из сотни неродственных природных генотипов Eucalyptus globulus были отобраны две контрастные группы по 5 растений, различающиеся выходом целлюлозы на 4%, что представляет собой значительный потенциальный выигрыш для промышленности [83]. Изучение природных популяций P. deltoides, P. nigra и P. trichocarpa показало, что содержание лигнина в них колеблется от 14 до 30%, а соотношении S : G – от 1 до 3 [84]. Так как оба этих фактора влияют на эффективность получения целлюлозы и биотоплива, то включение таких генотипов в селекционные программы с применением современных методов, например, маркер-опосредованной или геномной селекции, является многообещающей альтернативой модификации лигнина методами генной инженерии.
ОЦЕНКА В ПОЛЕ И БИОБЕЗОПАСНОСТЬ ТРАНСГЕННЫХ ДЕРЕВЬЕВ
По экономическим и правовым причинам большинство исследований с трансгенными деревьями проводится в теплице, хотя именно для деревьев полевые испытания имеют большое значение, т. к. результаты тепличных исследований в основном нельзя экстраполировать на поведение растений в естественных условиях. В теплице деревья не испытывают ежегодную смену циклов периодов покоя и роста, не подвергаются воздействию вредителей и заболеваний, у них нарушается процесс формирования древесины, а также очень сложно оценить стабильность экспрессии перенесенных генов [85]. Лигнин играет значительную роль в стрессоустойчивости, поэтому самые различные стрессовые факторы окружающей среды могут заметно влиять на жизнеспособность растений по сравнению с тепличными условиями. Неоднократно сообщалось о снижении продуктивности деревьев в полевых условиях, например, для растений P. tremula × P. alba с генами CCR [58]. Кроме того, принципиальные различия в росте и развитии деревьев P. trichocarpa с супрессией гена 4CL наблюдались при их выращивании в двух районах, различающихся по температуре и количеству осадков [72].
Вмешательство в метаболизм фенилпропаноидов также может влиять на биосинтез вторичных метаболитов, которые играют важную роль во взаимодействиях растений с окружающей средой. Тем не менее, оценка биобезопасности различных видов из рода Populus и березы повислой (Betula pendula) в полевых условиях не выявила существенного влияния встраивания генов биосинтеза лигнина на образование эктомикоризы [86], разложение листового опада [49], поражение вредителями или болезнями [87]. В случае обнаружения каких-либо различий по сравнению с контролем они находились в пределах внутривидовой изменчивости для коммерческих сортов [86].
Одним из основных направлений генной инженерии лесных пород, наряду с модификацией лигнина, является повышение их продуктивности, и большой интерес представляет взаимодействие между этими признаками. Многочисленные исследования показали отрицательную корреляцию между содержанием лигнина и биомассой (объемом древесины), которую можно рассматривать как конкуренцию за углерод между основными компонентами древесины – лигнином, с одной стороны, и целлюлозы с гемицеллюлозами – с другой [88]. Полевые испытания гибрида P. tremula × P. alba с геном глутаминсинтетазы сосны GS1a, обладающего усиленным ростом, не показали изменения уровня лигнина, но соотношение S:G возросло с 1.99 до 2.23 и это привело к улучшению растворения лигнина при щелочной делигнификации древесины [89]. В древесине двулетних растений осины (P. tremula) с геном GS1 сосны наблюдали другие изменения: содержание лигнина снизилось на 5–8%, а соотношение S:G – с 2.35–2.40 до 1.95–2.21 [90]. Таким образом, более продуктивные деревья потенциально могут обладать улучшенными характеристиками для производства целлюлозы и биотоплива.
Несмотря на всю важность полевых испытаний, практически невозможно оценить последствия выращивания трансгенных деревьев на некоторые долгосрочные процессы, например, круговорот биофильных элементов, в котором задействовано большое число изменяющихся, причем иногда случайным образом, факторов. Более того, на этот процесс влияет глобальное изменение климата, и все это делает возможным его оценку только с помощью математического моделирования. Впервые подобные исследования с трансгенными деревьями были проведены на осине с геном ксилоглюканазы Xeg и супрессированным геном 4CL [91, 92]. В моделях оценивали влияние трансгенных плантаций для нужд целлюлозно-бумажной промышленности на круговорот углерода и азота, и необратимых изменений не обнаружили. Лигнин является наиболее трудноразлагаемой частью древесины, и изменения его содержания и/или состава могут оказывать влияние на круговорот элементов питания в почве. В связи с этим, моделирование последствий выращивания деревьев с модифицированным лигнином должно стать необходимым элементом оценки биобезопасности таких растений перед их коммерческим применением.
ЗАКЛЮЧЕНИЕ
Содержание и состав лигнина в растениях являются основными факторами, влияющими на эффективность производства целлюлозы и биотоплива. Необходимость улучшения этих показателей способствовала значительному прогрессу в нашем понимании биосинтеза лигнина и механизмов регуляции лигнификации, а также влияния лигнина на рост и развитие растений. Эти знания позволили разработать ряд эффективных стратегий по модификации содержания и структуры лигнина, позволяющих не только улучшить характеристики лигноцеллюлозной биомассы с точки зрения ее переработки, но и минимизировать нежелательные последствия таких манипуляций для растений. Тем не менее, модификация лигнина, выполняющего и защитные функции, увеличивает риск ослабления устойчивости растений к экстремальным биотическим и абиотическим стрессам, которые увеличиваются в связи с изменением климата, что может привести к снижению продуктивности и даже к гибели растений. Это особенно важно для древесных растений, плантации которых закладываются на многие годы или даже десятилетия.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований в рамках научного проекта № 19-116-50103.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Tian Q., Wang X., Li C., Lu W., Li Yang L., Jiang Y., Luo K. Functional characterization of the poplar R2R3-MYB transcription factor PtoMYB216 involved in the regulation of lignin biosynthesis during wood formation // PLoS One. 2013. V. 8: e76369. https://doi.org/10.1371/journal.pone.0076369
Загоскина Н.В. Фенольные соединения и их участие в защите растений от стрессовых воздействий // Мат. X Междунар. симп. “Фенольные соединения: фундаментальные и прикладные аспекты”. Москва, 2018. С. 150.
Moura J.C., Bonine C.A., Viana J.D.O.F., Dornelas M.C., Mazzafera P. Abiotic and biotic stresses and changes in the lignin content and composition in plants // J. Integr. Plant Biol. 2010. V. 52. P. 360. http:// doi.org/https://doi.org/10.1111/j.1744-7909.2010.00892.x
Kitin P., Voelker S.L., Meinzer F.C., Beeckman H., Strauss S.H., Lachenbruch B. Tyloses and phenolic deposits in xylem vessels impede water transport in low-lignin transgenic poplars: a study by cryo-fluorescence microscopy. Plant Physiol. 2010. V. 154. P. 887. https://doi.org/10.1104/pp.110.156224
Saleme M.L.S., Cesarino I., Vargas L., Kim H., Vanholme R., Goeminne G., van Acker R., Fonseca F.C.A., Pallidis A., Voorend W., Junior J.N., Padmakshan D., van Doorsselaere J., Ralph J., Boerjan W. Silencing caffeoyl shikimate esterase affects lignification and improves saccharification in poplar // Plant Physiol. 2017. V. 175. P. 1040. https://doi.org/10.1104/pp.17.00920
Grev A.M., Wells M.S., Samac D.A., Martinson K.L., Sheaffer C.C. Forage accumulation and nutritive value of reduced lignin and reference alfalfa cultivars // Agron. J. 2017. V. 109. P. 2749. https://doi.org/10.2134/agronj2017.04.0237
Liu C.-J., Cai Y., Zhang X., Gou M., Yang H. Tailoring lignin biosynthesis for efficient and sustainable biofuel production // Plant Biotechnol. J. 2014. V. 12. P. 1154. https://doi.org/10.1111/pbi.12250
Bonawitz N.D., Chapple C. The genetics of lignin biosynthesis: connecting genotype to phenotype // Annu. Rev. Genet. 2010. V. 44. P. 337. https://doi.org/10.1146/annurev-genet-102209- 163508
Al-Haddad J.M., Kang K.-Y., Mansfield S.D., Telewski F.W. Chemical responses to modified lignin composition in tension wood of hybrid poplar (Populus tremula × × Populus alba) // Tree Physiol. 2013. V 33. P. 365. https://doi.org/10.1093/treephys/tpt017
Vanholme R., Cesarino I., Rataj K., Xiao Y., Sundin L., Goeminne G., Kim H., Cross J., Morreel K., Araujo P., Welsh L., Haustraete J., McClellan C., Vanholme B., Ralph J. et al. Caffeoyl shikimate esterase (CSE) is an enzyme in the lignin biosynthetic pathway in Arabidopsis // Science. 2013. V. 341. P. 1103. https://doi.org/10.1126/science.1241602
Wang X., Chao N., Zhang M., Jiang X., Gai Y. Functional characteristics of caffeoyl shikimate esterase in Larix kaempferi and monolignol biosynthesis in gymnosperms // Int. J. Mol. Sci. 2019. V. 20: 6071. https://doi.org/10.3390/ijms20236071
Dixon R.A., Barros J. Lignin biosynthesis: old roads revisited and new roads explored // Open Biol. 2019. V. 9: 190215. https://doi.org/10.1098/rsob.190215
del Río J.C., Rencoret J., Gutiérrez A., Elder T., Kim H., Ralph J. Lignin monomers from beyond the canonical monolignol biosynthetic pathway: another brick in the wall // ACS Sustainable Chem. Eng. 2020. V. 8. P. 4997. https://doi.org/10.1021/acssuschemeng.0c01109
Ralph J., Brunow G., Harris P.J., Dixon R.A., Schatz P.F., Boerjan W. Lignification: are lignins biosynthesized via simple combinatorial chemistry or via proteinaceous control and template replication? // Recent Advances in Polyphenol Research / Eds. Daayf F., Lattanzio V. Wiley- Blackwell Publishing. 2008. V. 1. P. 36. https://doi.org/10.1002/9781444302400.ch2
Chanoca A., de Vries L., Boerjan W. Lignin engineering in forest trees // Front. Plant Sci. 2019. V. 10. P. 912. https://doi.org/10.3389/fpls.2019.00912
Gui J., Lam P.Y., Tobimatsu Y., Sun J., Huang C., Cao S., Zhong Y., Umezawa T., Li L. Fibre-specific regulation of lignin biosynthesis improves biomass quality in Populus // New Phytol. 2020. V. 226. P. 1074. https://doi.org/10.1111/nph.16411
Mottiar Y., Vanholme R., Boerjan W., Ralph J., Mansfield S.D. Designer lignins: harnessing the plasticity of lignification // Curr. Opin. Biotechnol. 2016. V. 37. P. 190. http:// doi.org/https://doi.org/10.1016/j.copbio.2015.10.009
Horvath L., Peszlen I., Peralta P., Kasal B., Li L. Mechanical properties of genetically engineered young aspen with modified lignin content and/or structure // Wood Fiber Sci. 2010. V. 42. P. 310. https://doi.org/10.1016/j.sajb.2014.01.002
Vanholme R., De Meester B., Ralph J., Boerjan W. Lignin biosynthesis and its integration into metabolism // Curr. Opin. Biotechnol. 2019. V. 56. P. 230. https://doi.org/10.1016/j.copbio.2019.02.018
Lu F., Marita J.M., Lapierre C., Jouanin L., Morreel K., Boerjan W., Ralph J. Sequencing around 5-hydroxyconiferyl alcohol-derived units in caffeic acid O-methyltransferase-deficient poplar lignins // Plant Physiol. 2010. V. 153. P. 569. https://doi.org/10.1104/pp.110.154278
Wagner A., Tobimatsu Y., Phillips L., Flint H., Torr K., Donaldson L., Pears L., Ralph J. CCoAOMT suppression modifies lignin composition in Pinus radiata // Plant J. 2011. V. 67. P. 119. https://doi.org/10.1111/j.1365-313X.2011.04580.x
Stewart J.J., Akiyama T., Chapple C., Ralph J., Mansfield S.D. The effects on lignin structure of overexpression of ferulate 5-hydroxylase in hybrid poplar // Plant Physiol. 2009. V. 150. P. 621. https://doi.org/10.1104/pp.109.137059
Karlen S.D., Zhang C., Peck M.L., Smith R.A, Padmakshan D., Helmich K.E., Free H.C.A., Lee S., Smith B.G., Lu F., Sedbrook J.C., Sibout R., Grabber J.H., Runge T.M., Mysore K.S. et al. Monolignol ferulate conjugates are naturally incorporated into plant lignins // Sci. Adv. 2016. V. 2: e1600393. https://doi.org/10.1126/sciadv.1600393
del Rıo J.C., Marques G., Rencoret J., Martınez A.T., Gutierrez A. Occurrence of naturally acetylated lignin units // J. Agric. Food Chem. 2007. V. 55. P. 5461. https://doi.org/10.1021/jf0705264
Karlen S.D., Smith R.A., Kim H., Padmakshan D., Bartuce A., Mobley J.K., Free H C.A., Smith B.G., Harris P.J., Ralph J. Highly decorated lignins in leaf tissues of the Canary Island date palm Phoenix canariensis // Plant Physiol. 2017. V. 175. P. 1058. https://doi.org/10.1104/pp.17.01172
Kim H., Li Q., Karlen S.D., Smith R.A., Shi R., Liu J., Yang C., Tunlaya-Anukit S., Jack P. Wang J.P., Chang H.-M., Sederoff R.R., Ralph J., Chiang V.L. Monolignol benzoates incorporate into the lignin of transgenic Populus trichocarpa depleted in C3H and C4H // ACS Sustainable Chem. Eng. 2020. V. 8. P. 3644. https://doi.org/10.1021/acssuschemeng.9b06389
van Acker R., Déjardin A., Desmet S., Hoengenaert L., Vanholme R., Morreel K., Laurans F., Kim H., Santoro N., Foster C., Goeminne G., Légée F., Lapierre C., Pilate G., Ralph J. et al. Different routes for conifer- and sinapaldehyde and higher saccharification upon deficiency in the dehydrogenase CAD // Plant Physiol. 2017. V. 175. P. 1018. https://doi.org/10.1104/pp.17.00834
Ralph J., MacKay J.J., Hatfield R.D., O’Malley D.M., Whetten R.W., Sederoff R.R. Abnormal lignin in a loblolly pine mutant // Science. 1997. V. 277. P. 235. https://doi.org/10.1126/science.277.5323.235
Gui J., Luo L., Zhong Y., Sun J., Umezawa T., Li L. Phosphorylation of LTF1, an MYB transcription factor in Populus, acts as a sensory switch regulating lignin biosynthesis in wood cell // Mol. Plant. 2019. V. 12. P. 1325. https://doi.org/10.1016/j.molp.2019.05.008
Jervis J., Hildreth S.B., Sheng X., Beers E.P., Brunner A.M., Helm R.F. A metabolomic assessment of NAC154 transcription factor overexpression in field grown poplar stem wood // Phytochemistry. 2015. V. 115. P. 112. https://doi.org/10.1016/j.phytochem.2015.02.013
Zhong R., McCarthy R.L., Lee C., Ye Z.-H. Dissection of the transcriptional program regulating secondary wall biosynthesis during wood formation in poplar // Plant Physiol. 2011. V. 157. P. 1452. https://doi.org/10.1104/pp.111.181354
Yang Y., Yoo C.G., Rottmann W., Winkeler K.A., Collins C.M., Gunter L.E., Jawdy S.S., Yang X., Pu Y., Ragauskas A.J., Tuskan G.A., Chen J.G. PdWND3A, a wood-associated NAC domain-containing protein, affects lignin biosynthesis and composition in Populus // BMC Plant Biol. 2019. V. 19: 486. https://doi.org/10.1186/s12870-019-2111-5
Lebedev V.G., Subbotina N.M., Maluchenko O.P., Lebedeva T.N., Krutovsky K.V., Shestibratov K.A. Transferability and polymorphism of SSR markers located in flavonoid pathway genes in Fragaria and Rubus species // Genes. 2020. V.11: 11. https://doi.org https://doi.org/10.3390/ genes11010011
Soler M., Plasencia A., Lepikson-Neto J., Camargo E.L.O., Dupas A., Ladouce N., Pesquet E., Mounet F., Larbat R., Grima-Pettenati J. The Woody-preferential gene EgMYB88 regulates the biosynthesis of phenylpropanoid-derived compounds in wood // Front. Plant Sci. 2016. V. 7: e1422. https://doi.org/10.3389/fpls.2016.01422
Li C., Wang X., Lu W., Liu R., Tian Q., Sun Y., Luo K. A poplar R2R3-MYB transcription factor, PtrMYB152, is involved in regulation of lignin biosynthesis during secondary cell wall formation // Plant Cell Tiss. Organ Cult. 2014. V. 119. P. 553. https://doi.org/10.1007/s11240-014- 0555-8
Legay S., Sivadon P., Blervacq A.S., Pavy N., Baghdady A., Tremblay L., Levasseur C., Ladouce N., Lapierre C., Séguin A. EgMYB1, an R2R3 MYB transcription factor from eucalyptus negatively regulates secondary cell wall formation in Arabidopsis and poplar // New Phytol. 2010. V. 188. P. 774. https://doi.org/10.1111/j.1469-8137.2010.03432.x
Yang L., Zhao X., Ran L.Y., Li C.F., Fan D., Luo K.M. PtoMYB156 is involved in negative regulation of phenylpropanoid metabolism and secondary cell wall biosynthesis during wood formation in poplar // Sci. Rep. 2017. V. 7: 41209. https://doi.org/10.1038/srep41209
Zhong R., Ye Z.H. Complexity of the transcriptional network controlling secondary wall biosynthesis // Plant Sci. 2014. V. 229. P. 193. https://doi.org/10.1016/j.plantsci.2014.09.009
Zhang J., Xie M., Tuskan G.A., Muchero W., Chen J.-G. Recent advances in the transcriptional regulation of secondary cell wall biosynthesis in the woody plants // Front. Plant Sci. 2018. V. 9: 1535. https://doi.org/10.3389/fpls.2018.01535
Xie M., Muchero W., Bryan A.C., Yee K., Guo H.-B., Zhang J., Tschaplinski T.J., Singan V.R., Lindquist E., Payyavula R.S., Barros-Rios J., Dixon R., Engle N., Sykes R.W., Davis M. et al. A 5-enolpyruvylshikimate 3-phosphate synthase functions as a transcriptional repressor in Populus // Plant Cell. 2018. V. 30. P. 1645. https://doi.org/10.1105/tpc.18.00168
Chen H., Wang J.P., Liu H.Z., Li H.Y., Lin Y.-C.J., Shi R., Yang C., Gao J., Zhou C., Li Q., Sederoff R.R., Li W., Chiang V.L. Hierarchical transcription factor and chromatin binding network for wood formation in black cottonwood (Populus trichocarpa) // Plant Cell. 2019. V. 31. P. 602. https://doi.org/10.1105/tpc.18.00620
Cesarino I. Structural features and regulation of lignin deposited upon biotic and abiotic stresses // Curr. Opin. Biotechnol. 2019. V. 56. P. 209. https://doi.org/10.1016/j.copbio.2018.12.012
Mast S.W., Donaldson L.A., Torr K., Phillips L., Flint H., West M., Strabala T.J., Wagner A. Exploring the ultrastructural localization and biosyn-thesis of β(1,4)-galactan in Pinus radiata compression wood // Plant Physiol. 2009. V. 150. P. 573. https://doi.org/10.1104/pp.108.134379
Gorshkova T., Mokshina N., Chernova T., Ibragimova N., Salnikov V., Mikshina P., Tryfona T., Banasiak A., Immerzeel P., Dupree P., Mellerowicz E.J. Aspen tension wood fibers contain β-(1→4)-galactans and acidic arabinogalactans retained by cellulose microfibrils in gelatinous walls // Plant Physiol. 2015. V. 169. P. 2048. https://doi.org/10.1104/pp.15.00690
Mourasobczak J., Souza U., Mazzafera P. Drought stress and changes in the lignin content and composition in Eucalyptus // BMC Proc. 2011. V. 5. P. 103. http:// doi.org/https://doi.org/10.1186/1753-6561- 5-S7-P103
Srivastava S., Vishwakarma R.K., Arafat Y.A., Gupta S.K., Khan B.M. Abiotic stress induces change in Cinnamoyl CoA Reductase (CCR) protein abundance and lignin deposition in developing seedlings of Leucaena leucocephala // Physiol. Mol. Biol. Plants. 2015. V. 21. P. 197. https://doi.org/10.1007/s12298-015-0289-z
Xu C., Fu X., Liu R., Guo L., Ran L., Li C., Tian Q., Jiao B., Wang B., Luo K. PtoMYB170 positively regulates lignin deposition during wood formation in poplar and confers drought tolerance in transgenic Arabidopsis // Tree Physiol. 2017. V. 37. P. 1713. https://doi.org/10.1093/treephys/tpx093
Khaledian Y., Maali-Amiri R., Talei A. Phenylpropanoid and antioxidant changes in chickpea plants during cold stress. Russ. J. Plant Physiol. 2015. V. 62. P. 772. https://doi.org/10.1134/S1021443715060102
Seong E.S., Jeon M.R., Choi J.H., Yoo J.H., Lee J.G., Na J.K., Kim N.Y., Yu C.Y. Overexpression of S-adenosylmethionine synthetase enhances tolerance to cold stress in tobacco. Russ. J. Plant Physiol. 2020. V. 67. P. 242. https://doi.org/10.1134/S1021443720020144
Gallego-Giraldo L., Pose S., Pattathil S., Peralta A.G., Hahn M.G., Ayre B.G., Sunuwar J., Hernandez J., Patel M., Shah J. Elicitors and defense gene induction in plants with altered lignin compositions // New Phytol. 2018. V. 219. P. 1235. https://doi.org/10.1111/nph.15258
Bjurhager I., Olsson A.-M., Zhang B., Gerber L., Kumar M., Berglund L.A., Burgert I., Sundberg B., Salmen L. Ultrastructure and mechanical properties of Populus wood with reduced lignin content caused by transgenic down-regulation of cinnamate 4-hydroxylase // Biomacromolecules. 2010. V. 11. P. 2359. https://doi.org/10.1021/bm100487e
Sykes R.W., Gjersing E.L., Foutz K., Rottmann W.H., Kuhn S.A., Foster C.E. Ziebell A., Turner G.B., Decker S.R., Hinchee M.A.W., Davis M.F. Down-regulation of p-coumaroyl quinate/shikimate 30-hydroxylase (C3H) and cinnamate 4-hydroxylase (C4H) genes in the lignin biosynthetic pathway of Eucalyptus urophylla x E. grandis leads to improved sugar release // Biotechnol. Biofuels. 2015. V. 8. P. 128. https://doi.org/10.1186/s13068-015-0316-x
Seppanen S.K., Pasonen H.L., Vauramo S., Vahala J., Toikka M., Kilpelainen I., Setala H., Teeri T.H., Timonen S., Pappinen A. Decomposition of the leaf litter and mycorrhiza forming ability of silver birch with a genetically modified lignin biosynthesis pathway // Appl. Soil Ecol. 2007. P. 36. V. 100. https://doi.org/10.1016/j.apsoil.2006.12.002
Voelker S.L., Lachenbruch B., Meinzer F.C., Jourdes M., Ki C., Patten A.M., Davin L.B., Lewis N.G., Tuskan G.A., Gunter L., Decker S.R., Selig M.J., Sykes R., Himmel M.E., Kitin P. et al. Antisense down-regulation of 4CL expression alters lignification, tree growth, and saccharification potential of field-grown poplar // Plant Physiol. 2010. V. 154. P. 874. https://doi.org/10.1104/pp.110.159269
Wagner A., Donaldson L., Kim H., Phillips L., Flint H., Steward D., Torr K., Koch G., Schmitt U., Ralph J. Suppression of 4-coumarate-CoA ligase in the coniferous gymnosperm Pinus radiata // Plant Physiol. 2009. V. 149. P. 370. https://doi.org/10.1104/pp.108.125765
Shestibratov K., Lebedev V., Podrezov A., Salmova M. Transgenic aspen and birch trees for Russian plantation forests // BMC Proc. 2011. V.5. P. 124. https://doi.org/10.1186/1753-6561-5-S7- P124
Kovalitskaya Y., Dayanova L., Azarova A., Shestibratov K. RNA interference-mediated down-regulation of 4-coumarate: coenzyme A ligase in Populus tremula alters lignification and plant growth // Int. J. Environ. Sci. Educ. 2016. V. 11. P. 12259.
Coleman H.D., Park J.-Y., Nair R., Chapple C., Mansfield S.D. RNAi-mediated suppression of p-coumaroyl-CoA 3-hydroxylase in hybrid poplar impacts lignin deposition and soluble secondary metabolism // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 4501. https://doi.org/10.1073/pnas.0706537105
Coleman H.D., Samuels A.L., Guy R.D., Mansfield S.D. Perturbed lignification impacts tree growth in hybrid poplar—a function of sink strength, vascular integrity, and photosynthetic assimilation // Plant Physiol. 2008. V. 148. P. 1229. https://doi.org/10.1104/pp.108.125500
Zhou X., Ren S., Lu M., Zhao S., Chen Z., Zhao R., Lv J. Preliminary study of cell wall structure and its mechanical properties of C3H and HCT RNAi transgenic poplar sapling // Sci. Rep. 2018. V. 8: 10508. https://doi.org/10.1038/s41598-018-28675-5
Wang H., Xue Y., Chen Y., Li R., Wei J. Lignin modification improves the biofuel production potential in transgenic Populus tomentosa // Ind. Crop. Prod. 2012. V. 37. P. 170. https://doi.org/10.1016/j.indcrop.2011.12.014
Leple J.-C., Dauwe R., Morreel K., Storme V., Lapierre C., Pollet B., Naumann A., Kang K.-Y., Kim H., Ruel K., Lefebvre A., Joseleau J.-P., Grima-Pettenati J., De Rycke R., Andersson-Gunnera S. et al. Downregulation of cinnamoyl-coenzyme a reductase in poplar: multiple-level phenotyping reveals effects on cell wall polymer metabolism and structure // Plant Cell. 2007. V. 19. P. 3669. http:// doi.org/https://doi.org/10.1105/tpc.107.054148
Zhang W.B., Wei R., Chen S., Jiang J., Li H.Y., Huang H.J., Yang G., Wang S., Wei H.R., Liu G.F. Functional characterization of CCR in birch (Betula platyphylla x Betula pendula) through overexpression and suppression analysis // Physiol. Plant. 2015. V. 154. P. 283. https://doi.org/10.1111/ppl.12306
Jouanin L., Goujon T., de Nadaı V., Martin M.-T., Mila I., Vallet C., Pollet B., Yoshinaga A., Chabbert B., Petit-Conil M., Lapierre C. Lignification in transgenic poplars with extremely reduced caffeic acid O-methyltransferase activity // Plant Physiol. 2000. V. 123. P. 1363. https://doi.org/10.1104/pp.123.4.1363
Lapierre C., Pilate G., Pollet B., Mila I., Leple J.-C., Jouanin L., Kim H., Ralph J. Signatures of cinnamyl alcohol dehydrogenase deficiency in poplar lignins // Phytochemistry. 2004. V. 65. P. 313. https://doi.org/10.1016/j.phytochem.2003.11.007
Fan D., Li C., Fan C., Hu J., Li J., Yao S., Lu W., Yan Y., Luo K. MicroRNA6443-mediated regulation of ferulate 5-hydroxylase gene alters lignin composition and enhances saccharification in Populus tomentosa // New Phytol. 2020. V. 226. P. 410. https://doi.org/10.1111/nph.16379
Li S., Zhang Y., Xin X., Ding C., Lv F., Mo W., Xia Y., Wang S., Cai J., Sun L., Du M., Dong C., Gao X., Dai X., Zhang J., Sun J. The osmotin-like protein gene PdOLP1 is involved in secondary cell wall biosynthesis during wood formation in poplar // Int. J. Mol. Sci. 2020. V. 21: e3993. https://doi.org/10.3390/ijms21113993
Zhou X., Jacobs T.B., Xue L.J., Harding S.A., Tsai C.J. Exploiting SNPs for biallelic CRISPR mutations in the outcrossing woody perennial Populus reveals 4-coumarate:CoA ligase specificity and redundancy // New Phytol. 2015. V. 208. P. 298. https://doi.org/10.1111/nph.13470
Tsai C.-J., Xu P., Xue L.-J., Hu H., Nyamdari B., Naran R., Zhou X., Goeminne G., Gao R., Gjersing E., Dahlen J., Pattathil S., Hahn M.G., Davis M.F., Ralph J. et al. Compensatory guaiacyl lignin biosynthesis at the expense of syringyl lignin in 4CL1-knockout poplar // Plant Physiol. 2020. V. 183. P. 123. https://doi.org/10.1104/pp.19.01550
Takata N., Awano T., Nakata M.T., Sano Y., Sakamoto S., Mitsuda N., Taniguchi T. Populus NST/SND orthologs are key regulators of secondary cell wall formation in wood fibers, phloem fibers and xylem ray parenchyma cells // Tree Physiol. 2019. V. 39. P. 514. https://doi.org/10.1093/treephys/tpz004
Min D., Li Q., Jameel H., Chiang V., Chang H.M. The cellulase mediated saccharification on wood derived from transgenic low-lignin lines of black cottonwood (Populus trichocarpa) // Appl. Biochem. Biotechnol. 2012. V. 168. P. 947. https://doi.org/10.1007/s12010-012-9833-2
Studer M.H., DeMartini J.D., Davis M.F., Sykes R.W., Davison B., Keller M., Tuskan G.A., Wyman C.E. Lignin content in natural Populus variants affects sugar release // Proc. Natl. Acad. Sci. USA. 2011. V. 108. P. 6300. https://doi.org/10.1073/pnas.1009252108
Zhou S., Runge T., Karlen S.D., Ralph J., Gonzales-Vigil E., Mansfield S.D. Chemical pulping advantages of Zip-lignin hybrid poplar // ChemSusChem. 2017. V. 10. P. 3565. https://doi.org/10.1002/cssc.201701317
Özparpucu M., Gierlinger N., Cesarino I., Burgert I., Boerjan W., Reggeberg M. Significant influence of lignin on axial elastic modulus of poplar wood at low microfibril angles under wet conditions // J. Exp. Bot. 2019. V. 70. P. 4039. https://doi.org/10.1093/jxb/erz180
Voelker S.L., Lachenbruch B., Meinzer F.C., Kitin P., Strauss S.H. Transgenic poplars with reduced lignin show impaired xylem conductivity, growth efficiency and survival // Plant Cell Environ. 2011. V. 34. P. 655. https://doi.org/10.1111/j.1365-3040.2010.02270.x
Marchin R.M., Stout A.T., Davis A.A., King J.S. Transgenically altered lignin biosynthesis affects photosynthesis and water relations of field grown Populus trichocarpa // Biomass Bioenergy. 2017. V. 98. P. 15. https://doi.org/10.1016/j.biombioe.2017.01.013
Mahon E.L., Shawn D Mansfield S.D. Tailor-made trees: engineering lignin for ease of processing and tomorrow’s bioeconomy // Curr. Opin. Biotechnol. 2019. V. 56. P. 147. https://doi.org/10.1016/j.copbio.2018.10.014
Wilkerson C. G., Mansfield S. D., Lu F., Withers S., Park J.-Y., Karlen S.D., Gonzales- Vigil E., Padmakshan D., Unda F., Rencoret J., Ralph J. Monolignol ferulate transferase introduces chemically labile linkages into the lignin backbone. Science. 2014. V. 344. P. 90. https://doi.org/10.1126/science.1250161
Vanholme R., Morreel K., Darrah C., Oyarce P., Grabber J.H., Ralph J., Boerjan W. Metabolic engineering of novel lignin in biomass crops // New Phytol. 2012. V. 196. P. 978. https://doi.org/10.1111/j.1469-8137.2012.04337.x
Cai Y., Zhang K., Kim H., Hou G., Zhang X., Yang H., Feng H., Miller L., Ralph J., Liu C.-J. Enhancing digestibility and ethanol yield of Populus wood via expression of an engineered monolignol 4-O-methyltransferase // Nat. Commun. 2016. V. 7: 11989. https://doi.org/10.1038/ncomms11989
Vanholme B., Cesarino I., Goeminne G., Kim H., Marroni F., Van Acker R., Vanholme R., Morreel K., Ivens B., Pinosio S., Morgante M., Ralph J., Bastien C., Boerjan W. Breeding with rare defective alleles (BRDA): a natural Populus nigra HCT mutant with modified lignin as a case study // New Phytol. 2013. V. 198: 765. https://doi.org/10.1111/nph.12179
Yamamoto M., Tomiyama H., Koyama A., Okuizumi H., Liu S., Vanholme R., Goeminne G., Hirai Y., Shi H., Takata N., Ikeda T., Uesugi M., Kim H., Sakamoto S., Mitsuda N. et al. A century- old mystery unveiled: Sekizaisou is a natural lignin mutant // Plant Physiol. 2020. V. 182. P. 1821. https://doi.org/10.1104/pp.19.01467
Elissetche J.P., Valenzuela S., García R., Norambuena M., Iturra C., Rodríguez J., Mendonça R.T., Balocchi C. Transcript abundance of enzymes involved in lignin biosynthesis of Eucalyptus globulus genotypes with contrasting levels of pulp yield and wood density // Tree Genet. Genom. 2011. V. 7. P. 697. https://doi.org/10.1007/s11295-011-0367-5
Tuskan G.A., Muchero W., Tschaplinski T.J., Ragauskas A.J. Population-level approaches reveal novel aspects of lignin biosynthesis, content, composition and structure // Curr. Opin. Biotechnol. 2019. V. 56. P. 250. https://doi.org/10.1016/j.copbio.2019.02.017
Лебедев В.Г., Муратова С.А., Шестибратов К.А. Полевые испытания и коммерциализация биотехнологических форм лесных древесных растений // Лесоведение. 2015. № 5. С. 388.
Danielsen L., Lohaus G., Sirrenberg A., Karlovsky P., Bastien C., Pilate G., Polle A. Ectomycorrhizal colonization and diversity in relation to tree biomass and nutrition in a plantation of transgenic poplars with modified lignin biosynthesis // PLoS One. 2013. V. 8: e59207. https://doi.org/10.1371/journal.pone.0059207
Pilate G., Guiney E., Holt K., Petit-Conil M., Lapierre C., Leple J. C., Pollet B., Mila I., Webster E.A., Marstorp H.G., Hopkins D.W., Jouanin L., Boerjan W., Schuch W., Cornu D., Halpin C. Field and pulping performances of transgenic trees with altered lignification // Nat. Biotechnol. 2002. V. 20. P. 607. https://doi.org/10.1038/nbt0602-607
Novaes E., Kirst M., Chiang V., Winter-Sederoff H., Sederoff R. Lignin and biomass: a negative correlation for wood formation and lignin content in trees // Plant Physiol. 2010. V. 154. P. 555. http:// doi.org/https://doi.org/10.1104/pp.110.161281
Coleman H.D., Canovas F.M., Man H., Kirby E.G., Mansfield S.D. Enhanced expression of glutamine synthetase (GS1a) confers altered fibre and wood chemistry in field grown hybrid poplar (Populus tremula X alba) (717-1B4) // Plant Biotechnol. J. 2012. V. 10. P. 883. https://doi.org/10.1111/j.1467-7652.2012.00714.x
Лебедев В.Г., Фасхиев В.Н., Белый В.А., Шестибратов К.А. Определение состава лигнинов в трансгенных растениях осины с геном глутаминсинтетазы GS методом двумерного ЯМР // Мат. IX Междунар. симп. “Фенольные соединения: фундаментальные и прикладные аспекты”. Москва, 2015. С. 342.
Комаров А.С., Чертов О.Г., Быховец С.С., Припутина И.В., Шанин В.Н., Видягина Е.О., Лебедев В.Г., Шестибратов К.А. Воздействие осиновых плантаций с коротким оборотом рубки на биологический круговорот углерода и азота в лесах бореальной зоны: модельный эксперимент // Мат. биол. и биоинф. 2015. Т. 10. С. 398. https://doi.org/10.17537/2015.10.398
Лебедев В.Г., Ларионова А.А., Быховец С.С., Шанин В.Н., Комаров А.С., Шестибратов К.А. Моделирование биогеохимических циклов азота и углерода на лесных плантациях с трансгенными деревьями // Мат. Всерос. конф. с междунар. участием “Фундаментальные и прикладные проблемы современной экспериментальной биологии растений”. Москва, 2015. С. 415.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


