Физиология растений, 2022, T. 69, № 3, стр. 227-245
Сердечные гликозиды: распространение, свойства и специфика образования в культурах клеток и органов растений in vitro
С. В. Томилова a, b, *, А. В. Киташов a, c, А. М. Носов b, c
a Университет МГУ-ППИ в Шэньчжэне
Шэньчжэнь, Китай
b Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
c Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
* E-mail: lanatomilova@yandex.ru
Поступила в редакцию 01.12.2021
После доработки 05.12.2021
Принята к публикации 05.12.2021
- EDN: TZESXB
- DOI: 10.31857/S0015330322030162
Аннотация
Одной из отличительных особенностей растительного организма является вторичный метаболизм (образование веществ специализированного обмена). Данные по полным сиквенсам растительных геномов свидетельствуют, что от 15 до 25% всех генов задействованы в осуществлении этого процесса (биосинтез обслуживающих его ферментов, транспортеров, трансфакторов), при этом до сих пор неясны многие аспекты вторичного метаболизма, в том числе его физиологические функции. Перспективным подходом к решению фундаментальных и прикладных задач в области специализированного обмена является использование культур клеток и органов высших растений. Механизмы образования вторичных метаболитов в растительных системах in vitro с разным уровнем дифференцировки клеток могут существенно отличаться от таковых в интактном растении, что, при сопоставлении этих биологических систем, можно эффективно использовать для изучения принципов регуляции, организации и функционирования вторичного метаболизма. К настоящему времени известно более 100000 соединений специализированного обмена (алкалоиды, изопреноиды, фенольные соединения, ряд “минорных” групп вторичных метаболитов), которые, как правило, являются биологически активными веществами. Это обуславливает их практическую значимость и широкое применение в медицине: на сегодняшний день около трети всех лекарственных субстанций имеют растительное происхождение. На фоне острого дефицита лекарственного растительного сырья, использование культур клеток и органов растений в качестве источника биологически активных веществ весьма перспективно. Сердечные гликозиды являются одной из важнейших групп вторичных метаболитов, которая уже более двух веков используется в медицине для лечения кардиологических заболеваний. Сейчас интерес к ним существенно возрастает в связи с обнаружением новых свойств – в том числе антивирусной и противоопухолевой активности. В представленном обзоре проведен анализ основных результатов работ, посвященных изучению образования сердечных гликозидов в культурах клеток и органов растений-продуцентов этих соединений.
ВВЕДЕНИЕ
Высшие растения производят большое количество разнообразных химических соединений, которые не задействованы в их первичном обмене. Традиционно этот процесс называют вторичным метаболизмом или специализированным обменом, наличие которого является отличительной особенностью растительных организмов [1]. Данные по полным сиквенсам растительных геномов свидетельствуют, что около 15–25% генов кодируют ферменты, транспортеры, факторы транскрипции и другие белковые продукты, участвующие в биосинтезе вторичных метаболитов, при этом до сих пор неясны многие принципы его регуляции и организации, а главное – физиологические функции вторичных метаболитов [2]. Большинство исследователей считают, что данные соединения – это “биохимические инструменты” взаимодействия растительных организмов с окружающей средой. Вторичные метаболиты играют важную роль в стресс-реакциях и специализированных адаптациях растений при действии биотических и абиотических стрессоров (в системах защиты от вредителей и патогенов, при гипо- и гипертермии, водном дефиците, засолении); участвуют в процессах размножения (привлечение опылителей); во взаимодействии растений между собой и с другими организмами в экосистеме [1, 2]. Справедливость этой концепции подтверждена для ряда классов соединений специализированного обмена (например, многих фенольных соединений – антоцианов, изофлавоноидов) или некоторых “функциональных” групп вторичных метаболитов (например, фитоалексинов). В то же время, для большинства вторичных метаболитов строгих доказательств этой концепции практически нет [1].
Одним из перспективных подходов к изучению функционального значения вторичного метаболизма считается использование культур клеток или органов высших растений. В этой экспериментальной биологической системе могут синтезироваться различные по химической природе вещества, однако механизмы образования вторичных метаболитов в растительных системах in vitro с разным уровнем дифференцировки клеток могут существенно отличаться от таковых в интактном растении. Сопоставление специализированного обмена в системах интактное растение – культура органов – культура клеток является эффективным подходом для изучения принципов регуляции, организации и функционирования вторичного метаболизма [2, 3].
Практическое значение исследования специализированного обмена в культурах клеток и органов растений обусловлено тем, что вторичные метаболиты, как правило, обладают значительной и разнонаправленной биологической активностью. Большинство лекарственных и ядовитых растений являются таковыми именно за счет присутствия в них вторичных соединений. В настоящее время физиологически активные вещества растений часто рассматривают как основные составляющие лекарств, пищевых добавок, косметических и парфюмерных средств. Около трети всех лекарственных субстанций, используемых в медицинской практике, имеют растительное происхождение [4, 5].
Многие ценные лекарственные растения часто относятся к редким и эндемичным видам. При этом для большинства интактных растений (дикорастущих и плантационных) характерен нестабильный химический состав и высокая вероятность естественного и антропогенного загрязнения получаемого из них лекарственного сырья, зависящие от условий произрастания. В связи с этим поиск экологически чистого возобновляемого растительного сырья с высоким содержанием целевых веществ независимо от климатических и погодных условий является весьма актуальной проблемой.
Самым многочисленным классом веществ вторичного обмена растений являются изопреноиды, которых к настоящему времени насчитывают более 40 000 индивидуальных соединений [2]. Их классифицируют по числу изопреновых единиц, участвующих в построении молекулы, и разделяют на моно-, сескви-, ди-, сестер-, три- и тетратерпеноиды [2, 6]. Наиболее важной группой с точки зрения медицинского использования являются тритерпеноиды, к которым относятся тритерпеновые, стероидные и сердечные гликозиды, обуславливающие уникальные свойства таких растений как женьшень, солодка, маралий корень, диоскорея, наперстянка, строфант, ландыш и др. [2, 7].
Одной из наиболее интересных групп тритерпеноидов по праву считаются сердечные гликозиды, которые используются для лечения кардиологических заболеваний свыше 200 лет [7, 8]. До сегодняшнего дня растительное сырье является основным источником этих соединений (наперстянка – дигитоксин и дигоксин, строфант – строфантин К и G, ландыш – конваллязид и конваллятоксин) [8, 9]. При этом содержание данной группы веществ в интактном растении – это непостоянная величина, которая зависит от климатических условий, срока вегетации, и даже времени суток, в которое производится сбор [9]. В настоящее время интерес к сердечным гликозидам существенно возрастает в связи с обнаружением их новых свойств – в том числе антивирусной и противоопухолевой активности [10].
Изучение культуры клеток высших растений как источника сердечных гликозидов началось более 50 лет назад. Исследованием этой проблемы занимались многие группы ученых, которые использовали в качестве объекта преимущественно культуры клеток, тканей и органов разных видов рода Digitalis (наперстянка), хотя имеются сообщения и о культурах клеток других родов растений-продуцентов данных соединений. В большинстве случаев образования сердечных гликозидов в клетках in vitro не происходило. При этом в некоторых работах было зафиксировано наличие этих соединений в “молодых” культурах клеток (2–5 циклов выращивания после получения), однако в процессе дальнейшего длительного выращивания культур их содержание, как правило, снижалось. Образование сердечных гликозидов в культурах клеток можно было инициировать различными способами регуляции и воздействия, однако эффективность подобных методик часто уменьшалась с возрастом культур [11, 12].
В представленном обзоре проведен анализ накопленного опыта в этой области исследований и приведены основные результаты работ, посвященных изучению образования сердечных гликозидов в культурах клеток и органов in vitro разных семейств растений-продуцентов данной группы изопреноидов.
СЕРДЕЧНЫЕ ГЛИКОЗИДЫ КАК ФАРМАЦЕВТИЧЕСКИ ЦЕННАЯ ГРУППА ИЗОПРЕНОИДОВ
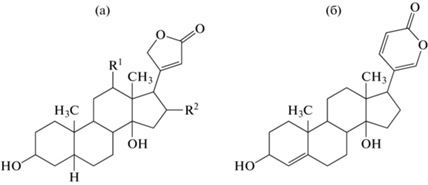
Сердечные гликозиды (кардиогликозиды) – это гликозиды тритерпеновых соединений, агликоном которых являются производные циклопентанопергидрофенантрена, имеющие в положении С-17 ненасыщенное лактонное кольцо, и оказывающие специфическое действие на сердечную мышцу. Данная группа включает два типа соединений в зависимости от строения ненасыщенного лактонного кольца агликона (рис. 1): карденолиды имеют пятичленное лактонное кольцо; буфадиенолиды – шестичленное [7].
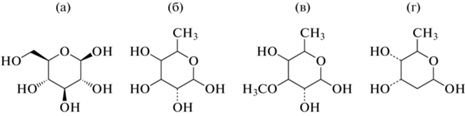
Сахарная цепь присоединена в положении С-3 и содержит до пяти углеводных остатков, которые помимо обычных сахаров (глюкоза, рамноза) включают различные редкие 6-дезокси-, 2,6-дидезокси- и 6-дезокси-3-метоксигексозы, такие как D-фукоза, D-дигиталоза и D-дигитоксоза [12] (рис. 2).
Рис. 2.
Химические структуры некоторых сахаров, входящих в молекулы сердечных гликозидов [13]: а – D-глюкоза; б – D-фукоза; в – D-дигиталоза; г – D-дигитоксоза.
Биосинтез сердечных гликозидов, в основном, происходит по классическому мевалонатному (MVA) пути образования изопреноидов, то есть предшественником для их синтеза является мевалоновая кислота [7, 14]. Важным открытием было то, что атомы углерода C-22 и C-23 лактонного кольца не являются производными мевалоновой кислоты, для их формирования предшественник прогестерона прегнан должен конденсироваться с такими соединениями как ацетил-КоА или малонил-КоА. Этот процесс был обозначен как “прегнановый путь”. Кроме того, описан альтернативный путь биосинтеза сердечных гликозидов с участием кислотного эквивалента прегненолона – норхолановой кислоты [10]. В процессе формирования этой группы соединений задействованы около 20 различных ферментов и три клеточных компартмента – митохондрии, эндоплазматический ретикулум и цитозоль [7, 14].
Сердечные гликозиды были обнаружены, по крайней мере, в 20 семействах высших растений, при этом семейство Apocynaceae является лидером по количеству видов, содержащих карденолиды. Наиболее известными продуцентами этих соединений считаются разные виды наперстянок Digitalis spp., относящиеся к семейству Plantaginaceae (ранее входили в семейство Scrophulariaceaе) [7, 10]. В отличие от карденолидов, буфадиенолиды распространены менее широко – они преимущественно встречаются в растениях шести семейств, таких как, Hyacinthaceae, Crassulaceae, Iridaceae, Melianthaceae, Ranunculaceae и Santalaceae [15]. Следует отметить, что сердечные гликозиды также найдены у насекомых (светлячки рода Photinus), земноводных (жабы рода Bufo, от которых и произошло название “буфадиенолиды”), пресмыкающихся (ужеобразные змеи рода Rhabdophis) и млекопитающих (выделены из плазмы крови и гипоталамуса человека) [15, 16].
Механизмы биологической активности сердечных гликозидов
Карденолиды и буфадиенолиды длительное время применяли в медицине в качестве эффективных кардиотонических лекарственных средств [8, 17]. Помимо сердца, данные соединения способны оказывать влияние на гладкие мышцы и центральную нервную систему [8]. Сердечные гликозиды – это сильные яды и только использование в очень малых дозах делает их относительно безопасными. В настоящее время, помимо применения этих соединений в терапии сердечно-сосудистых нарушений, в них увидели перспективных агентов для лечения различных видов рака, муковисцидоза, вирусных заболеваний и эффективных нейропротекторов [10, 17].
Большинство механизмов действия сердечных гликозидов связаны со способностью ингибировать активность мембранносвязанной Na+,K+-ATФазы [8, 17]. Эти соединения являются аллостерическими высокоспецифичными ингибиторами данного фермента [10, 17]. Характерный эффект гликозидов на сердце связан главным образом со структурой агликона и наличием в нем ненасыщенного лактонного кольца. Стероидная часть молекулы (агликон) считается фармакофором и необходима для распознавания рецепторами [10, 17]. Лактонное кольцо в положении C-17β содержит два атома кислорода, которые создают высокий отрицательный потенциал и, таким образом, увеличивают направленность образования водородных связей [18]. Добавление сахаров к стероидному агликону влияет на фармакодинамические и фармакокинетические свойства соединений (степень растворимости, проницаемость через клеточные мембраны, способность связываться с белками крови и тканей, активность, токсичность) [10, 17, 18].
Сердечные гликозиды активируют сигнальные свойства Na+,K+-ATФазы, что улучшает соотношение инотропности и токсичности и делает их одними из лучших лекарственных средств для лечения сердечных заболеваний. Сердечные гликозиды, в частности дигоксин и дигитоксин, более двух столетий являлись основными препаратами для коррекции сердечно-сосудистых нарушений, но идентификация ингибиторов ангиотензин-превращающего фермента, блокаторов ангиотензиновых рецепторов и β-адреноблокаторов значительно сократила их клиническое применение [17]. Тем не менее, некоторые исследования показали, что дигоксин в низких концентрациях значительно снижает смертность и госпитализацию у амбулаторных пациентов с хроническими систолической и диастолической сердечными недостаточностями. Поэтому, следует ли считать дигоксин препаратом прошлого для лечения сердечных заболеваний – это все еще предмет дискуссии [17, 19].
Обычные для сердечных гликозидов дозировки (0.25–3.0 мг на прием) длительное время были серьезным препятствием для применения их в терапии различных заболеваний, в частности, в качестве противоопухолевых средств [10]. Активность этих соединений против рака известна уже более 50 лет (самые ранние сведения датируются 1967 г.), но изначально эта идея не получила развития из-за опасений, связанных с их высокой токсичностью [10, 20]. В настоящее время новое направление – применение сердечных гликозидов в онкологии – активно развивается [10, 21].
Новые направления использования сердечных гликозидов в медицинской практике
В 1979 г. обратили внимание на то, что растения рода Digitalis оказывают лечебное действие при раке груди у женщин, но потребовалось почти 15 лет, прежде чем выяснили, что сердечные гликозиды могут быть использованы в онкотерапии в тех же малых дозах, что и в кардиологии. С тех пор был проведен ряд экспериментов по изучению их антипролиферативного действия на разные линии раковых клеток [10, 22–26].
Сейчас известно, что сердечные гликозиды оказывают альтернативное действие на нормальные и раковые клетки. При низких концентрациях в незлокачественных клетках они стимулируют пролиферацию и предотвращают апоптоз [10, 17, 27]. Подобные цитопротекторные свойства могут быть полезны при лечении нейродегенеративных заболеваний и больных с ишемическим инсультом [17, 28]. С другой стороны, сердечные гликозиды избирательно индуцируют гибель раковых клеток, а также повышают их чувствительность к облучению, что усиливает терапевтический потенциал данных соединений. Таким образом, открывается возможность увеличения эффективности лечения онкологических больных с помощью сочетания облучения с приемом карденолидов и буфадиенолидов [10, 29, 30]. В США запатентованы два препарата – Anvirzel (водный экстракт из Nerium oleander L., который содержит олеандрин и другие сердечные гликозиды) и PBI-05204 (СО2-экстракт из N. oleander), которые с успехом прошли клинические испытания и разрешены к применению в качестве противоопухолевых средств [31–33].
В настоящее время отмечен также противовирусный эффект сердечных гликозидов в отношении вирусов герпеса (HSV-1, HSV-2), цитомегаловируса (HCMV) и вируса иммунодефицита человека (HIV) [34–36]. Также сообщалось о потенциальном применении этих соединений для лечения муковисцидоза. Глубокое воспаление легких при данном заболевании в основном связано с перепроизводством интерлейкина-8. Показано, что дигитоксин в наномолярных концентрациях способен подавлять гиперсекрецию интерлейкина-8 в клетках эпителия легких [37].
Указанные биологические активности растительных сердечных гликозидов подчеркивают их потенциальный мультитерапевтический эффект. При этом следует отметить, что эндогенные соединения этого типа в организме человека участвуют в формировании многочисленных патологических состояний, таких как гипертоническая болезнь, почечная и сердечная недостаточность и др. [16].
РАСТЕНИЯ-ПРОДУЦЕНТЫ СЕРДЕЧНЫХ ГЛИКОЗИДОВ
Обладая разнообразием химических форм, сердечные гликозиды распространены по различным ботаническим семействам покрытосеменных растений (порядка 20), таким как Apocynaceae (роды Adenium, Acokanthera, Strophanthus, Apocynum, Cerbera, Thevetia, Nerium, Carissa, Urechites, Gomphocarpus, Calotropis, Pachycarpus, Asclepias, Xysmalobium, Cryptostegia, Periploca), Asparagaceae (роды Bowiea и Rohdea), Asteraceae (род Saussurea), Brassicaceae (роды Erysimum и Cheiranthus), Celastraceae (роды Euonymus и Lophopetalum), Combretaceae (род Terminalia), Crassulaceae (род Kalanchoe), Convallariaceae (род Convallaria), Euphorbiaceae (роды Mallotus и Trewia), Fabaceae (роды Coronilla и Securigera), Hyacinthaceae (роды Urginea и Ornithogalum), Iridaceae (роды Homeria и Moraea), Moraceae (роды Antiaris, Antiaropsis, Naucleopsis, Maquira), Malvaceae (роды Corchorus и Reevesia), Melianthaceae (роды Bersama и Melianthus), Plantaginaceae и Scrophulariaceae (род Digitalis), Ranunculaceae (роды Adonis и Helleborus), Solanaceae (род Nierembergia), Santalaceae (род Thesium) [7, 10, 15]. Многие виды растений-продуцентов этих соединений произрастают в тропических регионах и в прошлом использовались жителями Африки, Азии и Южной Америки для приготовления ядов для стрел. В целом карденолиды и буфадиенолиды являются мощной химической защитой растений от различных животных [10, 15].
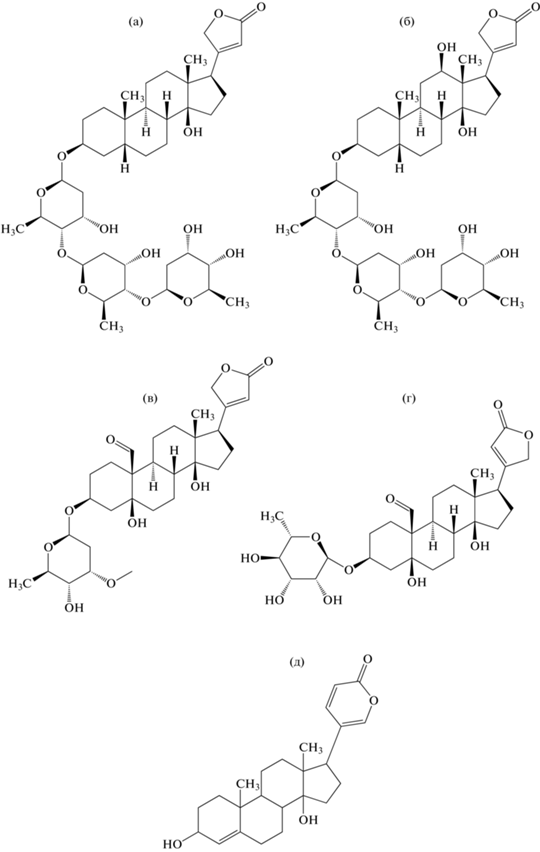
Род Digitalis (наперстянка) хорошо известен в медицине, начиная с XVIII века, благодаря наличию в этих растениях большого спектра (более 100 структур) карденолидов. Сердечные гликозиды наперстянки можно сгруппировать по агликонам – производные дигитоксигенина, дигоксигенина, гитоксигенина, гиталоксигенина, дигинатигенина, олеандригенина, узаригенина, ксисмалогенина и канаригенина (рис. 3). Они все имеют 14β-гидроксильную группу, метильный заместитель в положении С-10 и большинство 5β-конфигурацию [12]. Предполагается, что 5β-карденолиды образуются через прогестерон, который был обнаружен у высших растений в 2010 г. [38]. В положении 3β к агликону присоединены сахара, содержащие до пяти углеводных единиц, которые могут состоять из глюкозы, рамнозы и различных редких дезокси-сахаров, 2,6-дидезоксигексоз (дигитоксоза) и 6-дезокси-3-метоксисахаров (цимароза, дигиталоза). Наиболее известными соединениями Digitalis spp., применяемыми в медицинской практике, считаются дигоксин и дигитоксин (рис. 4) [12].
Семейство Apocynaceae имеет максимальное количество родов (около 55) растений-продуцентов карденолидов. Сюда входят рода Strophanthus, Apocynum, Cerbera, Thevetia, Nerium и др. Довольно часто в это семейство включают подсемейство Asclepiadoideae, которое в ряде случаев рассматривают как отдельное семейство. К семейству Asclepiadaceae относят роды Gomphocarpus, Calotropis, Asclepias, Cryptostegia, Periploca, Pergularia и др. [7, 10].
Растения рода Strophanthus (строфант) являются довольно известным продуцентом сердечных гликозидов, применяемых в кардиологической практике. Очищенные кардиогликозиды из семян S. kombe Oliv. используются в качестве инъекционного раствора под названием строфантин-К для лечения сердечной недостаточности, также существует препарат строфантин-G (уабаин) из семян S. gratus Baill [39, 40]. В отличие от липофильных карденолидов Digitalis spp. сердечные гликозиды Strophanthus spp. являются гидрофильными и обычно используются как препараты для внутривенного введения. Основными соединениями Strophanthus spp. считаются К-строфантозид, К-строфантин, уабаин и цимарин (рис. 4). Стоит отметить, что уабаин также является главным сердечным гликозидом африканского растения Acokanthera schimperi (A.DC.) Schweinf [40].
Nerium oleander L. (олеандр обыкновенный) является источником противоопухолевых препаратов Anvirzel и PBI-05204, основным компонентом которых считается карденолид олеандрин [31, 33]. Олеандр – это одно из самых ядовитых растений, практически все его части токсичны, благодаря наличию в них сердечных гликозидов. Основными соединениями N. oleander являются олеандрин, олеандригенин и одорозид [41].
Растения Thevetia spp. производят ряд биологически активных веществ, относящихся к сердечным гликозидам, таких как нерифолин, теветоксин, перувозид и теветин А и В [40]. Особенно интересным соединением считается перувозид, так как он используется в Европе как заменитель дигоксина при аллергических реакциях у пациентов. Стоит отметить, что концентрация в растении этих веществ достаточно низкая, поэтому выделение является сложной и дорогостоящей процедурой [42].
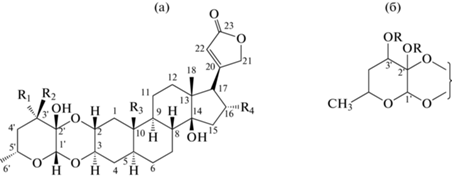
Важной особенностью растений семейства Asclepiadaceae является то, что они производят карденолиды, которые устойчивы к кислотному гидролизу [40, 43]. Данные свойства объясняются двойным прикреплением углеводной группы через ацетальные и гемиацетальные связи в положениях 3β и 2α соответственно к карденолидному агликону. Структура сахара основана на 4,6-дидезоксигексосулозе (рис. 5) (впервые предложена для гомфозида из Asclepias fruticosa L.) и показано, что она присутствует в калактине, калотропине, процерозиде, сириобиозиде, десглюкосириозиде и эриокарпине [43]. Тот же углевод, но в измененной форме, встречается также в ушаридине, калотоксине, ушарине, ворушарине, сириозиде, асклепине, и ряде других карденолидов [44]. Подобные специфические (маркерные) соединения активно продуцируют растения из родов Asclepias, Calotropis, Gomphocarpus, Pergularia. Помимо специфических двусвязанных сердечных гликозидов в растениях семейства Asclepiadaceae содержатся также стандартные соединения с одинарным прикреплением углеводной группы [40, 45].
Рис. 5.
Химическая структура двусвязанных карденолидов (а) и 4,6-дидезоксигексосулозного фрагмента (б) [43].
Сердечные гликозиды Convallaria majalis L. (семейство Convallariaceae) широко используются в клинической кардиологической практике (инъекционные препараты коргликард и коргликон). Основными карденолидами являются конваллятоксин, конваллязид и конваллятоксол, которые по свойствам близки к гликозидам Strophanthus spp. (рис. 4) [8, 40].
Буфадиенолиды менее широко распространены в растениях по сравнению с карденолидами. Наиболее известные продуценты этой группы соединений встречаются в семействах Asteraceae, Crassulaceae, Hyacinthaceae, Ranunculaceae [15].
Бóльшая часть буфадиенолидов была выделена из видов рода Urginea (семейство Hyacinthaceae) [15]. Например, Urginea maritima (L.) Baker. распространена на побережье Средиземного моря и используется в медицине с давних времен из-за ее мощного эффекта, подобного растениям рода Digitalis [40]. К основным соединениям, встречающимся в растениях Urginea spp., можно отнести сцилларен, сциллирозид, сциллиглаузид, просцилларидин, дезацетилсциллирозидин и сциллирозидин, которые обладают различными лекарственными, родентицидными и репеллентными свойствами (рис. 4). Наиболее используемый источник этих соединений – луковицы растений [15, 40].
Значительное количество буфадиенолидов обнаружено в растениях Kalanchoe spp., относящихся к семейству Crassulaceae. В традиционной медицине виды рода Kalanchoe используются для лечения инфекционно-воспалительных заболеваний, а также в качестве иммуносупрессивных соединений [46]. Растения вида Helleborus niger L. (семейство Ranunculaceae) также содержат сердечные гликозиды буфадиенолидного типа, основным из которых является хеллебрин [47]. Стоит отметить, что из растений Saussurea involucrata Matsum. & Koidz. (семейство Asteraceae) было выделено как минимум три буфадиенолида, такие как буфоталин, телоцинобуфагин и гамабуфоталин [48].
КАРДЕНОЛИДЫ В КУЛЬТУРЕ КЛЕТОК И ОРГАНОВ РАСТЕНИЙ РОДА Digitalis
Digitalis (наперстянка) – род травянистых растений семейства Plantaginaceae, включающий в себя более 20 видов, многие из них являются редкими и исчезающими, а также эндемичными для Средиземноморского региона, Турции, Греции и Кавказа. Растения наперстянки широко распространены по различным географическим зонам и встречаются на Балканах, в России, Венгрии, Италии, Германии, Испании, Румынии, Турции, Японии, Индии и США. Это наиболее известный продуцент карденолидов для медицины, данные соединения присутствуют во всех видах Digitalis spp., кроме D. sceptrum (L.f.) Loudon [11, 12]. Основным местом биосинтеза и хранения сердечных гликозидов в растениях рода Digitalis являются листья, а именно мезофилл. Кроме того, сообщалось, что в клетках ткани листа D. purpurea L. большинство соединений этой группы локализовано в митохондриях и хлоропластах. Корни растений обычно не способны продуцировать карденолиды, хотя они их содержат. Сердечные гликозиды в наперстянках могут быть первичного (с глюкозой на конце сахарной цепи, в основном депонируются в вакуолях) и вторичного (без глюкозы) типа. Вторичные карденолиды гликозилируются в цитозоле и активно транспортируются в вакуоль, присоединенная глюкоза способна увеличивать полярность соединения, что предотвращает его пассивный перенос через клеточные мембраны. Первичные карденолиды после их синтеза либо депонируются в вакуолях, либо загружаются в ситовидные трубки и транспортируются по флоэме в органы-“накопители”, такие как корни или цветки [49]. Помимо сердечных гликозидов в наперстянках найдены дигитанолы (представляют собой С5–С6 ненасыщенные С21-прегнаны, некоторые из них обладают 14β-гидроксильной функцией и боковой цепью сахаров, типичными для карденолидов), стероидные гликозиды, антрахиноны, фенилэтаноиды и флавоноиды [11–13].
Многие экспериментальные работы с культурами клеток Digitalis spp. оказались не слишком успешными в отношении получения значительного количества карденолидов [11, 50]. В каллусных культурах клеток наперстянок дигитоксин и дигоксин в первом цикле выращивания чаще всего не детектировались. Однако в ряде случаев содержание этих веществ в начале культивирования (сразу после получения культуры клеток) могло быть выше, чем в проростках интактных растений, но в процессе длительного субкультивирования клеток (более года) происходило постепенное снижение вплоть до полного исчезновения целевых соединений, что свидетельствовало об отсутствии их синтеза в дедифференцированных клетках in vitro. В свою очередь, увеличение содержания карденолидов в течение первого цикла выращивания культуры можно объяснить либо присутствием нескольких карденолид-продуцирующих клеток в популяции, либо их продукцией клетками экспланта, которые еще остаются в дифференцированном состоянии на ранней стадии формирования культуры клеток [51].
Влияние степени дифференцировки клеток на образование карденолидов
Связь между клеточной и морфологической дифференцировкой и формированием сердечных гликозидов была подтверждена результатами целого ряда исследований с различными видами культур in vitro наперстянок [11, 50]. Фитохимический скрининг каллусных и суспензионных культур клеток Digitalis spp. (D. purpurea L., D. lanata Ehrh., D. cariensis Boiss. ex Jaub. et Spach, D. mertonensis Buxt. and Darl., D. grandiflora Mill., D. lutea L.) показал, что содержание карденолидов там было крайне низким (около 0.5–2.0 нг/мг сухого веса), но при формировании дифференцированных микроглобул, эмбриоидов и проростков оно могло значительно увеличиваться (до 80–100 нг/мг сухого веса). При этом индукция корневых культур in vitro была менее эффективна для получения сердечных гликозидов [52].
С использованием каллусной культуры растений рода Digitalis с эмбриогенными структурами также была выявлена положительная корреляция между дифференцировкой и синтезом карденолидов [53, 54]. Из эмбриогенных клеточных культур D. lanata были изолированы и идентифицированы 5 сердечных гликозидов, таких как одорозид H, одоробиозид G, глюкодигифукозид, веродоксин и строспезид. Однако ни один из стандартных карденолидов взрослого растения, например, ланатозид А и С или дигоксин, в них не были обнаружены. Спектр сердечных гликозидов в эмбриогенных культурах клеток скорее похож на то, что встречается в проростках или молодых растениях наперстянки, поэтому подобная система может быть интересна для исследования биохимических механизмов индукции или подавления биосинтеза этой группы вторичных метаболитов [55].
При изучении влияния света и фитогормонов на формирование дигитоксина в культуре клеток D. purpurea было отмечено, что его содержание в недифференцированных зеленых клетках было значительно ниже, чем у зеленой культуры побегов и примерно таким же, как у недифференцированных неокрашенных клеток, растущих в темноте [56]. Однако при культивировании с ИУК, “зеленые” клетки содержали примерно в 6 раз больше дигитоксина, чем непигментированные клетки. Кроме того, было показано, что “белые” культуры побегов без хлоропластов, выращенные в темноте, имели концентрацию соединения близкую к “зеленым” культурам побегов с развитой хлоропластной системой. Было выдвинуто предположение, что наличие хлоропластов не является определяющим признаком для синтеза сердечных гликозидов, но их формирование, очевидно, связано с дифференцировкой побегов, так как увеличение степени дифференциации приводило к наибольшей стимуляции образования дигитоксина [56].
Высокое содержание карденолидов было определено в культуре органов in vitro, которая имела сформированные листья, тогда как в культуре корней в большинстве случаев оно было как минимум в 2–5 раз ниже [57]. Концентрация соединений в подобных органных культурах повышалась при добавлении в питательные среды ряда предшественников синтеза (гликохолат натрия, ацетат холестерина, прогестерон) [58]. Известно также, что индукция дифференцировки у D. purpurea побеговых культур из каллуса приводила к образованию карденолидов de novo, тогда как для корневых культур подобный эффект не отмечен [59]. В целом, можно сказать, что у различных культур in vitro растений рода Digitalis способность образовывать сердечные гликозиды проявлялась в разной степени, но связь органогенеза с формированием этих соединений в наперстянках очевидна [11, 50, 56].
Использование биотрансформации для получения карденолидов
Наиболее эффективным способом получения карденолидов в культурах клеток Digitalis spp. оказалась биотрансформация натуральных и полусинтетических субстратов, таких как дигитоксин и β-метилдигитоксин. Значительное количество работ в этой области было проведено на суспензионных культурах клеток D. lanata Ehrh. Наиболее ценными соединениями для медицины являются дигоксин и его производные, поэтому основные исследования были направлены на получение данных веществ. Дигоксин отличается от дигитоксина только дополнительной гидроксильной группой в положении С-12. Оказалось, что суспензионные культуры клеток D. lanata способны вполне успешно осуществлять реакцию 12β-гидроксилирования, что позволило получить деацетилланатозид С из дигитоксина и β‑метилдигоксин из β-метилдигитоксина. В ходе исследований была разработана система промышленного культивирования суспензионной культуры клеток D. lanata с использованием биореакторов объемами от 20 до 300 л. Однако, несмотря на полученные положительные результаты, в настоящее время в доступной литературе нет публикаций о применении подобного подхода для масштабного получения сердечных гликозидов. При этом представленные работы свидетельствуют о том, что основные ферментативные системы биосинтеза карденолидов активно функционируют в клетках in vitro наперстянок, но очевидно для их работы требуется соблюдение конкретных условий и/или наличие в среде определенных субстратов [60–62].
Оптимизация синтеза сердечных гликозидов в культурах клеток
Начиная с 80-х годов XX века, был выполнен целый ряд работ по оптимизации синтеза сердечных гликозидов в культурах клеток разных видов наперстянки. Содержание дигитоксина увеличивалось в каллусных культурах D. purpurea, которые выращивали в присутствии ИУК и фенобарбитала, способного повышать ферментативную активность цитохрома P450, участвующего в синтезе прегненолона и локализованного в митохондриях. Было отмечено, что присутствие ИУК стимулировало увеличение объемной фракции митохондрий и пластид (хлоропластов), тогда как при добавлении фенобарбитала повышалось только объемное соотношение митохондрий, а объемная фракция пластид снижалась. Так как при данных ультраструктурных изменениях в клетках возрастало содержание дигитоксина, это дало основание предполагать, что развитие митохондриальной системы клетки является положительным фактором для биосинтеза карденолидов [63].
На суспензионной культуре D. lanata было изучено влияние гиббереллинов, а именно гиббереллиновой кислоты GA3, на формирование сердечных гликозидов. В исследовании было отмечено, что GA3 стимулировала накопление карденолидов в темноте в культурах in vitro, имеющих определенную степень дифференциации (органогенез – развитие побегово-листовых и корневых культур) [64].
К увеличению содержания сердечных гликозидов в каллусной культуре клеток D. trojana Ivanina в отсутствии дифференцировки приводила предварительная обработка салициловой кислотой с последующим использованием высоких температур в качестве стрессового фактора [65].
В ряде работ сообщалось, что исключение CaCl2 из культуральной среды индуцировало заметное повышение продукции карденолидов в каллусных и суспензионных культурах Digitalis spp. [66–69]. Исходя из этого появилось предположение, что накопление сердечных гликозидов может зависеть от уровня внеклеточного кальция. Для подтверждения этой гипотезы были использованы LaCl3 (ингибитор кальциевых каналов) и EGTA – хелатор ионов кальция. После инкубации суспензионной культуры клеток D. thapsi L. с LaCl3 или EGTA отмечалось усиление синтеза дигитоксина и он был сопоставим с культурой клеток, выращенной на питательной среде без ионов кальция [68]. Связаны ли данные эффекты именно с изменением уровня внеклеточного кальция или здесь работают исключительно стресс-индуцируемые механизмы защиты и адаптации – пока ответить сложно, но более вероятным в этом случае представляется второй вариант.
Для каллусных культур эндемичных видов наперстянок Турции (D. davisiana Heywood, D. lamarckii Ivanina, D. trojana Ivanina, D. cariensis Boiss. ex Jaub. et Spach) при удалении из сред солей кальция и магния также наблюдалось увеличение накопления карденолидов [69]. В некоторых работах было показано, что повышение содержания MnSO4 в среде культивирования стимулировало образование целевых соединений в культурах клеток [66, 70]. В одной из работ [66] было даже описано применение LiCl для увеличения накопления карденолидов в суспензионной культуре клеток D. thapsi. Стоит отметить, что в питательных средах для культивирования клеток и органов растений литий не применяют, так как он не является эссенциальным элементом для растительного организма, но в литературе есть сведения, что в естественных условиях D. thapsi растет на почвах с повышенным содержанием этого металла, и он был обнаружен в листьях растения. При добавлении LiCl в культуральную среду суспензионной культуры D. thapsi был обнаружен стимулирующий эффект на производство карденолидов, при этом не отмечено ухудшения ростовых характеристик культуры [66].
Суммируя полученные различными группами исследователей данные о влиянии изменения состава питательных сред на синтез сердечных гликозидов в культурах клеток наперстянок, можно сказать, что в некоторых случаях этот подход приводил к увеличению образования целевых соединений, но определенных закономерностей в выборе эффективных факторов установить не удалось. Вероятно, при наличии в культуре клеток хотя бы незначительных количеств карденолидов, их накопление можно повысить, модифицируя состав питательных сред, при этом данных о том, насколько длительно может сохраняться этот эффект, практически нет. Кроме того, до настоящего времени остается открытым вопрос – возможно ли такими способами индуцировать синтез карденолидов при изначальном отсутствии в растительных клетках in vitro детектируемых количеств этой группы вторичных метаболитов.
В ряде исследований на фоне изменения минерального состава сред отмечена активация образования и накопления пероксида водорода (H2O2), при которой наблюдалось изменение окислительно-восстановительного состояния клеток, что в свою очередь, также стимулировало синтез сердечных гликозидов. АФК могут выступать в качестве сигнальных молекул при индукции различных защитных механизмов у растений, в том числе влиять на производство вторичных метаболитов. Показано, что при добавлении H2O2 в культуральную среду каллусных и суспензионных культур клеток Digitalis spp. через 6–24 ч инкубации наблюдалось увеличение накопления карденолидов, что свидетельствует о функционировании стресс-индуцированных механизмов запуска вторичного метаболизма [68, 71].
Для интенсификации синтеза сердечных гликозидов в каллусной культуре клеток D. purpurea использовали воздействие УФ-облучением. В работе было отмечено, что УФ-облучение ускоряло процессы роста и повышало тканевую дифференцировку каллусной культуры. Максимальное содержание дигитоксина было обнаружено в клеточной линии, полученной после 1 ч воздействия ультрафиолета, и этот показатель оказался выше в 3.5 раза, чем концентрация данного соединения в интактном растении [9].
Другие группы вторичных метаболитов в культурах клеток Digitalis spp.
В большинстве работ с культурами клеток и органов Digitalis spp. исследователи акцентировали свое внимание на обнаружении исключительно сердечных гликозидов и не пытались провести анализ соединений различных структурных классов [11]. Однако в литературе есть ряд сведений о наличии в дедифференцированных растительных клетках in vitro Digitalis spp. фенольных соединений и некоторых групп стероидов. В каллусных культурах клеток D. lanata и D. purpurea были обнаружены прогестерон, изофукостерин, 24-метиленциклоартенол, стероидные гликозиды (производные гитогенина и тигогенина), антрахиноны и фенилэтаноиды [50, 72–74].
В настоящее время культуры клеток разных видов рода Digitalis можно считать модельным объектом для изучения синтеза и накопления сердечных гликозидов.
КАРДЕНОЛИДЫ В КУЛЬТУРАХ КЛЕТОК ВЫСШИХ РАСТЕНИЙ РАЗЛИЧНЫХ СЕМЕЙСТВ
Существует целый ряд растений, имеющих медицинскую ценность, культуры клеток которых исследовали на содержание карденолидов. При этом полученные на них результаты довольно схожи с теми, которые были отмечены при работе с культурами клеток Digitalis spp.
Имеются сообщения [75–78] о получении каллусных и суспензионных культур клеток разных видов Strophanthus spp. (строфант, семейство Apocynaceae), но сердечных гликозидов там обнаружено не было. В связи с полным отсутствием в этих культурах клеток целевых соединений, они были использованы для изучения процессов биотрансформации дигитоксигенина. Было отмечено, что суспензионные культуры клеток разных видов строфанта способны к гидроксилированию, эпимеризации, изомеризации и гликозилированию, но они не продуцируют соединения при отсутствии в среде определенного субстрата [75–78].
На суспензионной культуре клеток Nerium oleander L. (олеандр обыкновенный, семейство Apocynaceae), как в случае с культурами клеток растений Digitalis spp. и Strophanthus spp., также активно исследовали процессы биотрансформации сердечных гликозидов. Была продемонстрирована способность клеток in vitro к окислению, изомеризации и гликозилированию 5βH-стероидных агликонов по положению С-3 [79]. Стоит отметить, что в каллусных и суспензионных культурах олеандра были обнаружены карденолиды (олеандрин, олеандригенин, одорозид), характерные для интактного растения. Увеличение накопления олеандрина в суспензионной культуре наблюдали при снижении концентрации азота и повышении количества фосфатов в питательной среде, показана также стимуляция синтеза соединения при добавлении прогестерона и холестерина, а также при использовании УФ. Содержание олеандрина в культуре клеток после различных воздействий было сопоставимо с интактным растением, где его концентрация находилась на уровне около 0.1% [80–83]. Исследователями отмечено, что экстракт каллусной культуры олеандра сохраняет видоспецифическую цитотоксическую активность, свойственную растению, что делает дедифференцированные клетки in vitro N. oleander потенциальным источником для получения ценных карденолидов [82].
В 80-х годах XX века были получены культуры клеток Thevetia spp. (семейство Apocynaceae) с целью изучения образования сердечных гликозидов в них. В каллусных культурах T. peruviana K.Schum., T. neriifolia Juss. и T. thevetioides Kunth. были обнаружены теветин, нерифолин, перувозид и дигитоксигенин, но их содержание на протяжении всего культивирования оставалось достаточно низким и с увеличением возраста каллуса отмечалось их полное исчезновение. При этом модификации питательных сред и добавление предшественников синтеза, таких как холестерин и прогестерон, как правило, не вызывали образования карденолидов в каллусных культурах, возраст которых был свыше шести месяцев [42, 84]. В свою очередь, для суспензионных культур клеток T. peruviana было показано, что даже после 2 лет культивирования сердечные гликозиды встречались во всех штаммах, однако их концентрация оставалась на крайне низком уровне [85]. При этом содержание перувозида в суспензионной культуре T. peruviana удавалось повысить за счет применения метилжасмоната [86]. На культурах клеток Thevetia spp. также исследовали процесс биотрансформации карденолидов и было показано, что они способны осуществлять реакции гликозилирования, дегликозилирования, деацетилирования и окисления субстратов [87]. Стоит отметить, что в каллусных и суспензионных культурах T. peruviana помимо сердечных гликозидов было отмечено присутствие фенольных (флавоноиды и лейкоантоцианидины) и тритерпеновых (олеаноловая и урсоловая кислоты) соединений [88–90].
Карденолиды были найдены в каллусных и суспензионных культурах клеток растений Calotropis spp. (C. gigantea (L.) Ait., C. procera Ait., семейство Asclepiadaceae). Полученные культуры клеток использовали для исследования влияния оптимизации питательной среды, плотности инокулюма при пересадке, значений pH и температуры на повышение накопления целевых веществ. В ряде случаев был отмечен определенный позитивный эффект на синтез соединений, но выявить конкретные закономерности и механизмы авторам не удалось [91, 92].
В 1987 г. появилось сообщение, что из листьев и культуры клеток Cryptolepis buchanani Roem. & Schult. (семейство Asclepiadaceae) был выделен новый карденолид – криптозин, который вызывал дозозависимую положительную инотропию. Культура клеток накапливала данное соединение, но его количество там было значительно ниже, чем в листе интактного растения [93].
Для изучения формирования сердечных гликозидов в системе in vitro была получена каллусная культура клеток Pergularia tomentosa L. (семейство Asclepiadaceae). Фитохимический анализ показал присутствие карденолида галакинозида в культурах клеток листового, корневого и семенного происхождения при культивировании с использованием α-НУК [94]. Кроме того, было отмечено, что при добавлении в среду выращивания прогестерона происходило увеличение концентрации данного соединения в каллусах примерно в 2–2.5 раза.
Как возможный источник сердечных гликозидов была изучена культура клеток Coronilla varia L. (семейство Fabaceae). В исследовании показано, что идентичный листьям интактного растения комплекс соединений в культуре клеток сохранялся в течение 7 культивирований, но впоследствии синтез некоторых веществ снижался или полностью прекращался [95]. В свою очередь для суспензионной культуры Securigera securidaca (L.) Deg. & Dorf. (семейство Fabaceae) было отмечено начало формирования сердечных гликозидов только в конце 6 цикла культивирования и их содержание там было выше, чем у семян интактного растения [96].
Таким образом, можно заключить, что в ряде культур клеток были обнаружены карденолиды, но в основном их содержание оказывалось либо исходно достаточно низким, либо постепенно снижалось в процессе длительного культивирования до исчезающе малых количеств, что соответствует данным полученным при работе с культурами клеток Digitalis spp.
БУФАДИЕНОЛИДЫ В КУЛЬТУРЕ КЛЕТОК И ОРГАНОВ ВЫСШИХ РАСТЕНИЙ
По сравнению с изучением карденолидов в культурах клеток и органов высших растений, информации по формированию буфадиенолидов в системах in vitro крайне мало. В основном встречаются только единичные сообщения о получении культур клеток некоторых потенциальных продуцентов этих соединений.
В 70-х годах XX века был проведен эксперимент по изучению влияния экстрактов культур клеток высших растений, содержащих сердечные гликозиды, на дыхание, частоту сердечных сокращений и кровяное давление у кроликов. Было отмечено, что экстракт из культуры клеток Urginea maritima (L.) Baker (семейство Hyacinthaceae) вызывал выраженную вазодилатацию и брадикардию, которые приводили к смерти животных. В экстракте, проанализированном методом ТСХ, были обнаружены соединения, которые потенциально отнесли к сердечным гликозидам [97]. Последующие химические анализы каллусной и суспензионной культур клеток U. maritima не выявляли наличия в них типичных буфадиенолидов интактного растения (сцилларен А, просцилларидин А и сцилларидин А), поэтому было высказано предположение, что кардиоактивность в этих культурах клеток может быть связана с соединениями не буфадиенолидной природы [98].
В 90-х годах XX века были исследованы три хромосомные расы (диплоиды, триплоиды и тетраплоиды) Urginea indica Kunth. (семейство Hyacinthaceae) на способность продуцировать буфадиенолиды в различных культурах in vitro. Исследователями было отмечено, что в каллусных и суспензионных культурах клеток всех трех генотипов не фиксировалось наличие целевых соединений, несмотря на то, что были протестированы разные регуляторы роста для их культивирования [99]. Кроме того, буфадиенолиды также не детектировались в ризогенных каллусах и на различных стадиях развития эмбриоидов. В низких количествах эти соединения были обнаружены в побеговых культурах, присутствие просцилларидина А и сцилларена А в значительных концентрациях было зафиксировано в регенерированных луковицах. Этот факт дал основание предположить, что способность накапливать целевые вещества может быть связана с дифференцировкой луковиц в интактном растении [99].
Имеется сообщение о получении каллусной культуры Charybdis congesta Speta (ранее Urginea congesta (семейство Hyacinthaceae)) и исследовании влияния регуляторов роста на синтез буфадиенолидов в ней. При выращивании культуры клеток на питательной среде с α-НУК и БАП содержание просцилларидина А, сциллирозида, сцилларена А и дезацетилсциллирозида было выше, чем в интактном растении, но насколько постоянен и длителен был этот эффект в работе не приведено [100].
В настоящее время показано, что некоторые химически модифицированные некардиоактивные буфадиенолиды могут вызывать гибель злокачественных клеток человека, не оказывая при этом отрицательного действия на нормальные клетки [101, 102]. Повышенный интерес к этому свойству буфадиенолидов побудил исследователей синтезировать новые соединения, которые могли бы помочь установить взаимосвязь между структурой-активностью и структурой-токсичностью [102, 103]. Стоит отметить, что некоторые новые буфадиенолиды, полученные путем биотрансформации известных соединений, показали более мощную активность против раковых клеток, чем их предшественники [102, 104, 105].
Буфоталин, телоцинобуфагин, цинобуфагин и гамабуфоталин – это цитотоксические буфадиенолиды, выделенные из Chan’Su (препарат на основе яда жаб Bufo gargarizans, применяемый в традиционной китайской медицине как кардиотонический и противоопухолевый) [102, 106]. Исследование биотрансформации цинобуфагина суспензионными культурами клеток Catharanthus roseus (L.) G. Don. (семейство Apocynaceae) и Platycodon grandiflorum (Jacq.) A. DC. (семейство Campanulaceae) привело к получению 4 и 2 новых соединений соответственно [106, 107]. В результате биотрансформации трех биоактивных буфадиенолидов – буфоталина, телоцинобуфагина и гамабуфоталина – суспензионной культурой Saussurea involucrata Matsum. & Koidz. (семейство Asteraceae) было получено 11 новых соединений, большинство из которых проявляли значительную цитотоксическую активность в отношении клеточных линий гепатомы человека и рака молочной железы [102]. Стоит сказать, что в интактных растениях C. roseus и P. grandiflorum не отмечено образования буфадиенолидов, тогда как в S. involucrata были найдены буфоталин, телоцинобуфагин и гамабуфоталин [48, 108, 109].
Следует отметить, что число работ по изучению образования сердечных гликозидов буфадиенолидного типа в культурах клеток и органов высших растений очень невелико и полученных в ходе исследований результатов недостаточно для выяснения определенных закономерностей их формирования. Несмотря на это, исходя из опубликованных данных, можно предполагать, что синтез этой группы соединений в дедифференцированных клетках растений имеет тенденции, схожие с образованием карденолидов в культурах клеток in vitro.
ЗАКЛЮЧЕНИЕ И ПЕРСПЕКТИВЫ
Основная масса данных литературы, касающихся изучения образования сердечных гликозидов в системе in vitro, получена на культурах клеток и органов разных видов рода Digitalis. Гораздо реже встречаются сообщения, относящиеся к культурам in vitro других растений-продуцентов этой группы тритерпеноидов.
Образование сердечных гликозидов в каллусных и суспензионных культурах клеток в значимых количествах было показано лишь в немногих работах (табл. 1). В большинстве случаев карденолиды и буфадиенолиды в дедифференцированных клетках in vitro были найдены либо в следовых количествах, либо их присутствие показать не удалось. Кроме того, можно отметить тенденцию к снижению содержания сердечных гликозидов в ходе длительного (более года) выращивания культур клеток. Различные способы воздействия на растительные клетки in vitro (изменение состава питательных сред, добавление предшественников синтеза целевых соединений, использование различных физических и химических стрессовых факторов) могут интенсифицировать накопление сердечных гликозидов, но, как правило, с увеличением “возраста” культуры (для длительно выращиваемых культур клеток) эффективность подобных методик снижается. Многие культуры клеток способны к биотрансформации различных натуральных и полусинтетических субстратов (дигитоксин, β-метилдигитоксин), что свидетельствует о возможности адекватного функционирования ряда ферментов и систем образования сердечных гликозидов в клетках in vitro.
Таблица 1.
Культуры клеток высших растений, продуцирующие сердечные гликозиды
| Вид растения | Тип культуры клеток | Обнаруженные соединения | Литературный источник |
|---|---|---|---|
| Digitalis spp. | Каллус | Дигитоксин | [9, 52, 56, 63, 65, 69, 71] |
| Каллус или суспензия с эмбриогенными структурами | Одорозид H, одоробиозид G, глюкодигифукозид, веродоксин, строспезид | [53–55] | |
| Суспензия | Дигитоксин | [52, 66–68] | |
| Nerium oleander | Каллус | Олеандрин, олеандригенин, одорозид | [80, 82] |
| Суспензия | [81, 83] | ||
| Thevetia peruviana | Суспензия | Теветин, нерифолин, перувозид, дигитоксигенин | [85, 86] |
| Calotropis spp. | Каллус | Карденолиды | [92] |
| Суспензия | [91] | ||
| Cryptolepis buchanani | Каллус | Криптозин | [93] |
| Pergularia tomentosa | Каллус | Галакинозид | [94] |
| Securigera securidaca | Суспензия | Карденолиды (секуридазид) | [96] |
| Charybdis congesta | Каллус | Просцилларидин А, сциллирозид, сцилларен А, дезацетилсциллирозид | [100] |
Значительно чаще формирование карденолидов и буфадиенолидов зафиксировано в культурах дифференцированных клеток (культуры миксотрофных клеток, микроглобул, соматических эмбриоидов) и культурах органов растений (культуры корней, побегово-листовые культуры, регенерированные луковицы), что может быть напрямую связано с системой локализации процессов биосинтеза и накопления вторичных метаболитов в интактных растениях. Правда, пока это подтверждено работами, проведенными лишь на нескольких видах растений родов Digitalis и Urginea и вопрос, действительно ли для активного биосинтеза сердечных гликозидов необходимы процессы дифференцировки и морфогенеза – или это особенность только нескольких родов растений – пока остается в значительной степени открытым.
В нескольких работах исследователи пытались найти в клетках in vitro растений-продуцентов сердечных гликозидов не только целевые соединения, но провести скрининг содержания разных групп вторичных метаболитов. Практически во всех случаях было обнаружено присутствие различных веществ специализированного обмена (в культурах клеток Digitalis spp. – антрахиноны, фенилэтаноиды, стероидные гликозиды; в каллусных и суспензионных культурах Thevetia peruviana – флавоноиды и тритерпеновые гликозиды). Это подтверждает формирующийся новый взгляд на специфику вторичного метаболизма в культурах клеток высших растений, согласно которому, в дедифференцированных клетках in vitro происходит активное формирование веществ вторичного обмена, но их качественный состав и количественное содержание, как правило, существенно отличаются от таковых в интактном растении.
Обнаруженные закономерности в сопоставлении с данными об образовании сердечных гликозидов в интактных растениях позволяют сделать ряд заключений о специфике формирования и физиологической роли этих соединений. В частности, о сложной пространственной и временной организации их синтеза; об отсутствии функциональной роли для дедифференцированных пролиферирующих клеток; о возможных факторах управления биосинтезом – гормональных (салицилат, метилжасмонат), сигнальных (перекись водорода, УФ, Са2+), стрессовыми воздействиями. Найденные закономерности подтверждают идею об экологических функциях сердечных гликозидов в жизнедеятельности растений.
Говоря о практическом применении карденолидов и буфадиенолидов, можно отметить появление информации об их использования для лечения не только сердечно-сосудистых патологий, но и высокой эффективности в качестве противоопухолевых агентов, нейропротекторов и противовирусных соединений. Культуры клеток и органов растений in vitro в качестве экологически чистого возобновляемого растительного сырья считаются сейчас одним из приоритетных направлений растительной биотехнологии. Исходя из анализа доступной литературы по образованию сердечных гликозидов в растительных системах in vitro, дедифференцированные клетки в качестве потенциальных продуцентов этой группы тритерпеноидов использовать нецелесообразно. Для биотехнологического получения карденолидов и буфадиенолидов, по-видимому, более эффективно использовать культуры дифференцированных клеток и органов растений. Однако, как было сказано выше, универсальность этого подхода для разных видов растений пока не очевидна.
Достаточно перспективным для промышленного получения сердечных гликозидов может быть использование биотрансформации, однако имеющиеся успешные примеры подобного способа, согласно доступным источникам, пока не нашли практического применения. Возможно, это обусловлено дороговизной производства биомассы культур клеток растений, и в связи с этим получение новых и ценных “биотрансформированных” соединений экономически невыгодно. Стоит отметить, что дополнительные фундаментальные исследования в этой области могли бы улучшить ситуацию с промышленным получением экологически чистых биологически активных веществ растительного происхождения.
Наконец, культуры клеток Digitalis spp., Thevetia spp. и, возможно, ряда других родов растений-продуцентов карденолидов и буфадиенолидов, могут оказаться достаточно перспективными для получения фармацевтически ценных вторичных метаболитов, не относящихся к группе сердечных гликозидов, например, стероидных и тритерпеновых гликозидов, антрахинонов, флавоноидов, фенилэтаноидов.
Подводя итог, можно отметить, что сердечные гликозиды являются одной из наиболее интересных групп тритерпеноидов, исследование которой имеет как фундаментальную, так и практическую значимость. Получить их образование в ощутимых количествах в дедифференцированных культурах клеток растений является сложной задачей – в отличие, к примеру, от близких по структуре стероидных гликозидов. Причина этого явления пока остается открытой, и для ответа на этот вопрос необходимо расширение направлений исследований – изучение культур in vitro разных видов растений (не только Digitalis spp.), анализ широкого спектра различных групп вторичных метаболитов (не только сердечных гликозидов), сопоставление имеющихся и вновь полученных результатов с физиологическими особенностями функционирования вторичного метаболизма в разнообразных системах – от дедифференцированной клетки in vitro до интактного растения.
Работа выполнена при финансовой поддержке Мегагранта Правительства Российской Федерации (Соглашение № 075-15-2019-1882).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Wink M. Introduction: biochemistry, physiology and ecological functions of secondary metabolites // Annu. Plant Rev. 2010. V. 40. P. 1. https://doi.org/10.1002/9781444320503.ch1
Nosov A.M., Popova E.V., Kochkin D.V. Isoprenoid production via plant cell cultures: biosynthesis, accumulation and scaling-up to bioreactors // Production of Biomass and Bioactive Compounds Using Bioreactor Technology / Eds. Paek K.Y., Murthy H.N., Zhong J.J. Dordrecht: Springer, 2014. P. 563. https://doi.org/10.1007/978-94-017-9223-3_23
Nosov A.M. Application of cell technologies for production of plant-derived bioactive substances of plant origin // Appl. Biochem. Microbiol. 2012. V. 48. P. 609. https://doi.org/10.1134/S000368381107009X
Хотим Е.Н., Жигальцов А.М., Кумара А. Некоторые аспекты современной фитотерапии // Журнал Гродненского государственного медицинского университета. 2016. Т. 3. С. 136.
Самбукова Т.В., Овчинников Б.В., Ганапольский В.П., Ятманов А.Н., Шабанов П.Д. Перспективы использования фитопрепаратов в современной фармакологии // Обзоры по клинической фармакологии и лекарственной терапии. 2017. Т. 15. С. 56.
Brahmkshatriya P.P., Brahmkshatriya P.S. Terpenes: chemistry, biological role, and therapeutic applications // Natural products: phytochemistry, botany and metabolism of alkaloids, phenolics and terpenes / Eds. Ramawat K.G., Merillon J.M. Heidelberg: Springer-Verlag, 2013. P. 2665. https://doi.org/10.1007/978-3-642-22144-6_120
Kreis W., Muller-Uri F. Biochemistry of sterols, cardiac glycosides, brassinosteroids, phytoecdysteroids and steroid saponins // Annu. Plant Rev. 2010. V. 40. P. 304. https://doi.org/10.1002/9781444320503.ch6
Матюшин А.И. Биохимическая фармакология сердечных гликозидов // Биохимическая фармакология / Под ред. П.В. Сергеева, Н.Л. Шимановского. Москва: ООО “Медицинское информационное агенство”, 2010. С. 358.
Величко Н.А., Смольникова Я.В. Получение сердечных гликозидов из клеточной культуры Digitalis purpurea L. Красноярск: Краснояр. гос. аграр. ун-т., 2014. 98 с.
Krishna A.B., Manikyam H.K., Sharma V.K., Sharma N. Plant cardenolides in therapeutics // International Journal of Indigenous Medicinal Plants. 2015. V. 48. P. 1871.
Verma S.K., Das A.K., Cingoz G.S., Gurel E. In vitro culture of Digitalis L. (foxglove) and the production of cardenolides: an up-to-date review // Ind. Crops Prod. 2016. V. 94. P. 20. https://doi.org/10.1016/j.indcrop.2016.08.031
Kreis W. The foxgloves (Digitalis) revisited // Planta Med. 2017. V. 83. P. 962. https://doi.org/10.1055/s-0043-111240
Clemente E.S., Muller-Uri F., Nebauer S.G., Segura J., Kreis W., Arrillaga I. Digitalis // Wild crop relatives: genomic and breeding resources, plantation and ornamental crops / Ed. Kole C. Heidelberg, Berlin: Springer-Verlag, 2011. P. 73. https://doi.org/10.1007/978-3-642-21201-7_5
Kreis W., Muller-Uri F. Cardenolide aglycone formation in Digitalis // Isoprenoid synthesis in plants and microorganisms: new concepts and experimental approaches / Eds. Bach T.J., Rohmer M. New York: Springer-Verlag, 2013. P. 425. https://doi.org/10.1007/978-1-4614-4063-5_29
Steyn P.S., van Heerden F.R. Bufadienolides of plant and animal origin // Nat. Prod. Rep. 1998. V. 15. P. 397. https://doi.org/10.1039/A815397Y
Федорова О.В., Коростовцева Л.С., Шапиро Дж.И., Багров А.Я. Эндогенные кардиотонические стероиды: клинические перспективы // Артериальная гипертензия. 2008. Т. 14. С. 220. https://doi.org/10.18705/1607-419X-2008-14-3-220-232
Prassas I., Diamandis E.P. Novel therapeutic applications of cardiac glycosides // Nat. Rev. Drug Discovery. 2008. V. 7. P. 926. https://doi.org/10.1038/nrd2682
Melero C.P., Medarde M., Feliciano A.S. A short review on cardiotonic steroids and their aminoguanidine analogues // Molecules. 2000. V. 5. P. 51. https://doi.org/10.3390/50100051
Ahmed A., Pitt B., Rahimtoola S.H., Waagstein F., White M., Love T.E., Braunwald E. Effects of digoxin at low serum concentrations on mortality and hospitalization in heart failure: a propensity matched study of the DIG trial // Int. J. Cardiol. 2008. V. 123. P. 138. https://doi.org/10.1016/j.ijcard.2006.12.001
Shiratori O. Growth inhibitory effect of cardiac glycosides and aglycones on neoplastic cells: in vitro and in vivo studies // Japanese Journal of Cancer Research Gann. 1967. V. 58. P. 521.
Mijatovic T., Quaquebeke E.V., Delest B., Debeir O., Darro F., Kiss R. Cardiotonic steroids on the road to anti-cancer therapy // Biochem. Biophys. Acta. 2007. V. 1776. P. 32. https://doi.org/10.1016/j.bbcan.2007.06.002
Stenkvist B., Bengtsson E., Eriksson O., Holmquist J., Nordin B., Westman-Naeser S. Cardiac glycosides and breast cancer // Lancet. 1979. V. 10. P. 563. https://doi.org/10.1016/s0140-6736(79)90996-6
Ueda J.Y., Tezuka Y., Banskota A.H., Tran Q.L., Tran Q.K., Saiki I., Kadota S. Antiproliferative activity of cardenolides isolated from Streptocaulon juventas // Biol. Pharm. Bull. 2003. V. 26. P. 1431. https://doi.org/10.1248/bpb.26.1431
Lopez-Lazaro M., Pastor N., Azrak S.S., Ayuso M.J., Austin C.A., Cortes F. Digitoxin inhibits the growth of cancer cell lines at concentrations commonly found in cardiac patients // J. Nat. Prod. 2005. V. 68. P. 1642. https://doi.org/10.1021/np050226l
Hallbook H., Felth J., Eriksson A., Fryknas M., Bohlin L., Larsson R., Gullbo J. Ex vivo activity of cardiac glycosides in acute leukaemia // PLoS One. 2011. V. 6. P. e15718. https://doi.org/10.1371/journal.pone.0015718
Fujino T., Kuroda M., Matsuo Y., Kubo S., Tamura C., Sakamoto N., Mimaki Y., Hayakawa M. Cardenolide glycosides from the seeds of Digitalis purpurea exhibit carcinoma-specific cytotoxicity toward renal adenocarcinoma and hepatocellular carcinoma cells // Biosci. Biotechnol. Biochem. 2015. V. 79. P. 177. https://doi.org/10.1080/09168451.2014.975183
Li J., Zelenin S., Aperia A., Aizman O. Low doses of ouabain protect from serum deprivation-triggered apoptosis and stimulate kidney cell proliferation via activation of NF-κappaB // J. Am. Soc. Nephrol. 2006. V. 17. P. 1848. https://doi.org/10.1681/ASN.2005080894
Wang J.K.T., Portbury S., Thomas M.B., Barney S., Ricca D.J., Morris D.L., Warner D.S., Lo D.C. Cardiac glycosides provide neuroprotection against ischemic stroke: discovery by a brain slice-based compound screening platform // Proc. Natl. Acad. Sci. U.S.A. 2006. V. 103. P. 10461. https://doi.org/10.1073/pnas.0600930103
Verheye-Dua F.A., Bohm L. Influence of ouabain on cell inactivation by irradiation // Strahlenther. Onkol. 1996. V. 172. P. 156.
Verheye-Dua F.A., Bohm L. Na+,K+-ATPase inhibitor, ouabain accentuates irradiation damage in human tumour cell lines // Radiat. Oncol. Invest. 1998. V. 6. P. 109. https://doi.org/10.1002/(SICI)1520-6823(1998)6:3<109::AID-ROI1>3.0.CO;2-1
Pathak S., Multani A.S., Narayan S., Kumar V., Newman R.A. AnvirzelTM, an extract of Nerium oleander, induces cell death in human but not murine cancer cells // Anti-Cancer Drugs. 2000. V. 11. P. 455. https://doi.org/10.1097/00001813-200007000-00006
Slingerland M., Cerella C., Guchelaar H.J., Diederich M., Gelderblom H. Cardiac glycosides in cancer therapy: from preclinical investigations towards clinical trials // Invest. New Drugs. 2013. V. 31. P. 1087. https://doi.org/10.1007/s10637-013-9984-1
Pan Y., Rhea P., Tan L., Cartwright C., Lee H.J., Ravoori M.K., Addington C., Gagea M., Kundra V., Kim S.J., Newman R.A., Yang P. PBI-05204, a supercritical CO2 extract of Nerium oleander, inhibits growth of human pancreatic cancer via targeting the PI3K/mTOR pathway // Invest. New Drugs. 2015. V. 33. P. 271. https://doi.org/10.1007/s10637-014-0190-6
Su C.T., Hsu J.T.A., Hsieh H.P., Lin P.H., Chen T.C., Kao C.L., Lee C.N., Chang S.Y. Anti-HSV activity of digitoxin and its possible mechanisms // Antiviral Res. 2008. V. 79. P. 62. https://doi.org/10.1016/j.antiviral.2008.01.156
Singh S., Shenoy S., Nehete P.N., Yang P., Nehete B., Fontenot D., Yang G., Newman R.A., Sastry K.J. Nerium oleander derived cardiac glycoside oleandrin is a novel inhibitor of HIV infectivity // Fitoterapia. 2013. V. 84. P. 32. https://doi.org/10.1016/j.fitote.2012.10.017
Cai H., Wang H.Y.L., Venkatadri R., Fu D.X., Forman M., Bajaj S.O., Li H., O’Doherty G.A., Arav-Boger R. Digitoxin analogues with improved anticytomegalovirus activity // ACS Med. Chem. Lett. 2014. V. 5. P. 395. https://doi.org/10.1021/ml400529q
Hanrahan J.W., Sampson H.M., Thomas D.Y. Novel pharmacological strategies to treat cystic fibrosis // Trends Pharmacol. Sci. 2013. V. 34. P. 119. https://doi.org/10.1016/j.tips.2012.11.006
Pauli G.F., Friesen J.B., Godecke T., Farnsworth N.R., Glodny B. Occurrence of progesterone and related animal steroids in two higher plants // J. Nat. Prod. 2010. V. 73. P. 338. https://doi.org/10.1021/np9007415
Makarevich I.F., Kovalev S.V. Cardiac glycosides from Strophanthus kombe // Chem. Nat. Compd. 2006. V. 42. P. 189. https://doi.org/10.1007/s10600-006-0075-9
Evans W.C., Evans D. Saponins, cardioactive drugs and other steroids // Trease and Evans’ Pharmacognosy (Sixteenth Edition) / Ed. Evans W.C. Edinburgh: Saunders, 2009. P. 304. https://doi.org/10.1016/B978-0-7020-2933-2.00023-X
Kumar A., De T., Mishra A., Mishra A.K. Oleandrin: A cardiac glycosides with potent cytotoxicity // Pharmacogn. Rev. 2013. V. 7. P. 131. https://doi.org/10.4103/0973-7847.120512
Taha H.S., Farag S.H., Shams K.A., Abdel-Azim N.S., Seif El-Nasr M.M. In vivo and in vitro studies on Thevetia species growing in Egypt II. Establishment of in vitro tissue culture system and production of cardiac glycosides // J. American Science. 2011. V. 7. P. 1.
Cheung H.T.A., Watson T.R., Seiber J.N., Nelson C. 7β,8β-epoxycardenolide glycosides of Asclepias eriocarpa // J. Chem. Soc. Perkin Trans. 1. 1980. P. 2169. https://doi.org/10.1039/P19800002169
Cheung H.T.A., Chiu F.C.K, Watson T.R., Wells R.J. Cardenolide glycosides of the Asclepiadaceae. New glycosides from Asclepias fruticosa and the stereochemistry of uscharin, voruscharin and calotoxin // J. Chem. Soc. Perkin Trans. 1. 1983. P. 2827. https://doi.org/10.1039/P19830002827
Abe F., Mori Y., Yamauchi T. Cardenolide glycosides from the seeds of Asclepias curassavica // Chem. Pharm. Bull. 1992. V. 40. P. 2917. https://doi.org/10.1248/cpb.40.2917
Kolodziejczyk-Czepas J., Stochmal A. Bufadienolides of Kalanchoe species: an overview of chemical structure, biological activity and prospects for pharmacological use // Phytochem. Rev. 2017. V. 16. P. 1155. https://doi.org/10.1007/s11101-017-9525-1
Yokosuka A., Inomata M., Yoshizawa Y., Iguchi T., Mimaki Y. Bufadienolides and ecdysteroids from the whole plants of Helleborus niger and their cytotoxicity // J. Nat. Med. 2021. V. 75. P. 393. https://doi.org/10.1007/s11418-021-01481-6
Chik W.I., Zhu L., Fan L.L., Yi T., Zhu G.Y., Gou X.J., Tang Y.N., Xu J., Yeung W.P., Zhao Z.Z., Yu Z.L., Chen H.B. Saussurea involucrata: A review of the botany, phytochemistry and ethnopharmacology of a rare traditional herbal medicine // J. Ethnopharmacol. 2015. V. 172. P. 44. https://doi.org/10.1016/j.jep.2015.06.033
Agrawal A.A., Petschenka G., Bingham R.A., Weber M.G., Rasmann S. Toxic cardenolides: chemical ecology and coevolution of specialized plant–herbivore interactions // New Phytol. 2012. V. 194. P. 28. https://doi.org/10.1111/j.1469-8137.2011.04049.x
Rucker W. Digitalis spp.: in vitro culture, regeneration, and the production of cardenolides and other secondary products // Medicinal and aromatic plants I. Biotechnology in agriculture and forestry, vol. 4 / Ed. B-ajaj Y.P.S. Heidelberg: Springer, 1988. P. 388. https://doi.org/10.1007/978-3-642-73026-9_21
Hagimori M., Matsumoto T., Kisaki T. Studies on the production of Digitalis cardenolides by plant tissue culture I. Determination of digitoxin and digoxin contents in first and second passage calli and organ redifferentiating calli of several Digitalis species by radioimmunoassay // Plant Cell Physiol. 1980. V. 21. P. 1391. https://doi.org/10.1093/pcp/21.8.1391
Nover L., Luckner M., Tewes A., Garve R., Vogel E. Cell specialization and cardiac glycoside formation in cell cultures of Digitalis species // Acta Hortic. 1980. V. 96. P. 65. https://doi.org/10.17660/ActaHortic.1980.96.3
Kuberski Ch., Scheibner H., Steup C., Diettrich B., Luckner M. Embryogenesis and cardenolide formation in tissue cultures of Digitalis lanata // Photochem. 1984. V. 23. P. 1407. https://doi.org/10.1016/S0031-9422(00)80475-6
Luckner M., Diettrich B. Formation of cardenolides in cell and organ cultures of Digitalis lanata // Primary and secondary metabolism of plant cell cultures / Eds. Neumann K.H., Barz W., Reinhard E. Heidelberg: Springer-Verlag, 1985. P. 154. https://doi.org/10.1007/978-3-642-70717-9_15
Seidel S., Reinhard E. Major cardenolide glycosides in embryogenic suspension cultures of Digitalis lanata // Planta Med. 1987. V. 53. P. 308. https://doi.org/10.1055/s-2006-962722
Hagimori M., Matsumoto T., Obi Y. Studies on the production of Digitalis cardenolides by plant tissue culture II. Effect of light and plant growth substances on digitoxin formation by undifferentiated cells and shoot-forming cultures of Digitalis purpurea L. grown in liquid media // Plant Physiol. 1982. V. 69. P. 653. https://doi.org/10.1104/pp.69.3.653
Lui J., Staba E. Effects of age and growth regulators on serially propagated Digitalis lanata leaf and root cultures // Planta Med. 1981. V. 41. P. 90. https://doi.org/10.1055/s-2007-971682
Lui J.H., Staba E.J. Effects of precursors on serially propagated Digitalis lanata leaf and root cultures // Phytochem. 1979. V. 18. P. 1913. https://doi.org/10.1016/S0031-9422(00)82701-6
Hirotani M., Furuya T. Restoration of cardenolide-synthesis in redifferentiated shoots from callus cultures of Digitalis purpurea // Phytochem. 1977. V. 16. P. 610. https://doi.org/10.1016/0031-9422(77)80032-0
Spieler H., Alfermann A.W., Reinhard E. Biotransformation of β-methyldigitoxin by cell cultures of Digitalis lanata in airlift and stirred tank reactors // Appl. Microbiol. Biotechnol. 1985. V. 23. P. 1. https://doi.org/10.1007/BF02660109
Kreis W., Reinhard E. 12β-Hydroxylation of digitoxin by suspension-cultured Digitalis lanata cells. Production of deacetyllanatoside C using a two-stage culture method // Planta Med. 1988. V. 54. P. 143. https://doi.org/10.1055/s-2006-962373
Kreis W., Reinhard E. 12β-Hydroxylation of digitoxin by suspension-cultured Digitalis lanata cells: Production of digoxin in 20-1itre and 300-1itre air-lift bioreactors // J. Biotechnol. 1992. V. 26. P. 257. https://doi.org/10.1016/0168-1656(92)90011-w
Bonfill M., Palazon J., Cusido R.M., Pinol M.T., Morales C. Effect of auxin and phenobarbital on the ultrastructure and digitoxin content in Digitalis purpurea tissue culture // Can. J. Bot. 1996. V. 74. P. 378. https://doi.org/10.1139/b96-047
Ohlsson A.B., Bjork L. Effects of gibberellic acid on cardenolide accumulation by Digitalis lanata tissue cultures grown in light and darkness // J. Plant Physiol. 1988. V. 133. P. 535.
Cingoz G.S., Gurel E. Effects of salicylic acid on thermotolerance and cardenolide accumulation under high temperature stress in Digitalis trojana Ivanina // Plant Physiol. Biochem. 2016. V. 105. P. 145. https://doi.org/10.1016/j.plaphy.2016.04.023
Corchete M.P., Jimenez M.A., Moran M., Cacho M., Fernandez-Tarrago J. Effect of calcium, manganese and lithium on growth and cardenolide content in cell suspension cultures of Digitalis thapsi L. // Plant Cell Rep. 1991. V. 10. P. 394. https://doi.org/10.1007/BF00232609
Cacho M., Moran M., Fernandez-Tarrago J., Corchete P. Calcium restriction induces cardenolide accumulation in cell suspension cultures of Digitalis thapsi L. // Plant Cell Rep. 1995. V. 14. P. 786. https://doi.org/10.1007/BF00232923
Paranhos A., Fernandez-Tarrago J., Corchete P. Relationship between active oxygen species and cardenolide production in cell cultures of Digitalis thapsi: effect of calcium restriction // New Phytol. 1999. V. 141. P. 51. https://doi.org/10.1046/j.1469-8137.1999.00317.x
Sahin G., Verma S.K., Gurel E. Calcium and magnesium elimination enhances accumulation of cardenolides in callus cultures of endemic Digitalis species of Turkey // Plant Physiol. Biochem. 2013. V. 73. P. 139. https://doi.org/10.1016/j.plaphy.2013.09.007
Ohlsson A.B., Berglund T. Effects of high MnSO4 levels on cardenolide accumulation by Digitalis lanata tissue cultures in light and darkness // J. Plant Physiol. 1989. V. 135. P. 505.
Cingoz G.S., Verma S.K., Gurel E. Hydrogen peroxide-induced antioxidant activities and cardiotonic glycoside accumulation in callus cultures of endemic Digitalis species // Plant Physiol. Biochem. 2014. V. 82. P. 89. https://doi.org/10.1016/j.plaphy.2014.05.008
Furuya T., Kojima H. 4-Hydroxydigitolutein, a new anthraquinone from callus tissue of Digitalis lanata // Phytochemistry. 1971. V. 10. P. 1607. https://doi.org/10.1016/0031-9422(71)85033-1
Furuya T., Kojima H., Katsuta T. 3-methylpurpurin and other anthraquinones from callus tissue of Digitalis lanata // Phytochem. 1972. V. 11. P. 1073. https://doi.org/10.1016/S0031-9422(00)88455-1
Matsumoto M., Koga S., Shoyama Y., Nishioka I. Phenolic glycoside composition of leaves and callus cultures of Digitalis purpurea // Phytochem. 1987. V. 26. P. 3225. https://doi.org/10.1016/S0031-9422(00)82474-7
Furuya T., Kawaguchi K., Hirotani M. Biotransformation of digitoxigenin by cell suspension cultures of Strophanthus gratus // Phytochem. 1988. V. 27. P. 2129. https://doi.org/10.1016/0031-9422(88)80110-9
Kawaguchi K., Hirotani M., Furuya T. Biotransformation of digitoxigenin by cell suspension cultures of Strophanthus amboensis // Phytochem. 1988. V. 27. P. 3475. https://doi.org/10.1016/0031-9422(88)80751-9
Kawaguchi K., Hirotani M., Furuya T. Biotransformation of digitoxigenin by cell suspension cultures of Strophanthus intermedius // Phytochem. 1989. V. 28. P. 1093. https://doi.org/10.1016/0031-9422(89)80190-6
Kawaguchi K., Hirotani M., Furuya T. Biotransformation of digitoxigenin by cell suspension cultures of Strophanthus divaricatus // Phytochem. 1991. V. 30. P. 1503. https://doi.org/10.1016/0031-9422(91)84197-Z
Paper D.H., Franz G. Biotransformation of 5βH-pregnan-3βol-20-one and cardenolides in cell suspension cultures of Nerium oleander L. // Plant Cell Rep. 1990. V. 8. P. 651. https://doi.org/10.1007/BF00269985
Чмелева С.И., Бугара А.М., Омельченко А.В., Якимова О.В. Получение каллусных культур олеандра обыкновенного (Nerium oleander L.) и их анализ на содержание сердечных гликозидов // Ученые записки Таврического национального университета им. В.И. Вернадского. Серия “Биология, химия”. 2009. Т. 22. С. 145.
Ibrahim A., Khalifa S., Khafagi I., Youssef D., Khan I., Mesbah M. Enhancement of oleandrin production in suspension cultures of Nerium oleander by combined optimization of medium composition and substrate feeding // Plant Biosyst. 2009. V. 143. P. 97. https://doi.org/10.1080/11263500802633683
Hovhannisyan N., Mkrumyan M., Yesayan A., Aroutiounian R., Newman R.A., Grigoryan R., Sarkisyan N., Gasparyan G. Callus culture of oleander retains pharmacological activities of the plant // Nat. Prod. Indian J. 2011. V. 7. P. 137.
Salama I.M., Mohamed H.M., EL-Megid A. Reflex of oleandrin production and molecular changes on the Nerium oleander cell suspension culture under UV-A radiation stress effect // Egypt. J. Rad. Sci. Applic. 2019. V. 32. P. 117. https://doi.org/10.21608/ejrsa.2019.7166.1062
Sen G., Datta P.C. Dedifferentiation and loss of thevetin in Thevetia peruviana callus // Planta Med. 1981. V. 41. P. 415. https://doi.org/10.1055/s-2007-971742
Dantas-Barros A.M., Foulquier M., Cosson L., Jacquin-Dubreuil A. Cardenolide formation in cell suspension cultures of Thevetia peruviana (Pers.) K. Schum. (synonym Thevetia neriifolia Juss.) // Nat. Prod. Lett. 1993. V. 3. P. 37. https://doi.org/10.1080/10575639308043835
Zabala M.A., Angarita M., Restrepo J.M., Caicedo L.A., Perea M. Elicitation with methyl-jasmonate stimulates peruvoside production in cell suspension cultures of Thevetia peruviana // In Vitro Cell. Dev. Biol.−Plant. 2010. V. 46. P. 233. https://doi.org/10.1007/s11627-009-9249-z
Doller P.C., Reinhard E. Biotransformation of cardenolides. Comparative studies with cell cultures of Thevetia neriifolia and Digitalis lanata // Planta Med. 1979. V. 37. P. 277.
Arias J.P., Zapata K., Rojano B., Arias M. Effect of light wavelength on cell growth, content of phenolic compounds and antioxidant activity in cell suspension cultures of Thevetia peruviana // J. Photochem. Photobiol. B: Biol. 2016. V. 163. P. 87. https://doi.org/10.1016/j.jphotobiol.2016.08.014
Arias J.P., Zapata K., Rojano B., Penuela M., Arias M. Cardiac glycosides, phenolic compounds and antioxidant activity from plant cell suspension cultures of Thevetia peruviana // Rev. U.D.C.A Act. & Div. Cient. 2017. V. 20. P. 353.
Mendoza D., Arias J.P., Cuaspud O., Arias M. Phytochemical screening of callus and cell suspensions cultures of Thevetia peruviana // Braz. Arch. Biol. Technol. 2020. V. 63. P. e20180735. https://doi.org/10.1590/1678-4324-2020180735
El-Bakry A.A., Ghazi S.M., Abdrabou H.A.A. Production of cardiac glycosides from Calotropis procera by cell suspension cultures // J. Appl. Sci. Res. 2011. V. 7. P. 1375.
Tripathi P.K., Awasthi S., Kanojiya S., Tripathi V., Mishra D.K. Callus culture and in vitro biosynthesis of cardiac glycosides from Calotropis gigantea (L.) Ait. // In Vitro Cell. Dev. Biol.−Plant. 2013. V. 49. P. 455. https://doi.org/10.1007/s11627-012-9481-9
Venkateswara R., Rao K.S., Vaidyanathan C.S. Cryptosin – a new cardenolide in tissue culture and intact plants of Cryptolepis buchanani Roem. & Schult. // Plant Cell Rep. 1987. V. 6. P. 291. https://doi.org/10.1007/BF00272001
Hifnawy M.S., El-Shanawany M.A., Khalifa M.M., Youssef A.K., Bekhit M.H., Desoukey S.Y. In vitro and in vivo cultivation of Pergularia tomentosa for cardenolides // IOSR J. Pharm. Biol. Sci. 2014. V. 9. P. 40. https://doi.org/10.9790/3008-09214052
Duskova J., Sovova M., Zackova P., Spurna V. Tissue culture of crownvetch (Coronilla varia L.) and the production of cardenolide-like substances in vitro // Biol. Plant. 1987. V. 29. P. 258. https://doi.org/10.1007/BF02892786
Tofighi Z., Ghazi saeidi N., Hadjiakhoondi A., Yassa N. Determination of cardiac glycosides and total phenols in different generations of Securigera securidaca suspension culture // Res. J. Pharmacogn. 2016. V. 3. P. 25.
Kaul B., Wells P., Staba E.J. Production of cardio-active substances by plant tissue cultures and their screening for cardiovascular activity // J. Pharm. Pharmac. 1967. V. 19. P. 760. https://doi.org/10.1111/j.2042-7158.1967.tb08028.x
Shyr S.E., Staba E.J. Examination of squill tissue cultures for bufadienolides and anthocyanins // Planta Med. 1976. V. 29. P. 86. https://doi.org/10.1055/s-0028-1097633
Jha S., Sahu N.P., Mahato S.B. Callus induction, organogenesis and somatic embryogenesis in three chromosomal races of Urginea indica and production of bufadienolides // Plant Cell, Tissue Organ Cult. 1991. V. 25. P. 85. https://doi.org/10.1007/BF00042178
Reddy A.S., Devi P.S., Kiran S.R. In vitro cell culture of Charybdis congesta for enhanced production of secondary metabolites: proscillaridin A, scillaren A and scilliroside // Afr. J. Biotechnol. 2013. V. 12. P. 1754. https://doi.org/10.5897/AJB2013.12103
Daniel D., Susal C., Kopp B., Opelz G., Terness P. Apoptosis-mediated selective killing of malignant cells by cardiac steroids: maintenance of cytotoxicity and loss of cardiac activity of chemically modified derivatives // Int. Immunopharmacol. 2003. V. 3. P. 1791. https://doi.org/10.1016/j.intimp.2003.08.004
Zhang X., Ye M., Dong Y., Hu H., Tao S., Yin J., Guo D. Biotransformation of bufadienolides by cell suspension cultures of Saussurea involucrata // Phytochem. 2011. V. 72. P. 1779. https://doi.org/10.1016/j.phytochem.2011.05.004
Hilton P.J., McKinnon W., Gravett E.C., Peron J.M.R., Frampton C.M., Nicholls M.G., Lord G. Selective inhibition of the cellular sodium pump by emicymarin and 14β anhydroxy bufadienolides // Steroids. 2010. V. 75. P. 1137. https://doi.org/10.1016/j.steroids.2010.07.010
Ye M., Qu G.Q., Guo H.Z., Guo D.A. Novel cytotoxic bufadienolides derived from bufalin by microbial hydroxylation and their structure-activity relationships // J. Steroid Biochem. Mol. Biol. 2004. V. 91. P. 87. https://doi.org/10.1016/j.jsbmb.2004.01.010
Ye M., Han J., An D.G., Tu G.Z., Guo D.A. New cytotoxic bufadienolides from the biotransformation of resibufogenin by Mucor polymorphosporus // Tetrahedron. 2005. V. 61. P. 8947. https://doi.org/10.1016/j.tet.2005.07.012
Ye M., Ning L., Zhan J., Guo H., Guo D. Biotransformation of cinobufagin by cell suspension cultures of Catharanthus roseus and Platycodon grandiflorum // J. Mol. Catal. B: Enzym. 2003. V. 22. P. 89. https://doi.org/10.1016/S1381-1177(03)00011-0
Ye M., Dai J., Guo H., Cui Y., Guo D. Glucosylation of cinobufagin by cultured suspension cells of Catharanthus roseus // Tetrahedron Lett. 2002. V. 43. P. 8535. https://doi.org/10.1016/S0040-4039(02)02078-6
Nisar A., Mamat A.S., Hatim M.I., Aslam M.S., Ahmad M.S. An updated review on Catharanthus roseus: phytochemical and pharmacological analysis // Indian Res. J. Pharm. Sci. 2016. V. 3. P. 631.
Deng Y., Ye X., Chen Y., Ren H., Xia L., Liu Y., Liu M., Liu H., Zhang H., Wang K., Zhang J., Zhang Z. Chemical characteristics of Platycodon grandiflorum and its mechanism in lung cancer treatment // Front. Pharmacol. 2021. V. 11. P. 609825. https://doi.org/10.3389/fphar.2020.609825
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений