Физиология растений, 2022, T. 69, № 5, стр. 531-542
Экотоксикологические аспекты влияния меди в ионной и наноформе на структурно-функциональные характеристики Dunaliella salina (Teod.)
Е. С. Соломонова a, *, Н. Ю. Шоман a, А. И. Акимов a, О. А. Рылькова a
a Федеральное государственное бюджетное учреждение науки Федеральный исследовательский центр
Институт биологии южных морей им. А. О. Ковалевского Российской академии наук
Севастополь, Россия
* E-mail: solomonov83@mail.ru
Поступила в редакцию 11.03.2022
После доработки 31.03.2022
Принята к публикации 31.03.2022
- EDN: ISZSZU
- DOI: 10.31857/S0015330322050219
Аннотация
Проведено комплексное исследование стрессовых откликов зеленой микроводоросли Dunaliella salina (Teod.) в ответ на добавление в культуральные среды f/4 и f/32 наночастиц оксида меди (0, 250, 665, 1330, 2000, 2500, 3750 мкг/л) и ионов меди (0, 15, 150, 200, 400, 580, 770 мкг/л). Установлено, что ингибирующее влияние меди на структурно-функциональные характеристики D. salina было менее выражено при выращивании водорослей на питательной среде f/4, что обусловлено высоким содержанием в среде хелатирующего агента ЭДТА, способного связывать растворенные в воде ионы металлов в хелатные комплексы, тем самым уменьшая их активность и токсическое действие на клетки и повышая биодоступность для водорослей. Показан различный механизм действия меди в ионной и наноформе на физиологию водорослей. Установлено, что медь в ионной форме оказывает цитотоксичное влияние на клетки Dunaliella salina, в то время как наночастицы CuO в большей мере механически воздействуют на поверхность клетки. При культивировании водорослей на среде f/32 замедление роста клеток, снижение флуоресценции диацетата флуоресцеина (FDA), удельного содержания хлорофилла на клетку, эффективности работы фотосинтетического аппарата и индукция синтеза АФК наблюдались при концентрации Cu2+ в среде выше 400 мкг/л. Тогда как негативное действие наночастиц CuO (НЧ) отмечено при содержании поллютанта выше 700 мкг/л и в большей степени сказывалось на морфологических изменениях клеток: происходило двукратное укрупнение клеток, количество шаровидных форм увеличивалось (до 71%), отмечались значительная деформация и перфорация плазмалеммы, преобладание деформированных клеток неправильной формы и агломерированных с наночастицами. Установлено, что максимальные исследуемые концентрации токсикантов не приводят к полной элиминации популяции, что, вероятно, обусловлено присутствием в культуре клеток, резистентных к воздействию меди (порядка 10–15% по данным FDA-окрашивания) и способных обеспечить выживаемость и последующее восстановление популяции Dunaliella salina при высоком уровне антропогенного загрязнения окружающей среды.
ВВЕДЕНИЕ
В эпоху повсеместного использования, создания и развития нанотехнологической продукции особенно актуальным является вопрос оценки ее влияния на окружающую среду. Но, несмотря на пристальное внимание, уделяющееся экологическим проблемам ресурсов Земли, влияние наноразмерных частиц металлов, которые активно используются в разных областях человеческой деятельности, на живые организмы на сегодняшний день – это мало изученный феномен.
Наночастицы (НЧ) металлов, в частности НЧ CuO, благодаря их уникальным химическим и физическим свойствам, находят применение практически во всех областях деятельности человека: науке и промышленности [1, 2], широко используются в потребительских товарах [3] или в качестве универсального биоцида [4, 5]. В настоящее время истинные мировые объемы производства наночастиц меди неизвестны, но такое их широкое применение неизбежно влечет за собой попадание НЧ CuO в водные экосистемы [3]. В то же время риски, связанные с неконтролируемым сбросом наночастиц CuO в окружающую среду в результате деятельности человека, не оценены, а вопросы в отношении их потенциального негативного воздействия на водные организмы все еще остаются нерешенными.
Фитопланктон представляет собой важный компонент водных экосистем, является первичным продуцентом органического вещества и основой всех трофических взаимодействий, вследствие чего, микроводоросли потенциально наиболее восприимчивы к НЧ на разных уровнях: репродуктивном (рост популяции), структурном и метаболическом [6, 7]. Ввиду этого понимание механизмов воздействия НЧ (с учетом приобретенных ими новых физико-химических свойств) на биологические объекты, выявление физиологического отклика оксигенных фототрофов как первично-продукционного звена трофической цепи на действие мелкодисперсных поллютантов, а также оценка возможных акклимационных изменений функционального состояния микроводорослей в ответ на это воздействие является крайне важной и актуальной задачей.
Одним из основных механизмов воздействия НЧ на водоросли является их адсорбция на клеточных стенках, что впоследствии может привести к разрушению мембран или самозатенению клеток [8–11]. К другим возможным механизмам влияния НЧ можно отнести высвобождение ионов металлов [12, 13], интернализацию наночастиц в клетки водорослей [7, 14], фотокатализ [15]. Собранной на сегодняшний день информации по исследуемой тематике недостаточно для выявления закономерностей и механизмов влияния НЧ на микроводоросли. Разрозненность имеющихся в литературе данных, по мнению многих авторов, обусловлена видоспецифичными особенностями самих объектов исследования, а именно составом и толщиной их клеточной стенки, являющейся “защитным барьером” от физического или биохимического воздействия НЧ [13, 14, 16]. Считается, что виды с тонкой клеточной стенкой более чувствительны к воздействию НЧ, чем виды с плотными целлюлозными, кремниевыми или карбонатными клеточными оболочками [17]. Однако в ряде работ [8, 18] данная гипотеза опровергается. Так, авторами [8] показано, что чувствительность к воздействию наночастиц CeO2 и Ce(NO3)3 у штамма Chlamydomonas reinhardtii с плотной клеточной стенкой и мутантного штамма без клеточной стенки была одинаковой, указывая на то, что оболочка клетки не препятствовала негативному воздействию поллютантов. Таким образом, основываясь на имеющихся данных, следует заключить, что механизмы, вызывающие разнообразие реакций у разных представителей одноклеточных водорослей после воздействия НЧ, остаются в значительной степени неизвестными.
Цель данного исследования заключалась в (а) оценке изменения ростовых, флуоресцентных, цитометрических показателей и содержания хлорофилла у Dunaliella salina при добавлении в среду наночастиц оксида меди и ионов меди разной концентрации; (б) сравнительной оценке степени токсичности ионов Cu2+ и нанооксида CuO при выращивании Dunaliella salina в условиях разной обеспеченности водорослей минеральным питанием.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. В качестве объекта исследования была использована альгологически чистая культура зеленой микроводоросли Dunaliella salina (Teod.), штамм IBSS-1 из коллекции культур микроводорослей и цианобактерий (IBSS) научно-образовательного центра коллективного пользования “Гидробионты мирового океана” (WDCM № 1201) Федерального исследовательского центра “Института биологии южных морей им. А. О. Ковалевского РАН”. Выбор объекта исследования обусловлен двумя причинами: (1) отсутствием у Dunaliella salina клеточной стенки, что делает данный вид микроводоросли более чувствительным к действию НЧ и (2) Dunaliella salina является наиболее перспективным видом для промышленного получения каротиноидов.
Условия проведения экспериментов. В ходе эксперимента культуру выращивали на питательной среде f/2 [19] в двух ее модификациях: 1) f/4 – двукратно разбавленная среда f/2; 2) f/32 – обедненная питательная среда, количественное содержание элементов которой в 16 раз ниже, чем в f/2. Выбор сред для культивирования обусловлен необходимостью оценки возможного взаимодействия между их составом и токсичным действием исследуемых поллютантов на клетки водорослей. Питательные среды готовили на основе фильтрованной и пастеризованной морской воды соленостью 18‰. Указанный разброс концентраций выбран нами для выяснения пределов устойчивости клеток микроводорослей к токсикантам. Культивирование водорослей проводили в конических колбах с объемом культуральной суспензии 150 мл при интенсивности света 85 мкЭ/(м2 с), светотемновом периоде 14/10 ч и температуре 20°С. Освещение колб осуществляли снизу светодиодами холодного света. Уровень освещенности определяли зондирующим 4П датчиком квантометра QSL 2101 (Biospherical Instruments Inc., США). Барботаж культур осуществляли аквариумными компрессорами, величина рН культуральной среды находилась в пределах 8.2–8.5. Предварительно до начала эксперимента водоросли адаптировали к заданным абиотическим условиям роста в течение 3 сут. При этом плотность культур поддерживали примерно на одном уровне порядка (2–2.5) × × 104 кл./мл путем ежесуточного разбавления свежей питательной средой заданной концентрации. На 4 сут эксперимента в колбы вносили растворы поллютантов.
Для приготовления растворов токсикантов использовали сульфат меди (ACS reagent, ≥ 98.0%, Sigma-Aldrich) и нанопорошок оксида меди (размер частиц 50–80 нм, Sigma-Aldrich). Из маточного раствора CuSO4 готовили растворы токсиканта с концентрациями 0, 15, 150, 200, 400, 580, 770 мкг/л (в пересчете на ионы Cu2+). Раствор, содержащий наночастицы оксида меди, предварительно обрабатывали ультразвуком с помощью ультразвуковой ванны “Сапфир” в течение часа для диспергирования частиц. Концентрация наночастиц оксида меди в разных вариантах эксперимента составляла 0, 250, 665, 1330, 2000, 2500, 3750 мкг/л. После добавления поллютантов водоросли выращивали в накопительном режиме в заданных абиотических условиях в течение 72 ч. В каждом варианте опыта использовали по 3 экспериментальные колбы.
Измерение численности клеток, прямого (FS), бокового светорассеяния (SS), красной автофлуоресценции клеток, флуоресценции FDA, АФК, а также максимальной квантовой эффективности ФС II (Fv/Fm) проводили ежедневно. В разделе “Результаты” представлены данные, полученные через 72 ч после добавления поллютантов в среду.
Методы измерений. Цитометрический анализ проб проводили в центре коллективного использования “Спектрометрия и хроматография” Федерального исследовательского центра “Института биологии южных морей им. А. О. Ковалевского РАН” на проточном цитометре MACSQuant Analazer (Miltenyi Biotec, Германия), оборудованном тремя лазерами (405 нм, 488 нм, 635 нм). Для обработки данных использовали программу FSC Express 7 Research Edition. Общую численность микроводорослей в культурах определяли в кластере на 2 параметрических цитограммах по прямому светорассеянию (FS) и флуоресценции отдельных клеток в красной спектральной области (FL4, 675 нм) на безразмерных логарифмических шкалах. Концентрацию клеток рассчитывали по скорости протока пробы (25 мкл/мин) и количеству событий, зарегистрированных в определенный промежуток времени. Контроль качества измерений численности производили с помощью калибровочных флуоросфер (Flow-CheckTM, Beckman Coulter, США) с известной концентрацией в пробе.
Метаболическую активность клеток (относительная величина) оценивали на 2 параметрических цитограммах по флуоресценции FDA (канал FL1 в зеленой области спектра, 525 нм) и автофлуоресценции клеток в красной области спектра на безразмерных логарифмических шкалах. Окрашивание водорослей витальным красителем диацетатом флуоресцеина (FDA) производили по протоколу [20]. Диацетат флуоресцеина (FDA) является маркером метаболической активности в живых клетках, а интенсивность его флуоресценции пропорциональна физиологической активности каждой из исследуемых клеток [21, 22]. Рассчитывали среднее значения аккумулированной флуоресценции FDA на клетку, предварительно вычитали значения автофлуоресценции клеток Dunaliella salina в данной области спектра.
Способность клеток Dunaliella salina к продукции активных форм кислорода оценивали по флуоресценции красителя 2, 7-дихлорфлуоресцеиндиацетата (DCFH-DA; Merck, Germany). DCFH-DA – клеточно-проницаемый индикатор АФК, наиболее часто используемый для количественной оценки количества генерируемых АФК [23]. Рабочий раствор красителя готовили в диметилсульфоксиде (DMSO) (конечная концентрация 5 мг/мл) и хранили при –4°С в замороженном состоянии (температура плавления DMSO +18.5°С). Окраску суспензии клеток проводили в соответствии с [23] – после оттаивания красителя при комнатной температуре его медленно добавляли в интенсивно перемешиваемую пробу в количестве 10 мкл/мл. Окраску производили в темноте в течение 30 мин. Интенсивность флуоресценции DCFH-DA оценивали по свечению клеток в зеленой области спектра, 525 нм, предварительно вычитали значения автофлуоресценции клеток Dunaliella salina в данной области спектра.
Определение концентрации хлорофилла в пробе проводили флуориметрическим методом. Для этого фиксированное количество суспензии водорослей фильтровали через стекловолокнистые фильтры Whatman (GF/C) с диаметром пор 0.45 мкм и диаметром рабочей поверхности 15 мм при вакууме не более 0.2 атм. Осевшую на фильтре взвесь экстрагировали 90%-ым водным раствором ацетона при температуре 8–10ºС в течение 18–24 ч [24]. Полученный экстракт центрифугировали при скорости 3000 об/мин в течение 10 мин, используя лабораторную центрифугу ОПН-3 (Дастан, Россия). После чего ацетоновые экстракты переносили в кварцевую кювету, в которой измеряли флуоресценцию до и после подкисления двумя каплями 1.2 М HCl. Измерения флуоресценции проводили на лабораторном флуориметре с импульсной модуляцией возбуждающего света на длине волны 455 нм “Мега-25м”, разработанным на кафедре биофизики биологического факультета МГУ [25]. Предварительная калибровка флуориметра была проведена по хроматографически чистому хлорофиллу a производства Sigma (США), исходную концентрацию которого определяли на спектрофотометре СФ-2000 (“ЛОМО”, Россия).
Измерение относительной переменной флуоресценции хлорофилла Fv/Fm (максимальная квантовая эффективность фотосистемы II) проводили на флуориметре с импульсной модуляцией возбуждающего света на длине волны 455 нм “Мега-25м”. Расчет проводили по формуле (1):
(1)
${{{{F}_{{\text{v}}}}} \mathord{\left/ {\vphantom {{{{F}_{{\text{v}}}}} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}} = {{({{F}_{{\text{m}}}} - {{F}_{0}})} \mathord{\left/ {\vphantom {{({{F}_{{\text{m}}}} - {{F}_{0}})} {{{F}_{{\text{m}}}}}}} \right. \kern-0em} {{{F}_{{\text{m}}}}}},$где F0 – величина флуоресценции хлорофилла при открытых реакционных центрах; Fm – максимальная флуоресценция при закрытых реакционных центрах.
Микроскопия. Суспензию микроводорослей для микроскопических исследований в течение 1 ч фиксировали глутаровым альдегидом (конечная концентрация в пробе 1%). Для световой микроскопии (СМ) использовали микроскоп Микмед-6, увеличение × 1000 (“ЛОМО”, Россия), с цифровой камерой (МС-6.3, “ЛОМО”, Россия), снабженный компьютерным программным обеспечением (MCVeiw, “ЛОМО-Микросистемы”, Россия) из ЦКП “Молекулярная структура вещества” Севастопольского Государственного университета. Размеры клеток определяли по микрофотографиям с помощью программы ImageJ 1.50i (National Institutes of Health, Java 1.6.0 20, США). В клетках измеряли диаметр (d), длину (l, h) и ширину (D). Объем рассчитывали по формуле объема “половины сфероида и параболоид” [26] и шара.
При подготовке образцов для сканирующего электронного микроскопа (СЭМ) 1–2 мл фиксированной пробы концентрировали на трековую мембрану с диаметром пор 3.0 мкм (производства ОИЯИ, г. Дубна, Россия). Далее проводили дегидратацию, используя серию разведения этанола: 20%, 30%, 50%, 75%, 96%, 100% [27]. Для сушки образцов в критической точке (1.5–2.5 ч) использовали устройство Leica EM CPD300 (Leica microsystems, Германия). Для напыления (Au/Pd; 0.5–1.0 мин) применяли прибор Leica EM ACE200 (Leica microsystems, Германия). Просматривали образцы с помощью сканирующего электронного микроскопа Hitachi SU3500 (Hitachi, Япония) при увеличении от × 500 до × 5000.
Статистический анализ данных. Статистическая обработка данных выполнялась по стандартным программным пакетам “Microsoft Exel 7.0”, “Grapher-9” для персонального компьютера. Значения, указанные на графиках и в таблице, представляют собой среднее трех измерений. Бары на графиках показывают среднеквадратичное отклонение измеряемых величин. Достоверность различий между выборками оценивали по t-критерию Стьюдента, при уровне значимости P < 0.05.
РЕЗУЛЬТАТЫ
Влияние ионов меди Cu2+ и наночастиц меди CuO на рост клеток Dunaliella salina. Данные о количестве клеток, полученные на 3 сут эксперимента, показали, что у Dunaliella salina наблюдалось угнетение роста при высоких концентрациях меди в среде как в ионной форме, так и виде наночастиц (табл. 1). При этом ингибирующее влияние меди было более выражено при выращивании водорослей на обедненной питательной среде. Так, при культивировании водорослей на среде f/4 влияние ионов меди Cu2+ на рост популяции (20% снижение относительно контроля) отмечено только при максимальной исследуемой концентрации 770 мкг/л. В то время как при выращивании на среде f/32 угнетающее влияние Cu2+ на рост водорослей наблюдалось уже при 400 мкг/л, а при 770 мкг/л плотность культуры была примерно в 2.5 раза ниже, чем в контроле. Аналогичная реакция установлена при воздействии наночастиц CuO. При выращивании водорослей на среде f/4 влияние НЧ CuO на рост D. salina наблюдалось при их содержании в среде выше 2000 мкг/л. При максимальной исследуемой концентрации наночастиц 3750 мкг/л отмечено 30% снижение плотности культуры относительно контроля. У D. salina, выращенной на среде f/32, ингибирующее влияние НЧ CuO на рост культуры наблюдалось уже при концентрации 665 мкг/л, при этом количество клеток в популяции было на 25% ниже, чем в контроле. Дальнейшее увеличение концентрации НЧ CuO в среде приводило к линейному снижению плотности культуры. При максимальном исследуемом содержании НЧ CuO 3750 мкг/л количество клеток D. salina составляло всего 7% по отношению к контролю.
Таблица 1.
Влияние меди на рост, внутриклеточное содержание хлорофилла и эффективность работы фотосинтетического аппарата у Dunaliella salina
| Концентрация меди, мкг/л | Кол-во клеток × 104, кл/мл | пг Хл/кл | Fv/Fm | Кол-во клеток × 104, кл/мл | пг Хл/кл | Fv/Fm |
|---|---|---|---|---|---|---|
| питательная среда f/4 | питательная среда f/32 | |||||
| Cu 2+ | ||||||
| 0 | 10.1 ± 0.7 | 4.43 ± 0.35 | 0.67 | 9.4 ± 0.6 | 4.18 ± 0.33 | 0.68 |
| 15 | 11.0 ± 0.8 | 4.49 ± 0.36 | 0.68 | 9.4 ± 0.5 | 3.88 ± 0.31 | 0.69 |
| 150 | 10.8 ± 0.7 | 4.43 ± 0.35 | 0.68 | 9.4 ± 0.6 | 3.50 ± 0.29 | 0.67 |
| 200 | 11.2 ± 0.6 | 4.10 ± 0.30 | 0.68 | 8.6 ± 0.5 | 3.00* ± 0.19 | 0.67 |
| 400 | 11.1 ± 0.5 | 3.80 ± 0.29 | 0.68 | 7.4* ± 0.5 | 2.30* ± 0.22 | 0.65 |
| 580 | 9.7 ± 0.6 | 3.68 ± 0.29 | 0.69 | 5.8* ± 0.4 | 1.97* ± 0.15 | 0.60 |
| 770 | 8.1* ± 0.5 | 3.60 ± 0.28 | 0.68 | 3.7* ± 0.3 | 1.91* ± 0.23 | 0.57 |
| CuO НЧ | ||||||
| 0 | 10.1±0.7 | 4.98 ± 0.39 | 0.67 | 9.4 ± 0.6 | 4.12 ± 0.33 | 0.68 |
| 250 | 11.2 ± 0.8 | 4.49 ± 0.36 | 0.68 | 9.6 ± 0.7 | 4.00 ± 0.32 | 0.68 |
| 665 | 10.7 ± 0.7 | 4.55 ± 0.36 | 0.68 | 7.2* ± 0.5 | 3.88 ± 0.31 | 0.68 |
| 1330 | 10.5 ± 0.7 | 4.49 ± 0.35 | 0.69 | 6.8* ± 0.5 | 3.11* ± 0.25 | 0.68 |
| 2000 | 8.2* ± 0.5 | 4.43 ± 0.35 | 0.68 | 5.0* ± 0.4 | 2.28* ± 0.18 | 0.64 |
| 2500 | 7.2* ± 0.5 | 4.43 ± 0.35 | 0.69 | 4.6* ± 0.3 | 1.97* ± 0.16 | 0.60 |
| 3750 | 7.1* ± 0.5 | 4.06 ± 0.32 | 0.68 | 0.7* ± 0.1 | 1.60* ± 0.21 | 0.41 |
Влияние ионов меди и наночастиц меди на содержание хлорофилла и эффективность работы фотосинтетического аппарата Dunaliella salina. При культивировании D. salina на среде f/4 медь, как в ионной форме, так и в виде наночастиц не оказывала существенного влияния на внутриклеточное содержание хлорофилла. В диапазоне концентраций Cu2+ 0–770 мкг/л содержание хлорофилла в клетках варьировало в пределах 3.6–4.5 пг/кл. При добавлении в среду НЧ CuO в количестве 0–3750 мкг/л содержание пигмента изменялось в пределах 4.0–5.0 пг/кл. Показатель Fv/Fm, характеризующий эффективность работы фотосинтетического аппарата водорослей, не изменялся и был равен 0.67–0.69.
В условиях роста водорослей на обедненной среде повышение концентрации меди приводило к снижению внутриклеточного содержания хлорофилла. Показано, что ионы меди Cu2+ в концентрации 15–200 мкг/л не влияли на содержание пигмента. В то время как при концентрации Cu2+ в среде 400–770 мкг/л наблюдалось уменьшение внутриклеточного содержания хлорофилла примерно в 1.8–2.2 раза по сравнению с контролем, что коррелировало со снижением эффективности работы фотосинтетического аппарата водорослей. При концентрациях Cu2+ 400, 580 и 770 мкг/л показатель Fv/Fm снижался до 0.65, 0.6 и 0.57 соответственно. Негативное влияние НЧ CuO на пигментный аппарат D. salina было отмечено при содержании поллютанта выше 2000 мкг/л. Добавление в среду НЧ в концентрациях 2000 и 3750 мкг/л приводило к уменьшению внутриклеточного содержания хлорофилла в 1.8 и 2.5 раза относительно контроля. При этом эффективность работы фотосинтетического аппарата водорослей в этих условиях снижалась до 0.64 и 0.41 соответственно.
Влияние ионов меди и наночастиц меди на АФК и флуоресценцию FDA Dunaliella salina. На рис. 1 показана динамика изменения продукции активных форм кислорода (АФК) и флуоресценции FDA у Dunaliella salina после добавления в среду ионов Cu2+ и НЧ CuO при культивировании водорослей на средах f/4 и f/32. Флуоресценция DCFH-DA, показывающая продукцию АФК в клетках, имела минимальные значения в диапазоне концентраций ионов меди от 0 до 200 мкг/л. При дальнейшем увеличении концентрации Cu2+ наблюдалось прогрессирующее повышение значений АФК. Максимальные величины данного показателя (120–170) отмечены при концентрации Cu2+ свыше 600 мкг/л для водорослей, выращенных на обедненной среде f/32. В то время как при культивировании на среде f/4 максимальные величины продукции АФК не превышали 110 (рис. 1a). Влияние НЧ CuO на продукцию АФК у микроводорослей имело схожую тенденцию. Повышение концентрации поллютанта в среде приводило к увеличению продукции АФК в клетках, при этом зависимости исследуемого параметра от среды культивирования выявлено не было. Так, в диапазоне концентраций НЧ CuO от 0 до 2500 мкг/л величина флуоресценции DCFH-DA увеличивалась от 40 до 100 по гиперболической зависимости. При максимальной исследуемой концентрации НЧ 3750 мкг/л отмечено резкое повышение продукции АФК до 220.
Рис. 1.
Изменение флуоресценции DCFH-DA (продукция активных форм кислорода) и флуоресценции FDA (ферментативная активность клеток) в зависимости от концентрации ионов меди Cu2+ (а, в) и наночастиц оксида меди в среде (б, г) у Dunaliella salina, выращенной на средах f/4 (1) и f/32 (2).

Показатель флуоресценции FDA, характеризующий уровень метаболической активности клеток, снижался при воздействии на водоросли исследуемых загрязнителей. Показано, что ионы меди в концентрации менее 400 мкг/л практически не влияли на флуоресценцию FDA при выращивании Dunaliella salina на среде f/4, тогда как при культивировании на среде f/32 снижение данного параметра отмечено при концентрации Cu2+ выше 200 мкг/л. С увеличение концентраций НЧ CuO наблюдали прогрессирующее снижение флуоресценции FDA у Dunaliella salina. Так, суммарное падение величины данного показателя на среде f/4 составило порядка 40%, а на обедненной среде f/32 в 4 раза относительно контроля. Низкие значения флуоресценции FDA у Dunaliella salina, выращенной на обедненной среде с добавлением высоких концентраций НЧ CuO (>2000 мкг/л) свидетельствуют о снижении жизнеспособности водорослей и показывают, что такие концентрации поллютанта оказывают летальный или близкий к нему характер на клетки водорослей. При добавлении НЧ CuO в концентрации выше 2000 мкг/л в обедненную по биогенным элементам культуральную среду на цитограммах проточного цитометра была отмечена выраженная гетерогенность (CV 54%) клеток вдоль оси FL1 (флуоресценция FDA). Это показывает, что исследуемая культура представляет собой “популяцию” из клеток различного функционального состояния: малоактивных и небольшого количества (10%) активных клеток Dunaliella salina. Кроме того, при концентрации НЧ CuO выше 2000 мкг/л увеличивалось количество мертвых клеток в культуре (т.е. клеток, которые не окрашивались диацетатом флуоресцеина), достигая 90% при максимальной исследуемой концентрации наночастиц 3750 мкг/л.
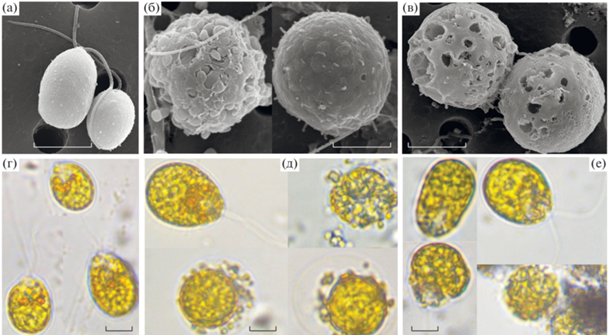
Влияние ионов меди и наночастиц меди на объем клеток Dunaliella salina и их гранулярность. Морфометрические исследования клеток D. salina в нативной пробе (контроль) показали, что культура микроводорослей была представлена большей частью грушевидными (56%), а также шаровидными (44%) формами, снабженными двумя жгутиками одинаковой длины (рис. 2а, г). Средний объем клеток в контроле составлял 389 ± 81 мкм3. При воздействии сублетальной концентрации меди (770 мкг/л) в культуре D. salina наблюдали снижение в 1.5 раза количества грушевидных клеток (до 38%) и, соответственно, увеличение численности шаровидных форм (до 62%). Округление клеток и увеличение линейных размеров, как известно, является реакцией на стрессовые условия [28]. Средний объем клеток, по сравнению с контролем, достоверно увеличивался в 1.7 раза до 678 ± 154 мкм3 (непарный t-тест, P < 0.05). Необходимо отметить, что многие клетки имели разрушенную или сильно деформированную поверхность (рис. 2б), у большой части шаровидных клеток наблюдали ретракцию (втягивание) цитоплазмы, ее отделение от плазмалеммы и выделение липидных капель (рис. 2д). Такой процесс иногда происходит при переходе клеток в состояние цист. При добавлении в среду НЧ CuO (2500 мкг/л) доля грушевидных клеток в культуре D. salina, по сравнению с контролем, еще больше снижалась, в 2 раза (до 29%), а количество шаровидных форм увеличивалось (до 71%). Средний объем клеток, по сравнению с контролем, также достоверно увеличивался в 1.3 раза до 530 ± 87 мкм3 (непарный t-тест, P < 0.05). У многих клеток наблюдалась значительная деформация и перфорация плазмалеммы (рис. 2в), кроме того, обнаруживались клетки неправильной формы и агломерированные с наночастицами (рис. 2е).
Рис. 2.
Микрофотографии Dunaliella salina при различных условиях культивирования на среде f/32. (а) – нативная проба (контроль), (б) – культивирование с добавлением Cu2+ 770 мкг/л; (в) – с добавлением CuO НЧ 2500 мкг/л (по данным СЭМ); (г) – контроль, (д) – культивирование с добавлением Cu2+ 770 мкг/л; (е) – с добавлением CuO НЧ 2500 мкг/л (по данным СМ). Масштабная линейка соответствует 5 мкм.
На рис. 3 представлена динамика изменения гранулярности клеток (боковое светорассеяние SS) через 72 ч выращивания D. salina в заданных в эксперименте условиях. Как видно из графиков, добавление ионов меди в концентрации менее 400 мкг/л не влияло на гранулярность клеток. Повышение концентрации Сu2+ от 400 до 770 мкг/л приводило к увеличению SS клеток на 20 и 35% у водорослей, выращиваемых на средах f/4 и f/32 соответственно. Добавление НЧ CuO в среду в концентрациях 0–3750 мкг/л сопровождалось линейным повышением значений бокового светорассеяния клеток от 75 до 115 при культивировании водорослей на среде f/4, и от 75 до 160 – на среде f/32. Таким образом, максимальные значения SS отмечены у культур, инкубируемых в условиях высоких концентраций ионов меди и наночастиц меди на обедненной по биогенным элементам среде. При этом значения бокового светорассеяния клеток были закономерно выше у водорослей, подверженных влиянию наночастиц, что, вероятно, обусловлено их механическим воздействием, приводящим к ультраструктурным повреждениям клеток водорослей. Подтверждением этому являются изображения, полученные с применением световой и сканирующей электронной микроскопии.
ОБСУЖДЕНИЕ
Обзор современной научной литературы показывает, что ответные реакции микроводорослей различной систематической принадлежности на присутствие в окружающей среде наночастиц металлов, в частности меди, исследованы недостаточно; приводятся противоречивые результаты влияния данного поллютанта на ростовые и функциональные показатели тест-организмов [29]. В большинстве исследований описывается эффект механического воздействия наночастиц на клетки, приводящего к повреждению целостности клеточных оболочек. При этом виды, окруженные только цитоплазматической мембраной (клеточная стенка отсутствует) или ультратонкой клеточной стенкой, более чувствительны к механическому воздействию НЧ, чем виды с плотными клеточными оболочками, выполняющими роль защитного “барьера” [16, 30]. Особенностью Dunaliella salina является отсутствие плотной клеточной оболочки, поэтому клетки характеризуются широкой амплитудой модификационной изменчивости, что и послужило поводом в выборе модельного вида для представленного исследования. Нами отмечено, что наличие у D. salina только цитоплазматической мембраны не делает данный вид водорослей более чувствительным к воздействиям НЧ CuO. В работе [31] у диатомовых водорослей Nitzschia closterium и Skeletonema costatum, культивируемых на среде f/2 и имеющих кремневый панцирь, ингибирование роста наблюдалось при концентрациях НЧ CuO выше 4 и 2 мг/л соответственно, что незначительно выше полученных нами значений у D. salina. Оценивание влияния НЧ металлов Ag и Ce на морфологические и функциональные характеристики D. salina и Chlorella autotrophica в работе [32] показало, что несмотря на отсутствие клеточной стенки, D. salina была более устойчива к действию токсикантов, чем C. аutotrophica с целлюлозной клеточной оболочкой. При этом авторы объясняют устойчивость D. salina биосорбцией или возможностью производить внеклеточные полимерные вещества, способные удалять ионы меди во внешнюю среду. Вероятно, у клеток микроводорослей, имеющих клеточную стенку, повышается чувствительность к загрязнениям в процессе клеточного деления за счет увеличения проницаемости мембран и образования новых пор [32]. Таким образом, ясно, что просто наличие плотной клеточной оболочки, по-видимому, не определяет более высокую устойчивость вида к воздействию токсиканта.
Кроме механического воздействия наночастиц на клетки в литературе имеются данные об их токсическом влиянии на микроводоросли, приводящем к ингибированию фотосинтеза, снижению содержания хлорофилла в клетках, увеличению продукции активных форм кислорода и фотоокислительному стрессу [5, 11, 12, 32, 33]. Авторы объясняют это высвобождением в среду свободных ионов меди Cu2+ [12, 13], а также со способностью НЧ проникать внутрь клетки через поры клеточной стенки [6, 33]. Результаты нашего исследования показали различный механизм действия меди в ионной и наноформе на физиологию водорослей. При этом установлено, что D. salina более чувствительна к действию ионов меди. Так, при культивировании водорослей на среде f/32 замедление роста клеток, снижение флуоресценции FDA, удельного содержания хлорофилла на клетку, эффективности работы фотосинтетического аппарата и индукция синтеза АФК отмечены при концентрации Cu2+ в среде выше 400 мкг/л. Наблюдаемые эффекты обусловлены ингибирующим цитотоксичным влиянием ионов меди на клетки D. salina. Тогда как негативное действие наночастиц CuO отмечено при содержании поллютанта в среде выше 700 мкг/л и в большей степени было обусловлено механическим воздействием на поверхность клеточной стенки, что приводило к появлению разрушенных и деформированных клеток в культуре. Однако при воздействии наночастиц отмечены максимальные показатели продукции активных форм кислорода в клетках, значения которых превышали таковые в контроле уже при минимальных концентрациях CuO НЧ в среде. Мы не можем объяснить причины этого эффекта. Однако основываясь на результатах исследований других авторов [34, 35], можем предположить, что увеличение внутриклеточного уровня АФК у микроводорослей может быть спровоцировано интернализацией наночастиц внутрь клеток.
Отдельное внимание стоит уделить механизмам действия ионов меди и наночастиц оксида меди на морфологию клеток водорослей. Медь в различных ее формах приводила к увеличению объемов клеток D. salina, изменению их формы и гранулярности, при этом сигнал SS, характеризующий гранулярность клеток, был значительно выше у D. salina, подвергшейся влиянию наночастиц. Аналогичные результаты были получены с другими видами водорослей [11, 12]. В работе [34] при добавлении в культуральную среду 5 мг/л НЧ TiO2 у Nitzschia closterium обнаружено значительное повышение интенсивности бокового рассеяния (SS) по сравнению с контролем. Авторы предполагают, что такое выраженное увеличение интенсивности SS может указывать на поглощение/интернализацию НЧ TiO2 водорослями. Изображения клеток D. salina, полученные нами с применением световой и сканирующей электронной микроскопии, позволили установить, что повышение значений SS является следствием значительной деформации и перфорации плазмалеммы, а также адсорбции отдельных наночастиц на поверхности клеток.
Наиболее неоднозначным на сегодняшний день остается вопрос количественной оценки влияния наночастиц на структурно-функциональные характеристики водорослей. Имеющиеся в литературе данные о стимулирующих, ингибирующих, сублетальных и летальных концентрациях НЧ весьма разрознены даже для одного вида водорослей. Причина этого, вероятно, в том, что степень влияния НЧ может зависеть от многих факторов, в частности, от исходной плотности культуры [36] или химического состава воды, используемой для культивирования водорослей [37]. Нами показано, что воздействие меди, как в виде наночастиц, так и в ионной форме было более выражено для водорослей, выращенных на обедненной среде f/32. При максимальных исследуемых значениях меди наблюдалось выраженное ингибирование роста водорослей, снижение Fv/Fm до значений 0.4–0.5, падение показателя флуоресценции FDA более чем в 3 раза относительно контроля, повышение АФК. Мы полагаем, что наблюдаемый эффект обусловлен наличием в питательной среде хелатора ЭДТА, способного связывать растворенные в воде ионы металлов в хелатные комплексы, тем самым уменьшая их активность и токсическое действие и повышая биодоступность для водорослей. Согласно прописи, исходное содержание ЭДТА в питательной среде f/32 в 6 раза ниже, чем в f/4, соответственно, и концентрация меди в свободной форме в ней будет гораздо выше. Например, в работе [38] показано, что ингибирование роста диатомовой водоросли Phaeodactylum tricomutum наблюдалось при добавлении 2 мкМ меди в культуральную среду без ЭДТА, тогда как в среде с ЭДТА медь не оказывала токсического воздействия на данный вид водоросли при концентрациях до 5 мкМ. Аналогичные результаты показаны в ряде других работ [39, 40] Таким образом, при анализе токсичности меди необходимо учитывать химический состав анализируемой суспензии.
ЗАКЛЮЧЕНИЕ
По результатам экспериментального исследования установлены основные закономерности изменения морфологических, структурно-функциональных, флуоресцентных и цитометрических показателей Dunaliella salina при добавлении в среду наночастиц CuO и ионов меди разной концентрации при культивировании водорослей на питательной среде f/4 и f/32. Отмечено, что действие меди на клетки было менее выражено для водорослей, выращенных на среде f/4, что обусловлено высоким содержанием в ней хелатирующего агента ЭДТА, способного связывать растворенные в воде ионы металлов в хелатные комплексы, тем самым уменьшая их активность и токсическое действие на клетки и повышая биодоступность для водорослей. Показан различный механизм действия меди в ионной и наноформе на физиологию водорослей. Установлено, что медь в ионной форме оказывает цитотоксичное влияние на клетки Dunaliella salina, в то время как наночастицы CuO в большей мере механически воздействуют на поверхность клеточной стенки, что приводит к появлению разрушенных и деформированных клеток в культуре. При этом Dunaliella salina более чувствительна к действию ионов меди. При культивировании водорослей на среде f/32 замедление роста клеток, снижение флуоресценции FDA, удельного содержание хлорофилла на клетку, эффективности работы фотосинтетического аппарата и индукция синтеза АФК наблюдались при концентрации Cu2+ в среде выше 400 мкг/л. Тогда как негативное действие CuO НЧ отмечено при содержании поллютанта выше 700 мкг/л и в большей степени сказывалось на морфологических изменениях клеток. В частности, установлено двукратное укрупнение клеток по сравнению с контролем, уменьшение количества клеток грушевидной формы (в контроле 60%), увеличение количества шаровидных форм (до 71%), значительная деформация и перфорация плазмалеммы, преобладание деформированных клеток неправильной формы и агломерированных с наночастицами. Кроме того, отмечено повышение продукции активных форм кислорода в клетках Dunaliella salina уже при минимальных концентрациях CuO НЧ в среде, что, вероятно, обусловлено интернализацией наночастиц внутрь клеток.
По результатам работы показано, что, несмотря на выраженное ингибирующее влияние меди, как в ионной, так и в наноформе, максимальные исследуемые концентрации токсикантов не приводили к полной элиминации популяции, что, вероятно, обусловлено присутствием в культуре клеток, резистентных к воздействию меди (порядка 10–15% по данным FDA-окрашивания), и способных обеспечить выживаемость и последующее восстановление популяции Dunaliella salina при высоком уровне антропогенного загрязнения среды.
Авторы выражают глубокую признательность сотруднику отдела экологической физиологии водорослей Федерального исследовательского центра “Института биологии южных морей им. А.О. Ковалевского РАН” Алатарцевой О.С. за предоставленную культуру Dunaliella salina и начальнику лаборатории микроскопии Лишаеву В. Н. за помощь в работе с электронным микроскопом.
Работа выполнена в рамках тем государственного задания Федерального исследовательского центра “Института биологии южных морей им. А.О. Ковалевского РАН” № 121041400077-1 “Функциональные, метаболические и токсикологические аспекты существования гидробионтов и их популяций в биотопах с различным физико-химическим режимом” и № 121030300149-0 “Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса”.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Shi M., Kwon H.S., Peng Z., Elder A., Yang H. Effects of surface chemistry on the generation of reactive oxygen species by copper nanoparticles // ACS Nano. 2012. V. 6. P. 2157. https://doi.org/10.1021/nn300445d
Ingle A.P., Duran N., Rai M. Bioactivity, mechanism of action, and cytotoxicity of copper-based nanoparticles: a review // Appl. Microbiol. Biotechnol. 2014. V. 98. P. 1000. https://doi.org/10.1007/s00253-013-5422-8
Bondarenko O., Ivask A., Kakinen A., Kahru A. Sub-toxic effects of CuO nanoparticles on bacteria: Kinetics, role of Cu ions and possible mechanisms of action // Environ. Pollut. 2012. V. 169. P. 81. https://doi.org/10.1016/j.envpol.2012.05.009
von Moos N., Maillard L., Slaveykova V.I. Dynamics of sub-lethal effects of nano-CuO on the microalga Chlamydomonas reinhardtii during short-term exposure // Aquat. Toxicol. 2015. V. 161. P. 267. https://doi.org/10.1016/j.aquatox.2015.02.010
Wang L., Huang X., Sun W., Too H.Z., Laserna A.K.C., Li S.F.Y. A global metabolomic insight into the oxidative stress and membrane damage of copper oxide nanoparticles and microparticles on microalga Chlorella vulgaris // Environ. Pollut. 2020. V. 258. P. 113647. https://doi.org/10.1016/j.envpol.2019.113647
Navarro E., Baun A., Behra R., Hartmann N.B., Filser J., Miao A.J., Quigg A., Peter H. Sigg L. Environmental behavior and ecotoxicity of engineered nanoparticles to algae, plants, and fungi // Ecotoxicology. 2008. V. 17. P. 372. https://doi.org/10.1007/s10646-008-0214-0
Navarro E., Piccapietra F., Wagner B., Marconi F., Kaegi R., Odzak N., Sigg L., Behra R. Toxicity of silver nanoparticles to Chlamydomonas reinhardtii // Environ. Sci. Technol. 2008. V. 42. P. 8959. https://doi.org/10.1021/es801785m
Rohder L.A., Brandt T., Sigg L., Behra R. Influence of agglomeration of cerium oxide nanoparticles and speciation of cerium (III) on short term effects to the green algae Chlamydomonas reinhardtii // Aquat. Toxicol. 2014. V. 152. P. 121. https://doi.org/10.1016/j.aquatox.2014.03.027
Sendra M., Yeste M.P., Gatica J.M., Moreno-Garrido I., Blasco J. Homoagglomeration and heteroagglomeration of TiO2, in nanoparticle and bulk form, onto freshwater and marine microalgae // Sci. Total Environ. 2017. V. 592. P. 403. https://doi.org/10.1016/j.scitotenv.2017.03.127
Deniel M., Errien N., Daniel P., Caruso A., Lagarde F. Current methods to monitor microalgae-nanoparticle interaction and associated effects // Aquat. Toxicol. 2019. V. 217. P. 105311. https://doi.org/10.1016/j.aquatox.2019.105311
Oukarroum A., Halimi I., Siaj M. Cellular Responses of Chlorococcum Sp. algae exposed to zinc oxide nanoparticles by using flow cytometry // Water Air Soil Pollut. 2019. V. 230. P. 1. https://doi.org/10.1007/s11270-018-4051-3
Saison C., Perreault F., Daigle J.C., Fortin C., Claverie J., Morin M., Popovic R. Effect of core-shell copper oxide nanoparticles on cell culture morphology and photosynthesis (photosystem II energy distribution) in the green alga, Chlamydomonas reinhardtii // Aquat. Toxicol. 2010. V. 96. P. 109. https://doi.org/10.1016/j.aquatox.2009.10.002
Wang Y., Zhu X., Lao Y., Lv X., Tao Y., Huang B., Wang J., Zhou J., Cai Z. TiO2 nanoparticles in the marine environment: physical effects responsible for the toxicity on algae Phaeodactylum tricornutum // Sci. Total. Environ. 2016. V. 565. P. 818. https://doi.org/10.1016/j.scitotenv.2016.03.164
Geneviere A.M., Derelle E., Escande M.L., Grimsley N., Klopp C., Menager C., Vichel A., Moreau H. Responses to iron oxide and zinc oxide nanoparticles in echinoderm embryos and microalgae: uptake, growth, morphology, and transcriptomic analysis // Nanotoxicology. 2020. V. 14. P. 1342. https://doi.org/10.1080/17435390.2020.1827074
Lee W.M., An Y.J. Effects of zinc oxide and titanium dioxide nanoparticles on green algae under visible, UVA, and UVB irradiations: no evidence of enhanced algal toxicity under UV pre-irradiation // Chemosphere. 2013. V. 91. P. 536. https://doi.org/10.1016/j.chemosphere.2012.12.033
Macfie S.M., Tarmohamed Y., Welbourn P.M. Effects of cadmium, cobalt, copper, and nickel on growth of the green alga Chlamydomonas reinhardtii: the influences of the cell wall and pH // Arch. Environ. Contam. Toxicol. 1994. V. 27. P. 454. https://doi.org/10.1007/BF00214835
Oukarroum A., Bras S., Perreault F., Popovic R. Inhibitory effects of silver nanoparticles in two green algae, Chlorella vulgaris and Dunaliella tertiolecta // Ecotoxicol. Environ. Saf. 2012. V. 78. P. 80. https://doi.org/10.1016/j.ecoenv.2011.11.012
Sendra M., Moreno-Garrido I., Blasco J., Araujo C.V. Effect of erythromycin and modulating effect of CeO2 NPs on the toxicity exerted by the antibiotic on the microalgae Chlamydomonas reinhardtii and Phaeodactylum tricornutum // Environ. Pollut. 2018. V. 242. P. 357. https://doi.org/10.1016/j.envpol.2018.07.009
Guillard R., Ryther J. Studies of marine planktonic diatoms: I. Cyclotella Nana Hustedt, and Detonula Confervacea (CLEVE) Gran // J. Can. Microbiol. 1962. V. 8. P. 229. https://doi.org/10.1139/m62-029
Соломонова Е., Муханов В. Оценка доли физиологически активных клеток в накопительных культурах Phaeodactylum tricornutum и Nitzschia sp. с помощью проточной цитометрии // Морской экологический журнал. 2011. Т. 10. С. 67.
Dorsey J., Yentsch C.M., Mayo S., McKenna C. Rapid analytical technique for the assessment of cell metabolic activity in marine microalgae // Cytometry Part A. 1989. V. 10. P. 622. https://doi.org/10.1002/cyto.990100518
Jochem F. Dark survival strategies in marine phytoplankton assessed by cytometric measurement of metabolic activity with fluorescin diacetate // Mar. Biol. 1999. V. 135. P. 721. https://doi.org/10.1007/s002270050673
Wang H., Joseph J.A. Quantifying cellular oxidative stress by dichlorofluorescein assay using microplate reader // Free Radical Biol. Med. 1999. V. 27. P. 612. https://doi.org/10.1016/S0891-5849(99)00107-0
Jeffrey R.F.C., Mantoura S.W. Phytoplankton Pigments in Oceanography: Guidelines to Modern Methods // Monographson oceanographic methodology / Eds. S.W. Wright et al. Paris: UNESCO Publishing, 1997. P. 661.
Маторин Д.Н., Осипов В.А., Яковлева О.В., Погосян С.И. Определение состояния растений и водорослей по флуоресценции хлорофилла: учеб.-метод. пособие. Москва: Макс Пресс. 2010. 116 с.
Брянцева Ю.В., Лях А.М., Сергеева А.В. Расчет объемов и площадей поверхности одноклеточных водорослей Черного моря. Севастополь: НАН Украины Институт биологии южных морей. 2005. 25 с.
Murtey M.D., Ramasamy P. Sample preparations for scanning electron microscopy – life sciences // Modern electron microscopy in physical and life sciences. 2016. P. 161.
Антоненко С.П., Догадина Т.В., Комаристая В.П. Изменчивость морфометрических признаков Dunaliella salina в условиях культуры // Экология моря. 2010. Т. 81. С. 5.
Bondarenko O., Juganson K., Ivask A., Kasemets K., Mortimer M., Kahru A. Toxicity of Ag, CuO and ZnO nanoparticles to selected environmentally relevant test organisms and mammalian cells in vitro: A critical review // Arch. Toxicol. 2013. C. 87. P. 1181. https://doi.org/10.1007/s00204-013-1079-4
Piccapietra F., Allue C.G., Sigg L., Behra R. Intracellular silver accumulation in Chlamydomonas reinhardtii upon exposure to carbonate coated silver nanoparticles and silver nitrate // Environ. Sci. Technol. 2012. V. 46. P. 7390. https://doi.org/10.1021/es300734m
Huang W., Zhou Y., Zhao T., Tan L., Wang J. The effects of copper ions and copper nanomaterials on the output of amino acids from marine microalgae // Environ. Sci. Pollut. Res. 2022. V. 29. P. 9780. https://doi.org/10.1007/s11356-021-16347-3
Sendra M., Blasco J., Araujo C.V.M. Is the cell wall of marine phytoplankton a protective barrier or a nanoparticle interaction site? Toxicological responses of Chlorella autotrophica and Dunaliella salina to Ag and CeO2 nanoparticles // Ecol. Indic. 2018. V. 95. P. 1053. https://doi.org/10.1016/j.ecolind.2017.08.050
Chen F., Xiao Z., Yue L., Wang J., Feng Y., Zhu X., Wang Z., Xing B. Algae response to engineered nanoparticles: current understanding, mechanisms and implications // Environ. Sci.: Nano. 2019. V. 6. P. 1026 https://doi.org/10.1039/C8EN01368C
Xia B., Chen B., Sun X., Qu K., Ma F., Du M. Interaction of TiO2 nanoparticles with the marine microalga Nitzschia closterium: growth inhibition, oxidative stress and internalization // Sci. Total Environ. 2015. V. 508. P. 525. https://doi.org/10.1016/j.scitotenv.2014.11.066
Liang S.X.T., Wong L.S., Dhanapal A.C.T.A., Djearamane S. Toxicity of metals and metallic nanoparticles on nutritional properties of microalgae // Water, Air, Soil Pollut. 2020. V. 231. P. 1. https://doi.org/10.1007/s11270-020-4413-5
Johnson D.J., Sanderson H., Brain R.A., Wilson C.J., Solomon K.R. Toxicity and hazard of selective serotonin reuptake inhibitor antidepressants fluoxetine, fluvoxamine, and sertraline to algae // Ecotoxicol. Environ. Saf. 2007. V. 67. P. 128. https://doi.org/10.1016/j.ecoenv.2006.03.016
Daglıoglu Y., Yılmaz Ozturk B. Effect of concentration and exposure time of ZnO-TiO2 nanocomposite on photosynthetic pigment contents, ROS production ability, and bioaccumulation of freshwater algae (Desmodesmus multivariabilis) // Caryologia. 2018. V. 71. P. 13. https://doi.org/10.1080/00087114.2017.1400262
Spencer C.P. Utilization of trace elements by marine unicellular algae // Microbiology. 1957. V. 16. P. 282. https://doi.org/10.1099/00221287-16-1-282
De Schamphelaere K.A.C., Nys C., Janssen C.R. Toxicity of lead (Pb) to freshwater green algae: development and validation of a bioavailability model and inter-species sensitivity comparison // Aquat. Toxic. 2014. V. 155. P 348. https://doi.org/10.1016/j.aquatox.2014.07.008
Pascual G., Sano D., Sakamaki T., Nishimura O. Effects of chemical interaction of nutrients and EDTA on metals toxicity to Pseudokirckneriella subcapitata // Ecotoxicol. Environ. Saf. 2020. V. 203. P. 110966. https://doi.org/10.1016/j.ecoenv.2020.110966
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений



