Физиология растений, 2023, T. 70, № 3, стр. 251-258
Влияние предпосевной обработки семян салициловой кислотой на рост и фотосинтетический аппарат ячменя при разном содержании цинка в субстрате
А. А. Игнатенко a, *, Ю. В. Батова a, Е. С. Холопцева a, Н. М. Казнина a
a Институт биологии – обособленное подразделение Федерального государственного бюджетного
учреждения науки Федерального исследовательского центра “Карельский научный центр
Российской академии наук”,
Петрозаводск, Россия
* E-mail: angelina911@ya.ru
Поступила в редакцию 03.11.2022
После доработки 09.11.2022
Принята к публикации 09.11.2022
- EDN: ICABQM
- DOI: 10.31857/S001533032370001X
Аннотация
В условиях вегетационного опыта изучали влияние предпосевной обработки семян салициловой кислотой (СК) на параметры роста и фотосинтетического аппарата (ФСА) растений ячменя (Hordeum vulgare L.), находящихся в оптимальных условиях минерального питания или при недостатке цинка в корнеобитаемой среде. Показано, что недостаток цинка не оказывает негативного влияния на ФСА, но вызывает торможение роста растений. Предпосевная обработка семян СК (10 мкМ) оказывала стимулирующее действие на интенсивность фотосинтеза и устьичную проводимость, что обеспечивало успешный рост растений в условиях недостатка цинка. При этом у растений, выращенных из обработанных СК семян, содержание цинка в корнях и побегах оказалось выше, чем у растений, чьи семена не были обработаны. На основании полученных результатов сделан вывод о возможности и перспективности применения предпосевной обработки семян СК для выращивания растений ячменя в условиях недостатка цинка в корнеобитаемой среде.
ВВЕДЕНИЕ
В настоящее время около 50% территорий в мире, используемых для выращивания зерновых культур, характеризуются низким уровнем цинка в почве или низкой его доступностью для растений [1]. В России площади почв с низким и средним содержанием цинка составляют около 98% [2]. Вместе с тем, цинк является одним из наиболее важных микроэлементов для растений. Он служит кофактором целого ряда ферментов, участвующих в различных биохимических процессах, входит в структуру домена “цинковые пальцы”, которая имеется у многих транскрипционных факторов, а также выполняет целый ряд других функций в растительной клетке [3–6]. Известно, что дефицит цинка вызывает у растений замедление делении и растяжения клеток, нарушение структуры и функционирования мембран, ингибирование синтеза белка, замедление скорости фотосинтеза, торможение транспорта воды и минеральных веществ, нарушение гормонального баланса. Все это, в конечном итоге, приводит к значительному снижению продуктивности растений [3, 4, 6], в связи с чем поиск возможных путей повышения устойчивости растений к дефициту данного микроэлемента является весьма актуальной задачей.
Одним из возможных способов решения упомянутой задачи является применение экзогенных регуляторов роста растений, которые характеризуются многофункциональностью своего действия, экологической безопасностью и низкими нормами расхода [7]. К одному из хорошо изученных в этом плане регуляторов роста относится соединение фенольной природы – салициловая кислота (СК). В растениях СК синтезируется из шикимовой кислоты и участвует в регуляции многих физиологических процессов, включая рост и развитие, фотосинтез, транспирацию, транспорт органических веществ и др. [8–10]. Помимо этого показано, что применение экзогенной СК способствует повышению устойчивости растений к различным абиотическим стрессорам [8, 11–14], в том числе к недостатку элементов минерального питания, что, например, было обнаружено в отношении фосфора [15], кальция [16] и железа [17, 18]. При этом защитную роль СК связывают с ее положительным влиянием на поглощение и баланс элементов минерального питания в растительном организме [19–21]. Следовательно, можно предположить, что СК будет способствовать повышению устойчивости растений и к дефициту цинка, однако экспериментальных данных, подтверждающих это, практически нет.
Цель работы – оценка влияния предпосевной обработки семян СК на устойчивость растений ячменя в условиях недостатка цинка в субстрате на основании изучения ряда показателей роста и фотосинтетического аппарата.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использовали растения ярового ячменя (Hordeum vulgare L.) сорта Нур. Для выбора оптимальной концентрации СК был проведен предварительный опыт, в ходе которого семена ячменя замачивали на 24 ч в растворе СК с концентрацией 1, 10, 100, 300, 500 или 700 мкМ. Затем семена отмывали от СК, переносили в чашки Петри с дистиллированной водой и выдерживали в темноте при температуре 22°С 6 сут. В качестве контроля использовали растения, которые на протяжении всего опыта инкубировали в дистиллированной воде. Определяли энергию прорастания и всхожесть семян, а также анализировали влияние СК на начальный рост проростков. Для изучения биометрических показателей использовали корни растений, поскольку они более чувствительны к обработке экзогенными соединениями, включая фитогормоны. Концентрация СК, оказывающая наибольший стимулирующий эффект на изученные показатели, была использована для дальнейших исследований.
Для исследования влияния обработки семян СК на рост и фотосинтетический аппарат (ФСА) у растений ячменя, часть семян предварительно подвергалась обработке СК (24 ч на растворе с 10 мкМ СК; вариант опыта “СК”), часть оставалась необработанной (24 ч на дистиллированной воде; вариант опыта “без СК”). Проклюнувшиеся семена высаживали в сосуды с отмытым от примесей и прокаленным песком. Плотность посева составляла 12 растений на сосуд. Опыт проводили в вегетационных условиях. При этом часть растений на протяжении всего эксперимента поливали питательным раствором Хогланда-Арнона с оптимальной концентрацией цинка (2 мкМ) (Zn+ (контроль)), тогда как другую часть – питательным раствором без добавления соли цинка (Zn- (опыт)).
Анализ растений проводили спустя 30 сут. после посева. Эффект предобработки семян СК оценивали по изменению показателей роста (длина корня, высота побега, их сырая и сухая биомасса, длина и площадь четвертого листа) и ФСА (содержание фотосинтетических пигментов, потенциальная эффективность квантового выхода ФС II (Fv/Fm), устьичная проводимость, интенсивность фотосинтеза и транспирации). Определяли оводненность тканей побега, а также содержание цинка в корнях и побегах растений.
Энергию прорастания и всхожесть семян определяли на третьи и седьмые сутки, соответственно, согласно ГОСТ 12038-84 [22].
Площадь (см2) листа определяли по формуле S = 2/3 × l × d, где l – длина листовой пластинки, d – ширина листовой пластинки [23].
Для оценки накопления сырой и сухой биомассы растений их извлекали из песка, корни отделяли от побегов и очищали от частиц песка. Надземные и подземные органы растений взвешивали на весах сразу после отбора (сырая биомасса) и после высушивания при 105°С до постоянного веса (сухая биомасса).
Суммарное содержание хлорофиллов оценивали с помощью измерителя уровня хлорофилла SPAD 502 Plus (“Konica Minolta”, Япония) и выражали в условных единицах SPAD. Потенциальный квантовый выход фотохимической активности ФС II (Fv/Fm) измеряли после 20-мин. темновой адаптации листьев с использованием анализатора фотосинтеза с импульсно-модулированным освещением MINI-PAM (“Walz”, Германия).
Интенсивность фотосинтеза, транспирации и устьичную проводимость измеряли с использованием портативной системы для исследования СО2-газообмена и водяных паров HСM-1000 (“Walz”, Германия), соединенной с листовой камерой в контролируемых условиях освещенности, температуры и влажности воздуха.
Оводненность тканей корня и побега рассчитывали по формуле: оводненность = [(сырая масса – сухая масса)/сырая масса] × 100%.
Содержание цинка в корнях и побегах растений определяли ICP-MS методом с использованием масс-спектрометра с индуцированной плазмой (“Thermo Fisher Scientific”, Германия) по стандартной методике [24]. Представленные в таблице 4 значения являются результатом анализа смешанной пробы (n = 12).
Измерения параметров ФСА проводили на четвертом от основания побега листе – самом молодом из полностью закончивших рост.
Статистический анализ. При изучении морфометрических показателей анализировали по 12 растений каждого варианта. Биологическая повторность для физиологических параметров была 5-кратной. На рисунках и в таблицах приведены средние величины и их стандартные ошибки. Статистическую обработку данных осуществляли с использованием пакета статистического анализа в Microsoft Office Excel 2007 и PAST 4.0. Статистически значимо различающиеся величины каждого показателя (при Р < 0.05) на рисунках и в таблицах обозначены разными латинскими буквами.
РЕЗУЛЬТАТЫ
Влияние разных концентраций СК на энергию прорастания, всхожесть семян и начальный рост корня растений ячменя
В предварительных опытах было исследовано влияние суточной обработки СК в разных концентрациях (в диапазоне от 1 до 700 мкМ) на энергию прорастания и всхожесть семян ячменя, а также на начальный рост проростков. Установлено, что обработка семян СК в концентрациях 1, 10, 100 и 300 мкМ не оказывает влияния на энергию прорастания и всхожесть семян, тогда как повышение концентрации СК до 500 и 700 мкМ приводит к снижению этих показателей по отношению к контролю (табл. 1).
Таблица 1.
Влияние разных концентраций СК на энергию прорастания, всхожесть семян, длину корня и его сухую биомассу у растений ячменя сорта Нур
| Концентрация СК, мкМ | Энергия прорастания, % | Всхожесть семян, % | Длина корня, см | Биомасса корня на 7 сут., мг | |
|---|---|---|---|---|---|
| 3 сут. | 7 сут. | ||||
| 0 (контроль) | 84 ± 2.19ab | 83 ± 3.21ab | 6.42 ± 0.08b | 12.83 ± 0.21bc | 6.22 ± 0.29bc |
| 1 | 83 ± 1.00ab | 82 ± 0.88b | 6.59 ± 0.08ab | 13.36 ± 0.20ab | 6.94 ± 0.23ab |
| 10 | 84 ± 1.53ab | 84 ± 0.58ab | 6.74 ± 0.07a | 13.68 ± 0.26a | 7.12 ± 0.23a |
| 100 | 87 ± 3.61a | 89 ± 1.00a | 6.46 ± 0.07b | 13.69 ± 0.23a | 6.88 ± 0.35ab |
| 300 | 83 ± 1.86ab | 80 ± 2.08bc | 6.11 ± 0.07c | 12.43 ± 0.24c | 5.83 ± 0.28c |
| 500 | 77 ± 4.58bc | 74 ± 5.36cd | 5.61 ± 0.07d | 11.55 ± 0.28d | 4.92 ± 0.32d |
| 700 | 71 ± 4.70c | 68 ± 5.84d | 4.69 ± 0.06e | 11.64 ± 0.22d | 4.89 ± 0.28d |
Обнаружено также, что СК в низких концентрациях либо не влияет на рост корня (1 мкМ), либо оказывает стимулирующее действие на изученные ростовые показатели (10 и 100 мкМ), тогда как при использовании ее высоких концентраций (300, 500 и 700 мкМ) рост подземной части растений тормозится (табл. 1). Сравнение двух стимулирующих концентраций выявило более ранний (на третьи сутки) и более ярко выраженный эффект от применения СК в концентрации 10 мкМ. На основании полученных результатов для дальнейших исследований использовалась концентрация СК 10 мкМ.
Влияние обработки семян СК (10 мкМ) на рост и ФСА растений ячменя
Проведенные исследования позволили установить, что недостаток цинка в субстрате не оказывает негативного влияния на рост корней растений, семена которых перед посевом не были обработаны СК (вариант “без СК”). Так, в частности, у опытных растений (Zn-) длина корня и его сырая и сухая биомассы не снижались по отношению к контролю (Zn+). При этом показатели роста побега (высота, сырая и сухая биомассы побега) в этих условиях заметно уменьшались (табл. 2). Растения, выращенные из обработанных СК семян (вариант “СК”), оказались более устойчивыми к недостатку цинка, о чем свидетельствует отсутствие уменьшения (по сравнению с оптимальным содержанием цинка) показателей роста корня и побега.
Таблица 2.
Влияние предпосевной обработки семян СК (10 мкМ) на рост растений ячменя сорта Нур
| Показатель | Вариант | |||
|---|---|---|---|---|
| без СК | СК | |||
| Zn+ (контроль) | Zn- (опыт) | Zn+ (контроль) | Zn- (опыт) | |
| Длина корня, см | 10.13 ± 0.49c | 14.44 ± 0.69a | 9.40 ± 0.55c | 11.82 ± 0.56b |
| Сырая биомасса корней, мг | 476.92 ± 42.34b | 638.10 ± 61.33a | 584.25 ± 50.19ab | 694.75 ± 75.27a |
| Сухая биомасса корней, мг | 65.66 ± 7.59b | 83.84 ± 11.54ab | 85.34 ± 8.26ab | 99.32 ± 11.85a |
| Высота побега, см | 31.86 ± 0.88a | 29.04 ± 0.95b | 31.54 ± 0.58a | 31.70 ± 0.66a |
| Сырая биомасса побега, мг | 1131.12 ± 80.27a | 853.95 ± 71.23b | 1175.49 ± 85.23a | 1137.64 ± 93.98a |
| Сухая биомасса побега, мг | 191.86 ± 14.99ab | 148.11 ± 14.06b | 192.16 ± 13.31a | 196.19 ± 15.41a |
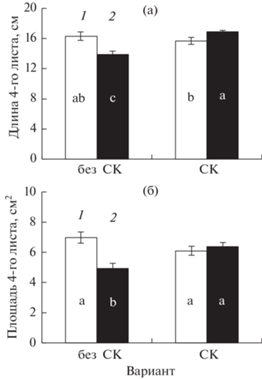
Помимо замедления линейного роста побега, у растений в варианте “без СК” при недостатке цинка в корнеобитаемой среде было отмечено уменьшение (по сравнению с оптимальным уровнем металла) длины и площади листовой пластинки четвертого (самого молодого из полностью развернувшихся) листа (рис. 1). В отличие от этого, у растений варианта “СК” в условиях дефицита металла значимого снижения этих показателей не наблюдалось (рис. 1). Более того, длина листа у опытных растений (Zn-) была даже несколько больше, чем у контрольных (Zn+).
Рис. 1.
Влияние предпосевной обработки семян СК (10 мкМ) на длину (а) и площадь (б) четвертого листа у растений ячменя сорта Нур. Варианты: 1 – Zn+ (контроль); 2 – Zn- (опыт); без СК – семена не были обработаны СК; СК – семена были обработаны СК.
Отрицательного влияния недостатка цинка в субстрате на содержание хлорофиллов не наблюдалось ни в одном из вариантов опыта (табл. 3). Не было различий между вариантами и в величине показателя Fv/Fm, характеризующего квантовую эффективность фотосинтеза, что свидетельствует об отсутствии изменений в ФС II (табл. 3).
Таблица 3.
Влияние предпосевной обработки семян СК (10 мкМ) на содержание хлорофиллов и потенциальный квантовый выход ФС II (Fv/Fm) у растений ячменя сорта Нур
| Показатель | Вариант | |||
|---|---|---|---|---|
| без СК | СК | |||
| Zn+ (контроль) | Zn- (опыт) | Zn+ (контроль) | Zn- (опыт) | |
| Содержание хлорофиллов, у.е. SPAD | 42.62 ± 0.86a | 42.53 ± 1.00a | 43.61 ± 0.81a | 42.73 ± 0.69a |
| Fv/Fm | 0.822 ± 0.002a | 0.819 ± 0.002ab | 0.819 ± 0.002ab | 0.811 ± 0.004b |
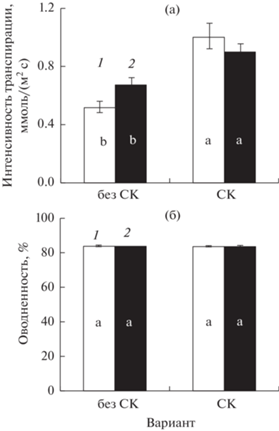
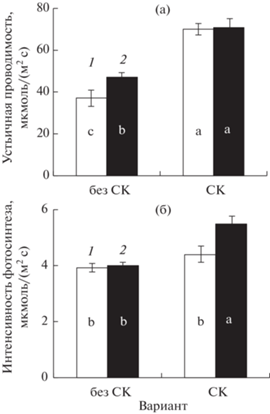
Известно, что скорость фотосинтеза у растений в стрессовых условиях во многом зависит от степени открытия устьичной щели. В наших опытах при недостатке цинка в субстрате у растений, чьи семена не были обработаны СК, устьичная проводимость возрастала (по сравнению с контролем) (рис. 2а), при этом скорость фотосинтеза сохранялась на уровне контроля (рис. 2б). В варианте с предобработкой семян СК устьичная проводимость оказалась гораздо выше, чем в варианте “без СК”, причем как в оптимальных условиях минерального питания, так и при недостатке цинка (рис. 2а). При этом у опытных растений (Zn-) наблюдалось и некоторое увеличение скорости фотосинтеза (рис. 2б).
Таблица 4.
Влияние предпосевной обработки семян СК (10 мкМ) на содержание цинка (ppm) в корнях и побегах ячменя сорта Нур
| Вариант | Корень | Побег | ||
|---|---|---|---|---|
| Zn+ (контроль) | Zn- (опыт) | Zn+ (контроль) | Zn- (опыт) | |
| Без СК | 49.39 ± 7.13 | 28.05 ± 5.66 | 31.61 ± 4.82 | 17.09 ± 2.83 |
| СК | 126.67 ± 17.10 | 66.55 ± 9.36 | 95.15 ± 13.18 | 33.36 ± 6.35 |
Рис. 2.
Влияние предпосевной обработки семян СК (10 мкМ) на устьичную проводимость (а) и интенсивность фотосинтеза (б) у растений ячменя сорта Нур. Варианты: 1 – Zn+ (контроль); 2 – Zn- (опыт); без СК – семена не были обработаны СК; СК – семена были обработаны СК.
Ярко выраженного изменения интенсивности транспирации при недостатке цинка в корнеобитаемой среде по сравнению с его оптимальным содержанием в субстрате выявлено не было (рис. 3а). Однако у растений, чьи семена были обработаны СК, скорость этого процесса оказалась гораздо выше, чем у необработанных растений, причем как в стрессовых, так и в оптимальных условиях. Изменения оводненности тканей побега при этом не наблюдалось (рис. 3б).
Влияние обработки семян СК (10 мкМ) на содержание цинка в органах растений ячменя
Химический анализ показал, что при недостатке цинка в субстрате содержание цинка в корнях и побегах растений ячменя заметно снижается (табл. 4). Обработка семян СК способствовала увеличению содержания металла в органах как в контрольном (Zn+), так и в опытном варианте (Zn-). В частности, содержание цинка в корнях и побегах растений варианта “СК” в оптимальных условиях минерального питания оказалось более, чем 2.5 и 3 раза выше, соответственно, чем у растений варианта “без СК”, а при недостатке цинка в корнеобитаемой среде – в 2.4 и 1.9 раза выше, соответственно (табл. 4).
ОБСУЖДЕНИЕ
В настоящее время регуляторы роста природного и синтетического происхождения широко используются для повышения стрессоустойчивости и продуктивности растений [11, 25, 26]. При этом показано, что их эффективность зависит от целого ряда факторов, в том числе концентрации, способа и продолжительности обработки, а также вида растения и фазы его развития [11]. К настоящему времени накоплена обширная информация о влиянии экзогенной СК на реакцию растений на действие неблагоприятных факторов биотической и абиотической природы, которая обобщена в целом ряде обзорных статей и монографий [8–11, 13, 14, 27]. В частности, выявлено, что это фенольное соединение повышает устойчивость растений к засолению, засухе, неблагоприятным температурам, высоким концентрациям тяжелых металлов, воздействию УФ и др. Участие же СК в адаптации растений к нарушению минерального питания, в том числе к недостатку цинка в корнеобитаемой среде, изучено крайне слабо.
В настоящем исследовании для изучения влияния СК на растения ячменя, находящиеся в условиях недостатка цинка в субстрате, использовалось предпосевное замачивание семян в растворе фитогормона. Судя по литературным данным, этот метод позволяет улучшить прорастание и всхожесть семян, а также способствует повышению устойчивости растений к биотическим и абиотическим стрессорам [9, 11, 14, 19, 27, 28]. Немаловажно и то, что этот метод считают экономически выгодным и экологически безопасным [26]. Однако использование метода предпосевной обработки семян требует подбора оптимальной концентрации СК, которая различна для каждого конкретного вида (и даже сорта). Проведенные нами предварительные опыты позволили установить, что наибольший стимулирующий эффект на прорастание, всхожесть семян и начальный рост проростков ячменя сорта Нур оказывала суточная обработка СК в концентрации 10 мкМ, которая и была использована в дальнейших исследованиях.
Опыты показали, что при недостатке цинка в субстрате у растений ячменя в варианте “без СК” заметно снижались (по сравнению с оптимальным уровнем минерального питания) высота побега, его биомасса и площадь листа. Торможение роста растений при их выращивании в условиях дефицита цинка – хорошо известно и может быть связано с замедлением деления, растяжения и дифференциации клеток [29], нарушением синтеза белков, углеводного и липидного обмена [6], изменением гормонального баланса [3], замедлением фотосинтетических процессов [30], повреждением структуры клеточных мембран [6, 30] и др. Обработка семян СК оказывала защитное действие на растения ячменя в стрессовых условиях, что проявлялось в поддержании процессов роста. Это согласуется с данными литературы. Так, например, ростстимулирующий эффект СК выявлен у ряда злаковых культур – у пшеницы при воздействии засухи [31], у ячменя – при засолении [32] и у риса – при обработке кадмием [33]. Активизация роста может быть обусловлена положительным влиянием СК на процесс деления клеток, что связано, например, с увеличением экспрессии ряда генов, участвующих в регуляции фаз клеточного цикла [34], с усилением фотосинтетической активности [10] и транспорта ассимилятов по тканям и органам растения [9]. Кроме того, обнаружено, что действие СК на рост растений может быть опосредовано ее влиянием на синтез, метаболизм и транспорт других фитогормонов, контролирующих рост, в частности, ауксинов [11].
Отрицательный эффект дефицита цинка на рост и развитие растений обычно объясняют замедлением фотосинтетических процессов. В частности, в этих условиях отмечено уменьшение содержания хлорофиллов, нарушение протекания реакций световой и темновой фаз фотосинтеза, снижение устьичной проводимости и замедление скорости ассимиляции углерода [30, 35]. Однако в наших опытах при недостатке цинка в корнеобитаемой среде скорость фотосинтеза у растений, чьи семена не были обработаны СК, не снижалась, что, отчасти, было связано с поддержанием уровня фотосинтетических пигментов, отсутствием нарушений в ФС II, а также увеличением устьичной проводимости. У растений варианта “СК” в этих условиях скорость фотосинтеза возрастала. Как показывают исследования, повышение интенсивности этого процесса после применения СК может быть обусловлено рядом причин, а именно, увеличением устьичной проводимости, уровня фотосинтетических пигментов, скорости транспорта электронов и активности ферментов темновых реакций фотосинтеза. Так, например, замачивание семян кукурузы в СК способствовало тому, что в условиях избытка кадмия у растений на более высоком уровне (по сравнению с контролем) поддерживалось содержание хлорофиллов, а также скорость ассимиляции CO2, что было связано с двукратным повышением активности РУБИСКО и фосфоенолпируваткарбоксилазы [28, 36]. Обработка проростков риса способствовала повышению фотохимической активности фотосистем и увеличению потока электронов от QA к пластохинону, что существенно уменьшало негативное действие ионов тяжелых металлов на ФСА растений [33]. Нельзя не учитывать и участие СК в поддержании целостности мембран, в том числе мембран тилакоидов, что также обеспечивает сохранение необходимой интенсивности фотосинтетических процессов в неблагоприятных условиях окружающей среды [33].
О влиянии недостатка цинка на водный обмен растений сведений крайне мало. В основном указывается, что при ярко выраженном его дефиците замедляется интенсивность транспирации, что в значительной степени связано с частичным закрытием устьичной щели [35]. Что же касается сведений об изменении этого процесса в ответ на обработку СК, то они довольно противоречивы. Ряд авторов указывает на уменьшение интенсивности транспирации и закрытие устьиц при воздействии на растения СК [9, 37], тогда как другие, наоборот, наблюдали ее увеличение [38, 39]. В наших опытах недостаток цинка в субстрате не вызывал существенного изменения интенсивности транспирации в варианте “без СК”, тогда как у растений варианта “СК” отмечалось значительное повышение скорости транспирации, причем как в оптимальных условиях (Zn+), так и в стрессовых (Zn-).
Полученные нами данные по содержанию цинка в органах растений свидетельствуют о том, что обработка семян СК способствует усилению поглощения цинка корнями и его перемещения в побеги. Возможно, именно этим объясняется стимулирующий эффект СК на ряд показателей ФСА. Ранее уже указывалось положительное воздействие СК на поступление элементов минерального питания в растения. Например, у растений кукурузы, подвергнутых засолению, при применении СК увеличивалось содержание Cu и Mn, что, по крайней мере, отчасти, оказывало положительное влияние на рост растений и накопление ими сухого вещества [19]. Обработка СК арахиса, выращиваемого при недостатке железа в субстрате, вызывала увеличение его содержания в листьях и корнях [17], а у растений риса, испытывающих дефицит фосфора, СК способствовала повышению уровня этого элемента в ксилеме и усиливала экспрессию генов транспортеров, осуществляющих его перемещение из корней в побеги [15]. Показано также, что обработка СК (замачивание семян или опрыскивание растений) в условиях дефицита железа или засоления увеличивала содержание цинка в листьях или корнях кукурузы [19], арахиса [17] и огурца [40]. Однако механизмы положительного влияния СК на поглощение и транспорт микроэлементов не до конца изучены.
Таким образом, предпосевная обработка семян СК повышает устойчивость растений ячменя к недостатку цинка в корнеобитаемой среде. Во многом это связано с повышением содержания цинка в корнях и побегах растений, что способствует более активному протеканию фотосинтетических процессов и, как следствие, поддержанию роста и накоплению биомассы в этих условиях. Полученные результаты свидетельствуют о возможности и перспективности применения предпосевной обработки семян СК для выращивания растений ячменя в условиях недостатка цинка в корнеобитаемой среде.
Исследование выполнено при финансовой поддержке гранта Российского научного фонда (проект № 22-26-00168, https://rscf.ru/projent/22-26-00168/). В работе использовано оборудование Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследований.
Список литературы
Cakmak I., Torun B., Erenoğlu B., Öztürk L.,Marschner H., Kalayci M., Ekiz H., Yilmaz A. Morphological and physiological differences in the response of cereals to zinc deficiency // Euphytica. 1998. V. 100. P. 349.
Сычев В.Г., Аристархов А.Н., Харитонова А.Ф., Толстоусов В.П., Ефимова Н.К., Бушуев Н.Н. Интенсификация продукционного процесса растений микроэлементами. Приемы управления. М.: Всероссийский научно-исследовательский институт агрохимии имени Д.Н. Прянишникова, 2009. 520 с.
Alloway B.J. Zinc in Soil and Crop Nutrition. 2nd Edition. Brussels: International Zinc Association; Paris: International Fertilizer Industry Association. 2008. 139 p.
Казнина Н.М., Титов А.Ф. Влияние дефицита цинка на физиологические процессы и продуктивность злаков // Успехи современной биологии. 2019. Т. 139. С. 280. https://doi.org/10.1134/S0042132419030037
Ali A., Bhat B.A., Rather G.A., Malla B.A., Ganie S. Proteomic studies of micronutrient deficiency and toxicity // Plant Micronutrients. Deficiency and toxicity management / Eds. T. Aftab, K.R. Hakeem. Springer. 2022. P. 257.
Khan S.T., Malik A., Alwarthan A., Shaik M.R. The enormity of the zinc deficiency problem and available solutions; an overview // Arabian J. Chem. 2022. V. 15. https://doi.org/10.1016/j.arabjc.2021.103668
Рябчинская Т.А., Зимина Т.В. Средства, регулирующие рост и развитие растений, в агротехнологиях современного растениеводства // Агрохимия. 2017. Т. 12. С. 62.
Vlot A.C., Dempsey D.A., Klessig D.F. Salicylic acid, a multifaceted hormone to combat disease // Annu. Rev. Phytopathol. 2009. V. 47. P. 177. https://doi.org/10.1146/annurev.phyto.050908.135202
Hayat Q., Hayat S., Irfan M., Ahmad A. Effect of exogenous salicylic acid under changing environment: a review // Environ. Exp. Bot. 2010. V. 68. P. 14. https://doi.org/10.1016/j.envexpbot.2009.08.005
Janda T., Gondor O.K., Yordanova R., Szalai G., Pal M. Salicylic acid and photosynthesis: signalling and effects // Acta Physiol. Plant. 2014. V. 36. P. 2537. https://doi.org/10.1007/s11738-014-1620-y
Шакирова Ф.М. Неспецифическая устойчивость растений к стрессовым факторам и ее регуляция. Уфа: Гилем, 2001. 160 с.
Horvath E., Szalai G., Janda T. Induction of abiotic stress tolerance by salicylic acid signaling // J. Plant Growth Regul. 2007. V. 26. P. 290. https://doi.org/10.1007/s00344-007-9017-4
Khan M.I.R., Fatma M., Per T.S., Anjum N.A., Khan N.A. Salicylic acid-induced abiotic stress tolerance and underlying mechanisms in plants // Front. Plant Sci. 2015. V. 6. https://doi.org/10.3389/fpls.2015.00462
Колупаев Ю.Е., Ястреб Т.О., Поляков А.К., Дмитриев А.П. Салициловая кислота и формирование адаптивных реакций растений на абиотические стрессоры: роль компонентов сигнальной сети // Вестн. Том. гос. ун-та. Биология. 2021. Т. 55. С. 135. https://doi.org/10.17223/19988591/55/8
Wu Q., Jing H.‑K., Feng Z.‑H., Huang J., Shen R.‑F., Zhu X.‑F. Salicylic acid acts upstream of auxin and nitric oxide (NO) in cell wall phosphorus remobilization in phosphorus deficient rice // Rice. 2022. V. 15. https://doi.org/10.1186/s12284-022-00588-y
Su T., Yu S., Yu R., Zhang F., Yu Y., Zhang D., Zhao X., Wang W. Effects of endogenous salicylic acid during calcium deficiency-induced tipburn in chinese cabbage (Brassica rapa L. ssp. pekinensis) // Plant Mol. Biol. Rep. 2016. V. 34. P. 607. https://doi.org/10.1007/s11105-015-0949-8
Kong J., Dong Y., Xu L., Liu S., Bai X. Effects of foliar application of salicylic acid and nitric oxide in alleviating iron deficiency induced chlorosis of Arachis hypogaea L. // Bot. Stud. 2014. V. 55. https://doi.org/10.1186/1999-3110-55-9
Shen C., Yang Y., Liu K., Zhang L., Guo H., Sun T., Wang H. Involvement of endogenous salicylic acid in iron-deficiency responses in Arabidopsis // J. Exp. Bot. 2016. V. 67. P. 4179. https://doi.org/10.1093/jxb/erw196
Gunes A., Inal A., Alpaslan M., Cicek N., Guneri E., Eraslan F., Guzelordu T. Effects of exogenously applied salicylic acid on the induction of multiple stress tolerance and mineral nutrition in maize (Zea mays L.) // Arch. Agron. Soil Sci. 2005. V. 51. P. 687. https://doi.org/10.1080/03650340500336075
Khan N.A., Syeed S., Masood A., Nazar R., Iqbal N. Application of salicylic acid increases contents of nutrients and antioxidative metabolism in mungbean and alleviates adverse effects of salinity stress // Inter. J. Plant Bio-l. 2010. V. 1. https://doi.org/10.4081/pb.2010.e1
Wang C., Zhang S., Wang P., Hou J., Qian J., Ao Y., Lu J., Li L. Salicylic acid involved in the regulation of nutrient elements uptake and oxidative stress in Vallisneria natans (Lour.) Hara under Pb stress // Chemosphere. 2011. V. 84. P. 136. https://doi.org/10.1016/j.chemosphere.2011.02.026
ГОСТ 12038-84. Межгосударственный стандарт. Семена сельскохозяйственных культур. Методы определения всхожести. Дата введения: 1986-07-01. М.: Изд-во стандартов.
Аникиев В.В., Кутузов Ф.Ф. Новый способ определения площади листовой поверхности у злаков // Физиология растений. 1961. Т. 8. С. 375.
Светов С.А., Степанова А.В., Чаженгина С.Ю., Светова Е.Н., Рыбникова З.П., Михайлова А.И., Парамонов А.С., Утицына В.Л., Эхова М.В., Колодей В.С. Прецезионный (ICP-MS, LA-ICP-MS) анализ состава горных пород и минералов: методика и оценка точности результатов на примере раннедокембрийских мафитовых комплексов // Труды КарНЦ РАН. Сер. Геология докембрия. 2015. № 7. С. 54.
Титов А.Ф., Таланова В.В. Устойчивость растений и фитогормоны. Петрозаводск: Карельский научный центр РАН, 2009. 206 с.
Rhaman M.S., Imran S., Rauf F., Khatun M., Baskin C.C., Murata Y., Hasanuzzaman M. Seed priming with phytohormones: an effective approach for the mitigation of abiotic stress // Plants. 2021. V. 10. https://doi.org/10.3390/plants10010037
Per T.S., Fatma M., Asgher M., Javied S., Khan N.A. Salicylic acid and nutrients interplay in abiotic stress tolerance // Salicylic acid: A multifaceted hormone / Eds. R. Nazar, N. Iqbal, N.A. Khan. Springer. 2017. P. 221.
Krantev A., Yordanova R., Janda T., Szalai G., Popova L. Treatment with salicylic acid decreases the effect of cadmium on photosynthesis in maize plants // J. Plant Physiol. 2008. V. 165. P. 920. https://doi.org/10.1016/j.jplph.2006.11.014
Hossian B., Hirata N., Nagatomo Y., Akashi R., Takaki H. Internal zinc accumulation is correlated with increased growth in rice suspension culture // J. Plant Growth Reg. 1997. V. 16. P. 239.
Chen W., Yang X., He Z. Feng Y., Hu F. Differential changes in photosynthetic capacity, 77 K chlorophyll fluorescence and chloroplast ultrastructure between Zn-efficient and Zn-inefficient rice genotypes (Oryza sativa) under low zinc stress // Physiol. Plantarum. 2008. V. 132. P. 89. https://doi.org/10.1111/j.1399-3054.2007.00992.x
Yavas I., Unay A. Effects of zinc and salicylic acid on wheat under drought stress // JAPS. 2016. V. 26. P. 1012.
Pirasteh‑Anosheh H., Ranjbar G., Hasanuzzaman M., Khanna K., Bhardwa R., Ahmad P. Salicylic acid‑mediated regulation of morpho‑physiological and yield attributes of wheat and barley plants in deferring salinity stress // J. Plant Growth Regul. 2022. V. 41. P.1291. https://doi.org/10.1007/s00344-021-10358-7
Yotsova E.K., Dobrikova A.G., Stefanov M.A., Kouzmanova M., Apostolova E.L. Improvement of the rice photosynthetic apparatus defence under cadmium stress modulated by salicylic acid supply to roots // Theor. Exp. Plant Physiol. 2018. V. 30. P. 57. https://doi.org/10.1007/s40626-018-0102-9
Xu L., Zhao H., Ruan W., Deng M., Wang F., Peng J., Luo J., Chen Z., Yib K. ABNORMAL INFLORESCENCE MERISTEM1 functions in salicylic acid biosynthesis to maintain proper reactive oxygen species levels for root meristem activity in rice // The Plant Cell. 2017. V. 29. P. 560. https://doi.org/10.1105/tpc.16.00665
Wang H., Liu R.L., Jin J.Y. Effects of zinc and soil moisture on photosynthetic rate and chlorophyll fluorescence parameters of maize // Biol. Plantarum. 2009. V. 53. P. 191. https://doi.org/10.1007/s10535-009-0033-z
Khan W., Prithiviraj B., Smith D.L. Photosynthetic responses of corn and soybean to foliar application of salicylates // J. Plant Physiol. 2003. V. 160. P. 485. https://doi.org/10.1078/0176-1617-00865
Liu C., Guo J., Cui Y., Lü T., Zhang X., Shi G. Effects of cadmium and salicylic acid on growth, spectral reflectance and photosynthesis of castor bean seedlings // Plant Soil. 2011. V. 344. P.131. https://doi.org/10.1007/s11104-011-0733-y
Husen A., Iqbal M., Sohrab S.S., Ansari M.K.A. Salicylic acid alleviates salinity caused damage to foliar functions, plant growth and antioxidant system in Ethiopian mustard (Brassica carinata A. Br.) // Agric. Food Secur. 2018. V. 7. P. 44. https://doi.org/10.1186/s40066-018-0194-0
Sedaghata M., Tahmasebi Sarvestania Z., Emamb Y., Mokhtassi Bidgolia A., Sorooshzadeha A. Foliar-Applied GR24 and salicylic acid enhanced wheat drought tolerance // Russ. J. Plant Physiol. 2020. V. 67. P. 733. https://doi.org/10.1134/S1021443720040159
Yildirim E., Turan M., Guvenc I. Effect of foliar salicylic acid applications on growth, chlorophyll, and mineral content of cucumber grown under salt stress // J. Plant Nutr. 2008. V. 31. P. 593. https://doi.org/10.1080/01904160801895118
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений