Физиология растений, 2023, T. 70, № 5, стр. 537-546
Связь дегидринов с адаптацией лиственницы Каяндера к условиям криолитозоны Якутии
Т. Д. Татаринова a, *, А. А. Перк a, А. Г. Пономарев a, И. В. Васильева a
a Институт биологических проблем криолитозоны Сибирского отделения Российской академии наук
Якутск, Россия
* E-mail: t.tatarinova@gmail.com
Поступила в редакцию 22.02.2023
После доработки 13.03.2023
Принята к публикации 17.03.2023
- EDN: WWJMZE
- DOI: 10.31857/S001533032360016X
Аннотация
Исследованы особенности состава и сезонных изменений стрессовых белков-дегидринов лиственницы Каяндера (Larix cajanderi Mayr), произрастающей в условиях экстремально холодного климата криолитозоны Центральной Якутии и отличающейся необычайно высокой морозоустойчивостью. C использованием технологии иммуноблоттинга впервые в побегах L. cajanderi выявлены мажорные дегидрины в интервале мол. м. 17–20, 37–42 и 73 кД. Установлен высокий уровень полиморфизма дегидринов внутри популяции L. cajanderi, различия между изученными экземплярами деревьев обнаружены, в основном, в области мол. м. 20–37 кД. В годичном цикле лиственницы наибольшим сезонным изменениям подвержены низкомолекулярные дегидрины, их содержание возрастало в конце фенологической осени и достигало постоянного уровня в период максимально низких зимних температур. Особенности сезонных изменений и значительное разнообразие состава дегидринов в побегах лиственницы могут указывать на их вероятное участие в формировании уникальной морозоустойчивости L. cajanderi при адаптации данного вида хвойных растений к условиям криолитозоны.
ВВЕДЕНИЕ
Древесные растения, произрастающие в условиях экстремально холодного климата и многолетней мерзлоты Центральной Якутии, отличаются необычайно высокой морозоустойчивостью благодаря их способности адаптироваться к холодовому фактору. Сверхнизкие зимние температуры воздуха (до –60°С и ниже) без возвратных потеплений, а также их резкие суточные перепады в межсезонье определяют жизнеспособность и видовой состав дендрофлоры в криолитозоне. В этой связи, в бореальных лесах Северо-Востока Сибири главную роль играют хвойные деревья сем. Сосновые (Pinaceae Lindl.) – лиственница Каяндера (Larix cajanderi Mayr) и лиственница даурская или Гмелина (L. dahurica Turcz. et Trautv. = syn. L. gmelinii (Rupr.) Rupr), далеко превосходящие по ареалу и количеству растений другие виды [1, 2].
Стрессовые факторы различной природы (низкие температуры, засуха, засоление и др.) могут индуцировать в растениях экспрессию генов специфических белков, в т.ч. с криопротекторными свойствами. В формировании устойчивости древесных растений к экстремальным климатическим условиям криолитозоны Якутии, вероятно, принимают участие и стрессовые белки-дегидрины, физиологическую роль которых связывают с защитой биополимеров и мембран клеток растений от повреждений, вызванных низкими температурами и дегидратацией [3–7].
Дегидрины представляют собой высокогидрофильные белки семейства LEA (Late Embryogenesis Abundant) или белки позднего эмбриогенеза и обнаружены у большинства таксономических групп растений [3, 5, 8, 9]. Для дегидринов характерны термостабильность, высокая степень конформационной лабильности и наличие в них специфических последовательностей, обогащенных полярными аминокислотами, особенно лизином и пролином. Наиболее распространенный пептидный мотив из 15 аминокислот (EKKGIMDKIKEKLPG) или консервативный K-сегмент, является общим для всех изученных дегидринов [3, 8, 10]. Различные сочетания консервативного K-сегмента и вариабельных (Y-, S-) сегментов определяют их функциональные свойства, связанные с криопротекторной, антифризной, антиоксидантной и металлсвязывающей функциями [4–6, 11, 12].
Стрессовые белки-дегидрины голосеменных растений изучены в гораздо меньшей степени, чем у покрытосеменных. При этом выявлены некоторые особенности в организации генома хвойных видов [13, 14]. Так, им свойственны значительно более крупные семейства генов дегидринов [15, 16]. Например, в базе данных транскриптома Picea glauca идентифицировано 53 разных генов дегидринов [17]. Кроме того, в составе дегидринов Pinaceae вместо Y-сегментов обнаружены A- и E-сегменты и специфичные N-концевые области [13, 14]. Разнообразие множества дегидринов с разным составом последовательностей A-, E-, S-, N- и K-сегментов предполагает не только сложность экспрессии их генов, но и возможность участия данных белков в развитии устойчивости хвойных древесных к различным стрессовым воздействиям, включая и низкие отрицательные температуры.
Резкое усиление экспрессии генов дегидринов и накопление их белковых продуктов отмечали при обезвоживании в тканях вегетирующих растений. Например, экспрессия семейства генов дегидринов выявлена у двух видов сосны – приморской (Pinus pinaster) и кедровой (P. pinea), подвергнутых водному стрессу [13, 18]. Наряду с этим, сообщалось, что дегидрины могут предотвращать коагуляцию макромолекул при различных температурах и низких осмотических условиях [8]. Короткий фотопериод и низкие закаливающие температуры, приводящие к дегидратации клеток, вызывали в разных органах и тканях растений умеренной зоны накопление дегидринов [4, 5, 9, 19], в том числе у хвойных деревьев [20–22]. К настоящему времени дегидрины обнаружены в хвое сосны обыкновенной Pinus sylvestris, произрастающей в разных природно-климатических условиях: в криолитозоне Центральной Якутии [23, 24] и в регионе Предбайкалья [21, 22], а также в хвое ели сибирской Picea obovata на северо-востоке Фенноскандии [16] и на юге Сибири [22]. Связь между сезонным накоплением некоторых дегидринов и развитием морозоустойчивости хвойных деревьев выявлена, например, у ели сибирской Picea obovata [16] и сосны веймутовой Pinus strobus [25].
Устойчивость к холоду у древесных растений изначально развивается в ответ на сокращение фотопериода и снижение температуры окружающей среды, индуцирующими экспрессию специфических генов, чувствительных к низким температурам, и синтез стрессовых белков. Вероятно, стрессовые белки-дегидрины, накапливающиеся в период осеннего перехода к зимнему покою, принимают участие в осмо- и криозащитных механизмах при низкотемпературной адаптации древесных растений к условиям холодного климата [5, 7, 11].
Огромные территории лиственничных лесов, охватывающие различные географические и климатические условия, свидетельствуют об большой экологической пластичности лиственницы как вида. Среди древесных пород мира якутская популяция лиственницы не имеет конкурентов по своей морозоустойчивости, выдерживая в зимнее время температуру ниже –60°С [26, 27]. Более того, меристематические ткани почек лиственницы могут сохранять жизнеспособность при замораживании до критически низкой температуры –196°С [28]. Обладая специфическими особенностями в транспирации, лиственницы также легко переносят летнее обезвоживание при высокой температуре воздуха [29]. Такие свойства указывают на существование у данного вида сформированного и наследственно закрепленного механизма, позволяющего сохранить жизнеспособность клеток в условиях холодных регионов в самых северных в мире ареалах произрастания древесных растений. Вследствие этого, доминирующими из хвойных деревьев на территории Республики Саха (Якутия) являются лиственницы даурская (Гмелина) и Каяндера, занимающие более 79% лесопокрытой площади региона [26, 27].
Исследования роли стрессовых белков, включая дегидрины, в формировании криоустойчивости лесообразующих древесных растений на Северо-Востоке Евразии немногочисленны. Ранее нами впервые были идентифицированы дегидрины в тканях березы повислой и сосны обыкновенной, произрастающих в условиях Центральной Якутии [30–32]. Дегидрины хвойных деревьев, в основном, изучены у некоторых вечнозеленых видов, тогда как дегидрины летнезеленой лиственницы почти не исследованы. Вместе с тем, надземные органы древесных растений в условиях криолитозоны наиболее подвержены длительному воздействию низких температур, приводящих к осмотическому стрессу. В этой связи, изучение механизмов, ответственных за формирование уникальной способности лиственницы переносить экстремально низкие зимние температуры, характерные для криолитозоны, представляется весьма актуальным. Выяснение роли стрессовых белков-дегидринов в развитии необычайно высокой морозоустойчивости хвойных пород на примере L. cajanderi позволит выявить особенности их адаптации к специфическим условиям произрастания, а также обнаружить общие закономерности формирования низкотемпературной устойчивости древесных растений криолитозоны.
Целью настоящей работы явилось изучение особенностей состава стрессовых белков-дегидринов и их изменений в сезонном цикле хвойных растений на примере лиственницы Каяндера (L. cajanderi Mayr) в условиях холодного климата и многолетней мерзлоты Центральной Якутии.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования в работе явилась лиственница Каяндера (Larix cajanderi Mayr) – бореальный восточноазиатский вид, главная лесообразующая порода Якутии и Северо-Востока Сибири. Произрастает в чрезвычайно суровых климатических условиях как на равнине, так и в горах. Следует отметить, что некоторые авторы рассматривают лиственницу Каяндера как восточную расу или подвид лиственницы даурской (Гмелина) [1, 2]. Эти же виды являются и самыми долгоживущими деревьями, отдельные экземпляры которых достигают возраста 900 лет.
Климат Центральной Якутии характеризуется экстремальными условиями: среднемесячная температура воздуха в январе составляет –38.6°С, годовое количество осадков – 237 мм. Температурные значения в регионе отслеживали по сайту URL http:meteo.ru/data. Климатические показатели в период сбора образцов в целом не отличались от среднемноголетних. Материалом исследования служили однолетние побеги лиственницы Каяндера без хвои, произрастающей в природных условиях (лесопарковая зона Ботанического сада ИБПК СО РАН, окрестности г. Якутска, 62° с.ш., 129° в.д.). Сбор и исследование биологического материала проводили в течение 2011–2016 гг. Методика сбора образцов и их обработка, в зависимости от условий эксперимента, варьировала. При отборе проб на биохимический анализ, материал сразу после получения фиксировали и хранили в жидком азоте до процедуры выделения белков. Для выявления полиморфизма дегидринов в период зимнего покоя (10.02.2011 г., минимальная температура воздуха –43.8°С, средняя –37.3°С) пробы отбирали индивидуально для каждого растения. Экземпляры деревьев (n = 13) обозначены региональным индексом и номером – YaL1-YaL13. При изучении сезонной динамики состава дегидринов сбор материала по отдельным растениям (YaL1, YaL6, YaL10, YaL11) осуществляли круглогодично (2011–2012 гг.) не реже одного раза в месяц.
Выделение суммарных белков из однолетних побегов лиственницы проводили согласно [21]. Навеску ткани (1.5–2.0 г) измельчали в ступке в жидком азоте в присутствии нерастворимого поливинилпирролидона (“Serva”, Германия, 2.5% по отношению к объему буфера). Все процедуры проводили при температуре +4°С. Белки экстрагировали буфером, содержащим 0.1 М Tрис-HCl, рН 7.5, 12 мМ β-меркаптоэтанол, 1% ДДС-Na, 10 мМ ЭДТА, 3 мМ ФМСФ (фенилметилсульфанилфторид). Гомогенат центрифугировали при 50 000 g в течение 40 мин. К супернатанту, профильтрованному через капроновую ткань, добавляли поливинилпирролидон (2.5%) и центрифугировали при 50 000 g в течение 35 мин. Суммарные белки осаждали пятью объемами ацетона при температуре −20°С в течение 1 ч. Осадок белка гомогенизировали в электрофоретическом буфере, содержащем 1 М Трис-HCl, рН 7.5, 10% ДДС-Na, 5% β-меркаптоэтанол, 10% глицерол. Раствор белка просветляли центрифугированием при 17 000 g (20 мин, +4°С) и использовали для проведения электрофореза. Содержание белка определяли по методу Bradford [34]. Электрофоретическое разделение белков проводили в 13.5% ПААГ в присутствии ДДС-Nа [35] с использованием маркеров молекулярной массы (“ThermoScientific”, США) и последующим окрашиванием Кумасси G-250 (“Serva”, Германия). На треки наносили равное количество белка (10–15 мкг). Выравнивание белков в треках ПААГ проводили опытным путем по интенсивности окраски белковых полос в сравнении с известным количеством контрольного образца (10–15 мкг). Перенос белков из ПААГ на ПВДФ (поливинилидендифторид) мембрану (“Bio-Rad”, США) проводили по методу Timmons и Dunbar [36]. Идентификацию дегидринов выполняли с помощью поликлональных антител против их К‑сегмента (EKKGIME/DKIKEKLPG) в разведении 1 : 500 (“Agrisera”, Швеция). Дегидрины визуализировали при помощи антикроличьих антител, конъюгированных с щелочной фосфатазой в разведении 1:2500 (“Sigma”, США). В качестве хромогенных субстратов использовали 5-бромо-4-хлоро-3-индолил фосфат и нитротетразолий синий (“AppliChem”, Германия). Данные сканирования гелей и мембран обрабатывали с помощью программы ImageJ 1.41o/Java 1.50_09 (США). Количественные показатели содержания дегидринов оценивали по интенсивности окраски мембраны в относительных единицах денситометрической плотности (отн. ед., D). Значение денситометрической плотности дегидрина с мол. м. 14 кД в июле принято за нулевой уровень. На рисунках представлены типичные мембраны, отражающие стабильно воспроизводимые результаты иммунодетекции дегидринов лиственницы с использованием специфических антител против К-сегмента.
Для интегральной количественной оценки морозоустойчивости растений использовали показатель проницаемости клеточных мембран, оцениваемый по выходу электролитов (electrolyte leakage method) [33]. Навеску свежесобранных побегов (1 г) сразу после сбора нарезали и инкубировали в 40 мл дистиллированной воды в термостате при постоянной температуре 25°С в течение 24 ч. Затем образцы подвергали кипячению для полного выхода электролитов. Условия опытов были подобраны в ходе предварительных экспериментов с варьированием соотношений массы навески к объему воды и длительности последующей экстракции. Выход электролитов до и после фиксации проб кипячением определяли по электропроводности (G) вытяжек с помощью реохордного моста Р38 на переменном токе частотой 50 Гц с использованием кондуктометрического датчика УК-02/1. Величина G водных вытяжек прямо пропорциональна повреждающему клеточные мембраны фактору. Степень морозоустойчивости растений в их годовом цикле оценивали в виде коэффициента морозоустойчивости (КМ), выражаемого отношением GН нативной вытяжки к GФ фиксированных кипячением образцов.
Измерения выполнены в трехкратной биологической повторности с привлечением статистического пакета Microsoft Office Excel 2010, в результатах приведены средние арифметические величины и их стандартные отклонения, различия значимы при P < 0.05.
РЕЗУЛЬТАТЫ
Произрастающие в суровых природно-климатических условиях Центральной Якутии древесные растения приобрели необычайно высокую морозоустойчивость. В защите клеток растений в ответ на стресс-факторы различной природы, в т.ч. к холодовому, связанному с дегидратацией, основная роль отводится стрессовым белкам-дегидринам. В данной работе впервые с использованием специфических антител в однолетних побегах лиственницы Каяндера обнаружены дегидрины в области мол. м. 14–42 и 73 кД. При сравнении отдельных экземпляров в период зимнего покоя деревьев (февраль) выявлен высокий уровень полиморфизма данных белков в центрально-якутской популяции L. cajanderi. Существенным отличием дегидринов в побегах лиственницы явилось их необычайно высокое разнообразие, поскольку большая часть этих белков обнаруживалась в диапазоне мол. м. 14–42 кД (рис. 1).
Рис. 1.
Результаты иммуноблоттинга дегидринов в побегах отдельных экземпляров (YaL1-YaL13) лиственницы Каяндера (Larix cajanderi) в Центральной Якутии в период зимнего покоя. Все образцы (n = 13) собраны 10.02.2011 г. (минимальная температура воздуха составила –43.8°С) и фиксированы для хранения в жидком азоте. Представлены типичные мембраны иммунодетекции дегидринов. Указаны молекулярные массы: слева – маркеров (М), справа – дегидринов.
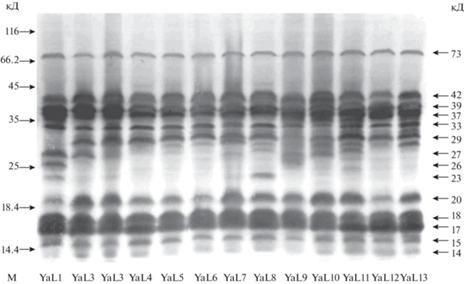
Во всех изученных образцах лиственницы в низкомолекулярной области в сравнительно большем количестве обнаружены дегидрины с мол. м. 17, 18 и 20 кД, в меньшем – 14 и 15 кД, а также в среднемолекулярной области представлены мажорные дегидрины с мол. м. 37, 39, 42 кД. Из других дегидринов, белки с мол. м. 29 кД наблюдали в побегах большинства деревьев лиственницы, тогда как белки 23, 26 и 27 кД встречались лишь у отдельных экземпляров. Среди высокомолекулярных полипептидов в зимний период в побегах всех изученных деревьев идентифицировали дегидрин с мол. м. 73 кД. Наличие или отсутствие в спектре белков тех или иных дегидринов, а также их количественное содержание определяли индивидуальные различия между отдельными лиственницами. Таким образом, дегидрины в побегах лиственницы в зимний период во время покоя проявляли более высокую вариабельность в среднемолекулярной области 23–29 кД, чем в низко- и высокомолекулярных областях.
Для выявления вероятной связи дегидринов с формированием морозоустойчивости лиственницы Каяндера в специфических условиях криолитозоны Якутии было предпринято изучение их сезонной динамики. Нами обнаружено, что в течение годичного цикла деревьев большая часть мажорных дегидринов в побегах лиственницы в осенне-зимний и зимне-весенний периоды представлена равномерно, но подвергается существенным изменениям в летние месяцы (рис. 2).
Рис. 2.
Сезонные изменения дегидринов в побегах лиственницы Каяндера (Larix cajanderi) (YaL1) в Центральной Якутии. Образцы были собраны в течение годового цикла (2011–2012 гг.) и фиксированы для хранения в жидком азоте. Представлены типичные мембраны иммунодетекции дегидринов. Указаны молекулярные массы: слева – маркеров (М), справа – дегидринов.
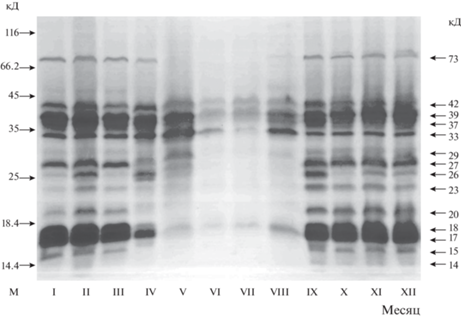
Дегидрины с мол. м. 33, 37, 39, 42 кД оказались менее подвержены сезонным изменениям – они не исчезали полностью в летние месяцы, хотя их количество уменьшалось. Более сглаженная динамика в годичном цикле лиственницы проявлялась в высокомолекулярной области у дегидрина 73 кД, который почти пропадал в летние месяцы и появлялся вновь в сентябре. Такие особенности этой группы дегидринов могут указывать на их более вероятные конститутивные свойства, связанные с участием в метаболических процессах в клетках хвойных. Наиболее отчетливо ход сезонных изменений дегидринов лиственницы прослеживается в изменениях низкомолекулярных белков, особенно в области мол. м. 14–29 кД, во время вегетации (в июне – июле). Почти все дегидрины появлялись к сентябрю в период осеннего перехода древесных растений к зимнему покою. При этом, уровень дегидринов 17 и 18 кД в побегах лиственницы был значительно выше, чем таковой других низкомолекулярных 14, 15 и 20, 23, 26, 27, 29 кД, содержание которых заметно возрастало осенью с августа до октября (до 22 раз). Затем дегидрины достигали и сохраняли стабильно высокий уровень в самые холодные месяцы зимы (ноябрь – март), когда отмечались наиболее низкие отрицательные температуры. Можно предположить, что в этот низкотемпературный период морозоустойчивость древесных растений в условиях криолитозоны достигала максимальных значений.
Весной (апрель – май), на фоне подъема температуры воздуха и начала оттаивания мерзлотных почв в побегах лиственницы в начале вегетации деревьев происходило заметное падение уровня дегидринов. В летние месяцы содержание большинства данных белков значительно снижалось, а некоторые, особенно в низкомолекулярной области с мол. м. 14, 15, 21, 23, 26, 27, 29 кД почти исчезали. Количество низкомолекулярных дегидринов 17, 18 кД, уменьшалось в гораздо большей степени от 460–520 до 40–50 отн. ед., чем среднемолекулярных, например, белков с мол. м. 37 и 39 кД от 370–410 до 130–160 отн. ед., соответственно, но те и другие не исчезали полностью. Обнаруженные изменения в составе индивидуальных дегидринов в годичном цикле центрально-якутской популяции лиственницы четко прослеживаются на гистограммах (рис. 3).
Рис. 3.
Динамика сезонных изменений состава отдельных дегидринов (а–г) в побегах лиственницы Каяндера (Larix cajanderi) (YaL1) в Центральной Якутии. Образцы были собраны в течение годового цикла (2011–2012 гг.) и фиксированы для хранения в жидком азоте. На гистограммах значение денситометрической плотности (D, отн. ед.) дегидрина 14 кД в июле принято за нулевой уровень. Представлены данные в виде средних арифметических значений и их стандартных отклонений, различия значимы при P < 0.05.
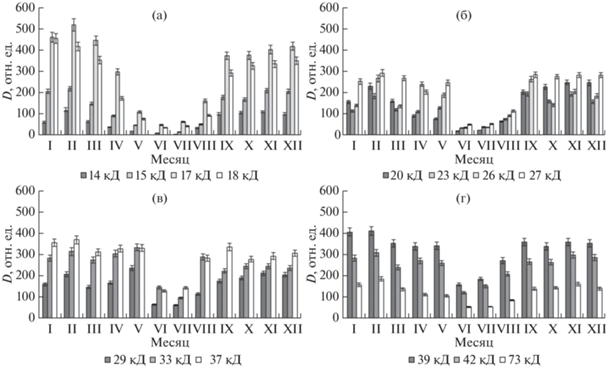
Из приведенных данных следует, что максимальное накопление дегидринов происходило к концу фенологической осени и устойчиво сохранялось в холодный период года. Самый высокий уровень дегидринов в побегах лиственницы наблюдали во время зимнего покоя деревьев в период экстремально низких температур, что указывает на тесную связь данных белков с низкотемпературной адаптацией лиственницы к условиям криолитозоны.
С целью оценки степени морозоустойчивости лиственницы Каяндера и выявления ее связи с уровнем дегидринов было предпринято изучение проницаемости клеточных структур побегов с использованием метода электролитов. Ежемесячная динамика изменения суммарных дегидринов ΣD и относительной морозоустойчивости KM деревьев на фоне среднемесячных температур воздуха t°C в Центральной Якутии приведена на рис. 4.
Рис. 4.
Динамика изменения суммарных дегидринов ΣD и морозоустойчивости KM (1) в побегах лиственницы Каяндера (Larix cajanderi) (YaL1) на фоне среднемесячных температур воздуха t°C (2) в Центральной Якутии (2011 г.). Степень морозоустойчивости растений в их годовом цикле оценивали в виде коэффициента морозоустойчивости (КМ). Приведены результаты экспериментов трех биологических повторностей с привлечением статистического пакета Microsoft Office Excel 2010. Представлены данные в виде средних арифметических значений и их стандартных отклонений, различия значимы при P < 0.05.
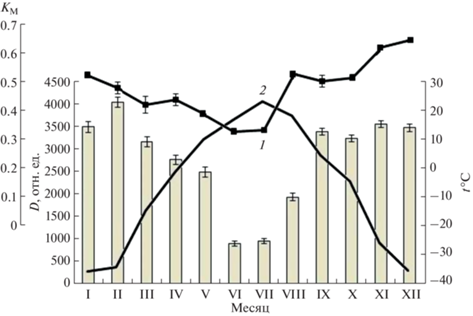
Данный метод ранее хорошо зарекомендовал себя при изучении некоторых видов плодово-ягодных культур в условиях Якутии [33]. Как и ожидалось, наибольшие значения коэффициента морозоустойчивости в побегах лиственницы наблюдали в зимние месяцы, когда он достигал показателей 0.53–0.65. Тенденцию спада КМ у деревьев фиксировали в начале весны (апрель), когда он уменьшался до 0.43–0.45 и далее снижался до минимальных значений в летние месяцы – 0.34. Ближе к осенне-зимнему периоду при подготовке растений к покою (август), показатели КМ снова возрастали. При этом, в побегах лиственницы Каяндера наблюдали синхронные однонаправленные изменения коэффициента морозоустойчивости КМ и содержания суммарных дегидринов D (отн. ед.) (рис. 4). Обратная зависимость имеет место для связи температуры воздуха с КМ и уровнем дегидринов, особенно их низкомолекулярных форм.
ОБСУЖДЕНИЕ
Устойчивость растений к неблагоприятным факторам среды формируется в результате комплекса структурных и физиолого-биохимических изменений клеток и тканей, однако механизмы их низкотемпературной адаптации в природных условиях до сих пор изучены недостаточно.
Особую роль в адаптации растений к абиотическим стрессорам играют защитные белки-дегидрины, препятствующие потере клеткой воды за счет высокой гидрофильности и стабилизирующие клеточные белки. В данном исследовании показано, что в годичных побегах L. cajanderi в условиях криолитозоны обнаружены стрессовые белки-дегидрины, преимущественно в области мол. м. 14–42 и 73 кД. Мажорные дегидрины лиственницы представлены белками с мол. м. 17, 18, 20, 37, 39 и 42 кД. Несколько меньше по содержанию составляли 14, 15, 17, 18, 20 кД, а также 73 кД дегидрины. Кроме того, в области мол. м. 20–37 кД отмечали большое разнообразие минорных изоформ дегидринов (от 3 до 5), которые определяли индивидуальные качественные и количественные различия между отдельными экземплярами лиственницы, особенно в зимний период. Высокий уровень полиморфизма дегидринов в побегах отдельных экземпляров центрально-якутской популяции лиственницы может свидетельствовать о значительном потенциале холодоустойчивости изучаемого вида, направленного для защиты и обеспечения жизнедеятельности растений и, вероятно, обусловлен особенностями низкотемпературной адаптации древесных растений рода Larix к условиям климата криолитозоны. Известно, что лиственница имеет наиболее высокий уровень летней транспирации среди хвойных деревьев, превосходя вечнозеленые виды по данному показателю в 2–3 раза [29]. В связи с этим она вынуждена сбрасывать хвою с наступлением морозов, обеспечивая свою криотолерантность, в том числе, за счет снижения потери воды в результате зимней транспирации. Сведения о внутривидовом полиморфизме дегидринов, а также их предполагаемой связи с адаптацией у других видов древесных, в том числе хвойных растений, практически отсутствуют. Так, была выявлена аллельная изменчивость данного типа белков в пяти природных популяциях Quercus petraea [37].
Анализ сезонных изменений дегидринов показал, что стрессовым белкам-дегидринам в годичном цикле лиственницы Каяндера свойственны характерные изменения, приводящие к их накоплению в период осеннего перехода растений к покою, стабильно высокому уровню в зимние месяцы (ноябрь – март) и затем снижению их содержания в весенний период года (апрель – май). По данным литературы, изучение сезонной вариабельности экспрессии генов дегидринов и содержания этих белков у различных видов выявило их высокий уровень зимой и низкий – летом во время их интенсивного роста. Большинство дегидринов древесных растений индуцируется в ответ на низкую температуру, а некоторые из них – на низкую температуру и на короткий день [11]. У древесных растений умеренных зон отмечалось накопление дегидринов при уменьшении содержания воды во время осеннего перехода к зиме, например, в тканях Picea obovata [16], Pinus sylvestris [20, 21], Cornus sericea [38], Betula pubescens [39]. Как следует из наших данных, в сезонном цикле L. cajanderi для спектра белков характерно высокое разнообразие состава дегидринов, максимальное содержание которых выявлено в период зимнего покоя деревьев (февраль), когда наблюдались сверхнизкие отрицательные температуры. По-видимому, индуцируемые холодовым фактором и накапливающиеся в самые морозные месяцы зимы в побегах лиственницы стрессовые белки-дегидрины, могут быть ассоциированы с формированием низкотемпературной устойчивости этого вида хвойных растений. С наступлением осени заметное сокращение длины дня и снижение температуры окружающего воздуха вызывают остановку роста и развития растений, тем самым одновременно включая процессы дегидратации, с которыми коррелирует возрастание уже в августе некоторых дегидринов (например, с мол. м. 33, 37 и 39 кД), а затем и четкое появление в сентябре их низкомолекулярных форм (с мол. м. 17, 18, 26 и 27 кД), вероятно, необходимых для компенсации потери воды. Такое же возрастание уровня экспрессии низкомолекулярных дегидринов в условиях дефицита влаги наблюдали в хвое ели сизой Picea glauca [14]. Появление дегидринов, особенно низкомолекулярных, в период осенней акклимации растений к холоду указывает на их индуцибельный характер, вызванный процессами сокращения долготы дня и нарастания холодового фактора. Накопление в побегах при осеннем переходе к зимнему покою и поддержание высокого уровня дегидринов указывают на их возможное участие в защите клеток деревьев, что наряду с опадением хвои, предохраняет лиственницы от обезвоживания во время низкотемпературного периода. С установлением постоянного снежного покрова на территории Центральной Якутии (конец октября – начало ноября) содержание всех дегидринов в побегах достигает стабильно высокого уровня и остается таковым в течение всего зимнего периода. Наряду с этим, сезонные изменения состава данной группы белков согласуются с показателями, полученных с помощью кондуктометрического метода по относительному выходу электролитов из побегов. Так, древесные растения в условиях сверхнизких температур характеризуются максимальными значениями морозоустойчивости на основе измерения их клеточной проницаемости побегов лиственницы методом электролитов (КМ = = 0.53–0.65). Наблюдаемые синхронные однонаправленные изменения морозоустойчивости, выраженные измеряемым коэффициентом КМ и уровнем накопления дегидринов в побегах, также могут свидетельствовать о связи криотолерантности лиственницы Каяндера с накоплением специфических белков-дегидринов. Весной (апрель – май) по мере прогревания воздуха и начала оттаивания мерзлотных почв в побегах лиственницы происходит резкое снижение содержания, а затем фактическое исчезновение летом низкомолекулярных дегидринов с мол. м. 14, 15 и 23, 26, 27, 29 кД, за которым следовали среднемолекулярные дегидрины с мол. м. 33, 39, 42 кД. Подобные циклы сезонных изменений уровня дегидринов, связанные с акклимацией и деакклимацией растений при изменениях светового и температурного факторов, обнаружены у разных древесных и кустарниковых видов. Ранее в почках березы B. pubescens, произрастающей в Финляндии, в зимний период отмечались дегидрины с мол. м. 24, 30 и 33 кД [39]. Сходная динамика в накоплении дегидринов, разных по мол. м., обнаружена и у хвойных древесных растений [16, 21, 40]. Характерные для двух видов ели Picea glauca и P. obovata дегидрины 32, 34 и 50 кД накапливались в период холодового стресса и исчезали в оптимальных условиях произрастания [40]. Значительное возрастание уровня дегидрина 16 кД в хвое совпадало с приобретением морозоустойчивости сосны веймутовой Pinus strobus [25]. В условиях Предбайкалья к специфичным для зимнего покоя сосны обыкновенной Pinus sylvestris относят дегидрины с мол. м. 17, 26 и 32 кД [21], в хвое ели сибирской Picea obovata в октябре месяце выявлены дегидрины 14.5, 34, 38, 55 кД [22], близкие по значениям мол. м. к таковым в хвое ели Picea obovata 33, 35 и 53 кД, ранее описанных в работе [16]. Накопление низкомолекулярных дегидринов у зимующих древесных растений происходило, в основном, только в периоды низких отрицательных температур, что свидетельствует об их отчетливой связи с адаптацией деревьев к холодовому фактору. Белки, сходные с низкомолекулярными дегидринами, ассоциированными с перезимовкой древесных растений, произрастающих в условиях многолетней мерзлоты, обнаружены в хвое сосны P. sylvestris (дегидрин с мол. м 14.5–15 кД) [23, 24], в побегах и почках березы повислой Betula pendula (дегидрин с мол. м. 17 кД) [31, 32]. Обнаруженные в побегах лиственницы низкомолекулярные дегидрины с мол. м. 14, 15, 17, 18 кД сходны с таковыми других хвойных, в частности, с дегидринами сосны обыкновенной и ели сибирской. Белок с мол. м. 73 кД, который присутствовал постоянно в побегах лиственницы в осенне-зимний период, по мол. м. также близок к дегидрину 72 кД в хвое сосны из Предбайкалья [22]. Вероятно, близкие по мол. м. стрессовые белки-дегидрины у разных древесных хвойных могут осуществлять сходные функции в их защите от зимнего обезвоживания в низкотемпературный период. Приведенные в работе данные согласуются с физиологической ролью дегидринов, связанной с противостоянием дегидратации, в первую очередь, при низкотемпературном стрессе. Наличие и разнообразие состава дегидринов, обнаруженных у отличающейся высокой морозоустойчивостью лиственницы Каяндера, по-видимому, является необходимым условием достижения оптимального уровня ее низкотемпературной устойчивости для успешной перезимовки в суровых климатических условиях криолитозоны Якутии.
Таким образом, с использованием специфических антител в побегах лиственницы Каяндера (Larix cajanderi) в условиях многолетней мерзлоты Центральной Якутии изучены особенности стрессовых белков-дегидринов и их изменения в годичном цикле. Характер сезонных изменений, значительное разнообразие состава и связанный с морозоустойчивостью высокий уровень данных белков в побегах L. cajanderi указывают на важную роль дегидринов в общих механизмах формирования низкотемпературной устойчивости при адаптации древесных растений к экстремально холодному климату криолитозоны.
Работа выполнена в рамках государственного задания Минобрнауки России по проекту “Исследование биогеохимических циклов и адаптивных реакций растений бореальных и арктических экосистем северо-востока России” (код научной темы: FWRS-2021-0024; № гос. регистрации в ЕГИСУ: ААААА-21-121012190034-2).
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит исследований с участием людей и животных в качестве объектов изучения.
Список литературы
Абаимов А.П., Коропачинский И.Ю. Лиственницы Гмелина и Каяндера. Новосибирск: Наука, 1984. 121 с.
Коропачинский И.Ю., Встовская Т.Н. Древесные растения Азиатской России. Новосибирск: изд-во СО РАН, филиал “Гео”, 2002. 707 с.
Kosova K., Prasil I.T., Vitamvas P. Role of dehydrins in plant stress response / Handbook of Plant and Crop Stress. Tucson: CRC. 2010. P. 239.
Hara M. The multifunctionality of dehydrins // Plant Signal. Behav. 2010. V. 5. P. 503. https://doi.org/10.4161/psb.11085
Hanin M., Brini F., Ebel C., Toda Y., Takeda S., Masmoudi K. Plant dehydrins and stress tolerance. Versatile proteins for complex mechanisms // Plant Signal. Behav. 2011. V. 6. P. 1503. https://doi.org/10.4161/psb.6.10.17088
Malik A.A., Veltri M., Boddington K.F., Singh K.K., Graether S.P. Genome analysis of conserved dehydrin motifs in vascular plants // Front. Plant Sci. 2017. V. 8. P. 1. https://doi.org/10.3389/fpls.2017.00709
Chang C.Y., Bräutigam K., Huner N.P., Ensminger I. Champions of winter survival: cold acclimation and molecular regulation of cold hardiness in evergreen conifers // New Phytol. 2021. V. 229. P. 675. https://doi.org/10.1111/nph
Close T.J. Dehydrins: emergence of a biochemical role of a family of plant dehydration proteins // Physiol. Plant. 1996. V. 97. P. 795. https://doi.org/10.1111/j.1399-3054.1996.tb00546.x
Аллагулова Ч.Р., Гималов Ф.Р., Шакирова Ф.М., Вахитов В.А. Дегидрины растений: их структура и предполагаемые функции // Биохимия. 2003. Т. 68. № 9. С. 1157.
Eriksson S.K., Kutzer M., Procek J., Gröbner G., Harryson P. Tunable membrane binding of the intrinsically disordered dehydrin Lti30, a cold-induced plant stress protein // Plant Cell. 2011. V. 23. P. 2391.
Welling A., Palva E.T. Molecular control of cold acclimation in trees // Physiol. Plant. 2006. V. 127. P. 167.
Cuevas-Velazquez C.L., Rendón-Luna D.F., Covarrubias A.A. Dissecting the cryoprotection mechanisms for dehydrins // Front. Plant Science. 2014. V. 5. P. 1. https://doi.org/10.3389/fpls.2014.00583
Perdiguero P., Barbero M.C., Cervera M.T., Soto A., Collada C. Novel conserved segments are associated with differential expression patterns for Pinaceae dehydrins // Planta. 2012. V. 236. P. 1863. https://doi.org/10.1007/s00425-012-1737-4
Sena J.S., Giguère I., Rigault P., Bousquet J., Mackay J. Expansion of the dehydrin gene family in the Pinaceae is associated with considerable structural diversity and drought-responsive expression // Tree Physiol. 2018. V. 38. P. 442. https://doi.org/10.1093/treephys/tpx125
Yakovlev I.A., Asante D.K., Fossdal C.G., Partanen J., Junttila O., Johnsen O. Dehydrins expression related to timing of bud burst in Norway spruce // Planta. 2008. V. 228. P. 459. https://doi.org/10.1007/s00425-008-0750-0
Kjellsen T.D., Yakovlev I.A., Fossdal C.G., Strimbeck G.R. Dehydrin accumulation and extreme low-temperature tolerance in Siberian spruce (Picea obovata) // Tree Physiol. 2013. V. 33. P. 1354. https://doi.org/10.1093/treephys/tpt105
Rigault P., Boyle B., Lepage P., Cooke J.E.K., Bousquet J., MacKay J.J. A white spruce gene catalog for conifer genome analyses // Plant Physiol. 2011. V. 157. P. 14. https://doi.org/10.1104/pp.111.179663
Velasco-Conde T., Yakovlev I., Majada J.P., Aranda I., Johnsen O. Dehydrins in maritime pine (Pinus pinaster) and their expression related to drought stress response // Tree Genet. Genom. 2012. V. 8. P. 957. https://doi.org/10.1007/s11295-012-0476-9
Welling A., Rinne P., Vihera-Aarnio A., Kontunen-Soppela S., Heino P., Palva E.T. Photoperiod and temperature differentially regulate the expression of two dehydrin genes during overwintering of birch (Betula pubescens Ehrh.) // J. Exp. Bot. 2004. V. 55. P. 507.
Kontunen-Soppela S., Laine K. Seasonal fluctuation of dehydrins is related to osmotic status in Scots pine needles // Trees. 2001. V. 15. P. 425. https://doi.org/10.1007/s004680100124
Korotaeva N.E., Oskorbina M.V., Kopytova L.D., Suvorova G.G., Borovskii G.B., Voinikov V.K. Variations in the content of stress proteins in the needles of common pine (Pinus sylvestris L.) within an annual cycle // J. For. Res. 2012. V. 17. P. 89. https://doi.org/10.1007/s10310-011-0260-y
Коротаева Н.Е., Иванова М.В., Суворова Г.Г., Боровский Г.Б. Дегидрины в адаптации сосны обыкновенной и ели сибирской к условиям произрастания в период вегетации // Сибирский лесной журнал. 2020. № 6. С. 54. https://doi.org/10.15372/SJFS20200605
Petrov K.A., Sofronova V.E., Bubyakina V.V., Perk A.A., Tatarinova T.D., Ponomarev A.G., Chepalov V.A., Okhlopkova Zh.M., Vasilieva I.V., Maximov T.Chr. Woody plants of Yakutia and low-temperature stress // Russ. J. Plant Physiol. 2011. V. 58. P. 1011. https://doi.org/10.1134/S1021443711060148
Tatarinova T.D., Perk A.A., Bubyakina V.V., Vasilieva I.V., Ponomarev A.G., Maximov T.C. Dehydrin stress proteins in Pinus sylvestris L. needles under conditions of extreme climate of Yakutia // Dokl. Biochem. Biophys. 2017. V. 473. P. 98. https://doi.org/10.7868/S0869565217080242
Chang C.Y., Fréchette E., Unda F., Mansfield S.D., Ensminger I. Elevated temperature and CO2 stimulate late-season photosynthesis but impair cold hardening in pine // Plant Physiol. 2016. V. 172. P. 802. https://doi.org/10.1104/pp.16.0075
Тимофеев П.А. Деревья и кустарники Якутии. Якутск: Бичик, 2003. 64 с.
Уткин А.И. Леса Республики Саха (Якутия) – феномен таежного пояса северной Евразии // Хвойные бореальной зоны. 2006. Т. 23. № 3. С. 7.
Миронов П.В., Левин Э.Д. Переохлаждение и обезвоживание хвойных зачатков в зимующих почках лиственницы сибирской // Физиология растений. 1985. Т. 32. С. 695.
Ваганов Е.А., Круглов В.Б. Экология древесных растений. Красноярск: Сибирский федеральный университет, 2007. 229 с.
Bubyakina V.V., Tatarinova T.D., Ponomarev A.G., Perk A.A., Solomonov N.G. Characteristics of seasonal dynamics of Betula platyphylla Sukacz. dehydrins associated with frost hardiness development under the cryolitic zone conditions // Dokl. Biol. Sci. 2011. V. 439. P. 258. https://doi.org/10.1134/S0012496611040193
Ponomarev A.G., Tatarinova T.D., Perk A.A., Vasilieva I.V., Bubyakina V.V. Dehydrins associated with the development of frost resistance of Asian white birch // Russ. J. Plant Physiol. 2014. V. 61. P. 105. https://doi.org/10.1134/S1021443713060095
Tatarinova T.D., Bubyakina V.V., Vetchinnikova L.V., Perk A.A., Ponomarev A.G., Vasilieva I.V. Dehydrin stress proteins in birch buds in regions with contrasting climate // Cell Tissue Biol. 2017. V. 11. P. 483. https://doi.org/10.1134/S1990519X17060098
Перк А.Я., Перк А.А. Изучение морозоустойчивости плодово-ягодных растений методом электропроводности // Исследование биологических ресурсов в Якутии. Якутск: изд-во ЯФ СО РАН СССР, 1978. С. 54.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding // Anal. Biochem. 1976. V. 72. P. 248.
Laemmli U. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 // Nature. 1970. V. 227. P. 680.
Timmons T.M., Dunbar B.S. Protein blotting and immunodetection // Meth. Enzymol. 1990. V. 182. P. 679.
Vornam B., Gailing O., Derory J., Plomion C., Kremer A., Finkeldey R. Characterization and natural variation of a dehydrin gene in Quercus petraea (Matt.) Liebl. // Plant Biol. 2011. V. 13. P. 881. https://doi.org/10.1111/j.1438-8677.2011.00446.x
Karlson D.T., Zeng Y.V.E., Stirm R., Joly J., Ashworth E.N. Photoperiodic regulation of a 24-kDa dehydrin-like protein in red-osier dogwood (Cornus sericea L.) in relation to freeze-tolerance // Plant. Cell. Physiol. 2003. V. 44. P. 25. https://doi.org/10.1093/pcp/pcg006
Rinne P., Welling A., Kaikuranta P. Onset of freezing tolerance in birch (Betula pubescens Ehrh.) involves LEA proteins and osmoregulation and is impaired in an ABA-deficient genotype // Plant Cell Environ. 1998. V. 21. P. 601. https://doi.org/10.1046/j.1365-3040.1998.00306.x
Strimbeck G.R., Schaberg P.G., Fossdal C.G., Schroder P.W., Kjellsen T.D. Extreme low temperature tolerance in woody plants // Front. Plant Science. 2015. V. 6. P. 1. https://doi.org/10.3389/fpls.2015.00884
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


