Генетика, 2019, T. 55, № 1, стр. 81-93
Новый случай рекомбинации между ядерным и митохондриальным геномами в роде Calliope Gould, 1836 (Muscicapidae, Aves): гипотеза происхождения Calliope pectoralis Gould, 1837
Л. Н. Спиридонова 1, *, О. П. Вальчук 1, Я. А. Редькин 2
1 Федеральный научный центр биоразнообразия Дальневосточного отделения
Российской академии наук
690022 Владивосток, Россия
2 Научно-исследовательский Зоологический музей Московского государственного университета
им. М.В. Ломоносова
125009 Москва, Россия
* E-mail: spiridonova@biosoil.ru
Поступила в редакцию 01.02.2018
После доработки 03.04.2018
Принята к публикации 07.03.2018
Аннотация
Впервые предложена гипотеза гибридного происхождения Calliope pectoralis от видов С. calliope и C. obscura на основе молекулярно-генетических данных и фенотипических признаков. Исследованы 80 образцов С. calliope и один образец С. pectoralis tschebaiewi. Получаемый в результате ПЦР продукт гена цитохрома b, три транспортных РНК, ND6 и контрольный регион (3.2 тпн), у 22 особей С. calliope имел гетерогенную природу по типу гетероплазмии. Результат клонирования этих ампликонов показал два варианта клонов: ген цитохрома b С. calliope и ядерный псевдоген, гомологичный гену цитохрома b С. pectoralis (сходство 96%). Реконструкция связей мт-гаплотипов гена цитохрома b и его ядерных копий распределила клонированные последовательности в двух кладах – C. calliope и C. pectoralis. Мы полагаем, что в данном случае имело место межгеномное рекомбинационное событие – перенос ядерной копии гена цитохрома b C. calliope в митохонриальный геном у гибридной самки, ставшей основателем вида С. pectoralis. Второй вид, участвовавший в гибридизации с C. calliope, по морфологическим признакам, вероятно, был C. obscura, так как только он из всех видов Calliope имеет черную грудь и черные с белыми основаниями внешние рулевые перья, похожие на таковые у C. pectoralis.
Изучение молекулярных маркеров митохондриальной ДНК с целью видовой идентификации (ДНК-кодирования) привело к появлению целого ряда “ложных” таксонов и связано в первую очередь с ядерными копиями митохондриальных генов (NUMT), коамплифицирующимися вместе с ортологичными генами митохондриальной ДНК [1]. NUMT считают фрагментами древней мтДНК и предлагают использовать в качестве базальных ветвей филогенетических деревьев митохондриальных маркеров для реконструкции предкового состояния митохондриального генома [2]. Однако в работе Б.В. Андрианова с соавторами получены данные, указывающие на высокую степень изменчивости псевдогенов митохондриального происхождения после их интеграции в хромосомы, что противоречит представлению о них как о “молекулярных ископаемых” [3].
Ядерные копии мтДНК чаще всего считают помехами, которые приводят к ошибочным построениям филогений таксонов разного ранга [4], что справедливо в тех случаях, когда ядерные копии амплифицируются у одних таксонов, а митохондриальные гены у других, поскольку сравниваемые последовательности имеют разные источники происхождения [5–7]. Использование митохондриальных генов и их фрагментов в качестве маркеров эволюционного процесса некоторыми исследователями ставится под сомнение, поскольку во многих случая доказана неравномерность мутирования митохондриальных генов и их частей [8]. Наряду с этим обнаружены факты нарушения материнского наследования митохондрий, описаны рекомбинации мтДНК, гетероплазмия и высокий уровень индивидуального гаплотипического разнообразия [9, 10].
Несмотря на общепринятое негативное мнение о ядерных копиях митохондриальных генов, наши данные показывают в некоторых случаях потенциальную важность использования NUMT для уточнения филогенетических построений. Ранее при изучении подвидов С. calliope (Pallas, 1776) нами была показана роль митохондриальных псевдогенов как источника новых вариантов подвидовых гаплотипов мтДНК [11]. Анализ митохондриальных генов и их ядерных копий отдельных представителей рода Calliope Gould, 1836 выявил новые факты, подтверждающие важную роль митохондриальных псевдогенов в поддержании генетического разнообразия мтДНК. Объектом данного исследования стал черногрудый соловей-красношейка C. pectoralis Gould, 1837, проблема происхождения которого заслуживает специального комментария.
Выделение соловьев-красношеек в качестве самостоятельного рода Calliope из большой, морфологически очень неоднородной группы “соловьев” Luscinia s. l., основанное на результатах современных филогенетических построений [12, 13], получило широкое признание и было принято в основных современных списках птиц Мира [14, 15]. В состав данного рода вошли политипические виды C. calliope и C. pectoralis и два монотипических вида – C. pectardens David, 1877 и C. obscura (Berezowski et Bianchi, 1891). Большинство представителей рода Calliope населяют горные районы Азии (рис. 1).
Рис. 1.
Ареалы видов Calliope и их подвидов: C. calliope (1 – C. c. calliope; 2 – С. c. beicki), С. pectoralis (3 – С. p. tschebaiewi; 4 – С. p. confusa; 5 – С. p. pectoralis; 6 – С. p. ballioni), 7 – C. obscura.
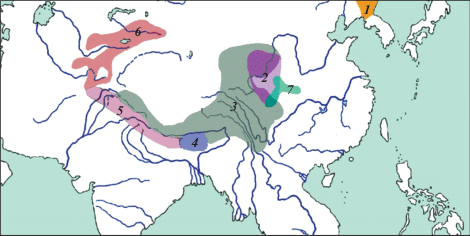
Черногрудый красношейка, представленный рядом подвидов, распространен от Тянь-Шаня и Памиро-Алая, через Гималаи до восточного Цинхая, Ганьсу и западной части провинции Сычуань [16]. Собственно соловей-красношейка C. calliope, широко распространенный на большей части Сибири и Дальнего Востока [17], в Центральном Китае представлен изолированной горной формой С. c. beicki (Meise, 1937). Монотипические виды C. pectardens и C. obscura населяют горы Южного и Центрального Китая [15].
C. pectoralis высокогорный вид, населяющий альпийские и субальпийские луга с кустарниковой растительностью, образует ряд хорошо обособленных подвидов [14, 16, 18–20]. C. p. pectoralis населяет южный макросклон Гималаев от Каракорума до восточных районов Непала; C. p. confusa (E. Hartert, 1910) обитает восточнее – в северо-восточных частях Индии и Бутане; самая северная форма C. p. ballioni (Severtsov, 1873) занимает горные системы Памиро-Алая и Тянь-Шаня. Наконец, ареал морфологически обособленной формы C. p. tschebaiewi Przevalski, 1876, простирается вдоль северного макросклона Гималаев от южной оконечности Каракорума до крайнего севера Мьянмы, Юннани, а также охватывает западную часть провинции Сычуань, Ганьсу и Восточный Цинхай (см. рис. 1).
Согласно мнению многих исследователей, таксономический статус C. p. tschebaiewi нуждается в переоценке. Еще Ч. Вори [18] указывал на то, что pectoralis и tschebaiewi могут быть разными видами. Исследуя вариации размеров и окраски подвидов С. pectoralis, В.М. Лоскот и К.К. Далецкая [16] пришли к выводу о наибольшей дивергенции С. p. tschebaiewi от других подвидов, возможно соответствующей видовому статусу. С учетом того, что в коллекциях не были найдены особи со строго промежуточными признаками между tschebaiewi и другими подвидами, авторы предложили считать эту форму мегаподвидом [16]. Позже П. Расмуссэн и Дж. Андертон [20] высказали мнение о промежуточном положении формы C. p. tschebaiewi между видами C. calliope и C. pectoralis по морфологическим признакам. По мнению этих же авторов, поскольку вокализация всех трех таксонов (calliope, pectoralis и tschebaiewi) очень сходна, в дальнейшем они могут рассматриваться либо в составе единого политипического вида, либо в качестве трех самостоятельных видов. И наконец, Я. Лю с соавт. [21] на основании данных мультилокусного анализа по двум митохондриальным и двум ядерным генам, а также по результатам сравнения вокализации и внешним морфологическим отличиям предлагают рассматривать форму tschebaiewi в качестве отдельного монотипического вида. Данная точка зрения отражена и в последнем списке воробьинообразных птиц Мира [15].
Гипотез о гибридном генезисе черногрудого красношейки С. pectoralis s. l. ранее не высказывалось, хотя на явно промежуточный характер признаков C. p. tschebaiewi некоторые исследователи обращали специальное внимание [20]. В нашей работе мы рассматриваем гипотезу гибридного происхождения С. pectoralis от видов С. calliope и С. obscura, основываясь на молекулярных данных и морфологическом облике обcуждаемых таксонов. Помимо этого представляем очередной случай прошедшего рекомбинационного события между гомологичными последовательностями ядерного и митохондриального геномов, в результате которого возник митохондриальный гаплотип С. pectoralis.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы ДНК и амплификация гена цитохрома b мтДНК. Исследованы 80 образцов С. calliope, отловленных в окрестностях станции кольцевания “Амуро-Уссурийского центра биоразнообразия птиц” (Приморский край, долина р. Литовка, N 42.962°; E 132.80°) в период осенней миграции 2011 г., и один образец С. pectoralis tschebaiewi, собранный на севере Мьянмы, штат Качин (N 27.489°; E 97.191°) (сборы В.Н. Сотникова). ДНК выделяли из образцов крови, фиксированной в 96%-ном этаноле, с помощью набора QIAgen DNeasy® Tissue Kit (Qiagen, Inc.). Мы использовали последовательности гена cytb из Генбанка NCBI: C. p. pectoralis (Гималаи, KJ456329), C. p. ballioni (Казахстан, HM633321). Необходимо отметить, что молекулярный анализ мигрантов С. calliope проводился в отсутствие образцов С. pectoralis. Амплификация фрагмента митохондриальной ДНК (мтДНК), включающего ген cytb, три т-РНК, ND6 и CR, и секвенирование на его основе гена cytb проведены, как описано в работе [11].
Клонирование фрагментов. Гетерогенные фрагменты восьми особей проклонированы с помощью набора InsTAcloneTM PCR cloning Kit (Fermentas, Litva) согласно инструкции производителя. Для легирования применили вектор pTZ57R/T. Трансформацию проводили в компетентные клетки Escherichia coli штамма XL1-Blue. Тестирование клонов на наличие вставки осуществляли с праймерами M13/pUCfw (5'-GCCAGGGTTTTCCCAGTCACGA-3') и M13/pUCrv (5'-GAGCGGATAACAATTTCACACAGG-3') при следующих условиях: преденатурация – 2 мин/94°C, затем 35 циклов: денатурация – 30 с/94°C, отжиг – 30 с/55°С, синтез – 1 мин/72°C, окончательный синтез – 5 мин/72°C. Все этапы эксперимента были проведены дважды, чтобы подтвердить воспроизводимость результатов. Клонированные последовательности гена cytb депонированы в Генбанк ENA/EMBL под номерами доступа LT991756–LT991862.
Секвенирование и компьютерная обработка последовательностей. Продукты амплификации были использованы для циклического секвенирования с набором реагентов ABI PRISM®BigDyeTM Terminator v. 3.1. Реакцию присоединения метки проводили с теми же праймерами. Результаты прочитывали на автоматическом лазерном секвенаторе ABI PRISM 3130 (Applied Biosystems, USA/Hitachi, Japan).
Прямые и обратные последовательности были собраны в пакете программ Staden 1.53 [22] и выровнены в программе Clustal W, предложенной в MEGA ver. 6 [23]. Для анализа нуклеотидного разнообразия клонов и построения матрицы полиморфных сайтов использовали программу DnaSP ver. 5.0 [24]. Реконструкция филогенетических связей между гаплотипами методом максимально правдоподобия (Maximum Likelihood, ML) проведена также в MEGA.
Секвенирование митохондриального фрагмента (3.2 тпн) от особи-мигранта № 16 проведено методом пиросеквенирования на Roche GS Junior. Приготовление быстрой библиотеки с лигированными адаптерами, проведение эмульсионной ПЦР, секвенирование с реагентами GS Junior Titanium Series выполнялись согласно инструкциям фирмы-изготовителя прибора и реактивов (454 Life Science Corp., Roche Company, Branford, CT 06405, USA). Работа выполнена на оборудовании ЦКП “Биотехнология и генетическая инженерия” ФНЦ Биоразнообразия ДВО РАН. Нуклеотидные последовательности собирали с помощью программы GS De Novo Assembler (http://454.com/ products/analysis-software/index.asp). Секвенирование фрагмента прошло со средним покрытием ×100–300. Для подтверждения рекомбинационного события между ядерным и митохондриальным геномами проведено тестирование ядерного псевдогена и соответствующих фрагментов мтДНК C. calliope, C. pectoralis, Luscinia svecica (Linnaeus, 1758), Larvivora akahige (Temminck, 1835) и Tarsiger cyanurus (Pallas, 1773) в программе RDP ver. 4 [25].
РЕЗУЛЬТАТЫ
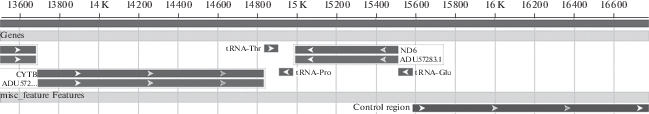
Причиной появления данного исследования стали рутинные эксперименты подбора условий амплификации длинных фрагментов для дальнейшего использования на секвенаторе нового поколения Roche 454. Анализ фрагмента длиной около 3.2 тнп, включающего ген cytb, три т-РНК, ND6 и CR (рис. 2), выявил в последовательностях 22 из 80 исследуемых особей С. calliope присутствие двойных пиков по типу гетероплазмии. В результате клонирования ампликонов от восьми особей получены 162 клона гена cytb, в среднем по 20 клонов от каждого фрагмента.
Рис. 2.
Схема амплифицированного фрагмента митохондриальной ДНК, включающего ген cytb, т-РНК, ND6 и контрольный регион (D-петля) (3.2 тпн), из которого был секвенирован ген cytb (1141 пн).
Последовательности клонов сравнивали с ранее выявленными гаплотипами подвидов С. calliope и с последовательностями, хранящимися в базе данных Генбанка NCBI. Картина распределения гетероплазмичных сайтов в данном случае оказалась иной, чем в предыдущих анализах [11]. Один вариант клонов у всех птиц оказался геном cytb мтДНК С. calliope, а второй по распределению фиксированных мутаций был сходным на 96% с геном cytb С. pectoralis.
В некоторых клонированных последовательностях обнаружены митохондрильные стоп-кодоны (TAA), единичные делеции, приводящие к сдвигу рамки считывания, и 11 терминирующих TGA-кодонов (“opal” или “umber”). Анализ клонированных последовательностей выявил высокий уровень изменчивости, обусловленный хаотично распределенными единичными мутациями и многочисленными рекомбинационными перестройками между разными вариантами гаплотипов, представленных в ядерном геноме С. calliope (рис. 3). Например, длина рекомбинантных участков в клонированных фрагментах варьировала от 85 пн у клона 16.6 (образец № 16) до 869 пн у клона 6.2 (образец № 6). Необходимо особо отметить, что вставки других вариантов гаплогрупп, обнаруженные в ядерных копиях митохондриальных генов у одной особи, свидетельствуют о высокой скорости изменчивости псевдогенов благодаря рекомбинационным процессам самой ядерной ДНК. Картина распределения нуклеотидов в ядерных псевдогенах calliope и гене cytb С. pectoralis имеет хорошо выраженную гомологию, что указывает на их общее происхождение. В то же время необходимо отметить и значительную дивергенцию между ядерным псевдогеном C. calliope и митохондриальным геном cytb С. pectoralis, что обусловлено длительным пребыванием паралога в ядерном геноме после рекомбинационного события.
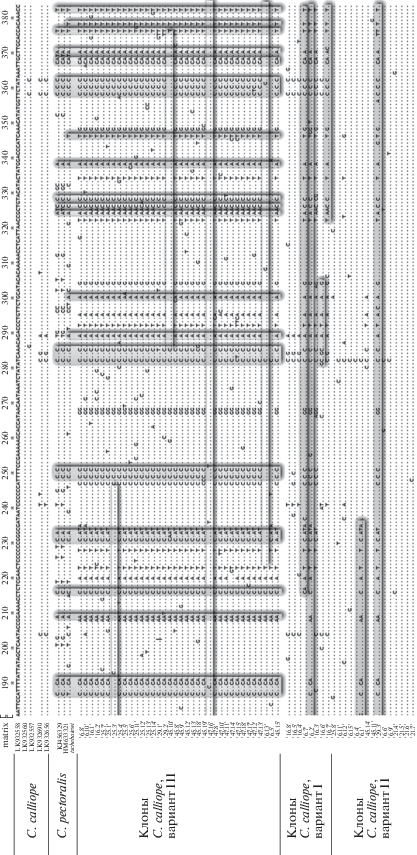
Рис. 3.
Матрица полиморфных сайтов гена cytb мтДНК C. calliope и C. pectoralis и клонированных ядерных копий C. calliope. Серым цветом выделены вертикально сайты, идентичные для C. pectoralis и ядерных копий C. calliope, горизонтально – рекомбинантные участки вариантов ядерного псевдогена C. calliope. Цифрами обозначены номера птиц-мигрантов C. calliope и их клонов.
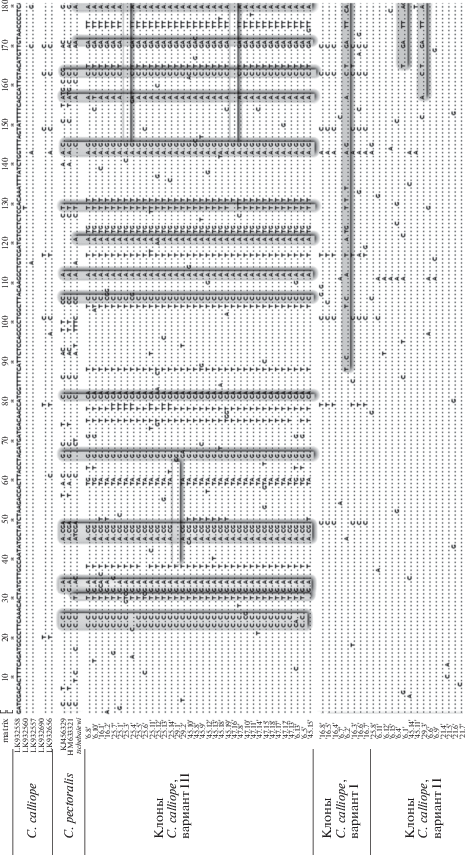
Рис. 3.
Окончание.
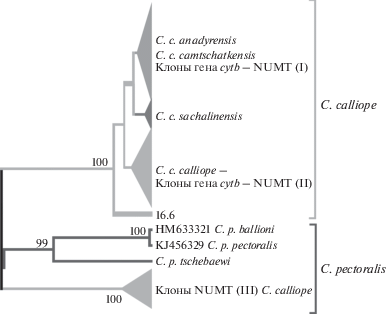
На рис. 4 показаны отношения видов C. calliope и C. pectoralis и клонированных последовательностей C. calliope. Реконструкция связей мт-гаплотипов гена cytb и его ядерных копий методом максимального правдоподобия показала, что все клоны распределились в трех кладах – C. calliope (I и II вариант) и C. pectoralis (III вариант). Полученный результат указывает на родственную связь ядерного псевдогена С. calliope и митохондриального гена С. pectoralis. Поскольку ядерный паралог и митохондриальный ген находятся в разных геномах, то мы полагаем, что имело место межгеномное рекомбинационное событие, как и в случае происхождения подвидовых гаплотипов C. calliope [11, 17].
Рис. 4.
Реконструкция филогенетических связей митохондриальных гаплотипов С. pectoralis и ядерных копий митохондриальных генов С. calliope, построенная по методу ML. I, II и III – варианты клонов.
Для подтверждения рекомбинационного события между ядерным псевдогеном и мтДНК было проведено тестирование NUMT и фрагментов мтДНК C. calliope, C. pectoralis, Luscinia svecica, Larvivora akahige и Tarsiger cyanurus в программе RDP ver. 4. В результате фрагмент cytb–CR мтДНК C. pectoralis оказался рекомбинантным с достоверными значениями вероятности (Chimaera, P = 1.458 × 10–04; MaxChi, P = 3.322 × 10–05; GENECONV, P = 1.123 × 10–08; SiScan, P = 5.562 × × 10–13).
ОБСУЖДЕНИЕ
Популяционные исследования митохондриальных маркеров у многих таксонов птиц выявляют две филогеографические картины. Одна из них характеризуется отсутствием хорошо выраженной филогеографической структуры и описана, например, для Parus major s.l., P. montanus s.l. [26], Perisoreus infaustus, Nucifraga caryocatactes [27], Nucifraga columbiana [28], Luscinia svecica [29]. Другая картина, наоборот, имеет хорошо выраженную филогеографическую структуру и обнаружена у C. calliope [17], Motacilla flava s.l., M. citreola s.l. [30], Ficedula parva s.l. и Alauda arvensis s.l. [31], Pinicola enucleator [32]. Причины таких явлений обычно объясняются событиями ледникового периода. Комплекс C. pectoralis по данным митохондриального маркера (cytb) характеризуется хорошо выраженной филогеографической структурой и, по мнению Я. Лю с соавторами, отделился от ближайшего родственника, C. calliope, распространенного севернее, в период раннего плиоцена (3.2–4.8 млн лет назад) [21].
Ранее на примере соловья-красношейки мы показали альтернативные пути формирования филогеографической структуры вида с участием ядерных псевдогенов [17]. Наши данные предполагают аналогичный сценарий формирования филогеографической структуры и для комплекса C. pectoralis. Обнаруженные у C. calliope ядерные копии гена cytb мтДНК сходны с митохондриальным геном С. pectoralis. Как можно объяснить такую гомологию последовательностей из разных геномов и у разных таксонов? Теоретически существуют два пути формирования дивергированных гаплотипов мтДНК: первый – постепенное накопление замен в результате длительного пребывания популяций в изоляции и второй – межвидовая гибридизация, в результате которой появляется новый вариант гаплотипа, не свойственный данному таксону. Однако сходство распределения полиморфных сайтов между мтДНК и ее ядерными копиями невозможно объяснить ни одним из этих путей. Третий путь, который здесь рассматривается, – обычная гомологичная рекомбинация между ядерным и митохондриальным геномами, которая внезапно приводит к смене мт-гаплотипа на новый, уже имеющийся в ядерном геноме паралог мтДНК.
Кроссинговер между гомологичными участками ядерного и митохондриального геномов и перенос ядерной копии гена cytb в мтДНК мог произойти в геноме гибридной самки, ставшей основателем вида С. pectoralis. Следовательно, C. pectoralis получил свой мт-гаплотип из ядерных псевдогенов C. calliope (одного из родителей). Транспорт нуклеиновых кислот различной длины в митохондрии и механизмы, с помощью которых происходят эти процессы, описаны в литературе [33, 34]. В обнаруженном рекомбинационном событии нам пока не удалось определить полную длину рекомбинантного фрагмента, которая может оказаться весьма значительной, как было установлено на примере домашней кошки [35]. Однако присутствие в нем гена cytb и контрольного региона (CR) установлено экспериментально.
Рекомбинационное событие, возможно, произошло во время или вскоре после межвидовой гибридизации на периферии современного ареала C. calliope beicki и ареала С. obscura. Низкая численность особей, вероятнее всего в районе, где располагается их современная зона контакта c подвидом C. p. tschebaiewi, способствовала последующему распространению рекомбинантного мт-гаплотипа по типу эффекта основателя (см. рис. 1). Это дало возможность новому гаплотипу закрепиться и стать таксон-специфичным по мере заселения новых территорий. Обратное предположение о внедрении митохондриального гаплотипа C. p. tschebaiewi в ядерный геном C. calliope представляется маловероятным по нескольким причинам. Во-первых, из-за значительной удаленности мест, где был обнаружен ядерный псевдоген (российский ДВ), и, во-вторых, высоким гнездовым консерватизмом этих видов соловьев.
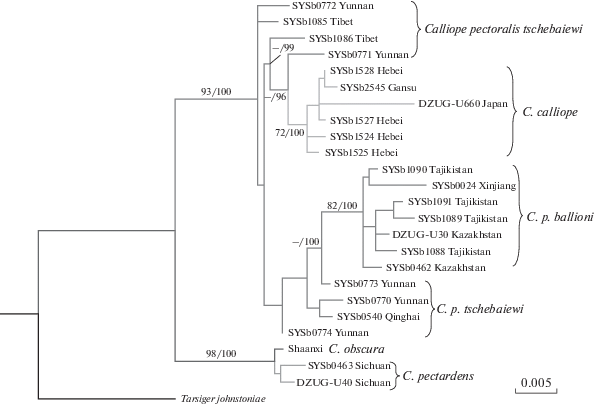
На рис. 5 показаны отношения видов Calliope по двум ядерным генам, взятые из работы Лю с соавт. [21]. Особенно хочется обратить внимание на разделение комплекса С. pectoralis на две филетические линии, одна из которых близка к С. calliope, а вторая незначительно дивергировала, однако обе находятся в кладе последнего вида. Данный результат полностью согласуется с нашими данными и подтверждает гипотезу гибридного происхождения вида С. pectoralis от C. calliope.
Рис. 5.
Филогенетические взаимосвязи четырех видов Calliope, построенные на основе объединенных последовательностей ядерного миоглобина и ODC гена (1364 пн) [21].
Межвидовая гибридизация у птиц случается достаточно часто и отмечена примерно для 850 видов [36]. Однако обособление межвидовых гибридов в отдельный вид и возникновение прекопуляционных изолирующих механизмов случается редко. Не так давно в результате естественной гибридизации большого кактусового земляного вьюрка Geospiza conirostris со средним земляным вьюрком G. fortis в течение нескольких поколений сформировался новый вид дарвиновых вьюрков [37]. Особи нового вида птиц отличаются от родительских видов формой и размерами клюва, имеют другую вокализацию и спариваются только с представителями своего вида. Вероятно таким же путем произошел комплекс С. pectoralis.
По данным митохондриальных маркеров время дивергенции по “молекулярным часам” между гаплотипами С. calliope и С. pectoralis оценено в 4 млн лет [21]. Результаты нашего исследования ставят под сомнение возможность использования “молекулярных часов”, поскольку происходит не только резкая смена гаплотипа, но накопление мутаций идет вначале в ядерном геноме. Сравнивая генетическое сходство (96%) ядерных копий мтДНК С. calliope и митохондриального гаплотипа cytb С. pectoralis со случаем, описанным в нашей предыдущей работе [11], можно лишь отметить, что становление последнего вида в результате гибридизации произошло раньше, чем возникновение подвидов С. calliope, поскольку сходство гена cytb и его ядерных копий у С. calliope выше (до 100%) по сравнению с таковыми у С. pectoralis.
Помимо генетических данных, указывающих на гибридное происхождение С. pectoralis, мы провели фенотипическое сравнение возможных участников гибридизации, в результате которой возник этот вид. По внешним морфологическим признакам представители рода Calliope отличаются достаточно четко, в первую очередь благодаря особенностям окраски оперения (рис. 6). Для черногорлого соловья C. obscura характерна черновато-синяя окраска верха у взрослых самцов, отсутствие депигментированных участков по бокам темени (“белых бровей”) и по бокам горла (“усов”), наличие широких белых полей в основании рулевых перьев (за исключением центральной пары) и относительно короткий хвост. При этом у взрослых особей окраска пигментированных частей рулевых перьев полностью черная. Для самцов черногорлого соловья свойственна полностью черная окраска боков головы, горла и груди, образующая широкий черный пластрон, резко контрастирующий с преимущественно белой окраской живота.
Рис. 6.
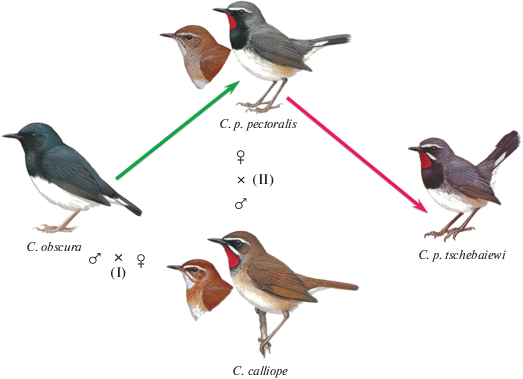
Схема двух событий межвидовой гибридизации (I и II) с полом птиц каждого родительского вида, в результате которых возникли подвиды C. pectoralis. Зеленая стрелка указывает форму, возникшую в результате гибридизации (I); красная стрелка – форму, возникшую в результате гибридизации (II). (Цветные фотографии см. статью в электронном виде.)
Соловей-красношейка C. calliope отличается наличием у самцов резко выраженного цветного пластрона (образованного перьями с ярко-красными вершинами и белыми основаниями), охватывающего подбородок, горло и верхнюю часть зоба, резко оконтуренного черными перьями челюстного штриха по бокам горла, переходящего в серый оттенок на боках зоба и груди. Для обоих полов характерна своеобразная топография окраски головы, обусловленная наличием четко выраженных светлых бровей (над глазом и кроющими уха), а также светлых “усов” (продольных полос, протягивающихся от основания подклювья ниже темного оперения уздечки и уха). Как для самцов, так и для самок характерна оливково-бурая окраска верхней стороны головы и тела, одноцветная (без белых полей) окраска рулевых того же оттенка, а также относительно большая длина хвоста.
Для подвидов черногрудого красношейки С. pectoralis свойственны внешние признаки, в различной степени переходные между черногорлым соловьем и соловьем-красношейкой. Подвиды С. p. pectoralis, С. p. ballioni и C. p. confusa обладают оливково-голубовато-серой окраской верхней стороны тела; у самцов на подбородке и горле выражено относительно небольшое красное пятно, со всех сторон окруженное полностью черным пластроном (перья уздечки, передней и нижней частей кроющих уха, боков горла, зоба и большей части груди), у обоих полов выражена белая бровь, которая при этом заметно короче, чем у C. calliope, и заканчивается сразу позади глаза. Хвост длиннее, чем у C. obscura, но в среднем короче, чем у соловья-красношейки. У самцов рулевые центральной пары целиком буровато-серые, а пигментированные части прочих перьев хвоста черные, тогда как основания большинства из них белые, при этом ширина депигментированных участков в среднем меньше, чем у черногорлого соловья. Уникальной чертой окраски всех черногрудых красношеек является наличие округлых белых пятен на вершинах большинства рулевых перьев (за исключением центральной пары), в меньшей степени выраженные или отсутствующие у самок и молодых птиц [16].
Вторым родительским видом С. pectoralis, судя по морфологическим признакам, мог быть C. obscura. Из всех видов соловьев только этот вид имеет черные горло и грудь. C. pectoralis сохранил фенотипические признаки обоих предполагаемых родителей. Самцы имеют красное горло и белые брови (C. p. tschebaiewi еще и белые усы) от C. calliope; черную грудь и черные, с белыми основаниями, внешние рулевые перья от C. obscura. Самки похожи на самок C. calliope, но более темные и серые. Молодые птицы похожи на таковых C. calliope. Отличается C. pectoralis как от C. calliope, так и от C. obscura белыми кончиками рулевых, характерными только для представителей комплекса черногрудых красношеек.
C. p. tschebaiewi морфологически резко отличается от других подвидов черногрудой красношейки, приближаясь по целому ряду признаков к C. calliope. Красное пятно у самцов этой формы заметно больше, чем у всех других подвидов черногрудого красношейки (помимо подбородка и горла охватывает верхнюю часть зоба), и сходно по размерам с таковым у C. calliope. Охватывающий цветовое пятно черный пластрон на груди значительно меньше, чем у других С. pectoralis. Светлая бровь над глазом в среднем длиннее, чем у черногрудого красношейки. Ниже кроющих уха, по бокам горла хорошо выражена белая полоса (ус), совершенно сходная с таковой у C. calliope. Окраска верхней стороны тела серовато-оливковая у самцов и оливково-бурая у самок, в наибольшей степени приближающаяся к расцветке верхней стороны тела соловья-красношейки. Белые пятна на вершинах рулевых мельче, чем у других подвидов С. pectoralis, или отсутствуют у самок и молодых птиц [16]. Хвост относительно длиннее, чем у других черногрудых красношеек, а в целом по своим пропорциям C. p. tschebaiewi практически сходен с китайским подвидом C. calliope beicki. Таким образом, форма tschebaiewi объективно имеет большее морфологическое и фенотипическое сходство с C. calliope, чем другие подвиды С. pectoralis, что косвенно указывает на ее гибридное происхождение.
По нашему мнению, разделение pectoralis на две филогенетические линии можно объяснить двумя фактами гибридизации, схема которых представлена на рис. 6. На первом этапе произошла гибридизация самки С. calliope, несущей рекомбинантный гаплотип мтДНК, с самцом C. obscura (см. рис. 6). Результатом этого случая стало возникновение формы, предковой для pectoralis, ballioni и confusa, которые имеют более широкий черный пластрон на груди, сходный с таковым и видимо унаследованный от C. obscura, а также красное пятно на горле и белые брови, приобретенные от С. calliope. На втором этапе участниками гибридизации были самец С. calliope и самка С. pectoralis. Потомство этой пары несло уже двойную дозу ядерного генома С. calliope, что отражено на дереве, построенном по ядерным генам (см. рис. 5) [21]. Результатом этого случая стало возникновение формы tschebaiewi, у которой морфологические признаки С. calliope проявились значительно сильнее, чем у прочих форм черногрудой красношейки.
Таким образом, мы обнаружили новые факты, указывающие на гомологичную рекомбинацию между участками митохондриального и ядерного геномов у соловья-красношейки, в результате которой на основе последовательностей ядерных псевдогенов возникли новые митохондриальные гаплотипы гибридного вида C. pectoralis. По молекулярным данным и фенотипическим признакам C. pectoralis является межвидовым гибридом C. calliope и C. obscura, а его проанализированный митохондриальный гаплотип имеет ядерное происхождение. Это новый случай межгеномной рекомбинации, установленный нами для рода Calliope. Обнаруженные варианты ядерных копий гена cytb С. calliope (см. рис. 3) являются потенциальным источником новых гаплотипов мтДНК и открывают скрытый грандиозный запас молекулярной изменчивости мтДНК, которая может быть реализована через межгеномную рекомбинацию.
Наши данные показывают потенциальную важность использования NUMT для правильного анализа филогенетических построений. Изучение ядерных паралогов в дальнейшем позволит переосмыслить их роль в формировании генетического разнообразия в природе и оценке скорости микроэволюционных процессов по митохондриальным маркерам. Новый факт переноса ядерных копий мтДНК в митохондриальный геном посредством симметричной рекомбинации является подтверждением взаимодействия ядерного и митохондриального геномов как единой сопряженной генетической системы клетки.
В данной работе впервые подтверждено молекулярными и морфологическими данными гибридное происхождение С. pectoralis с механизмом симметричной рекомбинации фрагментами ДНК между ядром и митохондриями, а также показана роль NUMT – ядерных копий мтДНК – в качестве источников новых таксон-специфичных митохондриальных гаплотипов.
Авторы выражают благодарность А.П. Крюкову и М.М. Козыренко за ценные замечания и помощь в редактировании рукописи и С.В. Шедько за сборку последовательности NUMT. Авторы выражают глубокую признательность В.М. Лоскоту за предоставленную возможность ознакомления с коллекционными материалами Зоологического института РАН (г. Санкт-Петербург), а также В.Н. Сотникову, собравшему и предоставившему для исследования экземпляр C. p. tschebaiewi из Мьянмы. За помощь в подготовке карты гнездовых ареалов соловьев мы чрезвычайно признательны А.А. Мосалову.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (грант № 16-04-01304). Значительная часть использованных материалов была подготовлена и депонирована в Зоологический музей МГУ при поддержке гранта Российского научного фонда “Научные основы создания национального банка-депозитария живых систем” (грант № 14-50-00029). Часть работы, выполненная Я.А. Редькиным, осуществлена в рамках государственной темы AAAA-A16-116021660077-3 – “Таксономический и биохорологический анализ животного мира как основа изучения и сохранения структуры биологического разнообразия”.
Список литературы
Song H., Buhay J.E., Whiting M.F., Crandall K.A. Many species in one: DNA barcoding overestimates the number of species when nuclear mitochondrial pseudogenes are coamplified // Proc. Natl Acad. Sci. USA. 2008. V. 105. P. 13486–13491. doi 10.1073/pnas.0803076105
Bensasson D., Zhang D.-X., Hartl D.L., Hewitt G.M. Mitochondrial pseudogenes: Evolution’s misplaced witnesses // TRENDS in Ecol. Evol. 2001. V. 16. P. 314–321.
Андрианов Б.В., Романов Д.А., Горелова Т.В. и др. Перенос митохондриальной ДНК в ядерный геном клеток пересеваемой клеточной линии Drosophila virilis // Генетика. 2013. Т. 49. № 6. С. 788–792.
Bernt M., Braband A., Schierwater B., Stadler P.F. Genetic aspects of mitochondrial genome evolution // Mol. Phyl. Evol. 2013. V. 69. P. 328–338. doi 10.1016/ j.ympev.2012.10.020
Arctander P. Comparison of a mitochondrial gene and a corresponding nuclear pseudogene // Proc. R. Soc. Lond. 1995. V. B262. P. 13–19.
Zhang D.-X., Hewitt G.M. Nuclear integrations: challenges for mitochondrial DNA markers // Trends Evol. Ecol. 1996. V. 11. P. 247–251.
Triant D.A., DeWoody J.A. The occurrence, detection, and avoidance of mitochondrial DNA translocations in mammalian systematics and phylogeography // J. Mamm. 2007. V. 88. P. 908–920.
Гречко В.В. Проблемы молекулярной филогенетики на примере отряда чешуйчатых рептилий (отряд Squamata): митохондриальные ДНК-маркеры // Мол. биол. 2013. Т. 47. № 1. С. 61–82.
Grzybowski T., Malyarchuk B.A., Czarny J. et al. High level of mitochondrial DNA heteroplasmy in single hair roots: reanalysis and revision // Electrophoresis. 2003. V. 24. P. 1159–1165.
Kraytsberg Y., Schwartz M., Brown T.A. et al. Recombination of human mitochondrial DNA // Science. 2004. V. 304. P. 981.
Спиридонова Л.Н., Редькин Я.А., Вальчук О.П., Крюков А.П. Ядерные копии митохондриальных генов – источник новых вариантов гаплотипов гена цитохрома b Luscinia calliope (Muscicapidae, Aves) // Генетика. 2016. Т. 52. № 9. С. 1069–1080. doi 10.7868/ S0016675816090137
Sangster G., Alstrom P., Forsmark E., Olsson U. Multilocus phylogenetic analysis of Old World chats and flycatchers reveals extensive paraphyly at family, subfamily and genus level (Aves: Muscicapidae) // Mol. Phylogenet. Evol. 2010. V. 57. P. 380–392. doi 10.1016/ j.ympev.2010.07.008
Alstrom P., Song G., Zhang R. et al. Taxonomic status of Blackthroat Calliope obscura and Firethroat C. pectardens // Forktail. 2013. V. 29. P. 94–99.
Dickinson E.C., Christidis L. The Howard & Moore Complete Checklist of the Birds of the World: Passerines. 4th ed., V. 2. Eastbourne: Aves Press, 2014. 752 p.
del Hoyo J., Collar N.J. HBW and BirdLife International Illustrated Checklist of the Birds of the World. V. 2. Passerines. Barcelona: Lynx Edicions, 2016. 904 p.
Loskot V.M., Daletskaya K.K. Plumages and size variation of the Himalayan rubythroat, Luscinia pectoralis (Gould, 1837) (Aves: Muscicapidae) // Zoosystematica Rossica. 2001. V. 9. P. 463–486.
Спиридонова Л.Н., Вальчук О.П., Редькин Я.А. и др. Филогеография и демографическая история соловья-красношейки Luscinia calliope // Генетика. 2017. Т. 53. № 8. С. 933–951. doi 10.7868/ S0016675817080100
Vaurie Ch. The Birds of the Palearctic Fauna. Order Passeriformes. L.: Witherby, 1959. 762 p.
Collar N. Family Turdidae. Handbook of the Birds of the World, Cuckoo-Shrikes to Thrushes. V. 10 / Eds Del Hoyo J., Elliott A., Christie D. Barcelona: Lynx Edicions, 2005. P. 514–807.
Rasmussen P.C., Anderton J.C. Birds of South Asia. The Ripley Guide. 2. Attributes and Status. 2nd ed. The Smithsonian Institution, Michigan State University and Lynx Edicions, Washington D.C., Michigan and Barcelona, 2012. 684 p.
Liu Y., Chen G., Huang Q. et al. Species delimitation of the white-tailed rubythroat Calliope pectoralis complex (Aves, Turdidae) using an integrative taxonomic approach // J. Avian Biol. 2016. V. 47. P. 001–012.
Bonfield J.K., Smith K.F., Staden R. A new DNA sequence assembly program // Nucl. Acids Res. 1995. V. 23. P. 4992–4999.
Tamura K., Stecher G., Peterson D. et al. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0 // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729.
Librado P., Rozas J. DnaSP v5: A software for comprehensive analysis of DNA polymorphism data // Bioinformatics. 2009. V. 25. P. 1451–1452.
Martin D.P., Williamson C., Posada D. RDP2: recombination detection and analysis from sequence alignments // Bioinformatics. 2005. V. 21. № 2. P. 260–262.
Pavlova A., Rohwer S., Drovetski S.V., Zink R.M. Different post-Pleistocene histories of Eurasian parids // J. Heredity. 2006. V. 97. P. 389–402.
Haring E., Gamauf A., Kryukov A. Phylogeographic patterns in widespread corvid birds // Mol. Phyl. Evol. 2007. V. 45. P. 840–862.
Dohms K.M., Burg T.M. Molecular markers reveal limited population genetic structure in a North American corvid, Clark’s nutcracker (Nucifraga columbiana) // PLoS One. 2013. V. 8. P. e79621.
Zink R.M., Drovetski S.V., Questiau S. et al. Recent evolutionary history of the bluethroat (Luscinia svecica) across Eurasia // Mol. Ecol. 2003. V. 12. P. 3069–3075.
Pavlova A., Zink R.M., Drovetski S.V. et al. Phylogeographic patterns in Motacilla flava and M. citreola: species limits and population history // Auk. 2003. V. 120. P. 744–758.
Zink R.M., Pavlova A., Drovetski S., Rohwer S. Mitochondrial phylogeographies of five widespread Eurasian bird species // J. Ornithol. 2008. V. 149. P. 399–413.
Drovetski S.V., Zink R.M., Ericson P.G.P., Fadeev I.V. A multilocus study of pine grosbeak phylogeography supports the pattern of greater intercontinental divergence in Holarctic boreal forest birds than in birds inhabiting other high-latitude habitats // J. Biogeog. 2010. V. 37. P. 696–706.
Weber-Lotfi F., Koulintchenko M.V., Ibrahim N. et al. Nucleic acid import into mitochondria: New insights into the translocation pathways // Biochim. Biophys. Acta. 2015. V. 1853. P. 3165–3181. doi 10.1016/j.bbamcr.2015.09.011
Константинов Ю.М., Дитриш А., Вебер-Лотфи Ф. и др. Импорт ДНК в митохондрии // Биохимия. 2016. Т. 81. № 10. С. 1307–1321.
Lopez J.V., Yuhki N., Masuda R. et al. Numt, a recent transfer and tandem amplification of mitochondrial DNA to the nuclear genome of the domestic cat // J. Mol. Evol. 1994. V. 39. P. 174–190.
Randler C. Avian hybridization, mixed pairing and female choice // Animal Behavi. 2002. V. 63. № 1. P. 103–119.
Lamichhaney S., Han F., Webster M.T. et al. Rapid hybrid speciation in Darwin’s finches // Science. 2017. doi 10.1126/science.aao4593
Дополнительные материалы отсутствуют.


