Генетика, 2019, T. 55, № 10, стр. 1151-1157
Первый опыт применения NGS секвенирования для проведения неинвазивного пренатального тестирования
Т. Э. Иващенко 1, *, Е. С. Вашукова 2, П. Ю. Козюлина 2, Н. М. Двойнова 2, О. Е. Талантова 1, А. Л. Коротеев 1, А. А. Пендина 1, А. В. Тихонов 1, О. Г. Чиряева 1, Л. И. Петрова 1, В. С. Дудкина 1, О. А. Ефимова 1, В. С. Баранов 1, А. С. Глотов 1
1 Научно-исследовательский институт акушерства,
гинекологии и репродуктологии им. Д.О. Отта
199034 Санкт-Петербург, Россия
2 ООО “НИПТ”
199106 Санкт-Петербург, Россия
* E-mail: tivashchenko2011@mail.ru
Поступила в редакцию 24.04.2019
После доработки 26.05.2019
Принята к публикации 30.05.2019
Аннотация
Для определения хромосомных аномалий плода в последние годы активно используют технологию неинвазивного пренатального тестирования (НИПТ). Неинвазивное пренатальное тестирование позволяет выявлять хромосомные патологии плода путем анализа внеклеточной ДНК (вкДНК) плода в материнской крови без проведения инвазивного вмешательства. В настоящем сообщении суммированы результаты разработки и апробация НИПТ-технологии в НИИ АГиР им. Д.О. Отта. Первые результаты НИПТ-теста, полученные нами при исследовании 149 образцов крови беременных женщин, доказали клиническую ценность данного анализа для выявления трисомии плода по хромосомам 21, 18 и 13. Из 149 образцов были выявлены 22 образца с анеуплоидиями, что в дальнейшем было подтверждено методом цитогенетического анализа кариотипа плода. В 21 образце с анеу-плоидиями в 57% случаев встречалась трисомия 21, в 24% – трисомия 18 и в 9% – трисомия 13. В одном образце выявлена анеуплоидия по хромосомам 21 и 13 одновременно и в одном случае – трисомия по хромосоме Х. Не было зарегистрировано ложноположительных результатов, 100% трисомий были подтверждены кариотипированием после инвазивной диагностики. Полученная специфичность соответствовала ожидаемой и составила >99.9%. Чувствительность метода – 100%. Метод НИПТ доказал свою надежность и, скорее всего, заменит классический комбинированный скрининг первого триместра с последующими инвазивными процедурами в ближайшие годы. Относительно высокая стоимость НИПТ и отсутствие компенсации его стоимости страховыми компаниями в России являются единственными недостатками данного метода. Учитывая ожидаемое дальнейшее снижение стоимости данного типа исследований, НИПТ-технология на основе секвенирования генома применима в клинической практике и заслуживает широкого использования в будущем.
ВВЕДЕНИЕ
Пренатальная диагностика врожденных наследственных заболеваний является одним из приоритетных направлений медицинской генетики. Большую группу врожденных наследственных болезней составляют хромосомные болезни, которые занимают одно из ведущих мест в структуре наследственной патологии человека. По данным цитогенетических исследований, среди новорожденных детей частота хромосомной патологии составляет 0.6–1.0%. Самая высокая частота хромосомной патологии (до 70%) зафиксирована в материале ранних спонтанных абортусов. Следовательно, большинство хромосомных аномалий у человека несовместимы даже с ранними этапами эмбриогенеза. Некоторая часть эмбрионов гибнет вскоре после имплантации (ранние выкидыши). Сравнительно немногие варианты числовых аномалий хромосом совместимы с постнатальным развитием и ведут к хромосомным заболеваниям [1]. К наиболее тяжелым и широко распространенным хромосомным заболеваниям относятся трисомии хромосом 21 (синдром Дауна) [2], 18 (синдром Эдвардса), 13 (синдром Патау) [3]. Женщины из группы риска по хромосомной патологии составляют до 86% от всех женщин, направляемых на пренатальную диагностику. Согласно приказу Министерства здравоохранения России первый этап пренатальной диагностики, который включает в себя биохимический скрининг (анализ PAPP-A и β-ХГЧ в крови матери) и УЗИ плода для выявления маркеров хромосомных болезней, проводится в первом триместре беременности. Комбинированный скрининг по данным Николаидиса [4] позволяет выявить около 90% плодов с трисомией 21 и другими наиболее распространенными анеуплоидиями, однако около 5% результатов являются ложноположительными. В группе риска, сформированной по результатам комбинированного скрининга, проводится инвазивная пренатальная диагностика для последующего проведения цитогенетического исследования кариотипа плода. В настоящее время разработаны и внедрены в клиническую практику разнообразные цитогенетические методы для определения кариотипа плода [5]. Однако трудоемкость и длительность анализа, а также достаточно высокая себестоимость являются серьезным препятствием для массового скрининга хромосомных патологий при беременности [6].
Для определения хромосомных аномалий плода в последние годы активно используют технологию неинвазивного пренатального тестирования (НИПТ). Еще в 1997 г. описана внеклеточная ДНК (вкДНК) плодного происхождения (или фетальная ДНК), циркулирующая в крови матери [7]. Основным источником фетальной вкДНК служат клетки эмбриона/плода или плаценты (чаще всего трофобласта), подвергшиеся апоптозу [8]. Повышенный уровень свободной эмбриональной ДНК может быть результатом некроза и апоптоза клеток плаценты [9, 10]. В отличие от вкДНК материнского происхождения, ДНК плодного происхождения представлена более короткими фрагментами [11]. Фетальную ДНК в материнской плазме возможно выявить уже на 32-й день гестации, но необходимая для анализа концентрация накапливается только к седьмой неделе [12]. Так, чувствительность метода неинвазивной пренатальной диагностики до сeми недель гестации оценивается в 50–77% и нарастает до 99–100% к 10–11-й неделям [13].
Таким образом, НИПТ позволяет выявлять хромосомные и иные патологии плода путем анализа фетальной вкДНК в материнской крови [14] без проведения инвазивного вмешательства. Следует отметить, что в настоящее время данный метод должен рассматриваться как первичный скринирующий тест на наличие анеуплоидии у плода, только дополняющий комбинированный скрининг, и при его позитивных результатах следует рекомендовать подтверждающую диагностику инвазивными методами [15].
Основными лимитирующими факторами в подобных исследованиях являются сложность идентификации фракции вкДНК и отнесение того или иного фрагмента к эмбриональной или материнской вкДНК.
Например, число копий фетальной хромосомы может быть определено путем сравнения количества прочтений последовательностей хромосомы, представляющей интерес, с количеством прочтений эталонных хромосом. Хромосома 21 составляет примерно 1.3% от общей аутосомной ДНК в геноме, а человек с трисомией 21 имеет 1.5-кратное увеличение ДНК из этой хромосомы до 1.85% от общего количества. Однако в образце крови с фракцией вкДНК плода в 15% количество фрагментов ДНК, происходящих из хромосомы 21, будет увеличиваться примерно с 1.3 до 1.4% [16]. Следовательно, анализ должен быть очень точным, чтобы иметь возможность обнаружить небольшую разницу в генетическом материале из соответствующей хромосомы.
Эту технологически сложную задачу удалось решить группе исследователей из Великобритании, используя основное для большинства технологий NGS [17] массивное параллельное секвенирование. Достоверность данной технологии подтверждена для скрининга фетальных анеуплоидий. Данный метод обеспечивает более низкие значения ложноположительных показателей, чем стандартный комбинированный скрининг [18]. Чувствительность метода составляет 99.94% для трисомии 21 и 100% для трисомий 18 и 13; специфичность – 99.46% для трисомии 21, 99.24% для трисомии 18 и 100% для трисомии 13 [19]. В настоящем сообщении суммированы первые результаты разработки и апробации НИПТ-технологии в НИИ АГиР им. Д.О. Отта.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использована плазма крови 149 беременных женщин. Взятие периферической крови проводили до проведения инвазивной пренатальной диагностики. От всех пациенток получено информированное согласие на участие в эксперименте.
Кровь собирали в пробирки, содержащие 0.5 М раствор ЭДТА (рН 8.0) (Greiner Bio One, Австрия) и тщательно перемешивали. Не позже чем через 4 ч после взятия крови осуществляли центрифугирование образцов при 2000 g в течение 10 мин при температуре 4°С. Далее собирали плазму и проводили повторное центрифугирование при 16 000 g в течение 10 мин при температуре 4°С.
Для выделения ДНК из плазмы крови беременных использовали набор реагентов MagMAX Cell-Free DNA Isolation Kit (Thermo Fisher Scientific Inc., США) согласно рекомендациям производителя. Конструирование библиотек ДНК включало следующие этапы: затупление концов двуцепочечных фрагментов ДНК, пришивание баркодов и последующая амплификация.
Подготовку библиотек проводили по протоколу набора Ion Plus Fragment Library Kit (Thermo Fisher Scientific Inc.) с некоторыми модификациями. Концентрацию образцов ДНК измеряли на флуориметре Qubit 2.0 (Invitrogen, США) с помощью набора реактивов Qubit dsDNA HS Assay Kit (Thermo Fisher Scientific Inc.). Качество образцов ДНК оценивали с помощью системы капиллярного электрофореза 2200 TapeStation Instrument (Agilent technologies, США), используя чипы High Sensitivity D1K ScreenTape и реактивы High Sensitivity D1K Reagents (Agilent technologies). Подготовку библиотек к секвенированию и нанесение их на чип осуществляли с помощью системы Ion Chef System (Thermo Fisher Scientific Inc.), используя набор Ion 540 Kit-Chef (Thermo Fisher Scientific Inc.) и микрочипы Ion 540 Chip (Thermo Fisher Scientific Inc.) согласно инструкции производителя. Секвенирование проводили на приборе Ion Torrent S5 (Thermo Fisher Scientific Inc.).
Биоинформатическая обработка результатов секвенирования состояла из следующих основных этапов: фильтрация полученных чтений по длине и качеству при помощи пакета SAMtools [20]; картирование чтений на референсный геном (GRCh37); определение пола плода; подсчет фетальной фракции образца при помощи пакета R SeqFF [21]; нормализация по GC-составу и определение анеуплоидий методом регрессионной Z‑метрики при помощи пакета R NIPTeR [22]. Полученные FASTQ файлы анализировали с помощью разработанного нами биоинформатического протокола, который признан лучшим инновационным проектом в сфере науки и высшего образования Санкт-Петербурга в 2018 г. в номинации “Лучшая научно-инновационная идея” http:// knvsh.gov.spb.ru/closedcontests/view/198/.
РЕЗУЛЬТАТЫ
Результаты анализа свободно циркулирующей ДНК плода в крови 149 беременных женщин методом массивного параллельного секвенирования представлены в настоящей работе. Средний возраст женщин составил 33.9 ± 0.8 лет (20–47 лет). Все пациентки были направлены на инвазивную пренатальную диагностику, так как попадали в группу риска по рождению ребенка с анеуплоидией. Сроки беременности варьировали от 9 до 32 недель гестации (среднее значение 15/5 ± 1/2 недель). Метод получения биоматериала для кариотипирования плода зависел от срока беременности. В 39.9% случаев это была хорионбиопсия, в 31.5% – амниоцентез, в 24.4% – плацентобиопсия и в 4.2% – кордоцентез. Результаты, полученные при проведении НИПТ и при кариотипировании материала плода, представлены в табл. 1.
Таблица 1.
Результаты тестирования образцов ДНК плода методом НИПТ и методом кариотипирования (n = 149)
| Кариотип/результат FISH | Кариотипирование | НИПТ* |
|---|---|---|
| Норма | ||
| 46,XX | 61 | 61 (норма, девочка) |
| 46,XY | 65 | 65 (норма, мальчик) |
| Сбалансированные перестройки | ||
| 46,ХY,t(15;16)(q15;q22)pat | 1 | 1 (норма, мальчик) |
| 46,XY,t(4;5)(p16;q31)pat | 1 | 1 (норма, мальчик) |
| Патологии | ||
| Анеуплоидии | ||
| 47,XX,+21 | 4 | 4 (трисомия 21, девочка) |
| 47,XY,+21 | 7 | 7 (трисомия 21, мальчик) |
| 47,XX,+18 | 3 | 3 (трисомия 18, девочка) |
| 47,XY,+18 | 2 | 2 (трисомия 18, мальчик) |
| 47,XX,+13 | 1 | 1 (трисомия 13, девочка) |
| 47,XXX | 1 | 1 (трисомия Х, девочка) |
| Мозаицизм | ||
| 47,XX,+21[25]/48,XX,+20,+mar [4] | 1 | 1 (трисомия 21, девочка) |
| Структурно несбалансированные перестройки | ||
| 47,XY,add(10)(q25),+21 | ||
| (FISH : 47,XY,+21.ish der (10)t(10;13)(q25;q22)(wcp10+,wcp13+,RB1–) | 1 | 1 (трисомия 13, трисомия 21, мальчик) |
При проведении цитогенетического исследования выявлены 126 образцов с нормальным кариотипом, что соответствовало данным, полученным при проведении НИПТ, из них плод мужского пола определен в 52% (65) случаев, а женского – в 48% (61) случаев.
Анализ внеклеточной ДНК позволил выявить 21 плод с анеуплоидиями, из них трисомия по хромосоме 21 – в 12 случаях, трисомия по хромосоме 18 – в пяти случаях, трисомия по хромосоме 13 – в двух случаях. У одной пациентки методом НИПТ была определена трисомия по хромосомам 13 и 21 одновременно. При анализе половых хромосом в одном случае выявлена трисомия по хромосоме Х. Кариотипирование материала плода, полученного в результате инвазивной диагностики, подтвердило наличие выявленных анеуплоидий.
В двух случаях при кариотипировании выявлены сбалансированные перестройки 46,ХY,t(15;16) (q15;q22) и 46,ХY,t(4;5)(p16;q31), для которых было определено отцовское происхождение. При анализе вкДНК в крови женщин, беременных этими плодами, определены нормальное соотношение хромосом 13, 18, 21 и мужской пол плодов.
Согласно полученным данным анализ вкДНК с использованием технологии НИПТ позволяет выявить мозаичную форму синдрома Дауна. По данным НИПТ в одном из образцов была зарегистрирована трисомия по хромосоме 21, тогда как кариотип плода был мозаичным: 47,XX,+21 [25]/48,XX,+20,+mar [4].
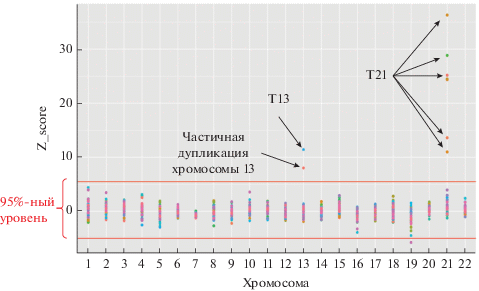
Особый интерес представляет выявленный нами при НИПТ-анализе вариант дополнительной частичной трисомии по хромосоме 13 у плода с анеуплоидией по хромосоме 21 (рис. 1). Кариотип плода: 47,XY,add(10)(q25),+21.
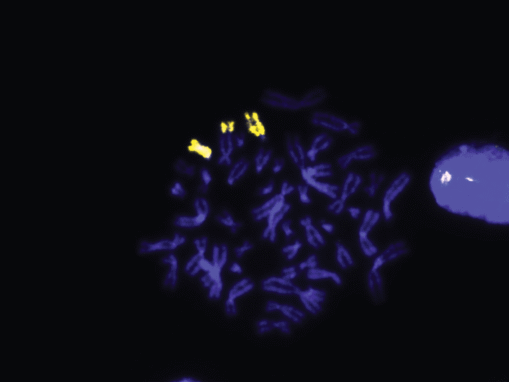
Анализ метафазных пластинок методом FISH с использованием полнохромосомного зонда к хромосоме 13 подтвердил наличие частичной трисомии по длинному плечу хромосомы 13 (13q22 → qter) (рис. 2). С его помощью в данном образце также выявлена частичная моносомия по хромосоме 10 (10q25 → qter). Результаты молекулярно-цитогенетического исследования методом FISH: 47,XY,+21.ish der (10)t(10;13)(q25;q22)(wcp10+,wcp13+,RB1–).
ОБСУЖДЕНИЕ
На современном этапе развития молекулярно-генетических технологий массивное параллельное секвенирование ДНК становится частью рутинной клинической практики. Данный метод широко используется для проведения неинвазивной пренатальной диагностики. В последние несколько лет технологию НИПТ применяют для пренатального скрининга трисомий по хромосомам 21, 18 и 13, а также количественных нарушений половых хромосом. В настоящее время метод НИПТ с использованием массивного параллельного секвенирования свободно циркулирующей вкДНК плода в крови матери рассматривается в качестве метода скрининга для выявления частых анеуплоидий [23].
Первые результаты НИПТ, полученные нами при исследовании 149 образцов крови беременных женщин, доказали клиническую ценность данного анализа для выявления трисомии плода по хромосомам 21, 18 и 13. Из 149 образцов был выявлен 21 образец с анеуплоидиями, что в дальнейшем было подтверждено методом цитогенетического анализа кариотипа плода.
Из 21 образца с анеуплоидиями в 57% случаев встречалась трисомия 21, в 24% – трисомия 18 и в 9% – трисомия 13. В одном случае выявлена анеу-плоидия по хромосомам 13 и 21 одновременно (5%), также в одном случае выявлена трисомия по хромосоме Х (5%). Не было зарегистрировано ложноположительных результатов, 100% трисомий были подтверждены кариотипированием после инвазивной диагностики. Полученная специфичность соответствовала ожидаемой и составила >99.9%. Чувствительность метода – 100%.
Хотелось бы отметить, что НИПТ, проведенный с использованием разработанного нами биоинформатического анализа, смог выявить не только регулярные трисомии по хромосомам 13, 18, 21, Х, но и частичную трисомию по хромосоме 13, а также мозаичную форму синдрома Дауна.
Известно, что основными показаниями для инвазивной пренатальной диагностики является повышенный материнский возраст, а также риск рождения ребенка с анеуплоидией по результатам комбинированного скрининга. В США большинство страховых компаний финансируют НИПТ для беременных с высокой степенью риска, хотя некоторые из них расширили охват до всех беременных [24]. В некоторых юрисдикциях, таких как Гонконг и Сингапур, НИПТ доступен только на коммерческой основе [25].
В Европе (Дания, Франция, Нидерланды и Швейцария) предлагают государственное финансирование НИПТ при повышенном риске рождения ребенка с анеуплоидиями [26]. На сегодняшний день Бельгия является единственной страной, которая использует НИПТ в качестве первичного скрининга [26].
Таким образом, НИПТ доказал свою надежность и, скорее всего, заменит классический комбинированный скрининг первого триместра с последующими инвазивными процедурами в ближайшие годы. Относительно высокая стоимость НИПТ и отсутствие компенсации его стоимости страховыми компаниями в России являются единственными недостатками данного метода. Учитывая ожидаемое дальнейшее снижение стоимости данного типа исследований, НИПТ-технология на основе секвенирования генома применима в клинической практике и заслуживает широкого использования в будущем.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации в рамках темы фундаментальных научных исследований 2019–2021 гг. (AAAA-A19-119021290033-1).
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Баранов В.С., Кузнецова Т.В., Кащеева Т.К., Иващенко Т.Э. Пренатальная диагностика наследственных болезней. Состояние и перспективы. Санкт-Петербург: ЭКО ВЕКТОР, 2017. 469 с.
Hook E.B. Chromosome abnormalities: prevalence, risks and recurrence // Prenatal Diagnosis and Screening / Eds Brock D.L.H., Rodeck C.H., Ferguson-Smith M.A. Edinburgh: Churchill Livingstone, 1992. P. 351–392.
Parker M.J., Budd J.L.S., Draper E.S., Young I.D. Trisomy 13 and trisomy 18 in a defined population: epidemiological, genetic and prenatal observations // Prenat. Diagn. 2003. V. 23. P. 856–860.
Nicolaides K.H. Screening for fetal aneuploidies at 11 to 13 weeks // Prenat. Diagn. 2011. V. 31. P. 7–15.
Баранов В.С., Кузнецова Т.В. Цитогенетика эмбрионального развития человека. Научно-практические аспекты. СПб: Изд-во Н-Л, 2007. 640 с.
Пренатальная диагностика наследственных и врожденных болезней / Под ред. Айламазяна Э.К., Баранова В.С. СПб.: МЕДпресс-информ, 2006. 415 с.
Lo Y.M., Corbetta N., Chamberlain P.F. et al. Presence of fetal DNA in maternal plasma and serum // Lancet. 1997. V. 350(9076). P. 485–487.
Ковалева Ю.А., Хасанов А.А., Сингатуллина Л.М. Определение внеклеточных ДНК крови – клиническое и диагностическое значение // Практич. медицина. 2010. № 43. С. 63–66.
Hromadnikova I., Zejskova L., Doucha J., Codl D. Quantification of fetal and total circulatory DNA in maternal plasma samples before and after size fractionation by agarose gel electrophoresis // DNA Cell Biology. 2006. V. 25. № 11. P. 635–640.
Wang S.J., Gao Z.Y., Lu Y.P. et al. Value of detection of cell-free fetal DNA in maternal plasma in the prenatal diagnosis of chromosomal abnormalities // Zhonghua Fu Chan Ke Za Zhi. 2012. V. 47. № 11. P. 808–812.
Chan K.C., Zhang J., Hui A.B. et al. Size distributions of maternal and fetal DNA in maternal plasma // Clin. Chem. 2004. V. 50(1). P. 88–92.
Galbiati S., Smid M., Gambini D. et al. DNA detection in maternal plasma throughout gestation // Hum. Genet. 2005. V. 117(2–3). P. 243–248.
Bustamante-Aragonés A., Rodríguez de Alba M., Perlado S. et al. Non-invasive prenatal diagnosis of single-gene disorders from maternal blood // Gene. 2012. V. 504. P. 144–149.
Dhallan R., Guo X., Emche S. et al. A non-invasive test for prenatal diagnosis based on fetal DNA present in maternal blood: a preliminary study // Lancet. 2007. V. 369. P. 474–481.
Баранов В.С., Кузнецова Т.В. Новые возможности генетической пренатальной диагностики // Журн. акушерства и женских болезней. 2015. Т. 64. № 2. С. 4–12.
Sparks A.B., Struble C.A., Wang E.T. et al. Non-invasive prenatal detection and selective analysis of cell-free DNA obtained from maternal blood: evaluation for trisomy 21 and trisomy 18 // Am. J. Obstet Gynecol. 2012. V. 206(319). P. e1–e9.
Fan H.C., Blumenfeld Y.J., Chitkara U. et al. Non-invasive diagnosis fetal aneuploidy by shotgun sequencing DNA from maternal blood // PNAS. 2008. V. 105. P. 16266–16271.
Bianchi D.W., Parker R.L., Wentworth J. et al. DNA sequencing versus standard prenatal aneuploidy screening // N. Engl. J. Med. 2014. V. 370. P. 799–808.
Liao C., Yin A.-H., Peng C.-F. et al. Non-invasive prenatal diagnosis of common aneuploidies by semiconductor sequencing // PNAS. 2014. V. 111. P. 7415–7420.
Li H., Handsaker B., Wysoker A. et al. The sequence alignment/map (SAM) format and SAMtools // Bioinformatics. 2009. V. 25(16). P. 2078–2079.
Kim S.K., Hannum G., Geis J. et al. Determination of fetal DNA fraction from the plasma of pregnant women using sequence read counts // Prenat. Diagn. 2015. V. 35(8). P. 810–815. Epub 2015 Jun 3https://doi.org/10.1002/pd.4615
Johansson L.F., de Weerd H.A., de Boer E.N. et al. NIPTeR: an R package for fast and accurate trisomy prediction in non-invasive prenatal testing // BMC Bioinformatics. 2018. V. 19(1). P. 531. https://doi.org/10.1186/s12859-018-2557-8
Lo P.S.S., Wang W., Zhang H.Y. et al. Secondary findings from non‑invasive prenatal testing for common fetal aneuploidies by whole genome sequencing as a clinical service // Prenat. Diagn. 2013. V. 33. P. 602–608.
NIPT Education for Health Care Professionals: Illumina Inc., 2018. Available from: https://www.illumina.com/ clinical/reproductive-genetic-health/nipt/healthcare-providers.html.
Cernat A., De Freitas C., Majid U. et al. Facilitating informed choice about non-invasive prenatal testing (NIPT): a systematic review and qualitative meta-synthesis of women’s experiences // BMC Pregnancy Childbirth. 2019. V. 19. P. 27. https://doi.org/10.1186/s12884-018-2168-4
Valera-Lema L., Punal-Rioboo J., Ballini L. Rapid assessment of other health technologies using the HTA Core Model® for Rapid Relative Effectiveness Assessment European Network for Health Technology Assessment Project ID: OTCA03. 2018. Screening of fetal trisomies 21, 18 and 13 by noninvasive prenatal testing.
Дополнительные материалы отсутствуют.