Генетика, 2019, T. 55, № 10, стр. 1180-1188
Исследование индивидуальной радиочувствительности у человека на основе оценки частоты хромосомных аберраций и микроядер в Т-лимфоцитах периферической крови
А. В. Возилова 1, *, Ю. Р. Ахмадуллина 1, 2
1 Уральский научно-практический центр радиационной медицины
454076 Челябинск, Россия
2 Челябинский государственный университет
454001 Челябинск, Россия
* E-mail: vozilova@urcrm.ru
Поступила в редакцию 24.04.2019
После доработки 26.05.2019
Принята к публикации 30.05.2019
Аннотация
В современном мире возрастает воздействие ионизирующего излучения на человека в диапазоне низких доз (медицинские диагностические процедуры и т.д.). Вопрос о влиянии малых доз на здоровье человека – дискуссионный и актуальный. Известно, что в популяции существует до 15% людей, у которых ответ на облучение будет отличаться от ожидаемого, что по литературным данным связано с особенностями генома. Исследование влияния хронического низкоинтенсивного облучения (диапазон доз на красный костный мозг от 3 до 4600 мГр), которому подверглись жители прибрежных сел р. Теча (Южный Урал), на радиочувствительность Т-клеток in vivo и in vitro при дополнительном γ-облучении Т-лимфоцитов периферической крови (0.5, 1 и 2 Гр) является актуальным. В качестве маркеров облучения использовали цитогенетические показатели – частоту нестабильных хромосомных аберраций и частоту микроядер. Радиочувствительными считались лица, у которых полученные значения показателей превышали 90-й процентиль. На основании результатов проведенного исследования были сделаны следующие выводы: доноров с повышенной радиочувствительностью было около 10%, причем на увеличение цитогенетических результатов не влияла доза хронического облучения красного костного мозга; не выявили влияния возраста на радиочувствительность в исследуемом возрастном диапазоне доноров (49–89 лет). В большинстве случаев не выявили воспроизводимого эффекта радиочувствительности у одного и того же донора при разных режимах облучения.
В современных условиях велико влияние низких доз облучения на человека. Многочисленные медицинские процедуры, неблагоприятная экологическая обстановка – все это увеличивает присутствие радиационного фактора в жизни людей. В случае же аварийного облучения или нештатной ситуации для профессионалов и населения цель радиационной защиты состоит в предотвращении детерминированных эффектов и в ограничении стохастических эффектов у человека в клинической практике [1]. Для достижения этой цели необходимо наиболее точно определить уровень повреждений ДНК, поскольку они играют роль в реализации эффектов облучения в организме человека и служат основой для определения дозы облучения человека при отсутствии физической дозиметрии или для валидации ее оценок.
Наиболее распространенный метод для определения повреждений ДНК – цитогенетический. В основе такого подхода лежит подсчет частоты хромосомных аберраций или частоты микроядер в Т-клетках периферической крови человека, которые могут при определенных ограничениях быть пересчитаны в дозу облучения с использованием калибровочной кривой доза–эффект [2].
Накопленные научные данные говорят в пользу существующих вариаций индивидуальных особенностей организмов на воздействие излучения, что также является ограничением для методов биодозиметрии. Так, отмечалось, что даже у людей с острой лучевой болезнью, переживших атомную бомбардировку в г. Хиросима и г. Нагасаки (Япония), наблюдались индивидуальные различия в интенсивности выпадения волос, в реакции гемопоэза и т.д. [3].
Одним из перспективных направлений в исследованиях в области радиационной генетики является изучение механизмов индивидуальной радиочувствительности человека. Актуальность этой темы обусловлена помимо возможных аварийных ситуаций, необходимостью профессионального отбора специалистов, контактирующих с ионизирующим излучением, выбором источников и адекватных доз излучения в ходе лучевой терапии, обоснованием необходимости большого количества медицинских диагностических процедур, уточнением норм радиационной безопасности для населения и персонала атомных производств [4].
Под индивидуальной радиочувствительностью понимают способность биологического объекта определенным образом реагировать на действие ионизирующей радиации. Оценить индивидуальную радиочувствительность возможно с использованием нескольких критериев: разной реакцей пациентов на лучевую терапию, реакцей здоровых тканей в отдаленном времени после проведения лучевой терапии, наличием в популяции наиболее предрасположенных к радиационно-индуцированным ракам индивидуумов, межиндивидуальной вариабельностью в репарации разрывов ДНК или скоростью элиминирования поврежденных клеток, разной реакцией клеток на действие ионизирующей радиации при определенных дозах и мощностях доз [5]. Так, индукция двойных разрывов ДНК, которые реализуются в хромосомные аберрации и частично в микроядра, считается проявлением индивидуальной чувствительности организма на действие радиации [2]. В последнее время большое внимание исследователей уделяется не прямому влиянию радиации на клетку (теория мишени), а так называемым “немишенным эффектам”, которые описаны как “эффект свидетеля”, “абскопальный эффект”, “адаптивный ответ”, геномная нестабильность, задержка апоптоза [6].
Одним из наиболее важных вопросов в современной радиобиологии является вопрос о корреляции особенностей генома организма и его радиочувствительности. Так, известно, что лучевая терапия особенно фатальна для носителей гомозигот гена ATM, и может запускать рак с высокой вероятностью у АТМ-, BRCA1- и BRCA2-, ТP53-гетерозиготных носителей. Считается, что все генные мутации с предрасположенностью к радиочувствительности или раку могут быть представлены в популяции в существенной пропорции от 5 до 15% [7].
Анализ литературных данных показывает, что радиочувствительность организма по-разному проявляется при воздействии малых и высоких доз ионизирующего излучения. В работе [8] проявление индивидуальной радиочувствительности преимущественно с применением флуоресценции для маркера γН2АХ регистрировали при воздействии в дозе 1 мГр. Отмечено, что в нормальных клетках кожи человека при малых (10 мГр) и высоких (2 Гр) дозах излучения изменения в экспрессии наблюдались в разных наборах генов [9]. При работе с микрочипами ДНК (10 500 генных зондов) было выявлено, что среди 853 зондов экспрессия 214 генов специфически определялась низкими дозами (10 мГр), а экспрессия 370 других генов – при воздействии высокими дозами (2 Гр). Набор из 140 известных генов, отвечающих на воздействие низкими дозами, включал в себя главным образом гены гомеостаза, клеточной коммуникации, сигнализации, структуры мембран, цитоскелета, РНК и синтеза белка, хроматина, энергетического метаболизма, стресса, гибели клеток и транспорта. Что было особенно важно, в условиях низких доз редко экспрессировались гены репарации ДНК. Таким образом, клеточные и тканевые реакции на облучение в диапазоне низких доз весьма специфичны и отличаются от реакций, вызываемых высокими дозами.
При изучении эффектов облучения у человека в условиях in vitro и in vivo было сделано предположение, что постановка вопроса о существовании радиочувствительных и радиоустойчивых генотипов не так однозначна, как представлялось радиобиологам ранее. Авторы предполагают, что следует разделять, по меньшей мере, три частично пересекающиеся группы полиморфных локусов генов, изменчивость которых ассоциирована с предрасположенностью к повышенному соматическому мутагенезу, а именно: 1) локусы, ассоциированные с уровнем спонтанных аберраций хромосом (например, локусы генов GSTM1, GSTT1); 2) локусы, ассоциированные с радиочувствительностью при облучении in vivo (возможно ген SOD2); 3) локусы, изменчивость которых определяет радиочувствительность хромосом при облучении in vitro (например, CYP1A1, CAT). Так, было показано, что частоты спонтанных (in vivo) и индуцированных (in vitro) аберраций хромосом ассоциированы с различными группами генов. Крупные делеции генов детоксикации чаще были сопряжены с пониженным уровнем цитогенетических нарушений. Большинство SNP, в том числе связанные с репарацией ДНК, слабо коррелировали с радиочувствительностью хромосом [10, 11]. Приведенные данные могут служить доказательством в пользу того, что за время эволюции клетки выработали несколько разных механизмов или путей клеточного ответа, которые могут взаимозаменять или дополнять друг друга в стрессовых ситуациях. А генетическое разнообразие, которым обладают клетки одной ткани, позволяет им по-разному реагировать на вредное воздействие (в нашем случае γ-радиация), адаптироваться к новым условиям или запускать механизмы апоптоза без ущерба деятельности для ткани и организма в целом.
Цель настоящего исследования – изучить влияние хронического низкоинтенсивного облучения организма на радиочувствительность Т-клеток периферической крови при γ-облучении in vitro. Для этого были взяты данные из цитогенетической базы УНПЦ РМ, которые были получены при обследовании жителей Южного Урала, подвергавшихся хроническому кумулятивному облучению в диапазоне доз от 0.003 до 4.6 Гр. Маркерами повреждения ДНК были выбраны нестабильные хромосомные аберрации (НХА) обменного типа и частота микроядер (МЯ) в цитокинез-блокированных митозах. В ходе исследования оценили влияние пола и возраста на радиочувствительность Т-лимфоцитов.
МАТЕРИАЛЫ И МЕТОДЫ
Критерии формирования групп доноров для исследований. Цитогенетические исследования, результаты которых приводятся в данной работе, в УНПЦ РМ выполнялись в течение нескольких лет среди лиц, подвергшихся хроническому облучению на Южном Урале в результате аварийных сбросов жидких радиоактивных отходов с ПО “Маяк” в р. Теча c 1948 г. по 1956 гг. Облучение населения было кумулятивным: внешним за счет γ-облучения от речной воды и внутренним β-облучением за счет поступления с питьевой водой и пищей радионуклидов 89,90Sr [12]. Диапазон кумулятивных доз облучения красного костного мозга (ККМ) обследованных людей составил от 0.003 до 4.6 Гр. Индивидуальные дозы облучения для жителей прибрежных сел р. Теча были рассчитаны в биофизической лаборатории УНПЦ РМ с применением обновленной дозиметрической системы TRDS-2016 [13].
Цитогенетическое исследование было проведено для лиц до 1960 г. рождения, обоего пола, преимущественно трех национальностей (русские, татары, башкиры), проживавших в прибрежных селах р. Теча. Из выборки были исключены лица, имеющие в анамнезе аутоиммунные, онкологические, хронические воспалительные заболевания в фазе обострения, лица, принимающие цитостатики, антибиотики, а также те, кто проходил диагностическое облучение в течение 6 предшествующих месяцев до момента взятия образца крови. Информация о состоянии здоровья доноров была получена из БД “Человек” УНПЦ РМ, информация о наличии онкозаболеваемости в анамнезе у обследуемых была предоставлена сотрудниками эпидемиологической лаборатории УНПЦ РМ. В соответствии с действующими международными нормами (Хельсинкская декларация 1964 г.) и с разрешения этического комитета УНПЦ РМ у всех пациентов было получено информированное согласие на забор образцов крови и на дальнейшие исследования.
Приготовление препаратов метафазных хромосом для оценки частоты нестабильных хромосомных аберраций. Для оценки частоты НХА обменного типа (дицентрические и кольцевые хромосомы, ацентрические кольца) готовили препараты метафазных хромосом из Т-лимфоцитов периферической крови доноров согласно протоколу, представленному в работе [2]. Протокол включает четыре последовательных этапа: культивирование клеток до стадии метафазы, гипотоническую обработку метафазных клеток, фиксацию метафазных пластинок и собственно приготовление препаратов хромосом. Кровь объемом 5 мл забирали из локтевой вены утром натощак в шприцы с гепарином. Культивирование Т-клеток проводили в стерильных бакпечатках. На одного донора готовили от одной до нескольких бакпечаток. Один образец культивировали без облучения в условиях in vitro, а остальные подвергали γ-облучению in vitro в дозах 0.5, 1 и 2 Гр. Дополнительное облучение проводили на установке Игур-1, мощность γ-облучения составила 0.014 Гр/с, источник облучения 137Cs, неравномерность облучения достигала 5%.
После облучения клетки культивировали в СО2-инкубаторе при 37.5°С в течение 54 ч. За 3 ч до окончания культивирования в культуру вводили колцемид в итоговой концентрации 0.1 мг/мл (Панэко, Россия). Фиксировали клетки 3-кратно, холодным 4°С свежеприготовленным фиксатором (3 части спирта этилового : 1 часть ледяной уксусной кислоты). Для получения препаратов хромосом суспензию раскапывали на охлажденные, обезжиренные стекла, которые сушили на воздухе. Качество препарата проверяли при фазово-контрастной микроскопии [14].
Окрашивали препараты 2%-ным красителем Гимза в течение 10 мин. Анализ проводили при световой микроскопии, при 1000-кратном увеличении на микроскопе AxioImagerZ2 (Сarl Zeiss, Германия). На одного человека анализировали от 100 до 500 клеток.
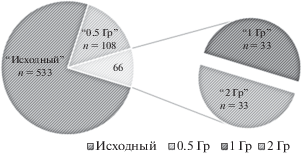
В итоге по результатам исследования НХА было сформировано четыре группы доноров в зависимости от дозы облучения образцов in vitro (рис. 1):
1) группа “исходный уровень” – культуру крови доноров не облучали в условиях in vitro, но Т-клетки подверглись воздействию в условиях in vivo в результате хронического облучения жителей прибрежных сел р. Теча. Это самая многочисленная группа, представленная в данной работе (533 обследованных);
2) группа “0.5 Гр” – культуру крови доноров дополнительно облучали in vitro в дозе 0.5 Гр. Это была вторая группа по величине в данной работе (108 человек);
3) группа “1 Гр” – культуру крови доноров дополнительно облучали in vitro в дозе 1 Гр;
4) группа “2 Гр” – культуру крови доноров дополнительно облучали in vitro в дозе 2 Гр.
Высокодозовые группы лиц “1 Гр” и “2 Гр” были представлены одними и теми же донорами, т.е. пересекались полностью (включают по 33 человека в каждой группе). Для всех доноров, кто входил в группы “0.5 Гр”, “1 Гр”, “2 Гр” оценивали исходный уровень НХА, т.е. эти группы полностью пересекались с группой доноров “исходный уровень”.
Приготовление препаратов цитокинез-блокированных лимфоцитов. Протокол методики микроядерного теста состоял из нескольких этапов: культивирование Т-лимфоцитов периферической крови, блокирование цитокинеза, гипотоническая обработка, фиксация суспензии клеток, а затем приготовление препаратов [15].
Для исследования использовали образцы цельной крови, взятой из локтевой вены в шприц с гепарином. Приготовление рабочих растворов и постановка культуры клеток выполнялись в стерильных условиях. Для каждого образца крови готовили два культуральных флакона. Флаконы инкубировали в CO2-инкубаторе при 37°С и концентрации CO2 5%. Через 29 ч от начала инкубации вторую пробу подвергали γ-облучению в дозе 1 Гр in vitro. Пробы облучали на установке ИГУР-1. Через 48 ч от начала инкубации в пробы добавляли 70 мкл рабочего раствора цитохалазина Б в DMSO. Через 72 ч от начала инкубации пробы подвергались гипотонической обработке раствором КCl (0.125 М) и фиксации смесью этанола и ледяной уксусной кислоты в соотношении 3 : 1. Далее из зафиксированной клеточной суспензии готовили препараты, которые после высыхания окрашивали 2%-ным красителем Романовского–Гимза в течение 2 ч.
Оценку клеток с микроядрами проводили при световой микроскопии 10 × 100 на микроскопе AxioImager (Германия). Оценивали количество двухъядерных лимфоцитов с микроядрами на 1000 двухъядерных лимфоцитов.
Для исследования микроядерным тестом было сформировано две группы доноров:
1) группа “исходный уровень” – культуру крови доноров не облучали в условиях in vitro, но Т‑лимфоциты подвергались хроническому облучению;
2) группа “1 Гр” – культуру крови доноров дополнительно облучали in vitro в дозе 1 Гр.
Для всех доноров из группы “1 Гр” оценивали исходный уровень клеток с микроядрами, т.е. группы перекрывались по донорам. Группа “исходный уровень” была представлена 633 донорами, а группа “1 Гр” – 497 донорами.
Критерии отбора радиочувствительных лиц. В данном исследовании радиочувствительными донорами назывались лица, у которых наблюдался повышенный цитогенетический клеточный ответ на радиационное воздействие. Как показал анализ распределений цитогенетических данных, представленных в настоящей работе, совокупности не подчинялись нормальному распределению, что соответствует данным литературы. К радиочувствительным донорам относили тех людей, показатели которых превышали 90-й процентиль [16]. В каждой представленной выборке анализировали влияние дозы хронического облучения на ККМ на показатели радиочувствительности. Также оценивали влияние пола и возраста на момент обследования на повышенный уровень цитогенетических нарушений. Для тех доноров, которые были представлены в разных дозовых группах, оценивали воспроизводимость радиочувствительности Т-клеток при разных дозах облучения.
Статистическую обработку данных проводили с применением программы SigmaPlot, для сравнения двух выборок данных использовали непараметрический ранговый критерий Манна–Уитни.
РЕЗУЛЬТАТЫ
В табл. 1 представлены результаты исследования частоты НХА в обследованных группах. В группе “исходный уровень” среди 533 обследованных было выявлено 5.25% радиочувствительных лиц. Возраст этих доноров располагался в ряду от 49 до 89 лет, диапазон облучения ККМ у них составил от 0.01 до 2.6 Гр, у женщин в 2 раза чаще выявлялись клетки с повышенными уровнями НХА.
Таблица 1.
Частота обменных нестабильных аберраций (M ± SD) и показатели радиочувствительности в подгруппах обследованных лиц
| Показатели | “Исходный уровень” n = 533 |
“0.5 Гр” n = 108 |
“1 Гр” n = 33 |
“2 Гр” n = 33 |
|---|---|---|---|---|
| Обменные аберрации на 100 клеток (M ± SD) | 0.23 ± 0.57 | 0.44 ± 0.66 | 12.97 ± 4.76 | 49.45 ± 17.96 |
| 90% | 1.00 | 1.05 | 18.00 | 61.2 |
| Количество радиочувствительных доноров | 28 (5.2%) | 11 (10.2%) | 3 (9.1%) | 4 (12.1%) |
| пол возраст дозы на ККМ, Гр |
19 жен : 9 муж 49–89 лет 0.01–2.60 |
9 жен : 2 муж 56–76 лет 0.05–1.43 |
1 жен : 2 муж 60–79 лет 0.007–1.71 |
3 жен : 1 муж 57–82 года 0.007–1.38 |
В группе “0.5 Гр” повышенный уровень хромосомных аберраций наблюдался чаще у женщин (9 и 2 соответственно), возраст этих доноров варьировал от 56 до 76 лет, индивидуальные дозы хронического облучения на ККМ располагались в ряду от 0.05 до 1.43 Гр.
Поскольку группы “исходный уровень” и “0.5 Гр” были самые многочисленные, предполагалось, что в этих группах будет выявлена наибольшая воспроизводимость повышения частоты маркеров облучения у одних и тех же лиц. Однако только у одной женщины 73 лет с дозой на ККМ, равной 0.75 Гр, выявили повышенные уровни НХА в группе “исходный уровень” и в группе “0.5 Гр”. Таким образом, остальные лица, имевшие уровень НХА выше 90-го процентиля в группе “0.5 Гр”, не имели таких же высоких значений НХА в группе “исходный уровень”.
В группе “1 Гр” повышенные уровни хромосомных обменов выявили у трех человек (одна женщина и двое мужчин). Это были доноры в возрасте 60, 70 и 79 лет на момент обследования. Дозы на ККМ у них располагались в ряду от 0.007 до 1.71 Гр. В группе “2 Гр” было выявлено четыре радиочувствительных донора (три женщины и один мужчина). Возрастной интервал был также широкий – от 57 до 82 лет и дозы облучения были от 0.007 до 1.39 Гр. Несмотря на то, что последние две группы полностью перекрывались по донорам, эффект радиочувствительности был обнаружен у разных обследуемых лиц. И эти люди не относились к радиочувствительным лицам при оценке исходного уровня НХА.
При анализе частоты Т-клеток с микроядрами выявили достоверные различия показателей в зависимости от пола. Поэтому цитогенетические данные далее представлены отдельно для мужчин и для женщин (табл. 2 и 3).
Таблица 2.
Частота клеток с микроядрами (M ± SD) и показатели радиочувствительности у обследованных женщин
| Показатели | “Исходный уровень” n = 388 (61.3) |
“1 Гр” n = 294 |
|---|---|---|
| (M ± SD), ‰ | 18.83 ± 11.21 | 151.02 ± 44.76 |
| 90% | 30 | 206.5 |
| Количество радиочувствительных доноров | 37 (9.5%) | 29 (9.8%) |
| возраст дозы на ККМ, Гр |
51–88 лет 0.01–2.78 |
54–79 лет 0.06–1.96 |
Таблица 3.
Частота клеток с микроядрами (M ± SD) и показатели радиочувствительности у обследованных мужчин
| Показатели | “Исходный уровень” n = 245 (38.7) |
“1 Гр” n = 203 |
|---|---|---|
| (M ± SD), ‰ | 14.41 ± 8.01 | 135.19 ± 37.1 |
| 90% | 26.3 | 183.4 |
| Количество радиочувствительных доноров | 24 (9.8%) | 20 (9.8%) |
| возраст дозы на ККМ, Гр |
54–84 лет 0.01–1.46 |
55–73 лет 0.08–1.53 |
Как видно из табл. 2, исходный уровень частоты лимфоцитов с МЯ из 388 образцов показатель в 30‰ был превышен у 37 женщин, что составило 9.5% обследованных. Возрастной диапазон радиочувствительных женщин располагался в ряду от 51 года до 88 лет, дозы на ККМ – в широком интервале от 0.01 до 2.78 Гр.
При оценке радиочувствительности лимфоцитов доноров в дозовой группе “1 Гр” из 294 обследованных образцов частота лимфоцитов с МЯ превысила 206.5‰ у 29 женщин, что составило 9.8% обследованных. Возрастной диапазон обследуемых лиц располагался в ряду от 54 до 79 лет.
Радиочувствительными донорами, у которых значения частоты клеток с микроядрами превысили 90-й процентиль и в группе “исходный уровень” и в группе “1 Гр”, были три женщины. Их возраст составил 65, 66 и 67 лет, дозы на ККМ – 1.26, 1.29 и 1.96 Гр, т.е. это были женщины, у которых дозы хронического облучения на ККМ превысили 1 Гр.
Как видно из табл. 3, исходный уровень частоты лимфоцитов с МЯ из 245 образцов значение в 26.3‰ было превышено у 24 мужчин, что составило 9.8% от всей выборки. Возраст радиочувствительных мужчин находился в ряду от 54 до 84 лет, дозы на ККМ у них располагались в широком интервале – от 0.01 до 1.46 Гр.
При оценке радиочувствительности лимфоцитов доноров в дозовой группе “1 Гр” из 203 обследованных образцов частота лимфоцитов с МЯ превысила 183.4‰ у 20 мужчин, что составило 9.8% обследованных. Их возраст располагался в ряду от 55 до 73 лет. Диапазон доз на ККМ у этих лиц составил 0.08–1.53 Гр.
Радиочувствительными донорами, у которых значения частоты клеток с микроядрами превысили 90-й процентиль в группе “исходный уровень” и “1 Гр”, были семь мужчин. Их возраст составил 58, 63, 63, 65, 68, 73 и 73 лет, дозы на ККМ были равны – 0.77, 0.93, 1.17, 0.14, 0.18, 1.01 и 1.24 Гр.
Таким образом, в ходе цитогенетического исследования, проведенного двумя методами в условиях in vitro γ-облучения среди населения Южного Урала, подвергшегося хроническому радиационному воздействию, выявили превышение цитогенетических показателей у небольшой части обследованной выборки (около 10%). Не было отмечено влияния дозы на ККМ хронического аварийного облучения на радиочувствительность Т-клеток, поскольку превышение повреждений ДНК в ФГА-стимулированных лимфоцитах наблюдалось у доноров как с низкими, так и с высокими дозами на ККМ (от 0.007 до 2.78 Гр). Высокие уровни НХА чаще выявляли у женщин, однако микроядерный тест влияния пола не выявил. Не обнаружили также влияния возраста на радиочувствительность Т-клеток у лиц в исследуемом возрастном диапазоне (48–89 лет). По уровню хромосомных аберраций отметили повышенные значения в группе “исходный уровень” и “0.5 Гр” только у одной женщины. А по методу микроядерного теста у 3 женщин и 7 мужчин (1 и 3.4% доноров соответственно).
ОБСУЖДЕНИЕ
Вопрос о радиочувствительности организма достаточно непростой, поскольку организм – сложная система и включает много элементов и связей между ними. В классической радиобиологии принято оценивать радиочувствительность на основе выживания клеточных культур или в экспериментах на животных [4].
Данные других исследователей и результаты, представленные в нашей работе, говорят в пользу того, что однозначно оценивать “радиочувствительность” всего организма на основе известных “клеточных” подходов пока не представляется возможным. Сложно устроенная многоуровневая система с огромным количеством регуляторных связей и механизмов (что представляет из себя организм человека) может модифицировать радиобиологический ответ и проявить иную реакцию на облучение в отличие от клеточной культуры при облучении in vitro. Так, в ходе исследования продуктов генов, ответственных за регуляцию клеточного цикла (TP53, CHK2, MDM2, NBS1, BRCA1, RAD17, АТМ), было отмечено, что недостаточное количество или отсутствие ферментов, регулирующих определенные стадии клеточного цикла, приводит к увеличению частоты мутирования и геномной нестабильности клеток [17].
Радиочувствительность организма может быть выявлена как при воздействии малых, так и высоких доз ионизирующего излучения, что косвенно подтверждают и данные, полученные в настоящем исследовании. Очень важно, что при использовании двух цитогенетических методов (метод простого окрашивания метафазных хромосом и микроядерный тест) были получены сходные результаты относительно влияния аварийного хронического облучения на радиочувствительность Т-клеток обследованных лиц. В ходе анализа данных было отмечено, что радиочувствительность во всех группах доноров выявлялась и при малых дозах на ККМ (0.007 Гр) и при высоких дозах на ККМ (до 2.78 Гр). Таким образом, в данной работе не было выявлено влияния дозы хронического облучения ККМ на проявление радиочувствительности ФГА-стимулированных Т-лимфоцитов.
Считается, что при малых дозах существенную роль играют “немишенные эффекты”, что приводит к большему эффекту от воздействия за счет увеличения объема ткани, вовлеченной в ответ, и не наблюдается зависимости эффектов от дозы. Существует предположение, что именно механизмы, лежащие в основе этих эффектов, влияют на индивидуальное разнообразие при радиобиологическом ответе. В работе [18] убедительно показано, что в передаче сигналов от поврежденной радиацией клетки к соседним необлученным клеткам задействованы межклеточные щелевые каналы и секреция растворимых факторов в межклеточное пространство, где активная роль принадлежит экзосомам. Отмечено, что даже при малых дозах повреждений от облучения больше, чем изначальный объем ткани, подвергшейся радиационному воздействию.
Важно отметить, что в настоящей работе радиочувствительными были клетки от 5 до 12% обследованных во всех группах, что может доказывать существенное влияние особенностей генома на радиочувствительность. Так, структурные особенности хроматина, генов (ОНП, мутации) способны модифицировать клеточный радиобиологический ответ: вызывать повышенный уровень хромосомных аберраций; усиливать или подавлять экспрессию отдельных генов; изменять интенсивность биохимических реакций и их каскадов и т.д. [19]. Влияние генетического фактора на вариацию радиобиологического ответа доказывает наличие редких синдромов у человека, которые предполагают высокую радиочувствительность при воздействии ионизирующего излучения (например: атаксия телеангиэктазия, синдром Ли Фраумени, анемия Фанкони, синдром повреждений хромосом Неймегена (NBS), синдром Корнелии де Ланге и т.д.) [7]. При таких синдромах фракция выживших клеток при облучении 2 Гр (SF2) составляет от 10 до 50% и увеличивается в 1.5–2 раза выход индуцированных хромосомных аберраций. Гомозиготные носители мутаций генов LIG4 или ATM, когда SF2 составляет всего 1%, хорошо поддаются лучевой терапии и для них уместно применить термин “гиперрадиочувствительность” [20, 21].
Наиболее хорошо исследована радиочувствительность у лиц, прошедших лучевую терапию. При наблюдении этих людей отмечались различные по степени тяжести поражения тканей и широкая вариабельность повреждений хромосом. Полиморфизмом гена GSTP1 можно было объяснить ∼35% изменчивости реакции на радиотерапию [22, 23].
Для 99 человек изучалась сопряженность частоты γ-индуцированных (1 Гр in vitro) аберраций хромосом с полиморфизмом 45 кандидатных генов репарации, детоксикации ксенобиотиков и оксидативного стресса (всего было изучено 53 сайта). В ходе исследования была обнаружена сопряженность уровней аберраций хромосомного типа с носительством минорных аллелей полиморфных сайтов генов OGG1 Ser326Cys, ABCB1 Ile1145 и NQO1 Pro187Ser (р = 0.0002). Совместное использование генетических и цитогенетических предикторов позволило объяснить более 30% популяционной изменчивости радиочувствительности хромосом [24].
Широкая вариабельность цитогенетических показателей отмечалась и в настоящем исследовании даже при высоких дозах облучения in vitro. Так, частота НХА в группе “1 Гр” варьировала от 5 до 24 на 100 клеток, а в группе “2 Гр” – от 18 до 104 на 100 клеток. Частота клеток с микроядрами в группе “1 Гр” варьировала от 30 до 336‰.
Известно, что к факторам, моделирующим радиобиологический ответ, относятся возраст, курение, наличие диабета и васкулярные заболевания, связанные с коллагеном. Данные относительно влияния на этот показатель пола, этнической принадлежности, диеты, алкоголя и других привычек либо отсутствуют, либо противоречивы [25]. В нашем исследовании установить влияние возраста на радиочувствительность Т‑лимфоцитов не удалось. Анализ данных показал, что повышенный уровень повреждений ДНК отмечали у лиц разного возраста в широком диапазоне – от 49 до 89 лет.
Что касается воспроизводимой повышенной радиочувствительности Т-клеток, то при оценке частоты НХА отметили только одну женщину (менее 1% выборки) у которой в “исходном уровне” и при “0.5 Гр” была обнаружена повышенная частота хромосомных обменов. Вопреки нашим ожиданиям, у радиочувствительных доноров в группе “1 Гр” и “2 Гр” не было отмечено такого же результата в “исходном уровне”. При использовании микроядерного теста воспроизводимую радиочувствительность клеток отметили у большего количества обследованных людей (три женщины и семь мужчин).
В представленном нами анализе цитогенетических данных, как в любом исследовании, есть неточности, которые могли повлиять на результаты. К ним можно отнести разное количество клеток (от 100 до 500) при анализе метафазных пластинок, малое число доноров в высокодозовых группах, ошибки оценок индивидуальных доз облучения ККМ, которые могут в некоторых случаях составлять до 30%. Однако выводы, которые сделаны на основании проведенного анализа, соответствуют опубликованным литературным данным, представленным нами выше.
Таким образом, мы считаем, что наши результаты позволяют заключить следующее:
необходимо с осторожностью делать выводы об индивидуальной реакции всего организма на облучение на основе клеточных методик, проведенных в условиях in vitro;
индивидуальная радиочувствительность организма примерно у 10% обследованных будет существенно влиять на результаты индивидуальной биодозиметрии. Это необходимо учитывать при подготовке экспертных заключений о наличии факта воздействия облучения на человека, а также при трактовке значений доз аварийного облучения в клинической практике.
Авторы выражают благодарность И.А. Чикиревой и З.И. Сыченко за техническое сопровождение работы.
Работа была поддержана Федеральным медико-биологическим агентством России.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Di Giorgio M., Sard M., Busto E. et al. Assessment of individual radiosensitivity in human lymphocytes using micronucleus and microgel electrophoresis “Comet” assays // Presentadoen: 11th International Congress on the International Radiation Protection Association. Madrid, España, 23–28 mayo 2004.
IAEA. International Atomic Energy Agency Technical Reports Series № 405. Cytogenetic Analysis for Radiation Dose Assessment: A Manual. 2011. P. 30–45.
Awa A. Persistent chromosome aberrations in the somatic cells of A-bomb survivors, Hiroshima and Nagasaki // Radiat. Res. 1991 (Suppl. 1). P. 265–274. https://doi.org/10.1269/jrr.32.Suppl_1.265
Отчет МКРЗ по тканевым реакциям, ранним и отдаленным эффектам в нормальных тканях и органах – пороговые дозы для тканевых реакций в контексте радиационной защиты / Под ред. Аклеева А.В., Киселёва М.Ф. Челябинск: Книга, 2012. 384 с. (Труды МКРЗ; публикация 118)
Le Guen B. Views on emerging scientific and societal issues in Radiological Protection Individual radiosensitivity and screening tests in the workplace // Workshop on Science and Values in Radiological Protection. Helsinki, Finland, 15–17 January 2008. https://inis.iaea.org.
Workshop on Science and Values in Radiological Protection. Helsinki, Finland, 15–17 January 2008. https://inis.iaea.org.
Foray N., Colin C., Bourguignon 100 years of individual radiosensitivity: how we have forgotten the evidence // Radiology. 2012. V. 264. P. 627–631.
Franco N., Lamartine J., Frouin V. et al. Low-dose exposure to gamma rays induces specific gene regulations in normal human keratinocytes // Radiat. Res. 2005. V. 163. P. 623–635. https://doi.org/10.1667/RR3391
Morgan W., Sowa M. Effects of ionizing radiation in nonirradiated cells // Proc. Natl Acad. Sci. USA. 2005. V. 102. № 40. P. 14127–14128. https://doi.org/10.1073/pnas.0507119102
Рубанович А.В., Хромов-Борисов Н.Н. Оценки генетических рисков при совместном действии генов: критический обзор // Генетика. 2016. Т. 52. № 7. С. 865–878. https://doi.org/10.7868/S0016675816070079
Сальникова Л.Е., Чумаченко А.Г., Веснина И.Н. и др. Анализ генотипической зависимости частот хромосомных аберраций в лимфоцитах человека при облучении in vivo и in vitro // Радиац. биология. Радиоэкология. 2010. Т. 50. № 3. С. 340–344.
Медико-биологические и экологические последствия радиоактивного загрязнения реки Теча // Под ред. Аклеева А.В., Киселева М.Ф. М.: Медбиоэкстрем, 2001. 532 с.
Degteva M.O., Shagina N.B., Tolstykh E.I. et al. Calculations of individual dose from environmental exposures on the Techa river and EURT using TRDS-2016 for members of the TRC members. Urals Research Center for Radiation Medicine and Pacific Northwest National Laboratory. 2017 // Final Report for Milestone 13, Part 1. April 2017. https://doi.org/10.1016/j.jenvrad.2017.08.013
Vozilova A.V., Shagina N.B., Degteva M.O., Akleyev A.V. Chronic radioisotope effects on residents of the Techa river (Russia) region: cytogenetic analysis more than 50 years after onset of exposure // Mut. Res. Gen. Toxicol. Environmen. Mutagen. 2013. V. 756. https://doi.org/10.1016/j.mrgentox.2013.05.016
Ахмадуллина Ю.Р. Радиочувствительность Т-лимфоцитов периферической крови у потомков первого поколения, отцы которых подверглись хроническому радиационному воздействию: Автореф. дис. … канд. биол. наук. М.: МГУ им. М.В. Ломоносова, 2014.
Гланц С. Медико-биологическая статистика McGraw‑Hill, 1994. М.: Практика, 1998. 459 с.
Xu B., Kim S., Lim D., Kastan M.G. Two molecularly distinct G2/M checkpoints are induced by ionizing irradiation // Mol. Cell. Biol. 2002. V. 22. № 4. P. 1049–1059. https://doi.org/10.1128/MCB.22.4.1049-1059.2002
Le M., Fernandez-Palomo C., McNeill F.E. et al. Exosomes are released by bystander cells exposed to radiation-induced biophoton signals: Reconciling the mechanisms mediating the bystander effect // PLoS One. 2017. V. 12(3). P. e0173685. https://doi.org/10.1371/journal.pone.0173685
Gorbunova V., Seluanov A. DNA double strand break repair, aging and the chromatin connection // Mut. Res. 2016. V. 788. P. 2–6. https://doi.org/10.1016/j.mrfmmm.2016.02.004
Gately D.P., Hittle G.S., Chan K.T., Yen T.J. Characterization of ATM expression, localization, and associated DNA-dependent protein kinase activity // Mol. Biol. Cell. 1998. V. 9. P. 2361–2374.
Хандогина Е.К. Изучение генетического контроля радиочувствительности // Генетика. 2010. Т. 46. № 3. С. 293–301.
Karahalil B., Sardas S., Kocabas N. et al. Chromosomal aberrations under basal conditions and after treatment with X-ray in human lymphocytes as related to the GSTM1 genotype // Mut. Res. 2002. P. 515. https://doi.org/10.1016/S1383-5718(02)00003-7
Marcona F., Andreoli C., Rossi S. et al. Assessment of individual sensitivity to ionizing radiation and DNA repair efficiency in a healthy population // Mut. Res. 2003. V. 541. https://doi.org/10.1016/S1383-5718(03)00171-2
Сальникова Л.Е., Чумаченко А.Г., Белопольская О.Б., Рубанович А.В. Генетические и цитогенетические предикторы радиочувствительности хромосом человека // Радиац. биология. Радиоэкология. 2013. Т. 53. № 3. С. 259–266.https://doi.org/10.21870/0131-3878-2018-27-2-46-61
Bouffler S. Evidence for variation in human radiosensitivity: potential impact on radiological protection 22 October 2015 ICRP Symposium 2015, Seoul, South Korea. https://doi.org/10.1177/0146645315623158
Дополнительные материалы отсутствуют.