Генетика, 2019, T. 55, № 11, стр. 1327-1334
Особенности наследования признака восстановления фертильности пыльцы подсолнечника при цитоплазматической мужской стерильности
Ю. И. Карабицина 1, В. А. Гаврилова 1, Н. В. Алпатьева 1, Е. Б. Кузнецова 1, И. Н. Анисимова 1, *
1 Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений
имени Н.И. Вавилова
190000 Санкт-Петербург, Россия
* E-mail: irina_anisimova@inbox.ru
Поступила в редакцию 07.02.2019
После доработки 14.05.2019
Принята к публикации 30.05.2019
Аннотация
Изучали потомства от скрещиваний стерильной линии ВИР116А с ЦМС РЕТ1 с линиями восстановителями фертильности пыльцы RIL130, ВИР210 и ВИР740, различавшимися по типу цитоплазмы и наличию диагностических молекулярных маркеров гена Rf1. Пыльца растений F1 всех трех комбинаций скрещиваний была высокофертильной (89.9–98.3% окрашенных пыльцевых зерен, ПЗ). Каждая из популяций F2 (ВИР116А × RIL130, ВИР116А × ВИР210 и ВИР116А × ВИР740) расщеплялась по признаку фертильности пыльцы в соотношении 3 (фертильные) : 1 (стерильные). Среди фертильных генотипов F2 выявлены “малопыльцовые”, у которых при визуальной оценке наблюдалось меньше пыльцы, чем в норме. Их частота составляла примерно 9% от общего числа растений в каждой из популяций, что согласуется с результатами, полученными ранее при анализе других гибридных комбинаций. При цитологическом анализе пыльца “малопыльцовых” растений характеризовалась пониженной (по сравнению с высокофертильными растениями) частотой фертильных ПЗ (80–100 и 11–78% соответственно) и более высоким содержанием аномальных ПЗ (у “малопыльцовых” до 88.5%, у растений с нормальным уровнем фертильности – до 18). С помощью молекулярных маркеров HRG01 и HRG02 подтверждено присутствие доминантного аллеля Rf1 в генотипах фертильных растений F2 (в том числе и “малопыльцовых”), что свидетельствует об их высокой диагностической ценности. Обсуждаются возможные генетические механизмы появления “малопыльцовых” сегрегантов F2.
Явление цитоплазматической мужской стерильности (ЦМС) – неспособность растения продуцировать фертильную пыльцу вследствие мутаций митохондриального генома – широко используется в селекции ряда сельскохозяйственных культур (кукурузы, сорго, рапса, подсолнечника). Помимо практической значимости, ЦМС как результат нарушений согласованной работы геномов ядра и митохондрий представляет идеальную модель для выяснения генетических механизмов ядерно-цитоплазматических взаимоотношений. Гибридное растение от скрещивания стерильной линии ЦМС с фертильной продуцирует пыльцу и завязывает семена в том случае, если в его генотип из генотипа отцовской линии-опылителя был введен функциональный аллель гена, супрессирующего эффекты ассоциированного с ЦМС аберрантного митохондриального генома. Такое явление называется восстановлением фертильности, а гены, детерминирующие признак восстановления фертильности пыльцы, обозначают символом Rf (Restoration of fertility). Современная селекция подсолнечника (Helianthus annuus L.) ориентирована на создание высокопродуктивных, устойчивых к болезням и вредителям гетерозисных гибридов на основе ЦМС. При создании гибридов подсолнечника используется преимущественно один тип ЦМС – РЕТ1, полученный в результате межвидового скрещивания H. petiolaris Nutt. × H. annuus [1]. ЦМС PET1 обусловлена экспрессией аберрантного митохондриального гена orfH522, продукт которого – белок с молекулярной массой 16 кДа – губителен для развития пыльцы [2–4]. Генетический контроль признака восстановления пыльцы у подсолнечника при ЦМС РЕТ1-типа изучен недостаточно. На основании данных гибридологического анализа разными авторами были сделаны предположения о наличии одного [5–7], двух комплементарных [8–10], трех [11] и даже четырех [12, 13] доминантных генов с различными типами взаимодействия. Согласно современным представлениям, для восстановления фертильности пыльцы при ЦМС РЕТ1 наряду с главным геном ген Rf1, локализованным в группе сцепления 13 интегрированной молекулярно-генетической карты, необходимо присутствие в генотипе гена Rf2, фенотипические эффекты которого не изучались, природа и хромосомная локализация неизвестны [14]. Рядом авторов были разработаны тесно сцепленные с локусом Rf1 маркеры, однако сам ген пока не клонирован и его нуклеотидная последовательность неизвестна [15–18].
Созданная в ВИРе генетическая коллекция подсолнечника насчитывает около 300 линий, в том числе стерильные линии на основе ЦМС PET1, закрепители стерильности и восстановители фертильности пыльцы [19]. Генетическое разнообразие коллекции по признаку фертильности пыльцы изучено недостаточно. С использованием диагностического маркера orfH522, ассоциированного с ЦМС PET1 [20, 21], было показано, что большинство (87%) линий-восстановителей имеют стерильный (PET1) тип цитоплазмы. В то же время у отдельных линий, восстанавливающих фертильность пыльцы при скрещиваниях с линиями ЦМС, диагностические маркеры гена Rf1 не выявлены [22–24].
У разных видов растений при оценке признака восстановления мужской фертильности, как правило, используют морфометрические параметры пыльцы, а также завязываемость семян при самоопылении [25–28]. Ранее нами при изучении наследования признака восстановления фертильности пыльцы в F2 гибридов от скрещиваний стерильных линий подсолнечника на основе ЦМС PET1 с линиями-восстановителями был отмечен моногенный характер расщепления. В популяциях F2, наряду с фертильными и стерильными, были обнаружены растения, у которых при визуальной оценке наблюдали значительно меньшее, чем обычно количество пыльцы в цветущей корзинке; такие формы обозначали как “малопыльцовые” [29]. Информация о генетической природе признака “малопыльцовости” и особенностях его проявления на цитологическом уровне отсутствует. Согласно данным О.Н. Вороновой с соавторами [30], в нормально развитых пыльниках подсолнечника более половины пыльцевых зерен (ПЗ) могут оказаться стерильными (от 44 до 99%).
Показатели фертильности пыльцы имеют важное селекционное значение, так как отцовские линии подсолнечника обычно получают на основе коммерческих гибридов путем отбора фертильных растений из расщепляющихся гибридных популяций F2 [31]. Кроме того, информация об особенностях проявления признака восстановления мужской фертильности на фоне стерильной цитоплазмы и характере наследования в гибридных поколениях необходима для понимания его молекулярных механизмов. В этой связи в данное исследование входило: 1) изучение характера наследования признака восстановления фертильности пыльцы при скрещиваниях линий генетической коллекции подсолнечника ВИР, различавшихся по типу цитоплазмы и наличию молекулярных маркеров гена Rf1; 2) определение особенностей проявления признака фертильности пыльцы на цитологическом уровне; 3) валидация диагностических молекулярных маркеров гена Rf1 на материале расщепляющихся гибридных популяций.
МАТЕРИАЛЫ И МЕТОДЫ
Исходным материалом для скрещиваний служили инбредные линии подсолнечника из генетической коллекции ВИР высоких (более 20) поколений инбридинга: стерильная линия ВИР116А, фертильные линии RIL130, ВИР210 и ВИР740 различного происхождения, а также гибриды от скрещиваний ВИР116А с фертильными линиями. Родительские линии, гибриды F1 и расщепляющиеся гибридные популяции F2 (ВИР116А × RIL130, ВИР116А × ВИР210 и ВИР116А × ВИР740) были изучены в полевых и лабораторных условиях по признакам фертильности пыльцы, а также генотипированы с помощью молекулярных маркеров, ассоциированных с генетической системой ЦМС-Rf. Скрещивания выполнены на Кубанской опытной станции ВИР в 2011 г., гибриды F1 и расщепляющиеся гибридные популяции F2 выращены в Пушкинском филиале ВИР в 2012–2017 гг.
Для проведения цитологического анализа с каждого из отцовских фертильных растений, гибридов F1 и F2 в период массового цветения собирали пять цветков и фиксировали в фиксаторе FAA (ФУС), в состав которого входил 70%-ный спирт (100 мл), ледяная уксусная кислота (7 мл), 40%-ный формалин (7 мл) [32]. Фертильность пыльцы оценивали визуально (по наличию нормально развитых пыльников, содержавших пыльцу), а также на глицерин-желатиновых препаратах, окрашенных ацетокармином по методике Навашина [33].
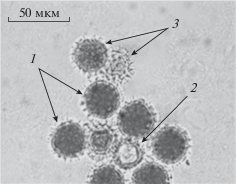
Цитологический анализ выполнен с помощью микроскопа (Zeiss Axioplan 2 imaging, Германия) при увеличении ×20 и ×40. При оценке показателей фертильности пыльцы использовали подход, изложенный в работах О.Н. Вороновой с соавт. [30]. Учитывали все ПЗ в десяти произвольных полях зрения каждого препарата, приготовленного из пыльников пяти цветков одного растения, разделяя их на фертильные, стерильные и аномальные; параллельно оценивали диаметр ПЗ. К фертильным относили полностью окрашенные морфологически правильные ПЗ; к стерильным – неокрашенные, но морфологически правильные, а к аномальным – морфологически неправильные со слабым окрашиванием содержимого (например, ПЗ не округлой формы) (рис. 1). К классу аномальных относили также аномально крупные (макро-) и аномально мелкие (микро-) ПЗ.
Тотальную ДНК выделяли из этиолированных проростков линий, а также из зеленых листьев 5‑недельных растений F2 с использованием модифицированного СТАБ-метода [34].
В молекулярно-генетическом анализе использовали STS-маркер, специфичный для митохондриального локуса orfH522 [21], ассоциированный с PET1-типом цитоплазмы (праймеры orfH522: прямой 5'-TGC CTC AAC TGG ATA AAT TCAC-3', обратный 5'-ACC GTT CTC TCA CGA GTT GAAG-3'), и SCAR-маркеры HRG01 и HRG02 гена Rf1 [15]. Для амплификации маркера HRG01 использовали праймеры К13 (прямой 5'‑TAT GCA TAA TTA GTT ATA CCC-3', обратный 5'-ACA TAA GGA TTA TGT ACG GG-3'), а для амплификации маркера HRG02 – праймеры Y10 (прямой 5'-AAA CGT GGG AGA GAG GTG G-3', обратный 5'-AAA CGT GGG CTG AAG AAC TA-3'). Реакционная смесь (25 мкл) содержала 50 нг геномной ДНК, однократный реакционный буфер, по 0.4 мкМ каждого из праймеров, по 0.2 мМ каждого dNTP (дезоксинуклеотидтрифосфаты) и 0.2 е.а. Taq ДНК-полимеразы, 0.1 мкг/мкл BSA (бычий сывороточный альбумин), 15.89 мкл ddН2О. Реагенты для ПЦР были получены от фирмы “Диалат” (Россия), бычий сывороточный альбумин – от фирмы Thermo Fisher Scientific (США). Праймеры синтезированы ООО “Евроген” (Россия). ПЦР проводили в термоциклере DNA Engine Tetrad 2 (Bio Rad, США).
Для праймеров orfH522 использовали следующую программу: начальная денатурация – 2 мин при 95°С, далее 36 циклов, включающих денатурацию – 1 мин при 95°С, отжиг праймеров – 1 мин при 59°C, элонгацию – 1 мин при 72°С; цикл финальной элонгации – 5 мин при 72°С. ПЦР с праймерами K13 и Y10 проводили при следующих условиях: начальная денатурация – 10 мин при 94°С, далее 36 циклов, включающих денатурацию – 45 с при 94°С, отжиг праймеров – 45 с при 58°C, элонгацию – 1 мин при 72°С; цикл финальной элонгации – 6 мин при 72°С. Продукты амплификации разделяли электрофорезом в 1.5%-ном агарозном геле.
Статистическая обработка результатов выполнена с использованием программ Excel 2007–2010 и Statistica 6.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
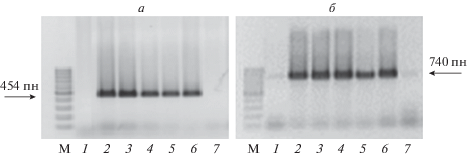
Родительские линии для скрещиваний были подобраны на основе предварительного молекулярного скрининга генетической коллекции подсолнечника ВИР, выполненного с помощью диагностических SCAR-маркеров гена Rf1 и STS-маркера orfH522 [23]. При амплификации ДНК материнской линии ВИР116А и отцовских линий RIL130 и ВИР210 с помощью праймеров orfH522 был получен диагностический фрагмент 516 пн, следовательно, эти линии имели стерильную (S) цитоплазму PET1-типа. В то же время у линии ВИР740 маркер orfH522 не обнаружен, эта линия характеризовалась фертильным (N) типом цитоплазмы. Кроме того, отцовские линии различались по наличию диагностических SCAR-маркеров HRG01 и HRG02 гена Rf1. Линии RIL130 и ВИР740 имели оба маркера, тогда как у линии ВИР210 маркеры гена Rf1 отсутствовали (рис. 2).
Рис. 2.
Электрофореграммы продуктов амплификации, полученных при использовании праймеров HRG01 (а) и HRG02 (б); 1 – ВИР210, 2 – ВИР740, 3 – RIL130, 4 – ВИР378, 5 – ВИР369, 6 – ВИР743, 7 – ВИР116А. М – маркер молекулярного веса ДНК (“Диалат”, Россия).
Поскольку линия ВИР210 характеризовалась стерильной цитоплазмой, но была фертильной, можно предположить, что в ее генотипе присутствовал ген (или гены) Rf (табл. 1).
Таблица 1.
Характеристика родительских линий
| Линия | Происхождение | Наличие маркеров | Тип цитоплазмы | Фертильные ПЗ, % | Диаметр ПЗ (среднее), мкм | ||
|---|---|---|---|---|---|---|---|
| orfH522 | HRG01 | HRG02 | |||||
| ВИР116А | Сорт Вымпел | + | – | – | S (PET1) | – | – |
| RIL130 | и-598221 | + | + | + | S (PET1) | 91.5 ± 0.3 | 29.80 ± 0.01 |
| ВИР740 | ВИР113 × источник Rf | – | + | + | N | 97.0 ± 0.1 | 33.34 ± 0.01 |
| ВИР210 | Неизвестно | + | – | – | S (PET1) | Не анализировали | |
Показатели фертильности пыльцы линий RIL130 и ВИР740 оказались высокими (91.5 и 97.0% фертильных ПЗ соответственно, табл. 1). Следует также отметить более низкие средние значения диаметра ПЗ у линии RIL130 по сравнению с ВИР740. Аномальные ПЗ у инбредных линий встречались крайне редко (с частотой <0.05%).
F1 от скрещиваний ВИР116А (РЕТ1) с линиями RIL130, ВИР740 и ВИР210 было фертильным. Гибридные растения характеризовались высоким уровнем фертильности пыльцы (89.9–98.3% фертильных ПЗ), пыльца была выровнена по диаметру (табл. 2). У растений отмечались аномальные ПЗ, Доля аномальных ПЗ у растений F1 различных комбинаций скрещиваний составляла 0.8–4.96%. Средние значения диаметра ПЗ у гибридов F1 отличались незначительно.
Таблица 2.
Характеристика пыльцы растений F1
| Комбинация F1 | Число растений, шт | Фертильные ПЗ, % | Стерильные ПЗ, % | Аномальные ПЗ, % | Диаметр ПЗ (среднее), мкм |
|---|---|---|---|---|---|
| ВИР116А × RIL130 | 3 | 98.2 ± 0.2 | 1.5 ± 0.2 | 0.8 ± 0.1 | 27.97 ± 0.01 |
| ВИР116А × ВИР740 | 3 | 89.9 ± 0.8 | 5.2 ± 1.0 | 5.0 ± 1.2 | 28.12 ± 0.01 |
| ВИР116А × ВИР210 | 2 | 98.3 ± 0.9 | 1.2 ± 0.4 | 2.4 ± 0.9 | 28.11 ± 0.01 |
Каждая из трех проанализированных семей F2 являлась потомством одного растения и расщеплялась по признаку фертильности пыльцы на фертильные (продуцировавшие пыльцу) и стерильные (без пыльцы) в соотношении 3 : 1, что соответствовало теоретически ожидаемому при моногенных различиях родительских линий (табл. 3). Кроме того, в каждой из популяций F2 были обнаружены “малопыльцовые” растения (их обозначили F/S), доля которых составляла 12.1–12.5% от числа фертильных растений и около 9% от общего числа растений в популяции. Во всех случаях фенотип “малопыльцовых” растений (фенотипический класс F/S) отличался от фенотипа высокофертильных растений (F) дефектами пыльников и корзинки, а также значительно меньшим, чем обычно, количеством пыльцы в цветущей корзинке.
Таблица 3.
Расщепление F2 гибридов по признаку восстановления фертильности пыльцы
| Комбинация скрещивания | Фенотипические классы | Общее число растений | Теоретически ожидаемое расщепление (F + F/S) : S | χ2 | p | ||
|---|---|---|---|---|---|---|---|
| F | F/S | S | |||||
| ВИР116А × RIL130 | 80 | 11 | 33 | 124 | 3 : 1 | 0.17 | 0.05 < p < 0.8 |
| ВИР116А × ВИР740 | 84 | 12 | 37 | 133 | 3 : 1 | 0.56 | 0.05 < p < 0.8 |
| ВИР116А × ВИР210 | 63 | 9 | 28 | 100 | 3 : 1 | 0.48 | 0.05 < p < 0.8 |
Результаты сравнения с помощью t-критерия Стьюдента показали, что изученные комбинации F2 статистически не различались по частоте встречаемости “малопыльцовых” растений (p > 0.05). Мы предположили, что выщепление в F2 группы “малопыльцовых” растений в каждой из комбинаций, полученных с участием одной и той же материнской формы, имеет генетическую основу. Это дало основание для выделения “малопыльцовых” растений в отдельный фенотипический класс. Заметим, что появление “малопыльцовых” форм с такой же частотой наблюдалось нами ранее и при анализе межлинейных гибридов, полученных от скрещиваний линии ВИР109А (ЦМС РЕТ1) с линиями-восстановителями из генетической коллекции ВИР [29].
Процент фертильных ПЗ у растений с высоким уровнем фертильности пыльцы варьировал незначительно (Сv 4.1–5.7%), тогда как у “малопыльцовых” значения коэффициента вариации колебались от 12.8 до 38.6% (табл. 4). Пыльца “малопыльцовых” растений характеризовалась следующими особенностями: частота окрашенных (фертильных) ПЗ была ниже, чем у растений с высоким уровнем фертильности (11–78 и 80–100% соответственно), а содержание аномальных ПЗ достигало 88.5 у “малопыльцовых” и 18% у высокофертильных растений. У растений F2 с высоким уровнем фертильности пыльцы диаметр ПЗ существенно не различался в пределах отдельных комбинаций. Следует отметить, что диаметр стерильных ПЗ варьировал в более широких пределах по сравнению с диаметром фертильных за счет наличия микро- и макро-ПЗ и составил 9.85–32.01 мкм у растений с высокой фертильностью пыльцы и 8.48–36.66 мкм – у “малопыльцовых”.
Таблица 4.
Сравнительная характеристика ПЗ растений, различающихся по показателям фертильности
| Характеристика ПЗ | Комбинации и фенотипические классы | ||||||
|---|---|---|---|---|---|---|---|
| ВИР116А × RIL130 | ВИР116А × ВИР740 | ВИР116А × ВИР210 | |||||
| F | F/S | F | F/S | F | F/S | ||
| По типу | |||||||
| Окрашенные, % | min | 83.5 | 11 | 81.9 | 34.7 | 79.8 | 50.2 |
| max | 100 | 78 | 99.3 | 76.3 | 98.1 | 77.3 | |
| Сv, % | 4.1 | 38.6 | 4.9 | 27.8 | 5.7 | 12.8 | |
| Неокрашенные, % | min | 0 | 0.5 | 0 | 0.7 | 0 | 2.4 |
| max | 12.6 | 16.9 | 11.7 | 34.4 | 18.2 | 22.8 | |
| Сv, % | 71.3 | 66.0 | 78.1 | 105.6 | 109.2 | 78.8 | |
| Аномальные, % | min | 0 | 8.5 | 0 | 10.4 | 0 | 1.9 |
| max | 9.2 | 88.5 | 17.4 | 58.2 | 17.6 | 42.5 | |
| Сv, % | 67.8 | 70.3 | 77.8 | 32.1 | 80.7 | 57.9 | |
| По диаметру | |||||||
| Диаметр фертильных ПЗ, мкм | min | 20.52 | 18.33 | 21.34 | 22.43 | 20.52 | 21.89 |
| max | 30.91 | 33.92 | 31.46 | 33.11 | 31.74 | 32.56 | |
| Диаметр стерильных ПЗ, мкм | min | 18.33 | 8.48 | 17.24 | 17.24 | 9.85 | 19.15 |
| max | 31.74 | 31.46 | 28.73 | 36.66 | 32.01 | 29.82 | |
| Среднее, мкм | 25.99 ± 0.01 | 24.80 ± 0.01 | 26.98 ± 0.01 | 25.72 ± 0.01 | 27.36 ± 0.01 | 26.81 ± 0.01 | |
| Число проанализированных растений, шт. | 80 | 11 | 84 | 12 | 63 | 9 | |
Исходя из результатов анализа расщеплений, можно предположить, что родительские линии всех трех комбинаций скрещиваний различались по аллелям одного главного гена, контролирующего признак восстановления фертильности пыльцы – очевидно, Rf1. Для определения генотипов растений F2 по локусу Rf1 был проведен молекулярный анализ с использованием сцепленных с геном Rf1 SCAR-маркеров HRG01 и HRG02.
Популяция F2 от скрещивания ВИР116А × × ВИР210 не расщеплялась по наличию молекулярных маркеров HRG01 и HRG02, поскольку эти маркеры отсутствовали у родительских форм. Фертильные растения гибридов ВИР116А × RIL130 и ВИР116А × ВИР740, в том числе и относившиеся к фенотипическому классу “малопыльцовых”, за единичными исключениями, характеризовались наличием обоих маркеров, что подтверждает присутствие в их генотипах доминантного аллеля гена Rf1 в гомо- или гетерозиготном состоянии (табл. 5). У большинства стерильных растений (предполагаемых гомозигот по рецессивному аллелю rf1) маркеры отсутствовали. В каждой из комбинаций в фенотипических классах – “малопыльцовых” и растений с высоким уровнем фертильности – выявлены генотипы, не имевшие маркеров, а также стерильные растения, у которых маркеры присутствовали. Среди “малопыльцовых” растений выявлены генотипы, которые имели только один из маркеров – HRG01 или HRG01. Отсутствие одного из маркеров у фертильных растений F2 или появление маркеров у стерильных сегрегантов можно объяснить результатом рекомбинации между локусом Rf1 и маркерным фрагментом.
Таблица 5.
Распределение маркеров гена Rf1 у растений из различных фенотипических классов в расщепляющихся гибридных популяциях F2
| Комбинация скрещивания | Наличие/отсутствие маркеров | Число растений с фенотипом, шт. | |||
|---|---|---|---|---|---|
| HRG02 | HRG01 | F | F/S | S | |
| ВИР116А × RIL130 | + | + | 75 | 10 | 1 |
| + | – | 2 | 0 | 2 | |
| – | + | 0 | 1 | 0 | |
| – | – | 3 | 0 | 27 | |
| Всего растений | 80 | 11 | 30 | ||
| ВИР116А × ВИР740 | + | + | 75 | 11 | 0 |
| + | – | 4 | 0 | 1 | |
| – | + | 4 | 1 | 4 | |
| – | – | 1 | 0 | 32 | |
| Всего растений | 84 | 12 | 37 | ||
Таким образом, с помощью молекулярного анализа подтверждено присутствие доминантного аллеля гена Rf1 в генотипах большинства как высокофертильных, так и “малопыльцовых” растений F2, а также его отсутствие – у стерильных. Однако гипотеза моногенного контроля не позволяет объяснить появление класса “малопыльцовых” растений. Для объяснения характера полученных расщеплений проверяли гипотезы о наличии двух генов с различным типом взаимодействия (при условии независимого наследования), однако ни одна из них не подтвердилась как в настоящем исследовании, так и при анализе других гибридных комбинаций [29]. Известно, что при наличии в генотипе одного доминантного аллеля Rf1 фертильность пыльцы гибридов F1 подсолнечника восстанавливается почти полностью. Это подтверждено и в настоящем исследовании. В таком случае появление в F2 рекомбинантов с пониженной фертильностью пыльцы (и ассоциированным с этим признаком характерным фенотипом “малопыльцовости”) можно объяснить негативными эффектами рецессивных аллелей генов, полученных от материнского родителя.
Растения с пониженной фертильностью пыльцы отмечались в F2 гибридов от скрещиваний линий ЦМС с восстановителями фертильности пыльцы у других видов растений; их фенотип обозначали как полуфертильный или полустерильный [25–27]. Так, например, в F2 от скрещивания линии ЦМС пшеницы с линией-восстановителем Sinha et al. [27], наблюдали выщепление полуфертильных и полустерильных форм наряду с нормальными фертильными растениями. Такие растения характеризовались пониженной фертильностью пыльцы и, следовательно, пониженной завязываемостью семян. У растений сорго, характеризующихся низкой озерненностью, фертильность пыльцы также понижена [26, 35]. Пониженную фертильность на фоне ЦМС объясняют действием полимерных генов, модификаторов, эффектами QTL либо влиянием генетического фона [25, 26].
Предложенные рядом авторов схемы дигенного контроля признака восстановления фертильности пыльцы подсолнечника при ЦМС РЕТ1 основывались на предположении о независимом наследовании генов [10, 36] и их возможное сцепление не обсуждалось. Однако вполне вероятно, что локус гена Rf1 сцеплен с локусом еще одного гена-восстановителя, влияющего на проявление признака мужской фертильности, а их доминантные аллели у отцовских родителей и рецессивные у материнской линии ВИР116А находились в фазе притяжения. Необходимо отметить, что, согласно современным представлениям, большинство идентифицированных к настоящему времени генов восстановления фертильности различных растений принадлежат к подклассу RFL-PPR (Restoration of Fertility Like Pentatricopeptide Repeats) и организованы в кластеры, включающие тандемно организованные копии [37]. Показано например, что у Brassica один и тот же локус Rf включает несколько генов-кандидатов, восстанавливающих пыльцу при различных типах ЦМС [37]. Недавно в результате GWAS-анализа в обширном районе хромосомы 13 подсолнечника (7.72 Mb) идентифицирован 21 ген-кандидат Rf1, из которых 20 генов относились к семейству PPR и один представлял ген альдегиддегидрогеназы [38]. Все эти данные позволяют предполагать наличие более одного гена Rf, восстанавливающего фертильность пыльцы при ЦМС РЕТ1, а также их возможное сцепление.
Авторы выражают благодарность старшему научному сотруднику лаборатории эмбриологии и репродуктивной биологии БИН РАН кандидату биологических наук О.Н. Вороновой за помощь в освоении методов цитологического анализа пыльцы.
Работа выполнена в рамках государственного задания согласно тематическому плану ВИР по теме 0662-2019-0001 “Коллекция масличных и прядильных культур ВИР (изучение и расширение генетического разнообразия масличных и прядильных культур)”.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Leqlerq P. Une sterilite cytoplasmique chez le tournesol // Ann. Amelior. Plant. 1969. V. 19. P. 99–106.
Kohler R., Horn R., Lossl A., Zetsche K. Cytoplasmic male sterility in sunflower is correlated with the co-transcription of a new open reading frame with the atpA gene // Mol. Gen. Genet. 1991. V. 227. P. 369–376.
Moneger F., Smart C.J., Leaver C.J. Nuclear restoration of cytoplasmic male sterility in sunflower is associated with the tissue-specific regulation of a novel mitochondrial gene // EMBO J. 1994. V. 13. P. 8–17.
Budar F., Pelletier G. Male sterility in plants: occurrence, determinism, significance and use // C. R. Acad. Sci. Paris. 2001. V. 324. № 6. P. 543–550.
Enns H., Dorrell D.G., Hoes J.A., Chubb W.O. Sunflower research, a progress report // Proc. 4th Int. Sunflower Conf. Memphis. 1970. P. 162–167.
Kinman M.L. New developments in the USDA and state experiment station sunflower breeding programs // Proc. 4th Int. Sunflower Conf. Memphis. 1970. P. 181–183.
Rukmini Devi K. Investigation on maintainer/restorer reaction, stability and gene action in diverse CMS sources in sunflower (Helianthus annuus L.). Ph.D. Dissertation. Acharya N.G. Ranga Agricultural University, Hyderabad, India. 2002.
Seiler G.J., Jan C.C. New fertility restoration genes from wild sunflower PET1 male sterile cytoplasm // Crop Science. 1994. V. 34. № 6. P. 1526–1528.
Serieys H. Identification, study and utilization of new CMS sources (Progress report 1996–1999) // IX FAO Consultation on Sunflower. Dobrich (Bulgaria). 1999.
Sujatha M., Reddy A.V., Shankar A.S. Genetics of fertility restoration in sunflower (Helianthus annuus L.) // Current Biotica. 2011. V. 5. № 1. P. 56–63.
Vranceanu A.V., Stoenescu F.M. Inheritance of pollen fertility restoration in sunflower // Analele Institutulei de Cercetari pentru Cereale si Plante technice. 1978. V. 43. P. 15–25.
Fick G.N., Zimmer D.E. Fertility restoration in confectionary sunflowers // Crop Sci. 1974. V. 14. P. 603–604.
Whelan E.D.P. A new source of cytoplasmic male sterility in sunflower // Euphytica. 1980. V. 29. № 1. P. 33–46.
Serieys H. Identification, study and utilization in breeding programs of new CMS sources in the FAO Subnetwork // In Proceedings of the 2005 Sunflower Subnetwork Progress Report. FAO Subnetwork, Rome. 2005. P. 47–53.
Tang S., Yu J.K., Slabaugh B. et al. Simple sequence repeat map of the sunflower genome // Theor. Appl. Genet. 2002. V. 105. P. 1124–1136.
Horn R., Kusterer B., Lazarescu E. et al. Molecular mapping of the Rf1 gene restoring fertility in PET1-based F1 hybrids in sunflower (Helianthus annuus L.) // Theor. Appl. Genet. 2003. V. 106. P. 599–606. https://doi.org/10.1007/s00122-002-1078-y
Horn R., Hamrit S. Gene cloning and characterization // Genetics, Genomics and Breeding of Sunflower / Eds. Hu J., Seiler G., Kole C. USA: Sci. Publ., 2010. P. 173–219.
Yue B., Vick B.A., Cai X., Hu J. Genetic mapping for the Rf1 (fertility restoration) gene in sunflower (Helianthus annuus L.) by SSR and TRAP markers // Plant Breed. 2010. V. 129. № 1. P. 24–28. https://doi.org/10.1111/j.1439-0523.2009.01661.x
Gavrilova V.A., Rozhkova V.T., Anisimova I.N. Sunflower genetic collection at the Vavilov institute of plant industry // Helia. 2014. V. 37. № 60. P. 1–16. https://doi.org/10.1515/helia-2014-0001
Leclercq P. Identification de genes de restauration de fertilité sur cytoplasmes stérilisants chez le tournesol // Agronomie. 1984. V. 4. P. 573–576.
Schnabel U., Engelmann U., Horn R. Development of markers for the use of the PEF1 cytoplasm in sunflower hybrid breeding // Plant Breeding. 2008. V. 6. P. 541–652. https://doi.org/10.1111/j.1439-0523.2008.01516
Анисимова И.Н., Гаврилова В.А., Рожкова В.Т. и др. Молекулярные маркеры в идентификации генов восстановления фертильности пыльцы у подсолнечника // Доклады РАСХН. 2009. № 6. С. 6–9.
Анисимова И.Н., Гаврилова В.А., Рожкова В.Т. и др. Генетическое разнообразие источников генов восстановления фертильности пыльцы подсолнечника // Доклады РАСХН. 2011. № 3. С. 6–11.
Карабицина Ю.И., Анисимова И.Н., Гаврилова В.А. и др. Молекулярное маркирование линий подсолнечника, различающихся по способности к супрессии фенотипа цитоплазматической мужской стерильности // Труды по прикладной ботанике, генетике и селекции. 2016. Т. 177. № 2. С. 99–107.
Elkonin L.A. Dominant male sterility in sorghum: effect of nuclear background on inheritance of tissue-culture-induced mutation // Theor. Appl. Genet. 2005. V. 111. № 7. P. 1377–1384. https://doi.org/10.1007/s00122-005-0069-1
Jordan D.R., Mace E.S., Henzell R.G. et al. Molecular mapping and candidate gene identification of the Rf2 gene for pollen fertility restoration in sorghum [Sorghum bicolor (L.) Moench] // Theor. Appl. Genet. 2010. V. 120. № 7. P. 1279–1287. https://doi.org/10.1007/s00122-009-1255-3
Sinha P., Tomar S.M.S., Vinod M. et al. Genetic analysis and molecular mapping of a new fertility restorer gene Rf8 for Triticum timopheevi cytoplasm in wheat (Triticum aestivum L.) using SSR markers // Genetica. 2013. V. 141. № 10–12. P. 431–441. https://doi.org/10.1007/s10709-013-9742-5
Кибальник О.П. Цитологический анализ фертильности пыльцы у гибридов F1 сорго на основе А3, А4 И 9Е типов ЦМС // Мат. Межд. науч.-практ. конф., посвященной 128-й годовщине со дня рождения академика Н.И. Вавилова. Саратов: 2015. С. 124–125.
Анисимова И.Н., Алпатьева И.В., Рожкова В.Т. и др. Полиморфизм гомологов RFL-PPR-генов у линий подсолнечника (Helianthus annuus L.) с различной способностью к супрессии фенотипа цитоплазматической мужской стерильности // Генетика. 2014. Т. 50. № 7. С. 814–824.
Воронова О.Н. Интегументальная эмбриония у ЦМС-линий подсолнечника. // Биология развития растений. Онтогенез. 2010. Т. 41. № 6. С. 455–460.
Carvalho C.G.P, Toledo J.F.F. Extracting female inbred lines from commercial sunflower hybrids // Pesq. agropec. bras., Brasília. 2008. V. 43. № 9. P. 1159–1162. https://doi.org/10.1590/S0100-204X2008000900009
Барыкина Р.П., Веселова Т.Д., Девятов А.Г. и др. Основы микротехнических исследований в ботанике. Справочное руководство. М., 2000. 128 с.
Навашин С.Г. Избранные труды. М.–Л.: Наука, 1951. № 1.
Анисимова И.Н., Алпатьева Н.В., Абдуллаев Р.А. и др. Скрининг генетических ресурсов растений с использованием ДНК-маркеров: основные принципы, выделение ДНК, постановка ПЦР, электрофорез в агарозном геле. Методические указания ВИР / Под ред. Радченко Е.Е. СПб: ВИР, 2018. 48 с.
Анисимова И.Н., Рябова Д.Н., Малиновская Е.В. и др. Полиморфизм по признакам, ассоциированным с генетической системой ЦМС-Rf, у зернового сорго из коллекции ВИР // Сельскохоз. биол. 2017. Т. 52. № 5. С. 952–963. https://doi.org/10.15389/agrobiology.2017.5.952rus
Reddy P.S., Thammiraju B. Inheritance of fertility restoration in sunflower (Helianthus annuus L.) // Euphytica. 1977. V. 26. P. 409–412.
Gaborieau L., Brown G.G., Mireau H. The propensity of pentatricopeptide repeat genes to evolve into restorers of cytoplasmic male sterility // Frontiers in Plant Sci. 2016. V. 7. P. 1816. https://doi.org/10.3389/fpls.2016.01816
Goryunov D.V., Anisimova I.N., Gavrilova V.A. et al. Association mapping of fertility restorer gene for CMS PET1 in sunflower // Agronomy. 2019. V. 9. № 2. P. 49. https://doi.org/10.3390/agronomy9020049
Дополнительные материалы отсутствуют.