Генетика, 2019, T. 55, № 11, стр. 1335-1349
Взаимодействие генов, контролирующих некоторые морфологические признаки льна (Linum usitatissimum L.)
Е. А. Пороховинова 1, *, А. В. Павлов 1, С. Н. Кутузова 1, Н. Б. Брач 1
1 Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений
им. Н.И. Вавилова (ВИР)
190000 Санкт-Петербург, Россия
* E-mail: e.porohovinova@vir.nw.ru
Поступила в редакцию 10.04.2019
После доработки 12.06.2019
Принята к публикации 19.06.2019
Аннотация
Взаимодействие 11 генов льна, контролирующих окраску гипокотиля, цветка и семян, деформацию лепестков, изучено с помощью генетического анализа. Все гены обладают плейотропным эффектом на несколько частей цветка, а также иногда на гипокотиль и семена. Четыре гена влияют на форму и интенсивность окраски цветка – s1 (полное прекращение синтеза антоцианов, деформированный венчик), sfbs1 (прекращение синтеза антоцианов в цветке, слабо деформированный венчик), pbc1 и pbc3 (очень светло-голубой, разной степени деформации венчик); шесть генов ослабляют голубую окраску цветка – wf1 (белый), f e (очень светло-голубой, пятнистые семена), dlb1, dlb3, dlb4 (разная интенсивность светло-голубого), ora1 (светлее голубого, оранжевые пыльники) и ген pf розовой окраски цветка и желтого оттенка семян. Базовую схему взаимодействия генов окраски и формы цветка льна можно представить следующим образом: s1 > sfbs1 > wf1 > pf1 > f e > pbc1 > pbc3 > dlb1 > dlb3 > ora1. Однако последовательность функционирования генов s1, wf1, pf1, f e и dlb3 изменяется в процессе формирования различных признаков. Так, по окраске цветка они будут располагаться следующим образом: s1 > wf1 ≥ pf1 ≥ f e ≥ dlb3, по его деформации pf1 = wf1 > dlb3 > s1 > f e, по окраске семян pf1 > s1 > f e > wf1 = dlb3.
Лен (Linum usitatissimum L., 2n = 30) – одна из культур, на которых Г. де Фриз переоткрыл законы Г. Менделя [1]. Уже в начале ХХ в. Т. Таммес [1, 2] предложила первую систему из 10 генов, влияющих на различные морфологические признаки (МП) льна. Ф. Плонка с соавт. [3, 4] описали систему из 16 генов, проанализировав также биохимический состав пигментов венчика. В. Лях с соавт. [5–11] на индуцированных мутантах описали 13 генов МП. В ВИРе создана самая крупная генетическая коллекция, в которой идентифицирован 41 ген льна [12–15].
Геном льна секвенирован в 2012 г. [16]. Были определены 15 групп сцепления. На них отмечено около 10 генов, контролирующих жирнокислотный состав масла семян [17–20], устойчивость к мучнистой росе [21], синтез целлюлозосинтазы [22]. Установлено положение только одного гена d, контролирующего МП – розовую окраску венчика и желтые семена [23, 24]. На основе картирующей популяции с помощью позиционного картирования показано, что этот ген кодирует фермент флавоноид-3'-гидроксилазу (F3'H). Он превращает розовоокрашенный пеларгонидин в синий дельфинидин, его функция была предсказана Ж. Дюбуа с соавт. [4]. Однако лишь современные методы позволили показать изменение этих пигментов не только в лепестках, но и в семенах [23, 24]. Таким образом, несмотря на прорыв, в молекулярной генетике льна ощущается острый недостаток данных, являющихся мостом, соединяющим “менделевскую” и “постгеномную” эры генетики.
Практически все работы по генетике льна лишь вскользь затрагивают взаимодействие генов. Данное исследование посвящено изучению взаимодействия генов МП льна методом классического генетического анализа. В нем обобщены как новые, так и опубликованные ранее результаты [12, 13, 25–28], описано взаимодействие 11 основных генов, контролирующих окраску гипокотиля, цветка и семян, деформацию лепестков. Все эти гены обладают плейотропным эффектом на несколько частей цветка и в некоторых случаях на гипокотиль и семена.
У льна “дикий тип” растения имеет фиолетовый гипокотиль, недеформированный голубой венчик (в бутоне синий), синие жилки лепестка, тычиночные нити и столбики, голубые пыльники, красно-коричневые семена.
Четыре гена влияют на форму венчика, интенсивность окраски гипокотиля и цветка. Ген s1 (star 1) обусловливает зеленый гипокотиль, белые сложенные и гофрированные лепестки, белые тычиночные нити и столбики, желтые пыльники и семена; sfbs1 (star flower brown seeds 1) – зеленый гипокотиль, белые слабо сложенные и слабо гофрированные лепестки, белые тычиночные нити и столбики, желтые пыльники; pbc1 (pale blue crimped 1) – светло-фиолетовый гипокотиль, почти белые гофрированные лепестки, белые тычиночные нити и столбики, желтые пыльники; pbc3 (pale blue crimped 3) – зеленый гипокотиль, лепестки очень-очень светло-голубые с голубыми жилками, сложенные и гофрированные, голубые тычиночные нити, темно-голубые столбики, светло-оранжевые пыльники [12].
Основное действие следующих шести генов направлено на ослабление голубой окраски венчика. Два гена влияют также на окраску пыльников и семян, один из них затрагивает окраску гипокотиля. Аллели гена wf1 (white flower 1) имеют неполное доминирование: wf1wf1 – белые венчик, тычиночные нити и столбики; WF1wf1 – светло-голубые лепестки, белые тычиночные нити и столбики. Ген f e контролирует светло-фиолетовый гипокотиль, очень светло-голубой венчик, белые тычиночные нити и столбики, серые пыльники, семена красно-коричневые с желтым пятном. Ген dlb1 (dilution blue 1) определяет очень светло-голубые, почти белые лепестки с темно-голубыми жилками, осветленные тычиночные нити и столбики. Ген dlb3 (dilution blue 3) контролирует светло-голубой венчик, синие жилки, осветленные тычиночные нити и столбики. Этот ген имеет множество аллелей (dlb3, dlb3-2, dlb3-5), различающихся по степени ослабления окраски цветка. Ген dlb4 (dilution blue 4) обусловливает незначительное осветление голубой окраски венчика, темно-голубые жилки, тычиночные нити и столбики. Ген ora1 (orange anthers 1) обусловливает светло-оранжевые пыльники, ослабление окраски жилок лепестков, тычиночных нитей и столбиков, желтую крапчатость у красно-коричневых семян [12].
Ген pf (pink flower) имеет несколько аллелей и обусловливает розовые лепестки, светло-оранжевые пыльники, голубые (pf1), почти белые – белые (pf-ad) тычиночные нити и столбики, темно-желто-коричневые (pf1) или желто-коричневые – желтые (pf-ad) семена. Ген RPF1 (Reduced Pink Flower 1) не имеет самостоятельного действия, ослабляет розовую окраску лепестков и голубую – тычиночных нитей у гомозигот по гену pf1 [12].
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали 19 линий шестого поколения инбридинга из генколлекции, созданной в отделе генетических ресурсов масличных и прядильных культур ВИР, и один сорт (табл. 1). Скрещивания между линиями проводили по стандартной методике [12]. F1 изолировали и обмолачивали индивидуально по растениям. F2 высевали рядом с родительскими линиями и F1 на делянках шириной 40 см, с междурядьями 20 см, 50 растений на рядке. В качестве эталона дикого типа использовали линию гк-2. При необходимости подтверждения результатов изучали семьи F3.
Таблица 1.
Характеристика линий генетической коллекции ВИР с мутациями в генах, контролирующих морфологические признаки
| Линия | Родословная | Генотип | Признаки |
|---|---|---|---|
| гк-2 | л-1 из к-48 (сел. Альтгаузена, Россия) | Дикий тип | (Г) фиол., (Б) гол., (Л) гол., плоск., (Ж) син., (Т, Ст) син., (П) гол., (С) кр.-кор. |
| Линии с деформированными лепестками | |||
| гк-136 | л-1 из к-6634 (Mermilloid, Чехия) | s1 | (Г) зел., (Л) бел., слож., гофр., (Т, Ст) бел., (П) желт., (С) желт. |
| гк-287 | л-2 из к-4043 (Deep Pink, Нидерланды) | s1, dlb3 | (Г) зел., (Л) бел., сл. слож., сл. гофр., (Т, Ст) бел., (П) желт., (С) желт. |
| гк-132 | л-1 из к-6608 (Currong, Австралия) | sfbs1 | (Г) зел., (Л) бел., сл. слож., сл. гофр., (Т, Ст) бел., (П) желт., (С) кр.-кор. |
| гк-391 | л-1-2 из и-606179 (Eyre, Австралия) | sfbs1, YSED1 |
(Г) зел., (Л) бел., сл. слож., сл. гофр., (Т, Ст) бел., (П) желт., (С) желт. |
| гк-277 | и-606138 (М12 УкрНИИМК) | sfbs1-2, dlb3-5 | (Г) зел., (Л) бел., оч. сл. слож., оч. сл. гофр., (Т, Ст) бел., (П) желт., (С) кр.-кор. |
| гк-188 | л-3 из к-3002 (Индия, Pusa Bihar) | pbc1 | (Г) св. фиол., (Б) оч. св. гол., (Л) бел. с гол. отт., гофр., (Ж) бел., (Т,Ст) бел., (П) желт., (С) кр.-кор. |
| гк-208 | л-1 из к-7947 (Pale Blue Crimped, США) | pbc1 | (Г) св. фиол., (Б) оч. св. гол., (Л) бел., с гол. отт., гофр., (Ж) бел., (Т, Ст) бел., (П) желт., (С) кр.-кор. |
| гк-53 | л-1-4 к-1044 (Витебский кряж, Беларусь) | pbc3 | (Г) зел., (Б) св. гол., (Л) бел. с гол.-фиол. отт., слож., гофр., (Ж) св. гол., (Т) гол., (Ст) т. гол., (П) св. ор., (С) кр. кор. |
| Линии с белыми или светло-голубыми недеформированными лепестками | |||
| гк-109 | л-3-2 из к-6099 (Moco-vi M.A.G., Аргентина) | wf1 | (Г) фиол., (Л) всегда бел., (Т, Ст) бел., (П) гол., (С) кр.-кор. |
| гк-124 | л-1 к-6284 (Stormont Motley, Сев. Ирландия) | f e, dlb4 | (Г) св. фиол., (Б) св. гол., (Л) оч. св. гол., (Ж) гол., (Т, Ст) бел., (П) сер., (С) пятн. |
| гк-1 | л-1 из к-30 (сел. Альтгаузена, Росcия) | dlb1, ora2 | (Г) фиол., (Б) св. гол., (Л) оч. оч. св. гол., (Ж) т. гол., (Т) гол., (Ст) син. у осн., (П) св. ор., (С) кр.-кор. |
| гк-72 | л-1 из к-4225 (Псковский 2970, Россия) | dlb1 | (Г) фиол., (Б) св. гол., (Л) оч. оч. св. гол., (Ж) т. гол., (Т) гол., (Ст) син. у осн., (П) гол., (С) кр.-кор. |
| гк-32 | л-2-1 к-716 (Псковский кряж, Россия) | dlb3 | (Г) фиол., (Б) син., (Л) св. гол., (Ж) син., (Т) бел., (Ст) св. гол. у осн., (П) гол., (С) кр.-кор. |
| гк-172 | л-1 из к-7771 (Beta 15, Чехословакия) | dlb3-2 | (Г) фиол., (Б) син., (Л) оч. св. гол., с прод. скл. (Ж) т. гол., (Т) св. гол. у осн., (Ст) св. гол., (П) гол., (С) кр.-кор. |
| гк-210 | л-1 из и-588294 (Б-125, Упитская оп. ст., Литва) | dlb3 | (Г) фиол., (Б) син., (Л) св. гол., (Ж) син., (Т) бел., (Ст) бел., (П) гол., (С) кр.-кор. |
| к-7822 | сорт Циан, Россия, ВНИИМК | dlb3-5 | (Г) фиол., (Л) св. гол., (Ж) гол., (Т, Ст) бел., (П) гол., (С) кр.-кор. |
| гк-65 | л-3 из к-3178 (местный, Тверская губ.) | ora1 | (Г) фиол., (Б) син., (Л) гол., (Т) св. гол., (Ст) син., (П) св. ор., (С) крапч. |
| Линии с розовыми лепестками | |||
| гк-141 | л-1 из к-6815 (К-6, Псковский НИИСХ) | pf1, rpf1 | (Б) т. роз., (Л) роз., (Ж) гол.-роз., (Т, Ст) гол., (П) св. ор., (С) т. ж.-кор. |
| гк-129 | л-2 из к-6392 (Bolley Golden, США) | pf-ad, RPF1 | (Б) оч. св. роз., (Л) бел. с роз. отт., (Ж) гол.-роз., (Т, Ст) бел., (П) св. ор., (С) желт. |
Таблица 2.
Генетический контроль деформации цветка и желтой окраски семян
| Скрещивание | Расщепление по классам, соответствующим | n | χ2 | |||
|---|---|---|---|---|---|---|
| линии | гены | F1 | P1 | P2 | ||
| гк-132 | sfbs1 | 9/236 | 3/63 | 4/89 | 16/ | 5.99/ |
| × | (Г) фиол., (Л) гол., плоск., (П) гол., | (Г) зел., (Л) бел., сл. слож., сл. гофр., (П) | (Г) зел., (Л) бел., слож., гофр., |
388 | 3.41 | |
| гк-103 | s1 | |||||
| (С) кр.-кор. | желт., (С) кр.-кор. | (П) желт., (С) желт. | ||||
| гк-208 | pbc1 | 9/202 | 3/61 | 4/73 | 16/ | 5.99/ |
| × | (Л) гол., плоск., | (Л) oч. оч. св. гол., | (Л) бел., слож., гофр., | 336 | 2.40 | |
| гк-136 | s1 | (П) гол. | гофр., (П) желт. | (П) желт. | ||
| гк-53 | pbc3 | 9/120 | 3/36 | 4/67 | 16/ | 5.99/ |
| × | (Л) гол., плоск., (П) | (Л) oч. оч. св. гол. слож., гофр., (П) св. ор., | (Л) бел., слож., гофр., | 213 | 0.65 | |
| гк-136 | s1 | гол., (С) кр.-кор. | (С) кр.-кор. | (П) желт., (С) желт. | ||
| гк-208 | pbc1 | 9/239 | 3/72 | 4/114 | 16/ | 5.99/ |
| × | (Л) гол., плоск., | (Л) оч. оч. св. гол., гофр., | (Л) бел., сл. слож., | 425 | 1.31 | |
| гк-132 | sfbs1 | (П) гол. | (П) желт. | сл. гофр., (П) желт. | ||
| гк-208 | pbc1 | 9/169 | 4/82 | 3/57 | 16/ | 5.99/ |
| × | (Г) фиол., | (Г) осветл., | (Г) осветл., | 308 | 0.44 | |
| гк-53 | pbc3 | (Л) гол., плоск., (П) гол. |
(Л) оч. оч. св. гол., гофр., (П) желт. | (Л) оч. оч. св. гол., слож., гофр., (П) св. ор. | ||
Примечание. Для табл. 2, 3–5, 7, 9–11: полужирным шрифтом отмечено теоретическое расщепление.
Обработку полученных данных проводили методами генетического анализа [29, 30] с использованием макросов, написанных авторами в среде MS Excel 2002. Соответствие практического расщепления теоретическому проверяли с помощью критерия χ2 при p < 0.05, с пограничными значениями $\chi _{{{\text{теор}}}}^{2}$ для n – 1 (1–5) = 3.84, 5.99, 7.81, 9.49, 11.07 соответственно.
В настоящей статье приняты следующие сокращения (подчеркнуто): белая, (Б)утон, (Г)ипокотиль, голубая, гофрированные, деформированные, желтая, (Ж)илки, коричневая, крапчатые, красно, (Л)епестки, малиновый, оранжевая, осветленные, очень, плоские, (П)ыльники, пятнистые, розовая, светло, серая, (С)емена, синяя, слабо, сложенные, (Ст)олбики, темная (Т)ычиночные нити, фиолетовая.
РЕЗУЛЬТАТЫ
Взаимодействие генов, отвечающих за деформацию лепестков
Гены s1, sfbs1 и pbc1 неаллельны. По форме цветка действие гена sfbs1 маскирует действие гена s1, а по цвету семян наоборот, но так как деформация цветка сильно зависит от погоды, правильнее разделять классы расщепления по семенам. Действие гена s1 маскирует проявление генов sfbs1, pbc1 и pbc3, а действие гена sfbs1 – проявление гена pbc1 (s1 > sfbs1 > pbc1). Действие гена pbc1 маскирует проявление гена pbc3 ([12, 28], табл. 2).
Фенотип, обусловливаемый геном sfbs1, легко отличим от pbc3 и характеризуется остановкой синтеза антоциана в цветке. Здесь антоциан не выявляется кислотой, в отличие от светло-голубой окраски, которая становится ярко-малиновой при взаимодействии с HCl.
F1 от скрещивания гк-53 (pbc3) × гк-132 (sfbs1) имело фенотип первого родителя “лепестки светло-голубые, слабо деформированные”. В F2 наблюдали расщепление, соответствующее дигенному (χ2 = 1.48):
| 86 : | 36 : | 38 | |
| (Л) | св. гол., слабо деформ. | бел. с гол. отт., слабо деформ. | бел., слабо деформ. |
| H01 | 9S pbc3- RPBC3 - : | 3S pbc3- rpbc3rpbc3 : | 4S sfbs1 S sfbs1 - - - - |
| H02 | 9SFBS1 - - - RPBC3- : | 3SFBS1 - - - rpbc3rpbc3 : | 4sfbs1sfbs1 - - - - |
| H03 | ${\mathbf{9}} = \left( \begin{gathered} {\mathbf{6}}\,\,SFBS1{\text{ - }}\Delta pbc3 + \hfill \\ {\mathbf{3}}\,\,SFBS1{\text{ - }}pbc3pbc3 \hfill \\ \end{gathered} \right)$ : | 3SFBS1 - Δ Δ : | ${\mathbf{4}} = \left( \begin{gathered} {\mathbf{3}}\,\,sfbs1sfbs1\Delta {\text{ - }} + \hfill \\ {\mathbf{1}}\,\,sfbs1sfbs1pbc3pbc3 \hfill \\ \end{gathered} \right),$ |
что может говорить либо об аллельности (H01) генов sfbs1 и pbc3, либо об их полном сцеплении (H02). Косвенным подтверждением второй гипотезы могут служить данные Ф. Плонка [3], который описал сцепление между генами f an и f dl в 32.6 сМ. Нами [12] доказана аллельность генов f an и sfbs1 (гк-132); описание фенотипов гомозиготных по генам fdl и pbc3 (гк-53) линий совпадает. В этом случае второй ген rpbc3 (reduce of pale blue colour crimped 3) не имеет самостоятельного действия и ослабляет светло-голубую окраску лепестков у гомозигот по гену pbc3. Этот ген несет линия гк-132. Третья гипотеза предполагает наличие делеции у гк-132 (Δ, sfbs1), вызывающей ослабление окраски у гомозигот по ней.
Таким образом, полную схему взаимодействия генов деформации лепестков можно представить как s1 > sfbs1 > pbc1 > pbc3.
Взаимодействие генов, контролирующих ослабление окраски венчика
Ген wf1 неаллелен генам f e, dlb1, dlb3, dlb4 и ora1.
Взаимодействие генов wf1 и f e происходит по типу комплементарного, т.е. ослабление окраски цветка идет более интенсивно, чем в гомозиготе по одному из генов, а семена становятся пятнистыми (табл. 3). В генотипе WF1wf1f ef e лепестки очень светло-голубые (светло-голубые в бутоне), тычиночные нити и столбики белые, а семена пятнистые. В генотипе wf1wf1f ef e лепестки становятся полностью белыми, а семена пятнистыми. Гены wf1 и f e сцеплены с частотой кроссинговера 5 сМ. Полученные данные согласуются с результатами работ Ф. Плонка, который установил сцепление генов f e и nc (wf1) в 1–2 сМ [3].
Таблица 3.
Анализ расщепления F2 от скрещивания гк-109 (wf1) × гк-124 (f e)
| Расщепление практическое | Фенотипы гибридов, соответствующих | Σ | $\chi _{{{\text{практ}}}}^{2}$ | ||||
|---|---|---|---|---|---|---|---|
| F1 | гк-109 | гк-124 | новые | ||||
| Цветок | |||||||
| св. гол. | бел. | оч. св. гол. | гол. | бел. | |||
| Семена | |||||||
| кр.-кор. | кр.-кор. (гк-109), пятн. | пятн. | кр.-кор. | пятн. | |||
| 180 | 79 | 80 | 6 | 9 | 354 | ||
| H01: гены wf1 и f e независимы | 6 | 4 | 1 | 3 | 2 | 16 | 252.2* |
| H02: гены wf1 и f e сцеплены (5 сМ) | 7.6 | 4.0 | 3.6 | 0.4 | 0.4 | 16 | 2.63 |
Взаимодействие генов wf1 и dlb1 происходит по типу комплементарного. У гомозигот по гену wf1 лепестки белые. Аллель dlb1 становится полудоминантным, в F1 лепестки почти белые, а не светло-голубые, как в доминантной гомозиготе DLB1DLB1(WF1wf1). Гены wf1 и dlb1 наследуются независимо (табл. 4).
Таблица 4.
Генетический контроль светло-голубой окраски цветка
| Скрещивание | Расщепление по классам, соответствующим | n | χ2 | |||||
|---|---|---|---|---|---|---|---|---|
| линии | гены | F1 | P1 | P2 | новые | |||
| гк-109 | wf1 | 6/117 | 1/20 | 6/118 | 3/47 | 16/ | 7.81/ | |
| × | (Л) бел. [P1] или почти | (Л) оч. оч. св. гол., | (Л) св. гол., | (Л) гол., | 302 | 2.03 | ||
| гк-1 | dlb1 | бел. [F1], (Ж) бел. | (Ж) т. гол. | (Ж) св. гол. | (Ж) син. | |||
| гк-124 | f e | 9/138 | 4/73 | 3/35 | 16/ | 5.99/ | ||
| × | (Л) гол., | (Л) оч. св. гол., | (Л) оч. оч. св. гол., | 246 | 4.83 | |||
| гк-72 | dlb1 | (С) кр.-кор. | (С) пятн. | (С) кр.-кор. | ||||
| гк-32 | dlb3 | 9/181 | 3/70 | 3/63 | 1/23 | 16/ | 7.81/ | |
| × | (Л) гол., | (Л) св. гол., | (Л) оч. оч. св. гол., | (Л) оч. оч. св. гол., | 337 | 1.30 | ||
| гк-72 | dlb1 | (Ж) син. | (Ж) син. | (Ж) т. гол. | (Ж) св. гол. | |||
| гк-1 | dlb1 | 9/81 | 3/32 | 3/26 | 1/15 | 16/ | 7.81/ | |
| × | (Л) гол., | (Л) оч. оч. св. гол., | (Л) гол., | (Л) оч. оч. св. гол., | 154 | 3.99 | ||
| гк-65 | ora1 | (С) кр.-кор. | (С) кр.-кор. | (С) крапч. | (С) крапч. | |||
| гк-109 | wf1 | 6/100 | 3/41 | 1/16 | 3/50 | 2/27 | 16/ | 11.07/ |
| × | (Л) св. гол., | (Л) бел., | (Л) гол., | (Л) гол., | (Л) оч. св. гол. | 245 | 3.28 | |
| гк-65 | ora1 | (П) гол., | (П) гол., | (П) св. ор., | (П) гол., | (П) св. ор., | ||
| (С) кр.-кор. | (С) кр. кор. | (С) крапч. | (С) кр.-кор. | (С) крапч. | ||||
| 1/11 (Л) бел., (П) св. ор., (С) крапч. |
||||||||
| гк-65 | ora1 | 9/147 | 3/55 | 3/42 | 1/16 | 16/ | 7.81/ | |
| × | (Л) гол., | (Л) гол., | (Л) оч. св. гол., | (Л) оч. св. гол., | 260 | 1.74 | ||
| гк-124 | f e | (Т, Ст) син., | (Т, Ст) гол., | (Т, Ст) осветл., | (Т, Ст) бел., | |||
| (П) гол., | (П) cв. ор., | (П) сер., | (П) св. ор., | |||||
| (С) кр.-кор. | (С) крапч. | (С) пятн. | (С) пятн. и крапч. | |||||
Взаимодействие генов wf1 и dlb3 также происходит по типу комплементарного (табл. 5). Как и dlb1, dlb3 вместо рецессивного становится полудоминантным, и уже в F1 лепестки почти белые, а не светло-голубые, как в DLB3DLB3WF1wf1. В отличие от чисто белых “почти белые” при взаимодействии с кислотой приобретают ярко-малиновую окраску. Классы WF1wf1DLB3DLB3–WF1wf1DLB3dlb3–WF1wf1dlb3dlb3 различаются по окраске цветка и в жару их можно охарактеризовать как светло-голубые – почти белые, в кислоте малиновые – белые, в кислоте малиновые, соответственно. Однако в пасмурную погоду лепестки имеют более выраженную светло-голубую окраску, поэтому данные классы были объединены в один. Гены wf1 и dlb3 сцеплены с частотой кроссинговера 1 сМ, из-за этого наблюдается существенный недостаток рекомбинантного класса “дикий тип – (Л) голубые (Т и Ст) синие”.
Таблица 5.
Анализ расщепления F2 от скрещивания гк-109 (wf1) × гк-32 (dlb3)
| Расщепление практическое | Фенотипы гибридов, соответствующих | Σ | $\chi _{{{\text{практ}}}}^{2}$ | |||
|---|---|---|---|---|---|---|
| F1 | гк-109 | гк-32 | новый | |||
| Окраска лепестков: в природе | ||||||
| почти бел. | бел. | св. гол. | гол. | |||
| Окраска лепестков: в кислоте | ||||||
| малин. | бел. | малин. | малин. | |||
| 190 | 78 | 85 | 1 | 354 | ||
| H01: гены wf1 и dlb3 независимы | 8 | 4 | 1 | 3 | 16 | 245.3 |
| H02: гены wf1 и dlb3 сцеплены (1 сМ) | 8.00 | 4.00 | 3.92 | 0.08 | 16 | 2.41 |
Ген f e неаллелен генам dlb1, dlb3 и dlb4. Взаимодействие генов f e и dlb1 по типу комплементарного, т.е. в генотипе f ef edlb1dlb1 лепестки становятся почти белыми (как у dlb1), жилки очень светло-голубыми, тычиночные нити и столбики белыми, пыльники серыми, семена пятнистыми (как у f e) (табл. 4).
Ген f e маскирует проявление генов dlb3 и dlb4. Взаимодействие генов f e, dlb4 и dlb3 можно объяснить с помощью нескольких гипотез (табл. 6). Для скрещиваний гк-124 (f e, dlb4) с гк-32 (dlb3) или гк-172 (dlb3-2), помимо отвергнутой гипотезы H01 независимого наследования всех трех генов, выдвинуты две гипотезы о взаимодействии генов dlb4 и dlb3: H02 – кумулятивная полимерия с внутри- или межгенным кроссинговером (сцепление между генами dlb3 и dlb4 9 сМ; расщепление 14.7 светло-голубой : 1.3 голубой венчик); H03 – некумулятивная полимерия (15 : 1) и исходя из тесного сцепления генов wf1 с f e и dlb3 – H04 – сцепление между генами f e и dlb3 (1 сМ), при этом гены dlb3 и dlb4 независимы и взаимодействуют по типу кумулятивной полимерии. Расщепление F2 гк-124 × × гк-172 не опровергло ни одну из гипотез. Семьи F2 гк-124 × гк-32 можно разделить на две группы, для первой достоверны H02 и H03 гипотезы, для второй – H04. F3 (в F2 светло-голубой венчик) не опровергло ни одну из гипотез (табл. 6).
Таблица 6.
Анализ расщепления F2 и F3 от скрещивания гк-124 с гк-32 и гк-172
| Цветок | Σ | Гипотезы/χ2 | ||||||
|---|---|---|---|---|---|---|---|---|
| св. гол. | оч. св. гол. | гол. или немного светлее | H01 | H02 | H03 | H04 | ||
| H01 | 33 | 16 | 15 | 64 | H01: Кумулятивная полимерия, гены dlb3 и dlb4 независимы |
|||
| H02 | 44.0 | 16.0 | 4.0 | 64 | H02: Кумулятивная полимерия, гены dlb3 и dlb4 сцеплены (9 сМ) |
|||
| H03 | 45 | 16 | 3 | 64 | H03: Некумулятивная полимерия генов dlb3 и dlb4 |
|||
| H04 | 39.8 | 16.0 | 8.2 | 64 | H04: Кумулятивная полимерия (dlb3 и dlb4) + + сцепление генов f e и dlb3 (1 сМ) | |||
| гк-32 (dlb3) × гк-124 (f e, dlb4) | ||||||||
| F2, 11 семей | 1236 | 427 | 95 | 1758 | 364.1 | 3.23 | 2.28 | 93.1 |
| F2, 6 семей | 565 | 221 | 94 | 880 | 88.4 | 29.5 | 72.1 | 3.49 |
| F3, 6 семей | 101 | 43 | 10 | 154 | 25.3 | 0.75 | 2.09 | 5.53 |
| гк-124 (f e, dlb4) × гк-172 (dlb3-2) | ||||||||
| F2, 3 семьи | 147 | 57 | 17 | 221 | 33.0 | 0.90 | 4.77 | 5.13 |
Ген dlb1 неаллелен генам dlb3 и dlb4. Гены dlb1 с dlb3 и dlb4 наследуются независимо, гены dlb1 и dlb3 комплементарно взаимодействуют, а ген dlb1 маскирует проявление гена dlb4 [12].
Ген ora1 всегда обусловливает оранжевую окраску пыльников и крапчатость семян. Так как он слегка ослабляет окраску жилок лепестков у гетерозигот по гену wf1, лепестки становятся почти белыми вместо светло-голубых [25]. Но для гомозигот по генам dlb1 или dlb3 такой эффект не выявлен (табл. 4, [12]).
Ген ora1 также не влияет на окраску венчика у гомозигот по гену f e, но делает белыми их тычиночные нити и столбики и светло-оранжевыми – пыльники. Гены ora1 и f e оказывают комплементарное действие на окраску семян, которые становятся пятнистыми и крапчатыми (табл. 4, [25]).
Таким образом, большинство генов светло-голубой окраски лепестков имеют комплементарное взаимодействие. Только в рецессивной гомозиготе по гену wf1 полностью ингибируется окраска, а ген f e маскирует проявление гена dlb3 в цветке и всегда дает пятнистость семян. Ген ora1 всегда обусловливает оранжевые пыльники и крапчатые семена.
Выявлена группа сцепления генов, контролирующих светло-голубую окраску венчика f e, wf1, dlb3 и dlb4 с частотами кроссинговера 5, 1 и 9 сМ соответственно.
Взаимодействие генов, контролирующих деформацию лепестков, с генами-ослабителями голубой окраски венчика
Влияние генов, ответственных за светло-голубую окраску венчика, на проявление генов, контролирующих деформацию цветка, выражается в уменьшении деформации и (или) ослаблении окраски цветка, при этом характерный плейотропный эффект последних на пыльники сохраняется.
При взаимодействии генов s1 и wf1 сохраняется неполное доминирование аллелей последнего, выраженное в уменьшении деформации белого венчика генотипа s1s1 в ряду: лепестки сложенные, гофрированные (WF1WF1) > слабо сложенные, слабо гофрированные (WF1wf1) > плоские (wf1wf1), а пыльники и семена остаются желтыми. Наблюдается следующее расщепление по цветкам [25]:
| 3/87 : | 6/144 : | 3/68 : | 1/21 : | 2/36 : | 1/24 (χ2 = 6.75) | |
| (Л) | голубые | св. голубые | белые | белые | белые | белые |
| недеформ. | недеформ. | недеформ. | деформ. | сл. деформ. | недеформ. | |
| (П) | гол. | гол. | гол. | желт. | желт. | желт. |
Ген dlb3 также ослабляет деформацию лепестков у гомозигот по гену s1. В F2 гк-2 × гк-287 (s1, dlb3) расщепление по цветкам соответствует 9/159 голубые недеформ. : 3/52 светло-голубые недеформ. : 3/56 белые деформ. : 1/8 белые слабо деформ. (χ2 = 5.40), у последних лепестки похожи на s1s1WF1wf1.
Для расщеплений в F2 по генам sfbs1 и wf1 ожидали получить распределение, аналогичное s1 и wf1 (табл. 7). Но при наличии всех шести классов оно отличается от теоретического за счет избытка классов WF1WF1 и недостатка wf1wf1. Была выдвинута гипотеза о присутствии летали, приводящей к избирательной гибели гамет wf1LET (табл. 8). Тогда расщепление соответствует 12 : 12 : 3 : 4 : 4 : 1. Подтверждением этой гипотезы может служить расщепление в F3 для гетерозигот по гену wf1. В одной половине семей оно должно соответствовать 1 : 2 : 1, в другой – 4 : 4 : 1. Из четырех семей в одной было расщепление 1 : 2 : 1, в двух – 4 : 4 : 1, а в одной выявлен недостаток рецессивных гомозигот, и расщепление соответствовало 1 : 2 : 1 с 0.05 > p > > 0.04 (табл. 9).
Таблица 7.
Анализ расщепления F2 от скрещивания гк-109 (wf1) с гк-391 (sfbs1, LET) и гк-132 (sfbs1, LET)
| (Л) (П) |
Гол. плоск. |
Св. гол. плоск. |
Бел. плоск. |
Бел. сл. деформ. |
Бел. оч. сл. деформ. |
Бел. плоск. |
∑ | Гипотезы/χ2 | |
|---|---|---|---|---|---|---|---|---|---|
| гол. | гол. | гол. | св. ор. | св. ор. | св. ор. | H01 | H02 | ||
| H01 | 3 | 6 | 3 | 1 | 2 | 1 | 16 | H01: Дигенное независимое наследование генов sfbs1 и wf1 |
|
| генотип | WF1WF1 | WF1wf1 | wf1wf1 | WF1WF1 | WF1wf1 | wf1wf1 | |||
| SFBS1- | sfbs1sfbs1 | ||||||||
| 3 | 6 | 3 | 3 | 1 | 16 | ||||
| генотип | WF1WF1 | WF1wf1 | wf1wf1 | WF1- | wf1wf11 | ||||
| SFBS1- | sfbs1sfbs1 | ||||||||
| 1 | 2 | 1 | 4 | ||||||
| генотип | WF1WF1 | WF1wf1 | wf1wf1 | ||||||
| H02 | 12 | 12 | 3 | 4 | 4 | 1 | 36 | H02: Тригенное независимое наследование генов sfbs1, wf1 и LET. Гаметы wf1Let – нежизнеспособны |
|
| генотип | WF1WF1 | WF1wf1 | wf1wf1 | WF1WF1 | WF1wf1 | wf1wf1 | |||
| SFBS1- | sfbs1sfbs1 | ||||||||
| - - | - let | letlet | - - | - let | letlet | ||||
| 12 | 12 | 3 | 8 | 1 | 36 | ||||
| генотип | WF1WF1 | WF1wf1 | wf1wf1 | WF1 - | wf1wf11 | ||||
| SFBS1- | sfbs1sfbs1 | ||||||||
| - - | - let | letlet | - - +- let | letlet | |||||
| 4 | 4 | 1 | 9 | ||||||
| генотип | WF1WF1 | WF1wf1 | wf1wf1 | ||||||
| - - | - let | letlet | |||||||
| гк-109 | 80 | 79 | 16 | 40 | 15 | 12 | 242 | 96.2 | 16.7 |
| × | 80 | 79 | 16 | 55 | 12 | 242 | 49.7 | 5.07 | |
| гк-132 | 80 | 79 | 16 | 175 | 48.5 | 0.69 | |||
| гк-109 | 44 | 42 | 13 | 18 | 18 | 6 | 141 | 31.2 | 2.66 |
| × | 44 | 42 | 13 | 36 | 6 | 141 | 25.1 | 2.66 | |
| гк-391 | 44 | 42 | 13 | 99 | 21.6 | 0.45 | |||
Таблица 8.
Расщепление по генотипу в F2 гк-109 (wf1) × гк-132 (LET)
| Гаметы | WF1LET | WF1let | wf1LET – гибнет | wf1let |
|---|---|---|---|---|
| WF1LET | WF1WF1LETLET | WF1WF1LETlet | Нет | WF1wf1LETlet |
| WF1let | WF1WF1LETlet | WF1WF1letlet | Нет | WF1wf1letlet |
| wf1LET – гибнет | Нет | Нет | Нет | Нет |
| wf1let | WF1wf1LETlet | WF1wf1letlet | Нет | wf1wf1letlet |
Таблица 9.
Анализ расщепления F3 гк-109 (wf1) × гк-391 (sfbs1, LET)
| (Л) | Гол. | Св. гол. | Бел. | Бел. | ∑ | Гипотезы/χ2 | ||
|---|---|---|---|---|---|---|---|---|
| (П) | гол. | гол. | гол. | св. ор. | H01 | H02 | ||
| H01 | 3 | 6 | 3 | 4 | 16 | H01: Независимое наследование генов sfbs1 и wf1 | ||
| генотип | WF1WF1 SFBS1- | WF1wf1 SFBS1- | wf1wf1 SFBS1- | - - sfbs1 sfbs1 | ||||
| H02 | 12 | 12 | 3 | 9 | 36 | H02: Независимое наследование генов sfbs1, wf1 и LET. Гаметы wf1Let – нежизнеспособны | ||
| генотип | WF1WF1 SFBS1- | WF1wf1 SFBS1- | wf1wf1 SFBS1- | - - sfbs1 sfbs1 | ||||
| - - | - let | letlet | - - | |||||
| Одна семья | letlet* | 40 | 54 | 40 | – | 134 | 5.04 | 49.3 |
| Одна семья | letlet? | 27 | 60 | 15 | 25 | 127 | 8.34 | 16.2 |
| Одна семья | LETlet | 17 | 19 | 1 | 15 | 52 | 13.56 | 3.04 |
| Одна семья | LETlet | 29 | 24 | 4 | 23 | 80 | 22.78 | 1.99 |
В F2 гк-124 (f e) × гк-132 (sfbs1) наблюдается достоверный недостаток рецессивных гомозигот по гену f e. Гены wf1 и f e сцеплены с частотой кроссинговера 5 сМ и вероятно та же леталь губит гаметы f eLET, что было подтверждено критерием χ2 (табл. 10).
Таблица 10.
Анализ расщепления F2 гк-124 (f e) × гк-132 (sfbs1, LET)
| (Л) | Гол., св. гол., плоск. | Бел., сл. деформ. |
Оч. св. гол., плоск. | Бел., сл. деформ. |
∑ | Гипотезы/χ2 | |
|---|---|---|---|---|---|---|---|
| (П) | гол. | желт. | сер. | желт. | |||
| (С) | кр.-кор. | кр.-кор. | пятн. | пятн. | H01 | H02 | |
| H01 | 9 | 3 | 3 | 1 | 16 | H01: Независимое наследование генов sfbs1 и f e | |
| генотип | SFBS1- | sfbs1sfbs1 | SFBS1- | sfbs1sfbs1 | |||
| F e - | F e - | f e f e | f e f e | ||||
| 3 | 1 | 4 | |||||
| H02 | 24 | 8 | 3 | 1 | 36 | H02: Независимое
наследование генов
sfbs1, f e и LET. Гаметы f eLet – нежизнеспособны |
|
| генотип | SFBS1- | sfbs1 sfbs1 | SFBS1- | sfbs1sfbs1 | |||
| F e- | F e - | f e f e | f e f e | ||||
| - - | - - | letlet | letlet | ||||
| 8 | 1 | 9 | |||||
| Практ. | 73 | 15 | 8 | 1 | 97 | 16.7 | 4.13 |
| 88 | 9 | 97 | 12.8 | 0.33 | |||
У F1 и F2 гк-210 (dlb3) × гк-391 (sfbs1) не найдено “дикого типа” окраски цветка, который должен быть, исходя из его доминирования в других скрещиваниях. Расщепление по окраске и форме лепестков было 9/277 светлее голубого, плоские : : 3/166 светло-голубые, плоские : 4/104 белые, слабо деформированные (χ2 = 1.73), что можно объяснить сцеплением генов wf1, f e и dlb3.
В генанализ была вовлечена линия гк-277, гомозиготная по гену sfbs1-2, полученному в результате радиационного мутагенеза сорта Циан в УкрНИИМК [5], который имеет светло-голубую окраску венчика, контролируемую геном dlb3-5. В F2 гк-2 × гк-277 (sfbs1-2, dlb3-5) получено расщепление по окраске и форме лепестков: 9/87 голубые, плоские : 3/30 светло-голубые, плоские : : 3/26 белые, слабо деформированные : 1/7 белые, очень слабо деформированные (χ2 = 1.10), что и ожидаемо при дигенном расщеплении.
Наконец, у F1 и F2 Циан (к-7822, dlb3-5) × гк-391 (sfbs1) также не обнаружено “дикого типа” окраски цветка, расщепление подобно F2 гк-210 × × гк-391 – 9/71 : 3/28 : 4/41 (χ2 = 0.89), что свидетельствует о летали именно у гк-391 и гк-132. Возможно, гк-132 и 391 имеют родственное происхождение, так как их родоначальники – сорта из Австралии. Вероятно, эта леталь (делеция?) находится на месте аллеля PBC3, показывая ложную аллельность генов sfbs1 (гк-132) и pbc3 (гк-53).
Ген s1 маскирует проявление гена ora1. Расщепление F2 гк-136 (s1) × гк-65 (ora1) соответствует 9/214 “дикий тип” : 3/68 (Л) голубые плоские, (П) светло-оранжевые, (С) крапчатые : 4/74 (Л) белые, деформированные, (П и С) желтые (χ2 = 3.50).
Гены sfbs1 и ora1 действуют независимо. Ген sfbs1 маскирует проявление гена ora1 в цветке, но не мешает проявлению крапчатости семян. Расщепление в F2 гк-132 × гк-65 соответствует:
| 9/92 : | 3/30 : | 3/20 : | 1/8 (χ2 = 3.36) | |
| (Л) | гол., плоские | гол., плоские | белые деформ. | белые деформ. |
| (П) | голубые | св. оранж. | желтые | желтые |
| (С) | красно-коричневые | крапчатые | красно-коричневые | крапчатые |
У гибридов второго поколения гк-208 (pbc1) × гк-124 (f e) было расщепление:
| 9/172 : | 3/53 : | 3/59 : | 1/16 (χ2 = 0.79) | |
| (Л) | гол. или светлее, плоск. | оч. оч. св. гол., гофр. | оч. св. гол., плоск. | бел., плоск. |
| (П) | голубые | желтые | серые | желтые |
| (С) | красно-коричневые | красно-коричневые | пятнистые | пятнистые |
с комплементарным взаимодействием генов, выражающимся в белой окраске венчика, ген pbc1 дает желтые пыльники, а ген f e обусловливает пятнистость семян.
У F2 гк-188 (pbc1) × гк-1 (dlb1) было расщепление по окраске и форме цветков – 9/46 “дикого типа” или немного светлее : 3/10 очень-очень светло-голубые, гофрированные: 3/9 очень-очень светло-голубые, плоские : 1/2 белые, плоские (χ2 = 4.51) – кумулятивное действие этих генов на белую окраску венчика и форму лепестков.
В F2 от скрещивания гк-208 (pbc1) × гк-210 (dlb3) получено расщепление – 9/205 (Л и П) “дикого типа” : 3/55 (Л) светло-голубые, плоские, (П) голубые : 4/91 (Л) очень-очень светло-голубые, гофрированные или слабо гофрированные, (П) желтые (χ2 = 2.19). У двойных рецессивных гомозигот по этим генам фенотип подобен гк-208, лишь слегка уменьшалась деформация цветка.
В F2 гк-53 (pbc3) × гк-124 (f e) наблюдали расщепление, исходя из которого действие гена f e подавляет действие гена pbc3:
| 9/71 : | 3/28 : | 4/41 (χ2 = 0.11) | |
| (Л) | гол., плоск. | оч. оч. св. гол., слож., гофр. | оч. св. гол., плоск. |
| (П) | голубые | желтые | серые |
| (С) | красно-коричневые | красно-коричневые | пятнистые |
В F2 гк-53 (pbc3) × гк-1 (dlb1) по окраске и форме лепестков было расщепление – 9/53 “дикого типа” : 3/27 очень-очень светло-голубые, плоские : 4/37 очень-очень светло-голубые, сложенные и гофрированные (χ2 = 5.72). То есть ген pbc3 маскирует проявление гена dlb1.
В F2 гк-53 (pbc3) × гк-32 (dlb3) обнаружено расщепление – 9/26 (Л и П) “дикого типа” : 3/12 (Л) светло-голубые плоские, (П) голубые : 3/16 (Л) очень-очень светло-голубые, сложенные и гофрированные, (П) светло-оранжевые : 1/6 (Л) почти белые, слабо сложенные и слабо гофрированные, (П) светло-оранжевые (χ2 = 1.88). То есть ген dlb3 ослаблял и без того слабую пигментацию цветка у гомозигот по гену pbc3.
Взаимодействие генов pbc1 и pbc3 с wf1 и ora1, гена dlb1 с s1 и sfbs1 не изучали.
Взаимодействие генов, контролирующих розовую окраску венчика, с генами деформации лепестков и ослабителями голубой окраски венчика
Гены s1 и pf1 имеют комплементарное действие. Ген s1 подавляет синтез антоцианов во всем растении, а pf1 ликвидирует деформацию лепестков и придает семенам желто-коричневую окраску, вероятно вызванную каротиноидами и хлорофиллами. Ген RPF1 не влияет на проявление гена s1. Расщепление в F2 гк-141 (pf1, RPF1) × × гк-136 (s1) соответствует [25]:
| 36/163 : | 3/12 : | 9/49 : | 12/43 : | 4/18 (χ2 = 0.79) | |
| (Л) | гол., плоские | роз., плоские | св. роз., плоские | бел. деформ. | бел., плоские |
| (П) | голубые | св. ор. | св. ор. | желтые | желтые |
| (С) | кр.-кор. | т. ж.-кор. | т. ж.-кор. | желтые | ж.-кор. |
Гены sfbs1 и pf1 также имеют комплементарное действие. Ген sfbs1 подавляет синтез антоцианов в гипокотиле и цветке, но не работает в семенах, а pf1 ликвидирует деформацию лепестков и придает семенам желто-коричневую окраску. Действие гена RPF1 сильно зависело от условий среды и сейчас не рассматривается. Расщепление в F2 гк-141 (pf1) × гк-136 (sfbs1) соответствует:
| 9/235 : | 3/81 : | 3/66 : | 1/25 (χ2 = 1.85) | |
| (Л) | гол., плоские | роз., плоские | бел., деформ. | бел., плоские |
| (П) | голубые | св. оранжевые | желтые | желтые |
| (С) | кр.-кор. | т. ж.-кор. | кр.-кор. | т. ж.-кор. |
Ген wf1 ослабляет розовую окраску венчика у гомозигот по гену pf1, но не влияет на окраску пыльников и семян. В F2 гк-109 (wf1, RPF1) × гк-129 (pf1-ad, RPF1) расщепление соответствует:
| 3/7 : | 6/40 : | 3/5 : | 1/6 : | 3/6 (χ2 = 6.13) | |
| (Л) | голубые | св.-голубые | белые | св.-розовые | белые |
| (П) | голубые | голубые | голубые | св.-оранжевые | желтые |
| PF1-WF1WF1 | PF1-WF1wf1 | PF1-wf1wf1 | pf1pf1WF1WF1 | pf1pf1-wf1 |
В F2 гк-109 (wf1, RPF1) × гк-141 (pf1, rpf1) родительские линии различаются по аллелям генов wf1 и rpf1, которые являются антагонистами. Ген rpf1 усиливает розовую окраску цветка, а wf1 – ослабляет. В генотипе pf1pf1 действие rpf1rpf1 такое же, как двух аллелей WF1. То есть розовую окраску цветка имеют растения генотипа rpf1rpf1WF1WF1 и rpf1rpf1 WF1wf1, светло-розовую – RPF1-WF1WF1 и rpf1rpf1wf1wf1, а белую – RPF1-WF1wf1 и RPF1-wf1wf1. Суммарное расщепление соответствует:
| 12/75 : | 24/139 : | 12/67 : | 3/11 : | 4/16 : | 9/50 (χ2 = 4.90) | |
| (Л) | голубые | св.-голубые | белые | розовые | св.-розовые | белые |
| (П) | голубые | голубые | голубые | св. ор. | св. ор. | желтые |
| (С) | кр.-кор. | кр.-кор. | кр.-кор. | т. ж.-кор. | т. ж.-кор. | т. ж.-кор. |
| PF1- | PF1- | PF1- | pf1pf1 | pf1pf1 | pf1pf1 | |
| WF1WF1 - - | WF1wf1 - - | wf1wf1 - - | WF1- rpf1rpf1 | WF1WF1RPF1- wf1wf1 rpf1rpf1 | WF1wf1 RPF1- wf1wf1 RPF1- |
Последний класс можно разделить, используя взаимодействие антоцианов с кислотой, которая усиливает их окраску. Было проанализировано три семьи F3pf1pf1 WF1wf1 RPF1 – у них расщепление по окраске лепестков соответствовало –6/42 белых, окрашиваемых в кислоте : 3/26 белых не окрашиваемых в кислоте : 4/34 светло-розовых : : 3/18 розовых (χ2 = 2.18).
Гены f e и pf1 имеют комплементарное действие (табл. 11). Ген f e ослабляет розовую окраску цветка до белой и немного осветляет пыльники и желто-коричневые семена. В F2 гк-124 (f e) × гк-141 (pf1) для дигенного расщепления (H01: 9 : 3 : 3 : 1) наблюдается существенный недостаток классов гомозигот по гену f e. У двух семей он недостоверен, а у трех – приводит к опровержению H01. По второй гипотезе ген rpf1, усилитель розовой окраски, ингибирует проявление гена f e (H02: 39 : : 9 : 13 : 3), по третьей – у гк-141 присутствует леталь, делающая гаметы f eLet нежизнеспособными (H03: 24 : 3 : 8 : 1), что уже было показано в скрещивании гк-124 × гк-132. H02 достоверна для четырех семей F2, H03 – для трех.
Таблица 11.
Анализ расщепления F2 гк-124 × гк-141
| (Л) | Гол., св. гол. | Роз., св. роз. | Оч. св. гол. | Бел. | Гипотезы/χ2 | |||
|---|---|---|---|---|---|---|---|---|
| (П) | гол. | св. ор. | сер. | желт. | ∑ | |||
| (С) | кр.-кор. | т. ж.-кор. | пятн. | ж.-кор. | H01 | H02 | H03 | |
| H01 | 9 | 3 | 3 | 1 | 16 | H01: ген rpf1
не влияет
на проявление гена f e |
||
| генотип | PF1-F e- | pf1pf1F e- | PF1- f ef e | pf1pf1f ef e | ||||
| 3 | 1 | 4 | ||||||
| F e- | f ef e | |||||||
| H02 | 39 | 13 | 9 | 3 | 16 | H02: ген rpf1 ингибирует ген f e | ||
| генотип | PF1- - - F e-; PF1rpf1rpf1f ef e | pf1pf1- - F e-; pf1pf1rpf1rpf1f ef e | PF1-RPF1- f ef e | pf1pf1 RPF1-f ef e | ||||
| 13 | 3 | 16 | ||||||
| RPF1-Fe-; rpf1rpf1f ef e | RPF1-f ef e | |||||||
| H03 | 24 | 8 | 3 | 1 | 36 | H03: гк-141 несет Let не сцепленную с геном F e. Гаметы f eLet нежизнеспособны | ||
| генотип | PF1- F e- - - | pf1pf1F e- - - | PF1- f ef e letlet | pf1pf1 f ef e letlet | ||||
| 8 | 1 | 9 | ||||||
| F e- - - | f ef eletlet | |||||||
| Две семьи | 64 | 26 | 17 | 4 | 111 | 3.27 | 1.13 | 8.19 |
| 90 | 21 | 111 | 2.19 | 0.00 | 6.85 | |||
| Одна семья | 21 | 13 | 2 | 0 | 36 | 11.41 | 8.00 | 4.83 |
| 34 | 2 | 36 | 7.26 | 4.11 | 1.13 | |||
| Две семьи | 94 | 35 | 14 | 6 | 149 | 11.16 | 3.30 | 1.43 |
| 129 | 20 | 149 | 10.65 | 2.78 | 0.81 | |||
Ген ora1 практическине влияет на проявление аллелей гена pf, в том числе в семенах [П11]. Однако из скрещивания гк-65 (ora1) × гк-141 (pf1) были отобраны единичные стабильные гибриды с розовыми лепестками и чисто розовыми, без голубого пигмента жилками, предположительно гомозиготные по обоим генам. Такой фенотип описан впервые.
Взаимодействие гена pf с pbc1, pbc3 и dlb1 не изучалось.
Таким образом, при взаимодействии с другими генами ген pf ингибирует деформацию венчика, делает светлее лепестки, тычиночные нити и столбики, придает пыльникам светло-оранжевый, а семенам желто-коричневый (желтый) цвет.
ОБСУЖДЕНИЕ
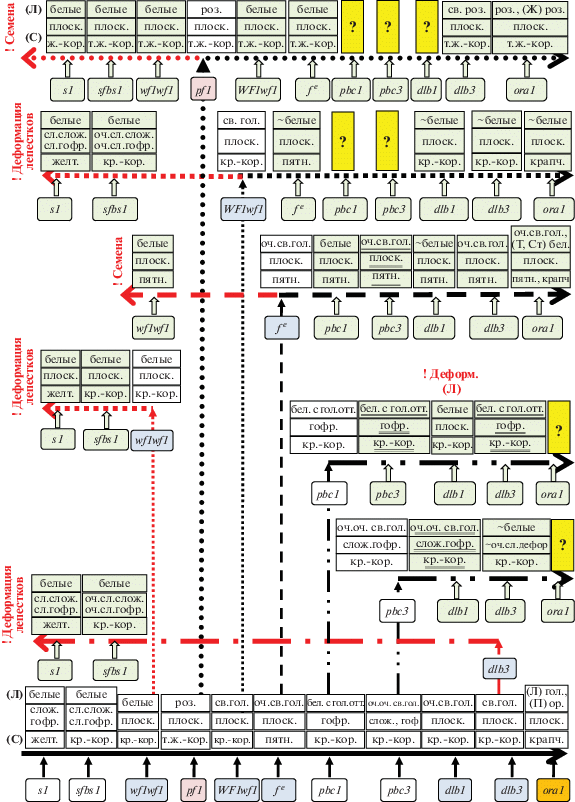
Схему взаимодействия генов деформации и светло-голубой окраски лепестков можно представить следующим образом: s1 > sfbs1 > wf1 > f e > > pbc1 > pbc3 > dlb1 > dlb3 > ora1. Но если рассматривать их действие на разные части растения схема усложняется. Ген wf1 стоит третьим в цепочке биосинтеза антоцианов, но первым, если брать деформацию лепестков. Он же полностью (или частично в гетерозиготе) подавляет окраску лепестков у гомозигот по гену f e, но не работает в семенах. Гены f e и dlb1 подавляют работу гена pbc1 по деформации венчика и имеют кумулятивное действие по окраске лепестков. Ген f e полностью маскирует работу гена pbc3. Ген dlb3 работает как “ослабитель” и окраски и деформации лепестков у гомозигот по гену pbc3 (рис. 1).
Рис. 1.
Последовательность действия генов, контролирующих окраску и форму цветка и семян.
 – путь формирования фенотипа;
– путь формирования фенотипа;  – действие гена;
– действие гена;  – совместное действие генов. ! – нарушение прямого пути формирования фенотипа, ?
– взаимодействие генов не изучалось. Двойным подчеркиванием показаны фенотипы, идентичные
фенотипам гомозигот по одному из генов.
– совместное действие генов. ! – нарушение прямого пути формирования фенотипа, ?
– взаимодействие генов не изучалось. Двойным подчеркиванием показаны фенотипы, идентичные
фенотипам гомозигот по одному из генов.
Ген розовой окраски венчика ингибирует его деформацию, делает светлее лепестки, тычиночные нити и столбики, придает пыльникам светло-оранжевый, а семенам желто-коричневый (желтый) цвет.
В общем цепочку взаимодействия генов окраски и формы цветка льна можно представить следующим образом: s1 > sfbs1 > wf1 > pf1 > f e > > pbc1 > pbc3 > dlb1 > dlb3 > ora1. В ней за основу взята окраска венчика. Однако последовательность функционирования генов s1, wf1, pf1, f e и dlb3 изменяется в процессе формирования различных признаков. Так, по окраске цветка они будут располагаться следующим образом: s1 > wf1 ≥ ≥ pf1 ≥ f e ≥ dlb3, по его деформации pf1 = wf1 > dlb3 > > s1 > f e, по окраске семян pf1 > s1 > f e > wf1 = dlb3.
Схема генов будет уточняться, так как еще не изучено взаимодействие генов pbc1 и pbc3 с pf, wf1, ora1, а также pf с dlb1.
Работа выполнена в рамках государственного задания ВИР № 0662-2019-0001.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Tammes T. The genetics of the genus Linum // Bull. Genet. 1928. V. 4. P. 1–36.
Tammes T. Some correlationphenomena in hybrids. Amsterdam: Koninklijke Akad. van Wateschappen te Amsterdam, 1912. V. 15. № 30. P. 1004–1014.
Plonka F. La competition polinique ches le Lin cultive // Annales de l’amelioration de plantes Institut National de la recherche Agronomique. 1971. V. 21. № 2. P. 179–220.
Dubois J., Harborne J., Bablom B., Plonka F. The inheritance of flower colors and anthocyanins in flax (Linum usitatissimum L.) // Annales de l’amelioration de plantes Institut National de la recherche Agronomique. 1979. V. 29. № 3. P. 267–276.
Лях В.А., Мищенко Л.Ю., Полякова И.А. Генетическая коллекция вида Linum usitatissimum L. Запорожье: ИМК УААН, 2003. 60 с.
Мищенко Л.Ю., Лях В.А. Наследование белой окраски лепестков венчика у некоторых линий льна масличного. Запорiжжя: Наук.-техн. бюл. Iнституту олiйних культур УААН, 2000. Вип. 5. С. 13–17.
Ягло М.Н., Лях В.А. Разнообразие окрасок семян у льна масличного и особенности их наследования // Вестник Белорусской гос. с.-х. академии. 2015. № 3. С. 70–73.
Полякова И.А., Яранцева В.В., Левчук А.Н., Лях В.А. Фенотипическое проявление мутаций хлорофиллдефицитности на ранних этапах онтогенеза льна масличного // Вiснiк Запоризького нац. ун-т. 2013. № 1. С. 49–57.
Полякова И.А. Мутация viridis индуцированная у льна масличного // Вiснiк Запоризького нац. ун-т. 2008. № 2. С. 163–165.
Полякова И.А. Наследование хлорофильной мутации xanthoviridis у льна масличного. Запорiжжя: Наук.-техн. бюл. Інституту олійних культур УААН, 2009. № 14. С. 52–55.
Ярцева В.В., Лях В.А. Морфология хлоропластов и пигментный состав листьев разного возраста хлорофилльных мутантов льна // Физиол. растений и генетика. 2015. Т. 47. № 3. С. 236–243.
Пороховинова Е.А. Генетический контроль морфологических признаков льна // Тр. по прикл. бот., ген. и сел. 2011. Т. 167. С. 159–184.
Пороховинова Е.А. Генетический контроль морфологических признаков проростков, плода и семян у льна // Вавиловский журн. генетики и селекции. 2012. Т. 16. № 4/2. С. 936–947.
Пороховинова Е.А., Брач Н.Б., Морван К., Кутузова С.Н. Генетическая коллекция льна в ВИРе: фундаментальное и прикладное использование // Тр. по прикл. бот., ген. и сел. 2013. Т. 174. С. 107–117.
Пороховинова Е.А., Брач Н.Б., Кутузова С.Н., Павлов А.В. Генетическая коллекция льна ВИР: современное состояние, перспективы формирования и развития: IV Вавиловская межд. конф. “Идеи Н.И. Вавилова в современном мире”. СПб.: ВИР, 20–24 ноября 2017 г. С. 146.
Wang Z., Hobson N., Galindo L. et al. The genome of flax (Linum usitatissimum) assembled de novo from short shotgun sequence reads // The Plant J. 2012. V. 72. P. 461–473. https://doi.org/10.1111/j.1365-313X.2012.05093.x
Cloutier S., Niu Z., Ragupathy R., Duguid S. SSR-based linkage map of flax (Linum usitatissimum L.) and mapping of QTLs underlying fatty acid composition traits // Mol. Breeding. 2011. V. 28. P. 437–451. https://doi.org/10.1007/s11032-010-9494-1
Cloutier S., Ragupathy R., Miranda E. et al. Integrated consensus genetic and physical maps of flax (Linum usitatissimum L.) // Theor. Appl. Genet. 2012. V. 125. P. 1783–1795. https://doi.org/10.1007/s00122-012-1953-0
Soto-Cerda B.J., Duguid S., Booker H. et al. Association mapping of seed quality traits using the Canadian flax (Linum usitatissimum L.) core collection // Theor. Appl. Genet. 2014. V. 127. P. 881–896. https://doi.org/10.1007/s00122-014-2264-4
You F.M., Li P., Kumar S. et al. Genome-wide identification and characterization of the gene families controlling fatty acid biosynthesis in flax (Linum usitatissimum L.) // J. Proteomics Bioinform. 2014. V. 7. P. 310–326. https://doi.org/10.4172/jpb.1000334
Asgarinia P., Cloutier S., Duguid S. et al. Mapping quantitative trait loci for powdery mildew resistance in flax (Linum usitatissimum L.) // Crop Science. 2013. V. 53. P. 2462–2472. https://doi.org/10.2135/cropsci2013.05.0298
Yurkevich O.Y., Kirov I.V., Bolsheva N.L. et al. Integration of physical, genetic and cytogenetic mapping data for cellulose synthase (CesA) genes in flax (Linum usitatissimum L.) // Frontiers in Plant Science. 2017. V. 8. P. 1467. https://doi.org/10.3389/ fpls.2017.01467
Sudarshan G.P. Genetic analysis of seed and flower colour in flax (Linum usitatissimum L.) and identification of a candidate gene in the D locus: Thesis for the Degree of Master of Science. Univ. Saskatchewan, Saskatoon, 2013. 149 p.
Sudarshan G.P., Kulkarni M., Akhov L. et al. QTL mapping and molecular characte-rization of the classical D locus controlling seed and flower color in Linum usitatissimum (flax) // Scientific Reports. 2017. V. 7. P. 15751. https://doi.org/10.1038/s41598-018-22651-9
Брач Н.Б., Пороховинова Е.А. Наследование морфологических и хозяйственно ценных признаков льна (Linum usitatissimum L.) // Идентифицированный генофонд растений и селекция. СПб.: ВИР, 2005. С. 863–872.
Пороховинова Е.А. Изучение наследования окраски и формы цветка и семян, а также ее связи с продолжительностью фазы всходы–цветение у льна (Linum usitatissimum L.) // Науч.-техн. бюл. ВНИИР им. Н.И. Вавилова. 2000. Вып. 239. С. 56–58.
Пороховинова Е.А. Совместное наследование генов морфологических признаков и восстановления фертильности пыльцы при цитоплазматической мужской стерильности у льна (Linum usitatissimum L.) // Тр. по прикл. бот., ген. и сел. 2017. Т. 178. В. 2. С. 84–95.https://doi.org/10.30901/2227-8834-2017-2-84-95
Пороховинова E.A., Кутузова С.Н., Павлов А.В. и др. Разнообразие морфологи-ческих признаков льна в генетической коллекции ВИР как результат его доместикации // Экологическая генетика. 2018. Т. 16(4). С. 33–50. https://doi.org/10.17816/ecogen16433-50
Лакин Г.Ф. Биометрия. М.: Высш. шк., 1990. 351 с.
Тихомирова М.М. Генетический анализ. Л.: ЛГУ, 1990. 280 с.
Дополнительные материалы отсутствуют.


