Генетика, 2019, T. 55, № 11, стр. 1279-1287
Генетическое разнообразие Solanum pinnatisectum Dun. и S. chacoense Bitt. по резистентности к вирусу картофеля Y и результатам ДНК-анализа
Е. В. Рогозина 1, *, П. С. Ульянич 1, В. А. Волков 1, Н. А. Чалая 1, Е. К. Потокина 1, 2
1 Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений
им. Н.И. Вавилова
190121 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: erogozina@vir.nw.ru
Поступила в редакцию 10.04.2019
После доработки 12.06.2019
Принята к публикации 19.06.2019
Аннотация
Картофель Solanum tuberosum L. располагает наибольшим разнообразием культурных и дикорастущих сородичей, генетическая природа которых исследована недостаточно. В настоящей работе изучена резистентность видов S. chacoense Bitt. и S. pinnatisectum Dun. к YBK и осуществлен поиск ДНК-маркеров, сцепленных с генами устойчивости. Впервые представительные популяции двух диплоидных клубненосных Solanum spp. охарактеризованы по резистентности к YBK и наличию ДНК-маркеров, сцепленных с генами сверхустойчивости (Ry) или сверхчувствительности (Ny), локализованными в сегменте длинного плеча хромосомы 9. Изучены девять образцов S. chacoense и шесть образцов S. pinnatisectum из коллекции ВИР. Растения 168 генотипов S. chacoense и 170 генотипов S. pinnatisectum оценены по устойчивости к искусственному заражению YBK. Установлены различия в разделении двух дикорастущих видов картофеля на фенотипические классы при заражении YBK. Разнообразие видимых реакций растений S. chacoense при инфицировании YBK отличается от однотипных симптомов, наблюдаемых у S. pinnatisectum. ДНК-анализ проведен для 170 генотипов S. chacoense и 44 генотипов S. pinnatisectum с использованием маркеров Ry186, S1d11 и СТ220, сцепленных с генами, детерминирующими устойчивость к вирусам у сортов, селекционных клонов картофеля или видов рода Solanum L. У большинства генотипов S. chacoense и S. pinnatisectum амплифицирован маркер СТ220, сцепленный с геном Nxphu у линии IvP35 вида S. phureja Juz. et Buk. и геном Sw-5 у томата. STS-маркер Ry186, сцепленный с геном Rychc у японских сортов, созданных на основе S. chacoense, обнаружен у незначительного числа генотипов S. chacoense и ассоциации маркер–признак не выявлено. Разработан CAPS-маркер S1d11/AcsI, различающий устойчивые и восприимчивые к YBK генотипы обоих дикорастущих видов картофеля. Растения двух дикорастущих клубнеобразующих видов Solanum L. впервые массово обследованы на наличие маркера гена GBSSI (гена гранул-связанной крахмалсинтазы). У значительной части генотипов (15% S. pinnatisectum и 25% S. chacoense) маркер гена, который контролирует биосинтез амилозы в формирующихся крахмальных гранулах, не выявлен. По способности формировать клубни между генотипами, которые обладают и не обладают маркером GBSS, значимых различий не выявлено, что свидетельствует о наличии аллельного варианта гена GBSSI у видов S. chacoense и S. pinnatisectum.
Возделываемый в сельскохозяйственном производстве картофель (Solanum tuberosum L. subsp. tuberosum) вместе с другими видами, образующими клубни и сходными по морфологии надземных органов, относится к подсекции Potatoe G. Don. в составе секции Petota Dumort. рода Solanum L. В сравнении с другими важнейшими сельскохозяйственными культурами картофель располагает наибольшим разнообразием культурных и дикорастущих сородичей [1]. Естественные местообитания видов секции Petota Dumort. рода Solanum L. приурочены к разным эколого-географическим районам на обширной территории, простирающейся от южных районов США (38° с.ш.) до побережья Чили и архипелага Чилоэ (41° ю.ш.), в пределах 16 стран Центральной и Южной Америки [2].
Клубнеобразующие виды рода Solanum L. обладают широким спектром признаков устойчивости к неблагоприятным факторам среды, отсутствующих у коммерчески возделываемого картофеля, в том числе устойчивостью к болезням и вредителям. Основной метод селекции картофеля – это межвидовая гибридизация, которая позволяет осуществить интрогрессию генетического материала (обеспечивающего наследование целевого признака) от родственных видов Solanum в геном культурного картофеля [3]. Картофель – вегетативно размножаемая культура, восприимчивая к вирусным заболеваниям, среди которых повсеместно серьезные экономические потери вызывает инфицирование вирусом картофеля Y (YBK) [4]. Устойчивые к YBK формы найдены среди дикорастущих клубнеобразующих Solanum spp. Генетические исследования диких родичей Solanum L. проведены на ограниченном числе видов. Молекулярно-генетический скрининг коллекций существенно расширяет знания о составе R-генов у дикорастущих форм картофеля [5].
Селекция на резистентность к YBK основана на сверхустойчивости (extreme resistance), контролируемой геном Ry, или на сверхчувствительности (hypersensitivity), детерминируемой геном Ny [6]. Сверхустойчивость (иммунитет) к YВК контролируют гены Rysto (источник – S. stoloniferum Schlechtd.), Rychc (S. chacoense Bitt.) и Ryadg (S. tuberosum ssp. andigena Juz. et Buk.), переданные в российские и зарубежные сорта и селекционные клоны от разных источников [3, 6]. Сверхчувствительность к определенным штаммам YBK, характерная для некоторых европейских сортов и селекционных клонов, унаследована от S. demissum Lindl., S. chacoense и S. tuberosum [6] и обнаружена у вида S. sparsipilum (Bitt.) Juz. et Buk. [7]. Гены сверхустойчивости и сверхчувствительности локализованы в кластерах на хромосомах 4, 9, 11 и 12.
В современной селекции большое значение имеет использование MAS (Marker-assisted-selection – отбор с помощью молекулярных маркеров) для идентификации форм с генами, детерминирующими ценные признаки. Интенсификация селекционного процесса картофеля на основе MAS-технологии является одной из приоритетных задач современных генетико-селекционных исследований. Для обнаружения генов Ry и Ny разработаны фланкирующие ДНК-маркеры [6]. Результаты тестирования селекционного материала в США и Канаде с помощью маркеров генов Rysto и Ryadg свидетельствуют о необходимости новых более специфичных маркеров генов иммунитета к YВК [8, 9]. Молекулярный скрининг генетических коллекций и сортов российской селекции выявил разную частоту форм с генами Rysto, Rychc и Ryadg, в зависимости от селекционного центра – оригинатора изученного материала [10–12]. Однако результаты анализа сортов и селекционных клонов с использованием молекулярных маркеров, опубликованные в литературе, не всегда сопровождаются сведениями об устойчивости исследованных сортов и селекционных клонов к YBK.
Исходные образцы – формы S. stoloniferum, S. andigenum, S. chacoense и S. demissum, использованные как источник генетического материала в селекции на устойчивость к YBK, не сохранились. Валидация ДНК-маркеров проводится главным образом на сортах и селекционных клонах гибридного происхождения. Поэтому особый интерес представляют исследование генетической природы устойчивости клубнеобразующих видов рода Solanum L. к YВК и поиск ДНК-маркеров, надежно сцепленных с целевым локусом у диких родичей картофеля. Цель настоящей работы – изучение резистентности видов S. chacoense и S. pinnatisectum к вирусу картофеля Y и поиск ДНК-маркеров, сцепленных с генами устойчивости. Впервые представительные популяции двух диплоидных клубненосных Solanum spp. охарактеризованы по устойчивости к YBK и наличию ДНК-маркеров, сцепленных с генами Ry, Ny, локализованными в одном участке хромосомы 9.
МАТЕРИАЛЫ И МЕТОДЫ
Материал исследования – образцы вида S. chacoense кк-2732, 2861, 3060, 7394,19769, 21848, 21849, 21854, 22638 и вида S. pinnatisectum кк-4455, 4459, 15254, 19157, 21955, 23569 из коллекции ВИР. Изучали семенное потомство (25–30 сеянцев каждого образца) и растения первой клубневой репродукции.
Фитопатологический анализ. Оценка резистентности к YВК проведена стандартными методами искусственного заражения – механической инокуляции (все растения S. pinnatisectum и S. chacoense) и прививки (растения S. pinnatisectum, устойчивые при механической инокуляции). Источник инфекции – картофель сорта Детскосельский и клон S. chacoense к-21321, пораженные обычным YВКO и некротическим YВКN штаммами вируса соответственно. Для накопления вирусной инфекции, приготовления инокулюма и как подвой при испытании прививкой использовали растения Nicotiana tabacum L. (сорт Самсун). Механическую инокуляцию растений S. chacoense и S. pinnatisectum проводили дважды с интервалом 7–8 дней. Использовали общую суспензию сока растений табака, инфицированных обычным YВКO и некротическим YВКN штаммами. Результаты оценивали через две-три недели после второго заражения визуально по симптомам вирусного поражения и методом иммуноферментного анализа (ИФА) (Enzyme-linked-Immunosorbent Assay, ELISA) в модификации “двойной сэндвич” [13]. Использовали диагностические наборы НПО “Биотехнология” ВНИИКХ им. А.Г. Лорха (Коренево, Московская обл.). Контроль – растения N. tabacum L. непораженные и инфицированные Y-вирусом. Диагностику поражения YВК проводили дважды: у сеянцев и растений первой клубневой репродукции.
Молекулярные методы анализа. ДНК выделяли из свежих листьев с использованием CTAB-буфера и 2-меркаптоэтанола по протоколу Doyle et al. [14]. Для выделения ДНК 100–150 мг материала измельчали путем замораживания в жидком азоте и гомогенизации в автоматической мельнице. Реакционная смесь ПЦР состояла из 2.5 мкл 10× Taq-буфера c MgCl2, 1 мкл смеси dNTP (10 мM), 0.5 мкл каждого из праймеров (10 мМ), 0.5 мкл Taq-полимеразы (5 ед./мкл) и 2 мкл ДНК (10–30 нг/мкл). Объем доводили до 25 мкл деионизированной водой.
Использовали маркеры Ry186, S1d11 и СТ220, сцепленные с генами, детерминирующими устойчивость к вирусам и локализованными в сегменте длинного плеча хромосомы 9 [6]. STS-маркер Ry186 был разработан Takeuchi с соавт. (2008 г.) и демонстрировал частоту рекомбинации 0.203% с геном устойчивости Rychc [цит. по 15]. Этот маркер оказался сцепленным с геном Rychc у японских сортов Saikai 35 и Konafubuki (последний создан на основе сверхустойчивого к YВК образца S. chacoense) [15, 16], а также с геном Ny-Smira, контролирующим сверхчувствительность сорта Sarpo Mira к штамму YВКNTN , который вызывает некротическое поражение клубней [17]. CAPS-маркер S1d11 сцеплен с геном Ny-1, детерминирующим сверхчувствительность сортов Albatros, Koga, Neptun, Niagara и Sekwana к штамму YВКN [18]. RFLP-маркер СТ220 сцеплен с локализованными в том же участке 9-й хромосомы геном Nxphu, детерминирующим сверхчувствительность линии IvP35 клубнеобразующего вида S. phureja Juz. et Buk. к вирусу картофеля X (XBK) [19], и геном Sw-5, контролирующим устойчивость томата к вирусу бронзовости или пятнистого увядания (TSWV, tomato spotted wilt virus) [20].
Для амплификации маркера Ry186 использовали праймеры (5'-TGGTAGGGATATTTTCCTTAGA-3', 5'-GCAAATCCTAGGTTATCAACTCA-3') и условия реакции, предложенные Mori c соавт. [15]. Протокол амплификации: 1 цикл (10 мин – 94°C), 35 циклов (30 с – 94°C, 30 с – 55°C, 1 мин – 72°C), 1 цикл (5 мин – 72°C). В качестве положительного контроля при постановке ПЦР для определения маркера Ry186 использован маркер GBSS гена GBSSI (гена гранул-связанной крахмалсинтазы), согласно рекомендации Mori c соавт. [15]. В анализ включены сорта Башкирский и Белоснежка, у которых детектирован маркер Ry186 [10].
Для амплификации маркера CT220 использовали праймеры (5'-AAGCGAATTATCTGTCAAC-3' и 5'-GTTCCTGACCATTACAAAAGTAC-3'), предложенные van der Voort с соавт. [21]. Программа амплификации включала 1 цикл денатурации (95°C – 3 мин), 35 циклов (95°C – 30 с, 60°C – 45 с, 72°C – 90 с), 1 цикл элонгации (72°C – 10 мин).
Результаты ПЦР для маркеров Ry186 и CT220 анализировали методом электрофореза в 1.5%-ном агарозном геле.
Для амплификации маркера S1d11 использовали праймеры (5'-GCCAAAAAGGGTAGGAAAAATG-3' и 5'-TCATCTTCACGAATCGGACTAAA-3') по протоколу ПЦР, предложенному Szajko c соавт. [18]: 1 цикл денатурации (95°C – 3 мин), 35 циклов (95°C – 25 с, 54°C – 35 с, 72°C – 90 с), 1 цикл элонгации (72°C – 5 мин).
Для секвенирования последовательностей маркеров S1d11 и CT220 продукт ПЦР очищали и концентрировали с использованием магнитных частиц AMPure XP по протоколу Agencourt AMPure XP [22]. Подготовку проб для секвенирования проводили с использованием набора BigDye Terminator v3.1 (Thermo Fisher Scientific). Состав реакционной смеси был адаптирован для генетического анализатора Нанофор-05 (Синтол) и включал: 1.2 мкл 5× Sequencing Buffer, 0.3 мкл Ready Reaction Mix, 0.3 мкл (10 мМ) праймера, 4.5 мкл деионизированной воды и 2 мкл очищенного ПЦР-продукта. Необходимая концентрация ПЦР-продукта доводилась согласно руководству BigDyeTM Terminator v3.1 Cycle Sequencing Kit USER GUIDE [23]. Программа амплификации и дальнейшая очистка продукта реакции с использованием 125 мM EDTA выполнялись в соответствии с рекомендациями производителя.
Продукт ПЦР, полученный для маркера S1d11, подвергался рестрикции с эндонуклеазой AcsI. Реакция рестрикции для AcsI имела следующий состав: 1 мкл SEBuffer W, 0.1 мкл AcsI (20 ед./мкл), 1 мкл BSA (1 мг/мл), 2.9 мкл деионизированной воды, 5 мкл продукта ПЦР (10–20 нг/мкл). Реакционная смесь инкубировалась при 50°C в течение 3 ч, с последующей инактивацией фермента при 80°C (20 мин). Результаты рестрикции анализировали методом электрофореза в 1.5%-ном агарозном геле. Длину фрагментов определяли с помощью маркера длин GeneRuler 50 bp DNA Ladder (Thermo Fisher Scientific).
Статистическую обработку результатов исследования проводили с помощью программы Statistica Basic Academic 13 (ЗАО СтатСофт Раша). Оценку связи ДНК-маркеров и признака устойчивости к YBK выполняли путем анализа таблиц сопряженности с помощью критерия согласия Пирсона (χ2, хи-квадрат) с поправкой Йетса на непрерывность. Опровержение H0-гипотезы об отсутствии связи между параметрами происходит при p < 0.05.
РЕЗУЛЬТАТЫ
Фитопатологическая оценка
Растения 338 генотипов двух диплоидных Solanum spp.: 168 генотипов девяти образцов S. chacoense и 170 генотипов шести образцов S. pinnatisectum оценены по резистентности к YBK и установлены различия между видами по реакции на искусственное заражение вирусом (табл. 1). В семьях растений S. chacoense через неделю после механической инокуляции наблюдали разнообразие видимых симптомов: появление крапчатости, затем морщинистой мозаики или точечные некрозы на инокулированных листьях, некроз жилок на инокулированных и вышерасположенных листьях, некротизацию вышерасположенных листьев и/или побега, опадение листьев, иногда гибель растения. В семьях растений S. pinnatisectum после механической инокуляции наблюдали опадение листьев и/или гибель растений.
Таблица 1.
Результаты искусственного заражения S. chacoense и S. pinnatisectum YBK
| Номер образца по каталогу ВИР | Растений всего | Из них при визуальной диагностике | Распределение на фенотипические классы* | ||||||
|---|---|---|---|---|---|---|---|---|---|
| без симптомов | с симптомами | растений всего | из них | ||||||
| Л | С | Г | устойчивых | сверхчувствительных | восприимчивых | ||||
| S. chacoense | |||||||||
| 2732 | 20 | 5 | 4 | 9 | 2 | 9 | 1 | 4 | 4 |
| 2861 | 20 | 0 | 4 | 16 | 0 | 12 | 1 | 6 | 5 |
| 3060 | 19 | 3 | 5 | 10 | 1 | 8 | 1 | 2 | 5 |
| 7394 | 21 | 0 | 10 | 9 | 2 | 14 | 0 | 2 | 12 |
| 19 769 | 20 | 10 | 4 | 6 | 0 | 17 | 8 | 2 | 7 |
| 21 848 | 13 | 0 | 6 | 6 | 1 | 5 | 0 | 2 | 3 |
| 21 849 | 19 | 0 | 7 | 12 | 0 | 10 | 0 | 0 | 10 |
| 21 854 | 19 | 5 | 3 | 9 | 2 | 8 | 1 | 1 | 6 |
| 22 638 | 16 | 1 | 10 | 5 | 0 | 8 | 0 | 2 | 6 |
| S. pinnatisectum | |||||||||
| 4455 | 30 | 22 | 5 | 0 | 3 | 3 | 3 | 0 | 0 |
| 4459 | 30 | 26 | 4 | 0 | 0 | 10 | 9 | 0 | 1 |
| 15 254 | 25 | 9 | 2 | 0 | 14 | 4 | 0 | 0 | 4 |
| 19 157 | 30 | 13 | 3 | 0 | 14 | 6 | 4 | 0 | 2 |
| 21 955 | 30 | 27 | 0 | 0 | 3 | 14 | 14 | 0 | 0 |
| 23 569 | 25 | 7 | 7 | 0 | 11 | 6 | 4 | 0 | 2 |
В результате распространения некрозов погибли лишь некоторые растения образцов S. chacoense кк‑2732, 3060, 7394, 21 848 и 21 854, тогда как заражение растений S. pinnatisectum вызвало массовую гибель в семьях образцов кк-15 254, 19 157 и 23 569 (табл. 1). Отсутствие внешних симптомов заболевания было характерно для большинства растений в семьях образцов S. pinnatisectum кк-4455, 4459 и 21 955, тогда как среди растений S. chacoense только в семье к-19 769 половина растений не имела внешних симптомов вирусного заражения, в остальных – растений без симптомов поражения было значительно меньше или совсем не наблюдали. У большинства растений S. chacoense образца к‑22 638 отмечена локальная реакция на заражение, в семьях образцов к-2861 и к-21 849 у значительной части растений наблюдалось проявление системной реакции. Среди исследованных образцов S. chacoense наибольшее разнообразие реакций на заражение YBK характерно для семей кк-2732, 3060 и 21 854, в каждой из которых выявлены растения визуально здоровые, с локальной или системной реакцией, мозаичностью или быстрой некротизацией, приводящей к гибели растений.
Данные иммуноферментного анализа подтверждают различия в резистентности S. chacoense и S. pinnatisectum к YВК. В изученной выборке растений двух дикорастущих родичей по результатам двухлетних испытаний 91 генотипа S. chacoense выявлено 12 устойчивых, 21 сверхчувствительных и 58 восприимчивых к YBK, среди 43 генотипов S. pinnatisectum – 34 устойчивых и 9 восприимчивых. Среди растений S. chacoense, без симптомов или с некротической реакцией на заражение вирусом, установлено наличие YВК в соке 27–100% проверенных генотипов в зависимости от образца. Сверхчувствительные генотипы S. chacoense выявлены в семьях образцов кк-2732, 2861, 3060, 19769 и 21854 (табл. 1). Диагностика методом ИФА растений S. pinnatisectum, без симптомов вирусного поражения, установила отрицательную реакцию всех растений образца к-21 955 и положительную (наличие YВК) в соке 7–73% проверенных генотипов остальных образцов. Сверхустойчивые к YВК генотипы S. pinnatisectum выявлены в семьях образцов кк-4455, 4459, 19 157, 21 955 и 23 569. У некоторых генотипов образца к‑15254 S. pinnatisectum и образца к-21 854 S. chacoense не отмечены симптомы вирусного поражения, но обнаружена положительная реакция ИФА на YВК, что свидетельствует об их толерантности к вирусу.
Анализ полиморфизма ДНК-маркеров, сцепленных с генами устойчивости
Анализ с использованием ДНК-маркеров был проведен для 170 генотипов S. chacoense и 44 генотипов S. pinnatisectum. В дополнение к исследуемой выборке S. chacoense обследованы на наличие ДНК-маркеров два клона – 3-41-6 и 3-42-2 образца к-19759 S. chacoense, выделенных ранее в коллекции ВИР и использованных как источники устойчивости к YВК при создании межвидовых гибридов – доноров селекционно-ценных признаков картофеля. Проанализирован полиморфизм трех ДНК-маркеров, сцепленных с устойчивостью к вирусам у картофеля и томата и локализованных в коротком сегменте на хромосоме 9 [6]. В их числе: CAPS-маркер S1d11, сцепленный с геном сверхчувствительности Ny-1 [18], STS-маркер Ry186, сцепленный с генами Rychc, Ny-Smira [16, 17], и RFLP-маркер CT220, который у видов семейства пасленовые (Solanaceae Juss) сцеплен с локусами генов Nxphu и Sw-5, контролирующих устойчивость к XBK и TSWV [19, 20]. В нашем исследовании впервые растения двух дикорастущих клубнеобразующих видов Solanum L. обследованы на наличие маркера гена GBSSI (гена гранул-связанной крахмалсинтазы), который рекомендован как положительный контроль при постановке ПЦР для определения маркера Ry186 [15].
Для детекции полиморфизма CAPS-маркера S1d11 у сортов картофеля ранее использовалась рестриктаза MnlI. У дикорастущих видов картофеля полиморфные сайты могли различаться, поэтому перед массовым скринингом выборки мы провели секвенирование ПЦР-продукта S1d11 у шести образцов S. chacoense, контрастных по устойчивости к YBK. В результате в амплифицированной последовательности 386 пн были выявлены два полиморфных сайта, служивших мишенями для эндонуклеазы рестрикции AcsI. Полученный CAPS-маркер S1d11/AcsI разделил выборку из 95 генотипов Solanum spp. на две группы, различающиеся по профилю рестрикции (+) и (–) (рис. 1). Генотипы, имеющие в профиле рестрикции фрагмент размером ~256 пн (+), показывали достоверную корреляцию с устойчивостью. Генотипы, не имеющие этого фрагмента в профиле рестрикции (–), показали восприимчивость к YBK. Ассоциация выявленных групп с устойчивостью к YBK при искусственном заражении оказалась статистически достоверной (табл. 2).
Рис. 1.
Профили рестрикции, выявленные с помощью CAPS-маркера S1d11/AcsI, среди образцов картофеля, показавших устойчивость (+) и восприимчивость (–) к YBK. M – маркер длин фрагментов ДНК.
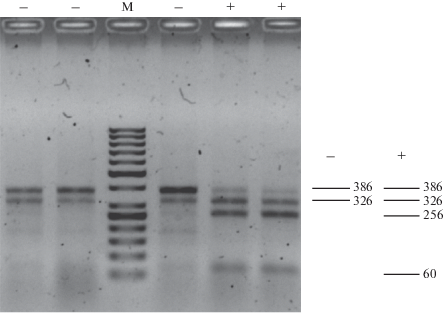
Таблица 2.
Число генотипов S. chacoense и S. pinnatisectum с идентифицированными ДНК-маркерами в разных фенотипических классах
| ДНК-маркер | Фенотип | Критерий χ2 Пирсона* (p-уровень) | |
|---|---|---|---|
| устойчивый | восприимчивый | ||
| S. chacoense | |||
| CT220 (+) | 10 | 40 | 3.98 (0.05) |
| (–) | 4 | 2 | |
| Ry186 (+) | 0 | 1 | 0.28 (0.60) |
| (–) | 14 | 37 (4 н.д.) | |
| S1d11/AcsI (+) | 12 | 3 | 29.17 (0.00) |
| (–) | 2 | 39 | |
| S. pinnatisectum | |||
| CT220 (+) | 28 | 8 | 0.49 (0.48) |
| (–) | 1 | 0 | |
| Ry186 (+) | 0 | 0 | н.д. |
| (–) | 29 | 8 | |
| S1d11/AcsI (+) | 29 | 0 | 31.33 (0.00) |
| (–) | 0 | 8 | |
Маркер СТ220 был амплифицирован у большинства генотипов S. chacoense и S. pinnatisectum (85 и 98% соответственно), не показав ассоциации с исследованным фенотипом. Секвенирование ПЦР-продукта CT220 у восьми образцов, контрастных по устойчивости, и анализ полученных последовательностей не выявили нуклеотидного полиморфизма у генотипов S. chacoense и S. pinnatisectum, который можно было использовать как мишень для эндонуклеаз.
Маркер Ry186 был амплифицирован у сортов Башкирский и Белоснежка, у семи генотипов S. chacoense (шесть в семье к-7394 и один – в семье к-2732) и не обнаружен у S. pinnatisectum. При этом маркерный фрагмент GBSS, использованный как позитивный контроль ПЦР, выявлен у большинства генотипов S. chacoense (75%) и S. pinnatisectum (85%), в том числе у 11 из 14 генотипов S. chacoense, устойчивых к YBK, но не имеющих маркера Ry186. По способности формировать клубни между генотипами, которые обладают и не обладают маркером GBSS, значимых различий не выявлено.
Ассоциации маркеров CT220 и Ry186 с устойчивостью растений двух видов Solanum L. к YВК не установлено (табл. 2).
ОБСУЖДЕНИЕ
Впервые представительные популяции двух дикорастущих клубнеобразующих видов Solanum L. охарактеризованы по резистентности к YBK и наличию ДНК-маркеров, картированных в локусе хромосомы 9. Установлены различия в разделении двух дикорастущих видов картофеля на фенотипические классы при заражении YBK. Разнообразие видимых реакций растений S. chacoense отличает представителей этого вида от растений S. pinnatisectum с однотипной симптоматикой при инфицировании YBK.
Вид S. chacoense относится к серии Yungasensа Corr., S. pinnatisectum – к серии Pinnatisecta (Rudb.) Hawkes, между их представителями явно выражены морфологические отличия наземных органов; ареалы серий находятся в разных эколого-географических регионах. Вид S. chacoense произрастает в Южной Америке, на территории нескольких стран – Аргентины, Боливии, Бразилии, Парагвая, Перу и Уругвая. Ареал S. pinnatisectum находится на территории другого континента – в Мексике. Виды имеют разные EBN (endosperm balance number – показатель балансового числа эндосперма) и по результатам молекулярного генотипирования относятся к разным кладам [2], т.е. являются эволюционно отдаленными дикими клубненосными родичами Solanum L. Обнаруженные нами различия в реакции на заражение YBK отражают несходство генетической природы двух Solanum spp.
ДНК-анализ с использованием трех маркеров, сцепленных с генами устойчивости сортового картофеля к YBK, клубнеобразующего вида S. phureja к XBK и томата к TSWV, обнаруживает согласованность в распределении каждого ДНК-маркера у исследованных генотипов двух клубнеобразующих дикорастущих видов Solanum L. Маркер СТ220 амплифицируется у подавляющего большинства генотипов S. chacoense и S. pinnatisectum, хотя полиморфизма в амплифицированной последовательности ДНК обнаружить не удалось. Этот маркер описан как сцепленный с генным кластером Sw-5, который первоначально был идентифицирован как доминантный локус гена, контролирующего устойчивость томата сорта Stevens (созданного на основе дикого вида Solanum peruvianum Mill.) к тосповирусу TSWV. Позднее у томата с кластером Sw-5 обнаружена устойчивость к широкому кругу тосповирусов. В составе кластера найдены пять паралогов, кодирующих белки с доменами NB и LRR, и идентифицирован иммунный рецептор против TSWV [24]. Выявление в нашем исследовании ДНК-последовательности, соответствующей маркеру СТ220 у генотипов филогенетически удаленных Solanum spp., указывает на ее консервативность у рода Solanum L.
Маркер Ry186, сцепленный с геном Rychc у сортов картофеля японской селекции, резистентность которых к YBK обеспечила интрогрессия генетического материала S. chacoense, редко встречается у образцов этого вида. Маркер Ry186 не найден у другого исследованного нами клубнеобразующего вида – S. pinnatisectum. Обнаружение маркера Ry186 у отечественных сортов картофеля [10] необходимо дополнить результатами анализа их сегрегирующего потомства для подтверждения его диагностической ценности. Полученные в нашем исследовании формы S. chacoense с контрастной реакцией на инфицирование YBK являются основой для дальнейшего изучения, картирования и идентификации R-генов.
Сопряженный молекулярный и фитопатологический скрининг обширной выборки S. chacoense и S. pinnatisectum позволил разработать CAPS-маркер S1d11/AcsI, надежно различающий генотипы двух родственных клубнеобразующих видов по резистентности к YBK. Валидация маркера S1d11/AcsI на генетически разнообразном материале – источниках устойчивости к YBK в коллекции ВИР позволит уточнить его универсальность и возможность использования в практической селекции.
При массовом скрининге двух дикорастущих клубнеобразующих видов Solanum L. маркер гена GBSSI (гена гранул-связанной крахмалсинтазы) у значительной части (15–25%) генотипов Solanum spp. не обнаружен. Невыявление у растений S. chacoense и S. pinnatisectum ДНК-маркера одного из генов, ассоциированных с метаболизмом крахмала, представляет определенный интерес, хотя нельзя полностью исключить и вероятность неудачной ПЦР. Ген GBSSI (гранул-связанной крахмалсинтазы), контролирующий биосинтез амилозы в формирующихся крахмальных гранулах, выявлен и охарактеризован во многих сортах картофеля, его инактивация позволяет получить картофель, клубни которого содержат преимущественно амилопектин [25]. В настоящем эксперименте не отмечено достоверных различий в клубнеобразовании между генотипами с GBSS-маркером и без маркера у обоих диких видов. Полученные нами результаты по детекции GBSS-маркера могут быть объяснены наличием аллельного варианта гена GBSSI у дикорастущих диплоидных видов S. chacoense и S. pinnatisectum.
Авторы выражают благодарность Е.Н. Юркиной за сохранение клоновых растений S. chacoense и S. pinnatisectum.
Работа поддержана грантом РФФИ (№ 18-016-00138) “Молекулярно-генетический анализ локусов, ассоциированных с устойчивостью видов и гибридов секции Petota рода Solanum L. к фитофторозу и Y вирусу картофеля”.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Vincent H., Wiersema J., Kell S. et al. A prioritized crop wild relative inventory to help underpin global food security // Biol. Conservation, 2013. V. 167. P. 265–275. https://doi.org/10.1016/j.biocon.2013.08.011
Spooner D., Ghislain M., Simon R. et al. Systematics, diversity, genetics, and evolution of wild and cultivated potatoes // Bot. Rev. 2014. V. 80. P. 283–383. https://doi.org/10.1007/s12229-014-9146-y
Ross H. Potato breeding – Problems and perspectives // Advances in Plant Breeding. Suppl. 13 to J. Plant Breeding. Berlin; Hamburg: Publ. Paul Parey, 1986. 132 p.
Tsedaley B. A review paper on Potato Virus Y (PVY) biology, economic importance and its managements // J. Biol., Agriculture and Healthcare. 2015. V. 5. № 9. P. 110–126.
Sokolova E., Pankin A., Beketova M. et al. SCAR markers of the R-genes and germplasm of wild Solanum species for breeding late blight-resistant potato cultivars // Plant Genet. Resources. 2011. V. 9. № 2. P. 309–312. https://doi.org/10.1017/ S1479262111000347
Valkonen J.P.T., Gebhardt C., Zimnoch-Guzowska E., Watanabe K. Resistance to Potato virus Y in potato // Potato Virus Y: Biodiversity, Pathogenicity, Epidemiology and Management. Springer, 2017. P. 207–241. https://doi.org/10.1007/978-3-319-58860-5_8
Moury B., Caromel B., Johansen E. et al. The helper component proteinase cistron of potato virus Y induces hypersensitivity and resistance in potato genotypes carrying dominant resistance genes on chromosome IV // MPMI. 2011. V. 24. № 7. P. 787–797. https://doi.org/10.1094/MPMI-10-10-0246
Fulladolsa A., Navarro F., Kota R. et al. Application of marker assisted selection for Potato virus Y resistance in the University of Wisconsin Potato Breeding Program // Am. J. Potato Res. 2015. V. 92. P. 444–450. https://doi.org/10.1007/s12230-015-9431-2
Nie X., Lalany F., Dickison V. et al. Detection of molecular markers linked to Ry genes in potato germplasm for marker-assisted selection for extreme resistance to PVY in AAFC’s potato breeding program // Can. J. Plant Sci. 2016. V. 96. P. 737–742.https://doi.org/10.1139/cjps-2015-0335
Бирюкова В.А., Шмыгля И.В., Абросимова С.Б. и др. Поиск источников генов устойчивости к патогенам среди образцов селекционно-генетических коллекций ВНИИКХ с использованием молекулярных маркеров // Защита картофеля. 2015. № 1. С. 3–7.
Гавриленко Т.А., Клименко Н.С., Антонова О.Ю. и др. Молекулярный скрининг сортов и гибридов картофеля северо-западной зоны Российской Федерации // Вавиловский журн. генетики и селекции. 2018. Т. 22. № 1. С. 35–45. https://doi.org/10.18699/VJ18.329
Рогозина Е.В., Терентьева Е.В., Потокина Е.К. и др. Идентификация родительских форм для селекции картофеля, устойчивого к болезням и вредителям, методом мультиплексного ПЦР-анализа // С.-х. биология. 2019. Т. 54. № 1. С. 19–30. https://doi.org/10.15389/agrobiology.2019.1.19rus
Clark M., Adams A. Characteristics of the microplate methods of enzyme-linked immunosorbent assay for the detection of plant viruses // J. Gen. Virol. 1977. V. 34. P. 475–483.
Doyle J.J., Doyle J.L. Isolation ofplant DNA from fresh tissue // Focus. 1990. V. 12. № 13. P. 39–40.
Mori K., Sakamoto Yu., Mukojima N. et al. Development of a multiplex PCR method for simultaneous detection of diagnostic DNA markers of five disease and pest resistance genes in potato // Euphytica. 2011. V. 180. № 3. P. 347–355.https://doi.org/10.1007/s10681-011-0381-6
Sato M., Nishikawa K., Komura K., Hosaka K. Potato virus Y resistance gene, Ry chc, mapped to the distal end of potato chromosome 9 // Euphytica. 2006. V. 149. № 3. P. 367–372. https://doi.org/10.1007/s10681-006-9090-y
Tomczynska I., Jupe F., Hein I. et al. Hypersensitive response to Potato virus Y in potato cultivar Sarpo Mira is conferred by the Ny-Smira gene located on the long arm of chromosome IX // Mol. Breeding. 2014. V. 34. № 2. P. 471–480. https://doi.org/10.1007/s11032-014-0050-2
Szajko K., Strzelczyk-Żyta D., Marczewski W. Ny-1 and Ny-2 genes conferring hypersensitive response to potato virus Y (PVY) in cultivated potatoes: mapping and marker-assisted selection validation for PVY resistance in potato breeding // Mol. Breeding. 2014. V. 34. № 1. P. 267–271. https://doi.org/10.1007/s11032-014-0024-4
Tommiska T., Hämäläinen J., Watanabe K., Valkonen J. Mapping of the gene Nxphu that controls hypersensitive resistance to potato virus X in Solanum phureja IvP35 // Theor. and Applied Genet. 1998. V. 96. № 6–7. P. 840–843
Brommonschenkel S.H., Tanksley S.D. Map-based cloning of the tomato genomic region that spans the Sw-5 tospovirus resistance gene in tomato // Mol. Gen. Genet. 1997. V. 256. P. 121–126.
van der Voort J.R., van der Vossen E., Bakker E. et al. Two additive QTLs conferring broad-spectrum resistance in potato to Globodera pallida are localized on resistance gene clusters // Theor. and Applied Genet. 2000. V. 101. № 7. P. 1122–1130. https://doi.org/10.1007/s001220051588
https://www.beckmancoulter.com/wsrportal/techdocs? docname=B37419
http://tools.thermofisher.com/content/sfs/manuals/ cms_081527.pdf
de Oliveira A.S., Boiteux L.S., Kormelink R., Resende R.O. The Sw-5 gene cluster: tomato breeding and research toward orthotospovirus disease control // Front. Plant Sci. 2018. V. 9. P. 1055. https://doi.org/10.3389/fpls.2018.01055
Слугина М.А., Кочиева Е.З. Использование генов углеводного обмена для улучшения качества клубней картофеля (Solanum tuberosum L.) обзор // С.-х. биология. 2018. Т. 53. № 3. С. 450–463. https://doi.org/10.15389/agrobiology.2018.3.450rus
Дополнительные материалы отсутствуют.


