Генетика, 2019, T. 55, № 12, стр. 1476-1480
Характер наследования катаболических плазмид группы несовместимости P-9 в бактериях рода Pseudomonas
Т. З. Есикова 1, Т. О. Анохина 1, Л. И. Ахметов 1, *, И. А. Кошелева 1, А. М. Боронин 1
1 Федеральный исследовательский центр “Пущинский научный центр биологических исследований РАН”,
Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина
Российской академии наук
142290 Московская обл., Пущино, Россия
* E-mail: lenarakhmetov@yandex.ru
Поступила в редакцию 04.02.2019
После доработки 02.04.2019
Принята к публикации 11.04.2019
Аннотация
Изучена способность плазмид биодеградации ε-капролактама (CАР плазмид), относящихся к P-2, P-7 и P-9 группам несовместимости, и плазмид биодеградации нафталина (NAH плазмид) IncP-9 к конъюгационному переносу в различные виды бактерий рода Pseudomonas, в том числе в PGPR штаммы (Plant Growth-Promoting Rhizobacteria), и характер наследования плазмид в этих штаммах. Показано, что частота конъюгационного переноса всех САР и NAH плазмид (независимо от принадлежности к группе несовместимости) в PGPR Pseudomonas была ниже частоты их переноса в почвенные штаммы P. putida в среднем на один порядок. При этом выявлено, что выделение антибиотически активных метаболитов штаммами PGPR Pseudomonas не является причиной низкой частоты конъюгационного переноса плазмид биодеградации в них. Обнаружено, что стабильность наследования катаболических плазмид в неселективных условиях зависит от их принадлежности к той или иной группе несовместимости, а также от штамма бактерии-хозяина. Так, все исследуемые CAP и NAH плазмиды стабильно поддерживались в штаммах почвенных псевдомонад P. putida KT2442 и BS394 в течение 100 генераций. Однако в клетках PGPR Pseudomonas стабильно поддерживались только САР плазмиды Р-2 и P-7 групп несовместимости. САР и NAH плазмиды, относящиеся к различным подгруппам IncP-9, полностью элиминировались из клеток ризосферных псевдомонад. Таким образом, в настоящей работе впервые выявлены особенности наследования катаболических плазмид IncP-9 в клетках PGPR Pseudomonas.
Одним из перспективных подходов для очистки загрязненных почв является фиторемедиация – совместное применение растений и ассоциированных с ними микроорганизмов. Известно, что некоторые представители ризосферных бактерий рода Pseudomonas способны улучшать рост растений за счет синтеза фитогормонов и защиты растений от фитопатогенов [1]. Такие полезные для растений бактерии объединяют в специфическую группу, которую принято называть PGPR Pseudomonas (Plant Growth-Promoting Rhizobacteria). Использование в фиторемедиационных технологиях полифункциональных штаммов, обладающих комплексом полезных признаков, в частности фитостимулирующими свойствами и способностью к биодеградации органических поллютантов, представляется весьма перспективным [2].
Бактерии рода Pseudomonas представляют собой большую таксономическую группу видов, проявляющих огромное метаболическое, физиологическое и генетическое разнообразие [3]. Среди свободноживущих почвенных псевдомонад наиболее часто выделяются P. putida, тогда как в ризосфере растений чаще всего представлены другие виды псевдомонад: P. fluorescens, P. chlororaphis и P. protegens. Бактерии P. aeruginosa встречаются в клинических материалах, почве и водоемах.
Способность к биодеградации у бактерий рода Pseudomonas часто кодируется внехромосомными генетическими элементами – плазмидами биодеградации (D-плазмиды), которые путем конъюгационного переноса обеспечивают распространение катаболических генов в микробных сообществах и их адаптацию к изменяющимся условиям окружающей среды [4]. В системе классификации плазмид псевдомонад насчитывается 14 групп несовместимости (Inc) [5]. Принадлежность плазмиды к той или иной группе несовместимости определяет круг ее бактериальных хозяев, способность к стабильному существованию в клетке хозяина, а, следовательно, судьбу генов биодеградации в бактериальных популяциях. Часто способность к утилизации ксенобиотиков и компонентов нефти (капролактам, полициклические ароматические углеводороды, н-алканы и др.) контролируется плазмидами групп несовместимости P-2, P-7 и P-9 [6]. Наши многолетние исследования показали, что наиболее распространенными в загрязненных почвах являются штаммы-деструкторы, содержащие плазмиды IncP-9. Несмотря на достаточно широкий круг бактериальных хозяев, катаболические плазмиды Р-9 группы несовместимости выделяются преимущественно из штаммов P. putida, тогда как IncP-7 плазмиды (узкий круг хозяев) обнаруживаются в штаммах P. fluorescens [7]. Для использования плазмидосодержащих штаммов-деструкторов в фиторемедиационных технологиях целесообразно изучать перенос катаболических плазмид и стабильность их наследования в PGPR Pseudomonas, а также условия, способствующие распространению плазмид биодеградации в бактериальных популяциях.
Цель настоящей работы – изучение способности катаболических плазмид IncP-9 (на примере плазмид биодеградации ε-капролактама и нафталина) к конъюгационному переносу в штаммы PGPR Pseudomonas и характера их наследования в этих штаммах.
В работе были использованы две группы штаммов:
1) варианты штамма P. putida BS394 (Cys–SmRRifR), содержащие различные САР и NAH плазмиды, полученные ранее [8, 9]. В экспериментальной работе эти штаммы были использованы в качестве доноров плазмид;
2) реципиентами служили ризосферные штаммы PGPR Pseudomonas, являющиеся антагонистами фитопатогенных грибов и бактерий – P. chlororaphis PCL1391 [10], P. fluorescens 2-79 [11], P. chlororaphis BS1393 (ВKM В-2188D), P. chlororaphis OV17 (ВKM В-2391D), P. protegens 38a (ВKM B-3228D), а также штамм P. putida KT2442 (gfpKmRRifR), выделенный из почвы [12], и P. aeruginosa ML4262 (Ile–Val–Met–His–Lys–), изолированный из клинических материалов [13]. Бактерии культивировали на полноценной среде LB и минеральной среде М9 при температуре 28°С. Источники углерода (глюкоза, капролактам) добавляли в концентрации 0.1% (вес/объем), нафталин наносили на перевернутую крышку чашки Петри. Аминокислоты для ауксотрофных штаммов вносили в минеральную среду в концентрации 20 мкг/мл, антибиотики (стрептомицин, канамицин и рифампицин) – в конечной концентрации 100 мкг/мл.
В работе были исследованы плазмиды биодеградации нафталина pBS216 и NAH7, детерминирующие окисление этого соединения до метаболитов цикла Кребса и относящиеся к IncP-9, а также плазмиды биодеградации капролактамa pBS262 (IncP-2), pBS270 (IncP-7) и pBS267, pBS268 и pBS265 (все относятся к IncP-9). САР плазмиды детерминируют разложение синтетического соединения ε-капролактама, которое используется для производства нейлона-6, и широко распространены в местах, загрязненных отходами соответствующих химических предприятий [14]. Конъюгационный перенос плазмид осуществляли методом Дана и Гонзалеса [15], частоту переноса определяли отношением числа полученных трансконъюгантов к общему числу клеток донора. Стабильность наследования плазмид проверяли путем последовательных пересевов бактериальной культуры, достигшей стационарной фазы роста в неселективных условиях (LB-бульон) в течение 10 сут (100 генераций), с последующим высевом на полноценную питательную среду и проверкой у колоний сохранности плазмидных маркеров.
Антагонистическую активность штаммов PGPR Pseudomonas по отношению к P. putida BS394 оценивали капельно-диффузным методом.
Исходя из поставленной цели, в различные штаммы псевдомонад, в том числе почвенные (P. putida), ризосферные (P. chlororaphis, P. fluorescens, P. protegens) и клинический изолят P. aeruginosa ML4262, при помощи конъюгационного переноса были переданы САР плазмиды, относящиеся к различным группам несовместимости: P-2 (pBS262), P-7 (pBS270) и P-9 (pBS267, pBS268, pBS265) (табл. 1). Следует отметить, что частота конъюгационного переноса всех САР плазмид в ризосферные штаммы и в P. aeruginosa была ниже частоты их переноса в штаммы P. putida в среднем на один порядок и составляла около 10–7–10–8. Было обнаружено также, что стабильность наследования CAP плазмид при культивировании бактерий в неселективных условиях зависит от их принадлежности к той или иной группе несовместимости, а также от штамма бактерии-хозяина. Так, все исследуемые CAP плазмиды стабильно поддерживались в штаммах P. aeruginosa ML4262, P. putida KT2442 и BS394 в течение 100 генераций. Однако в клетках ризосферных псевдомонад стабильно поддерживались только плазмиды pBS262 и pBS270, принадлежащие к Р-2 и P-7 группам несовместимости соответственно (табл. 1). Плазмиды pBS265, pBS267, pBS268 (все относятся к IncP-9, но выделены из разных географических районов и/или различаются по размерам) полностью элиминировались из ризосферных псевдомонад. Полученные результаты свидетельствуют о том, что САР плазмиды группы несовместимости Р-9, в отличие от плазмид других групп, элиминируются из клеток ризосферных псевдомонад в отсутствие селективного давления.
Таблица 1.
Стабильность наследования САР плазмид в различных штаммах Pseudomonas
| Реципиентный штамм | pBS262 IncP-2 450 тпн |
pBS270 IncP-7 100 тпн |
pBS267 IncP-9 140 тпн |
pBS268 IncP-9 100 тпн |
pBS265 IncP-9 140 тпн |
|---|---|---|---|---|---|
| Р. aeruginosa ML4262 | 100* | 100 | 100 | 100 | 100 |
| P. putida KT2442 | 100 | 100 | 100 | 100 | 100 |
| P. putida BS394** | 100 | 100 | 100 | 100 | 100 |
| PGPR Pseudomonas | |||||
| P. chlororaphis BS1393 | 95.7 ± 1.5 | 100 | 1.7 ± 0.6 | 0 | 0 |
| P. chlororaphis OV17 | 57.3 ± 0.6 | 89.7 ± 5.0 | 0 | 0 | 0 |
| P. protegens 38a | 75.0 ± 2.0 | 97.7 ± 2.5 | 9.7 ± 2.1 | 0 | 12.0 ± 3.0 |
| P. fluorescens 2-79 | 88.7 ± 1.5 | 98.3 ± 2.1 | 0 | 0 | 1.3 ± 0.6 |
| P. chlororaphis PCL1391 | 93.3 ± 3.5 | 100 | 0 | 0 | 6.0 ± 1.0 |
Примечание. * Данные приведены в % после культивирования штаммов в неселективных условиях в течение 100 генераций. ** Донорами плазмид служили природные штаммы-деструкторы капролактама P. putida. Во всех остальных скрещиваниях донорами плазмид служили варианты ауксотрофного штамма P. putida BS394, содержащие указанные САР плазмиды.
Известно, что плазмиды IncР-9 характеризуются полиморфностью генетических детерминант, обеспечивающих инициацию репликации [5]. На основании сиквенс-анализа выделено восемь подгрупп плазмид, различающихся по составу нуклеотидных последовательностей rep-гена и oriV-сайта, при этом САР плазмиды формируют отдельную подгруппу (γ-подгруппа) в молекулярной классификации плазмид IncР-9. Поскольку rep-область служит основной функциональной единицей, определяющей поддержание внехромосомного элемента в бактериальной популяции, представлялось интересным выяснить характер наследования плазмид других подгрупп IncP-9 в клетках почвенных и ризосферных псевдомонад. Для этого был осуществлен перенос имеющихся в нашем распоряжении плазмид биодеградации нафталина pBS216 (δ-подгруппа) и NAH7 (ζ-подгруппа) в соответствующие реципиентные штаммы. Важно отметить, что исследуемые NAH плазмиды формируют отдельные, отличные от САР плазмид, ветви на филогенетическом дереве плазмид IncP-9 [5].
Донорами плазмид биодеградации нафталина в скрещиваниях служили штаммы P. putida BS394 (pBS216) и BS394 (NAH7), полученные нами ранее. Как и в случае САР плазмид, перенос pBS216 и NAH7 в штамм P. putida KT2442 происходил с более высокой частотой (10–6–10–7 на клетку донора), чем в штаммы PGPR Pseudomonas (10–8–10–9). В ходе настоящей работы не удалось перенести исследуемые плазмиды биодеградации нафталина в P. aeruginosa ML4262.
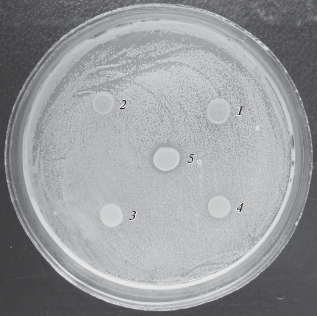
Как было сказано выше, штаммы PGPR Pseudomonas могут продуцировать антибиотически активные метаболиты, подавляющие рост различных микроорганизмов, что могло снижать численность клеток донорных штаммов при конъюгационном переносе и, следовательно, влиять на частоту переноса плазмид в ризосферные штаммы. В связи с этим была изучена антагонистическая активность PGPR Pseudomonas по отношению к P. putida BS394. Эксперименты показали, что штаммы P. chlororaphis BS1393, OV17, PCL1391, P. protegens 38а не подавляли рост P. putida BS394 (рис. 1). При этом штаммы P. chlororaphis BS1393 и OV17 сохраняли характерную оранжевую пигментацию, что свидетельствовало о продукции ими гидроксипроизводных феназин-1-карбоновой кислоты. Из тестированных ризосферных штаммов только P. fluorescens 2-79 проявлял антагонистическую активность по отношению к P. putida BS394, тем не менее конъюгационный перенос исследуемых плазмид из P. putida BS394 в штамм P. fluorescens 2-79 происходил с той же частотой, что и в другие ризосферные пседомонады. По-видимому, выделение антибиотически активных метаболитов штаммами PGPR Pseudomonas не является причиной низкой частоты конъюгационного переноса плазмид биодеградации в них, а обусловлено другими факторами.
Рис. 1.
Влияние ризосферных штаммов на рост P. putida BS394. 1 – P. chlororaphis BS1393, 2 – P. chlororaphis OV17, 3 – P. chlororaphis PCL1391, 4 – P. protegens 38а, 5 – P. fluorescens 2-79 (в центре).
Сравнительный анализ стабильности NAH плазмид в бактериях Pseudomonas выявил ту же закономерность, что и для САР плазмид (табл. 2). Плазмиды pBS216 и NAH7 стабильно наследовались в клетках P. putida KT2442 и P. putida BS394 и с высокой частотой элиминировались из ризосферных штаммов P. chlororaphis PCL1391, BS1393, OV17, P. fluorescens 2-79 и P. protegens 38a. В большинстве случаев плазмиды не обнаруживались в клетках реципиентов уже после 20–30 генераций. Исключение составлял штамм P. chlororaphis PCL1391 (pBS216), в котором около 60% популяции сохранили плазмиду после 100 генераций.
Таблица 2.
Стабильность наследования NAH плазмид в различных штаммах Pseudomonas
| Реципиентный штамм | pBS216 IncP-9 δ-подгруппа |
NAH7 IncP-9 ζ-подгруппа |
||
|---|---|---|---|---|
| 30 генераций | 100 генераций | 30 генераций | 100 генераций | |
| P. putida KT2442 | 100* | 100 | 100 | 98.3 ± 1.5 |
| P. putida BS394** | 100 | 100 | 100 | 100 |
| PGPR Pseudomonas | ||||
| P. chlororaphis BS1393 | 29.3 ± 2.5 | 0 | 0 | 0 |
| P. chlororaphis OV17 | 0 | 0 | 0 | 0 |
| P. protegens 38a | 100 | 1.7 ± 0.6 | 0 | 0 |
| P. fluorescens 2-79 | 0 | 0 | 0 | 0 |
| P. chlororaphis PCL1391 | 80.7 ± 3.5 | 60.0 ± 2.6 | 0 | 0 |
Примечание. * Данные приведены в % после культивирования штаммов в неселективных условиях в течение 100 генераций. ** Донорами плазмид служили природные штаммы-деструкторы нафталина P. putida. Во всех остальных скрещиваниях донорами плазмид служили варианты ауксотрофного штамма P. putida BS394, содержащие указанные NAH плазмиды.
Таким образом, в ходе настоящего исследования впервые выявлены особенности наследования катаболических плазмид IncP-9 в клетках ризосферных псевдомонад. На примере CAP и NAH плазмид, относящихся к различным подгруппам IncP-9, показана высокая степень их нестабильности в штаммах PGPR Pseudomonas, в отличие от штаммов P. putida, которые, вероятно, являются более подходящими хозяевами для этих плазмид. Обнаруженные различия в характере наследования этой группы внехромосомных элементов в различных штаммах бактерий Pseudomonas, по-видимому, связаны со специфическим влиянием генома клеток-хозяев на репликацию плазмидной ДНК и распределение вновь образующихся молекул между дочерними клетками. Данная работа привносит дополнительные сведения о характере наследования одной из самых разнообразных и биотехнологически значимых групп внехромосомных генетических элементов, а также указывает на необходимость поиска оптимальных бактериальных хозяев плазмид биодеградации ксенобиотиков при создании эффективных штаммов-деструкторов для использования в фиторемедиации.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Gupta G., Parihar S.S., Ahirwar N.K. et al. Plant Growth Promoting Rhizobacteria (PGPR): Current and future prospects for development of sustainable agriculture // J. Microb. Biochem. Technol. 2015. V. 7. P. 96–102. https://doi.org/10.4172/1948-5948.1000188
Siunova T.V., Anokhina T.O., Sizova O.I. et al. Impact of plant growth promoting rhizobacteria Pseudomonas in phytoremediation process // Handbook of Phytoremediation / Ed. Golubev I.A. USA, N.Y.: Nova Sci. Publ. Inc., 2011. P. 551–572.
Timmis K.N. Pseudomonas putida: a cosmopolitan opportunist par excellence // Environ. Microbiol. 2002. V. 4(12). P. 779–781.https://doi.org/10.1046/j.1462-2920.2002.00365.x
Smalla K., Jechalke S., Top E.M. Plasmid detection, characterization and ecology // Microbiol. Spectr. 2015. V. 3(1). PLAS-0038-2014. https://doi.org/10.1128/microbiolspec.PLAS-0038-2014
Sevastsyanovich Y.R., Krasowiak R., Bingle L.E.H. et al. Diversity of IncP-9 plasmids of Pseudomonas // Microbiology. 2008. V. 154. P. 2929–2941. https://doi.org/10.1099/mic.0.2008/017939-0
Boronin A.M., Kosheleva I.A. The role of catabolic plasmids in biodegradation of petroleum hydrocarbons // Current Environmental Issues and Challenges / Ed. Cao Giacomo, Orru Roberto. Springer, 2014. P. 159–168.https://doi.org/10.1007/978-94-017-8777-2-9
Измалкова Т.Ю., Сазонова О.И., Соколов С.Л. и др. Плазмиды биодеградации нафталина и салицилата Р-7 группы несовместимости в штаммах флуоресцирующих псевдомонад // Микробиология. 2005. Т. 74(3). С. 342–348.
Есикова Т.З., Грищенков В.Г., Боронин А.М. Плазмиды биодеградации ε-капролактама // Микробиология. 1990. Т. 59(4). С. 547–552.
Кочетков В.В., Боронин А.М. Сравнительное изучение плазмид, контролирующих биодеградацию нафталина культурой Pseudomonas // Микробиология. 1984. Т. 53(4). С. 639–644.
Chin-A-Woeng T.F.C., Bloemberg G.V., van der Bij A.J. et al. Biocontrol by phenazine-1-carboxamide-producing Pseudomonas chlororaphis PCL1391 of tomato root rot caused by Fusarium oxysporum f. sp. radicis-lycopersici // Mol. Plant Microbe Interact. 1998. V. 1. P. 1069–1077.
Mavrodi D.V., Ksenzenko V.N., Bonsall R.F. et al. A seven-gene locus for synthesis of phenazine-1-carboxylic acid by Pseudomonas fluorescens 2-79 // J. Bacteriol. 1998. V. 180. № 9. P. 2541–2548.
Eberl L., Schulze R., Ammendola A. et al. Use of green fluorescent protein as a marker for ecological studies of activated sludge communities // FEMS Microbiol. Letters. 1997. V. 149. P. 77–83. https://doi.org/10.1111/j.1574-6968.1997.tb10311.x
Sagai H., Hasuda K., Iyobe S. et al. Classification of R plasmids by incompatibility in Pseudomonas aeruginosa // Antimicrob. Agents Chemother. 1976. V. 10. P. 573–578.
Esikova T.Z., Ponamoreva O.N., Baskunov B.P. et al. Transformation of low-molecular linear caprolactam oligomers by caprolactam-degrading bacteria // J. Chem. Technol. Biotechnol. 2012. V. 87. № 3. P. 1284–1290. https://doi.org/10.1134/S0026261710030070
Dunn N.W., Gunsalus I.C. Transmissible plasmids coding early enzymes of naphthalene oxidation in Pseudomonas putida // J. Bacteriol. 1973. V. 114. P. 974–997.
Дополнительные материалы отсутствуют.


