Генетика, 2019, T. 55, № 12, стр. 1487-1490
Выращивание Caenorhabditis elegans на газоне бактерий Escherichia coli, дефектных по синтезу терминальных оксидаз bo' и bd-I, увеличивает продолжительность жизни нематод
О. А. Каткова-Жукоцкая 1, С. Ю. Еремина 1, Р. С. Шакулов 2, А. С. Миронов 1, *
1 Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
2 Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов Национального исследовательского центра “Курчатовский институт”
117545 Москва, Россия
* E-mail: alexmir_98@yahoo.com
Поступила в редакцию 04.03.2019
После доработки 12.04.2019
Принята к публикации 14.04.2019
Аннотация
Исследован эффект мутаций cyoA и cydA E. coli, нарушающих активность терминальных оксидаз bo' и bd-I соответственно, на продолжительность жизни нематод C. elegans. Показано, что средняя продолжительность жизни нематод при выращивании на мутантах cyoA увеличивалась на 15.5%, а на мутантах cydA – на 12.8%. Известно, что мутанты cyoА и cydА характеризуются повышенным уровнем генерации активных форм кислорода. Мы предполагаем, что увеличение продолжительности жизни C. elegans обусловлено умеренным окислительным стрессом, который возникает в организме нематод при культивировании на этих мутантных бактериях.
Нематоды Сaenorhabditis elegans являются одним из главных модельных организмов для изучения механизмов старения. Кишечный тракт нематод содержит микробиоту, состав которой зависит от видов бактерий, служащих источником их питания. С точки зрения исследования взаимодействия между организмом-хозяином и микробиотой, кишечный тракт нематод принципиально не отличается от человеческого и представляет собой первый эшелон защиты от неблагоприятных условий среды, а также играет важную роль в поддержании здоровья и продолжительности жизни [1]. Кроме того кишечный тракт нематод выполняет для других тканей функцию сигнального центра, реагирующего на продукты бактериального метаболизма. Имеющиеся данные позволяют заключить, что эволюция нематод, протекающая в постоянном симбиотическом контакте с бактериями, принципиально сходна с таковой у других эукариот, содержащих микробные сообщества в кишечном тракте [2].
В последнее время появились сообщения о том, что метаболические процессы, протекающие в бактериях, оказывают прямое влияние на продолжительность жизни нематод [3–8]. На протяжении многих лет считалось общепризнанным, что энергетический метаболизм, сопровождающийся формированием активных форм кислорода (АФК), играет ключевую роль в регуляции процесса старения [9]. Однако в последнее время традиционный взгляд на АФК как агентов, ответственных за процесс старения, подвергся ревизии [10, 11], и получены доказательства, что некоторый уровень АФК необходим для нормальной жизнедеятельности, а также увеличивает продолжительность жизни [12–18]. Таким образом, взаимосвязь между продолжительностью жизни и окислительным стрессом противоречива и требует дальнейших исследований.
Целью настоящей работы является изучение влияния мутаций в генах сyoA и cydA, кодирующих цитохромоксидазы bo' и bd-I [19–21] соответственно, на продолжительность жизни нематод C. elegans. Известно, что из-за нарушения процесса аэробного дыхания у этих мутантов наблюдается повышенный уровень генерации АФК [22].
В качестве газона для выращивания нематод использовали бактерий E. coli – производных штамма MG1655 дикого типа. В геном этого штамма с помощью трансдукции фагом Р1 переносили инсерции cyoA::kan и cydA::kan из штаммов коллекции Keio [23]. Трансдукцию проводили по стандартной методике [24].
Культивирование бактериальных штаммов осуществляли на полноценной среде LB (рН 7.0) [24], либо на твердых средах такого же состава с добавлением 2%-ного бакто-агара (фирма “Difco”). Для обеспечения селективного роста клеток использовали канамицин – 40 мкг/мл.
Для экспериментов с нематодами микроорганизмы выращивали в жидкой среде LB c необходимыми добавками при температуре 37°С на качалке n = 220 об/мин в течение 16 ч. Далее засевали по 20 мкл (MG1655) и 40 мкл (мутанты cyoA::kan и cydA::kan) ночной культуры чашки со стандартной нематодной средой (NGM) и выращивали в термостате при температуре 37°С в течение 16 ч. Перед посадкой нематод чашки с питательной подложкой охлаждали до 20°С.
В работе использовались Caenorhabditis elegans N2 Bristol (дикий тип). Культивирование нематод проводили при температуре 20°С. Для экспериментов животных выращивали из отмытых от посторонней микрофлоры яиц на среде NGM с необходимым бактериальным газоном в течение 2-х генераций [25]. Для установления возрастной синхронизации взрослых особей отсаживали на чашки Петри с NGM-средой и соответствующим бактериальным газоном для откладывания яиц. После 3–4 ч инкубации при температуре 20°С взрослых нематод убирали и выращивали личинки из яиц до возраста L4. Затем вручную пересаживали на чашки Петри с NGM-средой и бактериальным газоном. Численность нематод контролировали ежедневно. Количество нематод в опыте было не менее 100 особей на точку. Пересадку нематод осуществляли через день на аналогичные среды в течение всего эксперимента. Животные считались мертвыми, когда они прекращали глоточную перекачку и не реагировали на дотрагивание платиновой проволочкой. За начальную точку t = 0 принимали возраст нематод L4. Продолжительность жизни нематод оценивалась путем определения временного интервала, который соответствует выживаемости 50% популяции (СПЖ – средняя продолжительность жизни). Все эксперименты повторяли три раза. Построение графиков и их обработка методом сигмоидальной аппроксимации экспериментальных данных проводились с использованием программы SciDAVis 0.2.1.
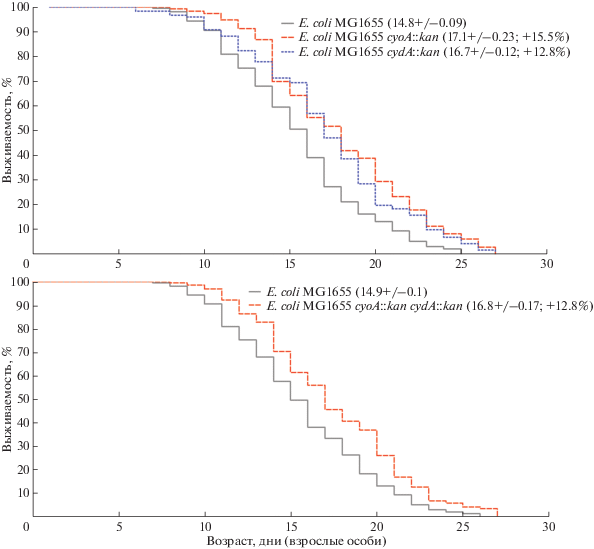
Результаты экспериментов по выращиванию C. elegans на газоне исследуемых штаммов показали, что несмотря на задержку в развитии нематод до стадии L4, СПЖ взрослых червей на мутанте cyoA::kan увеличивалась на 15.5% по сравнению с таковой на контрольном штамме MG1655 дикого типа (рис. 1, верхний график). Культивирование нематод на газоне мутанта cydA::kan также приводило к положительному эффекту на выживаемость червей: по сравнению с контрольным штаммом СПЖ возрастала на 12.8% (рис. 1, верхний график). Комбинация мутаций cyoA::kan и cydA::kan в одном геноме не приводила к дальнейшему повышению СПЖ нематод (рис. 1, нижний график). Отсутствие кумулятивного эффекта мутаций cyoA::kan и cydA::kan на СПЖ нематод, возможно, связано с существенным замедлением роста таких бактерий и, вследствие этого, снижением их способности служить эффективным источником питания для нематод. Мы предполагаем, что увеличение продолжительности жизни нематод, наблюдаемое при их культивировании на газоне бактерий, дефектных по терминальным оксидазам, обусловлено повышенным уровнем генерации АФК в клетках этих мутантов.
Рис. 1.
Графики выживаемости Caenorhabditis elegans N2 при выращивании на газоне штаммов E. coli MG1655 дикого типа и мутантов cyoA::kan и cydA::kan (верхний график) и cyoA::kan cydA::kan (нижний график). В скобках указаны значения СПЖ. Приведенные на рисунке цифровые значения в процентах отражают увеличение средней продолжительности жизни нематод на мутантных бактериях относительно нематод, выращенных на штамме MG1655 дикого типа. Графики выживаемости построены с использованием программы SciDAVis 0.2.1.
Полученные результаты подтверждают данные работы [26], демонстрирующей существенную задержку развития личинок нематод, а также активацию генов нематод, вовлеченных в митохондриальную защиту от окислительного стресса при их культивировании на мутантах cyo E. coli. Однако эффект мутации cyo на продолжительность жизни C. elegans в цитируемой работе не изучался. Таким образом, выявленный нами позитивный эффект культивирования нематод на мутантах E. coli, дефектных по синтезу терминальных оксидаз bo' и bd-I, на продолжительность их жизни может быть интерпретирован в рамках концепции “митохондриального гормезиса”. Согласно этой концепции умеренные дозы АФК приводят к усилению аэробного дыхания, индукции защитных механизмов организма от окислительного стресса и в конечном счете к увеличению продолжительности жизни [27–29].
Работа выполнена при финансовой поддержке Российского научного фонда, грант № 17-74-30030.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Clark L.C., Hodgkin J. Commensals in the C. elegans model // Cell. Microbiol. 2014. V. 16. P. 27–38. https://doi.org/10.1111/cmi.12234
Zhang J., Holdorf A.D., Walhout A.J.M. C. elegans and its bacterial diet as a model for systems-level understanding of host–microbiota interactions // Cur. Opinion in Biotechn. 2017. V. 46. P. 74–80. https://doi.org/10.1016/j.copbio.2017.01.008
Saiki R., Lunceford A.L., Bixler T. et al. Altered bacterial metabolism, not coenzyme Q content, is responsible for the lifespan extension in Caenorhabditis elegans fed an Escherichia coli diet lacking coenzyme Q // Aging Cell. 2008. V. 7. P. 291–304. https://doi.org/10.1111/j.1474-9726.2008.00378.x
Virk B., Correia G., Dixon D.P. et al. Excessive folate synthesis limits lifespan in the C. elegans E. coli aging model // BMC Biol. 2012. V. 10:67. https://doi.org/10.1186/1741-7007-10-67
Cabreiro F., Au C., Leung K.-Y. et al. Metformin retards aging in C. elegans by altering microbial folate and methionine metabolism // Cell. 2013. V. 153. P. 228–239. https://doi.org/10.1016/j.cell.2013.02.035
Gusarov I., Gautier L., Smolentseva O. et al. Bacterial nitric oxide extends the lifespan of C. elegans // Cell. 2013. V. 152. P. 818–830. https://doi.org/10.1016/j.cell.2012.12.043
Han B., Sivaramakrishnan P., Lin C.J. et al. Microbial genetic composition tunes host longevity // Cell. 2018. V. 173. P. 1058. https://doi.org/10.1016/j.cell.2018.04.026
Hoang K.L., Gerardo N.M., Morran L.T. The effects of Bacillus subtilis on Caenorhabditis elegans fitness after heat stress // Ecol. Evol. 2019. V. 9. P. 3491–3499. https://doi.org/10.1002/ece3.4983
Artal-Sanz M., Tavernarakis N. Mechanisms of aging and energy metabolism in Caenorhabditis elegans // IUBMB Life. 2008. V. 60. P. 315–322. https://doi.org/10.1002/iub.66
Back P., Braeckman B.P., Matthijssens F. ROS in aging Caenorhabditis elegans: damage or signaling? // Oxid. Med. Cell Longev. 2012. P. 608478. https://doi.org/10.1155/2012/608478
Scudellari M. The science myths that will not die // Nature. 2015. V. 528. P. 322–325. https://doi.org/10.1038/528322a
Shore D.E., Ruvkun G. A cytoprotective perspective on longevity regulation // Trends Cell Biol. 2013. V. 23. P. 409–420. https://doi.org/10.1016/j.tcb.2013.04.007
Ristow M., Zarse K. How increased oxidative stress promotes longevity and metabolic health: the concept of mitochondrial hormesis (mitohormesis) // Exp. Gerontol. 2010. V. 45. P. 410–418. https://doi.org/10.1016/j.exger.2010.03.014
Lee S.J., Hwang A.B., Kenyon C. Inhibition of respiration extends C. elegans life span via reactive oxygen species that increase HIF-1 activity // Curr. Biol. 2010. V. 20. P. 2131–2136. https://doi.org/10.1016/j.cub.2010.10.057
Schmeisser S., Schmeisser K., Weimer S. et al. Mitochondrial hormesis links low-dose arsenite exposure to lifespan extension // Aging Cell. 2013. V. 12. P. 508–517. https://doi.org/10.1111/acel.12076
Van Raamsdonk J.M., Hekimi S. Superoxide dismutase is dispensable for normal animal lifespan // PNAS USA. 2012. V. 109. P. 5785–5790. https://doi.org/10.1073/pnas.1116158109
Yang W., Hekimi S. A mitochondrial superoxide signal triggers increased longevity in Caenorhabditis elegans // PLoS Biol. 2010. V. 8. P. e1000556. https://doi.org/10.1371/journal.pbio.1000556
Bjelakovic G., Nikolova D., Gluudet L.L. et al. Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysis // JAMA. 2007. V. 297. P. 842–857. https://doi.org/10.1001/jama.297.8.842
García-Horsman J.A., Barquera B., Rumbley J. et al. The superfamily of heme-copper respiratory oxidases // J. Bacteriol. 1994. V. 176. P. 5587–5600. https://doi.org/10.1128/jb.176.18.5587-5600.1994
Cotter P.A., Chepuri V., Gennis R.B., Gunsalus R.P. Cytochromeo (cyoABCDE) and (cydAB) oxidase gene expression in Escherichia coli is regulated by oxygen, pH, and the fnr gene product // J. Bacteriol. 1990. V. 172. P. 6333–6338. https://doi.org/10.1128/jb.172.11.6333-6338.1990
Lindqvist A., Membrillo-Hernandez J., Poole R.K., Cook G.M. Roles of respiratory oxidases in protecting Escherichia coli K12 from oxidative stress // Antonievan Leeuwenhoek 2000. V. 78. P. 23–31. https://doi.org/10.1023/A:1002779201379
Brynildsen M.P., Winkler J.A., Spina C.S. et al. Potentiating antibacterial activity by predictably enhancing endogenous microbial ROS production // Nat. Biotechnol. 2013. V. 31. P. 160–165. https://doi.org/10.1038/nbt.2458
Baba T., Ara T., Hasegawa M. et al. Construction of Escherichia coli K-12 in-frame, single-gene knockout mutants: The Keio collection // Mol. Syst. Biol. 2006. V. 2. P. 2006–2008. https://doi.org/10.1038/msb4100050
Miller J.H. Experiments in Molecular Genetics, Cold Spring Harbor: Cold Spring Harbor Lab., 1972. 311 p.
Stiernagle T. Maintenance of C. elegans // Worm Book: The Online Review of C. elegans Biology, 2006. February 11. https://doi.org/10.1895/wormbook.1.101.1
Govindan J.A., Jayamani E., Zhang X. et al. Dialogue between E. coli free radical pathways and the mitochondria of C. elegans // PNAS USA. 2015. V. 112. P. 12456–12461. https://doi.org/10.1073/pnas.1517448112
Tapia P.C. Sublethal mitochondrial stress with an attendant stoichiometric augmentation of reactive oxygen species may precipitate many of the beneficial alterations in cellular physiology produced by caloric restriction, intermittent fasting, exercise and dietary phytonutrients: “Mitohormesis” for health and vitality // Med. Hypotheses. 2006. V. 66. P. 832–843. https://doi.org/10.1016/j.mehy.2005.09.009
Schulz T.J., Zarse K., Voigt A. et al. Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress // Cell Metab. 2007. V. 6. P. 280–293. https://doi.org/10.1016/j.cmet.2007.08.011
Ristow M., Schmeisser K. Mitohormesis: promotimg health and lifespan by increased level of reactive gene species (ROS) // Dose-Response. 2014. V. 12. P. 288–341. https://doi.org/10.2203/dose-response.13-035.Ristow
Дополнительные материалы отсутствуют.


