Генетика, 2019, T. 55, № 2, стр. 156-164
Ремоделирующий хроматин комплекс SWI/SNF влияет на пространственную организацию локуса гена ftz-f1
Ю. В. Николенко 1, *, А. Н. Краснов 1, Н. Е. Воробьева 1
1 Институт биологии гена Российской академии наук
119334 Москва, Россия
* E-mail: julia.v.nikolenko@gmail.com
Поступила в редакцию 27.03.2018
После доработки 15.05.2018
Принята к публикации 04.05.2018
Аннотация
Ген ftz-f1 кодирует ядерный рецептор, играющий важную роль в процессе онтогенеза Drosophila melanogaster. Транскрипция этого гена в начале метаморфоза ограничена узким периодом времени и подвержена сложной многоступенчатой регуляции. Недавно в дистальной части первого интрона гена ftz-f1 нами был обнаружен регуляторный элемент, обладающий свойствами энхансера. В настоящей работе мы продолжили исследование свойств хроматина в локусе гена ftz-f1. При помощи метода фиксации конформации хромосом (3С) было обнаружено пространственное взаимодействие промотора и интронного энхансера исследуемого локуса. На фоне нокдауна субъединицы SAYP, привлекающей комплекс SWI/SNF на ген ftz-f1, было детектировано значительное ослабление этого взаимодействия на подготовительной стадии транскрипции гена. На стадии активной транскрипции гена нокдаун SAYP приводил к значительному снижению уровня ацетилирования гистона Н3 по 27-му положению на промоторе и на энхансере. Полученные данные указывают на важную роль SWI/SNF в формировании структуры хроматина, необходимой для адекватной экспрессии гена ftz-f1, и на его важную роль в функционировании интронного энхансера.
Регуляция экспрессии генов в ядре эукариотической клетки – сложнейший многостадийный процесс. Активация транскрипции генов, которые экспрессируются специализированно, только в определенных тканях или на определенной стадии развития организма, осуществляется при участии удаленных от промотора элементов ДНК, называемых энхансерами, которые и определяют специфичность экспрессии генов. По сформировавшемуся в настоящее время представлению механизм работы энхансеров заключается в следующем. На удаленные от промотора участки ДНК привлекаются различные транскрипционные комплексы, которые за счет изгиба ДНК физически сближаются в пространстве с промотором гена и способствуют активации транскрипции [1, 2]. Таким образом, изменение трехмерной структуры ДНК является необходимым условием для взаимодействия энхансера и промотора, т.е. необходимым фактором для активации транскрипции гена.
Ранее нашей научной группой было проведено подробное изучение механизма активации транскрипции гена ftz-f1 Drosophila melanogaster (рис. 1,а) [3]. Этот ген – один из компонентов экдизонового каскада и его экспрессия регулируется белком раннего ответа на 20-гидроксиэкдизон (далее по тексту – “экдизон”), ядерным рецептором DHR3 [4–6]. Экспрессия DHR3 непосредственно индуцируется повышением титра экдизона в начале метаморфоза, и ген ftz-f1 является его основной известной мишенью [7]. Экспрессия ftz-f1 ограничена узким временным окном: она начинается, когда уровень экдизона снижается, а затем вновь подавляется повторным повышением уровня экдизона. Для подробного изучения процесса активации транскрипции гена ftz-f1 в нашей лаборатории был разработан протокол, позволяющий активировать транскрипцию генов dhr3 и ftz-f1 в культуре клеток Schneider-2 (S2) [3, 8, 9]. Схематическое изображение активации транскрипции гена ftz-f1 представлено на рис. 1,б. В отсутствие экдизона в культуральной среде ген dhr3 и, соответственно, ftz-f1 не экспрессируются (стадия “–”). После добавления экдизона в культуральную среду с последующей инкубацией в течение ночи происходит привлечение активатора DHR3 на регуляторные сайты гена ftz-f1, накопление РНК-полимеразы II на промоторе и начинается транскрипция, однако РНК-полимераза II задерживается на расстоянии ~1.5 тпн от промотора и дальнейшей элонгации транскрипции не происходит. Эта стадия активации транскрипции получила название “подготовительной” (стадия “+”). После троекратной отмывки клеток от культуральной среды, содержащей экдизон, и замены ее на несодержащую экдизон, начинается стадия активной транскриции гена (“+; –”). На этой стадии ген dhr3 уже не экспрессируется, но белок DHR3, синтезированный на подготовительной стадии, остается связанным с регуляторными сайтами гена ftz-f1. В нашей предыдущей работе в дистальной части первого интрона гена ftz-f1 был обнаружен регуляторный сайт [10]. Было показано, что этот сайт обладает рядом свойств, характерных для энхансеров. В частности, на нем отмечался высокий уровень связывания активатора DHR3, но отсутствовала РНК-полимераза II, на нем отмечался низкий уровень содержания модификации H3me3K4, характерной для промоторов, и в то же время – высокий уровень характерной для энхансеров модификации H3me1K4. Изучение содержания эпигенетической метки “активного” хроматина H3AcK27 показало, что изучаемый сайт не активен на стадиях “–” и “+” и работает на стадии активной транскрипции. Далее в тексте для краткости этот интронный регуляторный элемент будет обозначаться как “энхансер”.
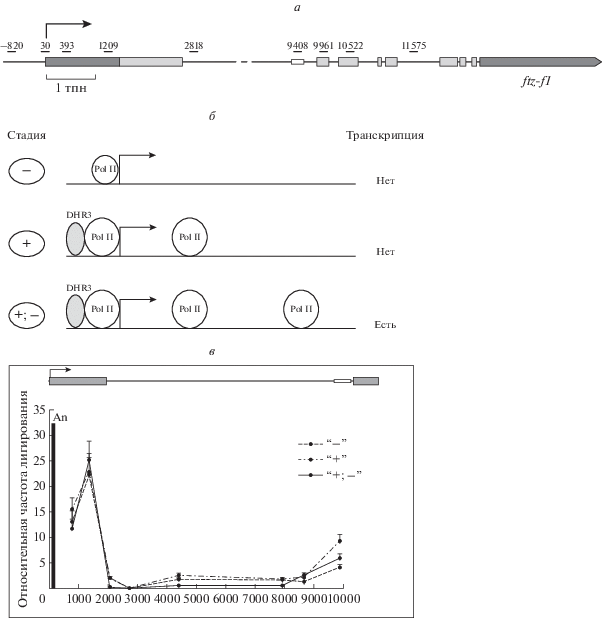
Рис. 1.
Схематическое изображение строения гена ftz-f1 (а), схема двухстадийной активации транскрипции гена ftz-f1 в экспериментальной системе в клетках S2 D. melanogaster (б) и 3С-анализ пространственной структуры хроматина в 5'-области гена ftz-f1 на разных стадиях активации транскрипции (в). Стрелкой обозначен сайт старта транскрипции гена, серыми прямоугольниками – экзоны, маленьким белым прямоугольником – энхансер. Расстояние указано в пн относительно старта транскрипции. An – расположение “якорного” праймера.
Целью данной работы было изучение пространственной структуры 5'-концевой области гена ftz-f1, а также изучение влияния комплекса SWI/SNF на ее формирование и на содержание ковалентных модификаций хроматина в процессе активации транскрипции.
МАТЕРИАЛЫ И МЕТОДЫ
Антитела
В настоящей работе были использованы антитела к DHR3 [11], SAYP [12], TBP, TAF1 [13], PB [14], к тотальному гистону H3 (Ab1791, Abcam), модифицированному гистону Н3: H3AcK27 (Active Motif, Catalog No: 39133) и H3me1K4 (Ab8895, Abcam).
Культивирование клеток линии Schneider-2
Культивирование клеток S2 D. melanogaster и индукцию экспрессии генов dhr3 и ftz-f1 экдизоном проводили как было описано ранее [3]. Для активации транскрипции dhr3 и ftz-f1 в культуральную среду добавляли экдизон до конечной концентрации 0.3 мкМ и инкубировали в течение ночи, затем проводили троекратную отмывку клеток средой, не содержащей экдизон, и инкубировали в среде без экдизона в течение 3 ч. Аликвоты клеток, отобранные на разных стадиях активации, использовали далее для проведения процедур иммунопреципитации хроматина и выделения РНК (данные протоколы были подробно описаны нами ранее [15]). РНК-интерференция SAYP проводилась по протоколу, описанному ранее [3]. Все эксперименты по индукции экспрессии генов dhr3 и ftz-f1 в норме и на фоне РНК-интерференции SAYP и иммунопреципитации хроматина были проведены в количестве трех повторов. Уровень экспрессии генов ftz-f1, e(y)3 (ген, кодирующий SAYP), ras (в качестве контроля) был измерен методом ОТ с последующей ПЦР в реальном времени.
Праймеры, использованные для измерения уровня экспрессии генов
ftz-f1: ACAACAACAATAACAACGACAATGATGC и CTGATTGCCGCTGCCACTCC; e(y)3: GCAACGGGAGCAGCAGTGATAC и AGACGCCGCAGGTGGACAG, CATCGTCGTCGTCGTCCTCAC и TGGTATCTGCTGCTGCTGCTG; ras: GAGGGATTCCTGCTCGTCTTCG и GTCGCACTTGTTACCCACCATC.
Праймеры, использованные для анализа гена ftz-f1 после иммунопреципитации хроматина
Район –820: ACAAAAAACTGCTGAAGAAGAGACC и ACTGTGGGTATGGCATTATGAAAG; район 30: GCTTTGTCATCTATGTGTGTGTTGTTG и GAGGCAGAGGCAGCGACG; район 393: GTTCTCTTGCTGCGTTGCG и GAAAGTGGGTCACGAATTTATTGC; район 1209: ACCGCA-ACCTATTTTACTACC и TTAGAAGACCGAAGA-GTTATCC; район 2818: CAGGGACATCACACATACG и CTCCGTAAGAGTCAGCTTTAAC; район 9408: CAACGCTTCACAGAAACAAACG и GTTGTACAAAGCGGCGTATGC; район 9961: GTTCGAGCGGATAGAATGCGT и GATATGCTTGCTGGTAGCCCG; район 10522: GAGGAGGAGGTGGCAATAATGC и GATCCTATTCCAGCCTC-GTGG; район 11575: GCAGCAACATGGTT-CAAAGC и TTCAATGCACATTCTGCCG.
3С
Фиксацию конформации хромосом клеток линии S2 D. melanogaster проводили по протоколу, описанному ранее [16], в работе была использована эндонуклеаза рестрикции DpnII (NEB). Контрольная библиотека, содержащая эквимолярное количество всех продуктов лигирования, была получена на основе геномной ДНК клеток линии S2 D. melanogaster. Эксперимент был проведен в виде трех независимых биологических повторов.
Праймеры, использованные для 3С-анализа гена ftz-f1
CATAGATGACAAAGCGTTACACC (“якорный праймер”), [FAM]CGATATT[BHQ1-dT]GGGTCACTCACACGC (TaqMan-зонд), TGTCAAGGAACACACAGCGAG, CGTACATGAAATGTTA-TTAGAAATGG, GTTCCGTGGGCAATGGCAG, TTCATTATATGTAGTGATTTCATACCTTC, GA-AGTACCTACTCATTTGATTGTTAGTC, CTGA-AAGTGAAGAAATGTCG, CGTATTCGTGTGC-TTGTGTG, TGGACGCAACAAATTCGGAC.
РЕЗУЛЬТАТЫ
Влияние комплекса SWI/SNF на пространственную структуру гена ftz-f1
Была исследована пространственная структура хроматина в 5'-концевой области гена ftz-f1 методом 3С (Chromosome conformation capture, метод фиксации конформации хромосом). Метод базируется на фиксации ДНК-белковых комплексов формальдегидом in vivo с последующим расщеплением ДНК эндонуклеазой рестрикции и религированием полученных фрагментов при низкой концентрации ДНК. Поскольку мы анализировали взаимодействие на относительно небольшом расстоянии порядка 10 тпн, в настоящей работе была использована рестриктаза DpnII, распознающая часто встречающиеся четырехнуклеотидные сайты. В качестве “якорного” района была использована область промотора гена ftz-f1. Относительная частота лигирования фрагментов ДНК определена методом ПЦР в реальном времени с использованием TaqMan-зонда. Для учета разной эффективности ПЦР для разных пар праймеров ПЦР-сигналы были отнормированы на сигналы, полученные для контрольного образца, содержавшего эквимолярное количество всех исследуемых продуктов лигирования.
Мы проанализировали пространственную структуру 5'-концевой области гена ftz-f1 и детектировали взаимодействие участков промотора и энхансера. Это взаимодействие наблюдалось на всех трех стадиях активации транскрипции (“–”, “+” и “+; –”), но было наиболее сильным на подготовительной стадии (рис. 1,в). Результаты, полученные для двух наименее удаленных от промотора точек, вероятно нельзя считать адекватными, так как расстояние от “якоря” очень невелико: ~800 пн и ~1.5 тпн.
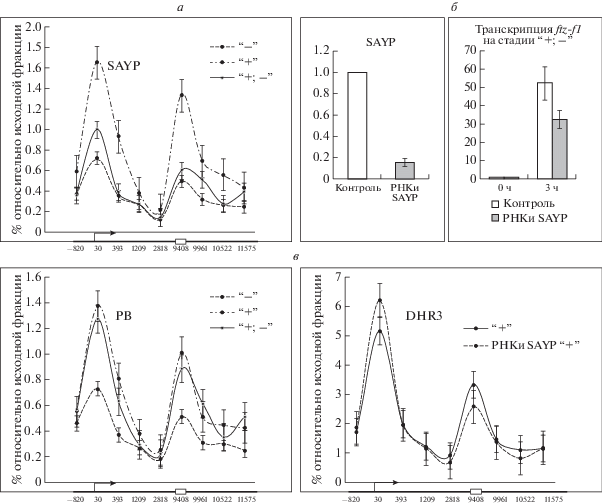
Поскольку в нашей предыдущей работе было показано, что в регуляции транскрипции гена ftz-f1 существенную роль играет ремоделирующий хроматин комплекс SWI/SNF, и обнаружено связывание этого комплекса на промоторе и в сайте “задержки” РНК-полимеразы [3], мы решили исследовать влияние этого комплекса на свойства хроматина в локусе гена ftz-f1. При помощи антител к двум субъединицам комплекса, PB и SAYP, исследовали профиль связывания комплекса с геном ftz-f1 и обнаружили (помимо найденного ранее пика связывания на промоторе) пик связывания комплекса на энхансере (рис. 2,а). Наиболее сильное связывание комплекса наблюдалось на подготовительной стадии транскрипции. Для исследования влияния SWI/SNF на состояние хроматина в изучаемом локусе было понижено внутриклеточное содержание субъединицы SAYP методом РНК-интерференции. Ранее было показано, что именно эта субъединица взаимодействует с ядерным рецептором DHR3 и обеспечивает посадку комплекса SWI/SNF на регуляторные элементы гена ftz-f1 [3]. Для повышения эффективности РНК-интерференции, как и в предыдущих работах [3, 13], использовали одновременно две двуцепочечные РНК, соответствующие районам, кодирующим разные части белка. Это позволило снизить содержание SAYP в 5–8 раз (рис. 2,б). Как и ожидалось, исходя из полученных ранее данных [3], на фоне нокдауна SAYP уровень транскрипции гена ftz-f1 через 3 ч после начала стадии активной транскрипции был снижен примерно вдвое по сравнению с контролем (рис. 2,б). В то же время нокдаун SAYP не оказывал влияния на связывание активатора DHR3 с промотором и энхансером гена ftz-f1 (рис. 2,в).
Рис. 2.
Профили связывания компонентов комплекса SWI/SNF с геном ftz-f1 на разных стадиях активации транскрипции (а), изменение транскрипции SAYP и ftz-f1 на фоне РНК-интерференции SAYP (б) и профиль связывания активатора DHR3 с геном ftz-f1 на подготовительной стадии транскрипции в норме и на фоне РНК-интерференции SAYP (в). SAYP, PB – компоненты комплекса SWI/SNF. Стрелкой обозначен сайт старта транскрипции гена, белым прямоугольником – энхансер. Расстояние указано в пн относительно старта транскрипции.
Было исследовано влияние нокдауна SAYP на формирование трехмерной структуры гена ftz-f1 методом 3С. На фоне нокдауна SAYP взаимодействие промотора и энхансера ослаблялось, при этом наибольший эффект наблюдался на стадии подготовки к активной транскрипции – относительная частота лигирования снижалась приблизительно в 5 раз (рис. 3,а).
Рис. 3.
3С-анализ пространственной структуры хроматина в 5'-области гена ftz-f1 на разных стадиях активации транскрипции в норме и на фоне РНК-интерференции SAYP (а) и профили связывания факторов инициации транскрипции с геном ftz-f1 на подготовительной стадии транскрипции в норме и на фоне РНК-интерференции SAYP (б). TBP, TAF1 – компоненты общего фактора транскрипции TFIID. Стрелкой обозначен сайт старта транскрипции гена, серыми прямоугольниками – экзоны, маленьким белым прямоугольником – энхансер. Расстояние указано в пн относительно старта транскрипции. An – расположение “якорного” праймера.
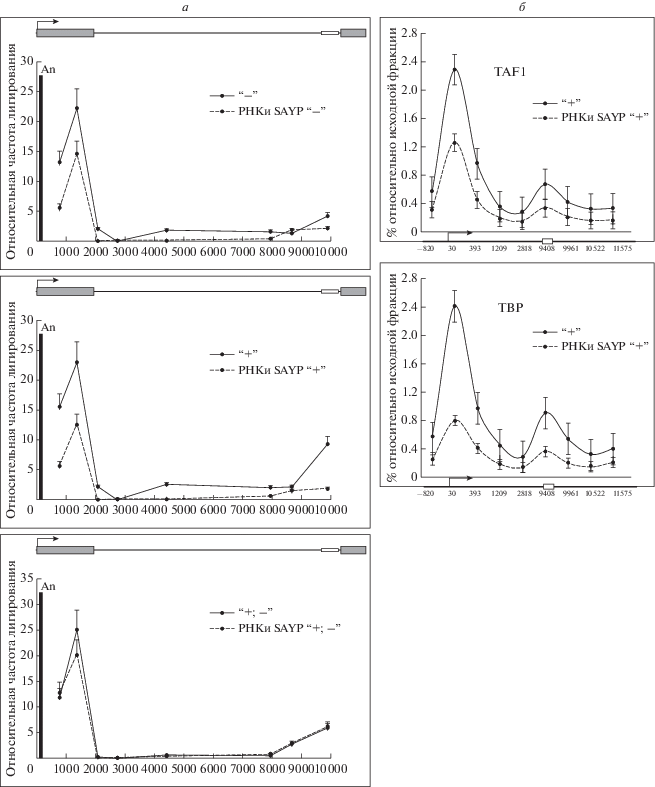
В отличие от промоторов энхансеры не способны связывать основные факторы транскрипции, однако метод иммунопреципитации хроматина позволяет детектировать некоторое количество общих факторов транскрипции на энхансере. Это связано с тем, что ДНК и белки на энхансере могут быть “сшиты” формальдегидом с общими факторами транскрипции, связанными с промотором гена [17]. Таким образом, изменение уровня связывания основных факторов транскрипции энхансером может свидетельствовать об изменении силы его взаимодействия с промотором. В нашей предыдущей работе мы обнаружили связывание общих факторов транскрипции TBP и Taf1 с энхансером гена ftz-f1. Наиболее сильное связывание детектировалось на подготовительной стадии транскрипции [10]. Как было показано выше в настоящей работе, наибольшее количество SWI/SNF и наибольшее его влияние детектируется на энхансере ftz-f1 также именно на этой стадии, поэтому она была выбрана нами для исследования влияния нокдауна SAYP. На фоне нокдауна SAYP наблюдалось резкое снижение связывания общих факторов транскрипции с энхансером; наблюдавшийся ранее пик полностью исчезал, что свидетельствует о сильном ослаблении связи энхансера с промотором (рис. 3,б). Таким образом, с помощью двух независимых подходов – напрямую методом 3С и косвенно методом иммунопреципитации хроматина – показано, что SWI/SNF играет важную роль в формировании пространственной структуры гена ftz-f1 на подготовительной стадии транскрипции.
Влияние комплекса SWI/SNF на активность интронного энхансера гена ftz-f1
В наших предыдущих работах было проведено исследование изменения содержания ковалентных модификаций гистона Н3 на регуляторных элементах гена ftz-f1 в процессе активации транскрипции [3, 10]. В настоящей работе исследовано влияние SWI/SNF на содержание двух модификаций гистона Н3, H3me1K4 и H3АсK27, на промоторе и энхансере. Было измерено методом иммунопреципитации хроматина содержание модифицированного гистона Н3 на промоторе и энхансере в норме и на фоне нокдауна SAYP (рис. 4). Как и ожидалось, высокое содержание гистона Н3, монометилированного по остатку лизина 4, отмечалось на всех стадиях активации транскрипции, и влияние нокдауна SAYP на содержание этой модификации было незначительным. Этот результат согласуется с литературными данными, что высокое содержание H3me1K4 характерно для энхансерных элементов вне зависимости от их активности [18]. Уровень H3АсK27 на энхансере, как и ожидалось, исходя из наших предыдущих исследований, был невысоким в неактивном состоянии и на подготовительной стадии активации транскрипции и резко возрастал в норме на стадии активной транскрипции (рис. 4). На фоне нокдауна SAYP содержание этой модификации на энхансере на стадии активной транскрипции было снижено примерно вдвое. На промоторе эта тенденция также сохранялась, но влияние SWI/SNF было слабее (рис. 4). По литературным данным H3АсK27 – маркер “активного” хроматина, он присутствует только на активно функционирующих энхансерах и промоторах [19], полученные в этом эксперименте данные согласуются с наблюдением, что на фоне нокдауна SAYP уровень экспрессии гена ftz-f1 на стадии активной транскрипции снижается (рис. 2,б).
Рис. 4.
Изменения уровня содержания модификаций гистона H3 на промоторе и энхансере гена ftz-f1 на разных стадиях активации транскрипции в норме и на фоне РНК-интерференции SAYP. H3me1K4/H3 – гистон Н3, монометилированный по остатку лизина 4; H3AcK27/H3 – гистон Н3, ацетилированный по остатку лизина 27.

Итак, в совокупности полученные данные свидетельствуют о важной роли комплекса SWI/SNF в формировании пространственной структуры и “активного” состояния хроматина в локусе гена ftz-f1 в процессе ступенчатой активации его транскрипции.
ОБСУЖДЕНИЕ
В настоящей работе исследована пространственная структура и ковалентные модификации хроматина в локусе гена ftz-f1. Полученные данные указывают на то, что хроматин в 5'-области гена образует петлю, которая сближает промотор гена с энхансером, расположенным в дистальной области первого интрона. Такая укладка хроматина сохраняется, по-видимому, всегда, независимо от транскрипционного статуса гена. Наиболее сильное взаимодействие наблюдается на подготовительной стадии транскрипции в условиях высокой концентрации экдизона. Другой район, который по данным 3С-анализа взаимодействует с промотором, расположен на расстоянии ~1.5 тпн и соответствует сайту, где происходит “задержка” РНК-полимеразы II на подготовительной и активной стадии транскрипции. Однако мы не можем быть уверены в адекватности полученных для этой точки результатов, так как ее удаленность от “якоря” слишком невелика.
Согласно общепринятой модели, образование ДНК-петли между промотором и энхансером способствует привлечению на промотор факторов, необходимых для позиционирования преинициаторного транскрипционного комплекса или перехода РНК-полимеразы II из состояния “задержки” в стадию элонгации [1, 20, 21]. Конкретные механизмы, обеспечивающие образование таких петель, остаются неизвестными. В настоящее время предполагается, что одним из основных белковых участников взаимодействия между энхансером и промотором является ДНК-связывающий белок CTCF [1], однако работа одного лишь CTCF не может определять специфичность взаимодействия между отдельными энхансерами и промоторами.
Полногеномное исследование сайтов посадки ремоделирующего хроматин комплекса SWI/SNF методом СhIP-seq показало, что 40% этих сайтов совпадают с местами посадки РНК-полимеразы II, а 43% совпадают с известными энхансерами [22]. Ранее [3] нами было обнаружено высокое содержание этого комплекса на промоторе гена ftz-f1 и в сайте “задержки” РНК-полимеразы. Было показано, что SWI/SNF на подготовительной стадии образует область с высокой плотностью нуклеосом в районе “задержки” РНК-полимеразы II, а также важен для фосфорилирования Ser2 С-концевого домена и перехода РНК-полимеразы II в состояние элонгации на стадии активной транскрипции. В настоящей работе мы обнаружили пик связывания SWI/SNF на энхансере гена ftz-f1, наблюдая наиболее сильное связывание на подготовительной стадии транскрипции. Нокдаун субъединицы SAYP, которая отвечает за привлечение комплекса SWI/SNF на ген, приводит к существенному ослаблению взаимодействия промотора и энхансера, особенно заметному на подготовительной стадии транскрипции. Полученные нами данные согласуются с опубликованными результатами исследований других научных лабораторий. Так, было продемонстрировано, что большую роль в процессе взаимодействия энхансера и промотора играет структура хроматина, а более конкретно структура нуклеосом, связанных с ДНК на участке между промотором и энхансером [23]. Также проводилось изучение влияния SWI/SNF на пространственную организацию отдельных геномных локусов: CIITA [24], генов цитокинов [25], α- и β-глобинов [26, 27]. За последнее время ряд работ был посвящен изучению роли SWI/SNF в формировании пространственной организации хроматина на геномном уровне [28, 29]. В экспериментах на клетках человека было показано влияние нокдауна Brg1, АТФазной субъединицы SWI/SNF, на пространственную организацию генома. В условиях нокдауна Brg1 происходит изменение плотности нуклеосом вблизи сайтов CTCF, что приводит к увеличению количества цис- и транс-взаимодействий субтеломерных участков хромосом [28]. На основании данных, полученных другими исследователями, а также наших результатов мы полагаем, что комплекс SWI/SNF участвует в формировании пространственной структуры локусов генов опосредованным путем, воздействуя на хроматин связывающих его участков (промоторов и энхансеров), повышая тем самым вероятность их взаимодействия.
В настоящей работе было обнаружено, что нокдаун SAYP на стадии активной транскрипции приводит к снижению содержания модификации H3АсK27 – метки “активного” хроматина – на промоторе и особенно на энхансере гена ftz-f1, а также снижению уровня экспрессии данного гена. Этот результат свидетельствует о вкладе комплекса SWI/SNF в механизм образования “активного” энхансера. В нашей предыдущей работе было показано, что на фоне мутации, снижающей экспрессию SAYP, в процессе метаморфоза D. melanogaster транскрипция гена ftz-f1 возрастает преждевременно, но затем снижается и остается на уровне значительно ниже нормы [3]. На основании всех полученных нами результатов можно предложить модель участия комплекса SWI/SNF в функционировании локуса гена ftz-f1. На подготовительной стадии транскрипции активатор DHR3 связывается с промотором и энхансером гена и привлекает комплекс SWI/SNF, который в свою очередь обеспечивает образование (или увеличение) области, свободной от нуклеосом. На образовавшийся открытый хроматин рекрутируются белки, обеспечивающие стабилизацию взаимодействия промотора и энхансера, а также транскрипционные факторы и коактиваторы, в том числе ковалентно модифицирующие хроматин. Совместная работа рекрутированных факторов обеспечивает адекватный ответ на снижение титра экдизона, т.е. своевременный переход в стадию активной транскрипции и быстрое достижение высокого уровня экспрессии гена ftz-f1.
Работа была поддержана грантом Программы Президиума РАН “Молекулярная и клеточная биология” и грантами Российского фонда фундаментальных исследований № 14-04-01297, 17-04-01713 и 18-04-01019.
Список литературы
Marsman J., Horsfield J.A. Long distance relationships: enhancer-promoter communication and dynamic gene transcription // Biochim. Biophys. Acta. 2012. V. 1819. № 11–12. P. 1217–1227. doi 10.1016/j.bbagrm.2012.10.008
Buecker C., Wysocka J. Enhancers as information integration hubs in development: lessons from genomics // Trends Genet.: TIG. 2012. V. 28. № 6. P. 276–284. doi 10.1016/j.tig.2012.02.008
Vorobyeva N.E., Nikolenko J.V., Nabirochkina E.N. et al. SAYP and Brahma are important for ‘repressive’ and ‘transient’ Pol II pausing // Nucl. Acids Res. 2012. V. 40. № 15. P. 7319–7331. doi 10.1093/nar/gks472
Huet F., Ruiz C., Richards G. Sequential gene activation by ecdysone in Drosophila melanogaster: the hierarchical equivalence of early and early late genes // Development. 1995. V. 121. № 4. P. 1195–1204.
Koelle M.R., Segraves W.A., Hogness D.S. DHR3: a Drosophila steroid receptor homolog // Proc. Natl Acad. Sci. USA. 1992. V. 89. № 13. P. 6167–6171.
Lam G.T., Jiang C., Thummel C.S. Coordination of larval and prepupal gene expression by the DHR3 orphan receptor during Drosophila metamorphosis // Development. 1997. V. 124. № 9. P. 1757–1769.
Ruaud A.F., Lam G., Thummel C.S. The Drosophila nuclear receptors DHR3 and betaFTZ-F1 control overlapping developmental responses in late embryos // Development. 2010. V. 137. № 1. P. 123–131. doi 10.1242/dev.042036
Mazina M.Y., Nikolenko J.V., Fursova N.A. et al. Early-late genes of the ecdysone cascade as models for transcriptional studies // Cell Cycle. 2015. V. 14. № 22. P. 3593–3601. doi 10.1080/15384101.2015.1100772
Vorob’eva N.E. Mechanism of transcription regulation by RNA polymerase II pausing // Tsitologiia. 2013. V. 55. № 3. P. 153–158.
Nikolenko J.V., Krasnov A.N., Mazina M.Y. et al. Studying a novel ecdysone-dependent enhancer // Dokl. Biochem. Biophys. 2017. V. 474. № 1. P. 236–238. doi 10.1134/s160767291703022x
Vorobyeva N.E., Nikolenko J.V., Krasnov A.N. et al. SAYP interacts with DHR3 nuclear receptor and participates in ecdysone-dependent transcription regulation // Cell Cycle. 2011. V. 10. № 11. P. 1821–1827. doi 10.4161/cc.10.11.15727
Shidlovskii Y.V., Krasnov A.N., Nikolenko J.V. et al. A novel multidomain transcription coactivator SAYP can also repress transcription in heterochromatin // The EMBO J. 2005. V. 24. № 1. P. 97–107. doi 10.1038/ sj.emboj.7600508
Vorobyeva N.E., Soshnikova N.V., Nikolenko J.V. et al. Transcription coactivator SAYP combines chromatin remodeler Brahma and transcription initiation factor TFIID into a single supercomplex // Proc. Natl Acad. Sci. USA. 2009. V. 106. № 27. P. 11049–11054. doi 10.1073/pnas.0901801106
Mohrmann L., Langenberg K., Krijgsveld J. et al. Differential targeting of two distinct SWI/SNF-related Drosophila chromatin-remodeling complexes // Mol. Cell. Biol. 2004. V. 24. № 8. P. 3077–3088.
Vorobyeva N.E., Mazina M.U., Golovnin A.K. et al. Insulator protein Su(Hw) recruits SAGA and Brahma complexes and constitutes part of Origin Recognition Complex-binding sites in the Drosophila genome // Nucl. Acids Res. 2013. V. 41. № 11. P. 5717–5730. doi 10.1093/nar/gkt297
Gavrilov A.A., Razin S.V. Study of spatial organization of chicken alpha-globin gene domain by 3C technique // Biochem. Biokhimiia. 2008. V. 73. № 11. P. 1192–1199.
Liang J., Lacroix L., Gamot A. et al. Chromatin immunoprecipitation indirect peaks highlight long-range interactions of insulator proteins and Pol II pausing // Mol. Cell. 2014. V. 53. № 4. P. 672–681. doi 10.1016/ j.molcel.2013.12.029
Heintzman N.D., Stuart R.K., Hon G. et al. Distinct and predictive chromatin signatures of transcriptional promoters and enhancers in the human genome // Nat. Genet. 2007. V. 39. № 3. P. 311–318. doi 10.1038/ ng1966
Koenecke N., Johnston J., Gaertner B. et al. Genome-wide identification of Drosophila dorso-ventral enhancers by differential histone acetylation analysis // Genome Biol. 2016. V. 17. № 1. P. 196. doi 10.1186/ s13059-016-1057-2
Cubenas-Potts C., Rowley M.J., Lyu X. et al. Different enhancer classes in Drosophila bind distinct architectural proteins and mediate unique chromatin interactions and 3D architecture // Nucl. Acids Res. 2017. V. 45. № 4. P. 1714–1730. doi 10.1093/nar/gkw1114
Ong C.T., Corces V.G. Enhancer function: new insights into the regulation of tissue-specific gene expression // Nat. Rev. Genet. 2011. V. 12. № 4. P. 283–293. doi 10.1038/nrg2957
Euskirchen G.M., Auerbach R.K., Davidov E. et al. Diverse roles and interactions of the SWI/SNF chromatin remodeling complex revealed using global approaches // PLoS Genetics. 2011. V. 7. № 3. P. e1002008. doi 10.1371/journal.pgen.1002008
Rubtsov M.A., Polikanov Y.S., Bondarenko V.A. et al. Chromatin structure can strongly facilitate enhancer action over a distance // Proc. Natl Acad. Sci. USA. 2006. V. 103. № 47. P. 17690–17695. doi 10.1073/ pnas.0603819103
Ni Z., Abou El Hassan M., Xu Z. et al. The chromatin-remodeling enzyme BRG1 coordinates CIITA induction through many interdependent distal enhancers // Nat. Immunol. 2008. V. 9. № 7. P. 785–793. doi 10.1038/ni.1619
Cai S., Lee C.C., Kohwi-Shigematsu T. SATB1 packages densely looped, transcriptionally active chromatin for coordinated expression of cytokine genes // Nat. Genet. 2006. V. 38. № 11. P. 1278–1288. doi 10.1038/ ng1913
Kim S.I., Bresnick E.H., Bultman S.J. BRG1 directly regulates nucleosome structure and chromatin looping of the alpha globin locus to activate transcription // Nucl. Acids Res. 2009. V. 37. № 18. P. 6019–6027. doi 10.1093/nar/gkp677
Kim S.I., Bultman S.J., Kiefer C.M., et al. BRG1 requirement for long-range interaction of a locus control region with a downstream promoter // Proc. Natl Acad. Sci. USA. 2009. V. 106. № 7. P. 2259–2264. doi 10.1073/pnas.0806420106
Barutcu A.R., Lajoie B.R., Fritz A.J. et al. SMARCA4 regulates gene expression and higher-order chromatin structure in proliferating mammary epithelial cells // Genome Res. 2016. V. 26. № 9. P. 1188–1201. doi 10.1101/gr.201624.115
Li G., Ruan X., Auerbach R.K. et al. Extensive promoter-centered chromatin interactions provide a topological basis for transcription regulation // Cell. 2012. V. 148. № 1–2. P. 84–98. doi 10.1016/j.cell.2011.12.014
Дополнительные материалы отсутствуют.


