Генетика, 2019, T. 55, № 2, стр. 125-135
Генетические и эпигенетические пути супрессора опухоли lethal (2) giant larvae у Drosophila melanogaster
Н. Я. Вайсман *
Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: weisman@bionet.nsc.ru
Поступила в редакцию 22.02.2018
После доработки 23.07.2018
Принята к публикации 07.06.2018
Аннотация
Супрессоры опухоли являются фундаментальными генами развития с полной пенетрантностью. Рецессивные мутации супрессора l(2)gl у дрозофилы сопровождаются сложными фенотипическими синдромами. Реализация функций локуса l(2)gl осуществляется генетическими и эпигенетическими путями. Продукт гена Lgl в сложных белковых комплексах контролирует установление клеточной полярности в стволовых эпителиальных и нервных клетках. Степень участия l(2)gl в регуляции раннего развития, продолжительности жизни, ответа на стресс, развития опухоли может зависеть от уровня экспрессии микроРНК, наличия внутриклеточных симбионтов, мутаций других жизненно важных генов и подвержена влиянию различного рода воздействий.
Эволюционно консервативный ген lethal (2) giant larvae (l(2)gl) у дрозофилы оказался первым открытым супрессором опухоли у животных (tumor suppressor gene, TSG). Его летальная мутация была обнаружена в опытах по мутагенезу К. Бриджесом еще в 1920-х гг. [1, 2]. Нормальные аллели TSG запрещают формирование новообразований [3]. Между TSG человека и генами дрозофилы, мыши, крысы, нематоды и дрожжей установлена высокая степень гомологии. Филогенетический анализ некоторых TSG позволил предположить, что семейства белков-супрессоров опухоли возникли в начале формирования многоклеточных животных [4].
МУТАЦИИ l(2)gl ВЫЗЫВАЮТ НЕОПЛАЗИЮ У ДРОЗОФИЛЫ И ЧЕЛОВЕКА
Мутации TSG одноступенчато вызывают неопластическое перерождение специфических клеточных типов вследствие утраты активности гена. Их генетические функции выявляются на основе фенотипов мутантных по супрессорам опухоли гомозиготных животных. В исследованиях TSG у дрозофилы значительная доля работ выполнена с мутациями l(2)gl. Впервые прямая связь между неограниченным ростом клеток, возникновением опухолей и изменением функции гена in vivo была установлена в опыте с рецессивной летальной мутацией l(2)gl4 [5]. В дальнейшем склонность к развитию злокачественных разрастаний была выявлена у гомозиготных мух по другим мутациям этого гена: делеции net l(2)gl (Dfnet62) и спонтанным аллелям, выделенным из изолированных природных популяций [6]. Большинство природных аллелей имеют полную пенетрантность, хотя и вызывают разную степень нарушений оптической доли мозга и имагинальных дисков. В гомозиготе они неизбежно приводят к образованию опухоли и смерти на поздней личиночной или ранней куколочной стадии. У мух дикого типа на этих стадиях диски достигают конечного размера, деления прекращаются и гормональные изменения индуцируют окукливание. Мутантные личинки не окукливаются, до гибели продолжают расти еще 2 нед. В это время они приобретают фенотип “giant larva” – увеличиваются по длине и объему.
Комплексный анализ фенотипов у l(2)gl-мутантов позволил составить детальное описание злокачественных опухолей. У гомозиготных особей l(2)gl нарушения формы, размера, анатомии и гистологии мозга формируются в течение третьего личиночного возраста. Недифференцированные нейробласты и материнские клетки ганглиев в мутантных зачатках оптических центров неограниченно делятся, что приводит к гиперплазии и увеличению мозга примерно в 2 раза. Склонность к образованию опухоли запрограммирована уже у эмбриона. Трансплантация мутантных по l(2)gl клеток эмбрионального или зрелого личиночного мозга взрослым особям вызывает сильное разрастание опухоли с поражением ткани хозяина, приводящей к его гибели. До трети клеток опухолевого трансплантата становятся анеуплоидными, в их ядрах выявляются вирусоподобные включения [5].
Мутантные эпителиальные клетки дисков теряют характерную полярность и способность к дифференцировке, боковые связи между ними нарушаются, ядра наполнены вирусоподобными частицами. Имагинальные диски теряют типичную упорядоченную монослойную клеточную организацию эктодермы и превращаются в аморфное многослойное нагромождение конгломератов клеток, намного превышающее по размеру диски дикого типа. Начиная с 10-дневного эмбриона, трансплантаты мутантных клеток дисков нормальным личинкам или взрослым мухам развиваются автономно в организме хозяина и, разрастаясь, убивают его с неодинаковой скоростью для разных l(2)gl-аллелей [5, 7].
Геном человека содержит ортолог l(2)gl (LGL1, Hugl-1, Human giant larvae), мутации которого также вызывают формирование злокачественных новообразований. Например, для большинства человеческих опухолей кишечника и простаты характерно нарушение транскрипции Hugl-1. В свою очередь одна нормальная копия Hugl-1, встроенная в геном дрозофилы, подавляет неоплазию у мутантных гомозигот l(2)gl/l(2)gl и предотвращает гибель животных [8].
ОПУХОЛЬ РАЗВИВАЕТСЯ ПРИ НАРУШЕНИИ ПОЛЯРНОСТИ КЛЕТОК У МУТАНТОВ TSG
В качестве первопричины возникновения неоплазии у животных с мутациями по генам-супрессорам опухоли рассматривается нарушение клеточной полярности. Как следствие изменения полярности возникают нарушение клеточной морфологии, архитектуры тканей, потеря способности клеток к дифференцировке и быстрый автономный рост, характерный для всех новообразований дрозофилы и позвоночных животных [9, 10].
В нормальных клетках животных определенная степень поляризации и внутренней организации формируется во время специализации для выполнения их функций. В настоящее время выявлены основные черты формирования полярности и ее поддержания. Схемы поляризации в разных типах клеток сходны с некоторыми вариациями локализации, функций и взаимодействий между белковыми комплексами, которые зависят от клеточного контекста, и регулируются небольшим числом эволюционно консервативных генов [9, 11, 12].
Полярность клеток выражается в асимметричном распределении белков между апикальным и базальным полюсами мембраны. Начинается поляризация клеток с формирования одной или нескольких осей в ответ на внутренние или внешние сигналы. Вдоль этих осей в мембране образуются неперекрывающиеся субдомены с разным белковым составом. От мембраны поляризация переходит на внутреннюю организацию клетки через активность клеточных сигнальных путей. Клеточная поляризация вдоль апикально-базальной оси характерна для нейробластов, клеток эпителия фолликулов яичников, имагинальных дисков и эпителия зародыша и личинки дрозофилы. Наиболее часто модельной системой для интенсивного изучения полярности служат культуры нейробластов и эмбриональной эктодермы [13, 14].
Первичная функция супрессоров опухоли состоит в эпигенетической регуляции клеточной полярности. Нормальные аллели супрессора опухоли l(2)gl участвуют в поддержании полярности клеток в тканях дрозофилы [8, 9, 15]. Ген l(2)gl кодирует полипептид с разными типами мотивов для взаимодействия с другими белками и формирования мультимерных комплексов [16].
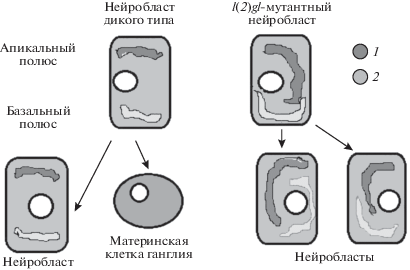
В ходе установления полярности нейробластов белок Lgl действует как антагонист атипической киназы (atypical protein kinase C, aPKC). В результате активность Lgl остается высокой в базо-латеральном домене, а активность aPKC – в апикальном домене клеточной мембраны. От нормальной функции гена l(2)gl зависит накопление на базальном полюсе факторов дифференцировки нейронов. Нейробласты, нокаутированные по гену l(2)gl, теряют полярное распределение клеточных детерминант. Они начинают делиться симметрично и неограниченно, что вызывает формирование опухоли мозга [10, 14, 17] (рис. 1).
Рис. 1.
Распределение aPKC (1) и клеточных детерминант (2) в нейробластах дикого и l(2)gl-мутантного типа.
Рисунки экспрессии aPKC и Lgl вдоль апикально-базальной оси в поляризованных клетках нейробластов и эпителия дрозофилы сходны. В зависимости от распределения белков между апикальным и базо-латеральным компартментами мембраны формируются морфология, межклеточные контакты и физиология эпителия. В эпителии ген l(2)gl контролирует клеточную организацию в базо-латеральном домене мембраны во взаимодействии с другими TSG: discs-large (dlg) и scribble (scrib) и образует белковый комплекс Scrib–Lgl–Dlg. Этот белковый комплекс связывается с молекулами трансмембранных комплексов, формируя межклеточные эпителиальные контакты, местоположение которых также маркирует полярность клеток. Белковые комплексы клеточных контактов передают сигналы извне к сети внутриклеточных регуляторных каскадов и цитоскелетным белкам. Мутации l(2)gl, вызывающие нарушения полярности мембраны и формирования контактов, приводят к ингибированию одних и активации других сигнальных путей и генов, к изменению морфологических особенностей клеток и тканевой архитектуры и часто к развитию неоплазии [13, 18].
В плане общей клеточной полярности эпителия асимметрично в базальной мембране локализуются сайты связывания интегринов. У многоклеточных организмов трансмембранные белки интегрины передают информацию от межклеточного матрикса внутриклеточным молекулам, и через активность клеточных сигнальных путей поляризация от мембраны переходит на внутреннюю организацию клетки [19].
Посредником передачи многих интегриновых сигналов является высоко консервативный белок FAK (нерецепторная тирозинкиназа, focal adhesion kinase, DFak56 у дрозофилы). Через фосфорилирование сигнальных молекул FAK управляет интегральной сетью регулирующих функции клеток каскадов. Сигнальные пути, активированные при участии FAK, контролируют важные клеточные процессы: дифференцировку, рост, выживаемость, пролиферацию, миграцию клеток, клеточный цикл, апоптоз, ангиогенез [20].
У дрозофилы экспрессия DFak56 обнаружена и изучена в процессе всего развития: в эмбрионах, личинке первой и третьей стадии, ранней и средней куколке и у взрослой мухи. Уровень экспрессии DFak56 наиболее высокий в поляризованных тканях в развивающемся эмбрионе: в центральной нервной системе и мышечной ткани, в фолликулярных, зародышевых и мигрирующих пограничных клетках развивающейся яйцевой камеры, эпидермисе и висцеральной мезодерме. Изучение мутантных по DFak56 животных показало, что функция фермента существенна для многих процессов развития и физиологии дрозофил [21].
Супрессор l(2)gl в значительной степени регулирует положение сайтов локализации интегринов и может оказывать косвенное, эпигенетическое влияние на активность FAK (DFak56) и нижестоящие сигнальные пути. У мутантных по l(2)gl животных должны нарушаться локализация интегринов и передача сигналов через FAK. Клетки будут приобретать свойства, характерные для развития рака, – неспособность к дифференцировке, неограниченную пролиферацию и способность к инвазии. Таким образом, один из путей регуляции развития опухоли супрессором l(2)gl может быть опосредован FAK и интегриновыми сигнальными путями.
микроРНК ПОДАВЛЯЮТ ЭКСПРЕССИЮ TSG И ВЫЗЫВАЮТ РАЗВИТИЕ ОПУХОЛИ У ЖИВОТНЫХ
Регуляторные молекулы коротких некодирующих микроРНК (microRNA, miRNA) впервые были обнаружены у Caenorhabditis elegans, а затем у других животных, растений и некоторых вирусов. У млекопитающих miRNA кодируются десятками сотен генов, по многим из которых обнаружен генетический полиморфизм. Последовательности нуклеотидов многих miRNA эволюционно консервативны у близких и далеких (шимпанзе, мышь, крыса, собака, курица) видов, а иногда схожи между позвоночными и беспозвоночными. У человека значительное число miRNAs сохранили гомологию только с приматами [22].
Молекулы miRNAs регулируют разные процессы развития и физиологические процессы, воздействуя на экспрессию белка. Они обычно связываются с находящейся в 3' нетранслируемой области mRNA (3'UTR mRNA) частично комплементарной им последовательностью. Прямое связывание между ними чаще ингибирует трансляцию или уменьшает стабильность mRNA, снижая экспрессию белка, но есть данные об усилении экспрессии. Решающими для регуляции трансляции являются нуклеотиды между 2–8 позициями 5'-конца молекулы miRNA, названные seed-областью. Мутации, затрагивающие последовательности зрелых miRNA или mRNA-мишеней, исключают связывание между ними [23, 24].
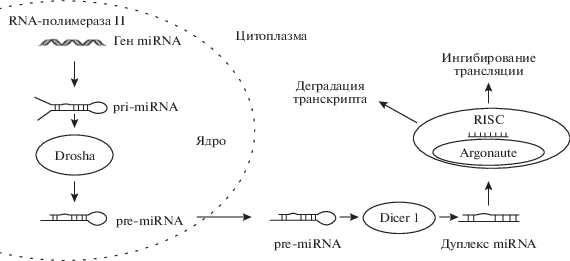
Первичные pri-miRNA транскрибируются полимеразой II со стартовых сайтов (TSS) промоторов генов miRNA и принимают форму “шпильки”. Транскрипты pri-miRNA превращаются в предшественников miRNA (pre-miRNA) под контролем Drosha и кофактора DGCR8 и транспортируются в цитоплазму. Там под воздействием рибонуклеазы RNase III Dicer они образуют зрелые miRNA в виде дуплексов, длиной примерно по 22 основания в каждой нити. Обедненные Dicer-клетки содержат редуцированное количество зрелых miRNAs. Процессинг miRNA может зависеть от клеточного типа и стадии онтогенеза (рис. 2).
Большинство miRNA имеют специфические паттерны внутриклеточной экспрессии. Одна из зрелых нитей дуплекса ассоциируется с другими молекулами и образует комплекс для репрессии трансляции или разрушения mRNA (RNA-induced silencing complex, RISC), ключевым каталитическим компонентом которого является белок Argonaute. Сеть miRNA и их мишеней очень сложна. Одна и та же miRNA может репрессировать или дестабилизировать большое число разных mRNA. Часто mRNA содержат не по одному сайту в 3'UTR для связывания с несколькими разными miRNA. Действия miRNA могут быть координированными, независимыми или избыточными [24–26].
Для воздействия на общую мишень несколько miRNA могут быть объединены в полицистронные транскрипты, кластеры. Кластерные miRNA транскрибируются совместно, но могут играть разные роли в онтогенезе. Например, у дрозофилы в один кластер объединены три miRNA (let-7, miR-125 и miR-100) с общей мишенью, транскрипционным фактором chronologically inappropriate morphogenesis (chinmo). В нервной системе дрозофилы во время развития за регуляцию chinmo в основном отвечает let-7, у взрослой особи в нервной системе функционирует miR-125. Такой двухфазный контроль chinmo сопровождается более быстрым процессингом let-7 во время развития и более низкой скоростью распада miR-125 во взрослой нервной системе. Причем одновременная утрата let-7 и miR-125 вызывает дегенерацию мозга животного. Кластерные miRNA могут перекрываться в пространстве, и их аддитивное действие дает наибольшую репрессию мишени [27].
У Drosophila melanogaster устойчивые к нуклеазам miRNA циркулируют в гемолимфе как постоянные компоненты, секретируемые клетками тканей. Специфичность, уровень экспрессии miRNA, число генов-мишеней в тканях дрозофилы зависят от возраста животных [28]. Эволюционно более древние miRNA имеют больше мишеней, чем молодые [29]. Во время развития дрозофилы miRNA контролируют основные клеточные процессы: рост клетки, дифференцировку, пролиферацию, апоптоз [30, 31]. Они могут участвовать в межклеточных коммуникациях и изменять экспрессию генов. Имеющиеся данные секвенирования позволяют предполагать, что мишенями внеклеточных miRNA у дрозофилы могут быть гены регуляции клеточных цикла, деления и смерти; сигнальных путей развития; устойчивости к стрессу; иммунного ответа и продолжительности жизни [28].
Все чаще miRNA связывают с эпигенетической регуляцией развития опухоли [32–34]. Один из способов эпигенетической регуляции с участием miRNA – посттранскрипционное подавление экспрессии TSG и модуляция их сигнальных путей. С использованием алгоритмов биоинформатики группой авторов было установлено, что LGL1 человека, ортолог l(2)gl дрозофилы, – один из предполагаемых генов-мишеней для miR-652-3p. Последовательность 3'UTR в LGL1 mRNA содержит высококонсервативную и совершенно комплементарную область в позиции от 903-го до 909-го нуклеотида для связывания с последовательностью miR-652-3p. В тканях эпителиальной опухоли легкого человека (NSCLC) и линиях нормальных клеток эпителия легких и бронхов (BEAS-2B) обнаружена обратная связь между экспрессией miR-652-3p и уровнем белка LGL1 [35].
Экспериментальное увеличение экспрессии miR-652-3p в клетках линий карциномы легкого человека (A549, Anip973, H1299) на длительное время значительно снижает уровень LGL1. Методами иммуногистохимии белок LGL1 обнаружен в опухолевых NSCLC и окружающих нормальных тканях. В опухолевых тканях с высоким уровнем miR-652-3p экспрессия LGL1 низкая, а с низким уровнем – высокая. Зависимость экспрессии LGL1 от miR-652-3p показана также с помощью искусственно сконструированных плазмид [35].
Изменение экспрессии других miRNA обнаружено при многих типах рака. Повышение по сравнению с нормой экспрессии miR-23a-27a-24 во время эритропоэза в клетках костного мозга in vitro ингибирует эритроцитарный протеом и способствует прогрессии эритролейкемии. Высокий уровень miR-23a-27a-24 обнаружен в APL (Acute promyelocytic leukemia, острый промиелолейкоз) и AML (Acute myeloid leukemia, острый миелоидный лейкоз) клеточных линиях и в содержащих ядро красных клетках крови больных лейкемией. В клетках хронической миелоидной лейкемии K562 нарушена трансляция эритроидных белков, обнаруживается только band3 mRNA, а белок band3 не образуется [36]. В линии клеток рака прямой кишки человека повышена экспрессия 18 miRNA, среди которых miR-124a [26].
Какие эпигенетические и генетические события вызывают увеличение экспрессии индивидуальных miRNA? Экспериментальное воздействие ингибитором метилирования ДНК (5-aza-2'-deoxy-cytidine, 5-Aza-CdR) и ингибитором деацетилазы гистонов (4-phenylbutyric acid, PBA) эпигенетически увеличивает уровень экспрессии некоторых miRNA. Гипометилирование гена let-7a-3 вызывает увеличение его экспрессии и онкогенные изменения. Этот ген высоко метилирован в нормальной ткани человека, но гипометилирован в клетках опухоли, например в аденокарциноме легкого [26].
Эпигенетические изменения экспрессии miRNA, которые находятся внутри интронных областей генов, могут возникать при ремоделировании хроматина гена-хозяина. Интронные miRNA и mRNA гена-хозяина происходят из общего транскрипта при совместной регуляции экспрессии. Внутри интрона гена Enah/Vasp-Like (EVL) обнаружен ген miR-342, экспрессия которого зависит от EVL. В раковых клетках под воздействием ингибиторов ДНК-метилирования и деацетилирования гистонов происходит совместное эпигенетическое усиление экспрессии интронных miRNA и mRNA гена-хозяина. Эпигенетические изменения экспрессии одних miRNA могут вызываться другими miRNA, формированием ими комплексов с белками и многими другими причинами [26, 36].
Модуляция уровня экспрессии miRNA, а также модуляция активности miRNA-RISC-комплекса, обнаружена у животных и растений после различного рода стрессовых воздействий. В условиях стресса возможно изменение процессинга miRNA и сродства miRNA-RISC к mRNA-мишеням. В линиях D. melanogaster применение теплового шока разделило чувствительные к стрессу miRNA на два класса: у одних уровень экспрессии выравнивался после воздействия, у других – он менялся только после повышения температуры содержания животных [37]. Уровень экспрессии miR-190 у дрозофилы тесно связан со стрессом, вызываемым гипоксией [38]. Возрастные уровни miRNA оказались зависимыми от стресса при ограничении калорий у мышей [28]. Стресс алкоголизма сопровождается изменением в мозге экспрессии генов. У дрозофилы алкоголь инициирует экспрессию 27 miRNA, которых нет в контроле; среди них – miR-6 и miR-310, суперэкспрессия которых значительно увеличивает чувствительность к алкоголю [39].
К генетическим событиям, увеличивающим экспрессию miRNA, можно отнести, например, амплификацию районов расположения miRNA-генов, делеции генов-супрессоров miRNA, генетические нарушения генов метилтрансфераз [32].
Можно предположить, что одним из механизмов развития опухоли у дрозофил с нормальным генотипом является эктопическое увеличение по каким-то генетическим или эпигенетическим причинам экспрессии неких miRNA в тканях с последующим эпигенетическим подавлением экспрессии генов, включая супрессор опухоли l(2)gl.
TSG РЕГУЛИРУЮТ РАННЕЕ РАЗВИТИЕ
Супрессоры опухоли являются фундаментальными генами развития со значительным плейотропным эффектом [5] (табл. 1). У дрозофилы обильная экспрессия продуктов плейотропного супрессора опухоли l(2)gl наблюдается повсеместно. Наибольшая экспрессия обнаружена в раннем эмбриогенезе и поздней третьей личиночной стадии [40]. Одна из функций гена l(2)gl связана с управлением оогенезом. Мутации гена в гомозиготном состоянии вызывают нарушения в яичниках у самок. Наблюдаемые дефекты возникают из-за нарушения полярности в клонах зародышевых клеток.
Таблица 1.
Генетическая онтология супрессора опухоли lethal (2) giant larvae у Drosophila melanogaster
| Сфера деятельности | Биологический процесс, органы дрозофилы | Ссылки |
|---|---|---|
| Супрессия онкогенеза | Контроль формирования полярности клеток | [5, 9] |
| Взаимодействие с miRNA | [28, 35] | |
| Развитие эмбриона | Оогенез | [7, 12] |
| Апоптоз | [48] | |
| Кольцевая железа | [1, 7] | |
| Первичная кишка, головной и дистальный отдел эмбриона, жировое тело, мужские половые клетки, гистолиз слюнных желез | [44] | |
| Становление приспособленности | Эмбриональная выживаемость | [5, 6, 45] |
| Продолжительность жизни имаго | [47, 55] |
В ооците нарушается полярное распределение базальных маркерных детерминант и структур цитоскелета, что приводит к аресту оогенеза и часто к формированию яйцевой камеры с 16 питающими клетками без ооцита [12, 41]. Возникает частичный некроз яйцевых камер. На переднем и заднем концах камер образуются многослойные скопления неправильной формы клеток фолликулярного происхождения, утративших полярность. Часто наблюдается неравномерное созревание яйцевых камер и перемешивание в овариолах ранних фолликулов гермариума с более поздними яйцевыми камерами [7].
В норме у дрозофил зародышевые клетки каждой цисты связаны между собой. В интеграции зародышевых клеток участвуют соединительные контакты, которые отражают контролируемую Lgl-асимметрию доменов мембраны по отношению к А-Р-оси цисты. У l(2)gl-мутантов формирование контактов и объединение клеток в цисты резко нарушаются [12, 41].
У многоклеточных животных осуществляется передача в яйцо и зиготу продуктов материнских генов, в том числе и l(2)gl. В течение первых нескольких часов эмбриогенеза они разрушаются. Деградацию материнских mRNA в это время вызывают miRNA и связывающие РНК белки [42]. Таким образом, miRNA эпигенетически могут способствовать негативному действию мутаций l(2)gl. Рецессивные мутации локуса l(2)gl у дрозофилы сопровождаются сложным фенотипическим синдромом. У гомозиготных по нуль-аллелям l(2)gl дрозофил нарушаются дифференцировка и функция кольцевой железы и утрачивается секреция экдизона. Стероидный гормон насекомых экдизон и его рецептор важны для развития, метаморфоза и контроля физиологии и продолжительности жизни взрослых особей. Изменение секреции экдизона задерживает окукливание и предоставляет дополнительное время для развития у личинки опухоли мозга и имагинальных дисков [7].
Уровень экдизона может также модулировать miR-14, регулируя экспрессию гена-рецептора экдизона EcR, который у дрозофилы компьютерным анализом идентифицирован как возможная мишень для miR-14. Экспериментальные данные показывают, что мутации miR-14 снимают ограничения для уровня экспрессии EcR. В связи с тем что мутации генов miR-14 и l(2)gl нарушают работу сигнального клеточного пути экдизона, они вызывают подобные дефекты у животных: уменьшение выживаемости во время развития и продолжительности жизни взрослых животных, усиление апоптоза и ответа на стресс [43].
Мутантный синдром гомозиготных lgl-мутантов включает гипертрофию первичной кишки, нарушения формы и размера клеток эпидермиса и эпителия кишки. Все зародыши погибают, приобретая типичные очертания из-за нарушения развития головного и дистального отделов эмбриона. Мутации lgl вызывают полную аплазию мужских половых клеток, изменяют развитие жирового тела, слюнных желез и время наступления их гистолиза. Возникновение множественных изменений у мутантов связано с участием TSG l(2)gl в передаче многих клеточных сигналов и регуляцией процессов дифференцировки и развития [7, 44].
ПРИСПОСОБЛЕННОСТЬ ИМАГО ДРОЗОФИЛЫ ЗАВИСИТ ОТ СУПРЕССОРА ОПУХОЛИ l(2)gl
Гетерозиготность по мутантным аллелям супрессора опухоли l(2)gl может оказывать позитивное или негативное влияние на биологическую приспособленность дрозофилы в зависимости от внешних воздействий и взаимодействия с другими жизненно важными генетическими факторами. Обнаружено, что в стрессовых температурных условиях на протяжении всего онтогенеза мутантные гетерозиготы l(2)gl*/+ приобретают преимущества перед гомозиготами по диким вариантам гена (+/+) по предимагинальной выживаемости в условиях конкуренции за жизненные ресурсы и по продолжительности жизни имаго.
При мягком температурном стрессе (29°С) дрозофилы с одним нормальным аллелем существенно устойчивее к повышенной температуре, чем мухи с двумя нормальными аллелями. В ответе на тепловой стресс обнаружены различия между l(2)gl-гетерозиготными самками и самцами. Смертность в разных возрастных периодах долгоживущих гетерозигот l(2)gl/+ неодинакова, характерно более позднее наступление старения и смертности в старшей возрастной группе [45].
Кратковременное воздействие повышенной температурой на формирующиеся яйцеклетки у матерей l(2)gl/+ также сообщает гетерозиготному потомству адаптивные преимущества на последующих этапах жизни по сравнению с нормальными животными, увеличивая его выживаемость. Особенно чувствительны к импульсному тепловому воздействию яйцеклетки на ранних стадиях оогенеза, возможно во время деления или детерминации стволовых клеток зародышевого пути [46] (табл. 2).
Таблица 2.
Сравнение средней продолжительности жизни гетерозиготных и контрольных дрозофил F1 от скрещивания l(+)gl/Cy × +/+ (Canton S) после теплового стресса на разные стадии проэмбрио [46]
| Генотип | Время кладки после стресса (сут) | Без стресса | ||||
|---|---|---|---|---|---|---|
| 1–2 | 3–4 | 5–6 | 7–8 | 9–10 | ||
| l(2)gl/+ | 63.1 ± 1.1* | 64.0 ± 1.3* | 57.7 ± 1.3 | 61.8 ± 1.2* | 58.0 ± 1.0* | 50.2 ± 1.4 |
| Cy/+ | 57.5 ± 1.0 | 55.6 ± 1.0 | 57.1 ± 1.1 | 56.6 ± 1.1 | 54.2 ± 0.9 | 52.7 ± 1.0 |
Механизм регуляции транскрипции через miRNA имеет место не только во время развития, но и во взрослом организме. Внешние воздействия, регулируя экспрессию и функцию miRNA, вызывают быстрое изменение метаболизма и адаптивности клетки. Разного рода стрессы у растений и животных могут нарушать процессинг miRNA, формирование комплексов miRNA–RISC и их сродство к mRNA-мишеням, стимулировать экспрессию новых miRNA. В результате снижается или увеличивается общая опосредованная miRNA репрессия генов. Ранний ответ на воздействие алкоголем у дрозофилы включал возникновение около 30 новых miRNA в мозге животных [39]. У Caenorhabditis elegans обнаружено влияние теплового стресса на состав специфического набора miRNA, связанного с жизнеспособностью во время развития [37, 38].
Первые описания, связанные с ролью miRNA в регуляции продолжительности жизни (ПЖ), были получены у мутантов lin-4 C. еlegans, когда в результате воздействия на ген-мишень ПЖ становилась короче. Подобным образом ведет себя miR-34 дрозофилы на ранних стадиях онтогенеза, продлевая ПЖ. Утрата других miRNA, например miR-1000, укорачивает ПЖ. Некоторые miRNA затрагивают ПЖ, подавляя mRNA, которые важны на ранней стадии жизненного цикла. Кластерные let-7 и miR-125, функционируя на разных стадиях онтогенеза, во время развития и во взрослой нервной системе, осуществляют контроль ПЖ. Полный репертуар miRNAs в регуляции старения и ПЖ не описан [27].
Можно предположить, что ген l(2)gl дрозофилы подвержен эпигенетической регуляции miRNA, связанными с жизнеспособностью животных. Возможно, под воздействием теплового стресса miRNA-репрессия l(2)gl ослабевает и устанавливается оптимальная для лучшей приспособленности гетерозигот l(2)gl/+ экспрессия нормального аллеля супрессора опухоли. Такая экспрессия одной дозы гена определяет организацию клеток, которая при стрессе оказывается благоприятной в смысле биологической приспособленности на уровне целого организма и популяции. Приспособленность в виде выживаемости в онтогенезе увеличивается. Возможно, свой вклад в регуляцию l(2)gl в гетерозиготе и продление жизни вносит возрастное изменение состава miRNA у дрозофил.
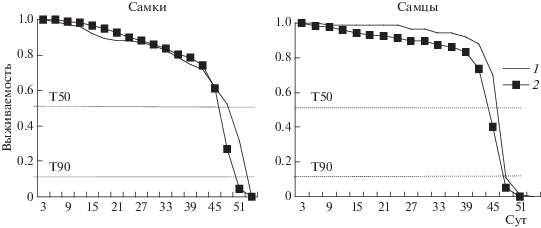
Другое воздействие на гетерозиготных l(2)gl/+-имаго – добавление синтетического фенольного антиоксиданта ТС-13 в корм дрозофилам – отрицательно сказалось на динамике смертности и значениях средней ПЖ, причем степень изменений у самок и самцов была неодинаковой. У самок понижение выживаемости наблюдали преимущественно в последние дни опыта, и отклонение средней ПЖ от контроля было небольшим и недостоверным. У самцов частота смертности была выше, чем в контроле, во всех возрастных группах животных, что внесло существенный вклад в понижение среднего значения ПЖ [47] (рис. 3).
Рис. 3.
Уменьшение выживаемости дрозофил линии l(2)gl/+ при воздействии антиоксиданта ТС-13 в концентрации 1% (2) по сравнению с контролем (1). Т50 и Т90 – гибель 50 и 90% особей [47].
Возможно, негативная реакция мутантных l(2)gl-гетрозигот на употребление антиоксиданта определяется одной из независимых функций супрессора опухоли – его участием в контроле апоптоза [48, 49]. У гетерозигот l(2)gl/+, вероятно, происходит нарушение эффективности апоптоза и их эмбриональная и имагинальная выживаемость падает уже в нормальных условиях. Употребление антиоксиданта еще больше подавляет апоптоз, что отражается на динамике старения и продолжительности жизни животных [50].
Известно, что в регуляции апоптоза участвуют miRNA. В опытах с клетками линии рака молочной железы человека обнаружено, что miR‑101 индуцирует сигнальный путь апоптоза, воздействуя на экспрессию компонентов Notch-пути [30]. В клетках рака желудка активация miR-512-5p вызывает супрессию генов, подавляющих инициацию апоптоза. В контроле клеточного цикла, апоптоза и старения задействованы молекулы miR-34a, которая в свою очередь является мишенью супрессора опухоли р53. Функция miR-652-3p также связана с репрессией путей клеточной смерти [26]. Эпигенетическое ингибирование апоптоза у гетерозигот l(2)gl/+, возможно, выполняется супрессором опухоли l(2)gl совместно с miRNA дрозофилы. Сигнальные пути, в том числе генная сеть апоптоза, между гонадами, нервной системой и кишечником координируют ПЖ целого организма.
Негативное воздействие гетерозиготности по l(2)gl-мутации на выживаемость обнаружено в компаунде с мутацией регулятора белков теплового шока, транскрипционного фактора hsf. Белок HSF, помимо активации белков теплового шока при стрессе, участвует в контроле нормального развития. Утрата функции HSF тормозит рост опухолей, возникающих в случае мутаций р53. Образуя комплекс с белком р53, HSF модулирует его транскрипционную активность при действии генотоксичных агентов [51–53]. Все мутации гена hsf у дрозофилы останавливают развитие на первой или второй личиночной стадии, гомозиготные животные нежизнеспособны [54].
В условиях температурного стресса у гетерозигот hsf1/+, так же как у гетерозигот l(2)gl*/+, значительно повышаются выживаемость во время развития, средняя ПЖ имаго и замедляется старение. У животных, гетерозиготных по двум мутациям, hsf1/+; l(2)gl/+, позитивный эффект, найденный у hsf1/+-моногетерозигот, подавляется. Возможно, в ходе онтогенеза белки HSF и Lgl взаимодействуют, и одновременное понижение дозы генов у дигетерозигот ухудшает жизнедеятельность животных [55].
Грам-отрицательная эндосимбиотическая бактерия Wolbachia колонизирует широкий круг беспозвоночных. Ранее популяционно-генетическое исследование показало, что Wolbachia влияет на ПЖ в зависимости от штамма бактерии, генотипа линии-хозяина, пола животных и температуры содержания. По этим параметрам зараженные Wolbachia линии из разных природных популяций при оптимальной и повышенной температуре содержания делятся на генотипические группы. При оптимуме содержания эндосимбионт снижает ПЖ его носителей, однако при стрессовых температурах (29°С) в части случаев эндосимбионт повышает ПЖ зараженных линий [56].
Внутриклеточный симбионт Wolbachia, используя miRNA, манипулирует экспрессией генов и активностью белков хозяина, которые определяют выживаемость инфицированных животных [57]. В серии экспериментов М. Кларка и др. [58] было обнаружено, что инфицирование бактерией особей D. simulans приводит к увеличению экспрессии mRNA и белка гена zipper в семенниках зараженных самцов. Искусственная сверхэкспрессия этого гена в семенниках трансгенных, свободных от эндосимбионта самцов D. melanogaster вызывает появление ряда хромосомных нарушений и фенотипа, характерного для цитоплазматической несовместимости в системе Wolbachia–D. melanogaster.
Белок Zipper участвует в установлении клеточной полярности зародышевых стволовых клеток. В этом процессе Zipper функционально тесно связан с продуктом опухолевого супрессора l(2)gl, белком Lgl, с которым он вступает в физическое взаимодействие [59, 60]. Оказалось, что самцы со сверхэкспрессией нормального аллеля l(2)gl в семенниках тоже индуцируют фенотип цитоплазматической несовместимости и гибель яиц [58]. Изложенные выше данные могут свидетельствовать о том, что в зараженных линиях роль l(2)gl в установлении полярности клеток и регуляции ПЖ может зависеть от деятельности бактерии Wolbachia.
ЗАКЛЮЧЕНИЕ
Мутации l(2)gl одноступенчато вызывают неопластическое перерождение специфических клеточных типов у гомозиготных животных. Формирование опухоли связано с нарушением первичной функции l(2)gl, которая состоит в эпигенетической регуляции клеточной полярности. Во время развития дрозофил в управлении оогенезом, дифференцировкой и функцией кольцевой железы, в формировании свойств приспособленности проявляется плейотропное действие нормальных аллелей l(2)gl. Деятельность локуса l(2)gl осуществляется генетическими и эпигенетическими путями, может зависеть от уровня экспрессии miRNA, наличия внутриклеточных симбионтов, мутаций других жизненно важных генов и подвержена влиянию различного рода воздействий.
Автор приносит глубокую благодарность М.Д. Голубовскому за многолетнее сотрудничество в исследованиях адаптивных свойств с использованием генетической модели супрессора опухоли l(2)gl.
Работа частично поддержана финансированием по бюджетному проекту ИЦиГ СО РАН № 0324-2018-0016.
Список литературы
Stern C., Bridges C.B. The mutants of the extreme left end of the second chromosome of Drosophila melanogaster // Genetics. 1926. V. 11. № 6. P. 505–503.
Hadorn E. An acceleration effect of normal “ring-glands” on puparium-formation in lethal larvae of Drosphila melanogaster // Proc. Natl Acad. Sci. USA. 1937. V. 23. № 9. P. 478–484.
Ajioka I., Dyer M.A. A new model of tumor susceptibility following tumor suppressor gene inactivation // Cell Cycle. 2008. V. 7. № 6. P. 735–740. doi 10.4161/ cc.7.6.5612
Омельянчук Л.В., Перцева Ю.А. Филогенетическое исследование формирования белкового семейства опухолевых супрессоров lethal(2)giant larvae // ДАН. 2010. Т. 430. № 6. С. 834–836.
Gateff E. Malignant and benign neoplasms of Drosophila melanogaster // Genetics and Biology of Drosophila. N.Y.: Acad. Press., 1978. V. 2b. P. 181–275.
Golubovsky M.D. The “lethal giant larvae” – the most frequent second chromosome lethal in natural population of D. melanogaster // Drosophila Inform. Serv. 1978. V. 53. P. 179.
Manfruelli P., Arquier N., Hanratty W.P., Semeriva M. The tumor suppressor gene, lethal(2)giant larvae (1(2)g1), is required for cell shape change of epithelial cells during Drosophila development // Development. 1996. V. 122. № 7. P. 2283–2294.
Brumby A.M., Richardson H.E. Using D. melanogaster to map human cancer pathways // Nat. Cancer Rev. 2005. V. 5. № 8. P. 626–639. doi 10.1038/nrc1671
Bilder D. Epithelial polarity and proliferation control: links from the Drosophila neoplastic tumor suppressors // Genes Dev. 2004. V. 18. № 16. P. 1909–1925. doi 10.1101/gad.1211604
Klezovitch O., Fernandez T.E., Tapscott S.J., Vasioukhin V. Loss of cell polarity causes severe brain dysplasia in Lgl1 knockout mice // Genes Dev. 2004. V. 18. № 5. P. 559–571. doi 10.1101/gad.1178004
Suzuki A., Ohno S. The PAR-aPKC system: lessons in polarity // J. Cell Sci. 2006. V. 119. № 6. P. 979–987. doi 10.1242/jcs.02898
Fichelson P., Jagut M., Lepanse S. et al. lethal giant larvae is required with the par genes for the early polarization of the Drosophila oocyte // Development. 2010. V. 137. № 5. P. 815–824.
Hutterer A., Betschinger J., Petronczki M., Knoblich J.A. Sequential roles of Cdc42, Par-6, aPKC, and Lgl in the establishment of epithelial polarity during Drosophila embryogenesis // Dev. Cell. 2004. V. 6. № 6. P. 845–854. doi 10.1016/j.devcel.2004.05.003
Prehoda K.E. Polarization of Drosophila neuroblasts during asymmetric division // Cold Spring Harb. Perspect. Biol. 2009. V. 1. № 2. P. 1–12.
Humbert P.O., Grzeschik N.A., Brumby A.M. et al. Control of tumourigenesis by the Scribble/Dlg/Lgl polarity module // Oncogene. 2008. V. 27. № 55. P. 6888–6907. doi 10.1038/onc.2008.341
Torok I., Hartenstein K., Kalmes A. et al. The l(2)gl homologue of Drosophila pseudoobscura suppresses tumorigenicity in transgenic Drosophila melanogaster // Oncogene. 1993. V. 8. № 6. P. 1537–1549.
Chia W., Somers W.G., Wang H. Drosophila neuroblast asymmetric divisions: cell cycle regulators, asymmetric protein localization, and tumorigenesis // J. Cell Biol. 2008. V. 180. № 2. P. 267–272. doi 10.1083/ jcb.200708159
Li Q., Shen L., Xin T. et al. Role of Scrib and Dlg in anterior-posterior patterning of the follicular epithelium during Drosophila oogenesis // BMC Developm. Biology. 2009. V. 9. № 1. P. 60. doi 10.1186/1471-213X-9-60
Danen E.H., Sonnenberg A. Integrins in regulation of tissue development and function // J. Pathol. 2003. V. 201. № 4. P. 632–641. doi 10.1002/path.1472
Golubovskaya V.M., Cance W.G. FAK and p53 protein interactions // Anticancer Agents Med. Chem. 2011. V. 11. № 7. P. 617–619.
Palmer R.H., Fessler L.I., Edeen P.T. et al. DFak56 is a novel Drosophila melanogaster focal adhesion kinase // J. Biol. Chem. 1999. V. 274. № 50. P. 35621–35629.
Landgraf P., Rusu M., Sheridan R. et al. A mammalian microRNA expression atlas based on small RNA library sequencing // Cell. 2007. V. 129. № 7. P. 1401–1414. doi 10.1016/j.cell.2007.04.040
Ventura A., Jacks T. MicroRNAs and cancer: short RNAs go a long way // Cell. 2009. V. 136. № 4. P. 586–591. doi 10.1016/j.cell.2009.02.005
Pipan V., Zorc M., Kunej T. MicroRNA polymorphisms in cancer: a literature analysis // Cancers (Basel). 2015. V. 7. № 3. P. 1806–1814. doi 10.3390/cancers7030863
Sun D., Yu F., Ma Y. et al. MicroRNA-31 activates the RAS pathway and functions as an oncogenic microRNA in human colorectal cancer by repressing RAS p21 GTPase activating protein 1 (RASA1) // J. Biol. Chem. 2013. V. 288. № 13. P. 9508–9518. doi 10.1056/NEJMoa1214609
Saito Y., Saito H., Liang G., Friedman J.M. Epigenetic alterations and microRNA misexpression in cancer and autoimmune diseases: a critical review // Clin. Rev. Allergy. Immunol. 2014. V. 47. № 2. P. 128–135. doi 10.1007/s12016-013-8401-z
Chawla G., Deosthale P., Childress S. et al. A let-7-to-miR-125 microRNA switch regulates neuronal integrity and lifespan in Drosophila // PLoS Genet. 2016. V. 12. № 8. P. 1–29. doi 10.1371/journal.pgen.1006247
Dhahbi J.M., Atamna H., Li R. et al. MicroRNAs circulate in the hemolymph of Drosophila and accumulate relative to tissue microRNAs in an age-dependent manner // Genomics Insights. 2016. V. 9. P. 29–39. doi 10.4137/GEI.S38147
Nozawa M., Fujimi M., Iwamoto C. et al. Evolutionary transitions of microRNA-target pairs // Genome Biol. Evol. 2016. V. 8. № 5. P. 1621–1633. doi 10.1093/ gbe/evw092
Guan H., Dai Z., Ma Y. et al. MicroRNA-101 inhibits cell proliferation and induces apoptosis by targeting EYA1 in breast cancer // Int. J. Mol. Med. 2016. V. 37. № 6. P. 1643–1651. doi 10.3892/ijmm.2016.2557
Yang H., Li M., Hu X. et al. MicroRNA-dependent roles of Drosha and Pasha in the Drosophila larval ovary morphogenesis // Dev. Biol. 2016. V. 416. № 2. P. 312–323. doi 10.1016/j.ydbio.2016.06.026
Calin G.A., Croce C.M. MicroRNA-cancer connection: the beginning of a new tale // Cancer Res. 2006. V. 66. № 15. P. 7390–7394. doi 10.1158/0008-5472.CAN-06-0800
Daikoku T., Hirota Y., Tranguch S. et al. Conditional loss of uterine Pten unfailingly and rapidly induces endometrial cancer in mice // Cancer Res. 2008. V. 68. № 14. P. 5619–5627. doi 10.1158/0008-5472.CAN-08-1274
Tekirdag K.A., Akkoc Y., Kosar A., Gozuacik D. MIR-376 family and cancer // Histol. Histopathol. 2016. V. 31. № 8. P. 841–855. doi 10.14670/HH-11-752
Yang W., Zhou C., Luo M. et al. MiR-652-3p is upregulated in non-small cell lung cancer and promotes proliferation and metastasis by directly targeting Lgl1 // Oncotarget. 2016. V. 7. № 13. P. 16703–16715. doi 10.18632/oncotarget.7697
Zhang Y.C., Ye H., Zeng Z. et al. The NF-κB p65/miR-23a-27a-24 cluster is a target for leukemia treatment // Oncotarget. 2015. V. 6. № 32. P. 33554–33567. doi 10.18632/oncotarget.5591
Funikov S.Y., Ryazansky S.S., Kanapin A.A. Interplay between RNA interference and heat shock response systems in Drosophila melanogaster // Open Biol. 2016. V. 6. № 10. P. 13. doi 10.1098/rsob.160224
De Lella Ezcurra A.L., Bertolin A.P., Kim K. et al. miR-190 enhances HIF-dependent responses to hypoxia in Drosophila by inhibiting the prolyl-4-hydroxylase Fatiga // PLoS Genet. 2016. V. 12. № 5. P. 1–24. doi 10.1371/journal.pgen.1006073
Ghezzi A., Zomeno M., Pietrzykowski A.Z., Atkinson N.S. Immediate-early alcohol-responsive miRNA expression in Drosophila // J. Neurogenet. 2016. V. 30. № 3–4. P. 195–204. doi 10.1080/01677063.2016.1252764
Mechler B.M., McGinnis W., Gehring W.J. Molecular cloning of lethal(2)giant larva, a recessive oncogene of Drosophila melanogaster // EMBO J. 1985. V. 4. № 6. P. 1551–1557.
Cox D.N., Seyfried S.A., Jan L.Y., Jan Y.N. Bazooka and atypical protein kinase C are required to regulate oocyte differentiation in the Drosophila ovary // Proc. Natl Acad. Sci. USA. 2001. V. 98. № 25. P. 14475–14480. doi 10.1073/pnas.261565198
Luo H., Li X., Claycomb J.M., Lipshitz H.D. The Smaug RNA-binding protein is essential for microRNA synthesis during the Drosophila maternal-to-zygotic transition // Genes, Genomes, Genetics (G3). 2016. V. 6. P. 3541–3551. doi 10.1534/g3.116.034199
Varghese J., Cohen S.M. MicroRNA miR-14 acts to modulate a positive autoregulatory loop controlling steroid hormone signaling in Drosophila // Genes Dev. 2007. V. 21. № 18. P. 2277–2782. doi 10.1101/gad.439807
De Lorenzo C., Mechler B.M., Bryant P.J. What is Drosophila telling us about cancer? // Cancer Metastasis Rev. 1999. V. 18. № 3. P. 295–311.
Golubovsky M.D., Weisman N.Y., Arbeev K.G. et al. Decrease in the lgl tumor suppressor dose in Drosophila increases survival and longevity in stress conditions // Exp. Geront. 2006. V. 41. № 9. P. 819–827. doi 10.1016/j.exger.2006.06.035
Вайсман Н.Я., Голубовский М.Д. Стресс на стадии формирования яйцеклеток влияет на выживаемость и долголетие потомков: роль опухолевого супрессора lgl в модельных экспериментах на дрозофиле // ДАН. 2008. Т. 419. № 1. С. 130–135.
Вайсман Н.Я., Голубовский М.Д., Зенков Н.К. и др. Вариабельность действия экзогенного антиоксиданта на выживаемость: моделирование на линиях дрозофилы, разных по продолжительности жизни и дозе онкосупрессора l(2)gl // Изв. РАН. Серия биол. 2010. № 3. С. 300–307.
Farkas R., Mechler B.M. The timing of Drosophila salivary gland apoptosis displays an l(2)gl-dose response // Cell Death Differ. 2000. V. 7. P. 89–101. doi 10.1038/sj.cdd.4400621
Grzeschik N.A., Amin N., Secombe J. et al. Abnormalities in cell proliferation and apico-basal cell polarity are separable in Drosophila lgl mutant clones in the developing eye // Dev. Biology. 2007. V. 311. № 1. P. 106–123. doi 10.1016/j.ydbio.2007.08.025
Ralser M., Lehrach H. Building a new bridge between metabolism, free radicals and longevity // Aging (Albany NY). 2009. V. 1. № 10. P. 836–838. doi 10.18632/ aging.100089
Horng-Dar W., Kazemi-Esfarjani P., Benzer S. Multiple-stress analysis for isolation of Drosophila longevity genes // PNAS. 2004. V. 101. № 34. P. 12610–12615.
Dai C., Whitesell L., Rogers A.B., Lindquist S. Heat shock factor 1 is a powerful multifaceted modifier of carcinogenesis // Cell. 2007. V. 130. № 6. P. 1005–1018. doi 10.1016/j.cell.2007.07.020
Logan I.R., McNeill H.V., Cook S. et al. Heat shock factor-1 modulates p53 activity in the transcriptional response to DNA damage // Nucl. Acids Res. 2009. V. 37. № 9. P. 2962–2973. doi 10.1093/nar/gkp180
Jedlicka P., Mortin M.A., Wu C. Multiple functions of Drosophila heat shock transcription factor in vivo // EMBO J. 1997. V. 16. № 9. P. 2452–2462.
Вайсман Н.Я., Евгеньев М.Б., Голубовский М.Д. Параллелизм и парадоксальность действия на жизнеспособность и продолжительность жизни мутаций регулятора белков теплового шока hsf1 и онкосупрессора l(2)gl у D. melanogaster // Изв. РАН. Серия биол. 2012. № 1. С. 27–34.
Вайсман Н.Я., Голубовский М.Д., Илинский Ю.Ю. Различия в параметрах продолжительности жизни и ее пол-специфичности в популяциях человека и их моделирование на дрозофиле // Успехи геронтологии. 2013. Т. 26. № 1. С. 66–75.
Zhang G., Hussain M., Asgari S. Regulation of arginine methyltransferase 3 by a Wolbachia-induced microRNA in Aedes aegypti and its effect on Wolbachia and dengue virus replication // Insect Biochem. Mol. Biol. 2014. V. 53. P. 81–88. doi 10.1016/j.ibmb.2014.08.003
Clark M.E., Heath B.D., Anderson C.L., Karr T.L. Induced paternal effects mimic cytoplasmic incompatibility in Drosophila // Genetics. 2006. V. 173. P. 727–734. doi 10.1534/genetics.105.052431
Strand D., Jakobs R., Merdes G. et al. The Drosophila lethal(2)giant larvae tumor suppressor protein forms homo-oligomers and is associated with nonmuscle myosin II heavy chain // J. Cell Biol. 1994. V. 127. P. 1361–1373.
Peng C.Y., Manning L., Albertson R., Doe C.Q. The tumour-suppressor genes lgl and dlg regulate basal protein targeting in Drosophila neuroblasts // Nature. 2000. V. 408. P. 596–600. doi 10.1038/35046094
Дополнительные материалы отсутствуют.