Генетика, 2019, T. 55, № 3, стр. 312-324
Обыкновенный хомяк (Cricetus cricetus) в Предкавказье: генетическая структура городских и пригородных популяций
Н. Ю. Феоктистова 1, *, И. Г. Мещерский 1, П. Л. Богомолов 1, С. И. Мещерский 2, Н. С. Поплавская 1, М. М. Чунков 3, В. В. Юферева 4, В. А. Тельпов 5, А. В. Суров 1
1 Институт проблем экологии и эволюции им А.Н. Северцова Российской академии наук
119071 Москва,, Россия
2 Московский педагогический государственный университет, кафедра зоологии и экологии
129164 Москва, Россия
3 Прикаспийский институт биологических ресурсов Дагестанского научного центра
Российской академии наук
367000 Махачкала,, Россия
4 Национальный парк “Кисловодский”
357700 Кисловодск,, Россия
5 Межрайонная территориальная станция юных натуралистов
города-курорта Кисловодска
357700 Кисловодск, Россия
* E-mail: feoktistovanyu@gmail.com
Поступила в редакцию 30.03.2018
После доработки 19.06.2018
Принята к публикации 04.06.2018
Аннотация
На основе анализа аллельного состава 10 микросателлитных локусов и нуклеотидных последовательностей мтДНК исследовали генетическую структуру обыкновенного хомяка в городах и сельских населенных пунктах Предкавказья. Показано, что в условиях собственно города население этого вида представлено обособленными группами, генетические различия между которыми высоки и не связаны с с расстоянием между ними. На окраинах городов, примыкающих к незастроенным или озелененным участкам, и далее в сельской местности степень изолированности соседних поселений хомяка снижается, а уровень генетических различий между ними начинает соответствовать разделяющему поселения расстоянию. В ходе работы этот вид впервые зарегистрирован на территории наиболее восточной части Предкавказья – в Республике Дагестан.
Традиционно урбанизацию рассматривают как негативное явление для биоты. Однако для ряда видов измененные в процессе урбанизации параметры окружающей среды оказываются не только приемлемыми, но и благоприятными для существования. Такие виды, как правило, являются эврибионтами и эврифагами с высокой плодовитостью и обширными ареалами [1–3] и могут быстро осваивать новые местообитания, заселяя города и становясь полноценными синурбистами. Примером такого вида является обыкновенный хомяк (Cricetus cricetus), который на фоне катастрофического снижения численности на большей части ареала в последние десятилетия начал активно заселять города как Западной Европы [4, 5], так и России [2, 3, 5] и Казахстана [6].
Исследование генетической структуры популяций видов-синурбистов позволяет выявить такие особенности, связанные с освоением городской среды, как характер использования пространства, степень изолированности отдельных поселений, уровень поддерживаемого генетического разнообразия.
Ранее на примере г. Симферополя [7] нами было показано, что городские поселения обыкновенного хомяка могут быть представлены отдельными группами (демами), которым присуща высокая степень генетической обособленности. Остается, однако, открытым вопрос, в какой степени такие особенности пространственной структуры популяций определяются именно условиями обитания в городе, а в какой – являются характерными для вида в целом, вне прямой зависимости от заселяемых биотопов. Для прояснения этого вопроса было желательным исследовать структуру населения хомяка в других городах, а также на окружающей их не урбанизированной территории.
Еще одним регионом, на территории которого обыкновенный хомяк в значительном количестве встречается в городах, является Предкавказье. Об обитании хомяка в г. Владикавказе еще в первой половине XX в. писал С.И. Огнев [8]. В Кисловодске и Нальчике этот вид обитает примерно с 70-х годов XX столетия (личное сообщение Ф.А. Темботовой).
Цель данной работы – определение особенностей генетической структуры обыкновенного хомяка в городах и пригородах Предкавказья для выявления общих закономерностей заселения этим видом урбаценозов.
МАТЕРИАЛЫ И МЕТОДЫ
Использованный материал. Основной использованный для проведения популяционного анализа материал был собран в г. Кисловодске (Ставропольский край) и северной части Кабардино-Балкарской Республики (КБР), включая г. Нальчик с окрестностями (рис. 1, табл. 1). Материал собирали в апреле–сентябре 2015 и 2016 гг. Большая часть образцов тканей получена от трупов животных, добытых владельцами садово-огородных участков или частных домов либо раздавленных на автодорогах. В парковой зоне г. Нальчик хомяков отлавливали живоловками, отбирали для анализа небольшие участки ушной раковины и выпускали.
Рис. 1.
Район работ и места сбора материала. В верхней части рисунка квадрат соответствует району сбора образцов, использованных при анализе популяционной структуры (нижняя часть рисунка), граница соответствует южной границe России. В нижней части рисунка оконтуривающие линии демонстрируют характер разделения совокупной выборки на две обособленные генетически однородные группы при анализе методом кластеризации. Расположение и характеристика точек сбора 1a–1g, 2–4, 5a–5e, 6–10 – см. табл. 1 и текст.
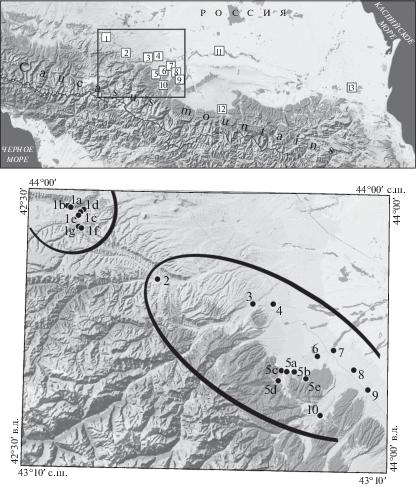
Таблица 1.
Места сбора образцов ткани обыкновенного хомяка, использованных при анализе популяционной структуры вида в населенных пунктах
| Обозначение выборки* | Место сбора | Число образцов | ||
|---|---|---|---|---|
| всего | в том числе 2015 г. | в том числе 2016 г. | ||
| 1a | Северный пригород г. Кисловодска, пос. Мирный, район частной застройки | 1 | 1 | 0 |
| 1b | Северный пригород г. Кисловодска, сад. т-во “Виктория”, район частной застройки | 3 | 1 | 2 |
| 1c | Северная часть г. Кисловодска, территория станции Юннатов | 22 | 12 | 10 |
| 1d | Северная часть г. Кисловодска, садовый участок на ул. Чехова | 11 | 0 | 11 |
| 1e | Центральная часть г. Кисловодска, садовый участок на ул. Героев Медиков | 6 | 6 | 0 |
| 1f | Южная часть г. Кисловодска, садовый участок на ул. Донская | 16 | 12 | 4 |
| 1g | Южная часть г. Кисловодска, садовый участок на ул. Пчелиная | 2 | 2 | 0 |
| 2 | с. Каменномостское Зольского р-на КБР, садовый участок | 1 | 0 | 1 |
| 3 | с. Исламей Баксанского р-на КБР, садовый участок | 1 | 0 | 1 |
| 4 | с. Дыгулыбгей Баксанского р-на КБР, садовый участок | 1 | 0 | 1 |
| 5а | г. Нальчик, западная часть города, парки и скверы** | 10 | 6 | 4 |
| 5b | г. Нальчик, южная часть города, р-н Вольный Аул, территория частной застройки | 5 | 1 | 4 |
| 5c | Западный пригород г. Нальчика, р-н “5-й микрорайон”, территория частной застройки | 3 | 3 | 0 |
| 5d | Юго-западный пригород г. Нальчика, с. Белая Речка | 2 | 0 | 2 |
| 5e | Южные окрестности г. Нальчикa, СНТ “Ветеран-2” (Черекский р-н КБР) | 1 | 1 | 0 |
| 6 | с. Нартан Чегемского р-на КБР, садовый участок | 4 | 0 | 4 |
| 7 | СНТ “Химик” Урванского р-на КБР | 7 | 0 | 7 |
| 8 | с. Старый Черек Урванского р-на КБР, садовый участок | 1 | 0 | 1 |
| 9 | с. Аргудан Лескенского р-на КБР, садовый участок | 8*** | – | – |
| 10 | с. Зарагиж Черекского р-на КБР, садовый участок | 2 | 0 | 2 |
| Всего: | 107 | 45 | 54 | |
Выборки 1–10 (табл. 1, рис. 1) были использованы при проведении популяционного анализа. Для этих образцов определяли как последовательности митохондриальной ДНК (мтДНК), так и аллельный состав микросателлитных локусов. Для оценки характера распределения митохондриальных линий в пределах региона были также определены нуклеотидные последовательности мтДНК для одной особи из района г. Владикавказа (Республика Северная Осетия, рис. 1, выборка 12) и двух особей из с. Чонтаул Кизилюртовского района Республики Дагестан (рис. 1, выборка 13). При анализе отношений между гаплотипами мтДНК дополнительно были использованы последовательности шести хомяков из Предкавказья, исследованных ранее [7]: двух особей из с. Аргудан Лескенского р-на КБР, одной особи из ближайших пригородов г. Нальчика, одной особи из г. Моздока (Республика Северная Осетия, рис. 1, выборка 11) и двух особей из Ставропольского края без уточнения точки сбора (выборка 0).
Молекулярно-генетический анализ. Собранные образцы ткани фиксировали в 96%-ном этаноле. Выделение ДНК проводили либо вручную с использованием набора реагентов Diatom DNA Prep 100 (OOO “Лаборатория Изоген”, Россия), либо на процессоре магнитных частиц KingFisher Flex Magnetic Particle Processor (Thermo Scientific, Финляндия) с использованием набора реагентов InviMag Tissue DNA Mini Kit/KF96 (STRATEC Molecular, Германия). Последующую постановку ПЦР осуществляли на основе смеси Mag Mix 2025 (ЗАО “Диалат”, Россия). Праймеры были синтезированы в НПК “Синтол” (Москва).
В качестве маркера филогенетических линий были использованы два локуса мтДНК: контрольный регион и ген цитохрома b (cytb). В ходе индивидуального генотипирования определяли аллельный состав 10 микросателлитных локусов (Ccrμ3, Ccrμ4, Ccrμ10, Ccrμ11, Ccrμ12, Ccrμ13, Ccrμ15, Ccrμ17, Ccrμ19, Ccrμ20, состав праймеров – по [9]). Условия амплификации и методы определения нуклеотидных последовательностей мтДНК и аллельного состава микросателлитных локусов были описаны ранее [7]. Варианты нуклеотидных последовательностей (гаплотипы), впервые обнаруженные в ходе данного исследования, депонированы в базе данных GenBank под номерами MG991807–813.
Математическая обработка полученных данных. Построение медианной сети вариантов нуклеотидных последовательностей двух объединенных участков мтДНК методом Median Joining выполняли в программе Network 4.612 [10].
Принадлежность особей обобщенной выборки к одной из потенциальных популяций на основе данных об аллельном составе микросателлитных локусов оценивали методом кластеризации, реализованным в программе Structure v. 2.3.4 [11]. В случае использования в анализе данных о гаплотипах мтДНК цифровое обозначение гаплотипа включали в матрицу как дополнительный гомозиготный локус. Значение логарифма вероятности (Mean LnP(K)) для каждого значения K (предполагаемое число популяций) рассчитывали как среднее из пяти последовательных оценок на основе 100 000 реплик burnin и 500 000 реплик основного анализа. Значение показателя Delta K (Evanno method) оценивали в программе STRUCTURE HARVESTER [12].
Определение уровня генетических различий между группами особей по частотам встречаемости гаплотипов мтДНК и аллелей микросателлитных локусов (FST-критерий), оценку ожидаемой и наблюдаемой гетерозиготности, числа аллелей и соответствия распределения их частот правилу Харди–Вайнберга, уровня гаплотипического разнообразия мт-линий в анализируемых выборках, а также оценку соответствия наблюдаемых генетических дистанций расстоянию между районами сбора (тест Мантеля) проводили с использованием программы Arlequin v. 3.11 [13].
Показатель относительного числа аллелей (allelic richness) и общего генетического разнообразия (averaged gene diversity over loci) определяли с использованием программы FSTAT v. 2.9.3 [14, 15]. Определение генетических дистанций (Da) между выборками и их визуализацию (кладограмма, построенная методом Neighbour Joining) проводили с помощью программы POPTREEW [16] с оценкой бутстреп-поддержки узлов на основании 100 000 реплик. Для дополнительной оценки соответствия наблюдаемых соотношений частот аллелей равновесию Харди–Вайнберга (global test: heterozygote deficiency) использовали программу Genepop v. 4.0.7 [17].
РЕЗУЛЬТАТЫ
Характер распределения митохондриальных линий
В обобщенной выборке был отмечен 31 гаплотип объединенного участка (1803 пн) фрагмента гена cytb (924 пн) и контрольного региона (879 пн). Девять из них выявлены впервые (табл. 2) и 22 были отмечены для территории Предкавказья ранее [18]. Медианная сеть отмеченных в Предкавказье гаплотипов показана на рис. 2.
Таблица 2.
Гаплотипы объединенного участка фрагмента гена цитохрома b и контрольного региона мтДНК обыкновенного хомяка, впервые отмеченные в ходе данного исследования
| Обозначение гаплотипа | Номер в Генбанке (cytb + dloop) |
|---|---|
| 4104Na | KY748062 + MG991812 |
| 4106Na | KY748062 + MG991813 |
| 4102N27 | MG991807 + KY748083 |
| 4016N27 | MG991808 + KY748087 |
| 4110NV | KY748064 + KY748080 |
| 4018NV | MG991809 + KY748082 |
| 4021NDg | MG991811+ KY748087 |
| 4114KN | MG991810 + KY748083 |
| 4103NBl | KY748063 + KY748083 |
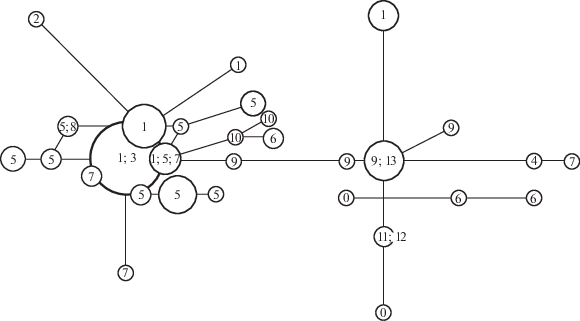
Рис. 2.
Медианная сеть гаплотипов мтДНК (фрагмент гена цитохрома b и контрольный регион, всего 1803 пн) обыкновенного хомяка, известных с территории Предкавказья. Метод Median Joining. Минимальное расстояние между кружками соответствует одной нуклеотидной замене. Числа соответствуют районам, в которых был встречен данный гаплотип: 1–10 – см. табл. 1; 11 – г. Моздок, 12 – окр. г. Владикавказа, 13 – Кизилюртовский р-н Республики Дагестан, 0 – Ставропольский край (точное место сбора неизвестно).
Анализ обобщенной выборки (локалитеты 1–10, 107 особей) методом кластеризации проводили с использованием данных о частоте гаплотипов мтДНК, так как расстояние между точками сбора в этом случае могло значительно превышать дистанцию индивидуальных миграций животных. Максимальное значение показателя Delta K (1510.8, при среднем значении показателя LnP(K) = = –3670.0) в этом случае было отмечено при тестировании гипотезы K = 2 (рис. 3). Выборка однозначно разделялась на два кластера, один из которых соответствовал особям из г. Кисловодска с ближайшими пригородами (n = 61). Второй кластер был представлен особями со всей остальной проанализированной территории (n = 46), включая (с вероятностью 92%) и особь из с. Каменномостского (выборка 2), расположенного гораздо ближе к Кисловодску (около 30 км), чем к Нальчику (около 50 км). К этому же кластеру одновременно относились (с вероятностью 82–99%) особи Баксанского (выборки 3, 4) и Черекского (выборка 10) районов КБР, расположенных на расстоянии более 40 км друг от друга.
Рис. 3.
Результаты анализа обобщенной выборки (107 особей) методом кластеризации с использованием данных о составе последовательностей мтДНК. Модель admixture. Обозначения выборок соответствуют указанным в табл. 1.
Генетическая дистанция между “кисловодским” и “кабардино-балкарским” кластерами (FST критерий на основе только частот аллелей микросателлитных локусов) составила 12.1%. При этом в выборке из г. Кисловодска на относительно небольшой площади (максимальное расстояние между точками сбора около 8 км) был отмечен сходный и даже более высокий общий уровень генетического разнообразия (0.723, суммарное число отмеченных аллелей 66), чем на всей остальной исследованной территории, с расстоянием между наиболее удаленными точками до 90 км (0.696, 70 аллелей). Однако число митохондриальных гаплотипов, отмеченных в Кисловодске (6 гаплотипов, индекс гаплотипического разнообразия H = 0.477) было существенно ниже, чем на всей остальной исследованной территории (21 гаплотип, H = 0.936). В то же время четыре из шести гаплотипов, отмеченных в Кисловодске, на остальной исследованной территории встречены не были.
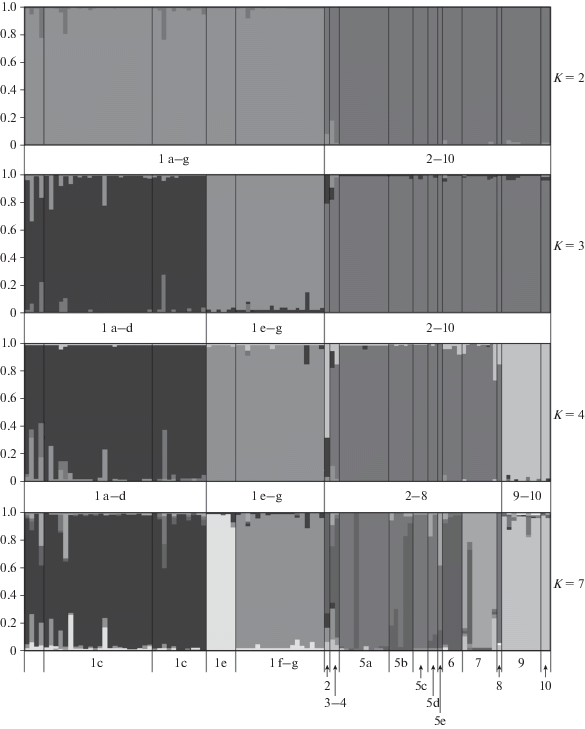
Результат тестирования гипотезы K = 3 соответствовал разделению выборки из г. Кисловодска на два обособленных кластера, соответствующих северной части города с пригородами (выборки 1a–d) и центральной и южной частям города (выборки 1e–1g), при сохранении всей совокупности особей из КБР как единого кластера (рис. 3). Только при тестировании гипотезы K = 4 выборка из КБР разделилась на кластер, соответствующий особям из наиболее южных районов сбора (выборки 9 и 10), и кластер, объединяющий всех остальных особей, за исключением одного хомяка из с. Каменномостское Зольского р-на (выборка 2), статус которого оказался неопределенным.
Минимальное среднее значение показателя LnP(K) (–3098.96) было отмечено для гипотезы K = 7, результаты тестирования которой в целом соответствовали разделению выборки из г. Кисловодска на три кластера, соответствующих особям, отловленным в северной (выборки 1a–1d), центральной (выборка 1e) и южной (выборки 1f–1g) частях города. Разделение выборки из КБР в этом случае в целом соответствовало четырем кластерам: особям из южных районов (выборки 9 и 10), особям из Урванского р-на (выборка 7), из с. Нартан (выборка 6) и группе особей, отловленных в пределах городской территории и ближайших окрестностях г. Нальчика (выборки 5a–d). Статус ряда особей, представляющих малочисленные (n = 1–3) выборки, собранные в удалении от остальных (в Зольском, Баксанском, Урванском, Черекском р-нах КБР) и в ближайших пригородах обоих городов, начиная с предположения о K = 3 чаще всего оказывался неопределенным (рис. 3).
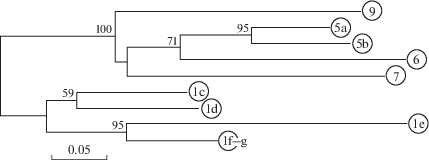
Обособленность хомяков, обитающих в Кисловодске, от животных с территории исследованных районов КБР, а в пределах каждой из этих территорий – основных выборок друг от друга, демонстрирует и анализ, основанный на прямой оценке генетических дистанций (рис. 4).
Рис. 4.
Результаты анализа генетических дистанций (Da с учетом данных о мтДНК гаплотипах) между выборками (n > > 3) обыкновенного хомяка из разных районов методом Neighbour Joining. Обозначения выборок соответствуют указанным в табл. 1. Числа в узлах кладограммы – величины бутстреп-поддержки.
Дальнейший анализ методом кластеризации проводили отдельно для выборок из г. Кисловодска (n = 61) и с территории КБР (n = 32). Анализируемая совокупность особей из КБР на данном этапе была ограничена выборками 5 (парковая зона г. Нальчика и ближайших окрестностей), 6 (с. Нартан) и 7 (Урванский р-н). Учитывая, что расстояние между отдельными точками сбора в этом варианте анализа не превышало нескольких километров, данные о распределении мт-гаплотипов использованы не были.
Следует отметить, что во всех случаях метод кластеризации не выявлял различий между особями, собранными в одной точке в разные годы. Для двух максимальных по объему из имеющихся у нас выборок животных разных лет (Кисловодск, 1c: 2015 г. – n = 12, 2016 г. – n = 10; парковая зона г. Нальчикa, 5a: 2015 г. – 6 особей, 2016 г. – 4 особи) межгодовые отличия были оценены с использованием показателя FST. В обоих случаях отличия оказались невысокими и статистически недостоверными (1.4%, p = 0.158 и 5.7%, p = 0.074 соответственно).
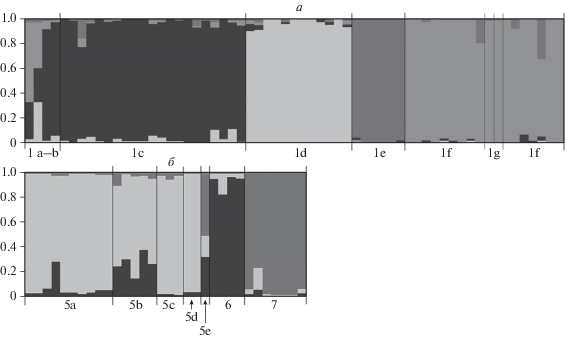
При анализе выборки из г. Кисловодска наибольшее значение показателя Delta K (896) соответствовало гипотезе K = 2, с разделением выборки по группам, соответствующим северной (1c–1d, в этом же кластере – три из четырех особей, собранных в северном пригороде, выборки 1a–1b) и центральной и южной (1e–1g) частям города. Среднее значение показателя LnP(K) в данном случае составило –1703. Минимальное среднее значение показателя LnP(K) (–1560) соответствовало гипотезе K = 4 и отражало разделение совокупной выборки на особей из точек сбора 1c, 1d, 1e и 1f + 1g (рис. 5, 6,а).
Рис. 5.
Взаимное расположение точек сбора образцов, использованных в популяционном анализе. Обозначения выборок соответствуют номерам в табл. 1.
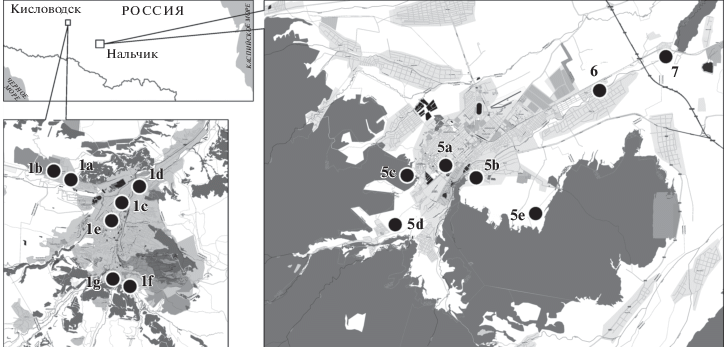
Рис. 6.
Результаты кластерного анализа региональных выборок (без учета данных о гаплотипах мтДНК), соответствующие минимальному значению показателя LnP(K). а – выборка из г. Кисловодска, n = 61, K = 4, модель admixture, две особи выборки 1g, входящие в состав кластера “южная часть города” (1f + 1g), показаны дополнительными вертикальными линиями; б – выборка из окрестностей г. Нальчика, n = 32, K = 3, модель admixture LOCPRIOR.
Попарные генетические дистанции, рассчитанные для этих групп, приведены в табл. 3 (все отличия статистически достоверны при p < 0.0001). Следует отметить, что в северной и центральной части города, в области плотной застройки, выборки из точек, разделенных расстоянием 1.3–1.5 км (1c и 1d, 1c и 1e), не только образуют отдельные кластеры, но характеризуются очень высоким уровнем генетических отличий (11.8 и 25.1% соответственно). В то же время в южной части города, примыкающей к курортной зоне, особи, пойманные в разделенных сходным расстоянием (1.2 км) точках 1f и 1g, с вероятностью более 97% относились к единому кластеру.
Таблица 3.
Попарные генетические дистанции (FST) между основными выборками хомяков из разных районов г. Кисловодска (%)
| Выборка | 1c (“Станция Юннатов”), n = 22 | 1d (ул. Чехова), n = 11 | 1e (ул. Героев Медиков), n = 6 | 1f + 1g (ул. Донская и Пчелиная), n = 8 |
|---|---|---|---|---|
| 1d | 11.80 | – | ||
| 1e | 25.12 | 33.40 | – | |
| 1f + 1g | 13.59 | 18.85 | 21.54 | – |
Показатели генетического разнообразия в исследованных популяционных выборках представлены в табл. 4. В Кисловодске для каждой из локальных выборок эти показатели оказываются заметно ниже, чем для города в целом. В то же время для каждой из локальных групп отмечено соответствие частот аллелей равновесию Харди–Вайнберга, не соблюдающемуся при рассмотрении всего населения хомяка в городе как единой популяции. Тест Мантеля для четырех рассмотренных локальных групп не выявил корреляции между генетическими дистанциями и расстоянием, разделяющим места сбора выборок (r = –0.237, p = 0.660).
Таблица 4.
Показатели генетического разнообразия в основных выборках хомяков из окрестностей г. Кисловодска (1c–1g) и Нальчика (5а–10)
| Выборка | n | Al | Ar | Div | HE | HO | l(HW) | p(HW) | h |
|---|---|---|---|---|---|---|---|---|---|
| 1c | 22 | 44 | 3.7 | 0.672 | 0.672 | 0.690 | 10/0 | 0.872 | 4 |
| 1d | 11 | 37 | 3.5 | 0.645 | 0.646 | 0.681 | 9/1 | 0.831 | 1 |
| 1e | 6 | 22 | 2.2 | 0.373 | 0.424 | 0.519 | 10/0 | 0.994 | 2 |
| 1f + 1g | 18 | 48 | 3.8 | 0.640 | 0.639 | 0.600 | 9/1 | 0.100 | 3 |
| 1c + 1d + 1e + 1f + 1g | 57 | 64 | н/о | 0.721 | 0.723 | 0.636 | 3/7 | 0.001 | 6 |
| 5а | 10 | 38 | 3.1 | 0.612 | 0.613 | 0.620 | 9/1 | 0.440 | 3 |
| 5b | 5 | 36 | 3.3 | 0.618 | 0.611 | 0.560 | 10/0 | 0.160 | 3 |
| 5a + 5b + 5c + 5d | 20 | 44 | 3.2 | 0.624 | 0.622 | 0.572 | 10/0 | 0.025 | 8 |
| 6 | 4 | 30 | 3.0 | 0.609 | 0.611 | 0.625 | 10/0 | 0.687 | 3 |
| 7 | 7 | 34 | 2.9 | 0.568 | 0.566 | 0.543 | 8/2 | 0.243 | 4 |
| 5a–5e + 6 + 7 | 32 | 58 | н/о | 0.653 | 0.673 | 0.577 | 8/2 | 0.001 | 14 |
| 9 | 8 | 35 | 2.9 | 0.572 | 0.578 | 0.663 | 10/0 | 0.967 | 2 |
| 5a–5e + 6 + 7 + 8 + 9 + 10 | 43 | 64 | н/о | 0.689 | 0.704 | 0.576 | 2/8 | 0.001 | 18 |
Примечание. n – объем выборки, Al – среднее число аллелей на локус, Ar – относительное среднее число аллелей на локус (показатель allelic richness, значение, соответствующее минимальной выборке, подчекнуто), Div – индекс общего генетического разнообразия (averaged gene diversity over loci), HE – уровень ожидаемой гетерозиготности, HO – уровень наблюдаемой гетерозиготности, l(HW) – число локусов, для которых не установлено (перед чертой) или установлено (после черты) достоверное (p < 0.05) несоответствие распределению Харди–Вайнберга, p(HW) – значение вероятности при тестировании соответствия распределению Харди–Вайнберга по всем локусам (global test of heterozygote deficiency), h – число отмеченных в выборке гаплотипов мтДНК, н/о – определение значения не проводили.
Анализ выборки из КБР методом кластеризации с использованием модели admixture (результат не показан) продемонстрировал обособленность особей из выборки 7 (минимальное расстояние до другой точки отлова, 6, – 5.7 км). Структуризации в остальной части выборки (для которой максимальное расстояние между двумя точками отлова, 6 и 5d, составляет 15.4 км, рис. 5) выявлено не было. Только дополнительный анализ с использованием модели admixture LOCPRIOR (минимальное среднее значение показателя LnP(K), –806.8, получено для гипотезы K = 3) позволил также показать обособленность выборки из точки 6 и неопределенный характер положения особи из точки 5e. Среди 20 особей из остальных точек сбора, разделенных расстоянием до 6 км, обособленных групп не обнаружилось (рис. 6,б).
Попарные генетические дистанции, рассчитанные для основных выборок из г. Нальчика и прилегающей территории, приведены в табл. 5. Для объединенной выборки хомяков из парковой зоны и ближайших пригородов г. Нальчика (5a–5d, n = 20) отличия с выборками из более удаленных районов составили: для выборки 6 (с. Нартан) –14.32%, для выборки 7 (СНТ “Химик”) – 15.49%, для выборки 9 (с. Аргудан) – 19.12%. Все отличия, за исключением пары 5а (парковая зона Нальчика)/5b (р-н Вольный Аул) – p = 0.054) являются статистически достоверными (p < 0.05–0.00001).
Таблица 5.
Попарные генетические дистанции (FST) между основными выборками хомяков из разных районов в окрестностях г. Нальчика (%)
| Выборка | 5a (парковая зона Нальчика), n = 10 | 5b (р-н Вольный Аул), n = 5 | 6 (с. Нартан), n = 4 | 7 (СНТ “Химик”), n = 7 | 9 (с. Аргудан), n = 8 |
|---|---|---|---|---|---|
| 5b | 5.35 | – | |||
| 6 | 16.41 | 11.14 | – | ||
| 7 | 16.63 | 17.29 | 21.51 | – | |
| 9 | 16.61 | 24.79 | 22.39 | 25.60 | – |
Тест Мантеля, проведенный как для всех пяти основных групп (5a, 5b, 6, 7, 9: r = +0.583), так и для трех выборок из ближайших окрестностей Нальчика (5a, 5b, 6: r = +0.946) в целом показал наличие положительной корреляции между генетическими и географическими дистанциями (хотя полученные значения и не являются статистически достоверными – p = 0.065 и p = 0.1630 соответственно).
Однозначное соответствие частот аллелей равновесию Харди–Вайнберга для выборок из КБР наблюдается только для локальных групп (табл. 4). При этом число аллелей и число гаплотипов мтДНК в локальных группах всегда ниже, чем в выборках, объединяющих образцы из нескольких соседних районов.
ОБСУЖДЕНИЕ
До последнего времени считалось, что ареал обыкновенного хомяка охватывает западное и среднее, но не восточное Предкавказье. Согласно литературным данным [19–21], на Кавказе этот вид встречается в Краснодарском крае, Адыгее, Ставропольском крае, Карачаево-Черкесии, Кабардино-Балкарии, Северной Осетии, Ингушетии и Чечне. Нами впервые показано, что обыкновенный хомяк обитает также и в Дагестане. Таким образом, в Предкавказье ареал вида занимает практически всю территорию от Черного до Каспийского морей.
Митохондриальные линии обыкновенного хомяка предкавказского региона представляют собой отдельную филогенетическую группу (“Кавказ”), обособленную от филогруппы E0, которая распространена на большей части территории России вплоть до Урала [18]. Представленный в настоящей работе расширенный анализ с использованием 50 новых образцов позволил выявить девять ранее неизвестных гаплотипов филогруппы “Кавказ” и подтвердить сделанный ранее [18] вывод об отсутствии в распределении популяций обыкновенного хомяка в данном регионе выраженной филогеографической структуры. Одни и те же или отличающиеся друг от друга единичными заменами гаплотипы встречаются в разных районах. В частности, один и тот же гаплотип имеют особи, отловленные в Лескенском р-не КБР и Кизилюртовском р-не Дагестана – территориях, разделенных расстоянием около 250 км. При этом в одном районе, напротив, могут быть встречены существенно различающиеся варианты нуклеотидных последовательностей (рис. 2).
В г. Симферополе поселения обыкновенного хомяка представляют собой обособленные субпопуляции (демы). Для них характерно сниженное, по сравнению с установленным для города в целом, генетическое разнообразие, а уровень отличий между субпопуляциями, населяющими районы, расположенные в 2–4 км друг от друга, может составлять 22–32%. Однако в окраинных районах, представляющих собой зеленые зоны, вплотную примыкающие к пригородной (не урбанизированной) территории, уровень генетических отличий между отдельными поселениями хомяков снижается до 5–9% [7]. Данные, полученные для г. Кисловодска, демонстрируют аналогичную картину: между отдельными выборками, собранными на расстоянии 1.3–2.7 км друг от друга, отмечен весьма значительный уровень генетических отличий – 12–33%. В южной, примыкающей к озелененной курортной зоне, части города степень различий между поселениями, очевидно, снижается.
В двух исследованных районах г. Нальчика (парковая зона и Вольный Аул), разделенных расстоянием около 2.2 км, генетическая дистанция между населяющими эти участки группами хомяков составляет 5.3%. Это значение соответствует отмеченному для окраинных районов Симферополя и является существенно меньшим, чем генетическая дистанция между обитающими на сходном расстоянии друг от друга группами хомяков в Кисловодске. Мы связываем это с тем, что в Нальчике выборки были собраны именно в окраинных районах и, вероятно, не отражают ситуацию внутри основной территории города.
Для освоенной человеком, но не урбанизированной территории в окрестностях Нальчика генетические дистанции в 11–26%, т.е. сходные по уровню с теми, что отмечаются между отдельными группами в Кисловодске, характерны для поселений хомяка, расположенных на значительно большем удалении друг от друга – от 6 до более чем 20 км.
Таким образом, полученные данные подтверждают, что население обыкновенного хомяка в городах как Крыма, так и Предкавказья представлено существенно обособленными друг от друга группами. Следует отметить, что, хотя Симферополь и исследованные города Предкавказья расположены в разных географических регионах, климат в районе их расположения является сходным – умеренно теплым, с мягкой зимой (среднегодовые температуры – +8…+11°C, среднеянварские –0…–3°C). Это является одним из абиотических факторов, прямо воздействующих на условия существования этого вида. В то же время теплый климат способствует развитию индивидуального жилого сектора с малоэтажной застройкой и садовыми участками и массовому озеленению как внутриквартальному, так и садово-парковому. Тем не менее к особенностям любого урбанизированного ландшафта следует отнести то, что подходящие для обитания хомяка участки разделены территориями, малопригодными для их жизни, либо плохо преодолимыми барьерами, характерными для городской среды (в частности, автомагистралями). В зеленых зонах, примыкающих к пригородным территориям, число таких непригодных или непреодолимых для хомяка зон снижается. В результате степень обособленности отдельных поселений животных менее выражена за счет ставшей возможной миграционной активности. Такая же ситуация характерна и для окружающей города сельской местности.
Важным, на наш взгляд, фактом, характеризующим городские популяции обыкновенного хомяка, является то, что в пределах не только городской территории Кисловодска и Симферополя, но и в окраинных районах Нальчика отмечено очень небольшое число мт-гаплотипов. Это может свидетельствовать о том, что городские территории изначально заселяются небольшим числом животных либо только немногие из них проникают вглубь урбанизированной территории и способны закрепляться здесь и давать начало устойчивым поселениям.
Работа выполнена при финансовой поддержке гранта РФФИ 17-04-01061 и Программы Президиума РАН 0109-2018-0067 “Биоразнообразие природных систем и биологические ресурсы России”.
Список литературы
Luniak M. Synurbization – adaptation of animal wildlife to urban development // Proc. 4th Internat. Urban Wildlife Sympos / Eds Shaw W.W., Harris K.L., van Druff L. Tucson: Univ. Arizona, 2004. P. 50–55.
Суров А.В., Поплавская Н.C., Богомолов П.Л. и др. Синурбанизация обыкновенного хомяка (Cricetus cricetus) // Журн. биол. инвазий. 2015. № 4. С. 105–117.
Карасева Е.В., Телицына А.Ю., Самойлов Б.Л. Млекопитающие Москвы в прошлом и настоящем. М.: Наука, 1999. 244 с.
Čanády A. New site of the European hamster (Cricetus cricetus) in the urban environment of Košice city (Slovakia) // Zool. Ecol. 2013. V. 23. № 1. P. 61–65. doi 10.1080/21658005.2013.769772
Feoktistova N.Yu., Surov A.V., Tovpinetz N.N. et al. The common hamster as a synurbist: a history of settlement in European cities // Zool. Polon. 2013. V. 12/58. № 3–4. P. 116–129. doi 10.2478/zoop-2013-0009
Surov A.V., Feoktistova N.Yu., Bogomolov P.L. Colonization of Astana city by the (Cricetus cricetus L., 1758) – latest example of sinurbization // 24th Annual Meeting of the International Hamster Workgroup. Uglich, Russia, 2017. P. 82–84.
Феоктистова Н.Ю., Мещерский И.Г., Суров А.В. и др. Генетическая структура городской популяции обыкновенного хомяка (Cricetus cricetus) // Генетика. 2016. Т. 52. № 2. С. 221–230. doi 0.7868/ S0016675816020041
Огнев С.И. Грызуны Северного Кавказа. Ростов-на-Дону: Гос. изд-во, 1924. 64 с.
Neumann K., Jansman H. Polymorphic microsatellites for the analysis of endangered common hamster populations (Cricetus cricetus L.) // Conservat. Genet. 2004. V. 5. P. 127–130.
Bandelt H.-J., Forster P., Röhl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. P. 37–48. www.fluxus-engineering.com. doi 10.1093/oxfordjournals.molbev.a026036
Pritchard J.K., Stephens M., Donnelly P.J. Inference of population structure using multilocus genotype data // Genetics. 2000. V. 155. P. 945–959.
Earl D.A., von Holdt B.M. STRUCTURE HARVESTER: a website and program for visualizing STRUCTURE output and implementing the Evanno method // Conservat. Genet. Res. 2012. V. 4. № 2. P. 359–361. doi 10.1007/ s12686-011-9548-7
Excoffier L., Laval G., Schneider S. Arlequin ver. 3.0: An integrated software package for population genetics data analysis // Evol. Bioinform. Online. 2005. V. 1. P. 47–50. PMCID: PMC2658868
Goudet J. FSTAT (Version 1.2): A computer program to calculate F-statisitics // J. Heredity. 1994. V. 86. P. 485–486.
Goudet J. 2001. FSTAT, a program to estimate and test gene diversities and fixation indices (version 2.9.3). Available from http://www2.unil.ch/popgen/softwares/fstat.htm. Updated from Goudet (1995).
Takezaki N., Nei M., Tamura K. POPTREEW: Web Version of POPTREE for constructing population trees from allele frequency data and computing some other quantities // Mol. Biol. Evol. 2014. V. 31. № 6. P. 1622–1624. doi 10.1093/molbev/msu093
Rousset F. Genepop’007: a complete re-implementation of the genepop software for Windows and Linux // Mol. Ecol. Res. 2008. V. 8. № 1. P. 103–106. doi 10.1111/ j.1558-5646.2012.01606.x
Feoktistova N.Yu., Meschersky I.G., Bogomolov P.L. et al. Phylogeographic structure of the Common hamster (Cricetus cricetus L.): Late pleistocene connections between Caucasus and Western European populations // PLoS One. 12(11): e0187527. doi 10.1371/journal.pone.0187527
Верещагин Н.К. Млекопитающие Кавказа. М.: Изд-во АН СССР, 1959. 704 с.
Темботов А.К. Определитель млекопитающих Северного Кавказа. Нальчик: Тип. им. Революции 1905 года, 1965. 97 с.
Пантелеев П.А. Грызуны Палеарктики. М.: ИПЭЭ РАН, 1998. 101 с.
Дополнительные материалы отсутствуют.


