Генетика, 2019, T. 55, № 3, стр. 359-364
Биоинформатический анализ транскриптомов седалищного нерва мышей после 30-суточного орбитального полета на биоспутнике “Бион-М1”
М. С. Кузнецов 1, *, П. Н. Резвяков 2, А. Н. Лисюков 1, О. А. Гусев 3, 4, Е. Е. Никольский 5, 6, 7, Р. Р. Исламов 1, 7
1 Казанский государственный медицинский университет,
кафедра медицинской биологии и генетики
420012 Казань, Россия
2 Казанский государственный медицинский университет, кафедра нормальной анатомии
420012 Казань, Россия
3 Казанский (Приволжский) федеральный университет,
лаборатория “Экстремальная биология”
420008 Казань,, Россия
4 Riken, Translational Genomics Unit
230-0045 Yokohama, Japan
5 Казанский государственный медицинский университет,
кафедра медицинской и биологической физики
420012 Казань,, Россия
6 Казанский (Приволжский) федеральный университет, лаборатория нейрофармакологии
420008 Казань, Россия
7 Казанский институт биохимии и биофизики, Федеральный исследовательский центр “Казанский научный центр” Российской академии наук
420111 Казань,, Россия
* E-mail: qmaxksmu@yandex.ru
Поступила в редакцию 03.03.2018
После доработки 09.10.2018
Принята к публикации 16.05.2018
Аннотация
Проведен сравнительный биоинформатический анализ транскриптомов седалищного нерва мышей линии C57BL/6J, находившихся в 30-суточном космическом полете на биоспутнике “Бион-М1” (группа “Полет”), мышей, находившихся в 30-суточном орбитальном полете с последующей 7-суточной реадаптацией на Земле (группа “Восстановление”), и мышей, содержавшихся в условиях биоспутника на Земле (группа “Контроль”). У мышей после 30-суточного пребывания в космосе (группы “Полет” и “Восстановление”) выявлен значительный пул генов с абсолютной разницей в экспрессии более чем в 32 раза при сравнении с мышами из группы “Контроль”. При этом сравнительный анализ транскриптомов мышей группы “Полет” и группы “Восстановление” существенных различий в экспрессии генов не обнаружил. С помощью базы KEGG (Kyoto Encyclopedia of Genes and Genomes) у животных после орбитального полета на биоспутнике выявлены гены, имеющие отношение к состоянию метаболических и сигнальных путей, участвующих в регуляции актинового цитоскелета, потенциал-зависимых кальциевых, натриевых и калиевых каналов, миелинизации нервных волокон.
Невесомость является одним из неблагоприятных факторов, действующих на человека в космосе. Наиболее ярко влияние невесомости проявляется развитием у космонавтов гипогравитационного двигательного синдрома (ГДС), характеризующегося специфическими изменениями в скелетных мышцах [1]. В мышцах, обеспечивающих поддержание позы, эти патологические сдвиги начинают развиваться уже в течение первых суток, а через некоторое время вместе с позными мышцами в процесс вовлекаются мышцы, осуществляющие произвольные движения [1, 2]. Известно, что мотонейроны контролируют реализацию эндогенной программы мышечных волокон (дифференцировка, поддержание дифференцированного состояния) и модулируют фенотипическую пластичность в пределах границ нормы экспрессии миогенного клеточного типа [3–5]. Информационные межклеточные взаимодействия в системе мотонейрон–скелетная мышца регулируют активность различных генов, определяющих морфофункциональные признаки обоих клеточных партнеров. Импульсная активность мотонейронов и нейрогенные молекулы, секретируемые из нервной терминали, контролируют экспрессию генов в скелетных мышечных волокнах. Мышца, в свою очередь, синтезирует миогенные нейротрофические факторы, которые транспортируются в перикарион и стимулируют экспрессию некоторых специфических генов в нервных клетках [2, 6]. Учитывая, что мРНК синтезируются в перикарионе двигательного нейрона, а далее с помощью механизмов антероградного аксонного транспорта распределяются по длине аксона, существует мнение, что изменения в активности транскрипции мРНК и ее доставки к месту трансляции могут быть патогенетическими звеньями некоторых мышечных заболеваний [7, 8].
Ранее в рамках проекта “Бион-М1” с целью изучения патогенеза ГДС, нами было выполнено полногеномное исследование поясничного отдела спинного мозга мышей, находившихся в 30-суточном космическом полете на биоспутнике [9]. Обнаруженные изменения транскриптомного профиля в спинном мозге дают основания полагать, что в развитии ГДС могут участвовать двигательные нейроны, иннервирующие мышцы задних конечностей. Поскольку морфофункциональное состояние протяженных аксонов мотонейронов спинного мозга в составе периферического нерва зависит от уровня специфических мРНК, обеспечивающих локальный синтез белка в аксоплазме, то изменение транскриптомного профиля в нервных отростках в условиях космического полета может быть также одним из факторов патогенеза ГДС. Научная программа проекта “Бион-М1” включала изучение механизмов адаптационных изменений в организме мышей как в условиях 30-суточного орбитального полета, так и после 7-суточной послеполетной реадаптации на Земле [10]. В настоящей работе на биоматериале, полученном нами для проведения полногеномного исследования, в целях продолжения исследований по изучению механизмов развития ГДС проведен биоинформатический анализ транскриптомного профиля седалищного нерва мышей после 30-суточного орбитального полета на биоспутнике “Бион-М1” и последующей недельной реадаптации на Земле.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты выполнены на 4–5-месячных мышах-самцах линии C57BL/6J весом 25.1 ± 3.2 г (Питомник лабораторных животных “Пущино”). Подопытные мыши были разделены на три экспериментальные группы: 1) “Полет” – мыши, находившиеся в 30-суточном космическом полете на биоспутнике “Бион-М1” (n = 2); 2) “Восстановление” – мыши, находившиеся в 30-суточном орбитальном полете, с последующей 7-суточной реадаптацией (n = 2) и 3) “Контроль” – мыши, содержавшиеся в течение эксперимента в условиях биоспутника при естественной гравитации на Земле (n = 2). Из эксперимента животных выводили методом цервикальной дислокации в соответствии с правилами, рекомендованными Физиологической секцией Российского Национального комитета по биоэтике [10].
Общую РНК из образцов седалищных нервов выделяли с помощью коммерческого набора RNeasy Mini Kit согласно протоколу производителя. 500 нг полученной общей РНК использовали для проведения полногеномного исследования с помощью коммерческого микрочипа GE 4 × 44K v2 Microarray Kit (Agilent Technologies, Santa Clara, USA) согласно инструкции производителя. Фоновая поправка вводилась с использованием SuBio Platform v1.16.4376 (Subio Inc., Kagoshima, Japan).
Все последующие этапы предобработки и анализа данных проводили в среде для статистических вычислений R (R Foundation for Statistical Computing, Vienna, Austria) с использованием дополнительных пакетов из репозиториев CRAN (https:// cran.r-project.org) и BioConductor (https://www.bioconductor.org). Для нормирования полученных данных после log2-трансформации и удаления результатов контрольных проб использовали метод квантильной нормализации. Для установления общих закономерностей изменения профиля экспрессии генов в разных экспериментальных группах применяли анализ главных компонент и иерархический кластерный анализ [11]. Кратность изменения экспрессии (Fold Change) определяли как отношение средних показателей экспрессии в сравниваемых группах [12]. Для удобства анализа дифференциальной экспрессии проводили log2-трансформацию вычисленной кратности изменения экспрессии. С целью выявления дифференциальной экспрессии генов применяли t-тест из пакета limma. К дифференциально экспрессирующимся относили гены с абсолютной кратностью изменения экспрессии более чем в 32 раза (абсолютный log2(Fold Change) > 5) при наблюдаемом p-значении <0.005 [12]. Для реализации алгоритма обогащения с целью выявления вовлеченных метаболических и сигнальных путей базы KEGG (Kyoto Encyclopedia of Genes and Genomes) использовали пакеты gage и pathview, к дифференциально экспрессирующимся генам в этом случае относили гены при наблюдаемом p-значении <0.05. Оценку направления изменения экспрессии проводили на основании среднего значения Fold Change генов-участников, p-значение рассчитывали как среднее геометрическое р-значений, полученных в результате анализа дифференциальной экспрессии, для определения q-значения использовали FDR-поправку [13].
РЕЗУЛЬТАТЫ
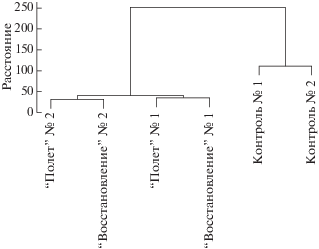
С помощью анализа главных компонент и иерархического кластерного анализа выявлено, что общий профиль экспрессии генов различается у мышей, находившихся в космическом полете (группы “Полет” и “Восстановление”), и животных из группы “Контроль” (рис. 1, 2). Наблюдения в группе “Контроль” согласно результатам анализа главных компонент представляют разнородную группу (рис. 1), однако результаты иерархической кластеризации свидетельствуют о том, что наблюдения составляют единую кладу (рис. 2). Сравнительный анализ группы “Восстановление” и группы “Полет” существенных различий не выявил. Наблюдения в этих двух группах животных составили смешанные клады при иерархическом кластерном анализе и смешанно распределены в пространстве первых двух главных компонент, которые объясняют 92% дисперсии. Таким образом, результаты транскриптомных данных, исследованные методом снижения размерности, могут свидетельствовать о том, что молекулярных сдвиги в тканях седалищного нерва животных, возникшие после 30-суточного космического полета, не нормализуются через неделю реадаптации мышей на Земле.
Рис. 1.
Распределение наблюдений в пространстве двух первых главных компонент. Наблюдения, принадлежащие трем экспериментальным группам, распределены в пространстве двух первых главных компонент, объясняющих 92% дисперсии. Наблюдения, принадлежащие группе “Полет” и группе “Восстановление” образуют смешанный кластер. PC1 – principal component 1 (первая главная компонента), PC2 – principal component 2 (вторая главная компонента).
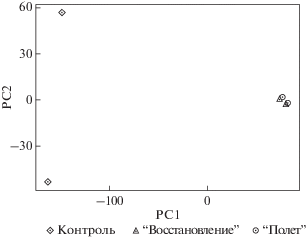
Рис. 2.
Иерархическая кластеризация наблюдений. Наблюдения, принадлежащие группе “Контроль”, образуют единый кластер. Наблюдения, принадлежащие группам “Полет” и “Восстановление”, образуют смешанные клады. В качестве меры расстояния между образцами подразумевается евклидово расстояние.
Сравнительный анализ экспрессии генов у животных группы “Полет” и группы “Контроль” выявил 87 генов с повышенной экспрессией и 11 генов с пониженной экспрессией (табл. 1 , см. в Приложении эл. версии статьи). При обогащении сигнальных и метаболических путей базы данных KEGG выявлено 57 вовлеченных путей с повышенной активностью (табл. 2 , см. в Приложении эл. версии статьи).
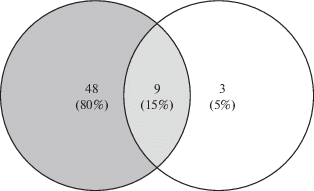
Анализ дифференциальной экспрессии между группой “Восстановление” и группой “Контроль” обнаружил 92 гена с повышенной экспрессией и 9 генов с пониженной экспрессией (табл. 3 , см. в Приложении эл. версии статьи). При обогащении сигнальных и метаболических путей базы данных KEGG выявлено 60 вовлеченных путей с повышенной активностью (табл. 4 , см. в Приложении эл. версии статьи), 57 из которых находятся на пересечении с выявленными при сравнении между группами “Полет” и “Контроль” (рис. 3).
Рис. 3.
Пересечение множеств сигнальных и метаболических путей, выявленных с помощью базы данных KEGG. Серый круг – результаты сравнительного анализа между группами “Полет” и “Контроль”. Белый круг – между группами “Восстановление” и “Контроль”.
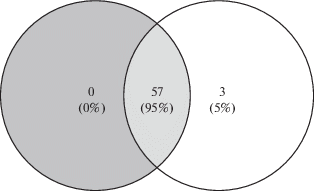
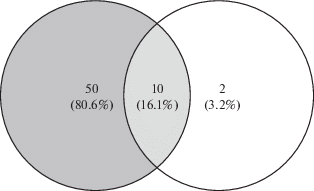
Сравнительный анализ уровней экспрессии генов в группах “Восстановление” и “Полет” не выявил значимых различий. При использовании в качестве порогов абсолютной кратности изменения экспрессии более чем в 2 раза и наблюдаемого р-значения <0.05, выявлено 9 генов с пониженной и 1 ген с повышенной экспрессией (табл. 5 , см. в Приложении эл. версии статьи). При обогащении данных, характеризующих состояние сигнальных и метаболических путей с помощью базы данных KEGG, установлено 12 вовлеченных путей с повышенной активностью (табл. 6 , см. в Приложении эл. версии статьи), 9 из которых находятся на пересечении, с выявленными при сравнении между группами “Полет” и “Контроль” (рис. 4) и 10 – между группой “Восстановление” и группой “Контроль” (рис. 5).
ОБСУЖДЕНИЕ
Освоение человеком дальнего космоса диктует необходимость проведения современных “омиксных” исследований на животных, направленных на изучение механизмов влияния неблагоприятных факторов, действующих на человека в космосе, и на разработку соответствующих профилактических мер. Одним из таких патологических состояний является гипогравитационный двигательный синдром (ГДС). Характерными проявлениями ГДС являются специфические изменения в скелетных мышцах, отвечающих за поддержание позы и в первую очередь страдающих в условиях гипогравитации. Принимая во внимание тот факт, что иннервацию этих мышц осуществляют мотонейроны спинного мозга, аксоны которых имеют значительную протяженность, сведения о качественном и количественном составе мРНК, обеспечивающей внутриаксонный синтез белка, представляют важное фундаментальное и практическое значение для космической медицины.
Нейроны относятся к клеткам с высокой степенью морфологической и функциональной поляризованности [14, 15]. Пластичность перикариона, аксонного холмика, дендритов и протяженного аксона, заканчивающегося специфическими моторными окончаниями, обеспечена характерными белковыми молекулами, синтезирующимися на месте их использования [16, 17]. Перикарион, занятый крупным ядром, развитой гранулярной эндоплазматической сетью и комплексом Гольджи, обладает высокой синтетической активностью. Однако белок-синтезирующий аппарат перикариона не способен обеспечить белковыми молекулами все компартменты нервной клетки, на что указывает известный факт синтеза белка в дендритах и аксоне [7]. При этом “интеллектуальность” нервной клетки заключается в четком распределении специфических мРНК в различных клеточных компартментах [17, 18]. мРНК адресно транспортируется в заданные места локальной трансляции белка [19]. Вместе с тем на сегодняшний день роль локальной трансляции мРНК в нервных отростках изучена недостаточно [8, 20].
В 2013 г. в рамках проекта “Бион-М1” был осуществлен 30-суточный орбитальный полет мышей на биоспутнике. Ранее в ходе реализации проекта нами было проведено полногеномное исследование тканей поясничного отдела спинного мозга. Сравнительный анализ образцов группы “Полет” и группы “Контроль” обнаружил 134 гена с повышенной экспрессией и 41 ген с пониженной экспрессией [9]. Зарегистрированная дифференциальная экспрессия нейроноспецифических генов и изменения в активности сигнальных внутриклеточных каскадов в спинном мозге подтвердили гипотезу о том, что важная роль в патогенезе ГДС принадлежит изменениям, происходящим в мотонейронах, иннервирующих соответствующие мышцы.
Полученные в настоящем исследовании результаты свидетельствуют о существенном влиянии космического полета на транскриптомный профиль в седалищном нерве, в составе которого проходят аксоны двигательных нейронов спинного мозга. У мышей после 30-суточного космического полета (группы “Полет” и “Восстановление”) выявлен значительный пул генов с разницей в экспрессии более чем в 32 раза при сравнении с группой “Контроль”. Важно отметить, что 8 сигнальных и метаболических путей базы данных KEGG, документированных при сравнении между группами “Полет” и “Контроль” в седалищном нерве, находятся на пересечении с таковыми, выявленными в спинном мозге животных группы “Полет” при сравнении с группой “Контроль” (см. табл. 2 , сигнальные и метаболические пути, находящиеся на пересечении двух множеств выделены курсивом; эл. вариант, Приложение). Особый интерес для дальнейшего исследования представляет эффект космического полета на транскрипцию генов, участвующих в регуляции актинового цитоскелета, потенциалозависимых кальциевых, натриевых и калиевых каналов, миелинизации нервных волокон.
Известно, что после возвращения на Землю клинические проявления патологических сдвигов, возникших за время космического полета, становятся особенно выраженными. Так, проведенный нами ранее сравнительный анализ транскриптомного профиля спинного мозга мышей после орбитального космического полета и мышей, прошедших 7-суточный период реадаптации, выявил дифференциальную экспрессию 178 генов (118 генов с повышенной экспрессией и 60 – с пониженной) [21]. В настоящем исследовании статистически значимых различий в транскриптомном профиле седалищного нерва в группах “Полет” и “Восстановление” не установлено. Таким образом, можно полагать, что через неделю пребывания на Земле в седалищном нерве мышей компенсаторные механизмы реадаптации на молекулярном уровне еще не наступили. При этом из 60 вовлеченных сигнальных и метаболических путей с повышенной активностью, обнаруженных в седалищном нерве, 51 пересекается с путями, выявленными в спинном мозге при сравнении группы “Восстановление” с группой “Контроль” (см. табл. 4 , эл. вариант, сигнальные и метаболические пути, находящиеся на пересечении двух множеств, выделены курсивом).
В силу уникальности “космического” биоматериала и связанного с этим малого размера выборки нам не удалось обеспечить приемлемую мощность для выявления всего пула вовлеченных нейроноспецифических генов. Кроме того, при анализе транскриптомного профиля тканей организма после космического полета следует учитывать не только эффекты гипогравитации, но и перегрузки, возникающие при старте и посадке космического корабля, а также повышение уровня радиоактивного излучения и уменьшение напряженности магнитного поля Земли в космосе.
Авторы выражают благодарность О.В. Тяпкиной и К.А. Петрову за помощь в экспериментах.
Исследование поддержано грантом РФФИ № 17-04-00385, программой фундаментальных исследований Президиума РАН “Фундаментальные исследования для разработки биомедицинских технологий”, субсидией, выделенной в рамках государственной поддержки Казанского (Приволжского) федерального университета в целях повышения его конкурентоспособности среди ведущих мировых научно-образовательных центров.
Список литературы
Shenkman B.S. From Slow to Fast: Hypogravity-induced remodeling of muscle fiber myosin phenotype // Acta Naturae. 2016. V. 8. № 4. P. 47–59.
Grigoriev A.I., Koslovskaya I.B., Shenkman B.S. Role of support afferentation in organization of the tonic muscle system // Ross. Fiziol. J. im. I.M. Sechenova. 2004. V. 90. № 5. P. 508–521.
Delbono O. Neural control of aging skeletal muscle // Aging Cell. 2003. V. 2. № 1. P. 21–29.
Sakuma K., Yamaguchi A. The recent understanding of the neurotrophin’s role in skeletal muscle adaptation // J. Biomed. Biotechnol. 2011. V. 2011. P. 1–12. doi 10.1155/2011/201696
Chevrel G., Hohlfeld R., Sendtner M. The role of neurotrophins in muscle under physiological and pathological conditions // Muscle Nerve. 2006. V. 33. № 4. P. 462–476. doi 10.1002/mus.20444
Baguma-Nibasheka M., Fracassi A., Costain W. et al. Role of skeletal muscle in motor neuron development // Histol. Histopathol. 2016. V. 31. № 7. P. 699–719. doi 10.14670/HH-11-742
Spaulding E.L., Burgess R.W. Accumulating evidence for axonal translation in neuronal homeostasis // Front. Neurosci. 2017. V. 11. P. 312–319. doi 10.3389/ fnins.2017.00312
Costa C.J., Willis D.E. To the end of the line: Axonal mRNA transport and local translation in health and neurodegenerative disease // Dev. Neurobiol. 2017. V. 78. № 3. P. 209–220. doi 10.1002/dneu.22555
Islamov R.R., Gusev O.A., Tanabe A. et al. Full-genome study of gene expression in lumbar spinal cord of mice after 30-day space flight on Bion-M1 biosatellite // Acta Astronautica. 2016. V. 122. P. 231–236. doi 10.1016/ j.actaastro.2016.01.026
Andreev-Andrievskiy A., Popova A., Boyle R. et al. Mice in Bion-M 1 space mission: Training and selection // PLoS One. 2014. V. 9. № 8. P. E104830. doi 10.1371/ journal.pone.0104830
Aziz R., Verma C.K., Srivastava N. Dimension reduction methods for microarray data: a review // AIMS Bioengineering. 2017. № 4. P. 179–197. doi 10.3934/ bioeng.2017.2.179
Saeys Y., Inza I., Larranaga P. A review of feature selection techniques in bioinformatics // Bioinformatics. 2007. V. 23. № 19. P. 2507–2517. doi 10.1093/bioinformatics/btm344
Luo W., Friedman M., Shedden K. et al. GAGE: Generally Applicable Gene Set Enrichment for Pathways Analysis // BMC Bioinformat. 2009. V. 10. № 1. P. 161–178. doi 10.1186/1471-2105-10-161
Bradke F., Dotti C.G. Neuronal polarity: vectorial cytoplasmic flow precedes axon formation // Neuron. 1997. V. 19. № 6. P. 1175–1186.
Terenzio M., Schiavo G., Fainzilber M. Compartmentalized signaling in neurons: From cell biology to neuroscience // Neuron. 2017. V. 96. № 3. P. 667–679. doi 10.1016/j.neuron.2017.10.015
Piper M., Holt C. RNA translation in axons // Annu. Rev. Cell Dev. Biol. 2004. V. 20. № 1. P. 505–523. doi 10.1146/annurev.cellbio.20.010403.111746
Alvarez J., Giuditta A., Koenig E. Protein synthesis in axons and terminals: significance for maintenance, plasticity and regulation of phenotype. With a critique of slow transport theory // Prog. Neurobiol. 2000. V. 62. № 1. P. 1–62. doi 10.1016/S0301-0082(99)00062-3
Glock C., Heumüller M., Schuman E.M. mRNA transport & local translation in neurons // Curr. Opin. Neurobiol. 2017. V. 45. P. 169–177. doi 10.1016/j.conb.2017.05.005
Lee B.H., Bae S.W., Shim J.J. et al. Imaging single-mRNA localization and translation in live neurons // Mol. Cells. 2016. V. 39. № 12. P. 841–846. doi 10.14348/molcells.2016.0277
Van Driesche S., Martin K. New frontiers in RNA transport and local translation in neurons // Dev. Neurobiol. 2018. V. 78. № 13. P. 331–339. doi 10.1002/dneu.22574
Кузнецов М.С., Резвяков П.Н., Лисюков А.Н. и др. Транскриптомный профиль спинного мозга мыши после 30-суточного космического полета на биоспутнике “БИОН-М1” и последующей 7-суточной реадаптации на Земле // Авиакосмич. и экологич. мед. 2017. Т. 51. № 7. С. 85–87. doi 10.21687/0233-528X-2017-51-7-85-87
Дополнительные материалы отсутствуют.