Генетика, 2019, T. 55, № 3, стр. 325-336
Генетическая дифференциация гольцов Арктической группы Северо-Восточной Азии и Северной Америки
А. Г. Олейник 1, *, Л. А. Скурихина 1, А. Д. Кухлевский 1, 2, Е. И. Бондарь 1, 2
1 Институт биологии моря им. А.В. Жирмунского, Национальный научный центр морской биологии
Дальневосточного отделения Российской академии наук
690041 Владивосток, Россия
2 Дальневосточный федеральный университет, кафедра клеточной биологии и генетики
690600 Владивосток, Россия
* E-mail: alla_oleinik@mail.ru
Поступила в редакцию 05.04.2018
После доработки 05.06.2018
Принята к публикации 14.05.2018
Аннотация
Проведен сравнительный анализ изменчивости митохондриальной ДНК Salvelinus taranetzi (и близкородственных таксонов) Азии и Salvelinus alpinus erythrinus Северной Америки (NWT), представляющих Арктическую филогенетическую группу гольцов рода Salvelinus. Показано, что оценки дивергенции комбинированных нуклеотидных последовательностей генов CoI, Cytb и CR участка мтДНК в пределах обсуждаемой филогруппы находятся в диапазоне 0.001–0.003 и не превышают внутривидовой изменчивости S. taranetzi. Генеалогический анализ подтверждает филогенетическую близость S. a. erythrinus и S. taranetzi из Азии. Предполагая общее происхождение S. taranetzi и S. a. erythrinus, мы показали наличие существенной дифференциации между географическими популяциями вследствие вероятной фрагментации ареала общего предка. Иерархический анализ молекулярного разнообразия (AMOVA) выявил, что большая часть изменчивости мтДНК (490 пн CR) приходится на межгрупповую компоненту (83% дисперсии), при слабом генетическом разнообразии внутри групп (10%). На широкой географической шкале выделяется регион Анадырско-Колымского бассейнового округа, который определяет гетерогенность филогруппы.
Арктический голец Salvelinus alpinus Linnaeus, 1758 (или S. alpinus complex) широко распространен в пресных водоемах Северной Голарктики. Исследователи высказывали разные взгляды как на состав таксона, так и на валидность выделяемых подвидов [1–4 и др.]. На основании анализа морфологических признаков было предложено разделить S. alpinus на три группы (эволюционные линии) в соответствии с предполагаемыми центрами их возникновения [3] (рис. 1). Согласно этим представлениям, европейская линия включает два подвида, S. a. alpinus и S. a. salvelinus, которые имели общего европейского предка. Арктическая линия (S. a. erythrinus) объединяет азиатские популяции из Сибири и североамериканские, расположенные восточнее р. Маккензи и первоначально обозначенные S. a. stagnalis [2], с центром происхождения в Сибири. В качестве самостоятельной таксономической группы (S. a. оquassa) рассматривают реликтовые популяции арктических гольцов с атлантического побережья Северной Америки из штата Мэн и провинции Южный Квебек. В отдельную филогенетическую группу, но без определения таксономического статуса, был выделен голец Таранца [3].
Рис. 1.
Схема распространения арктического гольца S. alpinus и гольца Таранца S. taranetzi. Тонкие линии показывают ареалы филогеографических групп, выделенные на основании морфологических признаков [3]. Основные линии ограничивают ареалы материнских филогенетических групп: Евразийской и Акадийской, согласно [6, 11], Арктической, согласно [17, 18, 30].
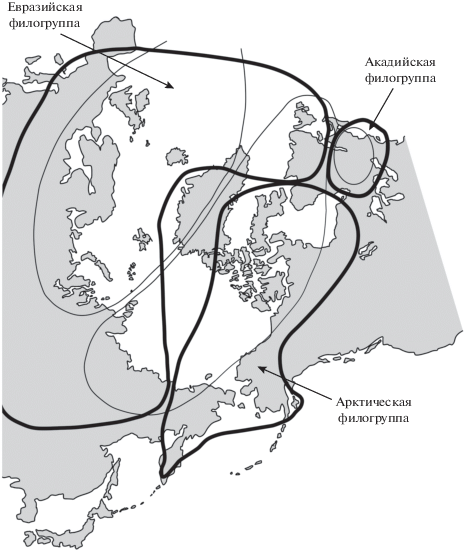
Молекулярно-генетические исследования изменили общее представление как о филогеографии S. alpinus, так и о составе филогенетических групп и их взаимоотношениях [5–13]. На основании анализа митохондриальной ДНК (мтДНК) у S. alpinus были выделены филогенетические группы: Атлантическая [6] или Евразийская [11] для S. a. alpinus и S. a. salvelinus; Акадийская для S. a. оquassa. Вместе они образуют монофилетическую супергруппу, объединяющую гольцов Европы, Сибири и атлантического бассейна Северной Америки (рис. 1). В то же время S. a. erythrinus оказался разделен на две филогенетические линии: Арктическую и Сибирскую. Следовательно, полученные результаты не подтверждают объединение североамериканских и сибирских популяций в рамках одного таксона S. a. erythrinus, морфологическое сходство которых связывалось с происхождением от общего предка [2, 3].
Еще одной нерешенной проблемой являются филогенетические взаимоотношения гольца Таранца Salvelinus taranetzi Kaganovsky, 1955 и популяций арктического гольца S. a. erythrinus Северной Америки (согласно [3]), расположенных восточнее бассейна р. Маккензи. Ареал S. a. erythrinus охватывает арктическое побережье, так называемые Северо-Западные территории (NWT), Арктический архипелаг и Западную Гренландию [14]. Морфологический анализ [15], данные о кариотипах [16] и изменчивости аллозимных локусов [7] указывают на сходство обсуждаемых таксонов. При этом некоторые исследователи предполагают, что “высокоарктического” гольца можно рассматривать в рамках единой филогруппы гольца Таранца [7, 15]. Следует подчеркнуть, что поскольку появление идентичных морфо- и экотипов гольцов может быть связано с конвергентной эволюцией в аллопатрии, необходимо оценить уровень генетической дифференциации и дивергенции S. taranetzi и S. a. erythrinus арктического побережья Северной Америки. Однако отсутствие исследований по филогеографии обсуждаемых таксонов на всем протяжении ареалов затрудняет их сопоставление и не позволяет полностью отвергнуть гипотезу о дивергенции предковой популяции S. taranetzi. Исследования филогеографии гольцов [6, 11] и филогенетических отношений представителей основных митохондриальных групп [8, 10, 12, 17, 18] ограничены относительно выборок S. taranetzi. В то же время в связи с исследованием филогеографии S. a. erythrinus на большей части ареала в Северной Америке [14] появилась возможность получить уточненные данные о дифференциации S. taranetzi с аллопатричными популяциями высокоарктического гольца.
Основная цель нашего исследования состояла в определении степени генетической дифференциации и дивергенции S. taranetzi (и близкородственных таксонов) Азии и S. a. erythrinus с арктического побережья Северной Америки для тестирования гипотезы об их филогенетической близости.
МАТЕРИАЛЫ И МЕТОДЫ
Данные о географической локализации, распределении по ареалу и объеме оригинальных выборок приведены в табл. 1. Были определены нуклеотидные последовательности трех участков мтДНК: контрольного региона (CR), генов цитохрома b (Cytb) и цитохромоксидазы-1 (CoI). В качестве внешней группы рассматривали S. alpinus.
Таблица 1.
Данные об исследованных таксонах гольцов рода Salvelinus
| Таксон | Локальность | Координаты | Комбинированный гаплотип (частота) | Объем выборки |
|---|---|---|---|---|
| S. taranetzi | оз. Аччен, Чукотский п-ов | 64°50′ N/174°36′ W | TR1(9) TR2(1) TR3(5) | 15 |
| S. taranetzi | оз. Пекульнейское, Чукотский п-ов | 62°33′ N/177°17′ E | TR4(3) TR5(3) TR6(1) TR7(1) TR8(1) | 9 |
| S. andriashevi | оз. Эстихед, Чукотский п-ов | 64°29′ N/173°33′ W | TR10(2) | 2 |
| Salvelinus sp. 4 | оз. Начикинское, п-ов Камчатка | 53°01′ N/157°50′ E | TR11(1) TR12(2) TR13(1) | 4 |
| S. krogiusae | оз. Дальнее, п-ов Камчатка | 52°55′ N/158°20′ E | TR9(3) | 3 |
| S. boganidae | оз. Эльгыгытгын, Чукотский п-ов | 67°30′ N/172°05′ E | TR14(2) | 2 |
| S. elgyticus | оз. Эльгыгытгын, Чукотский п-ов | 67°30′ N/172°05′ E | TR15(1) TR16(1) | 2 |
| S. a. erythrinus | р. Джейко (Jayko R.), о-в Виктории, NWT | 69°42′ N/103°16′ W | TR17(3) TR18(1) | 4 |
| S. a. erythrinus | р. Лочлен (Lauchlan R.), о-в Виктории, NWT | 68°56′ N/108°31′ W | TR17(3) TR19(1) | 4 |
| S. a. alpinus | р. Тессема, п-ов Таймыр | 69°49′ N/90°64′ E | AR1(1) | 1 |
| S. a. alpinus | оз. Ситасьяуре (Sitasjaure Lake), Скандинавский п-ов, Швеция | 67°53′ N/17°37′ E | AR4(3) AR5(1) AR6(1) AR7(1) | 6 |
| S. a. alpinus | оз. Лама, п-ов Таймыр | 69°38′ N/90°56′ E | AR2(3) AR3(1) | 4 |
| S. a. oquassa | Пруд Фладс (Floods Pond), Северная Америка | 44°73′ N/68°49′ W | AR8(2) | 2 |
Индивидуальные препараты тотальной ДНК получали из фиксированных тканей сердца или плавников по стандартной методике [19]. Для амплификации и секвенирования использовали наборы праймеров, которые ранее применялись для лососевых рыб [12, 20, 21]. Фрагменты мтДНК амплифицировали методом полимеразной цепной реакции, очищали, секвенировали в прямом и обратном направлениях с использованием набора BigDye Terminator v. 3.1 (Applied Biosystems, США). Последовательности нуклеотидов определяли в автоматическом анализаторе ABI Prism 3500 (Applied Biosystems). Первичную обработку и множественное выравнивание нуклеотидных последовательностей проводили в программах SeqScape v. 3 (Applied Biosystems) и Geneious v. 8.1 (www.geneious.com/).
Для представления филогенетических отношений между гаплотипами мтДНК использовали метод медианных сетей (алгоритм MJ) [22], реализованный в пакете программ Network 4.5.02 (Fluxus Technology Ltd., www.fluxus-engineering.com). Статистический анализ, включая расчет p-дистанций [23] и основных показателей разнообразия выборок гольцов (табл. 2), проводили в программе DnaSP v. 6 [24]. Для более полного представления об уровне дифференциации были использованы данные по нуклеотидным последовательностям из GenBank: участка CR (табл. 3); гена Cytb (табл. 4); митохондриальному геному S. alpinus [25].
Таблица 2.
Основные показатели изменчивости мтДНК объединенных выборок Арктической филогруппы гольцов рода Salvelinus
| Таксон | Число | Гаплотипическое разнообразие (h) |
Нуклеотидное разнообразие (π) |
|||
|---|---|---|---|---|---|---|
| популяций (выборок) | особей | гаплотипов | полиморфных сайтов (S) | |||
| CoI, Cytb и CR (3362 пн) | ||||||
| S. taranetzi | 2 (3) | 24 | 8 | 16 | 0.8370 ± 0.0510 | 0.0010 ± 0.0001 |
| S. a. erythrinus | 2 (2) | 8 | 3 | 2 | 0.4640 ± 0.0400 | 0.0002 ± 0.0000 |
| Salvelinus sp. 4 | 1 (1) | 4 | 3 | 3 | 0.8330 ± 0.2220 | 0.0005 ± 0.0002 |
| S. boganidae | 1 (1) | 2 | 1 | 0 | 0.0000 ± 0.0000 | 0.0000 ± 0.0000 |
| S. elgyticus | 1 (1) | 2 | 2 | 8 | 1.0000 ± 0.5000 | 0.0024 ± 0.0012 |
| CR (490 пн)* | ||||||
| S. taranetzi | 7 (8) | 63 | 7 | 6 | 0.7573 ± 0.0245 | 0.0156 ± 0.0111 |
| S. a. erythrinus | 77 (77) | 1084 | 11 | 10 | 0.0740 ± 0.0111 | 0.0010 ± 0.0021 |
| Salvelinus sp. 4 | 1 (2) | 24 | 1 | 0 | 0.0000 ± 0.0000 | 0.0000 ± 0.0000 |
| S. boganidae | 1 (2) | 22 | 1 | 0 | 0.0000 ± 0.0000 | 0.0000 ± 0.0000 |
| S. elgyticus | 1 (2) | 19 | 6 | 5 | 0.6959 ± 0.0969 | 0.0125 ± 0.0099 |
Таблица 3.
Последовательности CR мтДНК гольцов рода Salvelinus, использованные для расширенного генеалогического анализа (рис. 3)
| Гаплотип | GenBank ID (источник) | Частота | ||||
|---|---|---|---|---|---|---|
| I | II | III | IV | V | ||
| ARC19 | KY122267–KY122270, KY122271, KY122272–KY122275, KY122304–KY122307, KY122331 (1); EU310899 (2, 3); KX417784 (5) | 1 | 1087 | 47 | 0 | 0 |
| ARC20 | KC907317 (2) | 0 | 22 | 0 | 0 | 0 |
| ARC21 | KC907318 (2) | 0 | 3 | 0 | 0 | 0 |
| ARC22 | KC907319 (2) | 0 | 5 | 0 | 0 | 0 |
| ARC23 | KC907320 (2) | 0 | 5 | 0 | 0 | 0 |
| ARC24 | KC907321 (2) | 0 | 2 | 0 | 0 | 0 |
| ARC25 | KC907322 (2) | 0 | 1 | 0 | 0 | 0 |
| ARC26 | KC907323 (2) | 0 | 1 | 0 | 0 | 0 |
| ARC27 | KC907324 (2) | 0 | 1 | 0 | 0 | 0 |
| ARC28 | KC907325 (2) | 0 | 2 | 0 | 0 | 0 |
| ARC29 | KC907326 (2) | 0 | 4 | 0 | 0 | 0 |
| ARC30 | KC907327 (2) | 0 | 1 | 0 | 0 | 0 |
| ARC31 | KC907328 (2) | 0 | 2 | 0 | 0 | 0 |
| ARC32 | KR011244 (2) | 0 | 2 | 0 | 0 | 0 |
| ARC33 | KR011243 (2) | 0 | 1 | 0 | 0 | 0 |
| ARC34 | KR011245 (4); KY122310, KY122324, KY122326–KY122330, KY122332 (1) | 8 | 2 | 0 | 0 | 0 |
| tcH2 | KX417785 (5) | 0 | 0 | 20 | 0 | 0 |
| SEU1 | KP200681 (6) | 1 | 0 | 0 | 0 | 0 |
| SEU2 | KP200680 (6) | 1 | 0 | 0 | 0 | 0 |
| NAIV1 | KP200682 (6) | 1 | 0 | 0 | 0 | 0 |
| NAIV2 | KP200683 (6); KY122239–KY122240, KY122309, KY122311–KY122323, KY122325 (1); JX261983 (8) | 19 | 0 | 0 | 0 | 0 |
| SBOG | KP200679 (6); KY122254–KY122255 (1) | 22 | 0 | 0 | 0 | 0 |
| SELG1 | KP200676 (6) | 10 | 0 | 0 | 0 | 0 |
| SELG2 | KP200678 (6); KY122266 (1) | 2 | 0 | 0 | 0 | 0 |
| SELG3 | KP200674 (6) | 1 | 0 | 0 | 0 | 0 |
| SELG4 | KP200675 (6) | 4 | 0 | 0 | 0 | 0 |
| SELG5 | KP200677 (6) | 1 | 0 | 0 | 0 | 0 |
| TR15 | KY122265 (1) | 1 | 0 | 0 | 0 | 0 |
| ATL1 | AF297991 (7); KY122248–KY122251, KY122253 (1) | 0 | 0 | 0 | 25 | 0 |
| ATL4 | AF297994 (7); KY122252 (1) | 0 | 0 | 0 | 2 | 0 |
| ATL19 | KR011258 (2) | 0 | 0 | 0 | 3 | 0 |
| ATL22 | KR011256 (2); KY122244–KY122247 (1) | 0 | 0 | 0 | 4 | 0 |
| AR1 | KY122243 (1) | 0 | 0 | 0 | 1 | 0 |
| ACD9 | EU310898 (3); KY122241–KY122242 (1) | 0 | 0 | 0 | 0 | 18 |
| ACD10 | KR011259 (2) | 0 | 0 | 0 | 0 | 1 |
| ACD11 | KR011260 (2) | 0 | 0 | 0 | 0 | 1 |
Таблица 4.
Последовательности Cytb мтДНК гольцов рода Salvelinus, использованные для расширенного генеалогического анализа (рис. 4)
| Тестируемые группы | N | GenBank ID (источник) |
|---|---|---|
| Чукотский п-ов | 50 | KY122142–KY122143, KY122157–KY122158, KY122168–KY122169, KY122212–KY122235 (1); AY286035–AY286039 (2); JX960847, JX960850 (3); KP200641–KP200651 (4); JX262008 (5) |
| Северная Америка | 11 | KY122170–KY122173, KY122175–KY122178 (1); KP200652 (4); KU244698–KU244699 (6) |
| п-ов Камчатка | 9 | KY122174, KY122207–KY122210 (1); KX417780–KX417783 (7) |
| Бассейн р. Колымы | 5 | AY286040–AY286044 (2) |
| Евразийская филогруппа | 23 | KY122147–KY122156 (1); AY286021–AY286026 (2); JX960845–JX960846 (3); KP200660–KP200664 (4) |
| Акадийская филогруппа | 4 | KY122144–KY122145 (1); JX960844 (3); KP200659 (4) |
Степень межпопуляционной генетической дифференциации на основе критерия ΦST [26, 27] и количественную оценку географической подразделенности изменчивости мтДНК, AMOVA [28], определяли, используя пакет программ Arlequin ver 3.5 [29]. Существенность иерархических компонентов дисперсии и соответствующих Φ-статистик оценивали из непараметрического распределения псевдовероятностного теста [28].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Общая длина нуклеотидных последовательностей мтДНК составила 3362 пн. По комбинированной последовательности (1–1021 пн СR, 1022–2221 пн CoI и 2222–3362 пн Cytb) выявлены 91 вариабельный сайт (74 информативных) и 24 разных гаплотипа. Для Арктической филогруппы выявлены 36 вариабельных сайтов (22 информативных) и 18 гаплотипов мтДНК (табл. 1).
Уровень дивергенции мтДНК внутри Арктической филогруппы относительно низкий, включая дивергенцию аллопатричных выборок S. taranetzi и S. a. erythrinus (Dxy = 0.001 ± 0.000–0.03 ± 0.001). В то же время все представители Арктической филогруппы показывают одинаковые оценки дивергенции (0.015 ± 0.002) с S. a. alpinus (Евразийская группа) и S. a. оquassa (Акадийская группа). Соотношение внутри- и межпопуляционной дивергенции мтДНК аналогично описанному ранее для S. taranetzi [30]. Эти значения ниже полученных на основе PCR-RFLP-анализа мтДНК [13], но соответствуют внутривидовой изменчивости гольцов рода Salvelinus.
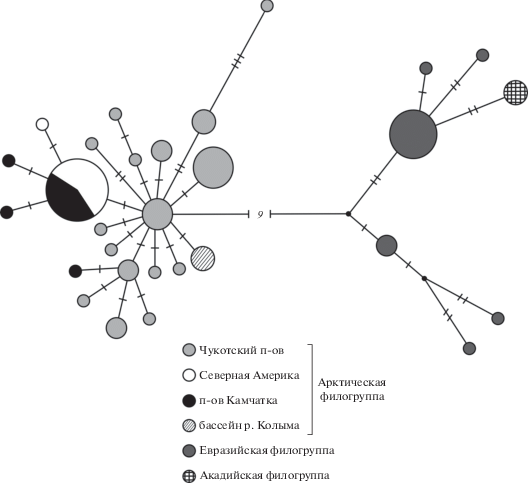
Сеть гаплотипов комбинированных нуклеотидных последовательностей генов CoI, Cytb и CR участка характеризуется несколькими центрами радиации, представляющими самостоятельные филогенетические группы гаплотипов (рис. 2). Максимальное генеалогическое расстояние 42 нуклеотидные замены наблюдается между Арктической и внешней (S. a. alpinus–S. a. oquassa) филогруппами. Реконструированная генеалогия Арктической филогруппы имеет бирадиальную структуру с двумя кладами. Особенностью данной генеалогии является наличие структурированности, обусловленной географическим распределением гаплотипов. Первая клада объединяет восемь гаплотипов, наблюдаемых только в азиатских популяциях Чукотского п-ова (табл. 1). Вторая клада включает восемь гаплотипов, встречающихся у S. a. erythrinus (NWT), а также обнаруженных в трех озерах Камчатки и Чукотки. Наиболее близкий таксон к S. a. erythrinus – голец из оз. Начикинского Salvelinus sp. 4, а не сибирские гольцы, входящие в Eвразийскую филогруппу. Минимальное расстояние между S. a. erythrinus (гаплотип TR17) и ближайшим гаплотипом Salvelinus sp. 4 (TR13) составляет три нуклеотидные замены. Самостоятельные генеалогические ветви представляют гаплотипы гольцов из оз. Эльгыгытгын (TR14–TR16), которые в равной степени (восемь нуклеотидных замен) удалены от обеих клад.
Рис. 2.
Генеалогическая сеть (MJ-анализ) гаплотипов комбинированных нуклеотидных последовательностей генов CoI, Cytb и CR участка мтДНК гольцов рода Salvelinus. Все мутации имеют равный вес, интервал поиска медианных векторов (черные точки) ε равен нулю. На ветвях указаны мутационные различия; размер окружностей пропорционален абсолютным частотам гаплотипов (табл. 1). Гаплотип AF154851 соответствует комбинированной нуклеотидной последовательности CoI, Cytb и CR полного генома мтДНК S. alpinus [25].
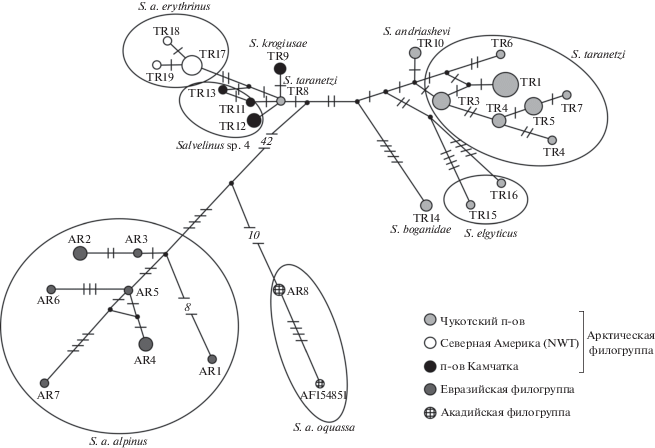
Для уточнения связей между представителями Арктической филогруппы мы сравнили полученные нуклеотидные последовательности мтДНК с данными, имеющимися в GenBank. Поскольку отсутствуют работы, в которых филогенетический анализ мтДНК гольцов проводили бы по трем исследованным нами последовательностям генов, генеалогический анализ осуществляли отдельно по участкам мтДНК. Для генеалогии на основе выравненного фрагмента CR (490 пн) характерно объединение слабо дивергировавших гаплотипов (табл. 3). Наблюдаются два основных центра радиации с центральными предковыми гаплотипами NAIV2 и ARC19, связанными парсимониально (рис. 3). В этой генеалогии сохраняется региональная тенденция распределения гаплотипов. Первая клада объединяет гольцов из чукотских популяций (оз. Аччен, оз. Пекульнейское, оз. Эстихед, оз. Найвак, р. Сеутакан, оз. Эльгыгытгын). Следует отметить два отклонения от представленного распределения гаплотипов на рис. 2. Из всей группы только гаплотип tcH2 был обнаружен в камчатской популяции S. taranetzi (оз. Двуюрточное) [18]. Исключением также является доминирующий в выборке S. taranetzi из Пекульнейского озера гаплотип ARC34. Впервые уникальная последовательность ARC34 была единично зарегистрирована на Аляске (Alaska Brooks Range) у S. anaktuvukensis в бассейне р. Анактувук [31]. Большинство особей в выборках S. taranetzi имеют доминирующий гаплотип NAIV2. Гаплотипы S. boganidae и S. elgyticus, характерные для таксономических выборок, связаны с центральным одной–двумя нуклеотидными заменами.
Рис. 3.
Генеалогическая сеть (MJ-анализ) гаплотипов CR участка (490 пн) мтДНК гольцов рода Salvelinus, построенная с привлечением данных из GenBank (табл. 3). Обозначение гаплотипов приведено согласно первому описанию [14, 17, 18]. Альтернативные связи показаны тонкими линиями. Размер окружности ARC19 составляет 70% частоты гаплотипа в суммарной выборке. Другие обозначения соответствуют рис. 2.
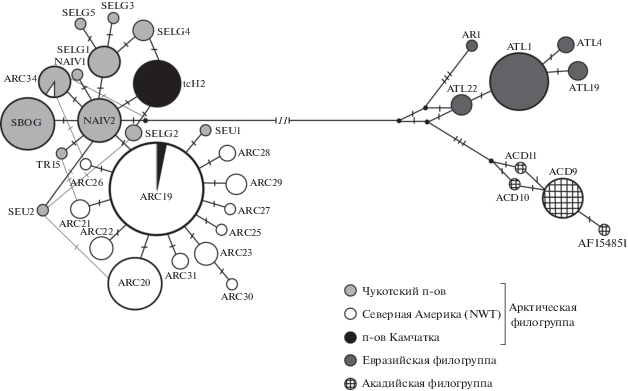
Вторая клада (рис. 3) объединяет гаплотипы, обнаруженные в Северной Америке (за исключением ARC34), а также в нескольких азиатских локальностях (оз. Начикинское, оз. Дальнее, оз. Пекульнейское, оз. Аяогытгын, р. Сеутакан). Доминирующим гаплотипом в кладе является ARC19, присутствующий во всех североамериканских выборках (77) и у большинства исследованных гольцов S. a. erythrinus (95.3% согласно [14]). ARC19 также доминирует в трех азиатских локальностях на п-ове Камчатка (оз. Начикинское, оз. Дальнее, оз. Аяогытгын) и единично встречается в оз. Пекульнейском. Радиальную структуру клады формируют 10 гаплотипов, парсимониально связанных с ARC19. Из этих гаплотипов только уникальный SEU1 был обнаружен в азиатской популяции S. taranetzi (р. Сеутакан) [17].
Сеть гаплотипов по гену Cytb (длина выравненной последовательности 973 пн) с привлечением данных из GenBank (табл. 4) имеет радиальную структуру для Арктической филогруппы гольцов. Данная генеалогическая сеть (рис. 4) сохраняет основные черты географической структурированности. Клада, объединяющая гаплотипы Cytb S. taranetzi, S. boganidae и S. elgyticus, озерных гольцов бассейна р. Колымы, ранее получила название “колымско-чукотская” [8]. Согласно уточненной структуре, центральное положение в генеалогии занимает предковый гаплотип, доминирующий в азиатских выборках S. taranetzi (оз. Аччен, оз. Эстихед, оз. Найвак), с которым практически все гаплотипы связаны парсимониально (оз. Аччен, оз. Пекульнейское, оз. Эстихед, р. Сеутакан, оз. Эльгыгытгын, оз. Выквынайваам, оз. Макси, оз. Джульетта). Наблюдаются два дополнительных центра радиации, которые также дивергировали от центрального на одну нуклеотидную замену (рис. 4). Интерес представляет группа, объединяющая четыре гаплотипа. Центральный гаплотип радиации является доминирующим в выборках S. a. erythrinus (Северное побережье Аляски (Alaska North Slope); бассейн р. Маккензи; о-в Виктории, NWT), трех азиатских популяциях гольцов (оз. Начикинское, оз. Дальнее, оз. Аяогытгын) и единично обнаружен у S. taranetzi.
Привлечение информации из GenBank позволило провести статистический анализ генетической дифференциации. Для этого были использованы частоты гаплотипов CR (490 пн), обнаруженные в 91 популяции гольцов Северо-Восточной Азии и Северной Америки [14, 17, 18]. Оценка подразделенности полиморфизма мтДНК с помощью критерия ΦST подтвердила дифференциацию между объединенными выборками гольцов. Все попарные ΦST-оценки S. taranetzi, S. a. erythrinus, Salvelinus sp. 4, S. boganidae и S. elgyticus статистически значимы (Р < 0.01), за одним исключением. Не удалось обнаружить существенных различий между выборками Salvelinus sp. 4 и S. a. erythrinus (ΦST = –0.0172, Р > 0.05). Значения ΦST между S. taranetzi и Salvelinus sp. 4 изменяются в зависимости от состава объединенной выборки S. taranetzi. Включение популяции из оз. Аяогытгын в выборку S. taranetzi в 2 раза снижает абсолютное значение ΦST: от 0.6259 до 0.3776 (Р < 0.01). Максимальные существенные различия наблюдаются между объединенными выборками S. taranetzi и S. a. erythrinus (0.9101, Р < 0.01). Индивидуальные выборки S. taranetzi более дифференцированы (0.6151–0.9449, Р < 0.01), чем выборки S. a. erythrinus, большая часть из которых достоверно не дифференцируются (ΦST = 0.0000, Р > 0.05).
Согласно AMOVA [28], oсновная доля молекулярной дисперсии частот гаплотипов CR (490 пн) тестируемых выборок гольцов (S. taranetzi, S. a. erythrinus, Salvelinus sp. 4, S. boganidae, S. elgyticus) приходится на различия между таксономическими группами (83% дисперсии, Р < 0.001), при низком генетическом разнообразии внутри групп (10%, Р < 0.001) (вариант I, табл. 5). В то же время, когда выборки S. taranetzi (без родственных таксонов) и S. a. erythrinus объединялись по принадлежности к континентам (Азия и Северная Америка) межгрупповой компонент дисперсии существенно не уменьшился (вариант IV, табл. 5). Разложение молекулярной изменчивости мтДНК на три иерархических уровня, согласно принадлежности к географическим регионам, выявило следующие характерные особенности распределения: 1) высокая межпопуляционная доля дисперсии (87%) наряду с умеренной внутрипопуляционной (13%) для S. taranetzi Азии (вариант II, табл. 5); 2) умеренная межпопуляционная доля дисперсии (12%) и высокое разнообразие (88%) внутри североамериканских популяций S. a. erythrinus (вариант III, табл. 5). Все компоненты дисперсии статистически высокосущественны (Р < 0.001).
Таблица 5.
Иерархический анализ межпопуляционных и внутрипопуляционных гаплотипических различий Арктической филогенетической группы гольцов рода Salvelinus на основе фрагмента CR (490 пн) мтДНК
| Уровень разнообразия | d.f. | Дисперсия (%) | Вероятность (Р) |
|---|---|---|---|
| Вариант I (группы S. taranetzi, Salvelinus sp. 4, S. krogiusae, S. boganidae, S. elgyticus и S. a. erythrinus) |
|||
| Между группами | 4 | 83.08 | <0.001 |
| Между популяциями внутри групп | 86 | 7.25 | <0.001 |
| Внутри популяций | 1180 | 9.67 | <0.001 |
| Вариант II (популяции S. taranetzi Азии) | |||
| Между популяциями | 6 | 87.29 | <0.001 |
| Внутри популяций | 63 | 12.71 | |
| Вариант III (популяции S. a. erythrinus NWT) | |||
| Между популяциями | 76 | 11.78 | <0.001 |
| Внутри популяций | 1056 | 88.22 | |
| Вариант IV (S. taranetzi и S. a. erythrinus) | |||
| Между группами | 1 | 79.92 | <0.001 |
| Между популяциями внутри групп | 82 | 9.19 | <0.001 |
| Внутри популяций | 1119 | 10.89 | <0.001 |
Распределение молекулярного разнообразия мтДНК отклоняется от обнаруженных закономерностей у S. taranetzi на основе PCR-RFLP-анализа трех участков мтДНК (ND1/ND2, ND5/ND6, Cytb/D-loop) [30]. Согласно этим данным, для азиатских популяций S. taranetzi характерны высокие показатели генетического разнообразия как внутри (57%), так и между популяциями (43%). Поскольку состав выборок перекрывается, основная причина заключается в гетерогенности распределения изменчивости по мтДНК у гольцов. Тем не менее этот факт не изменяет основной тенденции, поскольку североамериканские популяции более гомогенны по сравнению с азиатскими как по гаплотипическому составу, так и по нуклеотидному разнообразию (табл. 2; [14, 32, 33]). Очевидно, что генетическая структурированность S. a. erythrinus на большей части ареала выражена достаточно слабо.
Полученные результаты коррелируют с результатами анализа мтДНК у представителей Арктической филогруппы [14, 17, 18, 30, 34]. Сокращение длины анализируемых последовательностей мтДНК уменьшило разрешение генеалогий, но увеличение объема выборок позволило дополнить существующие к настоящему времени представления о филогенетических связях внутри Арктической филогруппы. Сопоставление генеалогических сетей, построенных по комбинированным последовательностям (рис. 2) и индивидуальным генным фрагментам мтДНК (рис. 3, 4), подтверждает подразделенность филогруппы, с одной стороны, и невысокий уровень генетических различий, с другой. В структуре выделяются две подгруппы. В первую (колымско-чукотскую) входят S. taranetzi из водоемов Чукотского полуострова, в том числе эндемичные таксоны из оз. Эльгыгытгын и бассейна р. Колыма. Вторая (условно североамериканская) подгруппа объединяет S. a. erythrinus (NWT), а также эндемичные популяции гольцов с неясным таксономическим статусом из озер п-ова Камчатка (оз. Начикинское, оз. Дальнее, оз. Аяогытгын). В настоящее время известны только две популяции на Чукотском полуострове, в которых обнаружены гаплотипы обеих филогеографических подгрупп. Это оз. Пекульнейское, входящее в состав Мейныпильгинской озерно-речной системы (собственные данные), и р. Сеутакан [17]. Интерес представляют и гольцы из оз. Двуюрточного [18], поскольку это единственная популяция на территории п-ова Камчатка, относящаяся к колымско-чукотской подгруппе. Имеющихся в настоящее время данных недостаточно для обоснованного обсуждения гипотез заселения Камчатки гольцами Арктической филогруппы [18, 30]. Однако уникальность гаплотипического состава оз. Двуюрточного позволяет предположить, что колонизация Камчатки проходила не в результате непрерывного расширения ареала, а через повторяющиеся миграции из нескольких предковых популяций. Присутствие азиатского гаплотипа ARC34 у S. anaktuvukensis может объясняться исторической интрогрессией мтДНК в контактной зоне Арктической и Берингийской филогрупп гольцов, что подтверждено анализом микросателлитных локусов [31].
Следовательно, для Арктической филогруппы на исследованной части ареала характерна выраженная структурированность, наибольший вклад в которую вносят различия между двумя филогенетическими подгруппами. На широкой географической шкале выделяется регион Анадырско-Колымского бассейнового округа, который определяет гетерогенность всей филогруппы. Дифференцированный анализ показал, что североамериканские популяции S. a. erythrinus гораздо более гомогенны по сравнению с азиатскими S. taranetzi как по гаплотипическому составу, так и по нуклеотидному разнообразию. Небольшая протяженность генеалогий филогруппы определяется низким нуклеотидным разнообразием всех выборок [14, 32, 33].
Ранее на основе PCR-RFLP-анализа мтДНК нами было предложено выделить самостоятельную Арктическую филогенетическую группу гольца Таранца [13], включающую азиатские популяции S. taranetzi, Salvelinus sp. 4, S. krogiusae, S. andriashevi, S. boganidae, S. elgyticus, колымско-чукотскую группу озерных гольцов Salvelinus sp., Salvethymus svetovidovi, а также S. a. erythrinus (первоначально S. a. stagnalis) Северной Америки. Филогенетический [13] и генеалогический анализы свидетельствуют, что Арктическая филогруппа S. taranetzi и филогруппа S. alpinus (Евразийская и Акадийская группы) достигли состояния реципрокной монофилии, без сохранения предкового полиморфизма. Генеалогический анализ показывает существование значительно дивергировавших митохондриальных линий (генеалогический разрыв более 40 нуклеотидных замен), каждая из которых коалесцирует к собственному предковому гаплотипу мтДНК.
В целом нам удалось решить проблему взаимоотношений S. taranetzi (с близкородственными таксонами) из Азии и S. a. erythrinus Северной Америки, доказав их филогенетическую близость. Генетическое сходство географических выборок (при наличии хоминга и отсутствии проходной стадии развития у озерных азиатских гольцов), вероятно, связано с послеледниковой колонизацией из общих источников, а не с потоком генов в современных популяциях. Предполагая общее происхождение S. taranetzi и S. a. erythrinus, мы показали существование между ними определенного уровня дивергенции вследствие вероятной фрагментации ареала общего предка и последующей эволюции в условиях изоляции расстоянием. Наши данные указывают на выживание предковых популяций и реколонизацию из разных ледниковых рефугиумов. Но для выяснения роли исторических событий в формировании современного географического распространения гаплотипов мтДНК представляется важным провести полный филогеографический анализ на всем ареале Арктической филогруппы гольца Таранца.
Авторы посвящают эту статью памяти выдающегося ихтиолога Игоря Александровича Черешнева и выражают глубокую признательность С.В. Фролову (ННЦМБ ДВО РАН), О.А. Радченко (ИБПС ДВО РАН) и J.-S. Moore (Laval University, Institute of Integrative Biology and Systems, Quebec, Canada), безвозмездно пополнившим коллекцию препаратов ДНК гольцов рода Salvelinus лаборатории генетики ННЦМБ ДВО РАН.
Исследование было поддержано Российским фондом фундаментальных исследований (проект № 15-04-01000).
Список литературы
McPhail J.D. A systematic study of the Salvelinus alpinus complex in Noth America // J. Fish. Res. Board Can. 1961. V. 18. P. 793–816.
Behnke R.J. A systematics review of the genus Salvelinus // Charrs: Salmonid Fishes of the Genus Salvelinus. Hague: Dr. W. Junk Publ., 1980. P. 441–480.
Behnke R.J. Organizing the diversity of the Arctic charr complex // Biology of the Arctic Charr: Proc. Intern. Symp. on Arctic Charr. Winnipeg: Univ. Manitoba Press, 1984. P. 3–21.
Савваитова К.А. Арктические гольцы (структура популяционных систем, перспективы хозяйственного использования). М.: Агропромиздат, 1989. 223 с.
Wilson C.C., Hebert P.D.N., Reist J.D., Dempson J.B. Phylogeography and postglacial dispersal of Arctic charr Salvelinus alpinus in North America // Mol. Evol. 1996. V. 5. P. 187–197.
Brunner P.C., Douglas M.R., Osinov A. et al. Holarctic phylogeography of arctic charr (Salvelinus alpinus L.) inferred from mitochondrial DNA sequences // Evolution. 2001. V. 55. № 3. P. 573–586.
Осинов А.Г. Эволюционные взаимоотношения между основными таксонами Salvelinus alpinus–Salvelinus malma complex: результаты сравнительного анализа аллозимных данных разных авторов // Вопр. ихтиологии. 2001. Т. 41. № 2. С. 167–183.
Радченко О.А. Изменчивость нуклеотидных последовательностей гена цитохрома b митохондриальной ДНК гольцов рода Salvelinus // Генетика. 2004. Т. 40. № 3. С. 322–333.
Oleinik A.G., Skurikhina L.A., Brykov V.A. Divergence of the Salvelinus species mitochondrial DNA from northeastern Asia // Ecol. of Freshwater Fish. 2007. V. 16. № 1. P. 87–98.
Taylor E.B., Lowery E., Liliestrale A. et al. Genetic analysis of sympatric char populations in western Alaska: Arctic char (Salvelinus alpinus) and Dolly Varden (Salvelinus malma) are not two sides of the same coin // J. Evol. Biol. 2008. V. 21. P. 1609–1625.
Alekseyev S.S., Bajno R., Gordeeva N.V. et al. Phylogeography and sympatric differentiation of the Arctic charr Salvelinus alpinus (L.) complex in Siberia as revealed by mtDNA sequence analysis // J. Fish Biol. 2009. V. 75. P. 368–392.
Crête-Lafrenière A., Weir L.K., Bernatchez L. Framing the salmonidae family phylogenetic portrait: a more complete picture from increased taxon sampling // PLoS One. 2012. V. 7. № 10. e46662.
Олейник А.Г., Скурихина Л.А., Брыков Вл.А. Филогения гольцов рода Salvelinus по данным анализа митохондриальной ДНК // Генетика. 2015. Т. 51. № 1. С. 63–77.
Moore J.-S., Robert B.R., Reist J.D., Taylor E.B. Post-glacial recolonization of the north American Arctic by Arctic charr (Salvelinus alpinus): genetic evidence of multiple northern refugia and hybridization between glacial lineages // J. Biogeography. 2015. V. 42. P. 2089–2100.
Глубоковский М.К., Черешнев И.А. Спорные вопросы филогении гольцов рода Salvelinus Голарктики. I. Изучение проходных гольцов из бассейна Восточно-Сибирского моря // Вопр. ихтиологии. 1981. Т. 21. № 5. С. 771–786.
Фролов С.В. Изменчивость и эволюция кариотипов лососевых рыб. Владивосток: Дальнаука, 2000. 229 с.
Osinov A.G., Senchukova A.L., Mugue N.S. et al. Speciation and genetic divergence of three species of charr from ancient Lake El’gygytgyn (Chukotka) and their phylogenetic relationships with other representatives of the genus Salvelinus // Biol. J. Lin. Soc. 2015. V. 116. № 1. P. 63–85.
Esin E.V., Bocharova E.S., Mugue N.S., Markevich G.N. Occurrence of sympatric charr groups, Salvelinus, Salmonidae, in the lakes of Kamchatka: a legacy of the last glaciations // J. Fish Biol. 2017. V. 91. № 2. P. 628–644.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 1626 p.
Uiblein F., Jagsch A., Honsig-Erlenburg W., Weiss S. Status, habitat use, and vulnerability of the European grayling in Austrian waters // J. Fish Biol. 2001. V. 59 (Supple A). P. 223–247.
Ward R.D., Zemlak T.S., Innes B.H. et al. DNA barcoding Australia’s fish species // Phil. Trans. Roy. Soc. B – Biol. Sci. 2005. V. 360. P. 1847–1857.
Bandelt H.-J., Foster P., Rohl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. P. 37–48.
Nei M., Kumar S. Molecular Evolution and Phylogenetics. N.Y.: Oxford Univ. Press, 2000. 333 p.
Rozas J., Ferrer-Mata A., Sánchez-DelBarrio et al. DnaSP 6: DNA sequence polymorphism analysis of large datasets // Mol. Biol. Evol. 2017. V. 34. P. 3299–3302.
Doiron S., Bernatchez L., Blier P. A comparative genomics analysis of the potential adaptative value of Arctic charr mtDNA introgression in brook charr populations (Salvelinus fontinalis Mitchill) // Mol. Evol. Biol. 2002. V. 19. P. 1902–1909.
Cockerham C.C. Analysis of gene frequencies // Genetics. 1973. V. 74. P. 679–700.
Weir B.S., Cockerham C.C. Estimating F statistics for the analysis of population structure // Evolution. 1984. V. 38. P. 1358–1370.
Excoffier L., Smouse P.E., Quattro J.M. Analysis of molecular variance inferred from metric distances among DNA haplotypes: application to human mitochondrial DNA restriction data // Genetics. 1992. V. 131. P. 479–491.
Excoffier L., Lischer H.E.L. Arlequin suite ver 3.5: a new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Res. 2010. V. 10. P. 564–567.
Олейник А.Г., Скурихина Л.А., Кухлевский А.Д. Вторичный контакт между двумя дивергентными линиями гольцов рода Salvelinus в Северо-Западной Пацифике // Генетика. 2017. Т. 53. № 11. C. 1297–1310.
Ayers S.D. A review of the species status of the Angayukaksurak charr (Salvelinus anaktuvukensis) of northern Alaska: perspectives from molecular and morphological data. MSc thesis. Univ. Alaska Fairbanks, 2010. 83 p. URL: http://www.arlis.org/docs/vol1/B/608729840.pdf (дата обращения: 21.03.2018).
Олейник А.Г., Скурихина Л.А., Брыков Вл.А. Дифференциация мальмы Salvelinus malma и гольца Таранца Salvelinus taranetzi по данным PCR-RFLP-анализа митохондриальной ДНК // Генетика. 2004. Т. 40. № 3. С. 386–392.
Олейник А.Г., Скурихина Л.А. Генетическая дивергенция симпатричных гольцов рода Salvelinus из озера Начикинское (Камчатка) // Генетика. 2007. Т. 43. № 8. С. 1097–1106.
Сенчукова А.Л., Павлов С.Д., Есин Е.В. и др. Гольцы рода Salvelinus из озера Начикинское (Камчатка) и их положение в филогенетической системе S. alpinus–S. malma // Вопр. ихтиологии. 2015. Т. 55. № 1. С. 74–81.
Шедько С.В., Мирошниченко И.Л., Немкова Г.А. Филогения лососевых рыб (Salmoniformes: Salmonidae) и ее молекулярная датировка: анализ мтДНК-данных // Генетика. 2013. Т. 49. № 6. С. 718–734.
Rodgers T.W., Mock K.E. National Petroleum Reserve Alaska fish mitochondrial sequences. 2015. (Unpublished).
Дополнительные материалы отсутствуют.