Генетика, 2019, T. 55, № 3, стр. 280-289
Изменение уровня экспрессии генов Aspergillus oryzae под влиянием ди(2-пиридил-1-оксид)диселенида
С. А. Залепкина 1, В. Ф. Смирнов 1, *, А. В. Борисов 2, Ж. В. Мацулевич 2
1 Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского,
кафедра биохимии и биотехнологии
603950 Нижний Новгород, Россия
2 Нижегородский государственный технический университет им. Р.Е. Алексеева,
кафедра “Производственная безопасность, экология и химия”
603950 Нижний Новгород, Россия
* E-mail: biodeg@mail.ru
Поступила в редакцию 09.04.2018
После доработки 24.09.2018
Принята к публикации 16.07.2018
Аннотация
С помощью полногеномного микрочипового анализа ДНК были исследованы механизмы токсического действия селенорганического соединения – ди(2-пиридил-1-оксид)диселенида на микроскопический гриб А. oryzae RIB40. Обнаружено, что действие данного соединения вызывает изменения уровня экспрессии 72 генов. В частности, снижение уровня экспрессии наблюдалось для генов, кодирующих белки-переносчики ионов меди, а значительное повышение – для генов, отвечающих за синтез оксидоредуктаз, что соответствует результатам биохимических экспериментов, в которых было показано увеличение активности эндооксидоредуктаз при действии ди(2-пиридил-1-оксид)диселенида на А. oryzae. Данные микрочипового анализа подтверждены результатами количественной ПЦР в реальном времени.
В последние годы наблюдается повышенный интерес к синтезу и всестороннему исследованию свойств селенорганических соединений [1, 2]. Одно из важнейших направлений исследований в этой области – выявление биологической активности данных соединений, что позволяет проводить целенаправленный синтез с заранее прогнозируемым характером их воздействия на живые объекты. Особенно большое внимание уделяется селенсодержащим соединениям с антимикробным действием [3, 4], которые могут быть использованы в ветеринарии, медицине и агропромышленном комплексе, а также в технической микробиологии (использовании химических соединений в качестве средств защиты промышленных материалов от микробиологических повреждений). Это особенно актуально в связи с тем, что микроорганизмы быстро адаптируются к биоцидным соединениям, поэтому их арсенал необходимо постоянно обновлять. Целенаправленный подбор биоцидных препаратов может быть осуществлен только на основе знаний о механизмах их ингибирующего действия на микроорганизмы. На сегодня известно, что в высоких концентрациях селен может вызывать образование свободных радикалов и последующий апоптоз клеток, обычно путем двойных разрывов ДНК, что приводит к снижению жизнеспособности клеток [5]. Однако большинство работ в этой области посвящены действию неорганических соединений селена [6], а механизмы действия органических селенсодержащих соединений на микроорганизмы, особенно мицелиальные грибы, пока неизвестны. Для выявления возможных метаболитических путей, на которые могут воздействовать физические и химические факторы, исследуется геном микроорганизмов [7, 8]. Одним из наиболее быстрых и систематических методов анализа действия химических соединений на микроорганизмы является микрочиповый анализ ДНК, отражающий уровень экспрессии генов [9, 10]. Данный метод позволяет установить ответные реакции организмов на конкретные химические соединения, т.е. определить механизмы их влияния; другие метаболические пути, нарушенные их действием; и защитные реакции организма, направленные на нейтрализацию действия данных соединений. В связи с этим целью работы было изучение с помощью полногеномного микрочипового анализа ДНК токсического действия селенсодержащего гетероциклического соединения ди(2-пиридил-1-оксид)диселенида на Аspergillus oryzae RIB40.
МАТЕРИАЛЫ И МЕТОДЫ
Получение ди(2-пиридил-1-оксид)диселенида
Данное соединение было синтезировано по методикам, приведенным в патенте [4]. Структуры соединений однозначно установлены методом ЯМР-анализа, их характеристики полностью соответствуют литературным данным [11].
Организмы и условия культивирования
Для определения фунгицидной активности соединений в качестве тест-культур использовали А. oryzae RIB40. Данный микромицет является активным биодеградантом промышленных материалов, что и обусловило его выбор для наших экспериментов. Культивирование микроскопических грибов для оценки прироста биомассы, активности эндооксидоредуктаз, а также выделения суммарной РНК осуществляли на жидкой питательной среде Чапека–Докса. В экспериментах по определению активности экзоферментов в указанную жидкую питательную среду в качестве индуктора активности оксидоредуктаз вносили сосновые опилки – 10.0 г/л. Культивирование проводили при температуре (27 ± 2)°С на перемешивающих устройствах марки ПЭ-0034 “Экоприбор” (Россия), которые обеспечивали встряхивание колб со скоростью 180 об./мин.
Выделение суммарной РНК
Для выделения суммарной РНК A. oryzae культивировали на жидкой минеральной среде Чапека–Докса в течение 48 ч. По истечении времени культивирования мицелий отбирали, промывали стерильной водой, отжимали, взвешивали и разделяли на две равные части, которые помещали в колбы со свежей средой, содержащей ди(2-пиридин-1-оксид)диселенид, растворенный в ДМСО, или ДМСО (в контрольном эксперименте). Мицелий инкубировали в течение дополнительного времени (10 мин–6 ч), отфильтровывали, промывали, отжимали и быстро замораживали при –80°С. Замороженные клетки мицелия быстро растирали пестиком в фарфоровой ступке, ресуспендировали в 1 мл ISOGEN при комнатной температуре, затем к ним добавляли 0.2 мл хлороформа, раствор перемешивали, выдерживали при комнатной температуре в течение 3 мин и центрифугировали при 12 500 g в течение 10 мин при 4°С. После этого отбирали 0.5 мл супернатанта и смешивали с 0.5 мл изопропанола, тщательно перемешивали, выдерживали при комнатной температуре в течение 10 мин и центрифугировали при 7 500 g в течение 5 мин при 4°С. Супернатант удаляли, осадок ресуспендировали в 1 мл 70%-ного этанола, и суммарная РНК выпадала в осадок после центрифугирования данного раствора при 7500 g в течение 5 мин при 4°С. Супернатант удаляли. Осадок РНК высушивали на воздухе. После сушки осадок растворяли в воде, обработанной диэтилпирокарбонатом. Целостность РНК подтверждали проведением электрофореза для образца РНК массой 20 мкг через 1%-ный агарозо-МОРS гель.
Микрочиповый анализ ДНК
Приблизительно 1 мкг мРНК, определенной спектрофотометрически при 260 нм, метили Cy3-dUTP для РНК сравнения или Cy5-dUTP для РНК в эксперименте с CyScribe cDNA Post Labeling Kit “GE Healthcare” (Великобритания) в соответствии с инструкциями изготовителя. Меченую комплементарную ДНК (кДНК) очищали с помощью CyScribe GFX Purification Kit “GE Healthcare” (Великобритания). Очищенные Су3- и Су5-меченные кДНК пробы смешивали в равном количестве и высушивали с помощью вакуумного насоса. Смесь меченых проб ресуспендировали в 60 мкл раствора для гибридизации следующего состава: 10.2 мкл ×20 стандартного цитратно-солевого буфера (SSC), 21 мкл формамида, 0.6 мкл семенников лосося, 1.8 мкл 10%-ного додецилсульфата натрия, 26.4 мкл дистиллированной воды. После тепловой денатурации при 95°С в течение 5 мин и инкубации при комнатной температуре в течение 30 мин смесь меченых кДНК наносили на 11 К A. oryzae олигонуклеотидные микрочипы “Fermlab” (Япония). После гибридизации при 42°С в течение 15 ч предметные стекла с микрочипами для анализа отмывали при комнатной температуре с использованием омывателя для предметных стекол SW-4 “Juji Field” (Япония) в растворе, содержащем ×2 SSC и 0.03%-ный додецилсульфат натрия в течение 15 мин, затем в растворе, содержащем ×0.2 SSC в течение 5 мин, и в завершение в растворе, содержащем ×0.05 SSC в течение 5 мин [12]. После удаления оставшегося буфера предметные стекла для микрочипового анализа ДНК были просмотрены с помощью сканера GenePix 4000B “Axon Instruments at Molecular Device” (США). Чувствительность сканирования была установлена так, чтобы отношение Су3/Су5 не превышало 0.8–1.2.
Квантификация изображений и анализ данных
Точки с отсканированных изображений микрочипового анализа были автоматически идентифицированы с помощью программного обеспечения Gene Pix Pro 6.0 “Axon Instruments at Molecular Devices” (США) со следующими параметрами: “Find circular features”, “Resize features during alignment” 60–200% диаметра и “Limit feature movement during alignment” 40 мкм. Интенсивность флуоресценции двух красителей Су3 и Су5 контрольного и опытного образцов РНК, соответственно, рассчитывали в каждой точке. Присутствующие и отсутствующие точки обозначались как “Р” и “А”, соответственно. Полученные данные импортировали в программное обеспечение Gene Spring GX 7.3.1 “Agilent Technologies” (США) для дальнейшего анализа. Для каждого эксперимента данные перекрестного окрашивания коррелировали по глубине и среднюю интенсивность точки использовали для уменьшения погрешности эксперимента. Нормализацию выполняли на скоррелированных по глубине данных с помощью нормализации локально взвешенного сглаживания диаграммы рассеяния (locally weighted scatter plot smoothing, LOWESS) со стандартными настройками, в которых использовали точки контрольной РНК с флуоресцентной интенсивностью выше 0.1 в обоих микрочипах. За степень экспрессии принимали отношение нормализованных интенсивностей экспериментальной мРНК к контрольной мРНК. Анализ степени экспрессии выполняли для точек с отметкой “Р” (приблизительно 73–99% от общего количества точек) на обоих микрочипах.
Анализ методом Нозерн-блот
Гибридизацию методом Нозерн-блот выполняли по методике [13]. 20 мкг суммарной РНК помещали на агарозный гель для проведения электрофореза. Количество используемой общей РНК определяли путем окрашивания следов от 18S и 28S рибосомных РНК бромистым этидием. Интенсивность сигналов измеряли с помощью биомолекулярного преобразователя изображений QuantLas 4000 biomolecular imager “GE Healthcare Bio-Sciences AB” (Швеция).
Количественная ПЦР в реальном времени
ПЦР в реальном времени была выполнена на Mini Opticon real-time PCR system “Bio-Rad Laboratories” (США) с детекцией SYBR Green, в соответствии с инструкциями изготовителя. Для приготовления реакционной смеси применяли набор DyNAmo SYBR Greenq PCR “Finnzymes Oy” (Финляндия). Для каждой реакционной смеси использовали эквивалентное количество кДНК, полученное с помощью реакции обратной транскрипции, с эквивалентным количеством суммарной РНК. В качестве нормализационного контрольного образца для определения степени экспрессии целевых генов использовался ген гистона Н2В. Статистический анализ был основан на критерии Уэлча, статистическую значимость определяли по значению Р = 0.05.
Последовательности используемых в исследовании праймеров представлены в табл. 1.
Таблица 1.
Последовательности праймеров, используемых в работе
| Код открытой рамки считывания | Ген | Пара праймеров (ориентация последовательностей – 5'–3' ) |
|---|---|---|
| AO090003000055 | enoA | F, CAAGTTAGTCGACTGACCAATTCC R, GGTTGACAGAAGTGCGGAAC |
| AO090701000065 | actA | F, ATGGAAGAGGAAGTTGCTGCTC R, TGCTCCTCCTGAGCGTAAAT |
| AO090020000006 | histone H2B | F, ATGGCACCCAAGGCTGCTG R, TTATTTGGCAGAAGAGGAGTACTTCG |
| AO090120000080 | tef1 | F, ATGGGTAAGGAAGACAAGCAGCAC R, TTATTTCTTGCCAGCCTTCTGG |
| AO090005001535 | F, CTTCAAGTCGGGCGCATG R, CAACCTGCGCAGACTTGAAC |
|
| AO090003000631 | F, ATGCTTTTTATACCGACTGTTCCTAC R, GAAGGCTGACGCTAAGCACTAA |
|
| AO090009000289 | F, ATGGTGCACAGCAAAGTCGTTATC R, TTAGAGGAGAGGGTTGGACTTGTAC |
|
| AO090005001147 | F, ATGTCCCAGAACAAGGCTCTC R, TTCAGGACAGCTTTGCCCTTG |
Определение активности ферментов
Мы исследовали общую активность ряда нативных эндо- и экзооксидоредуктаз (каталазы, пероксидазы, фенолоксидазы) гриба А. oryzae. Для определения активности экзооксидоредуктаз отбирали пробы культуральной среды гриба (15 мл). Для оценки активности эндооксидоредуктаз навеску мицелия гриба (500 мг) после определенного времени культивирования отделяли от культуральной среды, дезинтегрировали методом аналогичным описанному для выделения РНК, помещали в фосфатный буфер (рН 7.2 для каталазы и пероксидазы, рН 7.6 для фенолоксидазы), центрифугировали при 10 000 g в течение 15 мин, после чего отбирали супернатант для анализа. Активность ферментов определяли спектрофотометрически на приборе UV-mini 1240 “Shimadzu” (Япония): каталазную – по убыли Н2О2 (приλ = 240нм) [14], фенолоксидазную – по окислению п-фенилендиамина (при λ = 535 нм) [15], пероксидазную – по окислению п-фенилендиамина (при λ = 535 нм) в присутствии Н2О2 [16]. За единицу активности (ед.) каждого из перечисленных ферментов принимали изменение оптической плотности реакционной смеси за 1 мин в пересчете на 1 мг белка. Содержание белка в мицелии и культуральной среде определяли методом Лоури–Фолина [17]. Активность выражали в процентах по отношению к контролю. За контроль принимали значение активности оксидоредуктаз А. oryzae при его культивировании на среде с ДМСО без селенсодержащих соединений.
Активность оксидоредуктаз определяли на 13-е сутки культивирования. Селенорганические соединения растворяли в ДМСО и вносили в культуральную среду на четвертые сутки культивирования в концентрации 10 мг/л.
Статистическая обработка данных
Все результаты, полученные не менее чем в трех независимых экспериментах и не менее чем в трех повторностях, обрабатывали с помощью программ Statistica 10.0 и Microsoft Excel 2007. Оценку достоверности различий средних значений проводили по критерию Стьюдента для уровня вероятности не менее 95%. В таблицах и на рисунках приведены средние значения всех опытов со стандартными ошибками [18].
РЕЗУЛЬТАТЫ
Исследование воздействия ди(2-пиридил-1-оксид)диселенида на уровень экспрессии генов А. oryzaе
В результате наших предыдущих исследований по определению фунгицидных свойств селенорганических соединений было установлено, что среди используемых соединений наибольшей фунгицидной активностью обладает ди(2-пиридил-1-оксид)диселенид. Минимальная ингибирующая концентрация его по отношению к А. oryzaе составила 0.50% [19]. Стоит отметить, что контрольное соединение пиридин-1-оксид, аналогичное по строению исследуемым соединениям, но не содержащее в своем составе атомов селена, не проявляло ингибирующего действия на рост грибов в используемых концентрациях, что позволяет говорить о его нетоксичности по отношению к выбранным грибам. Для того чтобы определить гены А. oryzaе, на которые непосредственно влияет ди(2-пиридил-1-оксид)диселенид, необходимо выбрать оптимальное время его воздействия на мицелий. Это связано с тем, что при недостаточном времени воздействия препарата на микроорганизм экспрессия генов не изменится, а при слишком длительном воздействии препарата обнаружатся изменения в экспрессии очень большого числа разнообразных генов, косвенным образом связанных с действием препарата. С учетом этого на первом этапе данной серии экспериментов мы изучили влияние времени воздействия ди(2-пиридил-1-оксид)диселенида на уровень экспрессии генов А. oryzaе методом Нозерн-блот-анализа. Для этого были выбраны четыре гена с высоким уровнем экспрессии в вегетативном состоянии мицелия, а именно enoA, actA, histone H2B, tef1. Известно, что enoA (AO090003000055) кодирует фермент енолазу (фосфопируватгидратазу), катализирующий реакцию превращения 2-фосфоглицерата в фосфоенолпируват в процессе гликолиза у А. oryzaе, его транскрипция индуцируется глюкозой. У А. oryzaе аctA (AO090701000065) является одним из двух генов, кодирующих актин, белок, полимеризованная форма которого образует микрофиламенты — один из основных компонентов цитоскелета. Ген histone H2B (AO090020000006) кодирует белок гистон Н2В, который отвечает за сборку нуклеосомы, связывание ДНК, а также участвует в гетеродимеризации белков. Ген tef1 (AO070315000081) кодирует фактор элонгации транскрипции EF-1-альфа и преимущественно экспрессируется в концевых областях гиф. Мицелий А. oryzaе подвергался воздействию указанного соединения в течение следующих интервалов времени: 10 мин, 30 мин, 1 ч, 3 ч, 6 ч. Было обнаружено значительное подавление экспрессии гена enoA в мицелии после воздействия исследуемого соединения в течение 3 и 6 ч (рис. 1).
Рис. 1.
Величина экспрессии гена enoA в мицелии А. oryzaе после воздействия ДМСО (D) и ди(2-пиридил-1-оксид)диселенида (Se) в течение 3 и 6 ч.

Уровень экспрессии actA также был подавлен длительным (3 и более часов) воздействием указанного соединения. Экспрессия гистона Н2В в умеренной степени подавлялась селенсодержащим соединением, причем степень подавления увеличивалась с течением времени. Было обнаружено, что экспрессия гена tef1 подавляется действием растворителя (ДМСО) зависимым от времени образом, поэтому из данного эксперимента он был исключен. В соответствии с вышеизложенным можно сделать вывод о том, что ди(2-пиридил-1-оксид)диселенид не влияет на экспрессию выбранных высокоэкспрессируемых генов A. oryzae при кратковременном воздействии (10 мин), а при долговременном (1–6 ч) – подавляет экспрессию этих генов. Вследствие этого для того чтобы определить на какие гены ди(2-пиридил-1-оксид)диселенид воздействует в первую очередь, нами был выбран 30-минутный период воздействия и затем проведен микрочиповый анализ ДНК.
На этом этапе мы использовали суммарную РНК, выделенную из образцов мицелия A. oryzae RIB40 после 30-минутного воздействия 10 мг/л раствора ди(2-пиридил-1-оксид)диселенида в ДМСО или соответствующего количества ДМСО в контрольном эксперименте. Пробы ДНК для гибридизации были получены в ходе реакции обратной транскрипции с Су3- или Су5-меченными рандомными наномерами. Эксперименты проводились в двух повторностях, флуоресцентные сигналы детектировались путем сканирования. Об изменении уровня экспрессии гена под влиянием ди(2-пиридил-1-оксид)диселенида судили по соотношению уровней экспрессии гена в контрольном и опытном образцах. Если это соотношение было меньше 1, то имело место снижение экспрессии, а если больше – увеличение экспрессии гена под влиянием указанного соединения. Микрочиповый анализ ДНК генома показал, что экспрессия многих генов А. oryzae после воздействия ди(2-пиридил-1-оксид)диселенида отличается от контрольного образца. В общей сложности под влиянием указанного соединения изменился уровень экспрессии 72 генов. Из них 16 генов показали снижение уровня экспрессии более чем в 2 раза, а 30 – активацию, также в 2 и более раз. Наиболее сильно была подавлена экспрессия гена AO090120000214, который кодирует белок-переносчик ионов меди. Ортологи данного гена кодируют белки, которые участвуют в переносе ионов меди через плазматическую мембрану, аэробном дыхании, прорастании спор, росте гиф. Также было показано снижение экспрессии некоторых других генов, предположительно участвующих в транспорте ионов меди (AO090023000430, AO090120000175). Гены, уровень экспрессии которых увеличился под действием исследуемого соединения, кодируют разнообразные белки, в том числе шапероны (AO090038000288, AO090113000129), факторы инициации трансляции (AO090020000122, AO090012000783), гидролазы (AO090012000372), редуктазы (AO090005000481, AO090020000347) и т.д. В ответ на воздействие ди(2-пиридил-1-оксид)диселенида наибольшая активация была обнаружена для генов оксидоредуктаз и ферментов, поддерживающих окислительно-восстановительный гомеостаз. Данные результаты позволяют предположить, что селенсодержащие соединения нарушают окислительно-восстановительное равновесие клеток. Характеристики генов, уровень экспрессии которых изменился в наибольшей степени под воздействием ди(2-пиридил-1-оксид)диселенида, представлены в табл. 2.
Таблица 2.
Гены A. oryzae, уровень экспрессии которых значительно изменялся после воздействия ди(2-пиридил-1-оксид)диселенида
| Код открытой рамки считывания | Функция белка | Соотношение опыт/контроль |
|---|---|---|
| AO090120000214 | Транспортер ионов меди | 0.10 |
| AO090023000430 | Белок с предсказанными функциями | 0.21 |
| AO090120000175 | Белок с предсказанными функциями | 0.24 |
| AO090012000675 | НАД:флавиноксидоредуктаза | 4.59 |
| AO090003000631 | Глутатион-S-трансфераза | 4.86 |
| AO090005000481 | НАДН:флавиноксидоредуктаза/12-оксофитодиеноатредуктаза | 4.72 |
| AO090012000783 | Фактор инициации трансляции 2, альфа субъединица (eIF-2alpha) | 4.93 |
| AO090020000347 | Фосфоаденозинфосфосульфатредуктаза | 5.37 |
| AO090005001147 | НАД-зависимая оксидоредуктаза | 6.32 |
| AO090009000289 | Тиоредоксинредуктаза | 9.38 |
| AO090010000541 | Предполагаемая оксидоредуктаза, родственная нитроредуктазам | 13.71 |
| AO090003000124 | Белок с предсказанными функциями | 15.55 |
| AO090005001535 | НАДН:флавиноксидоредуктаза/12-оксофитодиеноатредуктаза | 43.07 |
Из данной таблицы видно, что воздействие ди(2-пиридил-1-оксид)диселенида вызывает умеренную (4.6–9.4) активацию экспрессии генов НАДН:флавиноксидоредуктаза/12-оксофитодиеноатредуктазы, глутатион-S-трансферазы, НАДН: флавиноксидоредуктазы, фосфоаденозинфосфосульфатредуктазы, НАД-зависимой оксидоредуктазы, тиоредоксинредуктазы и значительную активацию генов нитроредуктазы и НАДН:флавиноксидоредуктазы/12-оксофитодиеноатореду-ктазы (в 13.7 и 43.1 раз соответственнно).
Поскольку результаты микрочипового анализа ДНК сильно зависят от качества гибридизации, и в случаях плохой гибридизации полученные сигналы могут в несколько раз отличаться от реальных значений, нами проводились дополнительные исследования. Для подтверждения данных, полученных методом микрочипового анализа ДНК, и уточнения значений разницы в экспрессии генов в мицелии после воздействия ди(2-пиридил-1-оксид)диселенида и в контроле, выполнялась количественная ПЦР в реальном времени. С этой целью были выбраны четыре гена: AO090003000631, AO090005001147, AO090009000289, AO090005001535. Выбор данных генов был основан на величине уровня экспрессии и роли в специфическом механизме ответа на воздействие ди(2-пиридил-1-оксид)диселенида. Результаты эксперимента показали, что уровень экспрессии генов в мицелии после воздействия исследуемого соединения превосходил уровень экспрессии в контроле для AO090003000631 в 3.41 раз, AO090005001147 в 7.57 раз, AO090009000289 в 4.95 раз, AO090005001535 в 9.57 раз.
Таким образом, несмотря на некоторую разницу в значениях, полученных разными методами, было доказано, что воздействие ди(2-пиридил-1-оксид)диселенида действительно вызывает значительное увеличение экспрессии генов оксидоредуктаз и глутатионтрансфераз, которые играют главную роль в поддержании окислительно-восстановительного гомеостаза клеток.
Исследование действия ди(2-пиридил-1-оксид)диселенида на активность оксидоредуктаз А. oryzaе
В ходе дальнейших экспериментов нами было исследовано действие ди(2-пиридил-1-оксид)диселенида на физиолого-биохимические характеристики данного микромицета, а именно активность экзо- и эндооксидоредуктаз (каталазы, пероксидазы, фенолоксидазы). Результаты данных экспериментов представлены на рис. 2.
Рис. 2.
Действие ди(2-пиридил-1-оксид)диселенида на прирост биомассы и активность оксидоредуктаз А. oryzae.
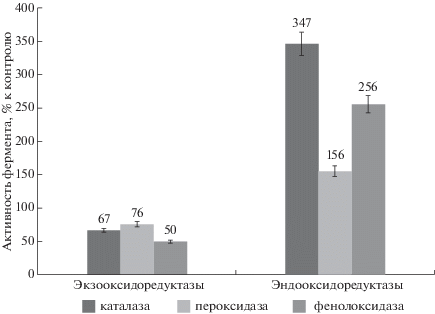
В ходе данного эксперимента было установлено, что ди(2-пиридил-1-оксид)диселенид значительно подавляет активность экзооксидоредуктаз А. oryzae, особенно фенолоксидазы. Действие же данного соединения на активность эндооксидоредуктаз было противоположным. Нами обнаружено значительное увеличение активности данных ферментов под воздействием ди(2-пиридил-1-оксид)диселенида. Стоит отметить, что оксидоредуктазы играют важную роль в жизнедеятельности микроорганизмов, в том числе микроскопических грибов. Экстрацеллюлярные ферменты участвуют в метаболизме различных субстратов природного и синтетического происхождения. Эндооксидоредуктазы участвуют в поддержании окислительно-восстановительного гомеостаза. В связи с этим можно предположить, что исследуемое соединение нарушало окислительно- восстановительный гомеостаз клеток, что и обусловливало повышенную активность эндооксидоредуктаз.
ОБСУЖДЕНИЕ
Как уже отмечалось ранее, механизм действия селенсодержащих соединений на живые организмы относительно мало изучен. Поскольку у микроскопических грибов отсутствует потребность в селене (в отличие от бактерий, архей, некоторых водорослей и животных, у грибов селенопротеины обнаружены не были [20]), они представляют собой чрезвычайно удобный объект для изучения влияния селена на функционирование клеток. Перед нами стояла задача определить на какие метаболические пути микроскопических грибов могут оказывать влияние изучаемые селенсодержащие соединения. Использование технологий микрочипового анализа ДНК в сочетании с доступностью расшифрованной геномной последовательности А. oryzaе предоставляет возможность исследовать изменение экспрессии генов по всему геному данного микромицета, что позволяет выявить его ответные реакции на воздействие конкретных препаратов. Эти реакции отражают механизмы как прямого, так и косвенного действия соединений, а также известные и потенциально возможные механизмы устойчивости к ним [8]. В наших экспериментах было обнаружено значительное увеличение уровня экспрессии различных генов, которые представляют собой ценную коллекцию генов-кандидатов, дальнейшее изучение функций которых позволит выяснить до какой степени они ответственны за устойчивость A. oryzae к селенсодержащим фунгицидам. В наибольшей степени было обнаружено повышение уровня экспрессии генов, отвечающих за синтез оксидоредуктаз. Вероятно, активация этих генов может быть связана с немедленным ответом на окислительный стресс, вызванный соединениями селена. Поскольку в нашем эксперименте большое число генов (72) изменяет экспрессию в ответ на воздействие селенсодержащего соединения, можно предположить, что токсичность данного соединения связана не только с непосредственным окислительным стрессом. Мы полагаем, что окислительный стресс, приводящий к нарушению окислительно-восстановительного равновесия, является одним из первых последствий проникновения селена в клетки A. oryzae. Это может быть связано с процессами детоксикации селена внутри клеток, которые сопровождаются образованием активных форм кислорода (АФК) [21].
Кроме того, известно, что у дрожжеподобных грибов селен в форме селенита при попадании в клетки вызывает снижение общего количества глутатиона, а, следовательно, ограничивает активность глутатион-зависимых ферментов, устраняющих АФК, что также способствует накоплению АФК и нарушению окислительно- восстановительного баланса клетки. В дополнение к этому селенит вызывает снижение соотношения глутатиона к его восстановленной форме (GSH/GSSG) в клетке, что также способствует снижению общего количества глутатиона [22]. Стоит отметить, что наши эксперименты показали увеличение более чем в 3 раза уровня экспрессии гена глутатион-S-трансферазы (AO090003000631). Ортологи данного гена отвечают за образование GSSG. Таким образом, полученные результаты позволили расширить наши представления о возможных механизмах действия селенсодержащих соединений на метаболизм клеток микроскопических грибов. В связи с этим на следующем этапе работы мы провели исследование изменения активности оксидоредуктаз (каталазы, пероксидазы, фенолоксидазы) под влиянием указанного соединения (рис. 2). Было обнаружено значительное повышение уровня активности эндооксидоредуктаз, что может быть связано с увеличением их синтеза de novo в результате влияния исследуемых соединений на экспрессию генов. Это предположение подтверждают результаты микрочипового анализа, которые также показали увеличение уровня экспрессии генов оксидоредуктаз. В экспериментах по оценке влияния ди(2-пиридил-1-оксид)диселенида на уровень активности экзоферментов было обнаружено снижение уровня активности экзооксидоредуктаз, которые также синтезируются в клетках грибов. Поэтому снижение их активности в культуральной среде, на наш взгляд, может быть связано с мембранотропным эффектом селенсодержащих соединений, т.е. их способностью изменять проницаемость мембран и определенным образом регулировать выход экзоферментов из клетки. О том, что селен способен влиять на экспрессию генов изучаемых ферментов, т.е. регулировать их синтез, указывается в работе [23]. В данной работе отмечается, что происходит существенное увеличение активности экзооксидоредуктаз в присутствии селена. Y.H. Kim с соавт. объясняют это тем, что в данном случае селен перестает выполнять антиоксидантную функцию и, напротив, способен вызывать окислительный стресс, который влечет за собой увеличение активности лакказы и пероксидазы. В работе [24] отмечалось, что в присутствии селенсодержащих соединений происходило снижение интенсивности дыхания гриба Lentinula edodes. Такой эффект может привести к нарушению окислительно-восстановительного гомеостаза клетки в результате окислительного стресса, вызванного селеном. По мнению авторов, ответной реакцией на это может быть увеличение активности эндооксидоредуктаз (в частности, лакказы), что они и наблюдали в своих экспериментах. Об адаптогенном и антистрессовом влиянии селена на микромицеты указывается в работе [25]. Возможно, аналогичное объяснение может быть правомерным и в нашей схожей ситуации в случае увеличения активности эндооксидоредуктаз А. oryzae при действии селенорганических соединений.
Результаты проведенных нами исследований позволяют выявить участки метаболизма А. oryzae, на которые способны влиять селенсодержащие соединения, что расширяет знания о механизмах токсического действия селенсодержащих соединений на микроскопические грибы. Анализ ингибирования экспрессии генов под воздействием ди(2-пиридил-1-оксид)диселенида будет весьма полезен в области создания фунгицидов направленного действия, которые могут найти применение в медицине, ветеринарии, сельском хозяйстве, а также в качестве средств защиты промышленных материалов от биоповреждений, вызываемых мицелиальными грибами.
Авторы статьи выражают благодарность проф. К. Gomi и коллективу кафедры “Bioindustrial Genomics” Tohoku University за предоставление возможностей для проведения экспериментов и консультации.
Список литературы
Bhowmick D., Mugesh G. Enzyme mimetic chemistry of organoselenium compounds // Patai’s Chemistry of Functional Groups. Chichester, UK: John Wiley & Sons, Ltd., 2013. P. 1175–1235. doi 10.1002/ 9780470682531.pat0726
Ninomiya M., Garud D.R., Koketsu M. Biologically significant selenium-containing heterocycles // Coord. Chem. Rev. 2011. V. 255. P. 2968–2990. doi 10.1016/ j.ccr.2011.07.009
Piętka-Ottlik M., Wójtowicz-Młochowska H., Kołodziejczyk K. et al. New organoselenium compounds active against pathogenic bacteria, fungi and viruses // Chem. Pharmaceutical Bull. 2008. V. 56. № 10. P. 1423–1427. doi 10.1248/cpb.56.1423
Henderson R., Rothgery E.F., Schnieder H.A. 2-Selenopyridine-N-oxide derivatives and their use as fungicides and bactericides // US Patent № 4496559. 1985.
Mániková D., Vlasáková D., Loduhová J. et al. Investigations on the role of base excision repair and non-homologous end-joining pathways in sodium selenite-induced toxicity and mutagenicity in Saccharomyces cerevisiae // Mutagenesis. 2009. V. 25. № 2. P. 155–162. doi 10.1093/mutage/gep056
Wu Z.L., Yin X.B., Lin Z.Q. Inhibitory effect of selenium against Penicillium expansum and its possible mechanisms of action // Current Microbiol. 2014. V. 69. № 2. P. 192–201. doi 10.1007/s00284-014-0573-0
Колтовая Н.А., Никулушкина Ю.В., Кадышевская Е.Ю. и др. Взаимодействие чекпойнт-генов RAD9, RAD17, RAD24, RAD53 c генами SRM5/CDC28, SRM8/NET1 и SRM12/HFI1 в определении чувствительности дрожжей Saccharomyces cerevisiae к действию ионизирующей радиации // Генетика. 2008. Т. 44. № 8. С. 1045–1055.
De Backer M.D., Ilyina T., Ma X.J. et al. Genomic profiling of the response of Candida albicans to itraconazole treatment using a DNA microarray // Antimicrob. Agents and Chemotherapy. 2001. V. 45. № 6. P. 1660–1670. doi 10.1128/AAC.45.6.1660-1670.2001
Liu T.T., Lee R.E.B., Barker K.S. et al. Genome-wide expression profiling of the response to azole, polyene, echinocandin, and pyrimidine antifungal agents in Candida albicans // Antimicrob. Agents and Chemotherapy. 2005. V. 49. P. 2226–2236. doi 10.1128/ AAC.49.6.2226-2236.2005
Meyer V., Damveld R.A., Arentshorst M. et al. Survival in the presence of antifungals: genome-wide expression profiling of Aspergillus niger in response to sublethal concentrations of caspofungin and fenpropimorph // J. Biol. Chem. 2007. V. 282. P. 32935–32948. doi 10.1074/jbc.M705856200
Mautner H., Chu Sh., Lee C.M. Studies of 2-selenopyridine and related compounds // J. Org. Chem. 1962. V. 27. P. 3671–3673. doi 10.1021/jo01057a065
Terabayashi Y., Sano M., Yamane N. et al. Identification and characterization of genes responsible for biosynthesis of kojic acid, an industrially important compound from Aspergillus oryzae // Fungal Genet. Biol. 2010. V. 47. № 12. P. 953–961. doi 10.1016/ j.fgb.2010.08.014
Kubodera T., Nobuo Y., Akira N. Pyrithiamine resistance gene (ptrA) of Aspergillus oryzae: cloning, characterization and application as a dominant selectable marker for transformation // Biosci. Biotechnol. Biochem. 2000. V. 64. № 7. P. 1416−1421. doi 10.1271/ bbb.64.1416
Li Y., Shellhorn H.E. Rapid kinetic microassay for catalase activity // J BiomolTech. 2007. V. 18. № 4. P. 185−187.
Flurkey W.H., Ratcliff B., Lopez L. et al. Differentiation of fungal tyrosinases and laccases using selective inhibitors and substrates // Enzym. Browning and its Prevention. 1995. V. 6. P. 81−89. doi 10.1021/bk-1995-0600.ch006
Nagaraja P., Shivakumar A., Kumar S.A. Development and evaluation of kinetic spectrophotometric assays for horseradish peroxidase by catalytic coupling of paraphenylenediamine and mequinol // AnalSci. 2009. V. 25. № 10. P. 1243−1248. doi 10.2116/analsci.25.1243
Досон Р., Эллиот Д., Эллиот У., Джонс К., Справочник биохимика. М.: Мир, 1991. 544 с. doi 10.1271/bbb.64.1416
Кобзарь А.И. Прикладная математическая статистика. М.: Физматлит, 2006. 816 с.
Залепкина С.А., Артемьева М.М., Безруков М.Е. и др. Использование селенсодержащих гетероциклических соединений в качестве средств защиты лакокрасочных материалов от микробиологических повреждений // Экология и промышл. России. 2018. Т. 1. С. 56−61. doi 10.18412/1816-0395-2018-1-56-61
Herrero Perpiñán E., Wellinger R.E. Yeast as a model system to study metabolic impact of selenium compounds // Microbial. Cell. 2015. V. 2. № 5. P. 139–149. doi 10.15698/mic2015.05.200
Bockhorn J., Balar B., He D. et al. Genome-wide screen of Saccharomyces cerevisiae null allele strains identifies genes involved in selenomethionine resistance // Proc. Natl Acad. Sci. USA. 2008. V. 105. № 46. P. 17682−17687. doi 10.1073/pnas.0805642105
Rao Y., McCooeye M., Windust A. et al. Mapping of selenium metabolic pathway in yeast by liquid chromatography-orbitrap mass spectrometry // Analyt. Chem. 2010. V. 82. № 19. P. 8121−8130. doi 10.1021/ ac1011798
Kim Y.H., Lee H.S., Kwon H.J. et al. Effects of different selenium levels on growth and regulation of laccase and versatile peroxidase in white-rot fungus, Pleurotus eryngii // World J. Microbiol. Biotechnol. 2014. V. 30. № 7. P. 2101–2109. doi 10.1007/s11274-014-1650-z
Nunes R.G.F.L., da Luz J.M.R., Fantuzzi E. et al. Mycelial growth of Pleurotus spp. in Se-enriched culture media // Advances Microbiol. 2013. V. 3. P. 31–36. doi 10.4236/aim.2013.38A003
Ильин Д.Ю., Ильина Г.В., Морозова М.И. Возможности использования соединений селена при хранении коллекционных культур ксилотрофных базидиомицетов // Изв. Саратовского ун-та. Серия Химия. Биология. Экология. 2012. Т. 12. №. 1. С. 56–60.
Дополнительные материалы отсутствуют.


