Генетика, 2019, T. 55, № 4, стр. 485-488
Влияние мутаций генов инсулинового сигнального каскада на изменение уровня углеводов у самок Drosophila melanogaster при тепловом стрессе
М. А. Еремина 1, Е. К. Карпова 1, И. Ю. Раушенбах 1, Д. С. Пирожкова 1, О. В. Андреенкова 1, Н. Е. Грунтенко 1, *
1 Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: nataly@bionet.nsc.ru
Поступила в редакцию 20.04.2018
После доработки 27.09.2018
Принята к публикации 28.05.2018
Аннотация
Исследовано влияние генов инсулинового сигнального каскада, транскрипционного фактора семейства Forkhead box class O (dfoxo) и инсулиноподобного белка DILP6 (dilp6), синтезируемого в жировом теле, на содержание углеводов в норме и при тепловом стрессе у самок Drosophila melanogaster. Установлено, что гипоморфные мутации dilp641 и foxoBG01018 вызывают в нормальных условиях повышение уровней глюкозы и трегалозы. Впервые показано, что резкое снижение уровня экспрессии генов dilp6 и dfoxo, вызываемое этими мутациями, не препятствует повышению уровней обоих сахаров при тепловом стрессе, однако снижает интенсивность этого ответа.
Сигнальный каскад инсулина/инсулиноподобных факторов роста (И/ИФР) крайне эволюционно консервативен и участвует в регуляции роста, развития, размножения, метаболического гомеостаза, продолжительности жизни и устойчивости к различным видам стресса [1–3]. В последние годы значительно вырос интерес к исследованию сигнального каскада И/ИФР у дрозофилы и использованию мух в качестве модельной системы для выяснения механизмов ряда заболеваний человека, таких как ожирение и диабет [1, 2, 4, 5]. Механизмы развития сахарного диабета все еще недостаточно изучены, и привлечение генетических моделей, таких как Drosophila melanogaster, может оказаться полезным для расшифровки молекулярно-генетических основ заболевания.
У D. melanogaster на настоящий момент известно восемь инсулиноподобных белков (DILP1–8). Эти белки связываются с единственным инсулиновым рецептором (InR), который активирует И/ИФР. Стимуляция рецептора приводит через ортолог субстрата инсулинового рецептора млекопитающих (СHICO) к активации протеинкиназы Akt, которая в свою очередь модулирует активность ряда белков, в частности, транскрипционного фактора семейства Forkhead box class O (dFOXO) [1, 5]. В нормальных условиях dFOXO неактивен, поскольку ингибируется И/ИФР; при снижении активности И/ИФР, в частности при недостатке питательных веществ, dFOXO транслоцируется в ядро, где активирует экспрессию генов-мишеней [6, 7]. Показано, что у дрозофилы окислительный и тепловой стресс также активируют dFOXO [6–8]. Сверхэкспрессия dFOXO повышает приспособленность [8, 9], что, в частности, подтверждается сниженной устойчивостью нуль-мутантов dFOXO дрозофилы к окислительному стрессу и их меньшей эффективностью в защите хозяев от вирусов [7, 10].
Установлено, что инсулиноподобный белок DILP6 экспрессируется на низком уровне в слюнных железах и сердце личинок и на высоком уровне – в жировом теле личинок и имаго D. melanogaster [1, 11]. Показано, что повышение экспрессии DILP6 в жировом теле самок D. melanogaster сопровождается повышением устойчивости к окислительному стрессу [12] и индуцирует поглощение липидов эноцитами у самок D. melanogaster, стимулирует жировой обмен при нехватке питания и повышает устойчивость мух к голоду [13]. Также обнаружено, что экспрессия DILP6 регулируется экдизоном – гормоном, стимулирующим линьку и метаморфоз у членистоногих, и транскрипционным фактором dFOXO [11, 12].
Основные компоненты сигнального каскада И/ИФР хорошо сохраняются в ходе эволюции, хотя у млекопитающих они имеют более высокую сложность, чем у беспозвоночных [11]. Изучение И/ИФР D. melanogaster демонстрирует, что консервативность также распространяется и на функциональный уровень. У мух со сниженной интенсивностью инсулинового сигналинга наблюдается повышенное содержание глюкозы в гемолимфе и высокое содержание углеводов и липидов в тканях, аналогичное наблюдаемому у млекопитающих с диабетическим фенотипом [14].
Двумя основными формами циркулирующих углеводов у дрозофилы являются глюкоза и трегалоза (дисахарид глюкозы). Глюкозу муха получает из внешних источников (с пищей), тогда как трегалоза синтезируется в жировом теле (аналоге печени/жировой ткани млекопитающих), циркулирует в гемолимфе и поглощается мышечными тканями, где метаболизируется до глюкозы [15].
В настоящей работе мы исследовали влияние гипоморфных мутаций генов dilp6 и dfoxo на изменение уровня углеводов при тепловом стрессе у половозрелых самок D. melanogaster.
В работе были использованы три линии D. melanogaster: линия dilp641 с делецией 3'-области гена phl и 5'-области гена dilp6, захватывающей первый экзон [3]; линия foxoBG01018, несущая транспозон элемента P [GT1] в 5'-области гена dfoxo, что приводит к снижению его экспрессии и функции [3, 6]; и линия дикого типа Canton S, используемая в качестве контроля. Линии получены из Bloomington Drosophila Stock Center. Мух выращивали на стандартной питательной среде при 25°C. Синхронизацию линий проводили по вылету имаго (собирали мух, вылетевших в течение 3–4 ч). Мух подвергали тепловому стрессу, перенося пробирки в сухой шкаф с температурой 38°С на 30 мин.
Экспрессию dilp6 измеряли в жировых телах 20 мух с использованием TRI reagent Lot #BCBT8883 (“Sigma”, США) для выделения суммарной РНК, набора Revert Aid First Strand cDNA Synthesis Kit #K1621 (“Thermo Scientific”, США) c праймером oligo (dT)18 для получения кДНК, набора R-402 с SYBR-Green I (“Синтол”, Россия) для проведения ПЦР-РВ и амплификатора CFX96 (“BIO-RAD”, США). Использованные праймеры: Dilp6_F 5'CACGGAATACGAACAGAGACG3', Dilp6_R 5'TCGGTTACGTTCTGCAAGTC3', RpL32_F 5'AGCATACAGGCCCAAGATCGT3' и RpL32_R 5'CGATGTTGGGCATCAGATACTG3'. Для определения уровней углеводов мух гомогенизировали с последующим центрифугированием. Уровень глюкозы в супернатантах измеряли, используя Glucose (HK) Assay Kit #SLBL3912V (“Sigma”, США). Трегалозу конвертировали в глюкозу путем добавления трегалазы (0.5 ед./мл, “Sigma”, США) с последующим определением количества глюкозы в образце. Измерения проводили с использованием не менее четырех биологических повторов на спектрофотометре Smart Spec Plus (“BIO-RAD”, США) при длине волны 340 нм, в трех технических повторах каждый. Достоверность различий оценивали, используя t‑критерий Стъюдента.
Ранее методом количественной полимеразной цепной реакции в реальном времени (ПЦР-РВ) нами было установлено, что гипоморфная мутация foxoBG01018 приводит к двукратному снижению уровня мРНК dfoxo у линии, используемой в данной работе [7]. В настоящей работе методом ПЦР-РВ мы оценили влияние мутации dilp641 на экспрессию гена dilp6 в жировом теле самок соответствующей линии. Обнаружено, что экспрессия гена dilp6 у линии dilp641 снижена в 13 раз по сравнению с уровнем экспрессии гена dilp6 в жировом теле линии дикого типа Canton S.
На рис. 1 представлены результаты исследования уровня углеводов у самок D. melanogaster с мутациями dilp641 и foxoBG01018 и самок контрольной линии Canton S в нормальных условиях и при тепловом стрессе. Ясно видно, что у мутантных самок обеих линий уровень как глюкозы, так и трегалозы в нормальных условиях повышен по сравнению с самками дикого типа (различия достоверны при p < 0.001). При тепловом стрессе уровень обоих сахаров как у мух дикого типа, так и у мутантных самок повышается по сравнению с нормальными условиями (различия с контролем достоверны при p < 0.001 для обоих сахаров у линий Canton S и foxoBG01018 и при p < 0.001 для глюкозы и при p < 0.01 для трегалозы у линии dilp641). Таким образом, снижение экспрессии генов dilp6 и dfoxo не препятствует повышению уровня углеводов в ответ на тепловой стресс. Однако степень повышения уровня глюкозы (на 12.5% по сравнению с уровнем в нормальных условиях) и трегалозы (на 7.5%) при тепловом стрессе у самок dilp641 ниже, чем у мух дикого типа (на 22.5 и 34.3% соответственно). У самок линии foxoBG01018 повышение уровня трегалозы (на 9.5%) и глюкозы (на 24.4%) также менее выражено, чем у мух дикого типа.
Рис. 1.
Влияние теплового стресса (30 мин, 38°C) на уровень глюкозы и трегалозы у 3-суточных самок D. melanogaster линии дикого типа (Canton S) и линий, несущих гипоморфные мутации инсулиноподобного белка DILP6 и транскрипционного фактора dFOXO. Каждое значение – среднее из 12–22 измерений. Звездочка – достоверность отличий мутантных самок от самок линии Canton S, ромб – достоверность различий между подвергнутыми тепловому стрессу и контрольными мухами одного генотипа (два ромба или звездочки – p < 0.01, три – p < 0.001).
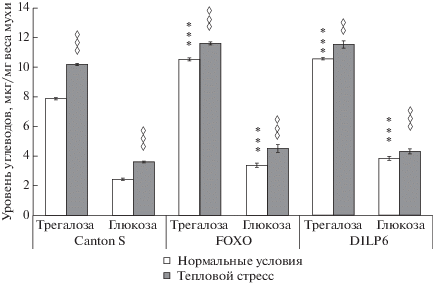
Полученные данные свидетельствуют о том, что гипоморфные мутации генов инсулинового каскада dilp6 и dfoxo, являющегося регулятором dilp6 в жировом теле [3, 12], приводят к повышению концентрации основных циркулирующих сахаров в гемолимфе дрозофилы и снижению интенсивности их ответа на тепловой стресс.
Работа выполнена при поддержке гранта РФФИ № 15-04-02934 и бюджетного проекта № 0324-2019-0041.
Список литературы
Toivonen J.M., Partridge L. Endocrine regulation of aging and reproduction in Drosophila // Mol. Cell. Endocrinol. 2009. V. 299. P. 39–50. doi 10.1016/ j.mce.2008.07.005
Nässel D.R., Vanden Broeck J. // Cell. Mol. Life Sci. 2016. V. 73. P. 271–290. doi 10.1007/s00018-015-2063-3
Gruntenko N.E., Rauschenbach I.Yu. The role of insulin signalling in the endocrine stress response in Drosophila melanogaster: A mini-review // Gen. Comp. Endocrinol. 2017. http://dx.doi.org/10.1016/j.ygcen.2017.05.019.
Xu J., Sheng Zh., Palli S.R. Juvenile hormone and insulin regulate trehalose homeostasis in the red flour beetle Tribolium castaneum // PLoS Genet. 2013. 9(6): e1003535. doi 10.1371/journal.pgen.1003535
Kannan K., Fridell Y.W. Functional implications of Drosophila insulin-like peptides in metabolism, aging, and dietary restriction // Front. Physiol. 2013. V. 4. P. 288.
Puig O., Marr M.T., Ruhf M.L., Tjian R. Control of cell number by Drosophila FOXO: downstream and feedback regulation of the insulin receptor pathway // Gen. Develop. 2003. V. 17. P. 2006–2020. doi 10.1101/gad.1098703
Gruntenko N.E., Adonyeva N.V., Burdina E.V. et al. The impact of FOXO on dopamine and octopamine metabolism in Drosophila under normal and heat stress conditions // Biol. Open. 2016. V. 5. P. 1706–1711. doi 10.1242/bio.022038
Hwangbo D.S., Gershman B., Tu M.P. et al. Drosophila dFOXO controls lifespan and regulates insulin signalling in brain and fat body // Nature. 2004. V. 429. P. 562–566. doi 10.1038/nature02549
Giannakou M.E., Goss M., Jünger M.A. et al. Long-lived Drosophila with overexpressed dFOXO in adult fat body // Science. 2004. V. 16. P. 305–361. doi 10.1126/science.1098219
Spellberg M.J., Marr M.T. FOXO regulates RNA interference in Drosophila and protects from RNA virus infection // Proc. Natl Acad. Sci. USA. 2015. V. 112. V. 14587–14592. doi 10.1073/pnas.1517124112
Grӧnke S., Clarke D.F., Broughton S. et al. Molecular evolution and functional characterization of Drosophila insulin-like peptides // PLoS Genet. 2010. V. 6:e1000857. doi 10.1371/journal.pgen.1000857
Bai H., Kang P., Tatar M. Drosophila insulin-like peptide-6 (dilp6) expression from fat body extends lifespan and represses secretion of Drosophila insulin-like peptide-2 from the brain // Aging Cell. 2012. V. 11. P. 978–985. doi 10.1111/acel.12000
Chatterjee D., Katewa S.D., Qi Y. et al. Control of metabolic adaptation to fasting by dILP6-induced insulin signaling in Drosophila oenocytes // Proc. Natl Acad. Sci. USA. 2014. V. 111. P. 17959–17964. doi 10.1073/pnas.1409241111
Broughton S.J., Piper M.D., Ikeya T. et al. Longer lifespan, altered metabolism, and stress resistance in Drosophila from ablation of cells making insulin-like ligands // Proc. Natl Acad. Sci. USA. 2005. V. 102. P. 3105–3110. doi 10.1073/pnas.1409241111
Tatar M., Kopelman A., Epstein D. et al. A mutant Drosophila insulin receptor homolog that extends life-span and impairs neuroendocrine function // Science. 2001. V. 292. P. 107–110. doi 10.1126/science.1057987
Дополнительные материалы отсутствуют.


