Генетика, 2019, T. 55, № 4, стр. 369-382
Полнотранскриптомное профилирование печени мышей C57BLACK/6J, получавших рационы c избытком жира, фруктозы и холестерина
С. А. Апрятин 1, *, Н. В. Трусов 1, А. Ю. Горбачев 1, В. А. Наумов 2, К. В. Мжельская 1, А. С. Балакина 1, И. В. Гмошинский 1, **
1 Федеральный исследовательский центр питания, биотехнологии и безопасности пищи
109240 Москва, Россия
2 Национальный медицинский исследовательский центр акушерства,
гинекологии и перинатологии им. академика В.И. Кулакова
117198 Москва, Россия
* E-mail: apryatin@mail.ru
** E-mail: gmosh@ion.ru
Поступила в редакцию 12.03.2018
После доработки 06.04.2018
Принята к публикации 03.05.2018
Аннотация
В печени мышей самок C57BLACK/6J, получавших изокалорийные рационы c избытком жира, фруктозы, холестерина или сочетаний фруктозы с жиром и холестерином в течение 62 сут, изучали дифференциальную экспрессию 30 003 генов методом полнотранскриптомного профилирования на микрочипе по протоколу “Agilent One-Color Microarray-Based Gene Expression Analysis Low Input Quick Amp Labeling” (version 6.8) и определяли относительные уровни экспрессии мРНК для генов Gpr19, P2ry12, Gnb1, Csf2rb, Gm38450, Pgm3, Prom2 и Adgrv1 методом ОТ-ПЦР в “реальном времени”. Для выявления метаболических путей (KEGGS), являющихся мишенями применявшихся диетических воздействий, транскриптомные данные анализировали методами биоинформатики в среде “R”. Определен специфический характер влияния экспериментальных рационов на метаболические пути JAK-STAT- и MAPK-киназ, VEGF- и TOR-сигнальных путей, ядерных транскрипционных факторов семейства PPAR, отражающие происходящие в печени изменения в воспалении, во внутриклеточной передаче сигнала, ангиогенезе, следствиями которых может быть развитие инсулиновой резистентности и жирового гепатоза. Впервые в эксперименте выявлено специфическое влияние всех указанных рационов на метаболические пути обмена аминокислот аспартата, глутамата, аланина, пролина, гистидина, аргинина. В группах животных, получавших избыток жира с фруктозой или холестерин, методом ОТ-ПЦР в “реальном времени” выявлены согласованные изменения в уровнях экспрессии генов Gpr19, Adgrv1 и Csf2rb, отражающие интегрированные сдвиги в профилях продукции цитокинов и нейрогормональной регуляции обменных процессов.
Одной из ведущих причин роста распространенности метаболического синдрома, ожирения, атеросклероза и других алиментарно-зависимых заболеваний является углубляющийся дисбаланс пищевого рациона современного человека, состоящий в избыточном потреблении легкоусвояемых углеводов, животных жиров, а также холестерина при недостатке витаминов, эссенциальных минеральных веществ и пищевых волокон в условиях малоподвижного образа жизни и высокой стрессовой нагрузки [1]. Выбор адекватных методов персонифицированной диетотерапии при алиментарно-зависимых заболеваниях требует использования чувствительных молекулярных (геномных, транскриптомных, метаболомных и других) маркеров, характеризующих стадию, тяжесть и направленность патологического процесса. Выявление таких маркеров в условиях клинических наблюдений затруднено проблемами доступности биологического материала, большой генетической гетерогенностью человеческой популяции, этическими проблемами. Ввиду этого хорошие перспективы имеет in vivo моделирование алиментарно-зависимых заболеваний у лабораторных животных, получающих экспериментальные рационы с измененной квотой жира и легкоусвояемых углеводов, а также повышенным количеством холестерина [2, 3]. Известные ограничения в использовании этих моделей состоят в наличии генетически обусловленных различий в характере липидного обмена у лабораторных грызунов (мышей, крыс) и человека, ввиду чего ответ многих интегральных показателей липидного обмена (таких, как уровни холестерина, триглицеридов, липопротеидов) на экспериментальные рационы может существенно отличаться от наблюдаемой клинической картины у пациентов [4]. Значительного повышения информативности исследований, проводимых на моделях in vivo, можно добиться с использованием современного транскриптомного анализа, в сочетании с методами биоинформатики, позволяющими проводить сравнения и оценки с привлечением больших объемов данных, всесторонне характеризующих согласованные изменения в экспрессии сотен или тысяч генов.
Цель данного исследования – изучение дифференциальной экспрессии генов в печени мышей самок инбредной линии C57BL/6J в условиях потребления трех типов рационов, способных привести к развитию метаболического синдрома или гиперлипидемии: с повышенной квотой жира, фруктозы, холестерина и их сочетаний, с использованием метода полнотранскриптомного профилирования совокупной мРНК на мультивалентных ДНК-микрочипах с последующим анализом полученных данных биоинформатическими методами в среде “R”.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использованы 48 мышей самок инбредной линии C57Black/6J со средней начальной массой тела 18 ± 1 г, полученных из питомника Филиала “Столбовая” ФГБУН “Научный центр биомедицинских технологий ФМБА России”. Животных содержали по четыре особи в прозрачных пластмассовых клетках из поликарбоната на подстилке из опилок при температуре 21 ± 1°С в режиме искусственного освещения 12/12 ч. Работу с животными выполняли в соответствии с Руководством [5] и Приказом [6]. Мыши были разделены на шесть групп равной численности по восемь животных. Средняя исходная масса тела в группах не различалась (p > 0.05, ANOVA). В течение 63 дней животные группы 1 (контроль) получали сбалансированный полусинтетический рацион (ПСР) по AIN93 с некоторыми модификациями [7], группы 2 − модифицированный ПСР с повышенным содержанием общих жиров (30% от массы сухого корма) за счет снижения содержания крахмала, группы 3 − ПСР и 20%-ный раствор фруктозы вместо воды, группы 4 − вышеуказанный высокожировой рацион и раствор фруктозы, группы 5 − модифицированный ПСР с повышенным содержанием холестерина (0.5% от массы сухого корма) за счет снижения количества жира, группы 6 − высокохолестериновый рацион и раствор фруктозы. Воду (группы 1, 2 и 5) или раствор фруктозы (группа 3, 4, 6) предоставляли в режиме свободного доступа, а рацион – изначально из расчета 4 г сухого корма на мышь в сутки. Для достижения изокалорийности рационов, а также удовлетворения изменяющейся с возрастом физиологической потребности животных в нутриентах и энергии производили коррекцию количественного состава рационов с частотой 1 раз в неделю. Выведение животных из эксперимента осуществляли на 63-й день путем декапитации под эфирной анестезией. Печень отбирали стерильными хирургическими инструментами из нержавеющей стали, немедленно охлаждали на льду до температуры 0–2°С, взвешивали с точностью ±0.01 г и хранили до исследования при температуре –80°С.
Выделение мРНК из ткани печени проводили с помощью набора “Agilent Total RNA Isolation Mini Kit” (Agilent Technologies, США). Навеску 20 мг печени гомогенизировали в стеклянном гомогенизаторе Поттера–Эдельвейма в 500 мм3 лизирующего буфера (с добавлением 5 мм3 β‑меркаптоэтанола на 500 мм3 буфера) при температуре 0–2°С. Дальнейшие процедуры проводили согласно [8]. Полученную общую РНК дополнительно обрабатывали ДНКазой I для удаления следов геномной ДНК. Концентрацию РНК определяли на спектрофотометре NanoDrop 1000, после чего разбавляли ее водой без нуклеаз до концентрации 200 нг/мм3 и проводили анализ степени фрагментации на “Agilent Bioanalyzer 2100” с определением показателя RIN (RNA Integrity Number). РНК хранили в воде, свободной от нуклеаз, или в виде изопропанольных осадков при –80°С. Полнотранскриптомный анализ 24 образцов ткани печени (6 групп по 4 животных в каждой группе) на микрочипах, входящих в состав “Gene Expression Hybridization Kit” (Agilent Technologies), проводили по протоколу “Agilent One-Color Microarray-Based Gene Expression Analysis Low Input Quick Amp Labeling, version 6.8” [9]. Сканирование микрочипов выполняли на приборе “SureScan Microarray Scaner”, производства “Agilent Technologies”. Величину экспрессии выражали в виде логарифма по основанию 2 (log2FC) возрастания или убывания флуоресценции по сравнению с контрольной группой. Данные сканирования чипов загружали в среду “R” и проводили квантильную нормализацию и дальнейший анализ дифференциальной экспрессии в дополнительном пакете limma. Для выявления метаболических путей (KEGGS) и их визуализации применяли пакеты AnnotationDbi, org.Rn.eg.db, pathview, gage, gageData. Для визуализации результатов на всех этапах применяют стандартную графику “R” и дополнительные пакеты ggplot2, ggrepel и gplots. Для создания “тепловой” карты (heatmap) применяли пакет heatmap2. Достоверность изменения экспрессии оценивали путем анализа логарифмов интенсивности флуоресценции, нормализованных по реперным генам с постоянными уровнями экспрессии с использованием Т-теста с множественной коррекцией Benjamini–Hochberg [10].
Количественный анализ экспрессии мРНК отдельных генов для 48 образцов ткани печени выполняли методом полимеразной цепной реакции в “реальном времени”, совмещенной с обратной транскрипцией (ОТ-ПЦР). Относительные уровни экспрессии генов Gpr19, P2ry12, Gnb1, Csf2rb, Gm38450, Pgm3, Prom2 и Adgrv1 определяли с использованием специфических олигонуклеотидных праймеров и флуоресцентной детекции на основе зонда карбоксифлуоресцеина (λ поглощения = 492 нм) производства фирмы ООО “ДНК-Синтез” (Россия). Исследование проводили в соответствии с инструкцией к наборам.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика моделей гиперлипидемии
В ходе кормления мышей экспериментальными рационами выявлены различия в их поедаемости, которая была достоверно снижена в группах мышей 2 и 4 (высокожировые рационы); отмечалась также повышенная в сравнении с другими группами удельная (на кг массы тела) калорийность рационов, содержащих фруктозу (группы 3, 4 и 6). С учетом этого в целях сближения уровней удельного потребления энергии и белка в опытных группах животных их рационы подвергали ряду последовательных модификаций. Так, в группах 3, 4 и 6 на 3-й день опыта снижали количество потребляемого крахмала на 20%, в группах 2, 3 и 4 на 24-й день увеличивали квоту белка за счет удаления 5% по массе целлюлозы и на 31-й день − за счет удаления 10% по массе крахмала; на 37-й день опыта во всех группах, не получавших избыток жиров (1, 3, 5 и 6), снижали суточное количество рационов на 30%, а начиная с 50-го дня – повышали его в этих же группах на 20%. В результате этих манипуляций в последние недели эксперимента фактическое удельное энергопотребление (УдЭн) в группах мышей различалось менее чем на 30%.
На протяжении эксперимента животные большинства групп равномерно прибавляли в массе тела, за исключением мышей группы 2, которые прибавляли в массе тела достоверно быстрее животных групп 1, 3 и 4 (p < 0.05), несмотря на то, что УдЭн на этом рационе было, во всяком случае, не больше, чем в остальных группах. Внешние признаки заболеваемости и летальность отсутствовали на протяжении эксперимента у всех животных.
Обзорное патологоанатомическое исследование внутренних органов показало наличие жировой дистрофии печени мышей групп 5 и 6, получавших добавку холестерина. При выведении из эксперимента относительная (в % от массы тела) масса печени мышей 3-й, 4-й и 6-й групп была достоверно повышена в сравнении с контролем. Масса белой жировой ткани достоверно не отличалась от контроля во всех опытных группах. Однако в группе 6 количество накопленного жира было достоверно снижено в сравнении с группой 2. Характеристика использованных in vivo моделей по интегральным, биохимическим, иммунологическим показателям и поведенческим реакциям была представлена ранее [11–13].
Полнотранскриптомное профилирование мРНК ткани печени
Изучение методом полнотранскриптомного профилирования мРНК печени мышей опытных групп 2–6 в сравнении с контрольной группой 1 было проведено для 30 003 генов, представленных на чипе. При этом дифференциальная экспрессия в размере |log2FC| ≥ 0.5 (в сторону как усиления, так и ослабления) при уровне значимости Pvalue ≤ 0.05 выявлена в общей сложности для 1647 генов (5.5% от общего количества); для большинства из них (1220; 74.1% от общего числа генов с дифференциальной экспрессией) изменение уровня экспрессии было уникальным только для одной из опытных групп. 29 генов (1.8%) отвечали изменением экспрессии одновременно в группах 2 (высокожировой рацион) и 3 (рацион с повышенной квотой фруктозы), 72 (4.4%) – в группах 2 (высокожировой рацион) и 5 (рацион с повышенной квотой холестерина), 280 (17%) – для групп 3 (рацион с повышенной квотой фруктозы) и 5 (рацион с повышенной квотой холестерина). Дифференциальная экспрессия 46 генов (2.8%) наблюдалась одновременно в трех группах животных 2, 3 и 5. Общими для групп 3 и 4 (фруктоза + жир) были 279 дифференциально экспрессированных генов, для групп 2 и 4 – 94 гена, групп 5 и 6 (фруктоза + холестерин) – 276 генов. Одновременно во всех пяти опытных группах животных отмечалась согласованная экспрессия 37 генов. На рис. 1 представлены результаты теоретико-множественного анализа (в виде диаграммы Венна) распределения генов, экспрессированных в группах 2, 3 и 5; в табл. 1 – общая сводка наименований генов c дифференциальной экспрессией во всех пяти опытных группах.
Таблица 1.
Список генов с дифференциальной экспрессией, вызванной потреблением опытных рационов при уровне значимости р ≤ 0.05 для групп мышей 2–6 (в сравнении с группой 1, получавшей сбалансированный полусинтетический рацион)
| Группа | Гены с положительной дифференциальной экспрессией (усиление)* | ||
|---|---|---|---|
| дифференциальная экспрессия, log2FС | |||
| >1 | >0.7−1.0 | ≥0.5−0.7 | |
| 2 | Dcx, Slc39a3, Setd3 | Prickle1, Limd2, 1700018F24Rik, Lmbrd1, Myl1, Zfp949, Agtpbp1 | Srsf10, Adss, Fam53a, 4933402N03Rik, Gnpat, Rps18, Gzme, L1td1, Cpa5, Olfr1012 |
| 3 | Nxnl1, Gle1, Olfr1008, Adap2os, Chchd3, Prr5, 4933402N03Rik, Fip1l1, Rpp38, P2ry12 | Cldn20, Adal, Atf1, LOC102640328, Ythdc1, C130060K24Rik, Tifab, Dcun1d1, Tia1, Adgrv1 | Gm21992, Spata5l1, Sec24d, Tbkbp1, Znhit2, Polr2k, 2810433D01Rik, 2010106E10Rik, Casr, Defb5 |
| 4 | Nepn, Slc35f5, Pgm3, Stam, LOC102632594, 2310057M21Rik, Arl6ip4, Bcl2l11, Rdm1 | 4933402N03Rik, Cd14, Arl8b, Olfr784, Hspa12a, Rad50, Ccdc162, Fbxw11, Slc25a18, Ikzf1, App | Adamtsl4, Brox, Smc1b, Gli3, Adgrb2, Ostm1, Qars, Mfsd2b, 4930474H20Rik, Gm28258, Smarcd1 |
| 5 | Vma21, Atp5h, Olfr472, Tuba1a, Csf2rb, Adss, Gm3448, Phf23, Myh11, Thoc3 | Gm17115, Mthfd2l, Vmn2r62, Ankrd23, Bcl2l11, Otud5, Tmem107, Tomm40, Strip2, Sox9 | Gucy2g, Ssbp2, Gm815, Pabpc4, Timp2, Arhgef19, Map3k6, Serpine2, Rabggta, Sdr9c7, Anks3 |
| 6 | Pum2, Vmn2r12, Bcs1l, Kcnc4, Rpgrip1l, Il7, Dubr, Olfr1008, C230072F16Rik, Gm33627 | Perm1, Ywhaz, Net1, Mtmr2, Peg3os, Mrm1, Nxnl1, Slc37a3, Dapk3, Commd8, Gm6109, Gm13629 | Adam33, Smr3a, Lpcat3, Snx21, Nr2f2, Prkch, Lin28b, Arhgef25, Pgam1, Adgrv1 |
| Группа | Гены с отрицательной дифференциальной экспрессией (подавление)* | ||
| дифференциальная экспрессия, log2FС | |||
| <–1 | (–1.0)−<(–0.7) | (–0.7)−≤(–0.5) | |
| 2 | Gm19583, Kif1a, Sugp2, Gm8096 | C130060K24Rik, Mbtd1, Capzb, Moxd2, Dpy19l3, Gm35405, LOC102632594, Uba5, Acp1, Cacng5 | Zfp750, Rad54l2, Gm32639, Mpdz, Ndnf, Gm14486, Zbbx, Ppfibp1, 2300002M23Rik, Prdm14 |
| 3 | Rbm7, Nfx1, Chka, Ggn, Wars2, Tmem65, Hps5, Gnb1, Rrp12, App, Epb41l3 | Gm36561, Asb1, Hs3st2, Tmem14a, Ggta1, Trpm1, Pigo, Agbl3, Ccz1, Rab3a | Tmem194b, Lcn3, Olfr1469, Olfr828, Eif3h, Dsc1, Abca9, Nlrp1b, Gm28729, Gm35973 |
| 4 | Timp2, Lrp2bp, Nxnl1, Znhit2, Rundc3a, 5730559C18Rik, Gm15413 , Mtap7d3, LOC105246305, Adgrv1 | Chka, Ovol3, Cd209a, Cd79b, Ndufb7, Gm14285, Cd36, Ipo13, Ptrf, Tekt5, Gtf2h2 | Gm14902, Olfr1195, Zp3, Sh3d21, Cfap20, 9230102K24Rik, Rab2b, Mapre3, Gm4793, Rbfa |
| 5 | Il7, Tpm2, Olfr1261, Ildr1, Phb, Chm, 9630013A20Rik, Asb3, Myo9b, Lin28b | Gm6251, Ctf2, 4930570G19Rik, Pnma2, Ccz1, Tmem260, C030013G03Rik, Adgrv1, Gm17762, Slc36a1 | Pigo, Gm9936, Hnrnpu, Pdgfa, Prkacb, Rad50, Rnf222, Cybb, 4930474H20Rik, Epb41l3 |
| 6 | Mlxip, Dmbx1, Pcsk4, A630019I02Rik, Rpl34, Fam181b, Myo9b, Rp1, Jmjd7, Gm3646 | 6430562O15Rik, Insig2, 4930407I19Rik, Ctage5, Zbtb42, LOC102636590, Qars, Iqch, Olfr10, Gm7562, Cd209a | Gm6377, Supv3l1, Mypn, Rpl24, Smco4, Gm15672, Dgkb, Gm11529, Arl6ip4, 9130409I23Rik, Wdr27 |
Рис. 1.
Диаграмма Венна, демонстрирующая распределение числа генов с дифференциальной экспрессией по группам 2 (30% жиров), 3 (20% фруктозы) и 5 (0.5% холестерина) мышей самок инбредной линии C57Black/6J (|log2FC| ≥ ≥ 0.5) в сравнении с контрольной группой.
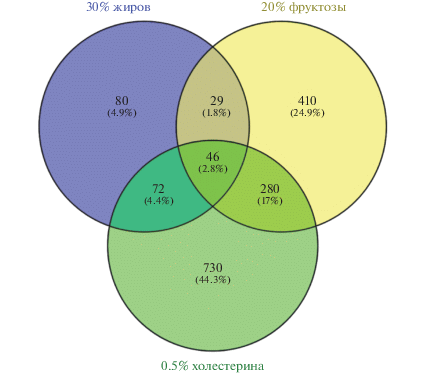
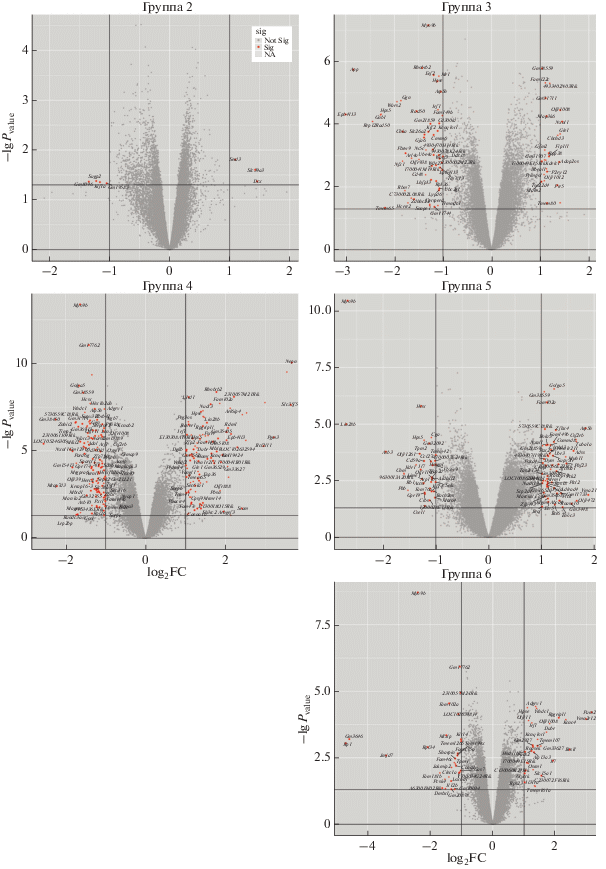
Рис. 2 демонстрирует распределения в группах животных 2–6 всех выявленных генов с достоверной дифференциальной экспрессией в координатах log2FC (ось абсцисс)–(–lg Pvalue, ось ординат) – “volcano plot”-диаграммы, являющиеся способом наглядного представления степени изменчивости транскриптома под действием экспериментальных рационов. Как следует из рисунка, в соответствии с увеличением количества генов в верхних левых и правых квадрантах диаграмм интегральное воздействие на транскриптом печени животных убывает в последовательности групп Гр. 4 > Гр. 5 > Гр. 3 ≈ Гр. 6 > Гр. 2. Таким образом, сочетание жира с фруктозой оказывает, по-видимому, наиболее выраженное и разнообразное воздействие на транскриптом печени, а одного только жира – наименьшее.
Рис. 2.
Диаграмма дифференциально экспрессированных генов (volcano plots) для групп 2–6 в координатах log2FC (ось абсцисс)–(–lg Pvalue, ось ординат). Верхние левый и правый квадранты диаграмм соответствуют |log2FC| ≥ 1 при уровне значимости Pvalue ≤ 0.05.
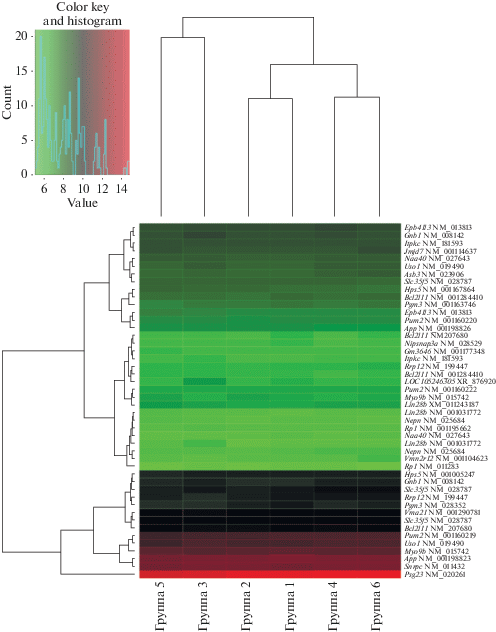
Кластеризация групп животных по распределению генов с наибольшей дифференциальной экспрессией в формате “тепловой” карты (рис. 3) показала, что наибольшее сходство с контрольной группой 1 было выявлено в группе 2. Промежуточное положение занимают группы 4 и 6. Наиболее отдаленными по дифференциально экспрессированным генам в сравнении с контролем были группы 3 и 5.
Рис. 3.
“Тепловые карты” (heatmaps) распределения дифференциально экспрессированных генов по группам 1–6 (зеленым цветом показаны гены со сниженной дифференциальной экспрессией, красным цветом – с повышенной).
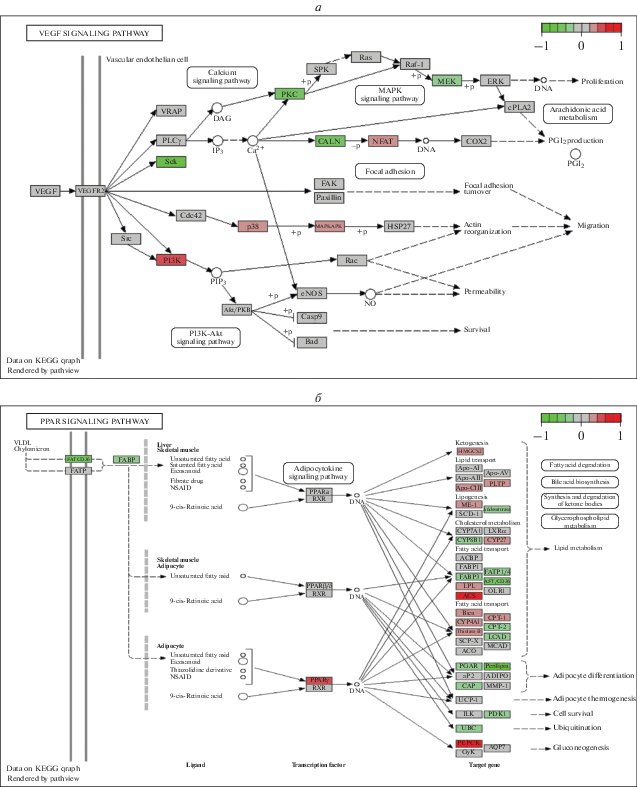
Анализ профилей дифференциальной экспрессии в среде “R” позволил выявить ряд метаболических путей, являющихся мишенями воздействия применяемых экспериментальных рационов. Всего в опытных группах 2, 3 и 5 было выявлено 74 метаболических пути (KEGGs), в которых произошли изменения под действием применяемых экспериментальных рационов, в том числе 17 метаболических путей, относящихся к обмену белков (рибосомальная трансляция, фагоцитоз, внутриклеточный протеолиз, в том числе убиквитин-зависимый), 12 – углеводов (гликолиз, глюконеогенез и др.), 10 – липидов, 8 – к внутриклеточной передаче сигнала, 6 – апоптозу, 5 – обмену отдельных аминокислот, включая триптофан, аланин, гистидин и др., 16 – прочим процессам. При этом число затронутых метаболических путей, общих для всех пяти опытных групп животных, составило 31, общих для групп 2 и 3 − 36, для групп 3 и 5 – 36, для групп 2 и 5 − 40, для групп 2, 3 и 5 − 32; уникальных для групп со 2-й по 6-ю − 9, 8, 2, 10 и 3 соответственно. В числе 32 общих для групп 2, 3 и 5 достоверно изменяющихся метаболических путей были представлены JAK-STAT- и MAPK-сигнальные пути (рис. 4 и 5), апоптоз, обмен кальция и аминокислот аргинина и пролина, что свидетельствует об активном ответе на рационы с избытками жиров, фруктозы и холестерина различных цитокинов, факторов роста и нейротрансмиттеров, активирующих вышеуказанные сигнальные и метаболические пути [14, 15]. Для животных, получавших высокожировой рацион (группа 2), была характерна специфическая дифференциальная экспрессия генов VEGF-сигнального пути (рис. 6), стимулирующего процессы ангиогенеза при ожирении и сахарном диабете 2-го типа [16]. Общей для высокожирового и высокофруктозного рационов (группы 2 и 3) была дифференциальная экспрессия генов TOR-сигнального пути, участвующего в числе прочего в регуляции ключевого ядерного транскрипционного фактора SREBP1, отвечающего за связь процессов липогенеза и клеточной пролиферации [17, 18]. Для высокофруктозного рациона (группа 3) было характерно изменение системы обмена триптофана, а также метаболических путей обмена пирувата, гликолиза и глюконеогенеза. Избыток в корме холестерина (группа 5) вызывал наиболее выраженные сдвиги в PPAR-сигнальном пути (рис. 6), занимающем центральное место в регуляции процессов обмена холестерина и детоксикации ксенобиотиков [19], а также в метаболических путях аспартата, глутамата и аланина.
Рис. 4.
Сравнительный анализ дифференциальной экспрессии генов JAK-STAT-сигнального пути у мышей, получающих рацион с избытком жира (а, группа 2) и фруктозы (б, группа 3). Цветом выделены гены с дифференциальной экспрессией в соответствии со шкалой изменения log2FC (для рис. 4–6).
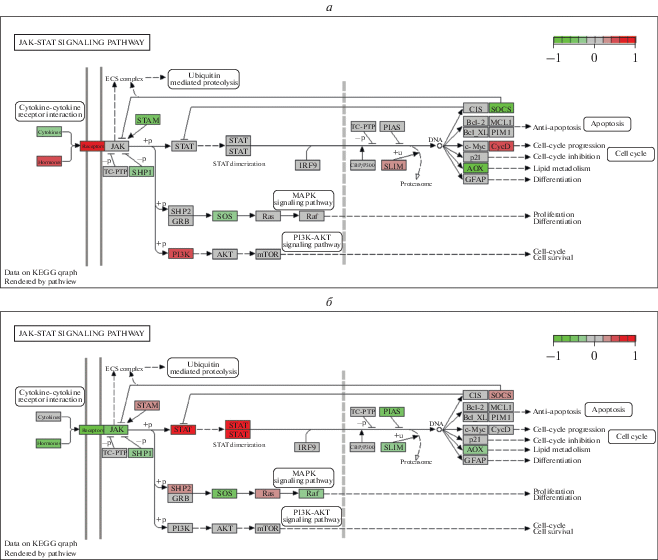
Рис. 5.
Сравнительный анализ дифференциальной экспрессии генов MAPK-сигнального пути у мышей, получающих рацион с избытком жира (а, группа 2) и фруктозы (б, группа 3).
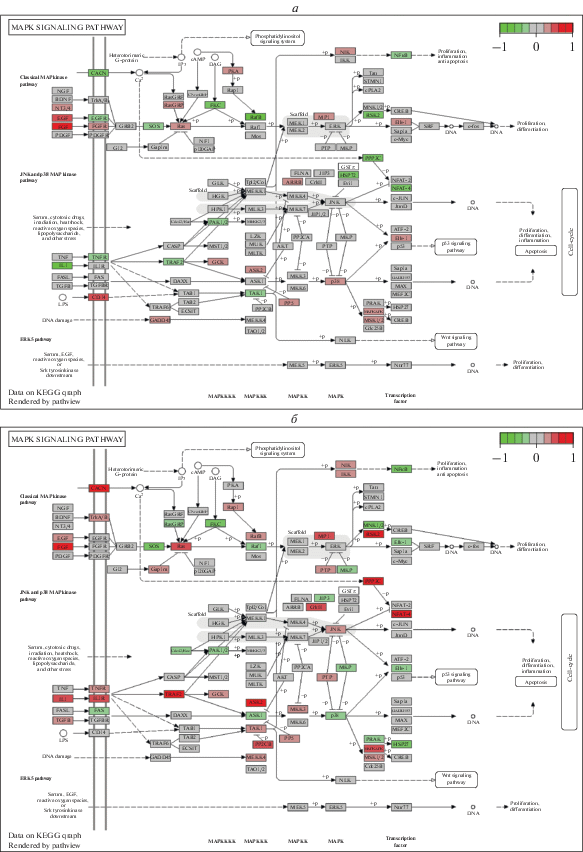
Рис. 6.
Дифференциальная экспрессия генов VEGF-сигнального пути (а), уникальных для мышей группы 2 (избыток жира) и PPAR-γ сигнального пути (б) у мышей группы 5 (избыток холестерина).
У мышей из групп 4 и 6, получавших смешанные рационы, сочетающие избыток жиров или холестерина с фруктозой, также была обнаружена согласованная дифференциальная экспрессия генов JAK-STAT-сигнального пути, который принимает активное участие во внутриклеточной передаче сигнала, в том числе от цитокиновых рецепторов и факторов роста. При этом дифференциальная экспрессия генов MAPK-сигнального пути, участвующего в передаче внутриклеточных сигналов не только от цитокиновых рецепторов и факторов роста, но и от нейротрансмиттеров, была выявлена только для группы 4, но не для группы 6.
Как следует из данных рис. 4, в группах 2 и 3 отмечаются различия в характере дифференциальной экспрессии генов JAK-STAT-сигнального пути. А именно, если в группе 2 наблюдалось повышение дифференциальной экспрессии генов, кодирующих рецепторы данного сигнального пути, то в группе 3, напротив, наблюдалось понижение дифференциальной экспрессии генов, кодирующих эти рецепторы, и повышение экспрессии генов, кодирующих STAT-белки.
Новым, не описанным в доступных источниках, является обнаруженное при модельной алиментарной дислипидемии у мышей изменение уровней экспрессии метаболизма ряда аминокислот (аргинина, пролина, аспартата, глутамата, аланина и др.).
Количественный анализ экспрессии генов методом ОТ-ПЦР
В табл. 2 представлены результаты количественного определения методом ОТ-ПЦР экспрессии отдельных генов у мышей групп 1–6 в виде логарифма по основанию 2 (log2FC) содержания соответствующих последовательностей в тотальной кДНК печени по отношению к реперному конститутивному гену GAPDH (глицеральдегидфосфатдегидрогеназа). Как видно из представленных данных, совместное введение жиров и их сочетания с фруктозой в рацион мышей группы 4 вызывает достоверное снижение относительного уровня экспрессии гена Gpr19 по сравнению с группой 1. Данные дифференциальной экспрессии в печени гена Gpr19, кодирующего GPCR-рецептор, были получены впервые. Ранее [21] было показано, что ген Gpr19 кодирует рецептор, наиболее близкий по строению к рецептору D2 дофамина, адренергическим рецепторам, а также рецептору нейропептида Y. Анализ с помощью Northern-блоттинга выявил дифференциальную экспрессию гена Gpr19 в периферических областях и области мозга, коррелирующей с экспрессией гена рецептора D2 дофамина [20]. В этом же исследовании анализ гибридизации in situ показал наличие гиперэкспрессии рецептора Gpr19 в головном мозге крыс. Все это может свидетельствовать о тесной связи GPCR-рецептора Gpr19 с нейрорегуляторной функцией при избытке жиров и углеводов в рационе.
Таблица 2.
Относительная экспрессия генов в печени мышей групп 1–6 (число животных по 8 в группе, если иное не указано)
| Группа | log2FC, медиана (в скобках – интервал изменения) для указанных генов | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Gpr19 | P2ry12 | Gnb1 | Csf2rb | Gm38450 | Pgm3 | Prom2 | Adgrv1 | ||
| 1 | –10.85 (–12.00, –9.50)4 |
–9.35 (–10.70, –8.50) |
–5.20 (–6.90, –4.70) |
–8.90 (–9.40, –8.40)2 |
–12.30 (–14.00, –12.30) |
–8.45 (–9.60, –6.70) |
–14.35 (–15.50, –14.10) |
–11.55 (–11.60, –11.10)5 |
|
| 2 | –11.55 (–13.20, –10.00) |
–9.95 (–10.40, –7.50) |
–5.70 (–7.10, –4.70) |
–8.40* (–8.60, –8.00)1 |
–11.70* (–12.80, –10.20)5 |
–8.00* (–8.90, –7.70)3 |
–12.90 (–16.10, –11.90) |
–11.25 (–12.00, –10.80)5 |
|
| 3 | –11.30 (–12.30, –10.10) |
–9.80 (–11.30, –8.50)4, 5 |
–5.35 (–5.90, 4.00) |
–8.90 (–9.40, –7.20) |
–12.70 (–14.40, –10.80) |
–9.25 (–11.00, –8.30)2, 4 |
–14.90 (–16.00, –13.70) |
–10.75 (–12.00, –10.10) |
|
| 4 | –11.85 (–15.70, –10.70)1 |
–9.10* (–9.70, –8.80)3 |
–5.20 (–6.70, –4.20) |
–8.55 (–9.70, –7.80) |
–11.95 (–15.00, –10.50) |
–8.60 (–9.10, –8.00)3 |
–13.50 (–14.60, –12.60) |
–11.50 (–11.90, –11.30)5 |
|
| 5 | –11.10 (–14.00, –9.50) |
–9.00 (–10.70, –7.10)3 |
–5.00 (–6.20, –3.90) |
–8.45 (–9.20, –7.80) |
–13.10 (–14.00, –11.10)2 |
–8.80* (–9.90, –7.00) |
–14.65 (–16.30, –13.10) |
–10.35 (–10.80, –9.20)1, 2, 4 |
|
| 6 | –10.85 (–13.90, –9.00) |
–9.20 (–11.40, –8.80) |
–4.80* (–7.20, –2.30) |
–8.35 (–9.90, –8.00) |
–12.10* (–14.30, –10.80) |
–8.50** (–10.00, –7.30) |
–15.55 (–18.20, –13.30) |
–11.10* (–11.70, –10.70) |
|
| Однофакторный дисперсионный анализ, ANOVA, P | Жир | 0.045 | >0.1 | >0.1 | >0.1 | >0.1 | >0.1 | 0.024 | >0.1 |
| Фруктоза | >0.1 | >0.1 | >0.1 | >0.1 | >0.1 | >0.1 | >0.1 | >0.1 | |
| Холестерин | >0.1 | >0.1 | >0.1 | >0.1 | >0.1 | 0.034 | >0.1 | 0.025 | |
Для гена Adgrv1, напротив, было показано увеличение дифференциальной экспрессии в группе с избыточной квотой холестерина в сравнении с группой 1. Белок Adgrv1 также представляет собой кальций-связывающий GPCR-рецептор, который экспрессирован на поверхности аксонов и других клеток центральной нервной системы [21]. Одной из известных функций этого рецептора на сегодняшний день является связь с развитием эпилептических судорог [22]. Вызванная рационом дифференциальная экспрессия этого гена в печени выявлена впервые.
В случае избытка жиров в рационе наблюдалось достоверное повышение относительного уровня экспрессии гена Csf2rb. Продукт данного гена является рецептором гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), а также интерлейкинов IL-3, IL-5 и играет важную роль в регуляции иммунного ответа и апоптоза [13, 23]. Анализ взаимосвязи генов Adgrv1, Csf2rb и Gpr19 с использованием данных онлайн-ресурса [24] показал, что хотя для них и отсутствует прямое взаимодействие, они согласованно влияют на экспрессию ряда функционально значимых генов, включая Il3ra (альфа-субъединица рецептора IL-3), Il4ra (альфа-субъединица рецептора IL-4), Il5ra (альфа-субъединица рецептора IL-5), Ccr3r (рецептор 3 для RANTES, MCP-3, MCP-4 и других хемокинов), TRAF3ip2 (белок, взаимодействующий с фактором 3, ассоциированным с рецептором фактора некроза опухолей), Сhrnb3 (бета-полипептид 3 холинергического никотинового рецептора), онкоген Kit и др., отвечающих за индукцию воспаления в ткани печени, процессы нейрорегуляции и онкогенеза.
Избыток фруктозы достоверно влияет на экспрессию гена Pgm3 (фосфоглюкомутазы); уровень экспрессии мРНК оказывается также достоверно пониженным в группе 3 в сравнении с высокожировыми группами 2 и 4. Избыток холестерина диеты (группа 5) достоверно усиливает экспрессию P2ry12 в сравнении с высокофруктозной группой 3 и подавляет экспрессию гена Gm38450 в сравнении с избытком жира (группа 2).
Отсутствие в ряде случаев прямого совпадения данных об экспрессии отдельных генов в методах полнотранскриптомного профилирования и ОТ-ПЦР может иметь в своей основе методические различия, в частности применяемый метод нормализации показателей. Если в первом случае нормализация проводится по всему чипу в целом с использованием комплекса “реперных” контролей, представляющих собой своеобразные “внутренние стандарты”, то во втором – нормализация проводится индивидуально для каждого образца относительно уровня экспрессии конститутивного гена (в данном случае GAPDH), которая априорно считается биологической константой, не зависящей существенным образом от каких-либо средовых факторов, включая применяемые рационы. Указанные обстоятельства являются отражением известных трудностей, существующих и до конца не преодоленных в полнотранскриптомном анализе, что отражается в целом ряде публикаций [25, 26].
Таким образом, проведенные исследования показали, что в ткани печени мышей, являющихся in vivo моделями алиментарной гиперлипидемии и метаболического синдрома, наблюдаются значительные изменения транскриптома, затрагивающие 1647, или 5.5% от общего количества исследованных генов и проявляющие в ряде случаев высокую специфичность для отдельных экспериментальных рационов. Выявлены метаболические пути, являющиеся мишенями воздействия при экспериментальной алиментарной дислипидемии, которые могут рассматриваться как информативные биомаркеры глубины и направленности патологических изменений обменных процессов. Так, в частности, показана общность изменений уровней экспрессии ряда генов, задействованных в JAK-STAT- и MAPK-сигнальных путях, апоптозе, обмене кальция и аминокислот (аргинина и пролина), независимо от характера применявшихся диетических манипуляций. Впервые выявлено влияние гиперлипидемических рационов на изменение уровней экспрессии у мышей генов, кодирующих обмен ряда аминокислот, а также показана возможная новая регуляторная функция генов Gpr19 и Adgrv1, кодирующих GPCR-рецепторы, на рационах с избытком жиров и углеводов и добавочной квоты холестерина, соответственно. В совокупности это свидетельствует о влиянии вышеуказанных генов и метаболических путей на развитие при потреблении избытков жиров, фруктозы и/или холестерина процессов воспаления в печени, а также в других органах и тканях, приводящих к дальнейшему развитию инсулиновой резистентности и имеющих в перспективе такие патологические последствия, как сахарный диабет 2-го типа либо неалкогольный жировой гепатоз.
Работа проведена за счет средств субсидии на выполнение государственного задания в рамках Программы поисковых научных исследований (тема ФАНО России № 0529-2015-0006).
Список литературы
Hutcheson R., Rocic P. The metabolic syndrome, oxidative stress, environment, and cardiovascular disease: the great exploration // Experim. Diabetes Res. 2012. V. 2012. № 2012. P. 2710–2728. doi 10.1155/2012/271028
Woods S.C., Seeley R.J., Rushing P.A. et al. A controlled high-fat diet induces an obese syndrome in rats // The J. Nutrition. 2003. V. 133. № 4. P. 1081–1087.
Wong S.K., Chin K.-Y., Suhaimi F.H. et al. Animal models of metabolic syndrome: a review // Nutrition & Metabolism. 2016. V. 13. P. 65–77. doi 10.1186/s12986-016-0123-9
Feig J.E., Hewing B., Smith J.D. et al. High-density lipoprotein and atherosclerosis regression: evidence from preclinical and clinical studies // Circulation Res. 2014. V. 114. № 1. P. 205–213. doi 10.1161/CIRCRESAHA.114.300760
Guide for the care and use of laboratory animals. Eighth Edition / Committee for the Update of the Guide for the Care and Use of Laboratory Animals; Institute for Laboratory Animal Research (ILAR); Division on Earth and Life Studies (DELS); National Research Council of the national academies. Washington: Nat. Acad. Press, 2011.
Приказ Министерства здравоохранения Российской Федерации № 193н от 01.04.2016 г. “Об утверждении правил надлежащей лабораторной практики”. (The experimental design was approved by the Animal Ethics Committee of the Federal Research Centre of Nutrition and Biotechnology (Protocol No. 193n from 01.04.2016) in accordance with the order of the Ministry of Health, and Social Development of the Russian Federation dated 01/04/2016, 193n, “On Approval of the Rules of Laboratory Practice”.)
Reeves P.G., Nielsen F.H., Fahey G.C., Jr. AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet // The J. Nutrition. 1993. V. 123. № 11. P. 1939−1951.
Agilent Total RNA Isolation Mini Kit Protocol. [Электронный ресурс: http://www.agilent.com/cs/library/ usermanuals/Public/5188_2710_A1.pdf.]
Agilent One-Color Microarray-Based Gene Expression Analysis Low Input Quick Amp Labeling, version 6.8. [Электронный ресурс: http://www.agilent.com/ cs/library/usermanuals/Public/G4140-90040_GeneExpression_OneColor_6.9.pdf.]
Benjamini Y., Hochberg Y. Controlling the false discovery rate: A practical and powerful approach to multiple testing // J. Royal Statist. Soc. Series B (Methodological). 1995. V. 57. № 1. P. 289–300.
Апрятин С.А., Мжельская К.В., Трусов Н.В. и др. Сравнительная характеристика in vivo моделей гиперлипидемии у крыс линии Вистар и мышей линии C57BI/6 // Вопр. питания. 2016. Т. 85. № 6. С. 14−23.
Апрятин С.А., Сидорова Ю.С., Шипелин В.А. и др. Характеристика показателей нейромоторики, тревожности и когнитивной функции на in vivo модели алиментарной гиперлипидемии и ожирения // Бюллетень эксперим. биологии и медицины. 2017. Т. 163. № 1. С. 46−51.
Ригер Н.А., Апрятин С.А., Евстратова В.С. и др. Сравнительный анализ цитокинового профиля плазмы крови крыс и мышей на in vivo-моделях гиперлипидемии // Иммунология. 2017. Т. 38. № 1. С. 11–18.
Aaronson D.S., Horvath C.M. A road map for those who don’t know JAK-STAT // Science. 2002. V. 296. № 5573. P. 1653–1655. doi 10.1126/science.1071545
Orton R.J., Sturm O.E., Vyshemirsky V. et al. Computational modelling of the receptor-tyrosine-kinase-activated MAPK pathway // The Biochem. J. 2005. V. 392. Pt 2. P. 249−261. doi 10.1042/BJ20050908
Cooper M.E., Vranes D., Youssef S. et al. Increased renal expression of VEGF and its receptor VEGFR-2 in experimental diabetes // Diabetes. 1999. V. 48. № 11. P. 2229–2239.
Hay N., Sonenberg N. Upstream and downstream of mTOR // Genes & Development. 2004. V. 18. № 16. P. 1926–1945. doi 10.1101/gad.1212704
Bengoechea-Alonso M.T., Ericsson J. The phosphorylation-dependent regulation of nuclear SREBP1 during mitosis links lipid metabolism and cell growth // Cell Cycle. 2016. V. 15. № 20. P. 2753–2765. doi 10.1080/ 15384101.2016.1220456
Berger J., Moller D.E. The mechanisms of action of PPARs // Annual Rev. Med. 2002. V. 53. P. 409−435. doi 10.1146/annurev.med.53.082901.104018
O’Dowd B.F., Nguyen T., Lynch K.R. et al. A novel gene codes for a putative G protein-coupled receptor with an abundant expression in brain // FEBS Letters. 1996. V. 394. № 3. P. 325−329.
McMillan D.R., Kayes-Wandover K.M., Richardson J.A., White P.C. Very large G protein-coupled receptor-1, the largest known cell surface protein, is highly expressed in the developing central nervous system // The J. Biol. Chem. 2002. V. 277. № 1. P. 785−792. doi 10.1074/jbc.M108929200
Skradski S.L., Clark A.M., Jiang H. et al. A novel gene causing a mendelian audiogenic mouse epilepsy // Neuron. 2001. V. 31. № 4. P. 537−544.
D’Andrea R., Rayner J., Moretti P. et al. A mutation of the common receptor subunit for interleukin-3 (IL-3), granulocyte-macrophage colony-stimulating factor, and IL-5 that leads to ligand independence and tumorigenicity // Blood. 1994. V. 83. № 10. P. 2802−2808.
Электронный ресурс: http://genemania.org/.
Gresham D., Dunham M.J., Botstein D. Comparing whole genomes using DNA microarrays // Nature Rev. Genet. 2008. V. 9. № 4. P. 291−302. doi 10.1038/nrg2335
Miklos G.L.G., Maleszka R. Microarray reality checks in the context of a complex disease // Nature Biotechnol. 2004. V. 22. № 5. P. 615−621. doi 10.1038/nbt965
Дополнительные материалы отсутствуют.


