Генетика, 2019, T. 55, № 5, стр. 531-543
Филогеография тихоокеанской трески Gadus macrocephalus на основе анализа полиморфизма контрольного региона мтДНК
С. Ю. Орлова 1, *, М. А. Смирнова 1, А. Н. Строганов 2, И. Н. Мухаметов 3, А. А. Смирнов 4, 5, 6, К. С. Ток 3, J. H. Park 7, А. М. Орлов 1, 8, 9, 10, 11
1 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
107140 Москва, Россия
10 Томский государственный университет, кафедра ихтиологии и гидробиологии
634050 Томск, Россия
11 Прикаспийский институт биологических ресурсов Дагестанского научного центра
Российской академии наук
367000 Махачкала, Россия
2 Московский государственный университет им. М.В. Ломоносова, кафедра ихтиологии
119991 Москва, Россия
3 Сахалинский научно-исследовательский институт рыбного хозяйства и океанографии
693023 Южно-Сахалинск, Россия
4 Магаданский научно-исследовательский институт рыбного хозяйства и океанографии
685000 Магадан, Россия
5 Северо-Восточный государственный университет, кафедра биологии и химии
685000 Магадан, Россия
6 Марийский государственный университет, кафедра экологии
424000 Йошкар-Ола, Россия
7 National Institute of Fisheries Science
46083 Busan, Republic of Korea
8 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Россия
9 Дагестанский государственный университет, кафедра ихтиологии
367000 Махачкала, Россия
* E-mail: kordicheva@rambler.ru
Поступила в редакцию 30.05.2018
После доработки 04.10.2018
Принята к публикации 19.11.2018
Аннотация
Проведен анализ 22 выборок тихоокеанской трески Gadus macrocephalus (n = 986) на основании данных о полиморфизме участка контрольного региона митохондриальной ДНК (599 пн). На основании полученных результатов показаны возможные пути расселения и формирования популяционных группировок тихоокеанской трески в азиатской части ареала и выделены три группировки, сходные по гаплотипическому составу. Первая группировка приурочена к мористым акваториям Берингова моря, охотоморских и тихоокеанских вод Курильских островов, находящихся в области действия круговоротов Северной Пацифики, и несет как гаплотипы рыб, переживших ледниковый период в рефугиуме, так и особей, мигрировавших из северных регионов Тихого океана в современный период. Вторая группировка трески объединяет выборки прибрежных акваторий Японского и Охотского морей, имеющих в большинстве случаев низкое гаплотипическое разнообразие, обусловленное нахождением на окраине видового ареала, изоляцией Японского моря в течение длительного времени и существованием рефугиума в южной части Охотского моря, где рыбы данной группировки могли находиться во время последнего оледенения. Третья группировка трески Желтого моря, адаптировавшаяся к условиям существования в мелководном водоеме субтропической области, кардинально отличается от всех остальных групп и сформировалась в результате расселения из рефугиума Восточно-Китайского моря и акватории Японского моря. Современное распределение митохондриальных гаплотипов в популяциях трески имеет признаки клинальной изменчивости, вызванной обоюдонаправленной миграцией из предполагаемых рефугиумов.
Тихоокеанская треска Gadus macrocephalus, являясь элиторальным широкобореальным видом, населяет материковый шельф и свал глубин (до 800 м) Северной Пацифики от Берингова пролива до п-ова Калифорния и южной части Корейского полуострова [1–6]. Она заселила северотихоокеанский регион 5.4–5.5 млн лет назад при открытии Берингова пролива [7, 8].
Формирование ареала трески вдоль азиатского и американского прибрежий происходило в результате реализации ее биологических особенностей в условиях специфической морфоструктуры ложа Северной Пацифики [9–11], что способствовало образованию в его пределах целого ряда локальных группировок, наличие которых было показано ранее по результатам морфологических исследований, мечения и анализа пространственного распределения [5, 9, 12–20].
Генетический анализ с использованием микросателлитных маркеров [21–27] выявил дифференциацию одних и сходство других группировок тихоокеанской трески. В частности, по результатам работ российских специалистов [25–27] были выделены две крупные группировки в западной и восточной частях Северной Пацифики, на достоверном уровне подтверждено сходство выборок из вод Южных Курильских островов, а также выборок из Охотского и Берингова морей. Кроме того, многочисленными исследованиями показано, что в пределах южной части ареала треска генетически неоднородна [10, 23, 28–33].
Популяционная неоднородность тихоокеанской трески в пределах ареала показана также и с использованием митохондриальных маркеров. Контрольный регион митохондриальной ДНК (D-loop) данного вида характеризуется низким уровнем изменчивости, но может быть эффективно использован в межпопуляционных исследованиях [34]. На основании генетического анализа с использованием как митохондриальных, так и микросателлитных маркеров выявлена дифференциация группировок трески как в пределах всей Северной Пацифики [23], так и на отдельных участках ее ареала в Охотском, Беринговом, Желтом и Японском морях [31–35].
Несмотря на достаточно большой объем генетических исследований тихоокеанской трески, проведенных в последние десятилетия, результаты разных исследований и интерпретация полученных данных значительно различаются. Кроме того, попытки проведения филогеографического анализа тихоокеанской трески с использованием выборок со всей азиатской части ее ареала от Желтого до северо-западной части Берингова моря с использованием митохондриальных маркеров ранее не предпринимались.
Цель настоящей работы – анализ филогеографических процессов в популяциях тихоокеанской трески на азиатской части ареала (акватории шельфа и верхней части материкового склона Северо-Западной Пацифики) на основании данных об изменчивости участка контрольного региона митохондриальной ДНК (D-loop).
МАТЕРИАЛЫ И МЕТОДЫ
Пробы тихоокеанской трески (n = 986) для генетических исследований собирали с 2005 по 2015 г. из уловов донных тралов, сетей и ловушек в Беринговом, Охотском, Японском морях, а также в тихоокеанских водах Курильских островов (21 выборка). Кроме того, в исследования была включена одна выборка из канадских вод (табл. 1, рис. 1).
Таблица 1.
Сроки, место сбора и объем выборок трески для генетических исследований
| Выборка | Номер выборки на карте | Место сбора | Год | Число образцов |
|---|---|---|---|---|
| UKurOh_3 | 1 | О-в Итуруп, охотоморская сторона | 2009 | 45 |
| SKurOh_2 | 2 | Северные Курилы, охотоморская сторона | 2007 | 29 |
| ZapKam_1 | 3 | Восточная часть Охотского моря, Западная Камчатка | 2005 | 48 |
| TauG_4 | 4 | Северная часть Охотского моря, Тауйская губа | 2010 | 47 |
| Chuk_5 | 5 | Наваринский район Берингова моря | 2006 | 22 |
| Chuk_6 | 6 | Анадырский залив Берингова моря | 2010 | 34 |
| Canada_7 | 7 | Воды Британской Колумбии, Канада | 2006 | 43 |
| Shant_8 | 8 | Северо-западная часть Охотского моря | 2009 | 84 |
| KarZal_9 | 9 | Карагинский залив | 2008 | 46 |
| NavZal_10 | 10 | Корякское побережье Берингова моря | 2008 | 47 |
| PetrZal_11 | 11 | Залив Петра Великого, Японское море | 2008 | 41 |
| Sah_12 | 12 | Южная часть Татарского пролива, Японское море | 2008 | 47 |
| SKurTO_13 | 13 | Северные Курилы, тихоокеанская сторона | 2007 | 41 |
| Chuk_14 | 14 | Наваринский район Берингова моря | 2008 | 43 |
| TauG_15 | 15 | Северная часть Охотского моря, Тауйская губа | 2014 | 76 |
| SKurOh_16 | 16 | Северные Курилы, охотоморская сторона | 2015 | 37 |
| NavZal_17 | 17 | Корякское побережье Берингова моря | 2006 | 41 |
| PetrZal_18 | 18 | Залив Петра Великого, Японское море | 2015 | 39 |
| Korey_20 | 20 | Южная Корея, Японское море | 2015 | 45 |
| ZapSah_21 | 21 | Центральная часть Татарского пролива, Японское море | 2015 | 47 |
| YelloSea_22 | 22 | Южная Корея, Желтое море | 2015 | 44 |
| UKurTO_23 | 23 | Южные Курилы, тихоокеанская сторона | 2015 | 40 |
Подавляющее большинство проб собрано в нагульный период, поскольку нерест тихооокеанской трески приходится на зимне-весенний период [1–7], когда из-за ледовых и погодных условий проведение научных исследований и сбор образцов от нерестовых особей практически невозможен.
Пробы тканей (фрагмент грудного плавника) фиксировали 96%-ным этанолом. Выделение и очистку ДНК проводили с помощью набора для выделения ДНК Wizard SV 96 Genomic DNA Purification System (Promega, США) согласно протоколу фирмы-изготовителя. Для амплификации участка контрольного региона мтДНК (D-loop) были использованы разработанные в лаборатории праймеры Ther1021-F 5'-ACGCTCATAAACAAAGGGGG, Ther426-R 5'-ACTGCTTCATAATATGTCCTAAAAACA. Для проведения реакций амплификации участка контрольного региона мтДНК использовалась следующая программа: денатурация ДНК – 95°С в течение 3 мин с последующими 35 циклами, состоящими из 30 с денатурации ДНК матрицы при 95°С, 30 с отжига праймеров при температуре 62°С и синтеза новых цепей в течение 30 с при 72°С, затем следовала завершающая элонгация 10 мин при 72°С.
После проведения ПЦР полученный продукт в объеме 2 мкл очищали от примесей методом этанол-преципитации. Для реакции секвенирования брали 0.3 пмоль очищенного ПЦР-продукта и 3.2 пмоль соответствующего праймера.
Реакцию секвенирования проводили с набором реактивов BigDye v. 1.1 (ABI) со следующими условиями амплификации: 1) денатурация – 94°С, 2 мин; 2) денатурация – 90°С, 30 с; 3) отжиг праймеров – 52°С, 30 с; 4) элонгация – 60°С, 4 мин; 5) шаги 2–4 повторяются 35 циклов; 6) охлаждение продукта – 12°С, 10 мин.
После проведения реакции секвенирования полученный продукт объемом 0.5 мкл растворяли в 15 мкл формамида (Hi-Di) [36], денатурировали при температуре 95°С в течение 3 мин. Секвенирование образцов ДНК трески проводили на приборе ABI Prism 3130xl согласно протоколу фирмы-изготовителя (Applied Biosystems, Foster City, CA, USA).
Матрицы генетической дифференциации Fst между выборками рассчитывали в программе Arlequin 3.5.1.3 [37].
Обработку полученных последовательностей участка D-loop осуществляли при помощи пакета программ Geneious 8.1.8 [38], использовалось выравнивание Geneious Aligment. Полученные нуклеотидные последовательности образцов трески переводили в необходимый формат для расчетов в программе TCS v. 1.21 [39] при помощи конвертора FaBox 1.41 [40]. Сеть гаплотипов строили на основе метода статистической парсимонии (maximum parsimony) в программе TCS v. 1.21. Среднее число нуклеотидных замен (k), число полиморфных сайтов (S), число гаплотипов (h), гаплотипическое разнообразие (Hd), нуклеотидное разнообразие (π) в каждой выборке и среди всех образцов анализировали в пакете программ DnaSP 5.10.01 [41].
РЕЗУЛЬТАТЫ
В результате проведенного исследования 986 образцов (22 выборки) тихоокеанской трески по фрагменту контрольного региона мтДНК длиной 599 пн обнаружено 38 гаплотипов. Из них 19 гаплотипов встречались более чем у одной особи, все остальные – уникальные.
Основу гаплотипического разнообразия составили три основных (массовых) гаплотипа – H1, Н2, Н3 (при этом Н3 > Н2 > H1) (табл. 2). Общая доля массовых гаплотипов составила 86%, на остальные 35 гаплотипов пришлось 14%. Гаплотипы Н2 и Н3 присутствуют в различных соотношениях во всех выборках. Гаплотип Н1 обнаружен во всех выборках, кроме двух: выборке из Желтого моря (YelloSea_22) и выборке из вод Западного Сахалина (ZapSah_21).
Таблица 2.
Распределение гаплотипов участка контрольного региона мтДНК тихоокеанской трески (процентное соотношение представлено только для массовых гаплотипов)
| Выборка | Гаплотипы участка контрольного региона мтДНК (H) | Итого | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 11 | 12 | 15 | 16 | 17 | 18 | 19 | 23 | 34 | 35 | Unique | ||
| n (%) | |||||||||||||||||||||
| UKurOh_3 | 8 (17) | 18 (39) | 16 (34) | 1 | 1 | 1 | 1 | 46 | |||||||||||||
| SKurOh_2 | 7 (24) | 8 (27) | 10 (34) | 1 | 2 | 1 | 29 | ||||||||||||||
| ZapKam_1 | 5 (10) | 7 (14) | 34 (70) | 2 | 48 | ||||||||||||||||
| TauG_4 | 4 (8) | 5 (10) | 32 (68) | 1 | 3 | 1 | 1 | 47 | |||||||||||||
| Chuk_5 | 3 (13) | 9 (49) | 5 (22) | 2 | 2 | 1 | 22 | ||||||||||||||
| Chuk_6 | 6 (17) | 14 (41) | 11 (32) | 2 | 1 | 34 | |||||||||||||||
| Canada_7 | 16 (38) | 13 (30) | 9 (21) | 1 | 1 | 1 | 1 | 42 | |||||||||||||
| Shant_8 | 8 (9) | 5 (5) | 57 (67) | 5 | 3 | 4 | 1 | 1 | 84 | ||||||||||||
| KarZal_9 | 5 (10) | 23 (50) | 10 (21) | 1 | 1 | 1 | 2 | 1 | 2 | 46 | |||||||||||
| NavZal_10 | 11 (23) | 18 (38) | 13 (27) | 1 | 2 | 1 | 1 | 47 | |||||||||||||
| PetrZal_11 | 1 (2) | 7 (17) | 29 (70) | 4 | 41 | ||||||||||||||||
| Sah_12 | 3 (6) | 6 (12) | 30 (63) | 1 | 5 | 1 | 1 | 47 | |||||||||||||
| SKurTO_13 | 9 (21) | 16 (34) | 14 (29) | 1 | 1 | 41 | |||||||||||||||
| Chuk_14 | 8 (18) | 23 (53) | 8 (18) | 1 | 2 | 1 | 43 | ||||||||||||||
| TauG_15 | 5 (6) | 13 (17) | 49 (64) | 2 | 1 | 2 | 2 | 2 | 76 | ||||||||||||
| SKurOh_16 | 11 (29) | 13 (35) | 11 (29) | 1 | 1 | 37 | |||||||||||||||
| NavZal_17 | 12 (29) | 9 (21) | 15 (36) | 1 | 1 | 3 | 41 | ||||||||||||||
| PetrZal_18 | 1 (2) | 2 (5) | 34 (87) | 1 | 1 | 39 | |||||||||||||||
| Korey_20 | 1 (2) | 1 (2) | 43 (95) | 45 | |||||||||||||||||
| ZapSah_21 | – | 16 (34) | 25 (53) | 2 | 1 | 3 | 47 | ||||||||||||||
| UKurTO_23 | 8 (20) | 14 (35) | 9 (22) | 1 | 1 | 7 | 40 | ||||||||||||||
| YelloSea_22 | – | 3 (6) | 20 (45) | 1 | 1 | 10 | 7 | 2 | 44 | ||||||||||||
| Все | 132 (13) | 243 (24) | 484 (49) | 8 | 10 | 26 | 3 | 2 | 4 | 2 | 4 | 6 | 6 | 5 | 5 | 5 | 4 | 10 | 8 | 19 | 986 |
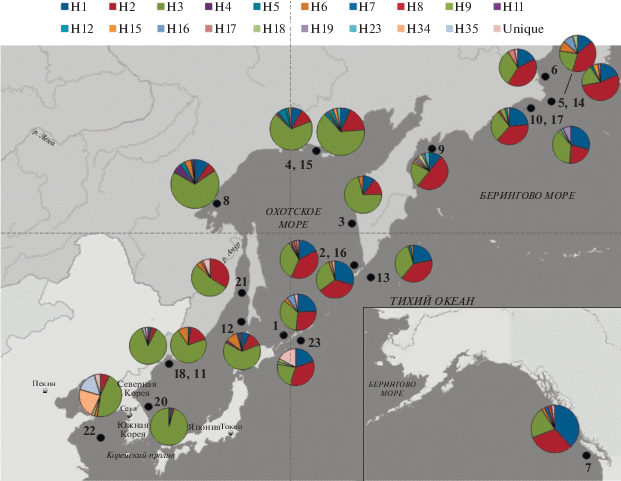
Соотношение массовых гаплотипов H1, Н2, Н3 имело сходные значения в выборках, которые условно могут быть объединены: группа 1 – Берингово море (Chuk_5, Chuk_6, KarZal_9, NavZal_10, Chuk_14, NavZal_17), СЗТО (SKurTO_13, UKurTO_23), Канада (Canada_7), Северные Курилы (SKurOh_2, SKurOh_16), Южные Курилы (UKurOh_3); группа 2 – Японское и северная часть Охотского моря (ZapKam_1, TauG_4, Shant_8, TauG_15, PetrZal_11, Sah_12, PetrZal_18, Korey_20, ZapSah_21); группа 3 – выборка из Желтого моря, отличающаяся от всех присутствием только в этой выборке гаплотипов Н34 и Н35 со значительными долями (22 и 16% соответственно) при отсутствии гаплотипа Н1 (табл. 2, рис. 2).
Рис. 2.
Распределение гаплотипов участка контрольного региона мтДНК в различных выборках тихоокеанской трески.
Сеть гаплотипов, представленная на рис. 3, отражает внутривидовую организацию тихоокеанской трески, существующую длительное время, на протяжении которого происходило формирование современной популяционной структуры в северотихоокеанском регионе. Сеть гаплотипов характеризуется существованием трех связанных между собой звездообразных структур и отражает возможную изоляцию отдельных группировок вида [42]. Пары массовых гаплотипов (Н1 и Н3; Н2 и Н3) отличаются друг от друга на одну мутацию. Структура гаплотипической сети прямо указывает на то, что гаплотип H3 является наиболее древним в связи со значительным превалированием над другими гаплотипами его доли и косвенно – с присутствием во всех выборках. Мы предполагаем, что данный гаплотип широко распространился после проникновения в Тихий океан предков тихоокеанской трески при первом кратковременном открытии Берингова пролива 5.5 млн лет назад. Наиболее молодой гаплотип H2 максимально представлен в выборках группы 1, в особенности в Беринговом море, что свидетельствует о возможном происхождении гаплотипа в беринговоморском рефугиуме и дальнейшем его распространении в ходе расселения трески. Гаплотип Н1 максимально представлен в выборке из вод Канады (38%). С продвижением на запад его частота встречаемости снижается вплоть до полного отсутствия в выборке из Желтого моря (YelloSea_22) и вод Западного Сахалина (ZapSah_21). Поэтому мы предполагаем формирование данного гаплотипа именно в североамериканских прибрежных акваториях.
Рис. 3.
Сеть гаплотипов контрольного региона мтДНК трески. Размеры кружков соответствуют числу образцов.
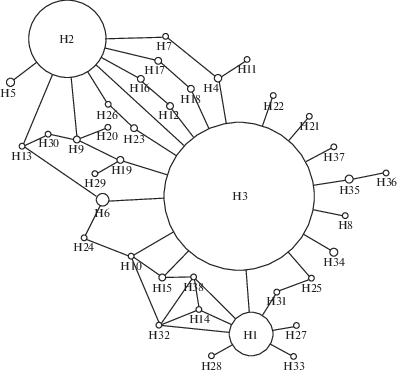
Уникальной и давно изолированной от остальных группировок тихоокеанской трески оказалась выборка из Желтого моря, что подтверждается происхождением гаплотипов H35 и Н36, встречающихся только в этой выборке, от массового гаплотипа Н3. Обнаружен гаплотип Н34, встречающийся с высокой частотой в выборке из Желтого моря и найденный еще только в одной выборке из залива Петра Великого (PetrZal_18). При этом Н34 и Н35 произошли независимо от массового гаплотипа Н3 путем замены нуклеотидов А/Т и T/G в позициях 16 и 491 соответственно.
Рассчитанные показатели гаплотипического разнообразия, представленные в табл. 2, формируют представление об эволюционной истории, путях расселения и современных внутривидовых отношениях в популяциях тихоокеанской трески. Среднее значение гаплотипического разнообразия тихоокеанской трески (Hd) с учетом всех 986 образцов составило 0.680 ± 0.012 (табл. 3). Минимальное значение Hd обнаружено в выборке из япономорских вод Южной Кореи (0.088 ± 0.057 Korey_20) и залива Петра Великого (0.242 ± 0.09 PetrZal_18), а максимальное гаплотипическое разнообразие – в выборке из тихоокеанских вод Южных Курил (0.801 ± 0.04 UKurTO_23).
Таблица 3.
Генетическое разнообразие исследованных образцов тихоокеанской трески по участку контрольного региона мтДНК
| Выборка | N | S | h | Hd ± m | σ | k | π |
|---|---|---|---|---|---|---|---|
| PetrZal_11 | 41 | 3 | 4 | 0.472 ± 0.013 | 0.083 | 0.52 | 0.0009 |
| PetrZal_18 | 39 | 4 | 5 | 0.242 ± 0.014 | 0.09 | 0.30 | 0.0005 |
| Korey_20 | 45 | 2 | 3 | 0.088 ± 0.008 | 0.057 | 0.09 | 0.0002 |
| ZapSah_21 | 47 | 6 | 7 | 0.611 ± 0.007 | 0.051 | 0.78 | 0.0013 |
| Sah_12 | 47 | 5 | 7 | 0.572 ± 0.011 | 0.078 | 0.73 | 0.0011 |
| YelloSea_22 | 44 | 7 | 8 | 0.726 ± 0.007 | 0.05 | 0.98 | 0.0016 |
| ZapKam_1 | 48 | 3 | 4 | 0.474 ± 0.011 | 0.078 | 0.53 | 0.0009 |
| SKurTO_13 | 41 | 4 | 5 | 0.699 ± 0.005 | 0.033 | 0.95 | 0.0016 |
| SKurOh_16 | 37 | 5 | 5 | 0.718 ± 0.005 | 0.029 | 1.08 | 0.0018 |
| SKurOh_2 | 29 | 5 | 6 | 0.766 ± 0.007 | 0.04 | 1.12 | 0.0019 |
| UKurOh_3 | 45 | 6 | 7 | 0.713 ± 0.006 | 0.037 | 1.00 | 0.0017 |
| UKurTO_23 | 40 | 11 | 12 | 0.801 ± 0.006 | 0.04 | 1.48 | 0.0025 |
| TauG_15 | 76 | 7 | 8 | 0.555 ± 0.007 | 0.061 | 0.68 | 0.0011 |
| TauG_4 | 47 | 6 | 7 | 0.524 ± 0.011 | 0.078 | 0.70 | 0.0012 |
| Shant_8 | 84 | 6 | 8 | 0.526 ± 0.008 | 0.063 | 0.71 | 0.0012 |
| Chuk_5 | 22 | 5 | 6 | 0.779 ± 0.014 | 0.064 | 1.21 | 0.002 |
| Chuk_6 | 34 | 4 | 5 | 0.711 ± 0.008 | 0.044 | 0.99 | 0.0017 |
| Chuk_14 | 43 | 5 | 6 | 0.657 ± 0.009 | 0.06 | 1.00 | 0.0017 |
| Canada_7 | 43 | 5 | 7 | 0.727 ± 0.005 | 0.035 | 1.14 | 0.0019 |
| KarZal_9 | 46 | 7 | 9 | 0.701 ± 0.009 | 0.058 | 1.05 | 0.0018 |
| NavZal_10 | 47 | 6 | 7 | 0.735 ± 0.004 | 0.033 | 1.08 | 0.0018 |
| NavZal_17 | 41 | 4 | 6 | 0.744 ± 0.005 | 0.029 | 1.06 | 0.0018 |
| Все | 986 | 24 | 38 | 0.680 ± 0.0003 | 0.012 | 0.91 | 0.0015 |
В среднем высокое гаплотипическое разнообразие показали выборки из вод Северных и Южных Курил (SKurTO_13, SKurOh_2, SKurOh_16, UKurOh_3) – 0.732, примерно такое же значение – выборки из Берингова моря и вод Канады (Chuk_5, Chuk_6, Chuk_14, Canada_7, KarZal_9, NavZal_10, NavZal_17) – 0.722. Выявлено высокое гаплотипическое разнообразие в выборке из Желтого моря – 0.726, притом что среднее гаплотипическое разнообразие выборок из Японского моря (PetrZal_11, PetrZal_18, Korey_20, ZapSah_21, Sah_12) составило 0.396. Довольно низкое среднее гаплотипическое разнообразие (0.519) наблюдалось в выборках из северной части Охотского моря (TauG_15, TauG_4, Shant_8, ZapKam_1), несмотря на большое количество исследованных образцов.
Принцип повторяемости значений Hd в выборках разных лет из сходных акваторий не всегда реализовался. Так, значение Hd в выборке из залива Петра Великого 2008 г. (0.472) гораздо выше значения для выборки 2015 г. – (0.242); отличались и значения разнообразия в двух разных выборках 2008 и 2006 гг. из акватории Наваринского района (Chuk_14 – 0.657 и Chuk_5 – 0.779). При этом в других вариантах принцип повторяемости вполне реализовывался в достаточной мере (табл. 3): гаплотипическое разнообразие в выборках разных лет из акватории Корякского побережья имело сходные значения (NavZal_10, 2008 г. – 0.735; NavZal_17, 2006 г. – 0.744), аналогичная ситуация отмечена для выборок разных лет из Тауйской губы (TauG_4, 2010 г. – 0.524; TauG_15, 2014 г. – 0.555).
Выборки из Берингова моря, вод Канады и Северных Курил, сходные по своему гаплотипическому составу, в большинстве случаев имеют низкий уровень генетической дифференциации между собой и достоверно отличаются от выборок из вод северной части Охотского моря, Японского и Желтого морей.
Матрицы генетической дифференциации Fst между выборками трески, рассчитанные в программе Arlequin 3.5.1.3 на основании данных полиморфизма участка контрольного региона мтДНК, представлены в табл. 4. Выявлено достоверное отличие выборки из Желтого моря от всех остальных, при этом значения Fst варьировали в достаточно высоких пределах – от 0.091 до 0.257 (наиболее низкие попарные значения Fst отмечены для залива Петра Великого Японского моря (PetrZal_18) и Тауйской губы Охотского моря (TauG_4), наиболее высокие – для Наваринского района Берингова моря (Chuk_14) и япономорских вод Кореи (Korey_20). Выборки из Японского моря достоверно (от 0.014 до 0.364) отличаются от выборок из других акваторий Северной Пацифики, за исключением выборок из северной части Охотского моря.
Таблица 4.
Попарные значения Fst между выборками тихоокеанской трески (под диагональю) и наличие (+) или отсутствие (–) статистической значимости при p < 0.05 (над диагональю)
| Выборки | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 20 | 21 | 23 | 22 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 0 | – | + | + | – | – | – | + | – | – | + | + | – | – | + | – | – | + | + | + | – | + |
| 2 | 0.000 | 0 | + | + | – | – | – | + | – | – | + | + | – | + | + | – | – | + | + | + | – | + |
| 3 | 0.073 | 0.055 | 0 | – | + | + | + | – | + | + | – | – | + | + | – | + | + | – | + | + | + | + |
| 4 | 0.060 | 0.045 | 0.000 | 0 | + | + | + | – | + | + | – | – | + | + | – | + | + | – | + | + | + | + |
| 5 | 0.000 | 0.000 | 0.135 | 0.107 | 0 | – | – | + | – | – | + | + | – | – | + | – | – | + | + | + | – | + |
| 6 | 0.000 | 0.000 | 0.121 | 0.097 | 0.000 | 0 | – | + | – | – | + | + | – | – | + | – | – | + | + | + | – | + |
| 7 | 0.008 | 0.000 | 0.115 | 0.108 | 0.038 | 0.025 | 0 | + | + | – | + | + | – | – | + | – | – | + | + | + | – | + |
| 8 | 0.100 | 0.083 | 0.000 | 0.001 | 0.159 | 0.149 | 0.139 | 0 | + | + | – | – | + | + | + | + | + | – | – | + | + | + |
| 9 | 0.012 | 0.035 | 0.162 | 0.132 | 0.000 | 0.000 | 0.072 | 0.191 | 0 | – | + | + | – | – | + | – | + | + | + | + | – | + |
| 10 | 0.000 | 0.000 | 0.094 | 0.079 | 0.000 | 0.000 | 0.002 | 0.126 | 0.013 | 0 | + | + | – | – | + | – | – | + | + | + | – | + |
| 11 | 0.086 | 0.078 | 0.000 | 0.007 | 0.122 | 0.128 | 0.148 | 0.013 | 0.154 | 0.112 | 0 | – | + | + | – | + | + | + | + | – | + | + |
| 12 | 0.078 | 0.065 | 0.000 | 0.006 | 0.114 | 0.120 | 0.123 | 0.000 | 0.154 | 0.104 | 0.000 | 0 | + | + | – | + | + | + | + | + | + | + |
| 13 | 0.000 | 0.000 | 0.089 | 0.072 | 0.000 | 0.000 | 0.002 | 0.116 | 0.014 | 0.000 | 0.105 | 0.095 | 0 | – | + | – | – | + | + | + | – | + |
| 14 | 0.007 | 0.027 | 0.181 | 0.148 | 0.000 | 0.000 | 0.045 | 0.207 | 0.000 | 0.000 | 0.182 | 0.174 | 0.002 | 0 | + | – | + | + | + | + | – | + |
| 15 | 0.058 | 0.047 | 0.000 | 0.000 | 0.099 | 0.091 | 0.119 | 0.015 | 0.122 | 0.078 | 0.001 | 0.009 | 0.070 | 0.143 | 0 | + | + | – | + | + | + | + |
| 16 | 0.000 | 0.000 | 0.089 | 0.080 | 0.014 | 0.000 | 0.000 | 0.117 | 0.041 | 0.000 | 0.117 | 0.099 | 0.000 | 0.022 | 0.084 | 0 | – | + | + | + | – | + |
| 17 | 0.014 | 0.000 | 0.055 | 0.052 | 0.054 | 0.039 | 0.004 | 0.079 | 0.085 | 0.007 | 0.094 | 0.075 | 0.013 | 0.072 | 0.061 | 0.000 | 0 | + | + | + | – | + |
| 18 | 0.162 | 0.146 | 0.011 | 0.017 | 0.248 | 0.225 | 0.206 | 0.010 | 0.251 | 0.181 | 0.036 | 0.025 | 0.189 | 0.281 | 0.024 | 0.184 | 0.126 | 0 | – | + | + | + |
| 20 | 0.232 | 0.229 | 0.051 | 0.053 | 0.352 | 0.314 | 0.280 | 0.029 | 0.324 | 0.250 | 0.078 | 0.055 | 0.269 | 0.364 | 0.056 | 0.265 | 0.193 | 0.000 | 0 | + | + | + |
| 21 | 0.027 | 0.045 | 0.079 | 0.061 | 0.014 | 0.028 | 0.113 | 0.102 | 0.028 | 0.046 | 0.049 | 0.063 | 0.038 | 0.057 | 0.043 | 0.073 | 0.094 | 0.159 | 0.224 | 0 | + | + |
| 23 | 0.000 | 0.000 | 0.096 | 0.087 | 0.014 | 0.004 | 0.000 | 0.128 | 0.038 | 0.000 | 0.118 | 0.105 | 0.000 | 0.019 | 0.097 | 0.000 | 0.000 | 0.170 | 0.234 | 0.076 | 0 | + |
| 22 | 0.179 | 0.161 | 0.105 | 0.099 | 0.203 | 0.207 | 0.218 | 0.103 | 0.233 | 0.196 | 0.101 | 0.095 | 0.195 | 0.257 | 0.109 | 0.195 | 0.164 | 0.091 | 0.128 | 0.162 | 0.188 | 0 |
ОБСУЖДЕНИЕ
Показатели гаплотипического разнообразия формируют представления о расселении, микроэволюционных процессах и схожих по гаплотипическому составу группировках трески. В результате анализа 22 выборок тихоокеанской трески в целом выявлен достаточно низкий полиморфизм контрольного региона мтДНК, хотя межвыборочный попарный уровень дифференциации в большинстве случаев имел достоверные значения. Обнаруженный общий низкий показатель гаплотипического разнообразия контрольного региона мтДНК, вероятно, связан не с прохождением тихоокеанской треской бутылочного горлышка, как упомянуто в работе Лиу с соавт. [35], а с консервативностью исследованного участка. Возможно, данный фрагмент контрольного региона имеет определенное функциональное значение, суть которого может быть выявлена в ходе дальнейших исследований. Ранее нами у тихоокеанской трески был выявлен более высокий, чем у фрагмента контрольного региона, полиморфизм участка гена Cytb [34].
Соотношения распределения обнаруженных гаплотипов у трески различных акваторий позволяют выделить три группы выборок. Основу группы 1 составляют выборки Берингова моря с примыкающими к ним выборками Канады и тихоокеанских вод Северных и Южных Курил (Chuk_5, Chuk_6, KarZal_9, NavZal_10, Chuk_14, NavZal_17, SKurTO_13, UKurTO_23, UKurOh_3, Canada_7, SKurOh_2, SKurOh_16). Группу 2 составляют выборки из северной части Охотского моря и прибрежных акваторий Японского моря (ZapKam_1, TauG_15, TauG_4, Shant_8, PetrZal_11, Sah_12, PetrZal_18, Korey_20, ZapSah_21). Группа 3 включает выборку из Желтого моря. Разделение тихоокеанской трески на группы совпадает с данными о расположении смоделированных рефугиумов в западной части Северной Пацифики [43] и возможном сохранении трески в их пределах: Японское, Охотское и Берингово моря.
Группа 1 от остальных групп отличалась не только соотношением гаплотипов, но и эколого-биологическими характеристиками. Выборки первой группы приурочены к мористым акваториям, находящимся в поле действия системы круговоротов Северной Пацифики. Хотя у тихоокеанской трески демерсальная икра, все же личинки, поднимающиеся в пелагиаль для питания мелкими беспозвоночными [44, 45], подвергаются денатантному разносу. Возможно, миграция на ранних стадиях развития и оказалась механизмом поддержания определенной генетической идентичности выборок из группы мористых акваторий. Стоит отметить, что выборка из тихоокеанских вод Южных Курил имеет самое высокое значение гаплотипического разнообразия за счет высокой доли уникальных гаплотипов – 17.5% (табл. 2), а представленные в ней уникальные гаплотипы Н27, Н28, Н29, Н30, Н31, Н32, Н33 произошли от разных массовых гаплотипов. Вероятно, треска данного региона несет как гаплотипы рыб, переживших похолодание в рефугиуме [43], так и особей, мигрировавших из северных регионов Тихого океана в послеледниковый период. По всей видимости, это и объясняет высокое разнообразие гаплотипов в данном регионе, что обычно не свойственно выборкам с окраин видового ареала [46].
Сходство гаплотипов между выборками из северной части Охотского моря и Японского моря обусловлено постгляциальным расселением. Однако активная миграция трески акваторий материкового шельфа Охотского и Японского морей в современности маловероятна по ряду причин. Известно, что тихоокеанская треска, в отличие от атлантической, в основном масштабных миграций не совершает, ограничиваясь перемещениями в рамках шельф–склон [47]. Хотя водообмен между Японским и Охотским морями существует, в частности через систему проливов (Татарский, Невельского, Лаперуза, Амурский лиман), однако их мелководность и сильное распреснение вод Амурского лимана противодействуют миграциям взрослых особей трески, а также личинок и ранней молоди [48–50].
В Северной Пацифике периоды оледенения не сопровождались такими кардинальными изменениями условий существования, как в Северной Атлантике: температуры вод изменялись слабо, структура течений в основном сохранялась, не было тотального развития ледников высотой многие сотни метров [51–53]. Выраженный характер имела только океанская регрессия, сопровождавшаяся закрытием Берингова пролива, осушением шельфовых зон Берингова, Охотского и Желтого морей, обособлением Японского моря [43]. Можно полагать, что значительных миграций и кардинальных изменений ареала тихоокеанской трески в ледниковое–постледниковое время не происходило, а изменения ее ареала носили локальный характер вследствие изменений глубин в прибрежье, сохраняясь везде, кроме полностью осушавшегося Желтого моря [43, 54].
Особняком располагается группа 3, представленная выборкой из Желтого моря (H1 – 0; H2 – 6; H3 – 45%), в которой, в отличие от других выборок, уникальные гаплотипы Н34 и Н35 составляли значительную долю (22 и 16% соответственно). Треска Желтого моря, демонстрировавшая также дифференциацию по микросателлитным маркерам [55], – самая молодая в северотихоокеанском бассейне группировка, сформировавшаяся в результате расселения (скорее всего из рефугиума Восточно-Китайского моря и акватории Японского моря [54]) в новообразовавшиеся в ходе послеледниковой океанской трансгрессии акватории 15.0–12.8 тыс. лет назад [43, 54, 56]. Важно подчеркнуть, что косвенным подтверждением происхождения трески Желтого моря из нескольких рефугиумов является показатель ее гаплотипического разнообразия (Hd = 0.726), который в 2 раза выше, чем в среднем у трески Японского моря (0.396). Специфический гаплотипический состав контрольного региона этой трески (полное отсутствие одного из массовых гаплотипов, высокая доля альтернативных гаплотипов, относимых к разряду уникальных в других выборках), видимо, является результатом и следствием адаптации к гидрологическим условиям субтропических вод Желтого моря, находящихся под воздействием несущего воды из тропической зоогеографической зоны течения Куросио [55].
Таким образом, проведенные нами исследования с использованием контрольного региона мтДНК тихоокеанской трески позволили получить информацию о ее филогеографической истории, путях расселения в пределах азиатской части ареала, формировании современного генетического разнообразия и выделить в пределах Северо-Западной Пацифики три группировки со сходным гаплотипическим составом. Проведенные нами предварительные исследования позволяют предположить, что применение других генетических маркеров (микросателлиты, SNP) предоставит возможность выделить особености современной популяционной структуры трески на исследованной нами акватории.
Авторы выражают глубокую признательность своим многочисленным коллегам, принимавшим участие в сборе материалов, использованных в данной статье: О.А. Ровниной (ФГБНУ “ЮгНИРО”, Керчь), А.В. Ходакову (ФГБНУ “ВНИРО”, Москва), М.И. Бойко и П.В. Калчугину (ФГБНУ “ТИНРО-Центр”, Владивосток), Г.В. Новомодному (Хабаровский филиал ФГБНУ “ТИНРО-Центр”, Хабаровск), Г.А. МакФарлейну (G.A. McFarlane, Pacific Biological Station, Nanaimo, B.C., Canada), а также А.А. Волкову (ФГБНУ “ВНИРО”, Москва) за помощь в отработке методик. Отдельная благодарность Н.С. Мюге (ФГБНУ “ВНИРО”, Москва) за конструктивное обсуждение рукописи.
Исследования осуществлены при финансовой поддержке РФФИ (гранты № 13-04-00803, 16-34-01285, 16-05-00317), госбюджетной темы 01 2001 17418, а также гранта Национального рыбохозяйственного института (National Institute of Fisheries Science, Republic of Korea) R2017035.
Список литературы
Линдберг Г.У., Легеза М.И. Рыбы Японского моря сопредельных и частей Охотского и Желтого морей. Ч. 2. Л.: Наука, 1965. 392 с.
Марти Ю.Ю. Трескообразные // Жизнь животных. Т. 4. Рыбы / Под ред. Расса Т.С. М.: Просвещение, 1971. С. 377–387.
Никольский Г.В. Частная ихтиология. М.: Высш. шк., 1971. 472 с.
Bakkala R.G., Mishima S., Westrheim S.J. et al. Distribution of Pacific cod in the North Pacific Ocean // Int. N. Pac. Fish. Comm. Bull. 1984. № 42. P. 111–115.
Борец Л.А. Донные ихтиоцены российского шельфа дальневосточных морей: состав, структура, элементы функционирования и промысловое значение. Владивосток: ТИНРО-Центр, 1997. 217 с.
Богданов Г.А. Тихоокеанская треска. Вопросы биологии и запасы. М.: ИПФ “Сашко”, 2006. 136 с.
Световидов А.Н. Трескообразные // Фауна СССР. Т. 9. Вып. 4. Рыбы. М.: Л.: Изд-во АН СССР, 1948. 221 с.
Гладенков А.Ю., Гладенков Ю.Б. Начало формирования межокеанических связей Пацифики и Арктики через Берингов пролив в неогене // Стратиграфия. Геол. корреляция. 2004. Т. 12. № 2. С. 72–89.
Grant W.S., Zhang C.I., Kobayashi T. et al. Lack of genetic stock discretion of Pacific cod (Gadus macrocephalus) // Can. J. Fish. Aquat. Sci. 1987. V. 44. № 3. P. 490–498.
Grant W.S., Stahl G. Evolution of Atlantic and Pacific cod: loss of genetic variation and gene expression in Pacific cod // Evolution. 1988. V. 42. P. 138–146. doi https://doi.org/10.1111/j.1558-5646.1988.tb04114.x
Grant W.S., Stahl G. Description of electrophoretic loci in Atlantic cod, Gadus morhua, and comparison with Pacific cod, Gadus microcephalus // Hereditas. 1988. V. 108. P. 27–36. doi https://doi.org/10.1111/j.1601-5223.1988.tb00678.x
Shimada A.M., Kimura D.K. Seasonal movements of Pacific cod, Gadus macrocephalus, in the eastern Bering Sea and adjacent waters based on tag-recapture data // U.S. Fish. Bull. 1994. V. 92. № 4. P. 800–816.
Петрова-Тычкова М.А. Меристические признаки трески дальневосточных морей // Изв. ТИНРО. 1948. Т. 28. С. 127–137.
Петрова-Тычкова М.А. Материалы по биологии трески Наваринского района // Изв. ТИНРО. 1954. Т. 42. С. 269–276.
Тихонов В.И. К морфологической характеристике анадырской трески // Изв. ТИНРО. 1955. Т. 43. С. 193–194.
Вершинин В.Г. Биология и промысел трески северо-западной части Тихого океана: Автореф. дис. ... канд. биол. наук. Владивосток: ДВНЦ АН СССР, 1984. 21 с.
Дьяков Ю.П. О морфологической гетерогенности западнокамчатской трески // Исследования биологии и динамики численности промысловых рыб камчатского шельфа. Петропавловск-Камчатский: КоТИНРО, 1991. Вып. 1. Ч. 1. С. 144–150.
Ким Сен Ток, Полтев Ю.Н. Внутривидовая дифференциация тихоокеанской трески Gadus macrocephalus Til. (Gadiformes, Gadidae) в водах Сахалина и Курильских островов средствами морфометрического анализа // Изв. ТИНРО. 1998. Т. 124. С. 747–757.
Kanno Y., Ueda Y., Matsuishi T. Subpopulation of Pacific cod on the Pacific coast of northern Japan // Nippon Suisan Gakkaishi. 2001. V. 67. № 1. P. 67–77.
Kanno Y., Ueda Y., Matsuishi T. Weight-based virtual population analysis of Pacific cod Gadus macrocephalus off the Pacific coast of southern Hokkaido // Fish. Sci. 2004. V. 70. P. 829–838. doi https://doi.org/10.1111/j.1444-2906.2004.00876.x
Cunningham K.M. Population genetics of Pacific cod (Gadus macrocephalus): evidence for large and small scale population structure: M.S. Thesis. Seattle: Univ. Washington, 2007.
Cunningham K.M., Canino M.F., Spies I.B. et al. Genetic isolation by distance and localized fjord population structure in Pacific cod (Gadus macrocephalus): limited effective dispersal in the northeastern Pacific Ocean // Can. J. Fish. Aquat. Sci. 2009. V. 66. P. 153–166.
Canino M.F., Spies I.B., Cunningham K.M. et al. Multiple ice-age refugia in Pacific cod, Gadus microcephalus // Mol. Ecol. 2010. V. 19. № 19. P. 4339–4351. doi https://doi.org/10.1111/j.1365-294X.2010.04815.x
Kim M.J., An H.S., Choi K.H. Genetic characteristics of Pacific cod populations in Korea based on microsatellite markers // Fish. Sci. 2010. V. 76. № 4. P. 595–603.
Строганов А.Н., Орлов А.М., Афанасьев К.И. и др. Предварительные данные по изменчивости трех микросателлитных локусов у тихоокеанской Gadus macrocephalus и атлантической G. morhua трески (Gadidae) // Вопр. ихтиологии. 2009. Т. 49. № 2. С. 191–199.
Строганов А.Н., Орлов А.М., Бурякова М.Е. и др. О генетической дифференциации тихоокеанской трески Gadus macrocephalus Tilesius, 1810 (Gadiformes: Gadidae) // Биол. моря. 2009. Т. 35. № 6. С. 436–439.
Строганов А.Н., Орлов А.М., Афанасьев К.И. и др. Изменчивость микросателлитных локусов в популяциях тихоокеанской трески Gadus macrocephalus Tilesius (Gadidae) // Вестн. МГУ. Сер. 16. Биология. 2010. № 2. С. 35–39.
Park B.H. On the race of cods (Gadus macrocephalus) between Yellow Sea and Chin Hae Bay of Korea // Fish. Res. Dev. Agency Rep. Fish. Res. 1965. V. 6. P. 97–115.
Gong Y., Park Y.C., Kim S.S. Study of the management unit of fisheries resources by genetic method. 1. Genetic similarity of Pacific cod in the North Pacific // Bull. Nat. Fish. Res. Dev. Agency. 1991. V. 45. P. 47–61.
Saitoh K. Genetic variation and local differentiation in the Pacific cod Gadus macrocephalus around Japan revealed by mtDNA and RAPD markers // Fish. Sci. 1998. V. 64. № 5. P. 673–679.
Gwak W.S., Nakayama K. Genetic variation and population structure of the Pacific cod Gadus macrocephalus in Korean waters revealed by mtDNA and msDNA markers // Fish. Sci. 2011. V. 77. № 6. P. 945–952.
Suda A., Nagata N., Sato A. et al. Genetic variation and local differences in Pacific cod Gadus macrocephalus around Japan // J. Fish Biol. 2017. V. 90. № 1. P. 61–79. doi https://doi.org/10.1111/jfb.13154
Смирнова М.А., Орлова С.Ю., Калчугин П.В. и др. Особенности популяционной структуры тихоокеанской трески Gadus microcephalus южной части ареала на основе микросателлитного анализа // Генетика 2018. Т. 54. № 6. С. 661–670.
Смирнова М.А., Орлова С.Ю., Мюге Н.С. и др. Генетическая дифференциация тихоокеанской трески Gadus macrocephalus в Охотском и Беринговом морях // Докл. акад. наук. 2015. Т. 465. № 3. С. 375–375.
Liu M., Lu Z.C., Gao T.X. et al. Remarkably low mtDNA control-region diversity and shallow population structure in Pacific cod Gadus microcephalus // J. Fish Biol. 2010. V. 77. P. 1071–1082. doi https://doi.org/10.1111/j.1095-8649.2010.02743.x
Silva W.A., Costa M.C.R., Jr., Valente V. et al. PCR template preparation for capillary DNA sequencing // BioTechniques. 2001. V. 30. № 3. P. 537–540.
Excoffier L., Lischer H.E.L. Arlequin suite ver 3.5: a new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Resour. 2010. V. 10. № 3. P. 564–567.
Drummond A.J., Ashton B., BuxtonS. et al. Geneious v5.4. 2011. Available from http://www.geneious.com/.
Clement M., Posada D., Crandall K.A. TCS: a computer program to estimate gene genealogies // Mol. Ecol. 2000. V. 9. P. 1657–1659.
Villesen P. FaBox: an online toolbox for Fasta sequences // Mol. Ecol. Notes. 2007. V. 7. P. 965–968.
Librado P., Rozas J. DnaSP v5: a software for comprehensive analysis of DNA polymorphism data // Bioinformatics. 2009. V. 25. № 11. P. 1451–1452.
Avise J.C. Phylogeography: The History and Formation of Species. Cambridge; London: Harvard Univ. Press, 2000. 447 p.
Bigg G.R. Environmental confirmation of multiple ice age refugia for Pacific cod, Gadus macrocephalus // Evol. Ecol. 2014. V. 28. № 1. P. 177–191.
Laurel B.J., Hurst T.P., Copeman L.A., Davis M.W. The role of temperature on the growth and survival of early and late hatching Pacific cod larvae (Gadus macrocephalus) // J. Plankton Res. 2008. V. 9. P. 1051–1060.
Hurst T.P., Cooper D.W., Scheingross J.S. et al. Effects of ontogeny, temperature, and light on vertical movements of larval Pacific cod (Gadus macrocephalus) // Fish. Oceanogr. 2009. V. 18. № 5. P. 301–311.
White M.J. Speciation in animals // Austral. J. Sci. 1959. V. 22. P. 32–39.
Моисеев П.А. Треска и камбалы дальневосточных морей // Изв. ТИНРО. 1953. Т. 40. С. 21–118.
Жабин И.А., Дубина В.А. Влияние стока реки Амур на гидрологические условия Амурского лимана // Тр. СахНИРО. 2008. Т. 10. С. 190–200.
Жабин И.А., Абросимова А.А., Дубина В.А., Некрасов Д.А. Влияние стока реки Амур на гидрологические условия Амурского лимана и Сахалинского залива Охотского моря в период весенне-летнего паводка // Метеорология и гидрология. 2010. № 4. С. 93–100.
Цхай Ж.Р. Пространственно-временная изменчивость концентрации хлорофилла-а в поверхностном слое Охотского моря и прилегающих акваторий по спутниковым данным: Дис. … канд. геогр. наук. Южно-Сахалинск: Ин-т мор. геол. и геофиз., 2017. 157 с.
Dong B., Valdes P.J. Simulations of the Last Glacial Maximum climates using a general circulation model: prescribed versus computed sea surface temperatures // Climate Dynamics. 1998. V. 14. № 7–8. P. 571–591.
Bigg G.R., Cunningham C.W., Ottersen G. et al. Ice-age survival of Atlantic cod: agreement between palaeoecology models and genetics // Proc. R. Soc. London B: Biol. Sci. 2008. V. 275. № 1631. P. 163–173.
Wang L.B., Yang Z.S., Zhang R.P. et al. Sea surface temperature records of core ZY2 from the central mud area in the South Yellow Sea during last 6200 years and related effect of the Yellow Sea Warm Current // Chinese Sci. Bull. 2011. V. 56. P. 1588–1595.
Park S.C., Yoo D.G., Lee C.W., Lee E.I. Last glacial sea-level changes and paleogeography of the Korea (Tsushima) Strait // Geo. Mar. Lett. 2000. V. 20. P. 64–71.
Song N., Liu M., Yanagimoto T. et al. Restricted gene flow for Gadus macrocephalus from Yellow Sea based on microsatellite markers: geographic block of Tsushima Current // Int. J. Mol. Sci. 2016. V. 17. № 467. P. 1–11. doi https://doi.org/10.3390/ijms17040467
Романова А.В. Условия формирования осадков Охотского моря в позднем плейстоцене–голоцене (по данным фораминиферового анализа): Дис. … канд. геол.-минер. наук. Владивосток: ДГИ, 2014. 144 с.
Дополнительные материалы отсутствуют.