Генетика, 2019, T. 55, № 5, стр. 609-612
Генотип эндосимбионта Wolbachia pipientis влияет на метаболизм октопамина у самок Drosophila melanogaster
Н. В. Адоньева 1, Е. В. Бурдина 1, Р. А. Быков 1, Н. Е. Грунтенко 1, И. Ю. Раушенбах 1, *
1 Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
* E-mail: iraushen@bionet.nsc.ru
Поступила в редакцию 03.07.2018
После доработки 07.08.2018
Принята к публикации 20.08.2018
Аннотация
Исследовано влияние генотипа эндосимбионта дрозофилы Wolbachia pipientis на метаболизм октопамина, одного из основных биогенных аминов насекомых, у молодых самок Drosophila melanogaster. Измерялись активность ключевого фермента синтеза октопамина – тирозиндекарбоксилазы и активность фермента его деградации – октопамин-зависимой N-ацетилтрансферазы. Показано, что в нормальных условиях у самок, инфицированных бактериями патогенного штамма wMelPop, повышена, а бактериями генотипа wMelCS снижена активность обоих исследованных ферментов, в то время как у самок, инфицированных wMel-генотипом, она не отличается от таковой у неинфицированных мух. Обнаружено также, что у всех самок, инфицированных Wolbachia, снижена интенсивность ответа тирозиндекарбоксилазы на тепловой стресс. Таким образом, впервые продемонстрировано влияние Wolbachia на метаболизм октопамина у самок дрозофилы и показано, что характер этого влияния определяется генотипом симбионта.
Одним из самых распространенных прокариотических симбионтов беспозвоночных является внутриклеточная α-протеобактерия Wolbachia pipientis, которая встречается у 40% наземных членистоногих [1]. Wolbachia передается по материнской линии и может манипулировать детерминацией пола и репродуктивной системой хозяина для того, чтобы способствовать распространению Wolbachia в популяции хозяина [2]. С другой стороны, инфицирование Wolbachia может быть полезно для хозяина [3, 4]. Различия в фенотипических проявлениях инфицирования могут быть связаны с особенностями физиологии организма хозяина, включая процессы эндокринной регуляции роста, развития и приспособленности [4–6]. Однако молекулярные механизмы, лежащие в основе взаимодействий Wolbachia–хозяин, а также физиологические механизмы, с помощью которых Wolbachia способствует адаптации организма хозяина, остаются во многом невыясненными. Одним из таких механизмов может быть влияние Wolbachia на метаболизм октопамина – одного из стресс-связанных гормонов насекомых.
Октопамин – один из основных биогенных аминов насекомых – функционирует как 1) нейротрансмиттер, пропускающий нервный импульс через синаптическую щель; 2) нейромодулятор, локально влияющий на соседние клетки центральной нервной системы, модифицируя действие нейротрансмиттера, и 3) нейрогормон, который транспортируется с током гемолимфы и действует на значительных расстояниях [7]. Октопамин контролирует устойчивость к голоданию, продолжительность жизни и баланс между экономным и затратным метаболическими режимами у дрозофилы [8].
Содержание биогенных аминов в каждый момент времени определяется соотношением их синтеза и деградации [7, 9]. Ключевым ферментом синтеза октопамина является тирозиндекарбоксилаза (ТДК), превращающая тирозин в тирамин, предшественник октопамина. Основным ферментом, катаболизирующим октопамин, является октопамин-зависимая арилалкиламин-N-ацетилтрансфераза (ОАТ) [7, 9].
Рошайб с соавт. [10] исследовали влияние инфицирования мух wMelPop, wMel и wMelCS вариантами Wolbachia на уровень и биосинтез октопамина (уровень транскрипции ТДК2 и тирозин-β-гидроксилазы) в головах самцов D. melanogaster и обнаружили негативное влияние штамма wMelPop на оба параметра, но не обнаружили разницы в пути биосинтеза октопамина между неинфицированными особями и мухами, инфицированными генотипами wMel и wMelCS.
В настоящей работе мы исследовали влияние различных вариантов инфекции Wolbachia pipientis (wMel, wMelPop и wMelCS) на метаболизм октопамина в теле самок дрозофилы – активность ОАТ в нормальных условиях и активность ТДК в нормальных условиях и при тепловом стрессе (ранее мы показали, что у дрозофилы ТДК является компонентом стресс-реакции [11]). Мы также убедились посредством ПЦР-анализа со специфическими праймерами к генам Wolbachia wsp и 16SrRNA, что тепловой стресс 38°С длительностью 1 ч не приводит к потере инфекции [12, 13].
В работе использованы специально созданные нами линии с замещенной цитоплазмой на едином ядерном фоне [14]. В качестве донора ядерного фона использована изосамочная линия Bi90, которая была создана в 2004 г. на основе сборов в популяции г. Бишкек (Кыргызстан). Эта линия до начала настоящей работы прошла не менее 300 поколений внутрилинейных скрещиваний и может считаться инбредной. Линия Bi90 инфицирована Wolbachia, генотип wMel, клада V. Одна пара мух из общего пула Bi90 была размножена, и потомки этой отводки использованы в экспериментах. В качестве контроля использовалась неинфицированная отводка линии Bi90T, созданная посредством культивирования мух на корме, содержащем 0.03% тетрациклина, в течение трех поколений. Линии, инфицированные Wolbachia генотипов wMel, wMelCS и штамма wMelPop, получены путем последовательных скрещиваний самки, обладающей соответствующим цитоплазматическим фоном, с самцом неинфицированной линии Bi90T в течение 20 поколений.
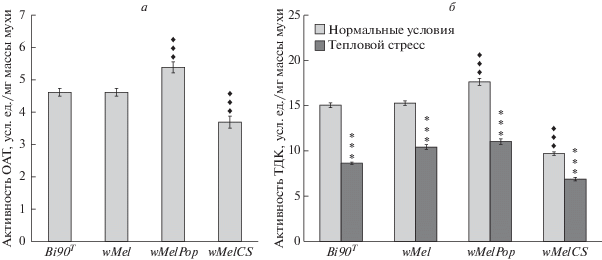
Рисунок 1,а демонстрирует результаты измерения активности ОАТ у 1-суточных неинфицированных самок линии Bi90T и самок, инфицированных бактериями wMel, wMelPop и wMelCS. Видно, что активность ОАТ у линий, инфицированных wMelPop, существенно выше, а у инфицированных wMelCS – существенно ниже, чем у Bi90T (различия достоверны при p < 0.001 для обоих типов Wolbachia). У самок линии с инфекцией wMel активность ОАТ не отличается от линии Bi90T.
Рис. 1.
Влияние генотипа Wolbachia pipientis на метаболизм октопамина (ОА) у 1-суточных самок Drosophila melanogaster. Активность (а) фермента, деградирующего ОА, ОА-зависимой N-ацетилтрансферазы (ОАТ), и (б) ключевого фермента синтеза ОА, тирозиндекарбоксилазы (ТДК), в нормальных условиях и после теплового стресса (38°С, 1 ч) у самок линий Bi90Т и Bi90, инфицированных типами Wolbachia wMel, wMelPop и wMelCS. Каждое значение – среднее из 10–20 измерений. Ромб – достоверность отличий от неинфицированных особей, звездочка – достоверность различий контрольных и стрессированных самок одного генотипа (три ромба или звездочки – достоверность отличий при p < 0.001).
Повышение/снижение активности фермента, деградирующего октопамин, должно привести к снижению/повышению уровня амина. Ранее мы показали существование механизма негативной обратной связи между уровнем биогенных аминов (дофамина и октопамина) и активностью ферментов их синтеза [15]. В таком случае можно ожидать, что снижение/повышение уровня октопамина (в результате повышения/снижения активности ОАТ) приведет к повышению/снижению активности ключевого фермента его синтеза. Чтобы это проверить, мы измерили активность ТДК у 1‑суточных самок всех исследуемых линий.
На рис. 1,б представлены результаты измерения активности ТДК в нормальных условиях и после теплового (38°С, 1 ч) стресса. Видно, что активность ТДК у самок, инфицированных Wolbachia wMel-генотипа, такая же, как у неинфицированных самок линии Bi90T. По сравнению с этим уровнем активность ТДК у самок, инфицированных Wolbachia wMelPop-штамма, повышена, а у самок, инфицированных Wolbachia wMelCS-генотипа, понижена (различия достоверны при p < 0.001 для обеих групп).
Необходимо отметить, что у всех самок, инфицированных Wolbachia, снижена интенсивность ответа (стресс-реактивность) на тепловой стресс: стресс-реактивность ТДК самок Bi90T составляет 42.7%, инфицированных wMel – 30.9%, wMelPop – 37.4%, wMelCS – 29.1% (различия с Bi90T достоверны при p < 0.01 для wMelPop и при p < 0.001 для wMel и wMelCS).
Итак, у самок дрозофилы разные генотипы Wolbachia оказывают различное влияние на метаболизм октопамина в нормальных условиях, но однонаправленно влияют на стресс-ответ хозяина. Таким образом, впервые продемонстрировано, что характер влияния Wolbachia на метаболизм октопамина у самок дрозофилы определяется генотипом симбионта.
Авторы благодарят доктора Луиса Тейшейру (Институт науки им. Гюльбенкяна, Лиссабон, Португалия) за предоставление линии D. melanogaster, инфицированной штаммом Wolbachia wMelPop.
Исследование поддержано грантом РФФИ № 16-04-00060 и Б.П. № 0324-2019-0016.
Список литературы
Zug R., Hammerstein P. Still a host of hosts for Wolbachia: Analysis of recent data suggests that 40% of terrestrial arthropod species are infected // PLoS One. 2012. 7(6): e38544. https://doi.org/https://doi.org/10.1371/journal.pone.0038544
Werren J.H., Baldo L., Clark M.E. Wolbachia: Master manipulators of invertebrate biology // Nat. Rev. Microbiol. 2008. V. 6 (10). P. 741–751. doi https://doi.org/10.1038/nrmicro1969
Weeks A.R., Turelli M., Harcombe W.R. et al. From parasite to mutualist: Rapid evolution of Wolbachia in natural populations of Drosophila // PLoS Biol. 2007. V. 5(5). doi.org/https://doi.org/10.1371/journal.pbio.0050114
Teixeira L., Ferreira A., Ashburner M. The bacterial symbiont Wolbachia induces resistance to RNA viral infections in Drosophila melanogaster // PLoS Biol. 2008. doi.org/https://doi.org/10.1371/journal.pbio.1000002
Ikeya T., Broughton S., Alic N. et al. The endosymbiont Wolbachia increases insulin/IGF-like signalling in Drosophila // Proc. R. Soc. Biol. Sci. 2009. V. 276(1674). P. 3799–3807. doi https://doi.org/10.1098/rspb.2009.0778
Faria V.G., Martins N.E., Magalhães S. et al. Drosophila adaptation to viral infection through defensive symbiont evolution // PLoS Genet. 2016. V. 12(9): e1006297. doi.org/https://doi.org/10.1371/journal.pgen.1006297
Toivonen J.M., Partridge L. Endocrine regulation of aging and reproduction in Drosophila // Mol. Cell. Endocrinol. 2009. V. 299. P. 39–50. doi https://doi.org/10.1016/j.mce.2008.07.005
Li Y., Hoffmann J., Li Y. et al. Octopamine controls starvation resistance, life span and metabolic traits in Drosophila // Sci. Rep. 2016. V. 6: e35359. doi https://doi.org/10.1038/ srep35359
Rauschenbach I.Yu., Adonyeva N.V., Alekseev A.A. et al. Role of arylalkylamine N-acetyltransferase in regulation of biogenic amines levels by gonadotropins in Drosophila // J. Comp. Physiol. B. 2008. V. 178. P. 315–320. doi https://doi.org/10.1007/s00360-007-0224-x
Rohrscheib C.E., Bondy E., Josh P. et al. Wolbachia influences the production of octopamine and affects Drosophila male aggression // Appl. Environ. Microbiol. 2015. V. 81. P. 4573–4580. doi https://doi.org/10.1128/AEM.00573-15
Gruntenko N.E., Chentsova N.A., Andreenkova E.V. et al. The effect of mutations altering biogenic amine metabolism in Drosophila on viability and the response to heat stress // Arch. Insect. Biochem. Physiol. 2004. V. 55. P. 55–67. https://doi.org/https://doi.org/10.1002/arch.10123
O’Neill S.L., Giordano R., Colbert A.M.E. et al. 16S rRNA phylogenetic analysis of the bacterial endosymbionts associated with cytoplasmic incompatibility in insects // Proc. Natl Acad. Sci. USA. 1992. V. 89. P. 2699–2702. https://doi.org/https://doi.org/10.1073/pnas.89.7.2699
Braig H.R., Zhou W., Dobson S.L. et al. Cloning and characterization of a gene encoding the major surface protein of the bacterial endosymbiont Wolbachia pipientis // J. Bacteriol. 1998. V. 180. P. 2373–2378. doi https://doi.org/10.1360/02tb9320
Gruntenko N.E., Ilinsky Y.Y., Adonyeva N.V. et al. Various Wolbachia genotypes differently influence host Drosophila dopamine metabolism and survival under heat stress conditions // BMC Evol. Biol. 2017. V. 17(Suppl. 2). P. 252. doi https://doi.org/10.1186/s12862-017-1104-y
Грунтенко Н.Е., Андреенкова Е.В., Монастириоти М., Раушенбах И.Ю. Биогенные амины негативно регулируют активность синтезирующих их ферментов у имаго Drosophila // Докл. РАН. 2001. Т. 379. С. 567–569.
Дополнительные материалы отсутствуют.


