Генетика, 2019, T. 55, № 6, стр. 728-733
Мейотические хромосомы, синаптонемные комплексы самки живородящей ящерицы (Zootoca vivipara) в профазе I мейоза
Л. А. Куприянова 1, *, Л. Д. Сафронова 2, А. И. Чекунова 3
1 Зоологический институт Российской академии наук
199034 Санкт-Петербург, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Россия
3 Институт биологии развития им. Н.К. Кольцова Российской академии наук
119334 Москва, Россия
* E-mail: larissakup@zin.ru
Поступила в редакцию 15.08.2018
После доработки 26.11.2018
Принята к публикации 11.12.2018
Аннотация
У самок живородящей ящерицы Zootoca vivipara (Lichtenstein, 1823) (семейство Lacertidae) из Северо-Запада России (2n = 35: 32А (акроцентрические аутосомы) + Z1Z2W половые хромосомы) исследованы клетки зародышевых пузырьков в полости яичника – ооциты, а также клетки ламинарной пластинки. Использовали прямой метод получения хромосом и метод тотальных распластанных ядер ооцитов Дрессера и Мозеса. Хромосомные препараты окрашивали красителем Гимза, для визуализации синаптонемных комплексов (СК) тотальные препараты ядер ооцитов окрашивали нитратом серебра и DAPI. Показано, что в ходе оогенеза самки первичные фолликулы входят в ранние стадии профазы I мейоза (стадии от лептотены до диплотены, формируются хромосомы типа “ламповых щеток”). Впервые получены и изучены тотальные препараты распластанных ооцитов. На основе светомикроскопического анализа CК ооцитов и учета их линейных размеров у самки c 2n = 35 представлен СК-кариотип, состоящий из 19 СК-элементов, среди которых выделены 16 СК аутосомных бивалентов. Оставшиеся три СК-элемента, по мнению авторов, могут представлять собой униваленты Z1Z2W половых хромосом или один бивалент WZ1 и униваленты Z2 и В-хромосомы. Как и в СК-кариотипе самцов Z. vivipara, у самки отмечены особенности в морфологии СК-элементов 5–6-й хромосом.
Ранний оогенез и ранние процессы мейоза среди низших позвоночных наиболее полно изучены у рыб и амфибий. Известно, что в яичниках рыб зародышевые пузырьки содержат различные типы клеток, включая примордиальные и первичные фолликулы. Последние, оставаясь в коре (кортексе) зародышевых клеток, вступают в ранние стадии профазы I мейоза (ранняя диплотена). Особенности морфологии их ооцитов, находящихся на ранней профазе I мейоза, детально описаны в литературе [1, 2]. При переходе к диакинезу они увеличиваются в размерах и трансформируются в превителлогенные фолликулы. Развитие превителлогенных ооцитов является наиболее продолжительной стадией в процессе оогенеза рыб и амфибий.
Данные о раннем оогенезе и ранних процессах мейоза рептилий малочисленны. Вместе с тем эти знания очень важны для понимания процессов мейоза и приобретают особое значение для однополых ящериц с партеногенетическим типом мейоза и видов со сложной системой половых хромосом. Нами были исследованы ранние стадии мейоза и СК в сперматогенезе самцов живородящей ящерицы Zootoca vivipara (Lichtenstein, 1823), семейство Lacertidae (Русская форма подвида Z. v. vivipara), у которых описаны множественные половые хромосомы: самец 2n = 36 акроцентрических (A) хромосом, среди них половые (Z1Z1Z2Z2) хромосомы [3]. Самки живородящей ящерицы Z. vivipara из многих популяций Европы также имеют уникальную для семейства систему множественных высоковариабельных половых хромосом (2n = 35: 32А + Z1Z2W). Половые хромосомы такого типа обнаружены у 4–5 видов из примерно 100 кариотипически проанализированных видов этого семейства. Однако только у Z. vivipara установлена высокая межпопуляционная изменчивость по морфологии W-половой хромосомы. Кроме того, особое значение приобретает также тот факт, что интенсивная реорганизация этой W-половой хромосомы сопровождается активным подвидо- и формообразованием – в пределах вида обнаружены 6–7 хромосомных форм и соответствующие им 6–7 гаплогрупп [4–8]. Учитывая вышеперечисленное, все события, связанные с эволюцией, реорганизацией, поведением половых хромосом вида Z. vivipara, представляют чрезвычайный интерес.
Настоящая статья является продолжением работы по изучению этого вида, конкретно по исследованию ранних стадий мейоза у самок живородящей ящерицы Zootoca vivipara (Lichtenstein, 1823), семейство Lacertidae (Русская форма подвида Z. v. vivipara).
Для изучения процесса мейоза и поведения половых хромосом в профазе I мейоза у самок живородящей ящерицы Z. vivipara (Русская форма подвида Z. v. vivipara) авторы исследовали клетки зародышевой полости яичника, клетки ламинарной пластинки и ранние ооциты.
Известно, что синаптонемный комплекс (СК) часто позволяет определить ряд кариологических характеристик вида, в том числе уточнить гомологию хромосом и половые хромосомы. Для визуализации синаптонемного комплекса тотальные препараты ядер ооцитов самки живородящей ящерицы окрашивали нитратом серебра и DAPI. Для сопоставления картин ранних стадий профазы I мейоза в клетках зародышевой полости использовали также клетки ламинарной пластинки и ранние ооциты, окрашенные красителем Гимза.
Для уточнения картин раннего оогенеза вида авторы дополнительно выделили и проанализировали примордиальные и первичные фолликулы [9].
Беременные самки живородящей ящерицы Z. vivipara (Русская форма подвида Z. v. vivipara) были собраны на юге Ленинградской области, в Лужском районе, 70–100 км к югу от Санкт-Петербурга, между пос. Сиверский–Мшинская– Луга, и обработаны 30 мая 2014 г. и 25 мая 2017 г.
У беременных самок из зародышевой полости яичника были выделены клетки или изолированные ооциты.
Для приготовления препаратов мейотических хромосом был использован прямой метод получения хромосомных препаратов из суспензии клеток ламинарной пластинки и ранних ооцитов (0.7–1.2 мм). Суспензию клеток ламинарной пластинки и гонад помещали в 0.9%-ный раствор цитрата натрия на 25 мин и затем фиксировали в смеси Карнуа (3 части 96%-ного метанола и 1 часть ледяной уксусной кислоты). Хромосомные препараты окрашивали по стандартной методике 5 мин 5%-ным красителем Гимза и анализировали под микроскопом (Axioplan Karl Zeiss).
Для микроскопического анализа СК препараты тотальных распластанных ядер ооцитов готовили из клеточной суспензии, полученной из зародышевой полости яичника самки по методу Дрессера и Мозеса [10]. Распластывание (спредирование) ооцитов проводили на капле 0.5%-ного раствора NaCl. Препараты фиксировали 4% параформальдегида и для визуализации СК их окрашивали 50%-ным раствором нитрата серебра, затем просматривали, измеряли и фотографировали под световым микроскопом Leica. Длины СК элементов измеряли с помощью программы Leica Application Suit V3 на цифровых микрофотографиях.
Внутри яичника самки живородящей ящерицы Z. vivipara (Русская форма подвида Z. v. vivipara) обнаружены многочисленные зародышевые пузырьки, которые состояли из множества различных дифференцированных типов клеток, включая примордиальные и первичные фолликулы. В ядрах первичных фолликул, оставшихся в коре зародышевого пузырька, обнаружены ооциты, находящиеся на ранних стадиях мейоза.
На препаратах, полученных из клеток ламинарной пластинки и ранних ооцитов, были найдены клетки, находящиеся также на стадиях профазы I мейоза, чаще пахитены–диплотены и наблюдались структуры типа ранние “ламповые щетки”. На хромосомах, окрашенных красителем Гимза, присутствовали гетерохроматиновые глыбки (рис. 1,а). Они могут быть связаны с прицентромерными и теломерными С-блоками гетерохроматина, которые, как известно [5], локализованы в ауто- и половых хромосомах этой формы подвида. В некоторых клетках были хорошо видны прокрашенные гетерохроматиновые структуры, возможно, также связанные с С-блоками гетерохроматина половых хромосом, конкретно W-хромосомы (рис. 1,б, рис. 3,а, б). Потому что, кроме прицентромерного и теломерного, в половой W-хромосоме Русской формы Z. v. vivipara имеется еще и дополнительный интерстициальный С- блок гетерохроматина [5], а в клетках Z. vivipara, находящихся на стадии пахитены–диплотены, – С-положительно окрашенное гетерохроматиновое “тельце” [11].
Рис. 1.
Клетки самок Русской формы живородящей ящерицы Zootoca v. vivipara (Ленинградская обл., Лужский район). а – клетка ооцита в ранней профазе I мейоза (стадия ранней диплотены) после окрашивания красителем Гимза. Обнаружены хромосомы типа ранних “ламповых щеток”. Стрелки указывают на гетерохроматиновые глыбки; б – метафазная пластинка после окрашивания С-ГЦ специфичным флуорохромом (CMA3). 2n = 35: 32A + Z1Z2W. Стрелка указывают на половую W-хромосому (A/ST, акро/субтелоцентрическая).
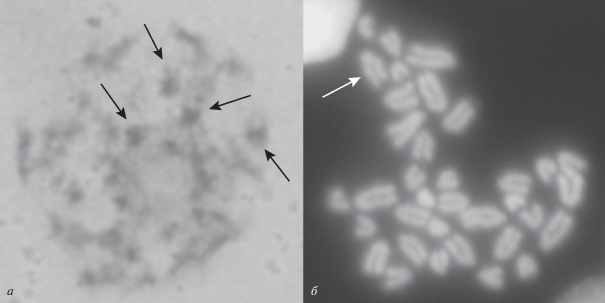
Для СК-кариотипирования самок Z. vivipara (Русская форма подвида Z. v. vivipara) были отобраны распластанные препараты ядер ооцитов на стадии средней пахитены, окрашенные азотнокислым серебром (рис. 2). На основе анализа СК в ооцитах самки было обнаружено 19 СК-элементов. Результаты предшествующих исследований авторов [3] самцов Русской формы подвида Z. v. vivipara подтвердили соответствие морфометрических характеристик относительных длин СК в профазе I мейоза с длиной метафазных хромосом соматических клеток. Поэтому раскладку и нумерацию СК-элементов самки также проводили на основании и в порядке убывания их линейных размеров.
Рис. 2.
Распластанные препараты ядер ооцитов самки Русской формы живородящей ящерицы Zootoca v. vivipara (Ленинградская обл., Лужский район) на стадии средней пахитены. Окраска азотно-кислым серебром. СК-кариотип 16 аутосомных бивалентов и 3 СК-элемента Z1Z2W половых хромосом с общей для Русской формы волнообразной морфологией предполагаемых половых Z1 (5/или 6-й по длине элемент) [2] и W (7-й СК-элемент) хромосом. Имерение длин СК элементов с помощью программы Leica Application Suite V3 (мкм): 1 – 39; 2 – 36; 3 – 33; 4 – 33; 5 – 30; 6 – 28.5; 7 – 28.5; 8 – 27; 9 – 27; 10 – 24; 11 – 21; 12 – 21; 13 – 19.5; 14 – 18; 15 – 16.5; 16 – 16; 17 – 13.5; 18 – 12; 19 – 12.
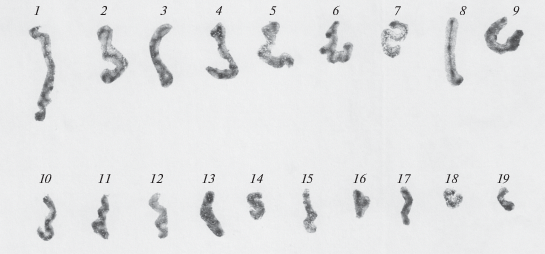
Рис. 3.
Метафазные пластинки клеток самок Русской формы живородящей ящерицы Zootoca v. vivipara (Ленинградская обл., Лужский район). а – С-метод дифференциального окрашивания; б – С-исчерченность гетерохроматина после окрашивания АТ специфичными флуорохромами (DAPI). Стрелки указывают на половую W-хромосому с дополнительным интерстициальным С-блоком гетерохроматина [17].
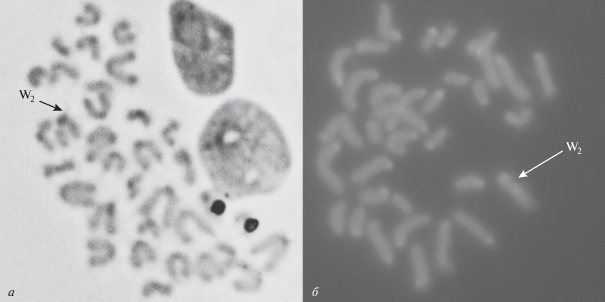
Как отмечалось ранее, самки разных форм Z. v. vivipara имеют в своем кариотипе 2n = 35: 32 акроцентрические аутосомы + 3 половые (Z1Z2W) хромосомы [12–18]. У исследованной Русской формы со сходной структурой кариотипа половая W-хромосома по размеру отнесена к хромосоме 5‑й пары и по морфологии – к акро/субтелоцентрическому (A/ST) типу (рис. 1,б). По цитогенетической структуре она также отличается от остальных хромосом кариотипа из-за присутствия дополнительного интерстициального С-блока гетерохроматина (рис. 3,а, б) [5].
Таким образом, у самки с диплоидным числом, равным 35, и указанной структурой кариотипа (2n = 35: 32 аутосомы + 3 половых Z1Z2W хромосомы) в ходе мейоза на стадии профазы I мейоза можно ожидать формирование 16 аутобивалентов и сложного тривалента половых хромосом или сложного бивалента и унивалента или унивалентов. При формировании СК-кариотипа самки были определены 19 СК-элементов и согласно их линейных размеров, как и у самца, выделены 16 СК-аутобивалентов и еще дополнительно три СК-элемента. Однако не было обнаружено асинаптических конфигураций СК. В связи с этим, принимая во внимание линейные размеры СК, эти три СК-элемента, по мнению авторов, могут представлять собой униваленты Z1Z2W половых хромосом или 1-го СК-бивалента половых W- и Z1-хромосом и унивалента мелкой Z2-хромосомы и В-хромосомы. В-хромосомы описаны в мейозе некоторых видов ящериц [19, 20]. В результате в ходе мейоза у самки живородящей ящерицы может быть сформировано в общей сложности 19 СК-элементов.
При сравнении СК-кариотипов самок с СК-кариотипом самцов Z. vivipara (Русская форма подвида Z. v. vivipara) (2n = 36, СК = 18) [3] отмечена их общая особенность – волнообразная морфология СК-элементов (предположительно половая Z1-хромосома, 5–6-я по длине в митотическом кариотипе).
Известно, что у некоторых саламандр (Amphibia: Caudata, Urodela) половые хромосомы XY на стадии поздней диплотены профазы I мейоза остаются унивалентами и ассоциируют теломерами, имеющими TTAGGG-теломерные повторы ДНК [21]. Ассоциация теломерами двух половых ZW хромосом с TTAGGG-теломерными повторами описана также на стадии ламповых щеток профазы I мейоза шести видов птиц [22]. У ящериц TTAGGG-теломерные повторы ДНК были показаны на многих митотических ауто- и половых W хромосомах партеногенетического вида семейства Lacertidae [23], к которому относится и Z. vivipara. Поэтому имеющиеся для указанных групп позвоночных животных данные относительно молекулярной структуры и поведения половых хромосом в мейозе позволяют предполагать, что в ранней профазе I мейоза половые Z1Z2W хромосомы самки Z. vivipara (Русская форма подвида Z. v. vivipara) могут ассоциировать теломерами между собой.
Новые данные о геноме Z. vivipara [24] также позволяют допустить, что сложное и неоднозначное поведение половых хромосом в мейозе может быть связано не только с их часто встречающейся в ходе эволюции вида реорганизацией, но и с обнаруженными в его геноме транспозонными элементами, которые локализованы на многих хромосомах кариотипа, включая половые.
Полученные результаты демонстрируют, что проблемы мейоза и оогенеза живородящей ящерицы Z. vivipara наряду с проблемами эволюции генома и кариотипа этого вида, интенсивной реорганизации его половых хромосом, сопровождающейся активным подвидо- и формообразованинием, представляют несомненный интерес. В связи с этим исследования авторов были посвящены не только ранним стадиям мейоза и формированию СК, но и детальному анализу раннего оогенеза [9], а также и другим нерешенным вопросам этого модельного вида рептилий.
Авторы выражают благодарность за внимание к работе и ценные советы д. б. н. О.Л. Коломиец, д. б. н. И.Н. Голубовской и к. б. н. В.Е. Спангенбергу.
Работа подготовлена при частичной финансовой поддержке гранта номер АААА-А19-119020590095-9.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Чмилевский Д.А. Оогенез рыб в норме и экстремальных воздействиях. СПб: Изд-во СПб. ун-та, 2017.
Hotta Y., Ito H., Stern H. Synthesis of DNA during meiosis // Proc. Natl Acad. Sci. USA. 1966. V. 66. P. 1184–1191.
Сафронова Л.Д., Куприянова Л.А. Метафазные и мейотические хромосомы, синаптонемные комплексы (СК) живородящей ящерицы Zootoca vivipara // Генетика. 2016. Т. 52. № 11. С. 1311–1317.
Surget-Groba Y., Heulin B., Guillaume C.-P. et al. Intraspecific phylogeography of Lacerta vivipara and the evolution of viviparity // Mol. Phylogen. Evol. 2001. V. 18. P. 449–459.
Kupriyanova L., Mayer W., Böhme W. Karyotype diversity of the Eurasian species Zootoca vivipara (Jacquin, 1787) from Central Europe and the evolution of viviparity // Herpetologia Bonnensis / Eds Vences M., Kűhler J., Ziegler T., Böhme W. Bonn: Koenig Museum, 2006. P. 67–72.
Cornetti L., Menegon M., Giovine G. et al. Mitochondrial and nuclear survey of Zootoca vivipara across the eastern Italian Alps: Evolutionary relationships, historical demography and conservation implications // PLoS One. 2014. V. 9. e85912.
Velekei B., Lakatos F., Biro P. et al. The genetic structure of Zootoca vivipara (Lichtenstein, 1823) populations did not support the existence of a north-south corridor of the VB haplogroup in eastern Hungary // N.-W. J. Zool. 2014. V. 10. № 1. P. 187–189.
Velekei B., Lakatos F. Covacin-Marcov S.-D. et al. New Zootoca vivipara (Lichtenstein, 1823) haplogroup in the Carpatians // N.-W. J. Zool. 2015. V. 11. № 2. P. 336–365.
Куприянова Л.А., Сафронова Л.Д., Цитрина А.А и др. Изучение ооцитов в раннем оогенезе живородящей ящерицы Zootoca vivipara в профазе I мейоза // Онтогенез. 2019 (в печати).
Dresser M., Moses M. Synaptonemal complex karyotyping in spermatocytes of the Chinesehamster (Cricetulus gricus). IV. Light and electron microscopy of synapsis and nucleolar development by silver staining // Chromosoma. 1980. V. 76. P. 1–22.
Capriglione T., Olmo E., Odierna G., Kupriyanova L. Mechanisms of differentiation in the sex chromosomes of some Lacertidae // Amphibia-Reptilia. 1994. V. 15. P. 1–8.
Chevalier M., Dufaure J., Lecher P. Cytogenetic study of several species of Lacerta (Lacertidae, Reptilia) with particular reference to sex chromosomes // Genetica. 1979. V. 50. № 1. P. 11–18.
Belcheva R., Biserkov V., Ilieva H. et al. Karyological studies on Lacerta vivipara (Jacq.) collected in Bulgaria // Cytologia. 1986. V. 51. № 3. P. 567–570.
Куприянова Л., Руди Е. Сравнительно-кариологический анализ популяций живородящей ящерицы (Lacerta vivipara, Lacertidae, Sauria) // Зоол. журн. 1990. Т. 69. Вып. 6. С. 93–101.
Orlova V., Kozlovskii A. Heterochromosomes and Nor-localization in the common lizard, Lacerta vivipara Jacquin, from Russia // Russ. J. Herpetol. 1996. V. 3. P. 191–195.
Odierna G., Aprea G., Capriglione T. et al. Progressive differentiation of the W sex chromosome between oviparous and viviparous populations of Zootoca vivipara (Reptilia, Lacertidae) // Ital. J. Zool. 1998. V. 65. P. 295–302.
Kupriyanova L., Odierna G., Capriglione T. et al. Chromosomal changes and form-formation, subspeciation in the wideranged Europasian species Zootoca vivipara (evolution, biogeography) // Herpetologia Petropolitana / Eds Ananjeva N., Tsinenko O. SPb., 2005. P. 47–52. (Russ. J. Herp. Supl. 12).
Kupriyanova L., Kirschey T., Böhme W. Distribution of the common or viviparous lizard, Zootoca vivipara (Lichtenstein, 1823 (Squamata: Lacertidae)) in central Europe and re-colonization of the Baltic Sea basin: new karyological evidence // Rus. J. Herpetol. 2017. V. 24. № 4. P. 311–317.
Kupriyanova L. B-chromosomes in the karyotype of Lacerta parva Boul. // Genetica. 1984. V. 52–53. P. 223–226.
Kichigin Ihttps://doi.org/., Lisachev A., Giovannotti M. et al. First report on B chromosome content in a reptilian species: the case of Anolis carolinensis // Mol. Genet. Genom. 2018. on linhttps://doi.org/10.1007/s00438-018-1483-9/s00438-018-1483-9.
Sessions S. Evolutionary cytogenetics in salamanders // Chromosome Research. 2008. V. 16. P. 183–201. https://doi.org/10.1007/810577-007-1205-3
Solovei I., Gaginskaya E., Hutchison H., Magregor H. Avian sex chromosomes in the lampbrush chromosomes; the ZW lampbruch bivalents from six species of birds // Chromosome Res. 1993. V. 1. P. 153–166.
Kupriyanova L. Cytogenetic and genetic trends in the evolution of unisexual lizards // Cytogenet. Genome Res. 2010. V. 127. P. 273–279.
Petraccioli A., Guarino F., Kupriyanova L. et al. Isolation and characterization of interspersed repeated sequences in the European common lizard, Zootoca vivipara, and their conservation in Squamata // Cytogenet. Genome Res. 2019. V. 157. № 2.
Дополнительные материалы отсутствуют.


