Генетика, 2019, T. 55, № 7, стр. 819-825
Полиморфизм контрольного района митохондриальной ДНК нативных и инвазивных популяций Harmonia axyridis (Coleoptera, Coccinellidae)
Б. В. Андрианов 1, *, Д. А. Романов 1, Т. В. Горелова 1, И. И. Горячева 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
* E-mail: andrianovb@mail.ru
Поступила в редакцию 22.11.2018
После доработки 10.01.2019
Принята к публикации 22.01.2019
Аннотация
Божья коровка арлекин Harmonia axyridis образует стабильные природные популяции в Восточной Азии и на юге Сибири и распространяющиеся инвазивные популяции в Европе, Африке и в обеих Америках в регионах с умеренным и субтропическим климатом. Охарактеризован полиморфизм контрольного района митохондриального генома в популяционных выборках из популяций нативного ареала и инвазивного ареала в Европе. Подтверждено разделение популяций нативного ареала на восточную и западную группы и близость инвазивной популяции к восточной популяционной группе. Гаплотипическое разнообразие максимально в популяции восточной популяционной группы Harmonia axyridis и снижено в инвазивной популяции. Показана стабильность гаплотипического состава митохондриального генофонда инвазивной популяции Европы в процессе расширения ареала инвазии.
Азиатская божья коровка Harmonia axyridis (Pallas, 1773) – широкоареальный полифаг, обитающий в естественных условиях в Восточной Азии, привлекает особенное внимание исследователей как модельный объект для изучения биоинвазий [1, 2]. Формирование инвазивной популяции H. axyridis, акклиматизировавшейся в Северной Америке, было обнаружено в 1988 г. [3, 4]. Ареал инвазивной популяции последовательно расширялся и захватил ряд регионов в Европе, Африке и Южной Америке [2, 5]. Распространение H. axyridis в Европе происходило от побережья Атлантического океана с запада на восток [1, 5]. На территории России размножение H. axyridis впервые было обнаружено в Калининграде в 2010 г. [6]. В 2013 г. H. axyridis была обнаружена в Крыму и на Северном Кавказе [7, 8].
Существование инвазивных популяций H. axyridis, активно расселяющихся в настоящее время, и предковых, популяций, обитающих в Восточной Азии, позволяет проведение сравнительных популяционно-генетических исследований, направленных на реконструкцию процесса инвазии.
Первое сравнительное исследование митохондриального генофонда нативных и инвазивных популяций H. axyridis было проведено на основе анализа нуклеотидной изменчивости гена cox1 [6]. Различий между составом митохондриальных гаплотипов инвазивной популяции и восточного популяционного кластера нативного ареала обнаружено не было. В западном популяционном кластере нативного ареала были найдены как общие с инвазивной популяцией гаплотипы, так и специфические гаплотипы. На основании полученных данных было высказано предположение о происхождении инвазивной популяции от жуков восточного популяционного кластера. Сходные данные получены при анализе изменчивости митохондриального гена atp6 [9]. Полученные результаты подтвердили генетическое своеобразие западного популяционного кластера H. axyridis. Показана сниженная изменчивость инвазивной популяции по отношению к популяциям восточного популяционного кластера и единство состава митохондриального генофонда на всем ареале инвазивной популяции Европы от побережья Атлантического океана до Черноморского побережья Кавказа. Данные по изменчивости как cox1, так и atp6 содержат слишком мало филогенетически информативных сайтов, чтобы достоверно выявить или отвергнуть генетическое своеобразие митохондриального генома инвазивной популяции. Для решения этого вопроса мы провели сравнительный анализ изменчивости контрольного района митохондриальной ДНК – наиболее полиморфного фрагмента митохондриального генома.
Контрольный район митохондриального генома насекомых расположен между геном 12S rRNA и геном tRNA I и изменчив по длине у разных видов. Причиной вариабельности контрольного района является высокая частота мутаций и небольшая протяженность функциональных доменов. Даже у близкородственных видов насекомых гомология может прослеживаться только на уровне функциональных блоков. У изученных видов жесткокрылых контрольный район обычно содержит один или несколько поли(Т)-блоков, локализованных рядом с последовательностью несовершенного палиндрома, потенциально способного сворачиваться в однонитчатой форме в шпилечную структуру [10–12]. Ориджины репликации J- и N-нитей митохондриального генома жесткокрылых локализованы в контрольном районе митохондриального генома. Показано наличие поли(T)-последовательностей в точке инициации репликации [13].
Быстрая эволюция контрольного района позволяет использовать его как чувствительный филогенетический маркер для анализа внутривидовой изменчивости [14]. Тем не менее у контрольного района имеются особенности структуры, которые затрудняют филогенетический анализ и требуют осторожности в интерпретации его результатов. В отличие от остальной митохондриальной ДНК контрольный район практически всегда содержит прямые тандемные повторы разной протяженности. Изменение размера контрольного района насекомых происходит в основном за счет изменения числа несовершенных тандемных прямых повторов, число которых колеблется от 2 до 53 у разных видов насекомых [15], и из-за дупликаций тРНК-подобных последовательностей [14]. Эволюция повторов в контрольном районе происходит не только путем точечных нуклеотидных замещений, но и по механизмам дупликаций и делеций крупных блоков. Вследствие этих особенностей для филогенетического анализа подходит не весь контрольный район, а только его фрагмент, содержащий функционально нагруженные консервативные блоки и не содержащий повторов [16].
В этой работе проведен сравнительный анализ изменчивости фрагмента контрольного района в выборках из инвазивной популяции Европы и из двух областей нативного ареала H. axyridis в Восточной Азии.
МАТЕРИАЛЫ И МЕТОДЫ
Сборы жуков. Имаго были собраны в ряде локальностей инвазивного ареала H. axyridis в Европе, а также в локальностях нативного ареала на юге Сибири и на Дальнем Востоке. Ареал инвазии был разбит на области в зависимости от времени сбора. Сборы в пределах каждой из зон были суммированы. Сборы, сделанные с 2006 по 2011 г. на территории ряда европейских стран, попали в первую группу, сборы 2013 г., проведенные на Кавказе, – во вторую, сборы 2016 г., проведенные в Крыму, – в третью. Выделение групп выборок отражает последовательность этапов инвазии H. axyridis от Западной Европы до Черноморского побережья Кавказа. Первая группа образована сборами в шести локальностях по шесть случайно отобранных жуков из каждой локальности. Сборы были проведены в Париже (2006), Берлине (2008), Мюнхене (2006), Турине (2006), Праге (2011), Калининграде (2010). Вторая группа образована сборами в четырех локальностях на территории городской агломерации “Большой Сочи” (2013). Третья группа образована сборами в четырех локальностях на территории Крыма (2016). Западный кластер популяций нативного ареала представлен сборами в районе Новосибирска (2014). Восточный кластер популяций нативного ареала представлен сборами на острове Русский (2009). Всего ДНК была выделена из 138 жуков. Перед проведением молекулярно-генетического анализа видовая принадлежность собранных жуков определялась по морфологическим признакам. Для всех собранных экземпляров был определен митохондриальный гаплотип по нуклеотидной последовательности фрагмента контрольного района митохондриального генома.
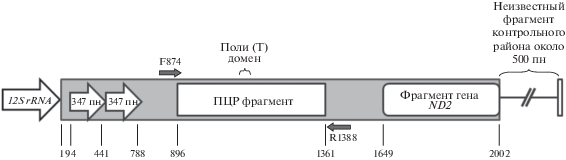
Определение филогенетически информативного фрагмента контрольного района митохондриального генома и подбор праймеров. Контрольный район митохондриального генома – самый вариабельный по длине и нуклеотидной последовательности компонент митохондриального генома насекомых. Наличие прямых и обращенных повторов в структуре контрольного района в ряде случаев создает трудности с получением ПЦР-фрагментов и их прочтением. Такие трудности были выявлены и в контрольном районе митохондриального генома H. axyridis. Авторы, опубликовавшие первый и пока единственный митохондриальный геном H. axyridis, отметили невозможность прочитать примерно 500 пн контрольного района [17]. На рис. 1 представлена структура отсеквенированной области контрольного района и локализация уникальной последовательности в его центральной части, выбранной для филогенетического анализа. Структура отсеквенированного фрагмента контрольного района митохондриального генома H. axyridis имеет уникальные особенности. Необычно наличие фрагмента митохондриального гена ND2 в составе контрольного района. Эта вставка создает в митохондриальном геноме почти совершенный прямой повтор длиной 354 нуклеотида, так как полный ген ND2 присутствует на своем месте. Возможно, эта инсерция не существует, так как отсеквенировать этот необычный фрагмент, используя ПЦР-праймеры, фланкирующие данную инсерцию, нам не удалось. Подбор праймеров проводился в программе Primer 3 [18].
Рис. 1.
Схема расположения структурных блоков контрольного района H. axyridis. Схема составлена на основе анализа митохондриального генома (GenBank ID: KR108208). Последовательность контрольного района выделена серым прямоугольником. Темно-серые стрелки обозначают положение и ориентацию праймеров (5'–3'). Прямые повторы в области, примыкающей к 12S rRNA гену, выделены широкими стрелками. Под рисунком приведены номера нуклеотидов. Нумерация начинается с первого нуклеотида контрольного района.
Выделение ДНК и условия ПЦР. ДНК выделяли из ножек жуков методом фенол-хлороформной экстрации по стандартной методике [19]. ДНК выделялась из конечностей индивидуальных имаго после морфологической идентификации. Выделенная тотальная ДНК была растворена в 50 мкл деионизованной воды. Концентрация ДНК определялась спектрофотометрическим методом с использованием Implen NanoPhotometer NP80 после тестирования чистоты препарата по соотношению поглощения ультрафиолета при 260/280 нм, концентрацию ДНК в препаратах выравнивали до 10 нг/мкл.
Амплификацию фрагмента контрольного района проводили c праймерами F874 5'-CCCCCG-AAACTAAACATTTTCT-3' и R1388 5'-TGGATAAAAAGTGATCTTAAAGGGTAA-3'. Реакцию амплификации проводили в конечном объеме 25 мкл с использованием наборов для амплификации “EncycloPlus PCR kit” в соответствии с инструкцией фирмы-производителя. Праймеры F874 и R1388 амплифицируют вариабельный митохондриальный фрагмент длиной 466 пн, включающий уникальную последовательность в центральной части контрольного района H. axyridis.
Условия ПЦР: первичная денатурация 5 мин при 94°С; 38 циклов с использованием Encyclo-полимеразы: денатурация при 94°С 30 с, отжиг при 60°С 30 с, синтез при 72°С 40 с; завершающий синтез при 72°С 7 мин.
Элюция продуктов амплификации. Фрагменты, полученные в результате амплификации, очищали в 1.5%-ном агарозном геле. Элюция фрагментов из геля проводилась с использованием набора для элюции Zymoclean™ Gel DNA Recovery Kit (Zymo Research, USA) в соответствии с инструкцией фирмы-производителя.
Секвенирование. Нуклеотидную последовательность ПЦР-фрагментов определяли с прямого и обратного праймеров на приборе ABI PRISM 3500 с использованием реагентов BigDye®Terminator v3.1 Cycle Sequencing Kit (Applied Biosystems, США) согласно рекомендациям фирмы-производителя.
Биоинформационный анализ. Анализ хроматограмм проводили с помощью программы ChromasPro 13.3 (Technelysium, Australia). Выравнивание последовательностей, полученных в результате секвенирования, с последовательностями, размещенными в базах данных, было выполнено с использованием ресурсов NCBI (http://www.ncbi.nlm.nih.gov) и программы MEGA 7.0 [20]. Для построения медианной сети гаплотипов использовалась программа PopArt [21] с применением алгоритма TCS [22].
РЕЗУЛЬТАТЫ
Были проанализированы 138 жуков в пяти выборках. Три выборки на территории инвазивного ареала в Европе представляют последовательные этапы инвазии и две выборки – потенциально предковые популяции для инвазивной популяции. При анализе полиморфизма митохондриального фрагмента контрольного района длиной 466 пн мы выявили 19 митохондриальных гаплотипов, из которых только четыре встречаются в инвазивных популяциях (табл. 1). Наибольшее гаплотипическое разнообразие обнаружено в восточном популяционном кластере нативного ареала. В инвазивных популяциях гаплотипическое разнообразие снижено. Особенно существенно снижение гаплотипического разнообразия в крайней восточной выборке на территории черноморского побережья Кавказа. Вместе с тем на территории Кавказа найден уникальный гаплотип (Hap3). Можно предположить, что это результат смешения распространяющейся инвазивной популяции с жуками, происходящими от однолетних биоконтрольных популяций H. axyridis, использовавшихся для борьбы с вредителями на территории Большого Сочи. Среди выявленных гаплотипов гаплотип Hap1 занимает уникальное положение. Он встречается во всех популяциях и по этой причине может рассматриваться как предковый. Кроме того, он самый массовый во всех локальностях инвазивной популяции. Этот факт может отражать как эффект основателя, так и положительное влияние на приспособленность его носителей в условиях инвазивной популяции.
Таблица 1.
Распределение митохондриальных гаплотипов в популяционных выборках H. axyridis
| Место сборов | Выборка | Номер гаплотипа | H | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | |||
| Европа* | 36 | 25 | 9 | 2 | 0.42 | ||||||||||||||||
| Крым* | 26 | 12 | 10 | 4 | 0.62 | ||||||||||||||||
| Кавказ* | 25 | 19 | 4 | 2 | 0.39 | ||||||||||||||||
| Новосибирск | 25 | 3 | 3 | 1 | 1 | 7 | 1 | 9 | 0.72 | ||||||||||||
| Остров Русский | 22 | 1 | 1 | 1 | 4 | 2 | 2 | 2 | 3 | 1 | 1 | 1 | 3 | 0.89 | |||||||
| Ʃ | 134 | ||||||||||||||||||||
Примечание. В таблице указано число жуков с данным гаплотипом. H – гаплотипическое разнообразие, рассчитано по Неи [23] как дополнение до единицы суммы квадратов частот гаплотипов. * Отмечены выборки из инвазивных популяций.
Для реконструкции филогенетических взаимоотношений митохондриальных гаплотипов H. axyridis мы построили медианную сеть (рис. 2). Найденные гаплотипы различаются небольшим числом нуклеотидных замещений. Как и ожидалось, гаплотип Hap1 занимает центральное положение относительно двух ветвей, соответствующих гаплотипам H. axyridis двух природных популяций: Новосибирска и острова Русский. Отсеквенированный ранее вариант контрольного района H. axyridis (GenBank ID: KR108208) группируется с основным гаплотипом Hap1, отличаясь двумя филогенетически не информативными точковыми заменами.
Рис. 2.
Медианная сеть митохондриальных гаплотипов H. axyridis. Построена на основе анализа изменчивости фрагмента контрольного района митохондриального генома H. axyridis длиной 466 пн. Нуклеотидные последовательности зарегистрированы в GenBank с номерами (MK180587–MK180605). Кружками представлены митохондриальные гаплотипы. Размер кружков пропорционален числу жуков с данным гаплотипом во всей выборке. Штрихами обозначены нуклеотидные замены. Гаплотипы, найденные в выборке жуков острова Русский, относящейся к восточной популяционной группе нативных популяций, отмечены белым цветом. Гаплотипы, обнаруженные в выборке жуков Новосибирска, относящейся к западной популяционной группе нативных популяций, выделены черным цветом. Гаплотипы, обнаруженные на территории ареала инвазивной группы популяции, выделены серым цветом. Гаплотипы, обнаруженные в нескольких выборках, представлены круговыми диаграммами. Площадь секторов пропорциональна числу жуков с данным гаплотипом. В качестве контроля приведена последовательность контрольного района из зарегистрированного митохондриального генома H. axyridis (GenBank ID: KR108208).
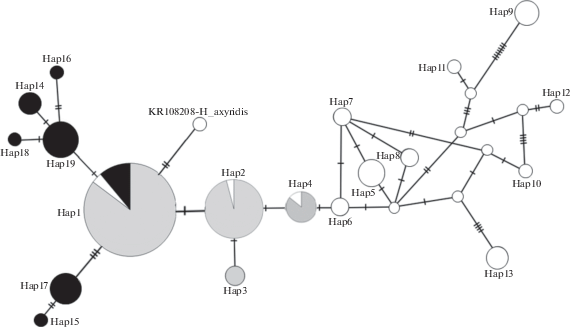
Состав гаплотипов двух нативных популяций отличает значительное своеобразие. Общим гаплотипом у популяций острова Русский и Новосибирска является только один гаплотип Hap1. В сумме его имеют 4 жука из 47 проанализированных жуков природных популяций (9%). Этот низкий уровень сходства указывает на генетическую изоляцию проанализированных популяций.
ОБСУЖДЕНИЕ
Результаты филогенетической реконструкции происхождения инвазивной популяции H. axyridis, проведенные в данной работе на основе анализа митохондриальной изменчивости и на основе анализа изменчивости микросателлитов [24], в основном совпадают. Анализ микросателлитной изменчивости приводит к выводу о происхождении инвазивной популяции от гибридных жуков восточного и западного популяционных кластеров. Центральное положение митохондриальных гаплотипов, встречающихся в инвазивной популяции, относительно двух ветвей, образованных митохондриальными гаплотипами восточного и западного популяционных кластеров, так же допускает происхождение инвазивной популяции от гибридных жуков восточного и западного популяционных кластеров. Следует отметить, что возможно и альтернативное объяснение такой топологии медианной сети. Нельзя исключить происхождения инвазивной популяции только от популяций восточного кластера без участия западного.
Основной гаплотип инвазивной популяции H. axyridis Hap1 занимает центральное положение в медианной сети митохондриальных гаплотипов этого вида. Интересно, что другие гаплотипы, встречающиеся в инвазивной популяции: Hap2, Hap4 и Hap3, близкородственны гаплотипу Hap1, что свидетельствует в пользу возможного адаптивного значения всех гаплотипов этой группы в условиях инвазии. Учитывая высокую скорость эволюции последовательностей контрольного района и небольшое число мутационных событий, разделяющих гаплотипы инвазивной популяции, можно предположить, что они возникли в ходе инвазии от гаплотипа Hap1. Более предпочтительным выглядит предположение о независимом попадании этих гаплотипов в состав плацдармной инвазивной популяции. Во-первых, все они, за исключением редкого гаплотипа Hap3, встречаются в восточной популяционной группе нативного ареала. Во-вторых, гаплотипы Hap2 и Hap4 имеют значительное представительство во всех инвазивных популяциях, что предполагает их дивергенцию от Hap1 на самых ранних этапах инвазии, что мало вероятно. Гаплотип Hap3 мог попасть в генофонд инвазивной популяции H. axyridis на территории Большого Сочи в результате скрещивания между жуками инвазивной популяции и жуками искусственного разведения, так как на сельскохозяйственных предприятиях, расположенных на территории Большого Сочи, H. axyridis искусственного разведения неоднократно использовалась для борьбы с вредителями. Хотя популяции искусственного разведения вымирают в конце летнего сезона, существует возможность гибридизации жуков разного происхождения при обитании на одной территории. Это предположение позволяет обьяснить причину, по которой гаплотип Hap3 не найден нами в выборках из инвазивной популяции H. axyridis Европы и Крыма.
Основываясь на полученных данных, можно предположить происхождение инвазивной популяции от нескольких самок восточной популяционной группы с разными, но близкородственными митохондриальными гаплотипами.
Как экспериментально показано, инвазивная популяция H. axyridis имеет сниженный генетический груз [25, 26] по сравнению с природными популяциями. Если допустить возможность повышенной адаптивности носителей гаплотипа Hap1 и его ближайших производных, то часть наблюдавшегося снижения генетического груза в инвазивных популяциях может быть объяснена влиянием оптимального митохондриального гаплотипа.
Работа выполнена при финансовой поддержке проекта РНФ 16-16-00079.
Авторы заявляют, что у них нет конфликта интересов.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Brown P.M.J., Adriaens T., Bathon H. et al. Harmonia axyridis in Europe: Spread and distribution of a non-native coccinellid // BioControl. 2008. V. 53. P. 5–21. https://doi.org/10.1007/s10526-007-9132-y
Roy H.E., Brown P.M.J., Adriaens T. et al. The harlequin ladybird, Harmonia axyridis: Global perspectives on invasion history and ecology // Biol. Invasions. 2016. V. 18. P. 997–1044. https://doi.org/https://doi.org/10.1007/s10530-016-1077-6
Chapin J.B., Brou V.A. Harmonia axyridis (Pallas), the third species of the genus to be found in the united states (Coleoptera, Coccinellidae) // Proc. Entomol. Soc. Wash. 1991. V. 93. P. 630–635.
Koch R.L., Venetter C., Hutchison W.D. Invasions by Harmonia axyridis (Pallas) (Coleoptera: Coccinellidae) in the Western Hemisphere: implications for South America // Neotropical Entomol. 2006. V. 35. P. 421–434. https://doi.org/10.1590/S1519-566X2006000400001
Brown P.M.J., Thomas C., Lombaert E. et al. The global spread of Harmonia axyridis: Distribution, dispersal and routes of invasion // BioControl. 2011. V. 56. P. 623–641. https://doi.org/10.1007/s10526-011-9379-1
Zakharov I.A., Goryacheva I.I., Suvorov A. Mitochondrial DNA polymorphism in invasive and native populations of Harmonia axyridis // Europ. J. Environment. Sci. 2011. V. 1. P. 15–18. https://doi.org/10.14712/23361964.2015.59
Ukrainsky A.S., Orlova-Bienkowskaja M.Ja. Expansion of Harmonia axyridis Pallas (Coleoptera: Coccinellidae) to European Russia and adjacent regions // Biol. Invasions. 2014. V. 16. I. 5. P. 1003–1008.
Орлова-Беньковская М.Я., Могилевич Т.А. Первая находка Harmonia axyridis (Pallas, 1773) (Coleoptera: Coccinellidae) в Кабардино-Балкарской республике и история расселения этого чужеродного вида по Кавказу и югу Европейской России с 2002 по 2015 год // Кавказ. энтомол. бюл. 2016. Т. 12. С. 93–98.
Андрианов Б.В., Горячева И.И., Романов Д.А., Захаров И.А. Особенности митохондриальной изменчивости нативных и инвазивных популяций Harmonia axyridis (Coleoptera, Coccinellidae) // Генетика. 2018. Т. 54. № 11. С. 1309–1315. https://doi.org/10.1134/ S0016675818110024
Kim M.J., Wan X., Kim I. Complete mitochondrial genome of the seven-spotted lady beetle, Coccinella septempunctata (Coleoptera: Coccinellidae) // Mitochondrial DNA. 2012. V. 23. P. 179–181. https://doi.org/10.3109/ 19401736.2012.668901
Shao L.L., Huang D.Y., Sun X.Y. et al. Complete mitochondrial genome sequence of Cheirotonus jansoni (Coleoptera: Scarabaeidae) // Genet. Mol. Res. 2014. V. 13. P. 1047–1058. https://doi.org/10.4238/2014
Zhang Z., Wang X., Li R. et al. The mitochondrial genome of Dastarcus helophoroides (Coleoptera: Bothrideridae) and related phylogenetic analyses // Gene. 2015. V. 560. P. 15–24. https://doi.org/10.1016/j.gene.2014.12.026
Saito S., Tamura K., Aotsuka T. Replication origin of mitochondrial DNA in Insects // Genetics. 2005. V. 171. P. 1695–1705. https://doi.org/10.1534/genetics.105.046243
Amaral D.T., Mitani Y., Oliveira G. et al. Revisiting Coleoptera A + T-rich region: Structural conservation, phylogenetic and phylogeographic approaches in mitochondrial control region of bioluminescent Elateridae species (Coleoptera) // Mitochondrial DNA. 2016. https://doi.org/10.3109/24701394.2016.1174220
Li T., Yang J., Li Y. et al. A mitochondrial genome of Rhyparochromidae (Hemiptera: Heteroptera) and a comparative analysis of related mitochondrial genomes // Sci. Reports. 2016. V. 6: 35175. https://doi.org/10.1038/srep35175
Mardulyn P., Termonia A., Milinkovitch M.C. Structure and evolution of the mitochondrial control region of leaf beetles (Coleoptera: Chrysomelidae): hierarchical analysis of nucleotide sequence variation // J. Mol. Evol. 2003. V. 56. P. 38–45. https://doi.org/10.1007/s00239-002-2378-1
Niu F.-F., Zhu L., Wang Su., Wei S.-J. The mitochondrial genome of the multicolored Asian lady beetle Harmonia axyridis (Pallas) and a phylogenetic analysis of the Polyphaga (Insecta: Coleoptera) // Mitochondrial DNA. 2015. P. 1–3. https://doi.org/10.3109/19401736.2015.1046165
Untergasser A., Cutcutache I., Koressaar T. et al. Primer3 – new capabilities and interfaces // Nucl. Acids Res. 2012. V. 40. № 15. e115. https://doi.org/10.1093/ nar/gks596
Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир, 1984. 479 с.
Kumar S., Stecher G., Tamura K. MEGA7: Molecular Evolutionary Genetics Analysis version 7.0 for bigger datasets // Mol. Biol. Evol. 2016. V. 33. P. 1870–1874. https://doi.org/https://doi.org/10.1093/molbev/msw054
Leigh J.W., Bryant D. POPART: full-feature software for haplotype network construction // Methods Ecol. Evol. 2015. V. 6. P. 1110–1116. https://doi.org/10.1111/2041-210X.12410
Clement M., Posada D., Crandall K.A. TCS: a computer program to estimate gene genealogies // Mol. Ecol. 2000. V. 9. P. 1657–1659. https://doi.org/10.1046/j.1365-294x.2000.01020.x
Nei M. Molecular Evolutionary Genetics. N.Y.: Columbia University Press, 1987. 512 p.
Lombaert E., Guillemaud T., Thomas C.E. et al. Inferring the origin of populations introduced from a genetically structured native range by approximate Bayesian computation: case study of the invasive ladybird Harmonia axyridis // Mol. Ecol. 2011. V. 20. P. 4654–4670. https://doi.org/10.1111/j.1365-294X.2011.05322.x
Facon B., Hufbauer R.A., Tayeh A. et al. Inbreeding depression is purged in the invasive insect Harmonia axyridis // Curr. Biol. 2011. V. 21. P. 424–427. https://doi.org/10.1016/ j.cub.2011.01.068
Tayeh A., Estoup A., Hufbauer R.A. et al. Investigating the genetic load of an emblematic invasive species: the case of the invasive harlequin ladybird Harmonia axyridis // Ecol. Evol. 2013 V. 3. P. 864–871. https://doi.org/10.1002/ ece3.490
Дополнительные материалы отсутствуют.


