Генетика, 2019, T. 55, № 8, стр. 893-903
Анализ коллекции яровой тритикале по генам устойчивости к листовой ржавчине с помощью ПЦР-маркеров
П. Ю. Крупин 1, 2, *, И. В. Груздев 1, М. Г. Дивашук 1, 2, М. С. Баженов 1, 2, А. А. Кочешкова 2, А. Г. Черноок 1, 2, М. В. Дудников 1, Г. И. Карлов 1, 2, А. А. Соловьев 1, 3
1 Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии
127550 Москва, Россия
2 Центр молекулярной биотехнологии, Российский государственный аграрный университет–
МСХА им. К.А.Тимирязева
127550 Москва, Россия
3 Главный ботанический сад им. Н.В. Цицина Российской академии наук
127276 Москва, Россия
* E-mail: pavel-krupin@yandex.ru
Поступила в редакцию 10.12.2018
После доработки 10.03.2019
Принята к публикации 19.03.2019
Аннотация
Приведены результаты анализа коллекции образцов яровой тритикале на наличие генов устойчивости к возбудителю листовой (бурой) ржавчины пшеницы (Puccinia triticina Erikss.) Lr9, Lr12, Lr19, Lr24, Lr25, Lr28, Lr29, Lr47 на основе полимеразной цепной реакции (ПЦР) с использованием ДНК-маркеров и контрольных образцов изогенных линий пшеницы, несущих искомый ген. Показано отсутствие положительной амплификации у всех изученных образцов яровой тритикале при использовании ДНК-маркеров на гены устойчивости Lr9, Lr24, Lr28, Lr29, Lr47. Показано, что образцы Лена 1270, 25АД20, к-1763, к-3256, Арта 59 несут аллель маркера Xgwm251, совпадающего по размеру с аллелем у изогенной линии Thatcher по гену Lr25. ПЦР-анализ с использованием маркера LrAg показал, что образцы тритикале Памяти Мережко, Ульяна, V20-140, S17, ПРАГ 554/1, C95, 08871, RIL-130 R22-2, 172-1-16, C250, 08857, 09228, 131/17, A2-16-11, POPW9, ПРАГ 500, С260, Арта 116/2, ПРАГ 554, AVS19883, к-1220, ПРАГ 553/1, С254, ПРАГ 518, ПРАГ 418, R-7-5 RIL202, Л2413, Л8-6 несут фрагмент, близкий по размеру к фрагменту, характерному для положительного контроля – изогенной линии сорта Thatcher по гену Lr19. Таким образом, нами установлено, что генетический фонд яровой тритикале крайне обеднен генами устойчивости к листовой ржавчине. Необходимы активные работы по интрогрессии новых генов устойчивости как из известных линий-доноров тритикале, так и из мягкой пшеницы.
Тритикале – зерновая культура, созданная человеком в результате скрещивания пшеницы и ржи с целью объединения в одном организме лучших признаков от родительских видов. Новые сорта переводят эту культуру из разряда перспективной в одну из наиболее востребованных зерновых культур. В 2016 г. мировые посевные площади тритикале составили 4.16 млн га, а мировое производство зерна – 15.2 млн т [1]. Производство зерна тритикале в мире стабильно растет в последние 20 лет, причем 50%-ный рост наблюдался за последнее десятилетие. Тритикале выращивают главным образом в Польше, Германии, Франции, Белоруссии и России как зернофуражную и кормовую укосную культуру [2].
В начале периода промышленного возделывания тритикале болезни существенно не снижали ее урожай. Однако при увеличении площадей посевов и распространении в производстве сортов с ограниченным наборов генов устойчивости в популяции патогена происходит интенсивный отбор в пользу редких или мутантных вирулентных аллелей. Это приводит к возникновению вирулентных рас патогена и преодолению устойчивости растения. Одним из наиболее актуальных заболеваний тритикале является листовая ржавчина пшеницы, вызываемая патогеном Puccinia triticina Erikss. [3]. В полевых условиях на этих двух культурах паразитирует одна и та же популяция патогена [4].
Листовая ржавчина – одно из серьезных заболеваний пшеницы, ущерб от которой может достигать 50% [5]. Защита урожая с использованием фунгицидов повышает стоимость конечной продукции и нагрузку на окружающую среду и, кроме того, эффективна только при своевременном применении. Альтернативным путем является создание генетически устойчивых форм.
Будучи аллополиплоидом, тритикале сочетает в себе гены устойчивости к листовой ржавчине пшеницы и ржи и, следовательно, обладает большим разнообразием ответных и защитных реакций. На сегодняшний день имеются сведения о 75 генах устойчивости к листовой ржавчине [6], из которых гены Lr25, Lr26 и Lr45 были интрогрессированы в пшеницу из генома ржи [7]. Многие Lr-гены к настоящему моменту утратили свою эффективность [8, 9]. В связи с этим в селекции тритикале кроме генетического пула пшеницы и ржи также используются гены близкородственных видов, таких как Triticum monococcum [10], A-egilops tauschii [11].
Исследования показали, что различные сорта и линии тритикале существенно различаются по устойчивости к листовой ржавчине [12–15]. Интрогрессирование и комбинирование эффективных Lr-генов разного видового происхождения и разного механизма устойчивости позволит создать сорта тритикале, обладающие длительной устойчивостью к листовой ржавчине.
Эффективно вести отбор устойчивых форм помогает использование молекулярных ДНК-маркеров на основе полимеразной цепной реакции (ПЦР). Их применение позволяет осуществлять скрининг коллекций сортов и линий на наличие доноров Lr-генов и направленно переносить гены устойчивости в другие сорта, создавать комбинации разных генов устойчивости в пределах одного генотипа, что приведет к сокращению объемов селекционного материала и повышению эффективности селекции [16].
Цель нашей работы заключалась в скрининге коллекции яровой тритикале на наличие генов устойчивости к листовой ржавчине с использованием ПЦР-маркеров. Для анализа были выбраны гены устойчивости к листовой ржавчине, которые в разные годы и разных эколого-географических нишах Российской Федерации сохраняли свою эффективность: Lr9, Lr12, Lr24, Lr28, Lr29, Lr47 [8, 9, 17–21]. Кроме того, для анализа был выбран ген Lr19 как один из наиболее распространенных и по-прежнему эффективных в большинстве условий ген устойчивости [22], а также ген Lr25 ржаного происхождения [23].
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал. В работе изучены 179 образцов яровой тритикале. Коллекция состояла из сортов яровой тритикале, включенных в Государственный реестр селекционных достижений, допущенных к использованию, сортов зарубежной селекции, коллекционных образцов, хранящихся во ФГБНУ “Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова” (ВИР), а также селекционных образцов из коллекции кафедры генетики, биотехнологии, селекции и семеноводства (КГБСиС) РГАУ–МСХА имени К.А. Тимирязева (табл. 1). В качестве контролей были использованы почти изогенные линии пшеницы, несущие гены устойчивости к листовой ржавчине Lr9, Lr12, Lr19, Lr24, Lr25, Lr28, Lr29, Lr47 (любезно предоставлены Всероссийским институтом фитопатологии, Отдел микологии и иммунитета, и ФГБНУ “НЦЗ имени П.П. Лукьяненко”, Отдел селекции и семеноводства пшеницы и тритикале).
Таблица 1.
Образцы коллекции яровой тритикале и их географическое происхождение
| № п.п. | Название | Происхождение | № п.п. | Название | Происхождение | № п.п. | Название | Происхождение |
|---|---|---|---|---|---|---|---|---|
| 1 | Rosner 612 | США | 61 | Мексика 24 | Россия | 121 | C 230 | Россия, КГБСиС |
| 2 | 09017 | Россия, КГБСиС* | 62 | V10286 | Россия, КГБСиС | 122 | 08857 | » |
| 3 | PI 520484 | Россия | 63 | V2-0-140 | » | 123 | к-3256 | Россия |
| 4 | T 327 | Мексика | 64 | Соловей харьковский | Украина | 124 | 9228 | Россия, КГБСиС |
| 5 | 25АД20 | Россия | 65 | V17-5-49 | Россия, КГБСиС | 125 | 131/17 | » |
| 6 | Мексика 13 | » | 66 | 08574 | » | 126 | A2-16-11 | » |
| 7 | C 78 | Россия, КГБСиС | 67 | Sandro | Швейцария | 127 | PI 429151 | Швейцария |
| 8 | Лена 1270 | » | 68 | PI 429162 | » | 128 | PI 422260 | Россия, КГБСиС |
| 9 | Gabo | Польша | 69 | Л 2412 | Россия, КГБСиС | 129 | Мексика 38 | Россия |
| 10 | PI 587531 | Россия | 70 | Гребешок | Россия | 130 | Л 13 | Россия, КГБСиС |
| 11 | C 247 | Россия, КГБСиС | 71 | PI 587548 | » | 131 | R19-1144 | » |
| 12 | V8-2-100 | » | 72 | к-1767 | Белоруссия | 132 | Л 8120 | » |
| 13 | T 328 | Мексика | 73 | ПРАГ 552 | Россия | 133 | 32-2-4 | » |
| 14 | Wanad | Польша | 74 | S 17 | Россия, КГБСиС | 134 | 08880 | » |
| 15 | к-1185 | Мексика | 75 | Grego | Польша | 135 | П13-5-2 | » |
| 16 | Хлебодар украинский | Украина | 76 | ПРАГ 554/1 | Россия | 136 | С 85 | » |
| 17 | T 348 | Мексика | 77 | Л 15 | Россия, КГБСиС | 137 | к-1200 | Испания |
| 18 | Памяти Мережко | Россия | 78 | С 191 | » | 138 | AVS 20675 | Австралия |
| 19 | C 97 | Россия, КГБСиС | 79 | V8-1-101 | » | 139 | к-1715 | Украина |
| 20 | Activo | Швейцария | 80 | PI 429153 | Швейцария | 140 | PI 520445 | Россия |
| 21 | PI 587279 | Россия | 81 | Арта 59 | Россия, КГБСиС | 141 | AVS 20909 | Австралия |
| 22 | 131/7188 | Россия, КГБСиС | 82 | PI 428904 | Россия | 142 | T 328 | Мексика |
| 23 | C 242 | » | 83 | 131/121 | Россия, КГБСиС | 143 | Л 8-4 | Россия, КГБСиС |
| 24 | Presto//Tesmo | Польша | 84 | C 253 | » | 144 | Л 8-6 | » |
| 25 | ПРАГ 553 (20) | Россия | 85 | 093302 | » | 145 | Popw 9 | Польша |
| 26 | Abaco | Швейцария | 86 | 08833 | » | 146 | 8514 | Россия, КГБСиС |
| 27 | Иволга | Россия, КГБСиС | 87 | 32-10-6 | » | 147 | ПРАГ 500 | Россия |
| 28 | Ульяна | Белоруссия | 88 | П13-5-3 | » | 148 | Ярило | » |
| 29 | Л 26 | Россия, КГБСиС | 89 | С 232 | » | 149 | 131/1621 | Россия, КГБСиС |
| 30 | П2-16-20 | » | 90 | R11-1138 | » | 150 | 09305 | » |
| 31 | ПРАГ 551 | Россия | 91 | C 95 | » | 151 | Л 8666 | » |
| 32 | Л 8-3 | Россия, КГБСиС | 92 | R20-5-138 | » | 152 | С 245 | » |
| 33 | к-1716 | Украина | 93 | 08871 | » | 153 | С 260 | » |
| 34 | PI 429031 | Мексика | 94 | Л 1348 | » | 154 | PI 429160 | Швейцария |
| 35 | PI 559373 | США | 95 | 08821 | » | 155 | Арта 116/2 | Россия, КГБСиС |
| 36 | V20-239 | Россия, КГБСиС | 96 | Л 2430 | » | 156 | V17-150 | » |
| 37 | ПРАГ 500/1 | Россия | 97 | ПРАГ 553 (3) | Россия | 157 | Белорусский | Белоруссия |
| 38 | Л 8645 | Россия, КГБСиС | 98 | AVS 20979 | Австралия | 158 | к-1068 | Эфиопия |
| 39 | С 169 | » | 99 | к-1922 | Украина | 159 | ПРАГ 554 | Россия |
| 40 | ПРАГ 553 (5) | Россия | 100 | Л13-5-13 | Россия, КГБСиС | 160 | Кармен | » |
| 41 | ПРАГ 559 (6) | » | 101 | Лана | Белоруссия | 161 | AVS 19883 | Австралия |
| 42 | к-3253 | » | 102 | PI 429251 | Россия | 162 | C 198 | Россия, КГБСиС |
| 43 | 32-16-2 | Россия, КГБСиС | 103 | Л 12 | Россия, КГБСиС | 163 | C 17 | » |
| 44 | AVS 90614 | Австралия | 104 | Л 2471 | » | 164 | к-1220 | Испания |
| 45 | S 1702 | Россия | 105 | Л 8112 | » | 165 | C 224 | Россия, КГБСиС |
| 46 | 131/114 | Россия, КГБСиС | 106 | RIL-130 R22-2 | » | 166 | ПРАГ 553/1 | Россия |
| 47 | T 323 | Мексика | 107 | к-1433 | Эфиопия | 167 | С 254 | Россия, КГБСиС |
| 48 | AVS 19885 | Австралия | 108 | PI 495820 | Россия | 168 | С 236 | » |
| 49 | PI 429157 | Швеция | 109 | к-1752 | Белоруссия | 169 | ПРАГ 518 | Россия |
| 50 | 08221 | Россия, КГБСиС | 110 | к-1763 | » | 170 | 09020 | Россия, КГБСиС |
| 51 | П13-5-1 | » | 111 | 08888 | Россия, КГБСиС | 171 | Л 22 | » |
| 52 | ПРАО-1 | Россия | 112 | 8-35-5 | » | 172 | ПРАГ 418 | Россия |
| 53 | PI 429082 | Польша | 113 | 09306 | » | 173 | 131/7 | Россия, КГБСиС |
| 54 | ПРАГ 553/2 | Россия | 114 | PI 448835 | США | 174 | Мексика 51 | Россия |
| 55 | Мексика 55 | » | 115 | Dubblet | Польша | 175 | Л 24 | Россия, КГБСиС |
| 56 | С 259 | Россия, КГБСиС | 116 | 172-1-16 | Россия, КГБСиС | 176 | 6-35-5 | » |
| 57 | RIL205 R7-2 | » | 117 | 9304 | » | 177 | PI 429158 | Швейцария |
| 58 | Legalo | Польша | 118 | C 250 | » | 178 | Л 2413 | Россия, КГБСиС |
| 59 | Л 8665 | Россия, КГБСиС | 119 | PI 429159 | Швейцария | 179 | R-7-5 RIL202 | » |
| 60 | 9308 | » | 120 | C 188 | Россия, КГБСиС |
Выделение ДНК. Семена проращивали в чашках Петри в течение 3–5 сут при температуре 25°C. ДНК выделяли из проростков длиной 5–10 см по методике с использованием CTAB с модификациями [24]. Проростки измельчали вручную в 450 мкл разогретого до 65°С 2× CTAB-буфера, растворенного в 450 мкл дистиллированной воды. Пробирки с измельченным растительным материалом перемешивали переворачиванием, затем держали на водяной бане при 65°С в течение 1.5–2 ч, периодически перемешивая содержимое покачиванием. К охлажденной до комнатной температуры смеси добавляли хлороформ–изоамил в соотношении 24 : 1, перемешивали переворачиванием в течение 15 мин и фракционировали в центрифуге в течение 15 мин при 12 000 об./мин. Надосадочную жидкость отбирали в чистую пробирку и добавляли эквивалентный объем охлажденного изопропанола, после чего перемешивали и повторно центрифугировали при 12 000 об./мин в течение 15 мин. Жидкость сливали, в пробирку добавляли 100 мкл 70%-ного этанола, центрифугировали при 12 000 об./мин, спирт сливали, пробирку высушивали. Далее в пробирку добавляли 100 мкл дистиллированной воды и хранили в виде раствора при 4°C.
ПЦР-анализ. На основе данных, опубликованных в научной литературе, нами были отобраны наиболее эффективные гены устойчивости к листовой и стеблевой ржавчине, локализованные в хромосомах субгеномов пшеницы A и B, так как объектом исследования служила гексаплоидная тритикале с геномным составом AABBRR, и на которые разработаны эффективные ПЦР-маркеры: SCS5550 на ген Lr9 [25], SSR-маркер Xgwm251 на гены Lr12 [26] и Lr25 [27], LrAg на ген Lr19 [28], S1302609 на ген Lr24 [29], SCS421570 на ген Lr28 [30], OPY10 на ген Lr29 [31], PS10 на ген Lr47 [32]. ПЦР проводили в амплификаторе C1000 Thermal Cycler в пробирках объемом 25 мкл. Каждая ПЦР-смесь объемом 25 мкл содержала 0.5 мкл раствора ДНК с концентрацией 50–300 нг, 0.5 мкл каждого праймера (10 нг/мкл), 200 мкмоль каждого dNTP, 2.5 ммоль MgCl2, 2.5 мкл Taq-буфера и 0.5 U Taq-полимеразы. Использованные молекулярные маркеры и условия амплификации указаны в табл. 2. Аликвоты ПЦР-продуктов, полученных с помощью маркеров SCS5550, LrAg, S1302609, SCS421570, OPY10, PS10, объемом 3.5–10 мкл анализировали путем электрофореза на 1.5%-ном агарозном геле в 0.5× TBE-буфере. Размеры бэндов устанавливали с помощью маркера молекулярного размера Gene Ruler 100bp DNA Ladder и Gene Ruler 1kbp DNA Ladder (Fermentas, Латвия). Размер продуктов амплификации, полученных с использованием SSR (simple sequence repeat) маркера Xgwm251, определяли фрагментным анализом на приборе AB3130xl Genetic Analyzer (Applied Biosystems, США) в соответствии с рекомендациями производителя.
Таблица 2.
Характеристика ПЦР-маркеров на гены устойчивости к листовой ржавчине
| Маркер | Ген | Донор | Последовательность нуклеотидов праймеров | Условия амплификации | Авторы маркера |
|---|---|---|---|---|---|
| SCS5550 | Lr9 | Ae. umbellulata 6BL |
F: 5' TGC GCC CTT CAA AGG AAG 3' R: 5' TGC GCC CTT CTG AAC TGT 3' |
2 мин 95°C, 30 циклов (1 мин 94°C, 1 мин 64°C, 1 мин 72°C) 7 мин 72°C | Gupta et al., 2005 [25] |
| Xgwm251 | Lr12 | T. aestivum | F: 5' CAACTGGTTGCTACACAAGCA 3' R: 5' GGGATGTCTGTTCCATCTTAG 3' |
3 мин 94°C; 45 циклов (1 мин 94°C, 1 мин 55°C, 2 мин, 72°C), 10 мин 72°C | Singh, Bowden, 2011 [26] |
| Lr25 | S. cereale | Singh et al., 2012 [27] | |||
| LrAg | Lr19 | Th. ponticum | f4: 5' CAG CTA CGT GCA TCC CTT TCT T 3' r1: 5' AGC TCC TTG TGA CTG AAA TGA ATG 3' r5: 5' GGA GGT ACC TTT GCC CAC TC A 3' |
15 мин 95°C, 35 циклов (40 с 94°C, 40 с 63.5°C, 40 с 72°C), 5 мин 72°C | Gennaro et al., 2009 [28] |
| S1302609 | Lr24 | Th. ponticum | F: 5' CGC AGG TTC CAA ATA CTT TTC 3' R: 5' CGC AGG TTC TAC CTA ATG CAA 3' |
2 мин 95°C, 35 циклов (1 мин 94°C, 1 мин 60°C, 1 мин 72°C), 7 мин 72°C | Gupta et al., 2006 [29] |
| SCS421570 | Lr28 | Ae. speltoides | F: 5' ACA AGG TAA GTC TCC AAC CA 3' R: 5' AGT CGA CCG AGA TTT TAA CC 3' |
2 мин 95°C, 40 циклов (1 мин 94°C, 1 мин 68°C, 1 мин 72°C), 7 мин 72°C | Cherukuri et al., 2005 [30] |
| OPY10 | Lr29 | Th. ponticum | F: 5' GTG ACC TCA GGC AAT GCA 3' R: 5' GTG ACC TCA GAA CCG ATG 3' |
3 мин 94°C, 35 циклов (30 с 94°C, 30 с 59°C, 1 мин 30 с 72°C) 10 мин 72°C | Tar et al., 2002 [31] |
| PS10 | Lr47 | Ae. speltoides | F: 5' GCT GAT GAC CCT GAC CGG T 3' R: 5' TCT TCA TGC CCG GTC GGG T 3' |
4 мин 95°C, 7 циклов (1 мин 94°C, 1 мин от 70 до 64°C, 1 мин 72°C), 35 циклов (1 мин 94°C, 1 мин 63°C, 1 мин 72°C), 7 мин 72°C | Helguera et al., 2000 [32] |
Определение генов устойчивости методом ПЦР
В работе была проанализирована коллекция яровой тритикале на наличие генов устойчивости к листовой ржавчине (Lr9, Lr12, Lr19, Lr24, Lr25, Lr28, Lr29, Lr47) с использованием ПЦР-маркеров (табл. 2).
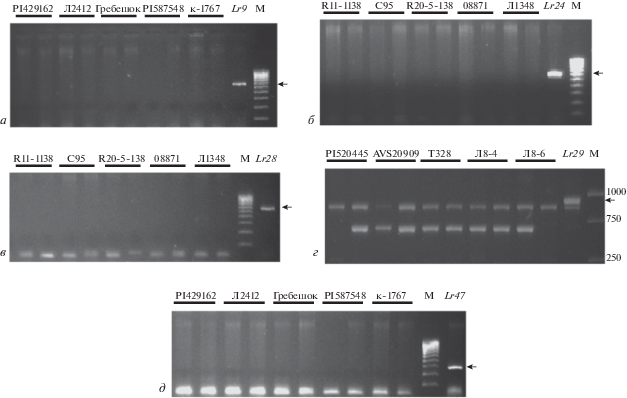
При использовании молекулярных маркеров SCS5550 на ген Lr9 (рис. 1,а), S1302609 на ген Lr24 (рис. 1,б), SCS421570 на ген Lr28 (рис. 1,в), OPY10 на ген Lr29 (рис. 1,г), PS10 на ген Lr47 (рис. 1,д) ни у одного из изучаемых образцов яровой тритикале не был обнаружен целевой фрагмент, показывающий наличие гена устойчивости. Вместе с тем фрагменты ожидаемого размера амплифицировались в каждом случае на соответствующем положительном контроле (изогенные линии Thatcher по генам устойчивости, указаны стрелками), что свидетельствует о корректности работы использованных нами молекулярных маркеров.
Рис. 1.
Пример результатов электрофоретического разделения ампликонов маркеров в 1.5%-ном агарозном геле на гены устойчивости к листовой ржавчине (в скобках указан размер целевого бэнда). а – SCS5550 на ген Lr9 (550 пн); б – S1302609 на ген Lr24 (609 пн); в – SCS421570 на ген Lr28 (570 пн); г – OPY10 на ген Lr29 (950 пн); д – PS10 на ген Lr47 (282 пн). Дорожки Lr9, Lr24, Lr28, Lr29, Lr47 – почти изогенные линии Thatcher с соответствующими генами устойчивости Lr (положительный контроль). М – маркер молекулярных размеров Gene Ruler 100bp DNA Ladder (a, б, в, д) и Gene Ruler 1kbp DNA Ladder (г). Стрелкой указаны целевые фрагменты.
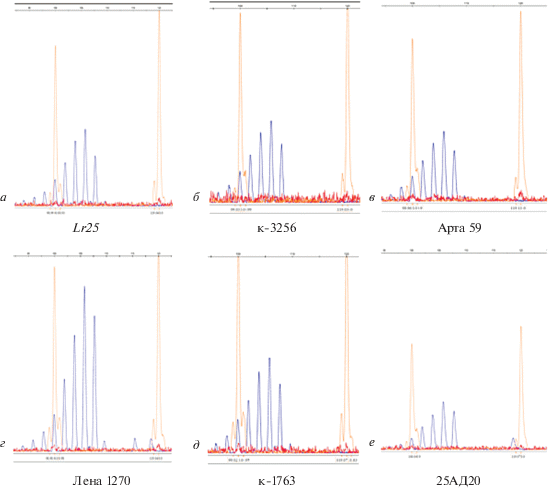
Для определения наличия генов Lr12 и Lr25 нами был использован микросателлитный маркер Xgwm251, по литературным данным сцепленный с этими генами. Продукты амплификации анализировали путем фрагментного анализа, в качестве контроля использовали изогенные линии Thatcher по генам Lr12 и Lr25. В результате проведения фрагментного анализа ни у одного из изучаемых образцов коллекции яровой тритикале не был выявлен амплифицируемый фрагмент, совпадающий по размеру с фрагментом, амплифицируемым на изогенной линии Thatcher Lr12. В пяти образцах (Лена 1270, 25АД20, к-1763, к-3256 и Арта 59) выявлен фрагмент, полностью совпадающий по размеру (108 пн) с фрагментом, амплифицируемым на изогенной линии Thatcher Lr25 (рис. 2).
Рис. 2.
Пример результатов фрагментного анализа с использованием микросателлитного маркера Xgwm251 на наличие гена Lr25. а – положительный контроль, изогенная линия Thatcher по гену Lr25; б–е – образцы яровой тритикале, показавшие фрагменты, совпадающие по размеру с положительным контролем. Желтым цветом обозначен маркер размеров (100 и 120 пн); синим цветом обозначен фрагмент, амплифицируемый при использовании маркера Xgwm251.
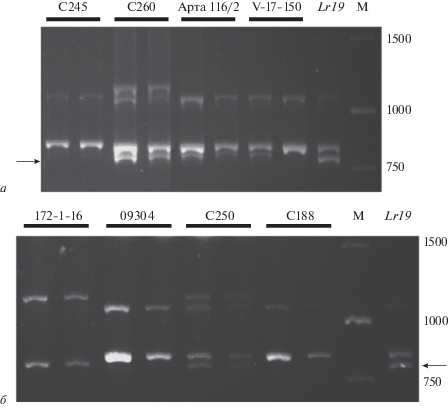
В результате проведенного ПЦР-анализа с использованием молекулярного маркера LrAg [28] установлено, что фрагмент, близкий по размеру к фрагменту 811 пн, характерному для положительного контроля – изогенной линии сорта Thatcher по гену Lr19, – имеют следующие 28 образцов: Памяти Мережко, Ульяна, V20-140, S17, ПРАГ 554/1, C95, 08871, RIL-130 R22-2, 172-1-16, C250, 08857, 09228, 131/17, A2-16-11, POPW9, ПРАГ 500, С260, Арта 116/2, ПРАГ 554, AVS19883, к-1220, ПРАГ 553/1, С254, ПРАГ 518, ПРАГ 418, R-7-5 RIL202, Л2413, Л8-6. Гетерогенность по маркеру LrAg продемонстрировали 14 образцов: ПРАГ 553 (20), S1702, 08221, С259, С191, PI448835, 08880, PI520445, 131/1621, V-17-150, AVS19883, С224, Л22, 131/7. Пример амплификации такого фрагмента представлен на рис. 3,а, целевой фрагмент размером около 811 пн указан стрелкой: образцы С260, Арта 116/2 несут фрагмент, близкий к целевому, в двух исследуемых растениях, образец V-17-150 несет фрагмент, близкий к целевому, в одном из двух исследуемых растений, в образце С245 целевой фрагмент отсутствует; целевой фрагмент виден на контрольном образце (обозначен Lr19). При этом по размеру бэнд, выявляемый у образцов тритикале, обладал несколько большей молекулярной массой, чем у положительного контроля всех перечисленных образцов, за исключением образца C250. Он показал фрагмент, наиболее близкий к контрольному образцу – почти изогенной линии Thatcher по гену Lr19 (показан на рис. 3,б; образец 172-1-16 несет фрагмент, близкий к целевому, у образцов 09304 и С188 искомый бэнд отсутствует).
Рис. 3.
Пример результатов электрофоретического разделения ампликонов маркера LrAg на ген Lr19 в 1.5%-ном агарозном геле. а – С245, С260, Арта 116/2, V-17-150; б – 172-1-16, 09304, С250, С188. Lr19 – изогенная линия Thatcher по гену Lr19 (положительный контроль). М – маркер молекулярных размеров Gene Ruler 1kbp DNA Ladder. Стрелкой указаны целевые фрагменты.
ОБСУЖДЕНИЕ
При интерпретации результатов ПЦР-анализа, проведенного с целью поиска генов устойчивости в коллекции сортов, важно понимать, что не все ПЦР-маркеры разработаны непосредственно на саму последовательность гена устойчивости. Так, среди генов устойчивости к листовой ржавчине известны последовательности генов или их кандидатов для Lr10, Lr19, Lr34 [25, 28, 33]. В большинстве случаев ПЦР-маркеры сцеплены с теми или иными генами и их применение возможно только в том случае, если в качестве донора используется непосредственно тот сорт, на котором был разработан сцепленный с геном ПЦР-маркер.
У проанализированной коллекции яровой тритикале у всех 179 образцов показано отсутствие генов Lr9, Lr24, Lr28, Lr29, Lr47.
Lr12 – ген пшеничного происхождения, локализованный в длинном плече хромосомы 4B [26, 34]. Нами в результате фрагментного анализа не выявлены образцы яровой тритикале, несущие аллель, амплифицируемый у изогенной линии Thatcher по гену Lr12. По всей видимости, образцы с данным геном устойчивости не попадали в селекционную программу ярового тритикале.
Ген Lr25 был передан в мягкую пшеницу линии Transec через транслокацию хромосомы 2R Secale cereale сорта Rosen и располагается в хромосоме 4B [23]. По данным Зубова [18] и Волковой [9], ген сохраняет свою эффективность, однако в работе Моториной [8] были выявлены вирулентные расы. Singh et al. [27] картировали микросателлитный маркер Xgwm251 на участок 4BL-хромосомы пшеницы, сцепленный с геном Lr25 на расстоянии 3.8 cM, используя почти изогенную линию пшеницы сорта Thatcher по гену Lr25. SSR-маркер Xgwm251 предназначен для использования в селекции мягкой пшеницы и выявляет фрагмент хроматина (интрогрессию) от ржи сорта Rosen, несущего ген Lr25, в генетическом окружении пшеницы. Однако существуют другие сорта ржи, обладающие данным микросателлитным аллелем, но не несущим ген Lr25. Поэтому в случае применения маркера Xgwm251 для скрининга коллекции тритикале на наличие гена Lr25 мы можем говорить лишь о вероятном нахождении гена устойчивости Lr25 (или его аналога) в геноме тритикале. В нашем исследовании показано, что образцы Лена 1270, 25АД20, к-1763, к-3256 и Арта 59 несут аллель (108 пн), по размеру совпадающий с аллелем, амплифицирующимся на изогенной линии Thatcher по гену Lr25.
Ген Lr19 был перенесен от Thinopyrum ponticum в хромосомы пшеницы гомеологичной группы 7. Ген Lr19 в течение длительного времени считался одним из самых надежных и получил большое распространение. Однако, по сообщениям Моториной [8] и Зубова [18], выявлены вирулентные расы, соответственно в Белгородской и Самарской областях, преодолевающие эту устойчивость. Gennaro et al. [28] создали кодоминантный STS-маркер LrAg на последовательность гена-кандидата Lr19. Он был выбран для идентификации гена Lr19 в изучаемой коллекции, так как создан непосредственно на последовательность гена-кандидата, а не просто сцеплен с геном или служит маркером на фрагмент интрогрессированного от Thinopyrum ponticum хроматина.
При использовании маркера LrAg на ДНК ржи нами был выявлен ампликон, близкий к целевому, следовательно, данный фрагмент у тритикале может амплифицироваться как с генома ржи, так и быть следствием интрогрессии гена Lr19 в геном тритикале со стороны родительской формы пшеницы, несущей этот ген. Поскольку данный маркер разработан на ген-кандидат устойчивости Lr19, то выявляемый у тритикале фрагмент также может амплифицироваться с гена устойчивости (или его кандидата). Среди образцов, несущих этот маркер, представлены как сорта (Ульяна и Памяти Мережко), так и селекционные линии РГАУ–МСХА им. К.А. Тимирязева. Полученные данные в целом согласуются с результатами изучения полевой устойчивости ряда образцов исследуемой коллекции яровой тритикале [35] и могут быть использованы в поиске новых генов устойчивости к листовой ржавчине ржаного происхождения.
Среди изученных 179 образцов яровой тритикале с помощью набора молекулярных маркеров найдены образцы, потенциально несущие некоторые гены устойчивости к возбудителю бурой ржавчины: Lr19 (42 образца) и Lr25 (5 образцов), и не выявлено ни одного носителя генов Lr9, Lr12, Lr24, Lr28, Lr29, Lr47, которые, по различным источникам, также являются высокоэффективными в создании сортов, устойчивых к бурой листовой ржавчине. Выделенные образцы могут нести гены устойчивости к листовой ржавчине, но только фитопатологические тесты и наблюдения могут показать, можно ли их использовать в селекционном процессе на устойчивость к бурой ржавчине. В исследуемой коллекции присутствуют образцы, обладающие как вертикальной, так и горизонтальной иммунной реакцией в полевых и лабораторных условиях [15, 35].
Несмотря на большое генетическое и фенотипическое разнообразие тритикале, необходимо дополнительно интрогрессировать в геном тритикале гены устойчивости из пшеницы, ржи и их диких сородичей. В первую очередь для переноса генов устойчивости к бурой ржавчине следует использовать T. aestivum, имеющую D-геном, в хромосомах которого могут быть локализованы такие эффективные гены, как Lr24, Lr34, Lr39, Lr43 [36–39]. Кроме того, необходимо использовать гены устойчивости ржи к возбудителю листовой ржавчины Puccinia dispersa Erikss. et Henning (Puccinia recondita Rob. ex Desm. f. sp. secalis) Pr1–Pr5 [40, 41]. Такой перенос хотя и сопряжен с рядом трудностей, позволит обогатить генофонд тритикале, что ввиду ограниченного набора возделываемых сортов (особенно яровой тритикале) [42] позволит в дальнейшем избежать эпифитотий и замедлить процесс расообразования у Puccinia triticina Erikss.
Авторы хотели бы выразить признательность рецензенту, ценные и справедливые замечания которого позволили, на наш взгляд, значительно улучшить качество статьи.
Работа выполнена при поддержке фонда РНФ № 16-16-00097.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
The Food and Agriculture Organization (FAO) of the United Nations. Available at http://faostat.fao.org/
Mergoum M., Singh P.K., Peña R.J. et al. Triticale: A “New” Crop with Old Challenges // Cereals. N.Y.: Springer, 2009. P. 267–287. https://doi.org/10.1007/978-0-387-72297-9_9
Singh R.P., Saari E.E. Biotic stresses in triticale // Proc. 2nd Int. Triticale Symp. Mexico, 1990. P. 171–177.
Михайлова Л.А., Мережко А.Ф., Фунтикова Е.Ю. Разнообразие тритикале по устойчивости к бурой ржавчине // Докл. Рос. акад. с.-х. наук. 2009. № 5. С. 27–29.
Roelfs A.P. Evidence for two populations of wheat stem and leaf rust in the USA // Plant Dis. Reports. 1974. V. 32. P. 806–809.
Singla J., Luthi L., Wicker T. et al. Characterization of Lr75: A partial, broad-spectrum leaf rust resistance gene in wheat // Theor. Appl. Genet. 2017. V. 130. P. 1–12. https://doi.org/10.1007/s00122-016-2784-1
Kolmer J.A. Leaf rust of wheat: Pathogen biology, variation and host resistance. Review // Forests. 2013. V. 4. P. 70–84. https://doi.org/10.3390/f4010070
Моторина И.П. Генетические основы устойчивости к бурой ржавчине форм мягкой пшеницы от отдаленных скрещиваний: Автореф. дис. … канд. биол. наук. Белгород, 2006.
Волкова Г.В. Научно обоснованные принципы создания и использования устойчивых к вредоносным болезням сортов пшеницы для стабилизации фитосанитарного состояния агроценозов на юге России. 2013 // Научн. журн. КубГАУ. 2013. № 91(7). С. 1–22.
Sodkiewicz W., Strzembicka A. Application of Triticum monococcum for the improvement of triticale resistance to leaf rust (Puccinia triticina) // Plant Breeding. 2004. V. 123. P. 39–42. https://doi.org/10.1046/j.1439-0523.2003.00949.x
Kwiatek M., Majka M., Wiśniewska H. et al. Effective transfer of chromosomes carrying leaf rust resistance genes from Aegilops tauschii Coss. into hexaploid triticale (×Triticosecale Witt.) using Ae. tauschii × Secale cereale amphiploid forms // J. Appl. Genet. 2015. V. 56(2). P. 1–6. https://doi.org/10.1007/s13353-014-0264-3
Тырышкин Л.Г., Курбанова П.М., Куркиев К.У. и др. Эффективная ювенильная устойчивость гексаплоидного тритикале к бурой ржавчине // Защита и карантин растений. 2008. № 10. С. 25.
Majka M., Serfling A., Czembor P. et al. Resistance of (Aegilops tauschii × Secale cereale) × Triticosecale hybrids to leaf rust (Puccinia triticina) determined on the macroscopic and microscopic level // Front. Plant Sci. 2018. V. 9. P. 1-13.
Hanzalová A., Bartoš P. Resistance of Triticale to wheat leaf rust (Puccinia triticina) // Czech J. Genet. Plant Breed. 2011. V. 47(1). P. 10–16. https://doi.org/10.17221/100/2010-cjgpb
Сидоров А.В., Тырышкин Л.Г., Соловьев А.А. Ювенильная устойчивость образцов тритикале современной селекции к листовой ржавчине // Вестн. cтуденческого научн. о-ва. 2014. № 1. С. 86–87.
Давоян Э.Р., Беспалова Л.А., Давоян Р.О. и др. Использование молекулярных маркеров в селекции пшеницы на устойчивость к бурой ржавчине в Краснодарском НИИСХ им. П.П. Лукьяненко // Вавилов. журн. генетики и селекции. 2014. Т. 18(4/1). С. 732–738.
Курбанова П.М. Генетическое разнообразие яровой мягкой пшеницы по эффективной возрастной устойчивости к листовой ржавчине: Автореф. дис. … канд. биол. наук. Санкт-Петербург, 2009.
Зубов Д.Е. Селекционная ценность доноров устойчивости яровой мягкой пшеницы к листовой ржавчине в Среднем Поволжье: Автореф. дис. … канд. с.-х. наук. Кинель: Самарская гос. с.-х. акад., 2011.
Плотникова Л.Я., Штубей Т.Ю. Эффективность генов возрастной устойчивости пшеницы к бурой ржавчине Lr22b, Lr34, Lr37 в Западной Сибири и цитофизиологическая основа их действия // Вавилов. журн. генетики и селекции. 2012. Т. 16(1). С. 123–131.
Сочалова Л.П., Лихенко И.Е. Изучение устойчивости пшеницы к листовым патогенам в условиях Западной Сибири // Сиб. вестн. с.-х. науки. 2011. № 1. С. 18–25.
Шаманин В.П., Гультяева Е.И., Шайдаюк Е.Л. и др. Вирулентность гриба Puccinia triticina на сортах и селекционных линиях мягкой пшеницы на опытном поле ОмГАУ в 2013 г. // Вестн. Алтайск. гос. аграр. ун-та. 2014. Т. 6 (116). С. 36–42.
Тырышкин Л.Г. Генетический контроль эффективной ювенильной устойчивости коллекционных образцов пшеницы Triticum aestivum L. к бурой ржавчине // Генетика. 2006. Т. 42. № 3. С. 377–384.
Driscoll C.J., Anderson L.M. Cytogenetic studies of Transec – a wheat-rye translocation line // Can. J. Genet. Cytol. 1967. V. 9. P. 375–380. https://doi.org/10.1139/g67-038
Murray M.G., Thompson W.F. Rapid isolation of high molecular weight plant DNA // Nucl. Acids Res. 1980. V. 8. P. 4321–4325. https://doi.org/10.1093/nar/8.19.4321
Gupta S.K., Charpe A., Koul S. et al. Development and validation of molecular markers linked to an Aegilops umbellulata-derived leaf-rust-resistance gene, Lr9, for marker-assisted selection in bread wheat // Genome. 2005. V. 48. P. 823–830. https://doi.org/10.1139/g05-051
Singh S., Bowden R.L. Molecular mapping of adult-plant race-specific leaf rust resistance gene Lr12 in bread wheat // Mol. Breeding. 2011. V. 28(2). P. 137–142. https://doi.org/10.1007/s11032-010-9467-4
Singh A., Pallavi J.K., Gupta P., Prabhu K.V. Identification of microsatellite markers linked to leaf rust resistance gene Lr25 in wheat // J. Appl. Genet. 2012. V. 53. P. 19–25. https://doi.org/10.1007/s13353-011-0070-0
Gennaro A., Koebner R.M.B., Ceoloni C. A candidate for Lr19, an exotic gene conditioning leaf rust resistance in wheat // Functional and Integrative Genomic. 2009. V. 9. P. 325–334. https://doi.org/10.1007/s10142-009-0115-1
Gupta S.K., Charpe A., Koul S. et al. Development and validation of SCAR markers co-segregating with an Agropyron elongatum derived leaf rust resistance gene Lr24 in wheat // Euphytica. 2006. V. 150(1–2). P. 233–240. https://doi.org/10.1007/s10681-006-9113-8
Cherukuri D.P., Gupta S.K., Charpe A. et al. Molecular mapping of Aegilops speltoides derived leaf rust resistance gene Lr28 in wheat // Euphytica. 2005. V. 143. P. 19–26. https://doi.org/10.1007/s10681-005-1680-6
Tar M., Purnhauser L., Csôsz L. et al. Identification of molecular markers for an efficient leaf rust resistance gene (Lr29) in wheat // Acta Biol. Szegediensis. 2002. V. 46(3–4). P. 133–134.
Helguera M., Khan I.A., Dubcovsky J. Development of PCR markers for wheat leaf rust resistance gene Lr47 // Theor. Appl. Genet. 2000. V. 101. P. 625–631. https://doi.org/10.1007/s001220051524
Dakouri A., McCallum B.D., Walichnowski A.Z., Cloutier S. Fine-mapping of the leaf rust Lr34 locus in Triticum aestivum L. and characterization of large germplasm collections support the ABC transporter as essential for gene function // Theor. Appl. Genet. 2010. V. 121. P. 373–384. https://doi.org/10.1007/s00122-010-1316-7
Singh D., Park R.F., McIntosh R.A. Genetic relationship between the adult plant resistance gene Lr12 and the complementary gene Lr31 for seedling resistance to leaf rust in common wheat // Plant Pathol. 1999. V. 48(5). P. 567–573. https://doi.org/10.1046/j.1365-3059.1999.00391.x
Груздев И.В., Захарова Е.В., Большакова Л.С., Соловьев А.А. Оценка образцов яровой тритикале (×Triticosecale Wittm.) по устойчивости к бурой ржавчине (Puccinia triticina Erikss.) в полевых условиях Московской области // Изв. ТСХА. 2017. № 3. С. 5–18.
Autrique E., Singh R., Tanksley S.D., Sorrells M.E. Molecular markers for fourleaf rust resistance genes introgressed into wheat from wild relatives // Genome. 1995. V. 38. P. 75–83. https://doi.org/10.1139/g95-009
Hussein T., Bowden R.L., Gill B.S., Cox T.S. Chromosome location of leaf rust resistance gene Lr43 from Ae-gilops tauschii in common wheat // Crop Sci. 1997. V. 37(6). P. 1764–1766. https://doi.org/10.2135/cropsci1997.0011183x0037000 60016x
Nelson J.C., Singh R.P., Autrique J.E., Sorrells M.E. Mapping genes conferring and suppressing leaf rust resistance in wheat // Crop Sci. 1997. V. 37. P. 1928–1935. https://doi.org/10.2135/cropsci1997.0011183x0037000 60043x
Raupp W.J., Sukhwinder-Singh G.L., Brown-Guedira G.L., Gill B.S. Cytogenetic and molecular mapping of the leaf rust resistance gene Lr39 in wheat // Theor. Appl. Genet. 2001. V. 102. P. 347–352. https://doi.org/10.1007/s001220051652
Wehling P., Linz A., Hackauf B. et al. Leaf-rust resistance in rye (Secale cereale L.). 1. Genetic analysis and mapping of resistance genes Pr1 and Pr2 // Theor. A-ppl. Genet. 2003. V. 107. P. 432–438. https://doi.org/10.1007/s00122-003-1263-7
Roux S.R., Hackauf B., Linz A. et al. Leaf-rust resistance in rye (Secale cereale L.). 2. Genetic analysis and mapping of resistance genes Pr3, Pr4 and Pr 5 // Theor. Appl. Genet. 2004. V. 110. P. 192–201. https://doi.org/10.1007/s00122-004-1807-5
Государственный реестр селекционных достижений, допущенных к использованию (на 20 февраля 2018 г.). Режим доступа: http://reestr.gossort.com/ reestr/culture/10.
Дополнительные материалы отсутствуют.


