Генетика, 2019, T. 55, № 8, стр. 869-875
Получение клеточной линии клеща Dermacentor marginatus
Н. И. Римиханов 1, Е. Ю. Эпова 2, А. В. Белякова 2, А. А. Лебедева 3, Е. С. Мутных 3, Ю. К. Бирюкова 4, *, М. В. Зылькова 4, А. В. Шибаева 2, Е. В. Трубникова 4, Д. А. Каратаева 5, Р. М. Акбаев 5, Я. Я. Тыньо 5, Б. К. Лайпанов 5
1 Московский государственный университет пищевых производств,
кафедра ветеринарной медицины
125080 Москва, Россия
2 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
119334 Москва, Россия
3 Институт общей генетики имени Н.И. Вавилова Российской академии наук
119991 Москва, Россия
4 Курский государственный университет, научно-исследовательская лаборатория “Генетика”
305000 Курск, Россия
5 Московская государственная академия ветеринарной медицины и биотехнологии им. К.И. Скрябина,
кафедра паразитологии и ветеринарно-санитарной экспертизы
109472 Москва, Россия
* E-mail: biriukova-ula@mail.ru
Поступила в редакцию 30.01.2019
После доработки 11.02.2019
Принята к публикации 26.02.2019
Аннотация
В связи с изменением общей экологической обстановки в России в последние годы резко увеличились потери животноводства от анаплазмоза овец. В связи с этим обострилась проблема получения вакцины против этого заболевания. Перевиваемая культура клеток клеща может служить удобным субстратом для наработки биомассы возбудителя анаплазмоза овец Anaplasma ovis в промышленных условиях с целью ее использования в производстве культурально-клеточной инактивированной вакцины. Путем культивирования гомогената яиц на модифицированной среде Лейбовица L15 получена перевиваемая клеточная линия пастбищного клеща Dermacentor marginatus – основного резервуарного хозяина A. ovis. Линия DM-77 имеет дедифференцированный фенотип: клетки округлые, с крупными ядрами и выраженными ядрышками. К моменту окончания работы линия выдержала восемь пассажей, не проявляя признаков потери скорости роста. При культивировании на среде с содержанием фетальной сыворотки 10% при 32°С время удвоения числа клеток составило 2.8 ± 0.3 сут.
Актуальность работы обусловлена тем, что в связи с изменением климата в последние два года на территории Северо-Кавказского и Южного федеральных округов наблюдается резкое увеличение заболеваемости мелкого рогатого скота анаплазмозом овец [1]. Он представляет собой хроническое заболевание, которое может наносить значительный экономический ущерб из-за снижения продуктивности овец по молоку и мясу. Ранее летальные исходы от анаплазмоза овец в острой фазе встречались в виде исключений, однако в последние годы отмечают неуклонное повышение смертности инфицированных животных, доходящее до 80%. Гибель животных обусловлена анемией и анорексией [2]. Возбудителем болезни является внутриклеточный паразит группы эрлихий Anaplasma ovis (порядок Rickettsiales, семейство Anaplasmataceae), переносчиком которой является пастбищный клещ Dermacentor marginatus [3]. Патологическая картина при анаплазмозе связана с разрушением эритроцитов и нарушением эритропоэза. Степень зараженности эритроцитов, как правило, колеблется в диапазоне 3–40%, но может достигать 80%.
По данным департамента животноводства и племенного дела минсельхоза РФ, в настоящее время поголовье овец в Российской Федерации превышает 24 млн голов. Около 70% поголовья сосредоточено в Северо-Кавказском федеральном округе (свыше 9 млн голов) и Южном федеральном округе (более 6 млн голов). Наиболее крупными субъектами Федерации, в которых сосредоточено поголовье овец, являются Дагестан (более 5 млн голов), Ставропольский край (2.3 млн голов), Республика Калмыкия (2.3 млн голов), Астраханская область (1.4 млн голов), Карачаево-Черкесская республика (1.3 млн голов), Республика Тува (1.2 млн голов), Волгоградская область (0.9 млн голов). В последние годы анаплазмоз крупного рогатого скота зарегистрирован на 27 территориях субъектов Федерации, в частности в Брянской, Смоленской, Калужской, Тверской, Рязанской, Владимирской, Московской, Пензенской, Оренбургской, Ульяновской, Курганской, Новосибирской, Калининградской областях, Республике Башкортостан, Алтайском крае. Анаплазмоз овец регистрируют в Дагестане, Ставропольском и Краснодарском краях, Саратовской, Калужской и Нижегородской областях, Республике Марий Эл. Одной из значимых целей Приоритетного направления развития науки, технологий и техники в Российской Федерации “Науки о жизни” является решение вопросов защиты сельскохозяйственных животных. Развитие технологий производства вакцин – одно из наиболее действенных элементов государственной политики в части повышения конкурентоспособности отечественного животноводства. Дело в том, что само по себе производство вакцин затратно на стадии разработки и испытаний и редко обеспечивает высокую рентабельность производителю. Испытания новых вакцин, как правило, занимают многие годы и даже десятилетия, связаны с риском распространения возбудителя из лабораторий. Однако отдача от применения вакцин в животноводстве огромна, так как вакцинация является единственным действенным методом предотвращения массовых вспышек инфекционных заболеваний, особенно вирусной природы, против которых неэффективны медикаментозные средства лечения.
Промышленный выпуск вакцины для борьбы с анаплазмозом в нашей стране не налажен, хотя имеется публикация, описывающая экспериментальный дизайн такой вакцины [4]. На практике профилактика этого заболевания основана на борьбе с механическими переносчиками возбудителя A. ovis – клещами и кровососущими насекомыми. Учитывая эпизоотическую ситуацию по анаплазмозу крупного рогатого скота в РФ, где заболевание регистрируют в виде отдельных очагов, для его профилактики предлагается разработать отечественную технологию производства инактивированной культуральной вакцины против анаплазмоза овец. Разработка вакцины против анаплазмоза овец является редким примером, когда создание и испытание новой вакцины возможно провести в короткий срок и при невысоких затратах. Это объясняется доказанной высокой защитной и технологической эффективностью ряда ранее разработанных вакцин, основанных на использовании природного антигена – инфицированных паразитом эритроцитов овец [4]. Очевидно, что наличие эффективной отечественной технологии производства вакцины против анаплазмоза на основе культуры клеток резервуарного хозяина A. ovis позволит в короткий срок произвести и испытать новую вакцину, не создавая риска распространения инфекционного агента. Результат испытаний будет регистрироваться в форме прекращения распространения анаплазмоза, риск падежа поголовья при этом полностью отсутствует. Реализация целей такой работы способна внести вклад в повышение конкурентоспособности отечественных производителей ветеринарных вакцин и повышение эффективности отечественного овцеводства.
В связи с изложенным целью работы было создание клеточной линии клеща D. marginatus, которая служила бы в качестве клеточного субстрата A. ovis для наработки биомассы внутриклеточного паразита.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор и определение клещей. Напитавшиеся самки клеща D. marginatus были собраны в Грачевском районе Ставропольского края в мае 2018 г., как описано ранее [5]. Их помещали в стерильные стеклянные пробирки, закрытые ватно-марлевыми пробками, термостатируемые при 28°С, и в течение 2–3 сут ожидали откладки яиц.
Отложенные самками клещей яйца в течение 1–6 ч использовали для получения перевиваемых клеточных культур.
Культуральные среды и добавки к ним. Для получения и поддержания клеточных линий D. marginatus использовали среду Лейбовица L15 (Life Technologies, США), модифицированную согласно Munderloh и Kurtti [6]: в среду L15 добавляли дополнительно глюкозу, органические кислоты, витамины, минеральную добавку и аминокислоты. После стерилизации к 3 объемным частям среды L15 добавляли 1 часть деионизованной воды культурального качества, 10% конечного объема фетальной сыворотки (Hyclone), 5% от конечного объема триптозофосфатного бульона (BD Biosciences, США), 0.1%-ный концентрат бычьего липопротеина с холестерином (MP Biomedical, США), HEPES до 10 мМ и NaHCO3 до 1 мМ; pH доводили до 7.1 с помощью 1 М стерильного раствора NaOH.
Получение клеточной культуры. Поверхность яиц D. marginatus из единичной кладки стерилизовали, промывая их в течение 3 мин в растворе 0.5%-ного гипохлорита натрия, свежеприготовленного на растворе состава: твин-80 – 0.5%, бензалкония хлорид 0.5%, этанол 70%. Затем стерилизующий раствор сливали и промывали яйца 3 раза стерильной деионизованной водой. Воду тщательно удаляли и вносили 200 мкл культуральной среды.
Яйца осторожно гомогенизировали, как описано [7], разрушали в полипропиленовой пробирке с помощью пестика (Kimble Chase, США), стараясь нарушить целостность хориона, но не повредить клетки. Гомогенат переносили в плоскостенную культуральную пробирку Nunclon с площадью рабочей поверхности 5.5 см2 и герметичной пробкой (Thermo Fisher Scientific, США), содержащую 500 мкл среды, 100 мкг/мл пенициллина и 50 мкг/мл стрептомицина (ОАО Борисовский завод медицинских препаратов, Белоруссия). Объем сред доводили до 2 мл и инкубировали пробирку в термостате при 32°C. Смену среды проводили 1–2 раза в неделю или в случае резкого падения рН, наблюдаемого по изменению цвета индикатора фенолового красного.
Исследования морфологии клеток с помощью конфокальной микроскопии. Конфокальные флуоресцентные изображения живых клеток культур D. marginatus получали после окрашивания клеток красителями Dihydrorhodamine 123 (Sigma-Aldrich, США), специфичным к митохондриям, и Hoechst 33342 (Thermo Fisher Scientific, США), специфичным к хроматину ядра. Клетки инкубировали в бессывороточной среде с 1 мкМ Dihydrorhodamine 123 и Hoechst 33342 в течение 1 ч, затем удаляли краситель, трижды промывали фосфатным солевым буфером рН 7.2, инкубировали в течение 3 ч в среде DMEM c 5% телячьей фетальной сывороткой и получали изображения с помощью лазерного сканирующего конфокального микроскопа Leica TCS SPE 5 (Германия), используя лазеры с длиной волны испускания 488 и 405 нм. Регистрация флуоресценции Dihydrorhodamine 123 – Ex488 нм/Em510–570 нм, а Hoechst 33342 – Ex405 нм/Em415–470 нм.
Исследования скорости роста культур. С целью проведения пересева ростовую среду тщательно удаляли с поверхности монослоя, трижды промывая его стерильным фосфатно-солевым раствором. К клеткам добавляли 1 мл 0.25%-ного раствора трипсина-ЭДТА (Life Technologies, США) на плоскостенную пробирку Nunclon, выдерживали в течение 10 мин при 32°C, что приводило к отсоединению клеток от пластиковой подложки. Действие трипсина останавливали, добавляя 2–3 мл свежей модифицированной ростовой среды Лейбовица L15. Клетки, полученные из одной пробирки с площадью рабочей поверхности 5.5 см2, распределяли по трем таким же чистым пробиркам, создавая плотность клеток в момент засева 3.5 × 105 ф. о. е./мл. Засеянные пробирки помещали в термостат при температуре 32°C. Смену среды проводили 1 раз в 3 сут. С 24-го часа после засева и до момента достижения слитности (конфлюэнтности) монослоя проводили подсчет числа клеток в 10 случайно выбранных полях из каждой пробирки с применением фазово-контрастного микроскопа. На основании этих подсчетов определяли число клеток в каждой пробирке на каждые сутки после высева.
Определение кариотипа клеток. В клеточной культуре, находящейся в логарифмической фазе роста (4–5-е сут после пересева), проводили смену среды на свежую, содержащую 12.5 мкМ колхицина (в качестве исходного использовали коммерчески доступный раствор колхицина с концентрацией 0.125 мМ, ООО Биолот, Россия) и инкубировали при 32°C в течение 24 ч. Клетки собирали с подложки путем обработки 0.25%-ным трипсином, как описано выше, осаждали центрифугированием при 300 g в течение 10 мин, суспендировали в 4 мл 75 мМ KCl и инкубировали при 32°C в течение 1 ч. После обработки клетки вновь осаждали центрифугированием при 300 g в течение 10 мин и суспендировали в фиксирующем растворе метанол–уксусная кислота в соотношении 3 : 1. Клетки осаждали центрифугированием, суспендировали в свежем фиксирующем растворе и инкубировали при комнатной температуре в течение 30 мин.
Клетки осаждали центрифугированием в третий раз и суспендировали в 200 мкл свежего фиксирующего раствора, наносили на охлажденные до –20°С предметные стекла и высушивали на воздухе.
Для специфического выявления районов ядрышковых организаторов использовали метод дифференциальной окраски хромосом нитратом серебра, предложенный Howell и Black [8], с некоторыми модификациями [9]. На препарат под каждое покровное стекло наносили 50 мкл бидистиллированной деионизированной воды, 150 мкл 50%-ного раствора нитрата серебра и 100 мкл коллоидного проявляющего раствора (2%-ный раствор желатина в 0.1%-ном растворе муравьиной кислоты) и инкубировали во влажной камере в термостате при температуре 56.7–60°С 40–60 мин. После промывки под струей проточной воды каждый препарат высушивали. Мазки заливали 3.2%-ным красителем Гимза в буфере Соренсона, pH 6.8, и выдерживали в течение 60 мин при 37°C. Микроскопирование препаратов проводили с помощью фазово-контрастного микроскопа Zeiss (увел. окуляра 10, увел. объектива 90) с масляной иммерсией. Подсчет числа хромосом проводили в 100 клетках каждого препарата.
Методы статистического анализа. Для оценки достоверности скорости роста клеточных культур использовали непараметрические методы статистического анализа: расчет медианы признака, интерквартильных интервалов, минимального и максимального значений [10]. При обработке качественных показателей вычисляли: размер выборочной доли в процентах и ошибку выборочной доли. При сравнении двух независимых групп были использованы непараметрический критерий Манна–Уитни и точный критерий Фишера [10]. В случае отклонения нулевой гипотезы и принятии альтернативной (р < 0.05) проводили попарное сравнение групп с использованием непараметрического теста Манна–Уитни, применяя поправку Бонферрони при оценке значения р.
РЕЗУЛЬТАТЫ
Получение и характеристика первичных клеточных культур
В результате высева гомогенатов 12 независимо полученных кладок D. marginatus было получено 44 независимых первичных культуры. При этом было установлено, что для инициации роста на площади рабочей поверхности 5.5 см2 необходимо использовать гомогенат не менее 30 эмбрионов: при меньшей дозе высева рост адгезионной культуры не начинался. Использования СО2-инкубатора не требовалось, так как пробирки имели герметичные пробки. Через 24 ч после первичного высева клетки прикреплялись к поверхности пластика, не образуя агрегатов или скоплений. Большинство клеток в первичных культурах имели округлую форму, крупное активное ядро с большим числом ядрышек и не имели признаков дифференциации. Основная часть эмбриональной ткани D. marginatus не прикреплялась к поверхности пластика и скапливалась на дне пробирок. Однако по ходу инкубации из них мигрировали отдельные клетки, которые занимали место на поверхности подложки. В отличие от первоначально прикрепившихся клеток, клетки, вышедшие из эмбриональной ткани с задержкой в 24–72 ч, имели дифференцированный фенотип. Большинство из них имели веретеновидную форму и небольшое ядро. Такие клетки можно классифицировать как фибробластоподобные. Существенно меньшая доля клеток имела плоскую чешуевидную форму. Эти клетки проявляли склонность к образованию контактов друг с другом и были классифицированы как эпителиальные. Наряду с этими двумя основными типами встречались единичные клетки нетипичной морфологии. Среди них выделялись клетки нейронального типа (с одним длинным выростом) и железистого типа (бокаловидной формы). Аналогичная картина на этой стадии для первичных культур медоносной пчелы Apis mellifera ранее описывалась в работе [11].
Отбор линий, способных к длительному автономному росту
Первичные линии, полученные при высеве гомогенатов эксплантов, достигли конфлюэнтности через 14–17 сут. После этого их снимали с подложки путем обработки 1%-ным трипсином в растворе Версена и пересевали в чистые пробирки Nunclon. Доза засева составляла 1/10 часть от исходного количества. По описанной схеме было проведено четыре пассажа длительностью 7–14 сут каждый. Пересев производили при достижении культурой конфлюэнтности 80–90%. После этого 31 первичная культура из 44 утратила или существенно снизила способность к росту. Оставшиеся 13 культур имели сходную морфологию: состояли из однотипных округлых клеток дедифференцированного фенотипа. Изменение суммарной скорости роста культур представлено на рис. 1.
Рис. 1.
Характеристика скорости роста первичных культур и полученной из них иммортализованной культуры DM-77. На диаграмме показано число пассажей (ось ординат) в зависимости от общего числа дней с момента начала эксперимента (ось абсцисс). Стрелкой отмечен момент, когда было проведено объединение наиболее быстрорастущих адгезионных культур по 3–4 и получено четыре смешанных культуры, которые были проведены через четыре дополнительных пассажа. Хорошо видна гибель большинства первичных культур вследствие исчерпания потенциала клеточного деления при проведении пассажей 2 и 3.
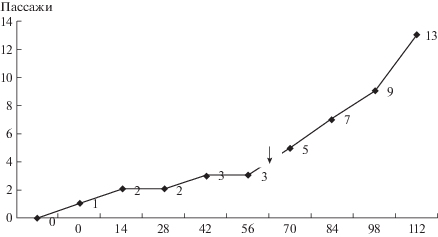
Поскольку оставшиеся культуры показывали тенденцию к замедлению роста при каждом следующем пассаже (рис. 1), было проведено объединение их по 3–4 в равных долях по числу клеток. В результате было получено четыре смешанных культуры, которые были проведены через четыре дополнительных пассажа. В результате была получена одна культура, не показавшая тенденции к замедлению скорости роста (рис. 1). Она получила обозначение DM-77 и была подвергнута детализованному исследованию.
Культуральная и морфологическая характеристика клеточной линии DM-77
Для линии DM-77 была определена максимальная скорость роста, достигавшаяся при разбавлении культуры, полученной после снятия монослоя с конфлюэнтностью 80% с подложки и разбавлении ее свежей средой в 3 раза. При культивировании на среде с содержанием фетальной сыворотки 10% при 32°С время удвоения числа клеток составило 2.8 ± 0.3 сут.
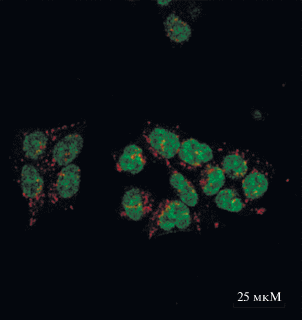
Морфология клеток, находящихся в максимально активной фазе роста, была исследована методом конфокальной микроскопии (рис. 2). Было установлено, что они сохраняют округлую форму и полностью дедифференцированный фенотип с крупным метаболически активным ядром.
Рис. 2.
Исследование морфологии клеточной линии DM-77 методом конфокальной микроскопии. Показана колокализация митохондриального маркера Dihydrorhodamine 123 (Ex488/Em510–570, красный цвет) в живых клетках линии DM-77. Ядра окрашены Hoechst 33342 (Ex405 нм/Em415–470 нм, зеленый цвет). Съемку проводили через 3 ч после инкубации с красителем (1 мкМ, 1 ч).
Для клеток был определен кариотип и митотический индекс [12]. Для этого клетки в течение 40 мин обрабатывали 0.125 мМ колхицином в гипотоническом растворе KCl. При обработке ~4000 клеток было установлено, что клетки, находящиеся в процессе митоза или имевшие хорошо различимые хромосомы, составляли 1.2 ± 0.2%. Все проанализированные клетки имели по 28 хромосом.
ОБСУЖДЕНИЕ
Клеточные линии клещей давно используются для выделения облигатных внутриклеточных бактериальных паразитов, имеющих медицинское и ветеринарное значение [13, 14]. Так, эмбриональная клеточная линия ISE6 из североамериканского клеща Ixodes scapularis обладает высокой пермиссивностью по отношению ко многим внутриклеточным эндосимбионтам. Она была использована для выделения переносимых клещами представителей рода Rickettsia [15–25].
Полученная нами клеточная линия DM-77 обладает высокой скоростью роста, превышающей показатели линии ISE6. Таким образом, в дальнейшем она может быть испытана в качестве субстрата для заражения возбудителем A. ovis и наработки его биомассы, которая затем может использоваться для производства инактивированной культурально-клеточной вакцины.
Работа выполнена при поддержке субсидии министерства науки и высшего образования РФ по Соглашению № 074-11-2018-017 от 29 мая 2018 г.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Логвинов А.Н., Тохов Ю.Г., Луцук С.Н. Обработка пастбищ против иксодовых клещей // Вестн. АПК Ставрополья. 2014. Т. 4. № 16. С. 115–117.
Логвинов А.Н., Михайленко В.В., Луцук С.Н. Морфологические изменения в плаценте овец при анаплазмозе // Вестн. АПК Ставрополья. 2013. Т. 3. № 11. С. 142–145.
Carelli G., Decaro N., Lorusso A. et al. Detection and quantification of Anaplasma marginale DNA in blood samples of cattle by real-time PCR // Vet. Microbiol. 2007. V. 124. № 1–2. P. 107–114. https://doi.org/10.1016/j.vetmic.2007.03.022
Георгиу Х.Г. Разработка способа получения анаплазменного антигена для серологической диагностики анаплазмоза овец // Ветеринария и кормление. 2013. № 6. С. 30–34.
Волцит О.В., Павлинов И.Я. Изменчивость формы гнатосомы взрослых особей трех видов рода Dermacentor (Ixodidae) // Паразитология. 1995. Т. 29. № 4. С. 199.
Munderloh U.G., Kurtti T.J. Formulation of medium for tick cell culture // Exp. Appl. Acarol. 1989. № 7. P. 219–229. https://doi.org/10.1007/BF01194061
Goblirsch M.J., Spivak M.S., Kurtti T.J. A cell line resource derived from honey bee (Apis mellifera) embryonic tissues // PLos One. 2013. V. 8. № 7. e69831. https://doi.org/10.1371/journal.pone.0069831
Howell W.M., Black D.A. A rapid technique for producing silver-stained nucleolus organizer regions and trypsin-giemsa bands on human chromosomes // Hum. Genet. 1978. V. 43. № 1. P. 53–56. https://doi.org/10.1007/BF00396478
Ляпунова Н.А., Еголина Н.А., Вейко Н.Н. и др. Ядрышкообразующие районы (ЯОР) хромосом человека: опыт количественного цитологического и молекулярного анализа // Биологич. мембраны. 2001. Т. 18. № 3. С. 189–199.
Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: МедиаСфера, 2003. 312 с.
Bergem M., Norberg K., Aamodt R.M. Long-term maintenance of in vitro Cultured honeybee (Apis mellifera) embryonic cells // BMC Dev. Biol. 2006. № 6. P. 17. https://doi.org/10.1186/1471-213X-6-17
Brito R.M., Oldroyd B.P. A scientific note on a simple method for karyotyping honey bee (Apis mellifera) eggs // Apidologie. 2010. V. 41. № 2. P. 178–180. https://doi.org/10.1051/apido/2009058
Kurtti T.J., Mattila J.T., Herron M.J. et al. Transgene expression and silencing in a tick cell line: A model system for functional tick genomics // Insect. Biochem. Mol. Biol. 2008. V. 38. № 10. P. 963–968. https://doi.org/10.1016/j.ibmb.2008.07.008
Kurtti T.J., Burkhardt N.Y., Heu C.C. et al. Fluorescent protein expressing Rickettsia buchneri and Rickettsia peacockii for tracking symbiont-tick cell interactions // Vet. Sci. 2016. V. 3. № 4. pii: E34. https://doi.org/10.3390/vetsci3040034
Simser J.A., Palmer A.T., Fingerle V. et al. Rickettsia monacensis sp. nov., a spotted fever group Rickettsia, from ticks (Ixodes ricinus) collected in a European city park // Appl. Environ. Microbiol. 2002. V. 68. № 9. P. 4559–4566. https://doi.org/10.1128/AEM.68.9.4559-4566.2002
Pornwiroon W., Pourciau S.S., Foil L.D. et al. Rickettsia felisfrom cat fleas: Isolation and culture in a tick-derived cell line // Appl. Environ. Microbiol. 2006. V. 72. P. 5589–5595.
Baldridge G.D., Burkhardt N.Y., Labruna M.B. et al. Wide dispersal and possible multiple origins of lowcopy-number plasmids in rickettsia species associated with blood-feeding arthropods // Appl. Environ. Microbiol. 2010. V. 76. P. 1718–1731. https://doi.org/10.1128/AEM.02988-09
Munderloh U.G., Blouin E.F., Kocan K.M. et al. Establishment of the tick (Acari: Ixodidae)-borne cattle pathogen Anaplasma marginale (Rickettsiales: Anaplasmataceae) in tick cell culture // J. Med. Entomol. 1996. V. 33. № 4. P. 656–664.
Munderloh U.G., Madigan J.E., Dumler J.S. et al. Isolation of the equine granulocytic ehrlichiosis agent, Ehrlichia equi, in tick cell culture // J. Clin. Microbiol. 1996. V. 34. P. 664–670.
Woldehiwet Z., Horrocks B.K., Scaife H. et al. Cultivation of an ovine strain of Ehrlichia phagocytophilain tick cell cultures // J. Comp. Pathol. 2002. V. 127. P. 142–149. https://doi.org/10.1053/jcpa.2002.0574
Munderloh U.G., Tate C.M., Lynch M.J. et al. Isolation of an Anaplasma sp. organism from white-tailed deer by tick cell culture // J. Clin. Microbiol. 2003. V. 41. № 9. P. 4328–4335. https://doi.org/10.1128/jcm.41.9.4328-4335.2003
Tate C.M., Howerth E.W., Mead D.G. et al. Anaplasma odocoilei sp. nov. (family Anaplasmataceae) from white-tailed deer (Odocoileus virginianus) // Ticks and Tick-Borne Diseases. 2013. V. 4. P. 110–119.
Munderloh U.G., Silverman D.J., MacNamara K.C. et al. Ixodes ovatus Ehrlichia exhibits unique ultrastructural characteristics in mammalian endothelial and tick-derived cells // Ann. N.Y. Acad. Sci. 2009. V. 1166. P. 112–119. https://doi.org/10.1111/j.1749-6632.2009.04520.x
Varela A.S., Luttrell M.P., Howerth E.W. et al. First culture isolation of Borrelia lonestari, putative agent of southern tick-associated rash illness // J. Clin. Microbiol. 2004. V. 42. P. 1163–1169. https://doi.org/10.1128/jcm.42.3.1163-1169.2004
Munderloh U.G., Yabsley M.J., Murphy S.M. et al. Isolation and establishment of the raccoon Ehrlichia-like agent in tick cell culture // Vector Borne Zoonotic Dis. 2007. V. 7. P. 418–425.
Дополнительные материалы отсутствуют.


