Генетика, 2019, T. 55, № 8, стр. 912-919
Тестирование безопасности продуктов из генетически модифицированного риса: экспериментальное исследование на крысах Спраг-Доули
М. Ширдели 1, 2, Ю. Л. Орлов 3, 4, *, Г. Ислами 1, 5, **, Б. Хаджимохаммади 1, 2, ***, Л. Э. Табиханова 3, М. Х. Ихрампуш 1, М. Э. Резвани 6, Х. Фаллахзаде 7, Х. Занди 1, 8, С. С. Хоссейни 1, С. Ахмадиан 1, 5, Ш. Мортазави 1, Р. Фаллахи 9, С. Л. Асади-Юсефабад 10
1 Научно-исследовательский центр безопасности продуктов питания и гигиены, Школа здравоохранения, Университет медицинских наук им. Шахида Садуги
8916188638 Йезд, Иран
10 Университет медицинских наук им. Шахида Садуги, Студенческий исследовательский комитет
8916188638 Йезд, Иран
2 Университет медицинских наук им. Шахида Садуги, департамент безопасности продуктов питания,
Школа здравоохранения
8916188638 Йезд, Иран
3 Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
4 Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет)
119991 Москва, Россия
5 Университет медицинских наук им. Шахида Садуги, департамент паразитологии и микологии
8916188638 Йезд, Иран
6 Университет медицинских наук им. Шахида Садуги, департамент физиологии,
Школа медицины
8916188638 Йезд, Иран
7 Университет медицинских наук им. Шахида Садуги, департамент биостатистики и эпидемиологии,
Школа здравоохранения
8916188638 Йезд, Иран
8 Университет медицинских наук им. Шахида Садуги, департамент микробиологии,
Медицинский факультет
8916188638 Йезд, Иран
9 Научно-исследовательский институт вакцины и сыворотки Рази, департамент вирусных заболеваний животных, Организация сельскохозяйственного образования и развития
3197619751 Кередж, Иран
* E-mail: orlov_yury@yahoo.com
** E-mail: eslami_g2000@yahoo.com
*** E-mail: b.hajimohammadi@gmail.com
Поступила в редакцию 09.02.2019
После доработки 28.02.2019
Принята к публикации 19.03.2019
Аннотация
Данная работа представляет экспериментальное исследование питания лабораторных животных – крыс линии Спраг-Доули – генетически модифицированным рисом. Нами было оценено присутствие последовательностей ДНК трансгенов CryIA(b), T35 и Р35 в печени этих крыс. 20 самцов и 20 самок крыс получали корм в виде гранул, приготовленных с помощью генетически модифицированного риса, в 50% необходимого состава углеводов в течение 90 дней. Выделение ДНК выполнялось по стандартному протоколу. Качество и количество экстрагированной ДНК определяли электрофорезом в агарозном геле и спектрофотометрией соответственно. Поиск остатков генетически модифицированных генов, включая CryIA(b), P35 и T35, был выполнен с помощью полимеразной цепной реакции с использованием специфических пар праймеров. Результаты анализировали с помощью электрофореза в агарозном геле с градацией ДНК в 50 пн в сравнении с контрольной группой, которую кормили стандартными гранулами немодифицированного риса. Все тесты амплификации были сделаны трижды. Анализ амплификации Р35, CryIA(b) и Т35 не выявил остатков этих генов внутри ткани печени крыс. Результаты не показали существенного различия между контрольной и экспериментальной группами. Таким образом, на рассмотренной модели лабораторных животных настоящее исследование опровергает возможность попадания остаточных фрагментов генов генетически модифицированного риса в ткани печени.
Генная инженерия растений является основой защиты злаков, в том числе риса, от насекомых-вредителей посредством вставки новых генов в зерно. В то же время встают вопросы безопасности продуктов питания из трансгенных растений, связанные с возможным переносом генетического материала. Важно экспериментально проверить наличие или отсутствие каких-либо дополнительных генов растений или их фрагментов в тканях животных после употребления генетически модифицированных (ГМ) продуктов.
Рис – один из основных продуктов питания для большей части населения мира, более чем для 3.5 млрд [1]. Более того, согласно прогнозам уже к 2025 г. рис станет основным продуктом питания для 4.3 млрд человек в мире. Для этого ежегодно будет производиться более 880 млн тонн риса, что намного выше нынешнего мирового производства. Более 53% населения мира, страдающего от голода и бедности, проживает в странах, где преобладает рисоводство, и, следовательно, повышение производства риса в этих районах актуально как никогда [2–4].
Однако рис, как и другие злаки, подвержен сильному повреждению насекомыми [5]. Около 200 видов насекомых повреждают растение риса на протяжении всего его вегетационного периода, к концу которого от 15 до 25% риса оказываются поврежденными [6]. Для сокращения потерь используются различные методы. Одними из самых инновационных являются методы генной инженерии, которые модифицируют геном риса, вводя гены устойчивости к насекомым путем переноса генетического материала от других растений, животных, микроорганизмов или синтетических конструктов [5, 6]. После таких генетических изменений исходные растения проявляют новые свойства, в том числе приобретают повышенную устойчивость к насекомым, что помогает в значительной степени снижать наносимый последними ущерб [7]. Полученные при помощи таких методов растения становятся генетически модифицированными. Возникающие проблемы безопасности генетически модифицированных продуктов вызвали широкое обсуждение в мире [3, 7–9]. В настоящей работе мы рассматриваем пример экспериментального тестирования безопасности питания с точки зрения возможности переноса трансгенов в организм для одного из сортов ГМ-риса.
Bacillus thuringiensis (Bt) – микроорганизм, который естественным образом вырабатывает активный белок против определенных насекомых [10]. B. thuringiensis формирует кристаллы инсектицидных δ-эндотоксинов (кристаллические белки, или Cry-белки), которые кодируются cry-генами. После переноса его генетического материала в геном риса он придает последнему устойчивость к насекомым, в том числе к видам моли Sesamia inferens, Chilo suppressalis, Tryporyza incertulas и Cnaphalocrocis medinalis [11]. Последующие тестирования безопасности ГМ-риса использовали крыс линии Спраг-Доули [11, 12], цыплят и других животных [13].
В целом технология генетической модификации широко применялась с середины 1990-х гг. и привела к повышению экономической эффективности производства риса [14–16], так, к примеру, уже в 2012 г. объем торговли зерном увеличился на 3%. Доля производства ГМ зерновых очень велика. К настоящему времени Китай стал крупнейшим производителем трансгенного риса. В других странах, таких как США, Пакистан, Испания и Индия, такая культура выращивается в тестовых объемах на фермах [1]. В России трансгенные растения используются только как модели для биотехнологических исследований [17, 18], особенно на табаке [19, 20].
Гены Cry бактерии B. thuringiensis были успешно введены в геном риса [21]. Первый устойчивый к насекомым-вредителям рис из Ирана называется Таром Молайи (Tarom Molaii Cry1Ab), он был создан в 1998 г. [22] Иранским институтом сельскохозяйственных исследований [23].
Тем не менее стали появляться исследования, показывающие вероятность сохранения трансгенов в живом организме при потреблении, особенно у человека [3]. Кроме этого, не исключалась возможность появления вероятных рисков при потреблении трансгенных пищевых продуктов, заключающихся в выработке трансгенами неизвестных токсинов, приводящих к аллергии и канцерогенезу [24, 25]. Предполагалось, что такое может произойти после введения этих генов в геном хозяина путем активации молчащих генов, снижения активности генов, при нарушении метаболизма или при выработке новых белковых токсинов у потребителя ГМ-продуктов. Опубликованные данные показывают, что достаточно большие фрагменты ДНК, способные нести целые гены из съеденных продуктов, могут избегать деградации в пищеварительном пути и попадать в систему кровообращения человека [26] через неизвестные механизмы передачи. Такая проблема требует тестирования безопасности питания ГМ-продуктами на лабораторных животных [27, 28], включая модели cry-генов на крысах [29, 30] и обезьянах [31, 32].
Наше исследование базируется на предположении о том, что вредоносность любого съедобного продукта обусловливается, во-первых, способностью его всасывания через кишечник и, во-вторых, наличием метаболитов, целых фрагментов ДНК и белков в печени и других тканях потребителя. В данном исследовании оценивалась возможность сохранения остатков гена CryIA(b) наряду с Р35 и Т35 в печени крыс, получавших иранский генно-модифицированный рис. Как нам известно, это одно из первых исследований такого рода для ГМ-риса.
МАТЕРИАЛЫ И МЕТОДЫ
Настоящая работа представляет собой экспериментальное исследование. Исследуемая популяция, включающая 20 самцов и 20 самок крыс Спраг-Доули, получала при кормлении 50% гранул риса ГМ в составе необходимых углеводов. Контрольную группу из 20 самцов и 20 самок крыс кормили стандартными гранулами того же риса сорта Таром Молайи без модификации. Обе группы животных были отобраны полностью случайно. Возраст крыс был от четырех до пяти недель, вес – около 200 г. Крысы были предоставлены Научно-исследовательским институтом вакцины и сыворотки Рази, Иран. Чтобы уменьшить стрессовое влияние смены среды, всех крыс предварительно держали в лаборатории в течение пяти дней перед экспериментами. Кормление проводилось в течение 90 дней для обеих групп без ограничений (ad libitum). На протяжении всего времени эксперимента влажность и температура поддерживались на уровне 40–60% и 15–22°С. Световой цикл был установлен на 12 ч света и 12 ч темноты. Крыс ежедневно оценивали клинически (изменения шкурки, меха, глаз, функции дыхательной, кровеносной и центральной нервной систем, моторная активность и стандартные паттерны поведения).
Продукты питания изготавливались Научно-исследовательским институтом вакцины и сыворотки Рази. Гранулы готовили двух видов – стандартные и с ГМ-рисом. Последние были изготовлены так, чтобы 50% необходимого углевода составлял ГМ-рис Таром Молайи. Рис сорта Таром Молайи был безвозмездно предоставлен Научно-исследовательским институтом биотехнологии сельского хозяйства Ирана. ГМ-рис Таром Молайи приобрел устойчивость к стеблевому червю при переносе CryIA(b) из B. thuringiensis.
Отбор проб. После 90 дней экспериментального кормления крысам была проведена анестезия кетамин гидрохлоридом. Пробы отбирали из печени. Образцы хранили при –20°С.
Выделение ДНК. Выделение ДНК проводили с использованием набора Exgene Cell SV kit (GeneAll Biotech Korea, # 101-106) по протоколу производителя. Качество и количество экстрагированной ДНК определяли с использованием электрофореза в агарозном геле и спектрофотометрии соответственно.
Обнаружение трансгенных мишеней. Присутствие или отсутствие P35, T35 и CryIA(b) определяли амплификациями с использованием ПЦР с помощью пары специфических праймеров (табл. 1).
Таблица 1.
| Праймер | Последовательность праймера (5' → 3') | Ген-мишень | Длина ПЦР-продукта, пн | Ссылка |
|---|---|---|---|---|
| аCryIA(b)-FI | CGGCCCCGAGTTCACCTT | CryIA(b) | 189 | [33] |
| CryIA(b)-RI | CAACAACATCATCCCAGCAG | |||
| CryIA(b)-FII | CCGCACCCTGAGCAGCAC | CryIA(b) | 420 | [34] |
| CryIA(b)-RII | CCCCTCAGAACAACAACGTGCCACC | |||
| T35-F | CGGGGGATCTGGATTTTAGTA | 35S терминатор | 137 | [35] |
| T35-R | AGGGTTCCTATAGGGTTTCGCTC | |||
| T35S-F | AGGGTTTCTTATATGCTCAACACATG | 35S терминатор | 118 | [35] |
| T35S-R | CACCAGTCTCTCTCTACAAATCTATCAC | |||
| P35-F | GCTCCTACAAATGCCATCA | 35S промотор | 194 | [36] |
| P35-R | GATAGTGGGATTGTGCGTCA | |||
| CryIA(b)-FIII | ACCGGTTACACTCCCATCGA | CryIA(b) | 1400 | [22] |
Программы амплификации выполнены на основе табл. 2. Электрофорез в агарозном геле (1–2%) использовали для анализа амплификации с шагом ДНК 50 пн. Отрицательным контролем служили образцы с бидистиллированной водой вместо ДНК. Положительным контролем был образец с интересующими мишенями. Все тесты амплификации были повторены трижды.
Таблица 2.
Программа амплификации для специфичных праймеров, используемых в исследовании
| Праймер | Денатурация | Отжиг | Элонгация |
|---|---|---|---|
| CryIA(b)I | 30 с при 94°C | 30 c при 62.5°C | 30 с при 72°C |
| CryIA(b)II | » | 30 с при 60°C | » |
| T35 | » | 30 с при 58°C | » |
| T35S | » | 30 с при 59.3°C | » |
| P35 | » | 30 с при 55°C | » |
| CryIA(b)III | » | 30 с при 60.5°C | » |
Табл. 2 показывает время и температуру полимеразной цепной реакции для применяемых специфичных праймеров. Время первого плавления для всех праймеров – 5 мин при 94°C, финальная элонгация – 5 мин при 72°C.
Статистический анализ. Обработку данных проводили с использованием программного обеспечения SPSS (версия 16). Поскольку фрагментов ДНК не было найдено ни в одной из групп, результаты статистических тестов не приведены.
РЕЗУЛЬТАТЫ
Клиническое обследование. На всем протяжении 90-дневного периода исследования не наблюдалось никаких клинических симптомов в группах животных.
Качественный и количественный анализ извлеченной ДНК. В качественно выделенной ДНК наблюдался большой фрагмент ДНК без каких-либо примесей. Количественный анализ соответствовал стандартным значениям.
Обнаружение трансгенных мишеней. Оценка амплификаций всеми парами праймеров, использованными в этом исследовании, не выявила ампликонов по сравнению с положительным контролем (рис. 1). Количественный анализ показал стандартные значения (35 ± 5.6 нг/мкл при очистке 1.7 ± 0.16).
Рис. 1.
Электрофорез в агарозном геле для оценки амплификации CryIA(b)III пар праймеров. 1 – маркер длин 50 bp DNA ladder; 2 – положительный контроль; 3–6 – экспериментальные образцы (пулирование для пяти животных); 7 – отрицательный контроль.
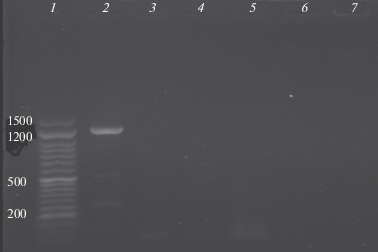
Рис. 1 показывает результаты электрофореза. Использовался метод пулирования образцов (пять животных на одну микротубу, всего четыре микротубы для группы из 20 животных).
ОБСУЖДЕНИЕ
Наше исследование не выявило какого-либо существенного подтверждения сохранности и присутствия трансгенов cryIA(b), P35 и T35 в печени крыс как в контрольной, так и в экспериментальной группе.
В 2003 г. было проведено исследование по изучению возможного присутствия ДНК трансгенных растений в рубце, двенадцатиперстной кишке, молоке, кале и крови дающих молоко коров, вскармливаемых соевой мукой и семенами трансгенной кукурузы [37]. Результаты показали, что трансгены (cp4epsp и cry1a(b)) обнаружены только в рубце и двенадцатиперстной кишке, но не обнаружены ни в одном из образцов крови, что подтвердило результаты исследований, проведенных Einspanier et al. [38]. По мнению Phipps et al. [37] причиной отсутствия компонентов ДНК в образцах кала может стать разрушение ДНК в желудочно-кишечном тракте до очень маленьких фрагментов, что не согласуется с исследованиями Einspanier et al. [38]. На самом деле на обнаружение любой растительной ДНК в кале животных может влиять целый набор факторов, включая форму приема пищи (цельное зерно или переработанный корм), количество реплицированной ДНК, полученной из небольшого числа необнаруженных участков репликации [37].
Nemeth et al. [39] провели ряд исследований на цыплятах-бройлерах, племенном скоте, дойных коровах и свиньях, которых кормили трансгенной кукурузой (MON810). Авторы показали, что ген Rubisco (rbcl) присутствует в мышечных образцах крупного рогатого скота, цыплят-бройлеров и свиней, а также в молоке крупного рогатого скота, но он не был обнаружен в печени экспериментальных животных. Кроме того, они показали, что P35 не был найден ни в одной ткани всех исследованных животных. В нашем исследовании мы подтвердили такие выводы, так как также не нашли никаких остатков P35 в печени крыс.
К настоящему времени уже есть несколько работ, которые показывают быструю деградацию генов и их взаимодействие в пищеварительном тракте животных [37, 39, 40]. В 2014 г. были проведены исследования на трансгенных крысах, которых кормили ген-модифицированной капустой (caMVP35S) [41]. Результаты эксперимента показали наличие фрагментов трансгенов в крови, печени и тканях мозга.
В противоположность вышеупомянутым исследованиям некоторые авторы сообщают, что фрагменты ДНК с генами кукурузы могут быть устойчивыми к полной деградации в пищеварительной системе при употреблении в пищу [40]. Согласно этим исследованиям такой результат указывает на кумулятивный эффект в крови, тканях печени и головного мозга и противоречит результатам Mazza et al. [42].
Результаты нашего исследования показали отсутствие существенных различий в сохранности трансгенов cryIA(b), T35 и P35 в тканях печени контрольной и экспериментальной групп животных. Таким образом, наши результаты опровергают возможность переноса трансгенов в органы потребителя продуктов из ГМ-риса. Авторам известно, что крысы Спраг-Доули возможно не являются лучшей моделью для оценки токсичности продуктов, так как эта линия исходно использовалась для онкологических исследований [9, 43]. Детальный анализ должен опираться на современные технологии – высокопроизводительное секвенирование и биоинформационные подходы для оценки потенциальной опасности трансгенов [44, 45], включая изучение миРНК в трансгенных растениях [46].
Хотя результаты настоящего исследования показали, что трансгены из ГМ-риса Таром Молайи не переносятся в печень потребителя, мы не можем экстраполировать полученные данные на другие пары трансгенных организмов и их потребителей – необходимо проводить дальнейшие эксперименты. Последние работы по естественной генетической гетерогенности [47] показывают, что ряд факторов ведет к неправильной оценке вариабельности, включая определение природного генотипа в отношении трансгенных эффектов. Предложено использовать вариабельность среди существующих сортов риса как критерий для оценки безопасности ГМ-риса [48].
Настоящий эксперимент был проведен в Научно-исследовательском центре безопасности продуктов питания и гигиены, Школа здравоохранения, Университет медицинских наук им. Шахида Садуги, Йезд, Иран. Авторы выражают благодарность этому Университету за поддержку исследования.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Seck P.A., Diagne A., Mohanty S., Wopereis M.C. Crops that feed the world 7: Rice // Food Security. 2012. V. 4. № 1. P. 7–24. https://doi.org/10.1007/s12571-012-0168-1
Choi H., Moon J.-K., Park B.-S. et al. Comparative nutritional analysis for genetically modified rice, Iksan483 and Milyang204, and nontransgenic counterparts // J. Korean Soc. Applied Biol. Chem. 2012. V. 55. P. 19–26. https://doi.org/10.1007/s13765-012-0004-5
Séralini G.-E., Clair E., Mesnage R. et al. RETRACTED: Long term toxicity of a Roundup herbicide and a Roundup-tolerant genetically modified maize // Elsevier. 2012. / Séralini G.E., Clair E., Mesnage R. et al. R-epublished study: long-term toxicity of a Roundup herbicide and a Roundup-tolerant genetically modified maize // Environ. Sci. Eur. 2014. V. 26. P. 14. https://doi.org/10.1186/s12302-014-0014-5
Ezzaher A. Genetically modified foods against hunger in developing countries // J. Food Quality and Hazards Control. 2015. V. 2. № 4. P. 111.
Estruch J.J., Carozzi N.B., Desai N. et al. Transgenic plants: an emerging approach to pest control // Nat. Biotechnol. 1997. V. 15. № 2. P. 137. https://doi.org/10.1038/nbt0297-137
Matteson P.C. Insect pest management in tropical Asian irrigated rice // Annual Rev. Entomol. 2000. V. 45. № 1. P. 549–574.
Alderborn A., Sundström J., Soeria-Atmadja D. et al. Genetically modified plants for non-food or non-feed purposes: straightforward screening for their appearance in food and feed // Food Chem. Toxicol. 2010. V. 48. № 2. P. 453–464. https://doi.org/10.1016/j.fct.2009.10.049
Zhang W., Shi F. Do genetically modified crops affect animal reproduction? A review of the ongoing debate // Animal. 2011. V. 5. № 7. P. 1048–1059. https://doi.org/10.1017/S1751731110002776
Panchin A.Y., Tuzhikov A.I. Published GMO studies find no evidence of harm when corrected for multiple comparisons // Crit. Rev. Biotechnol. 2017. V. 37. № 2. P. 213–217. https://doi.org/10.3109/07388551.2015.1130684
Kumar P.A., Sharma R.P., Malik V.S. The insecticidal proteins of Bacillus thuringiensis // Adv. Appl. Microbiol. 1996. V. 42. P. 1–43.
Song H., He X., Zou S. et al. A 90-day subchronic feeding study of genetically modified rice expressing Cry1Ab protein in Sprague–Dawley rats // Transgenic Res. 2015. V. 24. № 2. P. 295–308. https://doi.org/10.1007/s11248-014-9844-6
Cao S., He X., Xu W. et al. Safety assessment of transgenic Bacillus thuringiensis rice T1c-19 in Sprague–Dawley rats from metabonomics and bacterial profile perspectives // IUBMB Life. 2012. V. 64. № 3. P. 242–250. https://doi.org/10.1002/iub.601
Li Z., Gao Y., Zhang M. et al. Effects of a diet containing genetically modified rice expressing the Cry1Ab/1 Ac protein (Bacillus thuringiensis toxin) on broiler chickens // Arch. Animal Nutrition. 2015. V. 69. № 6. P. 487–498. https://doi.org/10.1080/1745039X.2015.1087749
Brookes G., Barfoot P. Economic impact of GM crops: the global income and production effects 1996–2012 // GM Crops Food. 2014. V. 5. № 1. P. 65–75. https://doi.org/10.4161/gmcr.28098
Brookes G., Barfoot P. Farm income and production impacts of using GM crop technology 1996–2015 // GM Crops Food. 2017. V. 8. № 3. P. 156–193. https://doi.org/10.1080/21645698.2017.1317919
Bhullar N.K., Gruissem W. Nutritional enhancement of rice for human health: the contribution of biotechnology // Biotechnol. Advances. 2013. V. 31. № 1. P. 50–57. https://doi.org/10.1016/j.biotechadv.2012.02.001
Маренкова Т.В., Дейнеко Е.В. Гибридологический анализ наследования мозаичного характера экспрессии nptII-гена у трансгенных растений табака // Генетика. 2016. Т. 52. № 6. С. 641–649. https://doi.org/10.7868/S0016675816060084
Маренкова Т.В., Дейнеко Е.В. Трансгенные растения как модели для изучения эпигенетической регуляции экспрессии генов // Вавиловский журн. генетики и селекции. 2015. Т. 19. № 5. С. 545–551. https://doi.org/10.18699/VJ15.071
Трифонова Е.А., Савельева А.В., Романова А.В. и др. Трансгенная экспрессия нативной и мутантной нуклеазы Serratia marcescens модулирует устойчивость табака Nicotiana tabacum L. к вирусу табачной мозаики // Генетика. 2015. Т. 51. № 7. P. 835–840. https://doi.org/10.1134/S1022795415070133
Жирнов И.В., Трифонова Е.А., Романова А.В. и др. Индуцированная экспрессия гена рибонуклеазы III Serratia marcescens в трансгенных растениях табака Nicotiana tabacum L. cv. SR1 // Генетика. 2016. Т. 52. № 11. С. 1256–1261. https://doi.org/10.7868/S0016675816110175
Fujimoto H., Itoh K., Yamamoto M. et al. Insect resistant rice generated by introduction of a modified delta-endotoxin gene of Bacillus thuringiensis // Biotechnology (N.Y.). 1993. V. 11. № 10. P. 1151–1155.
Ghareyazie B., Alinia F., Menguito C.A. et al. Enhanced resistance to two stem borers in an aromatic rice containing a synthetic cryIA(b) gene // Mol. Breeding. 1997. V. 3. № 5. P. 401–414. https://doi.org/10.1023/A:1009695324100
International Service for the Acquisition of Agri-biotech Applications (ISAAA). http://www.isaaa.org/ gmapprovaldatabase/event/default.asp?EventID=221. (Access date 08/02/2019).
Yavari B., Sarami S., Shahgaldi S. et al. If there is really a notable concern about allergenicity of genetically modified foods? // J. Food Quality and Hazards Control. 2016. V. 3. № 1. P. 3–9.
Wang Y., Wei B., Tian Y. et al. Evaluation of the potential effect of transgenic rice expressing Cry1Ab on the hematology and enzyme activity in organs of female Swiss rats // PLoS One. 2013. V. 8. № 11. P. e80424.
Spisák S., Solymosi N., Ittzés P. et al. Complete genes may pass from food to human blood // PLoS One. 2013. V. 8. № 7. P. e69805. https://doi.org/10.1371/journal.pone.0069805
EFSA GMO Panel Working Group on Animal Feeding Trials. Safety and nutritional assessment of GM plants and derived food and feed: the role of animal feeding trials // Food Chem Toxicol. 2008. V. 46. № Suppl. 1. P. S2–S70. https://doi.org/10.1016/j.fct.2008.02.008
Zou S., Huang K., Xu W. et al. Safety assessment of lepidopteran insect-protected transgenic rice with cry2A* gene // Transgenic Res. 2016. V. 25(2). P. 163–172.
Schrøder M., Poulsen M., Wilcks A. et al. A 90-day safety study of genetically modified rice expressing Cry1Ab protein (Bacillus thuringiensis toxin) in Wistar rats // Food Chem. Toxicol. 2007. V. 45. № 3. P. 339–349. https://doi.org/10.1016/j.fct.2006.09.001
Hammond B., Dudek R., Lemen J., Nemeth M. Results of a 90-day safety assurance study with rats fed grain from corn borer-protected corn // Food Chem. Toxicol. 2006. V. 44. № 7. P. 1092–1099. https://doi.org/10.1016/j.fct.2006.01.003
Tan X., Zhou X., Tang Y. et al. Immunotoxicological evaluation of genetically modified rice expressing Cry1Ab/Ac protein (TT51-1) by a 6-month feeding study on cynomolgus monkeys // PLoS One. 2016. V. 11. № 9. P. e0163879. https://doi.org/10.1371/journal.pone.0163879
Mao J., Sun X., Cheng J.H. et al. A 52-week safety study in cynomolgus macaques for genetically modified rice expressing Cry1Ab/1Ac protein // Food Chem. Toxicol. 2016. V. 95. P. 1–11. https://doi.org/10.1016/j.fct.2016.06.015
Opara C.N., Elijah A.I., Adamu L.G., Uzochukwu S.V. Screening for genetically modified maize in raw and processed foods sold commercially in Southern Nigeria boarder states // Applied Food Biotechnol. 2016. V. 3. № 3. P. 150–158.
Zaulet M., Rusu L., Kevorkian S. et al. Detection and quantification of GMO and sequencing of the DNA amplified products // Romanian Biotechnol. Letters. 2009. V. 14. № 5. P. 4733–4746.
Debode F., Janssen E., Berben G. Development of 10 new screening PCR assays for GMO detection targeting promoters (pFMV, pNOS, pSSuAra, pTA29, pUbi, pRice actin) and terminators (t35S, tE9, tOCS, tg7) // Eur. Food Res. Technol. 2013. V. 236. № 4. P. 659–669. https://doi.org/10.1007/s00217-013-1921-1
International Organization for Standardization. Foodstuffs: Methods of Analysis for the Detection of Genetically Modified Organisms and Derived Products: Qualitative Nucleic Acid Based Methods, Amendment 1: (ISO 21569:2005/Amd1:2013). 2013.
Phipps R., Deaville E.R., Maddison B.C. Detection of transgenic and endogenous plant DNA in rumen fluid, duodenal digesta, milk, blood, and feces of lactating dairy cows // J. Dairy Sci. 2003. V. 86. № 12. P. 4070–4078. https://doi.org/10.3168/jds.S0022-0302(03)74019-3
Einspanier R., Bieser B., Reischl J., Prelle K. First identification of caldesmon transcripts in bovine oviduct epithelial cells in vitro by means of an RNA differential display technique examining culture-induced expression changes // Reprod. Domest. Anim. 2001. V. 36. № 5. P. 230–235.
Nemeth A., Wurz A., Artim L. et al. Sensitive PCR analysis of animal tissue samples for fragments of endogenous and transgenic plant DNA // J. Agricultural Food Chem. 2004. V. 52. № 20. P. 6129–6135. https://doi.org/10.1021/jf049567f
Tony M., Butschke A., Broll H. et al. Safety assessment of Bt 176 maize in broiler nutrition: degradation of maize-DNA and its metabolic fate // Arch. Animal Nutrition. 2003. V. 57. № 4. P. 235–252.
Oraby H.A.S., Kandil M.M.H., Hassan A.A.M., Al-Sharawi H.A. Addressing the issue of horizontal gene transfer from a diet containing genetically modified components into rat tissues // Afr. J. Biotechnol. 2014. V. 13(48). P. 4410–4418. https://doi.org/10.5897/AJB2014.14088
Mazza R., Soave M., Morlacchini M. et al. Assessing the transfer of genetically modified DNA from feed to animal tissues // Transgenic Res. 2005. V. 14. № 5. P. 775–784. https://doi.org/10.1007/s11248-005-0009-5
Panchin A.Y. Toxicity of roundup-tolerant genetically modified maize is not supported by statistical test // Food Chem. Toxicol. 2013. V. 53. P. 475. https://doi.org/10.1016/j.fct.2012.10.039
Zhao K., Ren F., Han F. et al. Edible safety assessment of genetically modified rice T1C-1 for Sprague Dawley rats through horizontal gene transfer, allergenicity and intestinal microbiota // PLoS One. 2016. V. 11. № 10. P. e0163352. https://doi.org/10.1371/journal.pone.0163352
Haddad N., Johnson N., Kathariou S. et al. Next generation microbiological risk assessment-Potential of omics data for hazard characterisation // Int. J. Food Microbiol. 2018. V. 287. P. 28–39. https://doi.org/10.1016/j.ijfoodmicro.2018.04.015
Peng C., Chen X., Wang X. et al. Comparative analysis of miRNA expression profiles in transgenic and non-transgenic rice using miRNA-Seq // Sci. Rep. 2018. V. 8. № 1. P. 338. https://doi.org/10.1038/s41598-017-18723-x
Michno J.M., Stupar R.M. The importance of genotype identity, genetic heterogeneity, and bioinformatic handling for properly assessing genomic variation in transgenic plants // BMC Biotechnol. 2018. V. 18. № 1. P. 38. https://doi.org/10.1186/s12896-018-0447-9
Wang F., Dang C., Chang X. et al. Variation among conventional cultivars could be used as a criterion for environmental safety assessment of Bt rice on nontarget arthropods // Sci. Rep. 2017. V. 7. P. 41918. https://doi.org/10.1038/srep41918
Дополнительные материалы отсутствуют.


