Генетика, 2019, T. 55, № 9, стр. 1043-1053
Кластеры повторённых последовательностей ДНК в хромосомах полевок подрода Microtus (Microtus, Arvicolidae)
Н. В. Рубцова 1, Т. В. Карамышева 1, Н. Б. Рубцов 1, 2, *
1 Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
2 Новосибирский государственный университет, кафедра цитологии и генетики
630090 Новосибирск, Россия
* E-mail: rubt@bionet.nsc.ru
Поступила в редакцию 07.02.2019
После доработки 11.03.2019
Принята к публикации 28.03.2019
Аннотация
Работа посвящена изучению механизмов формирования и распространения кластеров повторённых последовательностей в хромосомах млекопитающих на примере группы близкородственных видов полевок подрода Microtus (Microtus, Arvicolini). Представлены результаты детального анализа распространения повторов, входящих в состав возникших de novo районов гетерохроматина у Microtus arvalis, в хромосомах двух хромосомных форм этого вида и трех близкородственных видов: M. rossiaemeridionalis, M. kirgisorum, M. transcaspicus. Обсуждаются возможные связи между интродукцией повторённых последовательностей, их транспозициями, амплификацией и формированием репродуктивной изоляции, способной приводить к видообразованию.
Районы конститутивного гетерохроматина, выявляемые в хромосомах млекопитающих, такие как С-позитивные участки хромосом, представляют собой высоковариабельную часть генома. Они демонстрируют высокую вариабельность по локализации, размеру и даже составу ДНК как у близкородственных видов, так и в пределах одного вида [1–3]. Наряду с крупными С-позитивными районами в хромосомах млекопитающих описаны участки хромосом, обогащенные повторяющимися последовательностями, но не выявляемые при С-дифференциальном окрашивании [4]. Такие районы отличаются по размеру, числу и типу повторённых последовательностей. Показано, что они могут представлять собой участки хромосом, наиболее часто участвующие в эволюционно значимых хромосомных перестройках [4–6]. Однако закономерности формирования таких районов и их дальнейшая эволюция остаются слабо изученными. Одним из возможных подходов для выяснения особенностей локализации в хромосомах млекопитающих кластеров повторённых последовательностей или районов, обогащенных повторами, является получение микродиссекционных ДНК-проб из С-позитивных районов хромосом и определение распределения входящих в их состав повторённых последовательностей в хромосомах как исходного вида, так и в хромосомах близкородственных видов [1, 7]. Особый интерес в подобных исследованиях представляет анализ распределения в хромосомах повторённых последовательностей, входящих в состав недавно возникших С-позитивных районов. К таким районам можно отнести С-позитивные районы хромосом, присутствующие лишь у небольшого числа особей изучаемого вида.
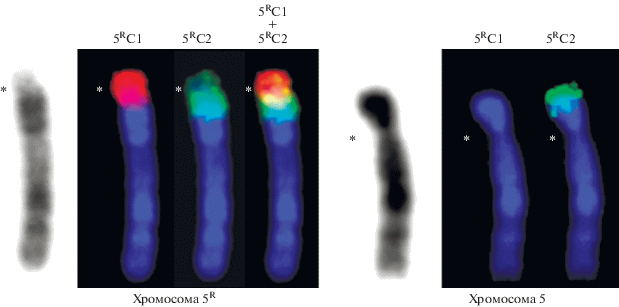
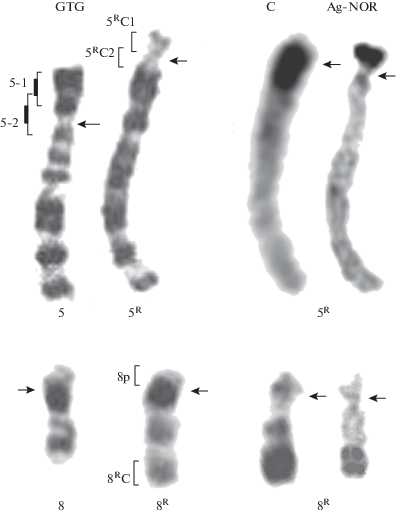
Два таких хромосомных района были ранее обнаружены в составе 5-й и 8-й хромосом у полевок вида Microtus arvalis хромосомной формы “obscurus” (далее M. arvalis “obscurus”) [4, 8]. Новый вариант хромосомы 5 (далее хромосома 5R) представлял собой почти акроцентрическую хромосому с огромным блоком прицентромерного гетерохроматина (рис. 1), c небольшими короткими плечами и активным ядрышкообразующим районом (ЯО-район), локализованным в дистальной части этих коротких плеч. Возникновение блока С-гетерохроматина в хромосоме 5 сопровождалось изменением положения центромеры и появлением активного ЯО-района. Выявленный дериват хромосомы 8 M. arvalis “obscurus” (далее хромосома 8R) был значительно крупнее исходной хромосомы 8 из-за дополнительного С-позитивного района в дистальной части длинного плеча, в котором были также обнаружены активные ЯО-районы (рис. 1). При этом не произошло видимого изменения позиции центормерного района [4]. Следует отметить, что у M. arvalis “obscurus” в хромосомах 5 и 8, не несущих крупных дополнительных гетерохроматиновых блоков, активные ЯО-районы не были выявлены ни в одном случае.
Рис. 1.
Хромосомы 5 и 8 кариотипа M. arvalis “obscurus” и их реорганизованные гомологи (5R и 8R). Представлены дифференциально окрашенные хромосомы (GTG-дифференциальная окраска; С-дифференциальная окраска, Аg‑NOR-окраска). Скобками показаны районы диссекции при получении ДНК-проб. Утолщенной линией показаны участки с максимальным числом собранных копий, которые были использованы при получении ДНК-проб. Стрелки указывают на центромерные районы хромосом.
Хромосомы полевок группы “arvalis” подрода Microtus длительное время являлись объектом интенсивных исследований. Перестроенная акроцентрическая хромосома 5R (как правило, один гомолог в паре) была обнаружена у отдельных особей M. arvalis “obscurus” в различных природных популяциях полевок Поволжья, Урала, Новосибирской области, Алтая, Армении, Казахстана, Азербайджана. В одной из популяций Армении частота встречаемости особей с этим С-гетерохроматиновым блоком достигала 10% [8–10]. На данный момент нам известен единственный случай наличия в дистальной части длинного плеча одного из гомологов хромосомы 8 M. arvalis “obscurus” дополнительного С-положительного района. Хромосома 8R была обнаружена нами у особи, отловленной на территории Армении [4].
Возникновение хромосомы 5R у M. arvalis “obscurus” некоторыми исследователями ранее трактовалось как следствие инверсии короткого плеча хромосомы 5 с последующей амплификацией ДНК прицентромерного района, что и привело к изменению положения центромеры и формированию С-гетерохроматинового блока. Однако сравнительный анализ дифференциальной GTG-исчерченности хромосом 5 и 5R не позволил прийти к окончательному заключению по этому вопросу [8, 10].
В настоящей работе проведено детальное сравнение организации короткого плеча хромосомы 5 и района хромосомы 5R, содержащих гомологичные последовательности ДНК. Проведен также анализ распределения кластеров повторов, гомологичных повторяющимся последовательностям ДНК необычных С-позитивных районов хромосом 5R и 8R, в хромосомах близкородственных видов группы “arvalis” рода Microtus.
МАТЕРИАЛЫ И МЕТОДЫ
Препараты метафазных хромосом: получение, окраска, описание. Препараты метафазных хромосом полевок готовили из ранее полученных первичных культур фибробластов легких полевок M. arvalis (хромосомные формы “arvalis” и “obscurus”), Microtus rossiaemeridionalis, Microtus kirgisorum, Microtus transcaspicus [4], как описано ранее [11]. Окраску хромосом красителями Гимза (GTG-окрашивание), DAPI и азотно-кислым серебром (Ag-NOR окрашивание) осуществляли по стандартным протоколам. Для их описания была использована общепринятая номенклатура хромосом [9].
Получение микродиссекционных ДНК-проб для многоцветного бэндинга. Микродиссекция хромосомного района проводилась таким образом, чтобы число копий участков собранного материала варьировало, уменьшаясь в направлении границы района диссекции. Районы диссекции определялись с перекрытием. Создание ДНК-проб из диссектированного материала проводили согласно стандартному протоколу [12, 13].
Районоспецифичные ДНК-пробы. При флуоресцентной гибридизации in situ (FISH) использовали ранее полученные районоспецифичные микродиссекционные ДНК-пробы из обычных хромосом 5 и 8, а также из С-позитивных районов перестроенных хромосом 5R и 8R M. arvalis “obscurus” [4]. Эти ДНК-пробы были получены стандартным способом, включающим микродиссекцию районов соответствующих хромосом и последующую амплификацию их ДНК в полимеразной цепной реакции с частично вырожденным праймером (DOP-PCR) [12]. Схемы диссекции хромосом представлены на рис. 1.
Флуоресцентная гибридизации in situ. FISH районоспецифичных ДНК-проб с метафазными хромосомами и детекцию сигнала (авидин-FITC/ биотинилированный антиавидин/авидин-FITC и антидигоксигенин-Cy3) проводили по стандартным методикам [12]. Для окрашивания хромосом после гибридизации in situ использовали краситель DAPI.
Микроскопический анализ и последующая обработка микроскопических изображений. Результаты дифференциального окрашивания и FISH анализировали с помощью микроскопа AXIOSKOP 2 Plus (ZEISS, ФРГ), для регистрации и обработки микроизображений использовали ССD-камеру, соответствующие комплекты фильтров фирмы “Chroma”, программное обеспечение AxioVision (ZEISS, ФРГ) и ISIS3 (METASystems GmbH, ФРГ).
РЕЗУЛЬТАТЫ
Новый С-позитивный район и транспозиция центромеры в хромосоме 5R у M. arvalis
Хромосома 5R содержала крупный С-положительный район. Локализация центромеры в центре С-позитивного блока определила наличие в хромосоме небольшого С-позитивного плеча. Методом Ag-NOR окрашивания в его дистальном участке был выявлен активный ЯО-район (рис. 1). Для анализа особенностей распределения повторённых последовательностей, входящих в состав возникшего de novo гетерохроматинового района, в хромосомах полевок группы “arvalis” были использованы микродиссекционные ДНК-пробы, полученные его микродиссекцией из районов, локализованных в длинном и коротком плечах хромосомы [4]: ДНК-проба 5RС1 была получена из материала короткого плеча хромосомы 5R, а ДНК-проба 5RС2 – из материала С-позитивного района, локализованного в длинном плече хромосомы 5R (рис. 1). FISH ДНК-пробы 5RС1 давала интенсивный сигнал, покрывающий весь С‑позитивный район хромосомы 5R, но на хромосоме 5 она не давала видимого сигнала (рис. 2). Супрессионная гибридизация in situ (CISS-гибридизация) ДНК-пробы 5RС2 интенсивно окрашивала часть С-позитивного района, локализованного в длинном плече хромосомы 5R, менее интенсивно – часть С-блока, локализованного в ее коротком плече. Кроме того, она окрашивала участок С-негативного района хромосомы 5R, прилежащего к блоку гетерохроматина, а на хромосоме 5 она окрашивала дистальную часть короткого плеча (рис. 2). Сигнал CISS-гибридизации микродиссекционных ДНК-проб в С-позитивном районе обусловлен высокой концентрацией повторённых последовательностей и неполной супрессией гибридизации повторённых последовательностей, присутствующих в ДНК-пробах. Сигнал CISS-гибридизации ДНК-пробы 5RС2 в С-негативном районе хромосомы 5R, прилежащем к блоку гетерохроматина, и в коротком плече хромосомы 5 обусловлен присутствием в ДНК-пробе материала эухроматинового района хромосомы, попавшего в нее в ходе микродиссекции в процессе генерации ДНК-пробы 5RС2. Сигналы в дистальном районе короткого плеча хромосомы 5 и эухроматиновом районе, прилежащем к блоку С-гетерохроматина хромосомы 5R, полученные в результате CISS-гибридизации ДНК-пробы 5RС2, указывают на наличие в их составе гомологичных уникальных последовательностей ДНК, т.е. на сохранение позиции дистального района хромосомы 5 при формировании хромосомы 5R. Эти данные не согласуются с гипотезой об изменении положения центромерного района в результате инверсии короткого плеча хромосомы 5.
Сравнительный анализ организации короткого плеча хромосомы 5 и проксимального эухроматинового района длинного плеча хромосомы 5R
Для определения порядка гомологичных участков в составе короткого плеча хромосомы 5 и проксимального эухроматинового района длинного плеча хромосомы 5R была получена пара перекрывающихся микродиссекционных ДНК-проб (ДНК-пробы 5-1, 5-2) из короткого плеча хромосомы 5 и проксимального района ее длинного плеча (схема диссекции хромосом приведена на рис. 1). Фрагменты хромосом вырезали так, чтобы разным участкам района диссекции соответствовало разное число собранных копий: выбранному участку хромосомы внутри района диссекции (на рис. 1 обозначен утолщенной линией) соответствовало максимальное число собранных копий. Число собранных копий уменьшалось в направлении границ диссектиремого района. Полученные таким способом ДНК-пробы при проведении CISS-гибридизации давали максимальную интенсивность сигнала в участке с максимальным числом собранных копий с постепенным уменьшением интенсивности сигнала к границам района диссекции. Это обеспечивало при многоцветной FISH уникальное соотношение интенсивностей сигналов используемых ДНК-проб в разных сегментах исследуемого района хромосомы 5.
В результате проведения двухцветной FISH на метафазных хромосомах M. arvalis “obscurus” с использованием ДНК-проб 5-1 и 5-2 было получено окрашивание районов pter → p13 и p15 → q13 хромосомы 5 и гомологичных этим районам участков хромосомы 5R (рис. 3). Соотношение относительных интенсивностей сигналов этих ДНК-проб характеризовало индивидуальные сегменты внутри окрашиваемых районов. Для визуализации сегментов, содержащих гомологичные уникальные последовательности, было использовано программное обеспечение (МСВ, пакет программ ISIS3 фирмы METASYSTEMS GmbH). Генерация псевдоцветов сегментов хромосомы была основана на соотношениях относительных интенсивностей сигналов ДНК-проб, т.е. на составе уникальных последовательностей ДНК анализируемых районов [14].
Рис. 3.
CISS-гибридизация ДНК-проб 5-1 (красный сигнал) и 5-2 (зеленый сигнал) и многоцветный бэндинг районов хромосом 5 (а) и 5R (б) M. arvalis “obscurus”. Справа от хромосом показаны профили относительной интенсивности гибридизационных сигналов (красная и зеленая линии) и окраски DAPI (синяя линия). “Дополнительный” блок С‑гетерохроматина хромосомы 5R отмечен скобкой, центромерные районы – звездочками.
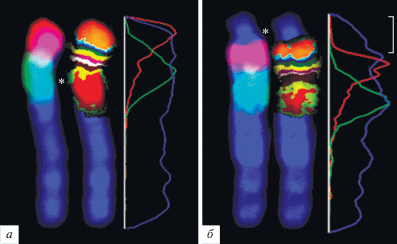
Классификатор псевдоцветов был подобран таким образам, чтобы обеспечивать надежную идентификацию хромосомных сегментов. Размер таких сегментов оказался значительно меньше района, детектируемого ДНК-пробой, полученной микродиссекцией хромосомного района, что позволило провести сравнение порядка выявленных гомологичных сегментов в хромосомах 5 и 5R. Результаты проведенного сравнения показали, что при реорганизации хромосомы 5 имела место транспозиция центромеры без инверсии районов в составе ее короткого плеча (рис. 3).
Стоит также отметить, что возникновение “дополнительного” С-блока в хромосоме 5R, вероятно, имело место без амплификации повторов прицентромерного района хромосомы 5, так как микродиссекционная ДНК-проба 5-2, в состав которой входила ДНК этого района, не дала сигнала в “дополнительном” С-позитивном районе. Отсутствие сигнала ДНК-пробы 5RС1 в дистальном районе короткого плеча хромосомы 5 позволяет предположить, что исходно в нем отсутствовал заметный по размеру кластер повторов, амплификация которых могла бы привести к формированию части крупного дополнительного блока гетерохроматина, локализованного в коротком плече хромосомы 5R. С этим предположением согласуется отсутствие сигнала при гибридизации ДНК-проб, включающих прицентромерный (ДНК-проба 5-2) и прителомерный (ДНК-проба 5-1) районы хромосомы 5, в “дополнительном” С-гетерохроматиновом районе хромосомы 5R (рис. 3).
Кластеры повторённых последовательностей, гомологичных повторам “дополнительного” блока С-гетерохроматина хромосомы 5R M. arvalis “obscurus”, в хромосомах полевок подрода Microtus
Результаты FISH ДНК-проб 5RС1 и 5RС2 (рис. 2) предполагают наличие в них следующих повторов: теломера-ассоциированные повторы (ДНК-проба 5RС1); рибосомные гены; повторённые последовательности, характерные для прицентромерных повторов; прочие повторы, включая диспергированные повторы, характерные для эухроматиновых районов хромосом (ДНК-проба 5RС2).
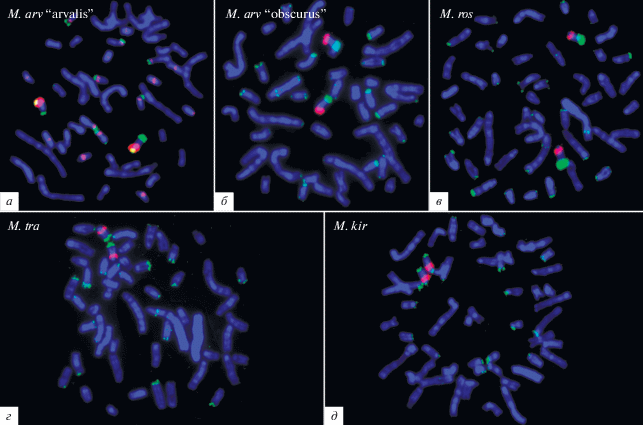
Следует отметить различия в локализации сигналов FISH ДНК-проб 5RС1 и 5RС2 в дополнительном С-позитивном районе хромосомы 5R. Если ДНК-проба 5RС1 окрашивала весь С-позитивный район хромосомы 5R, включая ЯО-район, то ДНК-проба 5RС2 давала интенсивный сигнал в части С-гетерохроматинового блока, локализованного в длинном плече 5R, только слегка окрашивая материал ее короткого плеча. FISH ДНК-проб 5RС1 и 5RС2 была проведена с метафазными хромосомами обеих хромосомных форм M. arvalis, а также с хромосомами M. rossiaemeridionalis, M. kirgisorum, M. transcaspicus (рис. 4).
Рис. 4.
Двухцветная FISH ДНК-проб 5RС1 (красный сигнал) и 5RС2 (зеленый сигнал) с метафазными хромосомами M. arvalis “arvalis” (а), M. arvalis “obscurus” (б), M. rossiaemeridionalis (в), M. transcaspicus (г) и M. kirgisorum (д).
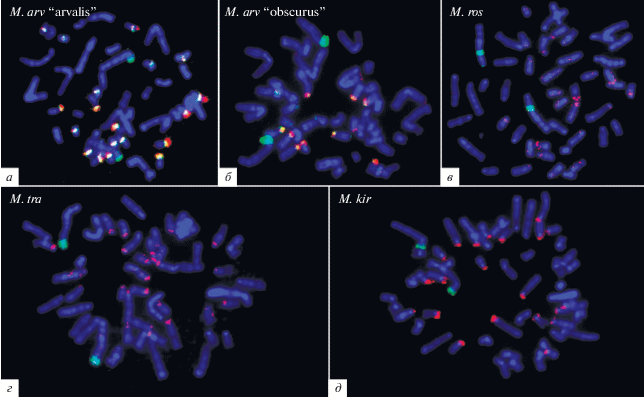
ДНК-проба 5RС1 не дала каких-либо специфических сигналов ни на хромосоме 5 M. arvalis, ни на ее гомеологах у других исследованных видов полевок (рис. 4). Идентификация хромосом, гомеологичных хромосоме 5 M. arvalis, проводилась по результатам FISH ДНК-пробы 5RС2, которая метила гомеологичные эухроматиновые районы хромосом у всех исследованных видов.
Район диссекции при получении ДНК-пробы 5RС1 содержал активный ЯО-район, что предполагает присутствие в ДНК-пробе фрагментов ДНК, гомологичных рибосомным генам. Однако FISH ДНК-пробы 5RС1 давала сигналы не во всех районах локализации, ранее выявленных в хромосомах M. arvalis активных ЯО-районах [9], а в некоторых из них были выявлены лишь слабые специфические сигналы (рис. 4,а, б). Вероятно, это обусловлено тем, что рибосомная ДНК составляла лишь малую часть диссектированного С-позитивного района. Таким образом, FISH ДНК-пробы 5RС1 позволяет проследить распределение в хромосомах полевок кластеров повторов, гомологичных гетерохроматину возникшего de novo гетерохроматинового района, но не дает возможности надежного выявления всех кластеров рибосомных генов. Для обозначения кластеров повторов, выявляемых FISH с ДНК-пробой 5RС1, в дальнейшем использовали сокращение “кластеры повторов С1”, а выявляемых FISH с ДНК-пробой 5RС2 – “кластеры повторов С2”.
Результаты FISH с ДНК-пробами 5RС1 и 5RС2 показали различие в числе, размере и локализации кластеров повторов С1 и С2 у разных хромосомных форм M. arvalis. Удивительно, но большим числом и размером этих кластеров характеризовалась хромосомная форма M. arvalis “arvalis”, в то время как крупный дополнительный блок гетерохроматина, содержащий эти повторы, был выявлен в перестроенной хромосоме 5R у M. arvalis “obscurus”. Крупные кластеры повторов С1 были выявлены в прицентромерных районах небольших и средних акроцентрических хромосом этого вида (рис. 4,а, б). У M. arvalis “arvalis” крупные кластеры повторов С2 присутствовали в тех же хромосомах. Они были локализованы дистальнее относительно кластеров повторов С1 (рис. 4,а). Кроме того, у M. arvalis “arvalis” кластеры повторов С2 были выявлены в прицентромерных районах нескольких небольших двуплечих хромосом (рис. 4,а). В хромосомах M. arvalis “obscurus” они были выявлены только в акроцентрических хромосомах рядом с кластерами повторов С1, и их размер был существенно меньше (рис. 4,а). В хромосомах других исследованных видов полевок FISH с ДНК-пробой 5RС2 не выявила кластеров повторённых последовательностей. Единственным исключением являлась хромосома 1 M. rossiaemeridionalis. Эта хромосома является гомеологом хромосомы 5 M. arvalis, отличающейся от нее инверсией короткого плеча, приведшей к переносу центромеры в теломерный район [9]. В некоторых копиях хромосомы 1 M. rossiaemeridionalis FISH с ДНК-пробой 5RС2 давала небольшой, но специфический сигнал в прицентромерном районе, указывающий на присутствие в этом районе небольшого кластера повторов С2 (рис. 4).
Кластеры повторов, гомологичных повторам С1, были выявлены в прицентромерных районах значительного числа акроцентрических хромосом M. rossiaemeridionalis, M. kirgisorum, M. transcaspicus. Наибольшее число хромосом с такими кластерами было обнаружено у M. kirgisorum. Кроме того, их локализация у M. kirgisorum отличалась от таковой в хромосомах M. rossiaemeridionalis и M. transcaspicus. Если кластеры повторов, гомологичных С1, у M. kirgisorum локализованы в коротких плечах части акроцентрических хромосом (рис. 4,д), то у M. rossiaemeridionalis и M. transcaspicus они тоже представлены в акроцентрических хромосомах, но локализованы в длинных плечах, в дистальной части прицентромерных С-положительных районов (рис. 4,в, г).
Кластеры повторённых последовательностей, гомологичных повторам “дополнительного” блока С-гетерохроматина хромосомы 8R M. arvalis “obscurus”, в хромосомах полевок подрода Microtus
В “дополнительном” С-позитивном районе хромосомы 8R FISH с ДНК-пробой 5RС1 давала слабый рассеянный сигнал, в то время как сигнал ДНК-пробы 5RС2 не превышал фоновый уровень (рис. 5). В результате микродиссекции двух районов хромосомы 8R и амплификации ДНК изолированных районов в DOP-PCR были получены две ДНК-пробы: 8р (микродиссекция короткого плеча) и 8RС (микродиссекция С-положительного района) (рис. 1). CISS-гибридизация с ДНК-пробой 8р интенсивно окрашивала короткие плечи хромосом 8 и 8R; FISH с ДНК-пробой 8RС окрашивала весь “дополнительный” С-позитивный район (рис. 5). ДНК-проба 8р в дальнейшем была использована для маркирования хромосом 8 и 8R у M. arvalis и гомеологичных хромосом у других видов полевок (рис. 6).
Рис. 5.
FISH ДНК-проб 5RС1, 5RС2 и 8RС с хромосомой 8RM. arvalis “obscurus”. Слева направо: инвертированный D-API-бэндинг, ДНК-пробы 5RС1 (красный сигнал), 5RС2 (зеленый сигнал), совмещенные сигналы ДНК-проб и FISH ДНК-пробы 8RС. Центромерные районы обозначены звездочками.

Рис. 6.
Двухцветная FISH ДНК-проб 8p (красный сигнал) и ДНК-пробы 8RС (зеленый сигнал) с метафазными хромосомами M. arvalis “arvalis” (а), M. arvalis “obscurus” (б), M. rossiaemeridionalis (в), M. transcaspicus (г) и M. kirgisorum (д).
FISH с ДНК-пробой 8RС интенсивно окрашивала дистальный район q-плеча хромосомы 8 M. arvalis “obscurus” и гомеологичные ему районы хромосом других исследованных видов полевок (рис. 6). В “дополнительном” С-гетерохроматиновом блоке хромосомы 5RM. arvalis “obscurus” FISH ДНК-проба 8RС окрашивала только район локализации ядрышкового организатора (рис. 7). Вероятно, “дополнительный” C-положительный район хромосомы 8R содержал большое количество последовательностей, гомологичных ДНК ЯО-районов, что обусловило их присутствие в ДНК-пробе 8RС. В результате FISH с ДНК-пробой 8RС давала сигнал в значительном числе ЯО‑районов на хромосомах всех исследованных видов полевок (рис. 6). Однако следует отметить, что самые мелкие ЯО-районы избегали детекции при проведении FISH с ДНК-пробой 8RС. Вероятно, в значительной степени сигнал гибридизации ДНК-пробы 8RС был обусловлен ДНК рибосомных генов и повторяющимися последовательностями, ассоциированными с ЯО-районами полевок. FISH с ДНК-пробой 8RС выявляла на хромосомах полевок прителомерные кластеры повторов, которые могли быть локализованы как на длинном, так и на коротком плечах хромосом. В дополнение к крупному кластеру в дистальном районе длинного плеча хромосомы 8 M. arvalis “obscurus” и гомеологичных ему районов у других видов полевок ДНК-проба 8RС окрасила прителомерные районы 11 пар аутосом и Х-хромосомы у M. arvalis “obscurus”, трех пар аутосом и Х-хромосомы у M. arvalis “arvalis”, 12 пар акроцентрических хромосом у M. rossiaemeridionalis и 16 пар аутосом у M. transcaspicus. Сигналов в прителомерных районах хромосом M. kirgisorum, за исключением ЯО-районов, после FISH с ДНК-пробой 8RС выявлено не было (рис. 6). В то же время она не давала сигнала в прицентромерных гетерохроматиновых районах хромосом ни у одного из исследованных видов полевок.
Рис. 7.
FISH ДНК-пробы 8RС (зеленый сигнал) с метафазной хромосомой 5RM. arvalis “obscurus”. Центромерный район обозначен звездочкой.

В интерстициальных сегментах хромосом при проведении CISS-гибридизации ДНК-пробы 8RС с метафазными хромосомами полевок группы “arvalis” были выявлены минорные сигналы. С‑гетерохроматиновые районы половых хромосом FISH с ДНК-пробой 8RС не окрашивала (рис. 6).
При создании ДНК-пробы 8р в ее состав вошел материал прицентромерного гетерохроматинового района этой хромосомы. FISH этой ДНК-пробы с хромосомами M. arvalis “arvalis” помимо окрашивания короткого плеча хромосомы 8 и прицентромерного гетерохроматина в длинном плече дала интенсивные сигналы в районах прицентромерного гетерохроматина еще нескольких пар акроцентрических и двуплечих хромосом. Удивительно, но подобного сигнала не было выявлено ни в одной хромосоме M. arvalis “obscurus”. В хромосомах остальных исследованных видов полевок CISS-гибридизация этой ДНК-пробы тоже окрашивала только эухроматиновые гомеологичные районы хромосом.
ОБСУЖДЕНИЕ
Анализ локализации кластеров повторённых последовательностей в хромосомах обыкновенных полевок позволяет предположить, что в ходе эволюции в этой группе видов имели место инсерции, транспозиции и амплификация различных повторённых последовательностей ДНК. Выяснение времени интеграции небольшого числа копий чужеродных последовательностей в геномы исследуемых видов оказывается за пределами возможностей настоящего исследования. Необходимо учитывать, что визуализация таких последовательностей методом FISH становится возможной лишь после формирования ими кластеров или существенного обогащения ими хромосомных районов. Несомненно, что оба “дополнительных” С-гетерохроматиновых блока хромосом 5R и 8RM. arvalis “obscurus” содержали не один, а несколько типов повторённых и дуплицированных последовательностей. На это указывает FISH с ДНК-пробами 5RC1 и 5RC2, которая выявляет различные районы хромосом, обогащенные повторами. Очевидно, что дополнительный С-позитивный район хромосомы 8RC также содержит различные повторённые последовательности.
Формирование кластеров повторённых последовательностей, содержащих ДНК, гомологичную ДНК “дополнительных” С-гетерохроматиновых блоков M. arvalis “obscurus”, в хромосомах полевок группы “arvalis” началось, вероятно, относительно недавно, уже после отделения от предков видов группы “agrestis” подрода Microtus. На это указывает полное отсутствие сигналов при проведении FISH с ДНК-пробами 5RС1, 5RС2 с метафазными хромосомами M. agrestis (вид из группы “agrestis” подрода Microtus) [4].
Неожиданным результатом оказалось выявление протяженного и интенсивного сигнала в дистальном районе хромосомы 8 у обеих хромосомных форм M. arvalis и в гомеологичных районах хромосом у других исследованных видов полевок при проведении FISH c ДНК-пробой 8RС при отсутствии в этих районах детектируемых блоков С‑гетерохроматина. Возможно, выявление такого сигнала обусловлено присутствием в этом районе кластера соответствующих повторённых последовательностей уже у предкового вида с последующим расселением этих повторов в прителомерные районы других хромосом. Мы полагаем, что нельзя исключить присутствия в этих районах кластера достаточно протяженных дупликонов, включающих “уникальные” последовательности генома полевок. Эта гипотеза может быть проверена проведением FISH с ДНК-пробой 8RС c хромосомами более далеких видов полевок, в геномах которых не имела место амплификация и расселение повторов, составляющих основную часть “дополнительного” С-позитивного района, из которого и была получена ДНК-проба 8RС.
Полученные к настоящему времени результаты дают возможность провести лишь качественную оценку размера соответствующих С-позитивных блоков и кластеров повторённых последовательностей, а также их разнообразия в прицентромерных и прителомерных районах хромосом. Детальный анализ их распределения и определения числа копий требует проведения клонирования фрагментов ДНК, входящих в состав микродиссекционных ДНК-библиотек, создания на их основе ДНК-проб и проведения FISH. Секвенирование клонированных фрагментов ДНК и FISH с полученными ДНК-пробами с метафазными хромосомами различных видов полевок позволят перейти к анализу конкретных участков генома полевок на уровне сиквенса повторённых последовательностей.
Результаты, полученные в настоящей работе, показали различия в формировании кластеров повторённых последовательностей у близкородственных видов и даже разных хромосомных форм одного вида. FISH с соответствующими микродиссекционными ДНК-пробами позволила провести анализ локализации таких кластеров повторов и показать, что они отличаются как по времени расселения, так и по районам предпочтительной локализации. Расселение одного из них имело место только у M. arvalis, тогда как другие оказались представлены в многочисленных районах хромосом всех исследованных видов полевок (рис. 4, 6). Кластеры повторов, гомологичных повторам “дополнительного” С-положительного района в длинном плече хромосомы 5R, присутствовали в прицентромерных районах некоторых хромосом этого вида, но не были обнаружены у остальных исследованных видов полевок. Повторы, характерные для участка “дополнительного” С-гетерохроматинового района хромосомы 5R, локализованного в ее коротком плече, у M. arvalis были обнаружены преимущественно в коротких плечах акроцентрических хромосом. Однако следует отметить, что локализация кластеров гомологичных повторов у разных видов оказалась различной. Если у M. arvalis и M. kirgisorum они были локализованы только в коротких плечах акроцентрических хромосом, то у M. rossiaemeridionalis – предпочтительно в дистальной части С-положительных прицентромерных районах длинных плеч, а у M. transcaspicus их локализация примерно в равной степени была выявлена в коротких и длинных плечах хромосом. К сожалению, невозможно определить, как происходило расселение этих повторов в хромосомах предков исследованных видов. Возможно, у разных предков отличались места предпочтительного формирования таких кластеров, но нельзя исключить, что локализация кластеров повторов была изменена позже в результате последующих хромосомных перестроек. Однако результаты анализа распределения в хромосомах кластеров повторов, гомологичных ДНК короткого плеча хромосомы 5R, позволяют вернуться к вопросу о локализации ЯО-районов в хромосомах полевок группы “arvalis”. Ранее было показано, что в акроцентрических хромосомах M. arvalis и M. kirgisorum ЯО-районы локализованы в коротких плечах, тогда как в гомеологичных акроцентрических хромосомах у M. transcaspicus и M. rossiaemeridionalis они локализованы в прицентромерных районах длинных плеч. Это практически полностью совпадает с локализаций кластеров повторённых последовательностей, вовлеченных в настоящее исследование. Рассматривая особенности локализации кластеров, выявляемых ДНК-пробами 5RС1 и 8RС и ЯО-районов, и учитывая, что для представителей одного вида характерен один вариант локализации ЯО-районов, следует предположить, что у одной пары видов сохранился предковый вариант их локализации, тогда как у другой произошло их перемещение. Причем такое перемещение произошло во всех хромосомах, несущих ЯО-районы. Нам сложно представить, что оно могло произойти в результате согласованных инверсий в прицентромерных районах этих хромосом. Более вероятным нам представляется, что расселение и последующая амплификация повторов, включающих рибосомные гены, происходили у предков пары видов в новые районы, отличающиеся своей позицией относительно центромеры. Причем их амплификация приводила к избыточному числу рибосомных генов, что провоцировало последующую утрату части рибосомных генов как в “новых”, так и “старых” ЯО-районах. Поскольку амплификация повторов происходила только в новых районах, такая динамика числа рибосомных генов закончилась полной утратой “старых” ЯО-районов. На участие повторов, представленных в коротком плече хромосомы 5R, в формировании новых ЯО-районов указывает как наличие ЯО-района в самом гетерохроматиновом блоке, так и общее увеличение числа ЯО-районов у полевок M. arvalis “obscurus” в сравнении с полевками M. arvalis “arvalis”.
Сравнительный анализ паттернов GTG-окраски аутосом полевок группы “arvalis” [9] показал, что в ходе эволюции имели место робертсоновские слияния хромосом и небольшое число инверсий хромосомных районов. За исключением одной инверсии в хромосоме 15, у M. kirgisorum имели место инверсии целых хромосомных плеч, т.е. в возникновении инверсий были задействованы районы хромосом, включающие кластеры анализируемых в работе повторённых последовательностей. Возможно, обогащение хромосомных районов этими повторами приводило к увеличению вероятности прохождения в них хромосомных перестроек. Это предположение хорошо согласуется с обогащением этими повторами выявленных в Х‑хромосомах полевок группы “arvalis” горячих точек хромосомных перестроек [4].
Подводя итоги анализа распределения кластеров повторённых последовательностей у исследованных видов полевок, следует отметить, что повторы в прицентромерных и прителомерных районах хромосом этих видов представляют собой один из наиболее быстро эволюционирующих элементов генома, что было показано при анализе и других групп видов млекопитающих [1, 2, 7]. Многочисленные исследования механизмов формирования общей архитектоники интерфазного ядра, необходимой для нормального функционирования клетки [15–17], и прохождения мейоза [18, 19] показали важную роль прицентромерных и прителомерных районов в их реализации. Таким образом, быстрая дивергенция ДНК этих районов даже при относительно кратковременной географической изоляции популяций может приводить к принципиальной дивергенции в организации геномов и сохранению репродуктивной изоляции при воссоединении ареалов временно изолированных популяций. Процесс видообразования крайне сложен и, вероятно, существуют различные пути возникновения репродуктивной изоляции. Предложенный механизм является только одним из множества возможных, которые могут приводить к видообразованию. Однако он интересен тем, что позволяет объяснить существование огромных различий, которые наблюдаются в разных таксонах, и указывает на необходимость анализа повторённых последовательностей при изучении механизмов и направлений хромосомной эволюции в разных таксонах млекопитающих и, особенно, в таксонах невысокого ранга.
Работа поддержана грантами РФФИ (19-015-00084а) и бюджетным финансированием по теме государственного задания (0324-2019-0042, № гос-регистрации: АААА-А17-117071240065-4).
Авторы заявляют, что у них нет конфликта интересов.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Список литературы
Рубцов Н.Б., Карамышева Т.В., Богданов А.С. и др. Сравнительный FISH-анализ С-позитивных районов хромосом лесных мышей (Rodentia, Muridae, Sylvaemus) // Генетика. 2011. Т. 47. № 9. С. 1236–1246.
Рубцов Н.Б., Карамышева Т.В., Богданов А.С. и др. Сравнительный анализ гомологии ДНК прицентромерных районов хромосом лесных мышей родов Apodemus и Sylvaemus // Генетика. 2015. Т. 51. С. 1423–1432.
Graphodatsky A.S. Conserved and variable elements of mammalian chromosomes // Cytogenetics of Animals / Ed. Halnar C.R.E. CAB International Press: UK, 1989. P. 95–123. NII Article ID (NAID) 10003229126
Rubtsov N.B., Rubtsova N.V., Anopriyenko O.V. et al. Reorganization of the X chromosome in voles of the genus Microtus // Cytogenet. Genome Res. 2002. V. 99. № 1–4. P. 323–329. https://doi.org/10.1159/000071611
Larkin D.M., Pape G., Donthu R. et al. Breakpoint regions and homologous synteny blocks in chromosomes have different evolutionary histories // Genome Res. 2009. V. 19. P. 770–777. https://doi.org/10.1101/gr.086546.108
Murphy W.J., Larkin D.M., Everts-van der Wind A. et al. Evolution: Dynamics of mammalian chromosome evolution inferred from multispecies comparative maps // Science. 2005. V. 309. P. 613–617. https://doi.org/10.1126/science.1111387
Карамышева Т.В., Богданов А.С., Картавцева И.В. и др. Сравнительный FISH-анализ С-позитивных блоков прицентромерных районов хромосом малых лесных мышей Sylvaemus uralensis (Rodentia, Muridae) // Генетика. 2010. Т. 46. № 6. С. 805–816.
Akhverdian M.R., Liapunova E.A., Vorontsov N.N., Teslenko S.V. Intrapopulation autosomal polymorphism in the common vole Microtus arvalis of the Transcaucasian region // Russ. J. Genet. 1999. V. 35. P. 1687–1698.
Mazurok N.A., Rubtsova N.V., Isaenko A.A. et al. Comparative chromosome and mitochondrial DNA analyses and phylogenetic relationships within common voles (Microtus, Arvicolidae) // Chromosom. Res. 2001. V. 9. P. 107–120.
Мейер М.Н., Голенищев Ф.Н., Раджабли С.И., Саблина О.В. Серые полевки (подрод Microtus) фауны России и сопредельных территорий // Тр. Зоол. ин-та. 1996. Т. 232. С. 90–112.
Nesterova T.B., Mazurok N.A., Matveeva N.M. et al. Demonstration of the X-linkage and order of the genes GLA, G6PD, HPRT, and PGK in two vole species of the genus Microtus // Cytogenet. Genome Res. 1994. V. 65. P. 250–255.
Rubtsov N.B., Karamisheva T.V., Astakhova N.M. et al. Zoo-FISH with region-specific paints for mink chromosome 5q: delineation of inter- and intrachromosomal rearrangements in human, pig, and fox // Cytogenet. Genome Res. 2000. V. 90. P. 268–270.
Lichter P., Cremer T., Tang C.J. et al Rapid detection of human chromosome 21 aberrations by in situ hybridization // Proc. Natl Acad. Sci. USA. 1988. V. 85. P. 9664–9668.
Chudoba I., Plesch A., Loerch T. et al. High resolution multicolor-banding: a new technique for refined FISH analysis of human chromosomes // Cytogenet. Genome Res. 1999. V. 84. P. 156–160.
Karamysheva T.V., Torgasheva A.A., Yefremov Y.R. et al. Spatial organization of fibroblast and spermatocyte nuclei with different B-chromosome content in Korean field mouse, Apodemus peninsulae (Rodentia, Muridae) // G-enome. 2017. V. 60. № 10. P. 815–824. https://doi.org/10.1139/gen-2017-0029
Cremer T., Cremer M. Chromosome territories // Cold Spring Harbor Perspectives in Biology. 2010. V. 2. № 3. P. 1–22. https://doi.org/10.1101/cshperspect.a003889
Cremer T., Cremer C. Chromosome territories, nuclear architecture and gene regulation in mammalian cells // Nature Rev. Genetics. 2001. V. 2. № 4. P. 292. https://doi.org/10.1038/35066075
Kleckner N. Questions and assays // Genetics. 2016. V. 204. P. 1343–1349. https://doi.org/10.1534/Genetics.116.197608
Zickler D., Kleckner N. A few of our favorite things: Pairing, the bouquet, crossover interference and evolution of meiosis // Seminars in Cell & Developmental Biol. Acad. Press. 2016. V. 54. P. 135–148. https://doi.org/10.1016/j.semcdb.2016.02.024
Дополнительные материалы отсутствуют.