Генетика, 2019, T. 55, № 9, стр. 1099-1104
Инсерционные мутации гена shaggy, кодирующего протеинкиназу GSK3, увеличивают продолжительность жизни Drosophila melanogaster
М. В. Тростников 1, 2, Е. Р. Веселкина 1, А. В. Кременцова 1, 3, Н. В. Рощина 1, 2, Е. Г. Пасюкова 1, *
1 Институт молекулярной генетики Российской академии наук
123182 Москва, Россия
2 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
3 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
119334 Москва, Россия
* E-mail: egpas@rambler.ru
Поступила в редакцию 18.02.2019
После доработки 03.04.2019
Принята к публикации 09.04.2019
Аннотация
Ген shaggy Drosophila melanogaster кодирует высококонсервативную серин-треониновую протеинкиназу GSK3 (Glycogen Syntase Kinase 3), которая играет важную роль в различных сигнальных путях и метаболических процессах. В этой работе мы впервые показали, что мутации в гене shaggy влияют на продолжительность жизни, причем увеличение продолжительности жизни сопряжено с уменьшением активности синапсов. Полученные нами данные об изменении эксперссии гена shaggy у мутантов позволяют предположить, что в основе наблюдаемых изменений фенотипа лежит изменение экспрессии минорных транскриптов гена, индуцированное мутационными изменениями в их регуляторной области.
GSK3 (Glycogen Syntase Kinase 3) – высококонсервативная серин-треониновая протеинкиназа, которая участвует во множестве сигнальных путей, фосфорилируя более чем 50 белков-мишеней и регулируя эмбриогенез и дифференцировку; обновление, миграцию клеток и апоптоз; транскрипцию генов и метаболизм. В частности, у Drosophila melanogaster GSK3 играет важную роль в контроле развития нервной системы и прежде всего в регуляции асимметричного деления нейробластов [1]. Ранее мы продемонстрировали, что функциональные изменения в нескольких генах, участвующих в регуляции этого процесса, а именно в гене aPKC, кодирующем GSK3-мишень, атипичную протеинкиназу C, в генах escargot и inscutable влияют на продолжительность жизни мух [2, 3]. На основе полученных нами данных мы предположили, что изменения в экспрессии генов на эмбриональной стадии могут быть причиной увеличения продолжительности жизни взрослых мух [3]. Было бы весьма интересно понять, действительно ли процесс асимметричного деления нейробластов важен для детерминации продолжительности жизни. Чтобы приблизиться к ответу на этот вопрос, мы проверили, влияет ли изменение функции GSK3 на продолжительность жизни.
У Drosophila melanogaster единственную форму GSK3, GSK3-beta, кодирует ген shaggy (sgg) (https:// flybase.org/reports/FBgn0003371). Для выяснения того, влияет ли работа гена и кодируемого им белка на продолжительность жизни, мы использовали традиционный подход – анализ мутаций гена sgg. Две линии с инсерционными мутациями, P{EP}sgg[EP1576] w[1118] и y[1] P{EPgy2}sgg[EY02862] w[67c23], были получены из центра культур Drosophila (Блумингтон, США, https://bdsc.indiana.edu/index.html). В качестве контрольных были использованы линии w[1118] и y[1] w[67c23], содержащие соответствующие маркеры и не содержащие инсерций. Для дополнительного выравнивания генетического фона каждая линия с мутацией прошла 10 поколений возвратных скрещиваний с соответствующей контрольной линией. Полученные линии, обозначенные sgg[EP1576] и sgg[EY02862], были далее использованы в работе. С помощью методики, описанной ранее [3], во всех линиях подтвердили отсутствие Wolbachia – симбионта дрозофилы, способного повлиять на ее продолжительность жизни [4].
Продолжительность жизни была измерена у девственных самцов и самок мутантных и контрольных генотипов согласно методике, описанной ранее [3]. Девственных особей каждого пола и генотипа отбирали в течение дня и помещали в пробирки со стандартной питательной средой, по 5 самок или самцов отдельно. Количество живых мух в пробирке регистрировали ежедневно; оставшихся в живых мух перекидывали на свежий корм раз в неделю; все культуры вели при 25°C. Выборка составила 100 особей на генотип/пол; такой опыт был повторен дважды. Для оценки полученных данных использовали стандартный статистический анализ продолжительности жизни [5, 6]. Кривые выживания оценивали, используя процедуру Каплана–Мейера. Непараметрический критерий Манна–Уитни использовали для оценки статистической значимости различия между кривыми выживаемости.
Оказалось, что обе мутации не влияют на продолжительность жизни самцов, но достоверно увеличивают продолжительность жизни самок, причем результаты двух независимых опытов хорошо совпадают (табл. 1, рис. 1,а, б). Зависимость влияния различных генетических факторов на продолжительность жизни от пола широко известна, хотя природа такой зависимости остается неясной [7]. Мутация sgg[EP1576] увеличила продолжительности жизни самок в среднем на 25%, а мутация sgg[EY02862] – в среднем на 18%. Продолжительность жизни 25% самых долгоживущих самок также увеличилась на 22 и 13%, что свидетельствует о замедлении скорости старения у мутантов.
Таблица 1.
Параметры, характеризующие продолжительность жизни самцов и самок с мутациями в гене sgg
| Мутация | Пол | Генотип | N | Средняя (ошибка средней) | Верхняя квартиль | Достоверность отличия от контрольного генотипа, тест Манна–Уитни |
|---|---|---|---|---|---|---|
| sgg[EP1576] | ♂ | Контроль | 100 | 42.21 (1.75) | 52.00 | |
| Мутант | 100 | 41.62 (2.04) | 53.00 | P = 0.29736 | ||
| Контроль | 100 | 43.72 (1.97) | 59.00 | |||
| Мутант | 100 | 41.41 (2.27) | 60.00 | P = 0.34623 | ||
| ♀ | Контроль | 100 | 37.78 (1.32) | 46.50 | ||
| Мутант | 100 | 45.96 (1.69) | 58.50 | P = 0.00061 | ||
| Контроль | 100 | 34.40 (1.61) | 45.00 | |||
| Мутант | 100 | 44.22 (1.65) | 53.50 | P = 0.00018 | ||
| sgg[EY02862] | ♂ | Контроль | 100 | 35.77 (1.52) | 46.50 | |
| Мутант | 100 | 36.48 (1.32) | 44.50 | P = 0.33509 | ||
| Контроль | 100 | 38.41 (1.29) | 47.00 | |||
| Мутант | 100 | 39.36 (1.41) | 47.50 | P = 0.96784 | ||
| ♀ | Контроль | 100 | 49.05 (1.42) | 57.50 | ||
| Мутант | 100 | 55.66 (1.38) | 64.00 | P = 0.00004 | ||
| Контроль | 100 | 49.82 (1.57) | 62.00 | |||
| Мутант | 100 | 59.08 (1.42) | 70.50 | P = 0.00001 |
Рис. 1.
Влияние мутаций на экспрессию гена sgg и фенотип. Влияние мутаций sgg[EP1576] (а) sgg[EY02862] (б) на продолжительность жизни самцов и самок; сплошная линия – контроль, точки – мутант. Влияние мутации sgg[EP1576] на активность синапсов у самцов (в) и самок (г) и транскрипцию sgg у самок (е); сплошная окраска – контроль, окраска точками – мутант (в, е); препарат НМС личинок, окраска антителами к пероксидазе хрена, маркеру пресинаптических мембран, и белку Bruchpilot, специфичному для зон активных синаптических контактов, белые точки (г); RA, RB, RF, RG, RR – различные транскрипты гена sgg (е). Транскрипты гена sgg и местоположение инсерций (д); RA–RR – различные транскрипты гена sgg.
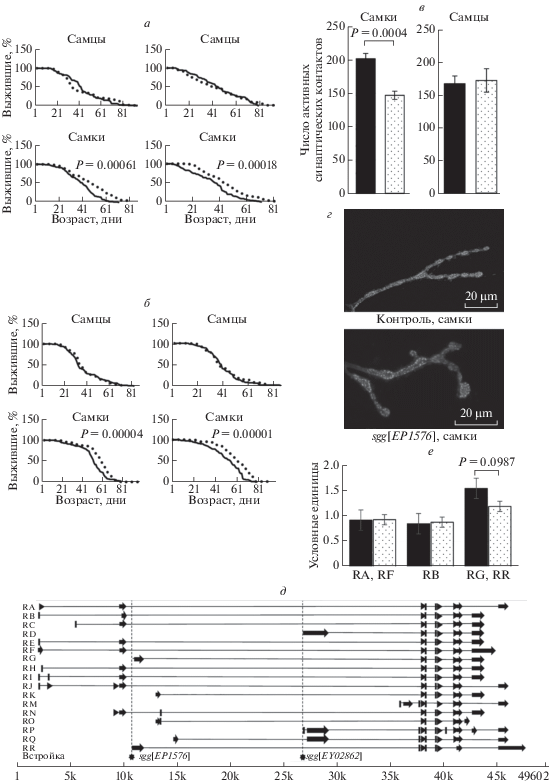
В контексте работы, проводимой в нашей лаборатории и связанной с исследованием роли нейрональных генов в контроле продолжительности жизни, нам хотелось понять, влияют ли мутации гена sgg на структуру и функцию нервной системы. Ранее уже было показано, что sgg[EY02862] угнетает рост и функцию синапсов нейромышечных связок (НМС) [8]. Чтобы оценить влияние sgg[EP1576] на функцию синапсов, мы охарактеризовали количество активных синаптических контактов в НМС контрольных и мутантных самок на личиночной стадии. НМС личинок дрозофилы часто используются в качестве модельной системы для изучения функции синапсов [9].
Препараты НМС были приготовлены и проанализированы согласно методике, описанной ранее [10]. Личинок третьей стадии препарировали в натрий-фосфатном буфере (phosphate buffered saline, PBS) и фиксировали в 4%-ном параформальдегиде (Sigma-Aldrich) при комнатной температуре в течение 20 мин. Для иммуноокрашивания препараты помещали в блокирующий буфер (BlockPRO, Visual Protein Biotechnology Corporation) на 1 ч при комнатной температуре и инкубировали с первичными антителами в течение ночи при 4°С, а затем с вторичными антителами в течение двух часов и помещали в среду для иммунофлуоресценции (VectaShield, Vector Labs). После каждой стадии обработки препараты промывали в фосфатном буфере (3 × 15 мин). Были использованы первичные антитела против Bruchpilot (DSHB) – белка, специфического для зон активных синаптических контактов [11], и пероксидазы хрена (Jackson ImmunoResearch) – белка, широко используемого в качестве маркера пресинаптических мембран [12]. НМС были проанализированы в четвертой мышце третьего и четвертого сегментов брюшной полости 5–7 личинок на генотип/пол с помощью конфокального лазерного сканирующего микроскопа (Zeiss LSM 510) и программ ImageJ (http://rsb.info.nih.gov/ij/index.html) и LSM Image Browser (Zeiss).
Проведенный анализ показал, что у контрольных и мутантных самцов число активных синаптических контактов одинаково, в то время как у самок мутация sgg[EP1576] приводит к достоверному снижению числа активных синаптических контактов (рис. 1,в, г). Полученный результат говорит о том, что у самок мутация одновременно снижает активность синапсов и увеличивает продолжительность жизни. В целом можно заключить, что у мутантных самок sgg[EP1576] и sgg[EY02862] повышенная продолжительность жизни ассоциирована с подавлением синаптической функции.
Влияние мутаций sgg на фенотип должно базироваться на изменении экспрессии гена, вызванном мутациями. Ген sgg образует 17 аннотированных транскриптов (рис. 1,д), соответствующих 10 аннотированным изоформам белка (http://flybase.org/reports/FBgn0003371), однако даже такое количество транскриптов/изоформ не представляет все возможные комбинации альтернативных экзонов и/или альтернативных промоторов. Экспериментально подтверждено существование десяти транскриптов sgg и пяти белков Sgg с различной первичной структурой [13]. Белок Sgg-PB, который кодируют шесть аннотированных транскриптов, включая sgg-RB (GenBank # AY122193.1), считают основной изоформой, поскольку он был обнаружен на всех стадиях жизненного цикла и в разных тканях [13, 14]. Мы проверили, изменяется ли количество транскрипта sgg-RB и белка Sgg-PB у мух с мутациями, используя методы, описанные ранее [10].
Для измерения количества транскриптов из 20–25 целых мух в возрасте 3–5 дней с помощью реагента TRIzol (Invitrogen) и ДНКазы I (Sigma-Aldrich), в соответствии с инструкциями производителя, выделяли тотальную РНК, всего по три независимых выделения на генотип/пол. Первую цепь кДНК синтезировали с помощью обратной транскриптазы Mint (Евроген) с олиго(dT)-праймерами в соответствии с инструкциями производителя. Количество кДНК определяли с помощью RT-qПЦР, используя SYBR Green I – праймеры, специфичные для sgg-RB (RB1 5' ATATACAGATCTTTTGTTTGGCAA 3'; RB2 5' AGGAGGAAGTTCTTGGACGA 3') и амплификатор MiniOpticon (Bio-Rad). Гены Gdh и Adh использовали в качестве референсных для нормализации различий в количестве суммарной кДНК между образцами [3]. Относительную экспрессию генов оценивали с помощью программного обеспечения CFX Manager 3.1 (Bio-Rad, 2012). Для измерения количества белка Sgg 20–25 целых мух в возрасте 3–5 дней, 20–25 самок в возрасте 30 дней или головы 50 самок в возрасте 3–5 дней гомогенизировали в 8 M мочевине; всего по три независимых выделения белка на генотип/пол. Равные количества белка разделяли в 4–12%-ном акриламидном геле Bis/Tris SDS-PAGE, переносили на мембраны Immobilon (Millipore), блокировали в буфере I-Block (Applied Biosystems) при комнатной температуре и инкубировали в течение 1 ч с антителами против GSK3 beta (1 : 300, Abcam). Антитела против бета-актина (1 : 1000, Abcam) использовали для контроля загрузки белка. Далее гибридизовали с вторичными антителами, конъюгированными с щелочной фосфатазой (1 : 30 000, Sigma). После проявления мембран относительную интенсивность полос оценивали с помощью программы Image Lab (Bio-rad).
Ни одна мутация не повлияла на количество транскрипта sgg-RB у самцов и самок в возрасте 3–5 дней (рис. 1,е, демонстрирует полученный результат на примере самок с мутацией sgg[EP1576]). Мутация sgg[EP1576] не повлияла также на количество белка Sgg размером около 55 кДа, который соответствует изоформе PB и ряду других изоформ Sgg (http://flybase.org/reports/ FBgn0003371), у 3–5-дневных самок (0.705 ± ± 0.2011 и 0.718 ± 0.2988 условных единиц, P = = 0.6725), а также в их головах (мозге) (0.887 ± 0.151 и 0.740 ± 0.1783 условных единиц, P = 0.5281). Можно было предположить, что эффект отсутствует у молодых особей и появляется в том возрасте, когда кривые выживания контрольных и мутантных самок начинают различаться, т.е. после 30 дней (рис. 1,а). Однако и у 30-дневных самок sgg[EP1576] количество белка Sgg размером около 55 кДа оказалось таким же, как у 30-дневных контрольных самок (0.435 ± 0.113 и 0.415 ± ± 0.179 условных единиц, P = 0.9241).
Кроме sgg-RB, лишь несколько других – минорных – транскриптов sgg были описаны в виде полноразмерных кДНК: sgg-RA (GenBank # X70863.1); sgg-RD (GenBank # BT133153.1); sgg-RG (GenBank # AY119664.1 и # BT050474.1); и sgg-RO (GenBank # BT072831.1). Анализ протеома выявил две изоформы Sgg помимо sgg-PB: sgg-PA и sgg-PD в линии эмбриональных клеток Kc167; в тканях мух не было обнаружено дополнительных изоформ [15, 16]. Мутация sgg[EP1576] вызвана инсерцией векторной конструкции в ту часть гена sgg, которая соответствует интрону транскриптов sgg-RA, sgg-RB, sgg-RC, sgg-RE, sgg-RF, sgg-RH, sgg-RI, sgg-RJ и sgg-RN и 5'-регуляторной области остальных транскриптов. Мутация sgg[EY02862] вызвана инсерцией векторной конструкции в ту часть гена sgg, которая соответствует интрону тех же транскриптов, а также транскриптов sgg-RG, sgg-RK, sgg-RO, sgg-RQ и sgg-RR. Мы решили проверить, влияют ли мутации на количество каких-либо минорных транскриптов, и выбрали для этого транскрипты, существование которых подтверждено экспериментально: sgg-RA, для которого обе инсерции попадают в интрон, и sgg-RG, для которого инсерция, вызывающая мутацию sgg[EY02862], также попадает в интрон, а инсерция, вызывающая мутацию sgg[EP1576], – в 5'-регуляторную область. В процессе подбора специфических для этих транскриптов праймеров мы обнаружили, что эта задача не всегда выполнима из-за сильного структурного сходства разных транскриптов. Использованные нами праймеры были специфичны для sgg-RA + sgg-RF (RA1 5' GTGAAAGCCAATGAACAGT 3'; RA2 5' TTTACAGCTACTTCTTCGG 3') и для sgg-RG + + sgg-RR (RG1 5' CCCACACTTTCTTCGCTGC 3'; RG2 5' TTGATTGCCACCAGTTCGCC 3'). Ни одна мутация не повлияла на количество транскриптов sgg-RA + sgg-RF у самцов и самок в возрасте 3–5 дней (рис. 1,е, демонстрирует полученный результат на примере самок с мутацией sgg[EP1576]). Количество транскриптов sgg-RG + sgg-RR у контрольных самок и самок с обеими мутациями sgg[EY02862] оказалось одинаковым, у самок с мутацией sgg[EP1576] количество транскриптов sgg-RG + sggRR визуально отличалось от контрольного (рис. 1,е), а вероятность того, что это отличие достоверно, составила 90% (P < 0.10). При оценке достоверности отличий по сложным количественным признакам иногда стандартный порог достоверности (P < 0.05) изменяют до P < 0.10. Допустимость такой процедуры по-разному оценивается разными учеными, и единого мнения не выработано [17]. То, что нам не удалось продемонстрировать высоко достоверных отличий, может объясняться небольшим количеством минорных транскриптов в клетках. Нельзя исключить, что транскрипты sgg-RG + sgg-RR или один из них специфичны для какого-то типа клеток и поэтому различия в их количестве трудно выявить при исследовании материала из целых мух. Тем не менее полученные нами результаты указывают на то, что инсерции могут влиять на количество тех транскриптов, в чью регуляторную область они попадают. Представляется целесообразным исследовать роль отдельных транскриптов гена sgg в контроле продолжительности жизни не с помощью мутаций, а с помощью индукции сверхэкспресии или вызванного РНК-интерференцией нокдауна индивидуальных транскриптов, используя бинарную систему GSL4-UAS [18]. Этот метод позволит направленно менять уровень экспрессии того или иного транскрипта sgg и соответствующей ему изоформы белка Sgg в выбранных тканях.
В этой работе мы впервые продемонстрировали роль гена sgg в контроле продолжительности жизни и показали, что увеличение продолжительности жизни, вызванное мутациями sgg, сопряжено со снижением синаптической функции. В основе таких изменений фенотипа скорее всего лежит изменение экспрессии отдельных минорных транскриптов гена, индуцированное мутационными изменениями в их регуляторной области.
Мы искренне благодарны Л.В. Олениной за консультации и обсуждение работы. Мы выражаем глубокую признательность Центру культур Drosophila (Блумингтон, США, https://bdsc.indiana. edu/index.html) за многолетнее содействие нашим исследованиям.
Работа выполнена с использованием оборудования Центра коллективного пользования научным оборудованием Института молекулярной генетики РАН.
Работа была поддержана Государственным заданием ИМГ РАН № AAAA-A19-119022590053-3 и грантами РФФИ № 18-34-00934-мол_а, № 19-34-80042-мол_эв_а.
Авторы заявляют, что у них нет конфликта интересов.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта позвоночных животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Список литературы
Colosimo P.F., Liu X., Kaplan N.A., Tolwinski N.S. GSK3beta affects apical-basal polarity and cell-cell adhesion by regulating aPKC levels // Dev. Dyn. 2010. V. 239. P. 115–125. https://doi.org/10.1002/dvdy.21963
Pasyukova E.G., Symonenko A.V., Roshina N.V. et al. Neuronal genes and developmental neuronal pathways in Drosophila lifespan control // Life Extension, Healthy Ageing and Longevity. 3: Life Extension: Lessons from Drosophila. Switzerland: Springer International Publ., 2015. P. 3–37.https://doi.org/10.1007/978-3-319-18326-8_1
Symonenko A.V., Roshina N.V., Krementsova A.V., Pasyukova E.G. Reduced neuronal transcription of escargot, the Drosophila gene encoding a Snail-type transcription factor, promotes longevity // Front. Genet. 2018. V. 9. P. 151. https://doi.org/10.3389/fgene.2018.00151
McGraw E.A., O’Neill S.L. Wolbachia pipientis: intracellular infection and pathogenesis in Drosophila // Curr. Opin. Microbiol. 2004. V. 7. P. 67–70. https://doi.org/10.1016/j.mib.2003.12.003
Wilmoth J.R., Horiuchi S. Rectangularization revisited: variability of age at death within human populations // Demography. 1999. V. 36. P. 475–495.
Carey J.R. Longevity: The Biology and Demography of Life Span. Princeton: Princeton Univ. Press, 2003. 304 p.
Tower J. Sex-specific gene expression and life span regulation // Trends Endocrinol. Metab. 2017. V. 28. P. 735–747. https://doi.org/10.1016/j.tem.2017.07.002
Franciscovich A.L., Mortimer A.D., Freeman A.A. et al. Overexpression screen in Drosophila identifies neuronal roles of GSK-3 beta/shaggy as a regulator of AP-1-dependent developmental plasticity // Genetics. 2008. V. 180. P. 2057–2071. https://doi.org/10.1534/genetics.107.085555
Ruiz-Canada C., Budnik V. Introduction on the use of the Drosophila embryonic/larval neuromuscular junction as a model system to study synapse development and function, and a brief summary of pathfinding and target recognition // Int. Rev. Neurobiol. 2006. V. 75. P. 1–31. https://doi.org/10.1016/S0074-7742(06)75001-2
Rybina O.Y., Sarantseva S.V., Veselkina E.R. et al. Tissue-specific transcription of the neuronal gene Lim3 affects Drosophila melanogaster lifespan and locomotion // Biogerontology. 2017. V. 18. P. 739–757. https://doi.org/10.1007/s10522-017-9704-x
Wagh D.A., Rasse T.M., Asan E. et al. Bruchpilot, a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila // Neuron. 2006. V. 49. P. 833–448. https://doi.org/10.1016/j.neuron.2006.02.008
Franco B., Bogdanik L., Bobinnec Y. et al. Shaggy, the homolog of glycogen synthase kinase 3, controls neuromuscular junction growth in Drosophila // J. Neurosci. 2004. V. 24. P. 6573–6577. https://doi.org/10.1523/JNEUROSCI.1580-04.2004
Ruel L., Pantesco V., Lutz Y. et al. Functional significance of a family of protein kinases encoded at the shaggy locus in Drosophila // EMBO J. 1993. V. 12. P. 1657–1669.
Bourouis M. Targeted increase in shaggy activity levels blocks Wingless signaling // Genesis. 2002. V. 34. P. 99–102. https://doi.org/10.1002/gene.10114
Brunner E., Ahrens C.H., Mohanty S. et al. A high-quality catalog of the Drosophila melanogaster proteome // Nat. Biotechnol. 2007. V. 25. P. 576–583. https://doi.org/10.1038/nbt1300
Tress M.L., Bodenmiller B., Aebersold R., Valencia A. Proteomics studies confirm the presence of alternative protein isoforms on a large scale // Genome Biol. 2008. V. 9. R162. https://doi.org/10.1186/gb-2008-9-11-r162
Pritschet L., Powell D., Horne Z. Marginally significant effects as evidence for hypotheses: changing attitudes over four decades // Psychol. Sci. 2016. V. 27. P. 1036–1042. https://doi.org/10.1177/0956797616645672
Brand A.H., Perrimon N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes // Development. 1993. V. 118. P. 401–415.
Дополнительные материалы отсутствуют.


